داروشناسی چیست؟ – آموزش فارماکولوژی به زبان ساده + معرفی کتاب

داروها ترکیبات سنتزی یا طبیعی هستند که با تغییر مسیرهای بیوشیمیایی و پیامرسانی سلولها به درمان بیماریها کمک میکنند. این ترکیبات ساختاری مشابه مولکولهای بدن دارند و فعالیت این مولکولها را مهار یا تحریک میکنند. داروشناسی دانشی بین رشتهای است که ساختار داروها، اثر آنها بر بدن، اثر بدن بر دارو و پارامترهای موثر در رسیدن به درمان حداکثری را بررسی میکند. در این مطلب توضیح میدهیم پارامترهای داروشناسی چیست و داروها با چه مکانیسمهای فعالیت دستگاههای مختلف را تغییر میدهند.
داروشناسی چیست ؟
داروشناسی علمی است که اثر بیوشیمیایی و فیزیولوژیک داروهای سنتزی و طبیعی بر بافتها، اندامها و دستگاههای بدن را بررسی میکند. ساختار دارو، اثر دارو در بدن (دینامیک دارو | برهمکنش دارو-رسپتور)، اثر بدن بر دارو (سنتیک دارو | جذب، توزیعپذیری، متابولیسم و دفع) و سمیت داروها (تاکسیکولوژی) از موضوعاتی است که در داروشناسی به آن پرداخته میشود. داروشناسی را میتوان بر اساس سیستم هدف در بدن به گروههای زیر تقسیم کرد.
- نوروفارماکولوژی: بررسی اثر داروها بر سیستم عصبی مرکزی و محیطی
- ایمونوفارماکولوژی: بررسی اثر داروها در سیستم ایمنی
- کاریوفارماکولوژی: بررسی اثر داروها بر سیستم قلبی-عروقی
- رنال فارماکولوژی: بررسی اثر داروها بر دستگاه ادراری
- اندوکرین فارماکولوژی: اثر داروها بر سیستم اندوکرین بدن و هورمونها
- سایکوفارماکولوژی: اثر داروها بر روان، ذهن و رفتار
- فارماکوژنتیک: بررسی اثر تنوع ژنتیکی بر پاسخ بدن به دارو
- فارماکواپیژنتیک: بررسی اثر الگوهای اپیژنتیکی بر پاسخ بدن به دارو
دارو چیست ؟
دارو یک ترکیب شیمیایی یا زیستی است که که پس از برهمکنش با مولکولهای بدن موجود زنده فعالیت فیزیولوژیک بدن را مهار یا فعال میکند. این ترکیباتی برای اهداف درمانی یا از بین بردن پاتوژنها استفاده میشوند. این ترکیبات از نظر ترکیب و ساختار شیمیایی، وزن مولکولی، حالت فیزیکی و روشهای تجویز تفاوت دارند. ویژگیهای دارو
- ترکیب شیمیایی: داروها در سه دسته ترکیبات آلی، معدنی و بیولوژیک تقسیمبندی میشوند.
- ترکیبات آلی: بسیاری از داروها از ترکیبات آلی (کربوهیدرات، پروتئین و لیپید) تشکیل میشوند. RNAهایی که در روشهای ژندرمانی جدید استفاده میشوند را میتوان گروه جدیدی از داروهای بیولوژیک در نظر گرفت.
- ترکیبات معدنی: مواد معدنی گروه دیگر از داروها هستند که در تنظیم فرایندهای مختلف بدن نقش دارند. برای مثال لیتیوم یکی از داروهایی است که برای تنظیم فعالیتهای سیستم عصبی مرکزی تجویز میشود. مکملهای مواد غذایی (آهن، روی، منیزیوم و کلسیم) در این گروه از داروها قرار میگیرند.
- ساختار: ساختار داروها در اتصال به رسپتورها و آنزیمهای بدن نقش بسیار مهمی دارد. این ساختار باید شبیه ساختار مولکولهای طبیعی کاملا مکمل رسپتور یا آنزیم باشد. بسیاری از داروها مولکولهای آلی با بیش از یک مرکز کایرال و دارای ایزمرهای فضایی متفاوتی هستند که یکی از آنها بهینهترین برهمکنش را با مولکولهای زیستی دارد. به همین دلیل این داروها به شکل مخلوطی از ایزومرها تهیه میشوند.
- حالت فیزیکی: داروها به شکل ترکیبات جامد (قرص، کپسول و پودر)، مایع، گاز، سوسپانسیون یا امولسیون (پماد) تهیه میشوند. حالت فیزیکی دارو در انتخاب روش تجویز نقش دارد.
- روش تجویز: از نظر روش تجویز داروها را میتوان به انواع تزریقی (عضلانی، وریدی، جلدی و زیرجلدی)، خوراکی (دهان)، زیرزبانی، بین دندانی (بوکو | Bucco)، استنشاقی، «تراپوستی» (Transdermal) و رکتالی تقسیمبندی کرد. روشهای خوراکی و رکتالی برای تجویز داروهای جامد، مایع و سوسپانسیون، روش تزریقی برای تجویز داروهای مایع و سوسپانسیون، روش استنشاقی برای داروهای گازی و روش پوستی برای امولسیونها استفاده میشود.
- وزن مولکولی: داروها مولکولهایی با وزن مولکولی بسیار کم (آهن با وزن مولکولی ۷) یا بسیار زیاد (پروتئین آلتپلاس با وزن مولکولی ۵۹،۰۵۰) هستند. اما بیشتر ترکیبات دارویی وزن مولکولی بین ۱۰۰ تا ۱۰۰۰ دارند. وزن مولکولی کمتر از ۱۰۰ برهمکنش اختصاصی مولکول دارو با مولکولهای تنظیمی و وزن مولکولی بیش از ۱۰۰۰ توزیعپذیری دارو در بدن را مختل میکند.
فارماکودینامیک
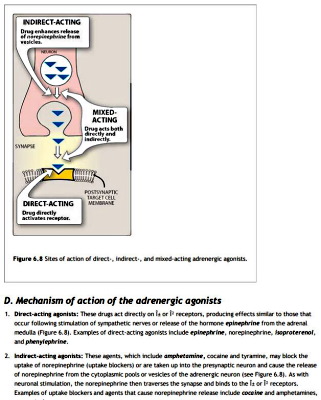
فارماکودینامیک بخشی از داروشناسی است که روشهای اثر دارو بر فعالیتهای بدن را بررسی میکند. برهمکنش با رسپتورهای غشای پلاسمایی (گیرندههای خارج سلولی)، سیتوپلاسم و هسته (گیرندههای داخل سلولی)، برهمکنش با جایگاه فعال یا تنظیمی آنزیمها، ایجاد تغییرات فیزیکی (تغییر فشار اسمزی) یا شیمیایی (تشکیل کمپلکس و انعقاد) مکانیسمهای اثر داروها در بدن است. برهمکنش با رسپتورها و آنزیمها مکانیسمهای اختصاصی در داروشناسی با اثربخشی بیشتر و ایجاد تغییرات فیزیکی یا شیمیایی، مکانیسمهای عمومی با اثربخشی کمتر هستند. دارو به شکل آگونیست یا آنتاگونیست با رسپتور یا آنزیم برهمکنش میدهد.
- آگونیست کامل: آگونیستهای کامل عملکرد مولکولهای طبیعی را کاملا تقلید میکنند. این ترکیبات به تمام گیرندههای اختصاصی مولکول طبیعی متصل شده و پاسخ حداکثری ایجاد میکنند.
- آکونیستهای نسبی: این داروها به تمام گیرندههای اختصاصی مولکول طبیعی متصل میشوند اما پاسخ حداکثری ایجاد نمیکنند.
- شبیه آگونیست: بعضی داروها با مهار مولکولهای طبیعی بدن از پایان فعالیت آگونیستهای طبیعی جلوگیری میکنند و به آنها شبه آگونیست گفته میشود. برای مثال مهارکنندههای استیلکولین استراز با افزایش استیلکولین در دسترس اثری مشابه آگونیستهای گیرنده کولینرژیک دارند.
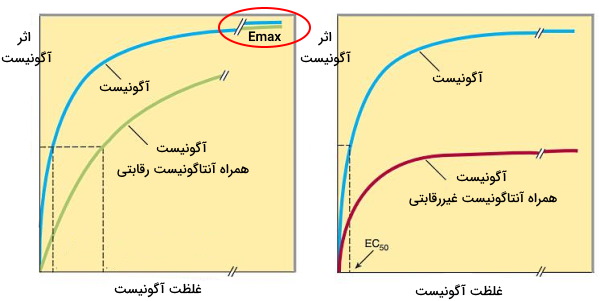
- آنتاگونیست: برهمکنش داروهای آنتاگونیست با رسپتور یا جایگاه تنظیمی آنزیم اتصال مولکولهای دیگر (لیگاند طبیعی مولکول) را مهار میکند. برای مثال آنتاگونیستهای استیلکولین ازجمله آتروپین از اتصال این انتقالدهنده عصبی به گیرنده ماهیچه جلوگیری میکند. این ترکیبات به دو دسته رقابتی و غیررقابتی تقسیم میشوند.
- آنتاگونیست رقابتی: این ترکیبات برای اتصال به رسپتورها با مولکولهای طبیعی بدن و داروهای آگونیست رقابت میکنند. اتصال این داروها به جایگاه فعال رسپتور با مهار فعالیت سلول همراه است. اما اگر رسپتورها اشباع نشده باشند، آگونیست یا مولکول طبیعی به رسپتورهای باقیمانده متصل میشوند. در این حالت سلول برای غلبه بر اثر آنتاگونیست به غلظت بسیار زیاد آگونیست یا مولکول طبیعی نیاز دارد. اثر این داروها قدرت اثر مولکول طبیعی را کاهش و EC50 را افزایش میدهند. فتول آمین آنتاگونیست غیررقابتی نوراپینفرین است.
- آنتاگونیست غیر رقابتی: این ترکیبات به جایگاه آلوستریک رسپتور متصل میشوند. این اتصال با تغییر کنفورماسیون پروتئین جایگاه فعال رسپتور یا آنزیم را تغییر داده و اتصال لیگاند مهار میشود. به همین دلیل افزایش غلظت مولکول طبیعی تاثیری در تمایل رسپتور یا آنزیم به گیرنده ندارد. در این حالت کارایی حداکثری ($$E_{max}$$) کاهش یافته اما قدرت اثر و EC50 مولکول طبیعی ثابت است. فنوکسی بنزامین آنتاگونیست غیررقابتی نوراپینفرین است.
گیرنده های خارج سلولی
شناخت ساختار و عملکرد گیرندههای داخل سلولی و خارج سلولی نقش مهمی در داروشناسی ترکیبات موثر بر بدن دارد. کانالهای دریچهدار یونی، پروتئینهای غشایی همراه پروتئین G و تیروزینکینازها ساختارهای طبیعی غشای سلولی هستند برای انتقال پیام مولکولهای طبیعی بدن (هورمونها و نوروترانسمیترها) و تغییر عملکرد سلولهای هدف هستند. اتصال لیگاند-گیرنده در این رسپتورهای با تغییر کنفورماسیون پروتئینی و فعال کردن مولکولهای سیتوپلاسمی و تغییر فعالیت سلول همراه است. داروهای با وزن مولکولی بالا، هیدروفیل و قطبی با تقلید این رفتار عملکرد سلولها را تغییر میدهند.
- کانالهای دریچهدار یونی: اتصال دارو به این گیرندهها ورود و خروج یونها در سلولها را تغییر میدهد. بیشتر داروهای سیستم عصبی با این گیرندهها برهمکنش دارند. برای مثال لورازپام یکی از داروهای بیماری صرع است که به گیرندههای GABA-a در غشای نورون متصل میشود. اتصال دارو-گیرنده با ورود یونهای کلر به سیتوپلاسم، منفی شدن پتانسیل الکتریکی سلول و مهار پتانسیل عمل همراه است. در نتیجه تحریک نورون و تشنج مهار میشود.
- گیرندههای همراه پروتئین G: گیرندههای همراه با پروتئین G، از زنجیرههای پلیپپتیدی که هفته بار از غشای عبور میکنند، یک دومین خارج سلولی برای اتصال دارو یا هورمون و یک دومین سیتوپلاسمی در ارتباط با پروتئین G تشکیل شده است. در تمام این گیرندهها اتصال لیگاند با تغییر کنفورماسیون گیرند و فعال شدن پروتئین G (تبادل GDP با GTP) همراه است. اما نوع پیامرسان ثانویه و تغییرات داخلی بر اساس نوع پروتئین G تغییر میکند.
- $$G_{q}$$: پروتئین $$G_{q}$$ فعال آنزیم فسفولیپاز C غشایی را فعال میکند. این آنزیم لیپیدهای فسفاتیدیل بیس فسفات کناری را به فسفاتیدیل اینوزیتول تریفسفات (IP3) و دیآسیل گلیسرول (DAG) هیدرولیز میکند. این دو مولکول با افزایش غلظت کلسیم سیتوپلاسم و فعال کردن فسفوکیناز C واکنشهای درونسلولی را تغییر میدهند. داروی نوراپینفرین با این مکانیسم انقباض و ضربان قلب را افزایش میدهد.
- $$G_{s}$$: پروتئین $$G_{s}$$ فعال آنزیم آدنیلات سیکلاز غشایی را فعال میکند. این آنزیم ATP را به cAMP و cAMP آنزیم کیناز A تبدیل میکند. آنزیم کیناز A با فسفوریلاسیون آبشاری پروتئینها تنظیمی، آنزمیها یا کانالهای غشایی عملکرد سلول را تغییر میدهد.
- $$G_{i}$$: پروتئین $$G_{i}$$ فعال با مهار آدنیلات سیکلاز تولید cAMP و فعال شدن پروتئین کیناز A را مهار میکند. در نتیجه فعالیت سلول مهار میشود.
- تیروزینکینازها: این رسپتورها آنزیمهای دیمری غشا با یک دومین لیگاندی خارج سلول و یک دومین آنزیمی داخل سلول هستند. اتصال لیگاند به این رسپتورها با تغییر کنفورماسیون پروتئین و فعال شدن دومین آنزیمی (بخش سیتوپلاسمی) همراه است. هر آنزیم فعال باقیماندههای تیروزین زیرواحد دیگر را فسفوریله میکند. اتصال پروتئینهای فسفوتیروزین به این زیرواحدها با فعال شدن آبشاری پروتئینهای سیتوپلاسمی و تغییر فعالیت سلول همراه است. هورمون طبیعی و داروی انسولین از این روش عملکرد سلول را تغییر میدهند.
گیرنده های داخل سلولی
گیرندههای داخل سلولی گروه دوم رسپتورهایی هستند که برهمکنش آنها با دارو در داروشناسی بررسی میشود. داروهای با وزن مولکولی پایین، غیرقطبی، هیدروفوب و محلول در چربی از جمله داروهای استروئیدی با عبور از غشای سلول به گیرندههای سیتوپلاسمی یا غشای هسته متصل میشوند. این گیرندهها معمولا فاکتورهای رونویسی هستند یا فاکتورهای رونویسی را فعال میکنند. در نتیجه برهمکنش دارو گیرنده با افزایش رونویسی و پروتئینسازی سلول همراه است. به همین دلیل سلول به زمان طولانیتری برای پاسخ به این سلولها نیاز دارد.
پاسخ بدن به دارو
داروشناسی امکان بررسی تغییرات بدن پس از ورود دارو را فراهم میکند. پاسخ بدن افراد مختلف به یک داروی واحد متفاوت است و پاسخ بدن یک فرد به دارو در بازه زمانی تغییر میکند. کاهش حساسیت یکی از پاسخهای بدن به دارو است که با دو مکانیسم «تاکیفلاکسی» (Tachyphylaxis) و «تحمل» (Tolerance) ایجاد میشود.
- تاکیفلاکسی: اگر دوز داروی تجویزی زیاد باشد، همزمان گیرندههای سلولی زیادی تحریک شده و بدن دچار تغییرات ناگهانی میشود. در نتیجه از مکانیسمهای کاهش سنتز رسپتورها، غیرفعال کردن رسپتورها با فسفوریلاسیون یا پروتئین ارستین (Arestin) و اندوسیتوز رسپتور برای کاهش تغییرات ایجاد شده استفاده میکند. افزایش غلظت دارو در این مکانیسم تاثیری بر پاسخ سلولی ندارد.
- تحمل: تحمل یا مقاومت در پاسخ به مصرف طولانیمدت یک دارو ایجاد میشود. در شرایط سلول از کاهش سنتز و اندوسیتوز رسپتورها برای کاهش حساسیت نسبت به دارو استفاده میکند. افزایش آنزیمهای متابولیک تجزیهکننده دارو یکی دیگر از مکانیسمهایی است که در واکنش تحمل حساسیت بدن به دارو را کاهش میدهد. افزایش دوز دارو منجر به اشباع شدن آنزیمها شده و حساسیت به دارو را افزایش میدهد. پاسخ بدن به مخدرها در این گروه قرار دارد.
رابطه دوز دارو و پاسخ بدن
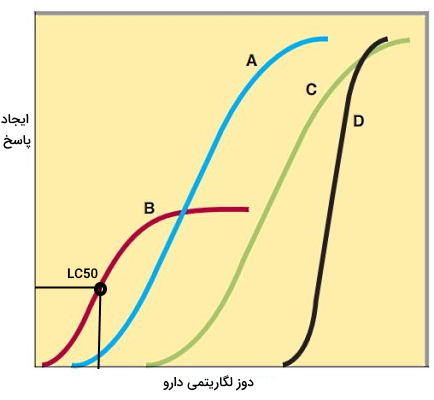
برای دریافت بهترین پاسخ درمانی باید دوز بهینهای از دارو برای بیمار تجویز شود. یکی از اهداف داروشناسی تعیین روشهای رسیدن به دوز بهینه و بررسی اثربخشی این دوز است. انتخاب دوز بهینه به بررسی «قدرت اثر» (Potency) و «کارایی» (Efficacy) دارو نیاز است تا با ایجاد کمترین عوارض جانبی بیشترین پاسخ ایجاد شود.
- قدرت اثر: قدرت اثر، غلظتی (LD50 یا EC50) از دارو است که ۵۰٪ پاسخ بهینه در بدن را ایجاد کرده باشد. برای مثال قدرت اثر آنتیبیوتیکهای باکتریوسیدال غلظتی از این داروها است که ۵۰٪ جمعیت باکتریایی مورد آزمایش را از بین میبرد. هر چه «تمایل» (Affinity) دارو به گیرنده بیشتر باشد، قدرت اثر آن بیشتر است. در نمودار زیر غلظت مورد نیاز داروهای A و B برای دریافت ۵۰٪ پاسخ بهینه، کمتر از داروهای C و D است. به همین دلیل قدرت اثر داروهای A و B بیشتر است.
- کارایی: کارایی پارامتری است که حداکثر ایجاد پاسخ در بدن را نشان میدهد. این پارامتر به نوع برهمکنش دارو با گیرندههای سلولی و تعداد گیرندههای برهمکنش دهنده با دارو بستگی دارد. برای مثال کارای ترکیبات آگونیست کامل از آگونیستهای نسبی بیشتر است. در نمودار پایین کارایی داروهای A ،C و D بیشتر از داروی B است.
ضریب اثربخشی دارو
دوز موثر (ED50) غلظتی از دارو است که در ۵۰٪ جمعیت دریافتکننده دارو اثربخشی بهینه داشته و دوز سمی (TD50) غلظتی از دارو است که در ۵۰٪ جمعیت دربافت کننده اثر سمی داشته است. ضریب اثربخشی دارو نسب دوز موثر به دوز سمی دارو (TD50/ED50) و یکی از پارامترهای ایمنی دارو است. هر چه این نسبت کمتر باشد، عوارض جانبی دارو بیشتر است. جنتومایسن، دجاکسین، فنوتالین و لیتیوم از جمله داروهای با ضریب اثربخشی پایین و استروئیدها و پنیسیلینها از جمله داروهای با ضریب اثربخشی بالا هستند.
فارماکوکینتیک
بدن انسان محیطی پویا است که واکنش متفاوتی به ترکیبات خارجی نشان میدهد. فارماکوکینتیک بخشی از داروشناسی است که این واکنشها و برهمکنش بدن با دارو را بررسی میکند. بسیاری از داروها ترکیبات محلول در چربی هستند که به شکل فعال تجویز میشوند. اما بعضی داروها ترکیباتی هستند که به شکل غیرفعال (پرودراگ) تجویز شده و در اندام هدف فعال میشوند. این داروها برای رسیدن به محل اثر باید از بخشهای مختلف بدن عبور کنند و تعدادی کمی از داروها مستقیم به محل اثر وارد میشوند.
در نتیجه دارو باید ابتدا وارد جریان خون (جذب) و پس از عبور از بافتهای مختلف (نفوذپذیری) وارد اندام هدف (توزیعپذیری) شود. برای مثال داروهای سیستم عصبی که از روش خوراکی وارد بدن شده است باید از سلولهای دیواره روده، مویرگها، سد خونی-مغزی و مویرگهای مغزی عبور کند. در نهایت داروی باقیمانده و متابولیتهای آن باید با سرعت مناسبی غیرفعال یا از بدن خارج شوند. تمام این فرایندها در بخش سینتیک داروشناسی بررسی میشود.
جذب دارو
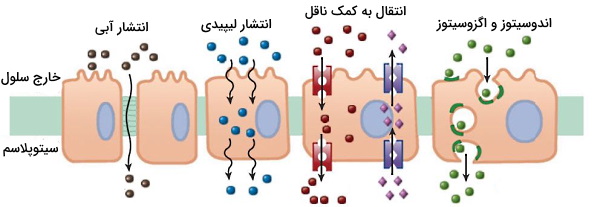
مکانیسمهای جذب دارو بر اساس ویژگیهای شیمیایی دارو، بافت هدف و روش تجویز متفاوت است. اگر دارو از روش خوراکی تجویز شود، غشای سلولهای دیواره معده و روده اولین سد ورود به خون است. انتشار ساده، ناقلهای غشایی، اندوسیتوز و اگزوسیتوز مسیرهای اصلی جذب دارو در بافتهای مسیر رسیدن به خون و اندام هدف است.
- انتشار آبی: انتشار آبی یا ساده داروها مثل مولکولهای طبیعی در بدن در جهت شیب غلظت ایجاد میشود. با این روش مولکول از سیتوزول سلول، بین اتصال محکم غشای اپیتلیال و اندوتلیال مویرگها عبور میکنند. داروهای هیدروفیل و کوچک از این روش وارد سلولها میشوند.
- انتشار لیپیدی: غشای تمام سلولهای بدن انسان از دولایه لیپیدی تشکیل میشود که برای رسیدن به بافت هدف دارو باید از آن عبور کند. به همین دلیل انتشار لیپیدی یکی از فاکتورهای محدودکننده در نفوذپذیری داروها است که به نسبت بخش هیدروفوب و هیدروفیل دارو بستگی دارد.
- ناقلهای غشایی: ناقلها پروتئینهای غشایی هستند که مسیر برای انتقال مولکولهای بزرگ در جهت شیب غلظت (بدون مصرف انرژی) یا خلاف شیب غلظت (با مصرف انرژی) ایجاد میکنند. از آنجایی که اکثر داروها مولکولهایی با ساختار مشابه مولکولهای طبیعی بدن هستند میتوانند به کمک ناقل وارد سلول شوند.
- اندوسیتوز و اگزوسیتوز: اندوسیتوز دو فرایندی است که با تشکیل وزیکولهای غشایی ترکیبات با وزن مولکولی بالا را وارد سلول یا از سلول خارج میکند. این فرایند با اتصال مولکول به رسپتورهای غشایی شروع شده و با تشکیل وزیکول، انتقال مولکول به سیتوپلاسم و آزاد شدن مولکول در سیتوپلاسم ادامه مییابد.
توزیع پذیری دارو
توزیعپذیری یکی از فاکتورهای مهم در داروشناسی است که حرکت دارو در جریان خون را بررسی میکند. جریان خون، نفوذپذیری مویرگها، تمایل اتصال به پروتئینهای سرم و انحلالپذیری دارو عوامل تغییردهنده توزیعپذیری دارو هستند.
- جریان خون: به طور طبیعی جریان خونی بعضی اندامها از جمله کلیه، کبد و مغز بیشتر از اندامهایی مثل پوست و بافت چربی است. به همین دلیل توزیع دارو در این اندامها بیشتر است. به علاوه کاهش جریان خون در اندامهایی که دچار شوک شدهاند، توزیع دارو در این اندامها را کاهش میدهد.
- نفوذپذیری مویرگها: غشای مویرگها آخرین سدی است که دارو برای رسیدن به اندام هدف از آن عبور میکند. هر چه تعداد و اندازه منافذ بین سلولهای اندوتلیال مویرگها بیشتر باشد (مغز استخوان، کبد، کلیه و غدد اگزوکرین)، توزیع دارو در بافت بیشتر است. افزایش اتصالات محکم و کاهش فاصله بین سلولهای اندوتلیال مویرگ با کاهش توزیع دارو در اندام همراه است. داروی طراحی شده برای این اندامها (ماهیچه و سد خونی-مغزی) باید بسیار کوچک یا هیدروفوب باشد یا بهوسیله ناقلهای غشایی به سلولها منتقل شود.
- تمایل اتصال به پروتئینهای سرم: آلبومین پروتئینی بزرگی است که از اندوتلیال مویرگ خارج نمیشود و نقش مهمی در تنظیم فشار اسمزی خون دارد. این پروتئین در کبد ساخته و غلظت سرمی آن بهوسیله کلیهها تنظیم میشود. تمایل زیاد آلبومین به دارو با کاهش داروی آزاد در خون و توزیعپذیری دارو همراه است. در این شرایط غلظت سرمی دارو از غلظت بافتی آن بیشتر است. غلظت آلبومین خون در بیماران کلیوی و سیروز کبدی کاهش و غلظت بافتی دارو افزایش مییابد. تعیین دوز موثر برای جلوگیری از عوارض جانبی غیرقابل جبران در این بیماران بسیار اهمیت دارد.
- انحلالپذیری دارو: بخش اصلی خون از آب تشکیل شده است و ویژگیهای شیمیایی دارو نقش مهمی در توزیعپذیری و انحلال آن در این مایع دارد. به طور کلی مولکولهای کوچک، غیرقطبی و هیدروفوب به راحتی از غشای سلولها عبور میکنند و غلظت بافتی بیشتری دارند. اما غلظت سرمی داروهای بزرگ، هیدروفیل و قطبی در خون بیشتر است.
زیست فراهمی دارو
زیست فراهمی پارامتر مهم دیگر داروشناسی است و نسبتی از دارو را نشان میدهد که پس از تجویز وارد خون میشود و بر اساس نوع روش تجویزی متفاوت است. برای مثال اگر از تزریق وردی برای تجویز دارو استفاده کنیم ۱۰۰٪ داروی تجویزی وارد جریان سیستمی خون میشود. اما بخش قابل توجهی از داروهای تجویز خوراکی و رکتال پس از جذب در لوله گوارش وارد کبد و غیرفعال میشود. به همین دلیل در شرایط اورژانسی تزریق وردی بهترین روش تجویز دارو است. این کمیت را میتوان از محاسبه مساحت زیر نمودار غلظت دارو در خون نسبت به زمان محاسبه کرد.
زمان و سطح در دسترس جذب دارو دو عامل دیگری هستند که فراهمی زیستی را تغییر میدهند. برای مثال اسهال زمان توقف دارو در لوله گوارش را کاهش میدهد. به همین دلیل در این شرایط نمیتوان از روشهای خوراکی یا رکتال برای تجویز دارو استفاده کرد.
متابولیسم دارو
کبد اندام اصلی متابولیسم دارو در بدن است. آنزیمهای این اندام وظیفه تبدیل ترکیبات سمی به ترکیبات غیرسمی، داروی غیرفعال به داروی فعال (برای شروع اثر) و داروی فعال به متابولیتهای غیرفعال (برای دفع در ادرار یا مدفوع) را بر عهده دارند. سیتوکرومها (Cyp 450) آنزیمهایی با گروه پروتستاتیک هم هستند که در غشای میتوکندری و شبکه اندوپلاسمایی صاف هپاتوسیتها قرار دارند و در متابولیسم داروها شرکت میکنند. این آنزیمها در دو مرحله و بهوسیله واکنشهای اکسایش کاهش و هیدرولیز ترکیبات هیدروفوب و غیرقطبی را به ترکیبات هیدروفیل و قطبی تبدیل کرده و دفع دارو را تسهیل میکنند. بعضی داروها در مرحله اول و بعضی در مرحله دوم غیرفعال میشوند. این فرایندها به ویژگیهای شیمیایی وابسته است.
آنزیمهای گروه Cyp450 مرحله اول تجزیه دارو از شکل فعال به شکل غیرفعال را برعهده دارند. عوامل ژنتیکی (پلیمورفیسم)، تداخل دارویی و بیماریهای کبدی عملکرد این آنزیمها در افراد مختلف را تغییر میدهند.
- عوامل ژنتیکی: پلیمورفیسم یکی از مکانیسمهای ایجاد تنوع ژنتیکی طبیعی است. این مکانیسم در ژنهای آنزیم سیتوکروم کبدی (Cpy 450) منجر بیان آنزیمهای سریع و آهسته میشود. تجزیه سریع داروها از شکل فعال به غیرفعال سبب کاهش غلظت سرمی دارو میشود. در نتیجه برای رسیدن به اثربخشی بهینه به تجویز دوز بیشتری از دارو نیاز است. از طرفی تجزیه آهسته دارو از حالت فعال به غیرفعال منجر به افزایش غلظت سرمی دارو و اثرات جانبی خطرناک خواهد شد.
- تداخل دارویی: داروها ممکن است علاوه بر اندام هدف، فعالیت آنزیم Cyp450 را تغییر دهند. بعضی داروها (آزول و آمپرازول) با اتصال به جایگاه فعال آنزیم اتصال داروهای دیگر را مهار و عوارض جانبی آن را افزایش میدهند و بعضی داروها (ریفامپین و کاربامازفین) با فعال کردن این آنزیم و افزایش سرعت متابولیزه شدن دارو، غلظت سرمی و اثربخشی آن را کاهش میدهند.
- بیماریهای کبدی: بیماریهای کبدی کارای یا تعداد آنزیمهای متابولیز داروها را کاهش میدهند. در نتیجه غلظت داروی فعال در بدن و عوارض جانبی آنها افزایش مییابد. به علاوه کارایی آنزیم در نوزادان و سالمندان (افزایش سن) کمتر از افراد دیگر است که احتمال سمیت دارو را افزایش میدهد.
مرحله دوم متابولسیم بهوسیله آنزیمهای ترانسفرازی انجام میشود که با اضافه کردن گروههای متیل، استیل، سولفور، گلوتاتیون و گلوکرونات انحلالپذیری و آبدوستی داروی غیرفعال را افزایش میدهند. بعضی داروها مستقیم وارد مرحله دوم و بعضی داروها بدون ورود به این مرحله از بدن خارج میشوند.
دفع دارو
باقیمانده دارو یا متابولیتهای غیرفعال آن باید از بدن دفع شوند. در داروشناسی روشهای دفع دارو را بررسی میکنیم. بازدم از ریهها (داروهای استنشاقی مثل داروهای بیهوشی)، دفع مدفوع از روده که جذب کیسه صفرا) و دفع ادرار از کلیه و مثانه راههای خروج دارو از بدن هستند. داروهایی که روی لوله گوارش اثر میگذارند اما در این لوله جذب نمیشوند و داروهایی که پس از جذب در کیسه صفرا وارد روده میشوند، همراه مدفوع از بدن خارج خواهند شد. اما کلیه اندام اصلی در دفع ترکیبات دارویی غیرفعال است. ترشح و بازجذب فرایند اصلی تشکیل ادرار و ورود مواد از شبکه مویرگی به لولههای نفرونی است که بر دفع داروها اثر دارد.
- ترشح: ترشح فرایند ورود مواد از شبکه مویرگی نفرون به مجرای این لولههای کلیوی است که در کپسول بومن و لولههای نفرونی انجام میشود.
- فیلتراسیون گلومرولی: ترشح مواد از شبکه مویرگی گلومرول به کپسول بومن نفرون، فیلتراسیون گلومرولی نام دارد. داروها همراه سایر این مواد با این فرایند وارد نفرون میشوند. به همین دلیل تغییرات نرخ فیلتراسیون کلیوی (GFR) دفع دارو از بدن را تغییر میدهد. برای مثال کاهش GFR در بیماریهای مزمن و حاد کلیه با افزایش غلظت سرمی دارو و افزایش عوارش جانبی همراه است. افزایش اتصال آلبومین-دارو یکی دیگر از عواملی است که تشرح دارو در نفرون را کاهش و غلظت سرمی آن را افزایش میدهد.
- ترشح لولههای نفرونی: بخشی از مواد و داروها در پس از عبور از سلولهای توبولی کلیه وارد لولههای نفرونی میشوند. داروهای هیدروفیل، قطبی با وزن مولکولی بالادر این قسمت بهوسیله پمپهای غشایی و مصرف ATP از خون وارد سلولهای توبولی کلیه میشوند. اما داروهای هیدروفوب، کوچک و غیرقطبی بهوسیله انتشار ساده وارد سولهای لولههای نفرونی میشوند.
- بازجذب: بازجذب فرایند برگشت آب، الکترولیتها و سایر مواد غیر دفعی از لوله پیچخورده دور به جریان خون کلیوی است. این فرایند در شرایط فیزیولوژیکی نقش مهمی در تنظیم فشار اسمزی بدن دارد. داروهایی با وزن مولکولی پایین، غیرقطبی و هیدروفوب با این فرایند به جریان خون برمیگردند. از کلیه به کبد منتقل میشوند. آنزیمهای کبدی با اضافه کردن گروههای قطبی انحلاتل این ترکیبات در آب را افزایش و احتمال بازجذب آنها از نفرون را کاهش میدهند. سدیم بیکربنات و آمونیوم کلرید دو ترکیبی هستند که برای کاهش بازجذب داروهای اسید و باز ضعیف از نفرونها تجویز میشوند. سدیم بیکربنات با افزایش pH (بار منفی ادرار) و آمونیوم کلرید با کاهش pH (بار مثبت ادرار) از بازجذب این داروها جلوگیری میکنند.
سینتیک دفع دارو
قبل از توضیح سینتیک دفع دارو لازم است با کلیرانس، نیمه عمر و حجم توزیعی دارو را توضیح دهیم.
«کلیرانس» (Clearance) یا پاکسازی نسبت سرعت دفع دارو از بدن به غلظت سرمی دارو است. سرعت دفع دارو به متابولیسم کبدی و دفع کلیوی آن بستگی دارد. اختلال در عملکرد هر یک از این اندامها کلیرانس دارو را کاهش میدهد. کلیرانس را میتوان بهوسیله فرمول زیر محاسبه کرد. در این فرمول CE کلیرانس، RE سرعت دفع دارو و C غلظت دارو در مایعات بدن (خون یا پلاسما) است.
$$CL= \frac{RE}{C}$$
حجم توزیعی نسبت حجم کل داروی موجود در بدن به غلظت دارو در پلاسما یا خون را نشان میدهد. حجم توزیعی بالاتر نشاندهنده غلظت بیشتر دارو در مایع میانبافتی و توزیع غیر یکنواخت دارو در بدن است. حجم توزیعی را میتوان از فرمول زیر محاسبه کرد که در آن Vd حجم توزیعی، m جرم یا مول کل دارو در بدن و C غلظت دارو در خون یا پلاسما را نشان میدهد.
$$V_d=\frac{m}{C}$$
نیمهعمر دارو زمان لازم برای دفع ۵۰٪ از داروی تجویز شده و یکی دیگر از پارامترهایی است که در کلیرانس نقش دارد. افزایش نیمه عمر با کاهش کلیرانس و کاهش آن با افزایش کلیرانس همراه است. فرمول زیر رابطه کلیرانس (CL)، نیمه عمر (t1/2) و حجم (Vd) توزیعی دارو را نشان میدهد.
$$t_\frac{1}{2}= \frac{0.7\times{V}}{CL}$$
سنتیک دفع بیشتر داروها شبیه سنتیک آنزیمهای درجه اول است. در این داروها سرعت دفع دارو مستقیم با غلظت تجویزی دارو دارد. در نتیجه افزایش داروی تجویزی با افزایش سرعت دفع همراه است. به علاوه نیمهعمر دارو در این سینتیک ثابت است. برای مثال اگر نیمهعمر دارو ۱ ساعت و داروی تجویزی ۱۰۰ میلیگرم باشد، در ساعت اول ۵۰ میلیگرم دارو، در ساعت دوم ۲۵ میلیگرم و در ساعت سوم ۱۲٫۵ میلیگرم آن از بدن دفع میشود.
آسپیرین و فنوتون از معدود داروهایی هستند که سینتیک دفع آنها شبیه واکنشهای آنزیمی درجه صفر است. در این داروها نیمهعمر متغیر اما سرعت دفع ثابت است. برای مثال اگر داروی تجویزی ۱۰۰ میلیگرم و سرعت دفع ۲۵ میلیگرم بر ساعت باشد، پس از یک ساعت ۷۵ میلیگرم، در ساعت دوم ۵۰ میلیگرم، در ساعت سوم ۲۵ میلیگرم دارو در بدن وجود دارد و پس از چهار ساعت دارو کاملا از بدن خارج میشود. در نتیجه سرعت دفع و غلظت اولیه دارو مستقل از هم هستند.
تعیین دوز تجویزی
برای درمان بهینه بیمار به غلظت مشخصی از دارو در خون (دوز هدف) نیاز است. ویژگیهای شیمایی و سینتیک دارو، دوز داروی تجویزی و تعداد دفعات تجویز و انتخاب بهترین روش تجویز در رسیدن به دوز هدف نقش دارند. در شرایط کلینیکی که جان بیمار در خطر آنی نیست و زمان لازم برای رسیدن به دوز هدف وجود دارد، برای پیشگیری از مسمومیت دارویی و کاهش عوارض جانبی به شکلی تعریف میشود که سرعت ورود دارو به خون با سرعت دفع دارو از بدن یکسان باشد.
در این شرایط برای رسیدن به غلظت هدف در خون، دارو از غلظتهای پایین تجویز میشود. افزایش غلظت تا زمانی که افزایش غلظت داروی ورودی، تغییری در غلظت دارو در خون ایجاد نکند، ادامه دارد. سرعت تجویز دارو در این روش را میتوان از معادله زیر محاسبه کرد که در آن CL کلیرانس دارو در کلیه، TC غلظت کل داروی تجویزی و DR سرعت تجویز دوز است.
$$DR=CL\times TC$$
اگر زمان در رسیدن به دوز هدف اهمیت داشته باشد، غلظت بالایی از دارو برای رسیدن به دوز هدف در کمترین زمان ممکن تجویز میشود. در این روش غلظت بالایی از دارو وارد خون میشود. اما قبل از اینکه تمام دارو از بدن دفع شود دوز بعدی تجویز و غلظت دارو افزایش مییابد. میانگین حداکثر و حداقل دوز دارو در خون در این روش با میانگین دوز بهینه در روش اول برابر است. دوز تجویزی در این روش را میتوان از حجم توزیعی دارو و غلظت کلی دارو محاسبه کرد که در آن LD دوز تجویزی، V حجم دوز تجویزی بلافاصله پس از ورود به بدن و TC غلظت کل دارو در بدن است.
$$DL=V\times TC$$
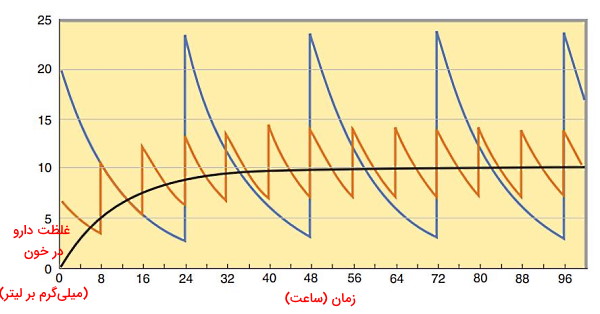
گراف پایین نمودار تغییر غلظت دارو در خون در واحد زمان را نشان میدهد. نمودار سیاه تغییرات غلظت دارو در خون پس از اینفیوژن وریدی دارو را نشان میدهد. در بخش انتهایی نمودار سرعت ورود دارو به خون و دفع آن از بدن یکسان است. نمودار نارنجی تزریق غلظت پایینتر همان دارو هر ۸ ساعت یکبار و نمودار آبی تزریق غلظت بالاتر دارو هر ۲۴ ساعت یکبار را نشان میدهد. میانگین دوز هدف در هر سه روش تزریق ۱۰ میلیگرم در ساعت است.
داروشناسی داروهای قلبی عروقی
در بخشهای قبلی مفاهیم اولیه و مشترک داروشناسی را توضیح دادیم. در این بخش داروشناسی انواع ترکیبات موثر بر قلب و گردش خون را بررسی میکنیم. قلب اندام حیاتی بدن و بهطور غیرمستقیم با تمام اندامهای بدن در ارتباط است. به همین دلیل آسیب و اختلال عملکرد ممکن است فعالیت اندامهای دیگر را مختل کند. داروهای تنظیم فشار خون، نارسایی قلبی، آریتمی قلب، کمخونی، ضدانعقادی، افزایش خونسازی، کاهش چربی خون مهم داروهایی هستند که در درمان بیماریهای قلبی-عروقی کاربرد دارند.
داروهای تنظیم فشار خون
ترکیبات ادرارآور، تنظیم سیستم عصبی سمپاتیک، افزایش قطر رگها (Vasodilators) و مهار آنژیوتانسین داروهایی هستند که برای کاهش فشار خون بالا تجویز میشوند.
- ترکیبات ادرارآور: اثر این داروها بر لولههای نفرونی دفع سدیم و آب در کلیهها را افزیاش و با کاهش حجم خون و خروجی قلب، فشار خون را کاهش میدهند.
- داروهای سیستم عصبی سمپاتیک: در بسیاری از بیماران، فشار خون بالا به دلیل عملکرد سیستم عصبی سمپاتیک ایجاد میشود که تجویز مهارکنندههای این سیستم با درمان بیماری همراه است.
- ترکیبات افزایشدهنده قطر رگ: این داروها (هیدرالازین، مینوکسیدول، دیازوکسید، سدیم نیروپروسید و فنولدوپام) با اثر بر کانالهای کلسیمی ماهیچههای صاف در دیواره سرخرگهای کوچک انقباض این ماهیچهها را مهار میکنند. در نتیجه مقاومت دیواره رگها و فشار خون سیستمی کاهش مییابد. سدیم نیتروپروسید و نیتراتها ترکیباتی هستند که بر ماهیچه صاف دیواره سیاهرگها نیز اثر دارند.
- داروهای مهار آنژیتانسین: مهارکنندههای آنزیم تبدیل آنژیوتانسین در غشای سلولهای اندوتلیال، مهارکننده رقابتی رسپتور آنژیوتانیسون در قلب، رگها، کلیهها، قشر غدد فوق کلیه، ریه، ساقه مغز، گانگلیای پایه و اندام دور بطنی، آنتاگونیست رنین و مهارکنندههای آلدوسترون از داروهای مهار تولید یا فعالیت آنژیوتانسین هستند که برای کاهش فشار خون تجویز میشوند.
داروهای نارسایی قلب
نارسایی قلب در اثر اختلالهای مختلفی ایجاد میشود که خروجی قلب را کاهش میدهد. کاهش حجم خون خروجی قلب با کاهش فشار خون سرخرگی، تحریک بارورسپتورها، انتقال پیام به مراکز کنترل مدولای مغز میانی و ترشح نوراپینفرین از نورونهای سمپاتیک همراه است.
اتصال این انتقالدهنده عصبی به گیرندههای $$\beta_1$$ در غشای ماهیچه قلبی با افزایش ضربان، انقباض و مصرف اکسیژن و کاهش زمان دیاستول (کاهش خونرسانی به میوکارد) همراه است. این فرایند در طولانیمدت منجر به ضعیف شدن میوکارد و کاهش مزمن خروجی قلب میشود. آنتاگونیستهای گیرنده بتا، مهارکننده سیستم رنین-آنژیوتانسین-آلدوسترون (RAAS)، مهارکننده گیرنده آنژیوتانسین، داروهای اتساع عروق داروهای اصلی درمان نارسایی قلب (کاهش مرگ) و داروهای ادرارآور و الکترولیتها داروهای کاهش علائم سیستمی نارسایی قلب هستند.
- آنتاگونیست گیرنده بتا: این ترکیبات (متوپروپول سوکسینات و بیسوپروپول) به گیرندههای بتا در غشای سلولهای سلولهای ماهیچه و گرهها متصل شده و اتصال نوراپینفرین را مهار میکنند. این داروها ضربان و انقباض قلب را کاهش میدهند. اتصال این ترکیبات به گیرنده بتا در غشای سلولهای JG کلیه با کاهش ترشح رنین و مهار افزایش فشار خون سیستمی به درمان نارسایی قلب کمک میکند. این داروها برای درمان نارسایی قلبی همراه با کاهش برونقلب و بیماریهای رگهای کرونری تجویز میشوند.
- مهارکننده RAAS: مهارکننده آنزیم تبدیل آنژیوتانسین I (بنازپریل و لیزینوپرویل)، مهارکنندههای سنتز آنژیتانسین (لوزارتان) و آنتاگونیستهای آلدوسترون (اسپیرولاکتون و اپلنون) ترکیبات مهارکننده RAAS هستند. با کاشه تولید آلدوسترون، رنین و آنژیوتاکسین، کاهش خون برگشتی به قلب و فشار خون سیستمی، به درمان نارسایی قلبی کمک میکنند.
- داروهای اتساع عروق: این ترکیبات مستقیم بر ماهیچههای صاف سرخرگها و سیاهرگها اثر میگذارند. ایزوسوربات دینیترید و هیدرولازین در این گروه قرار دارند. این داروها برای درمان نارسایی قلبی حاد و درمان این بیماری در افراد مبتلا به نارسایی کلیه تجویز میشود.
- ایزوسوربات دینیترید از غشای سیتوپلاسمی ماهیچه سیاهرگها عبور کرده و در سیتوپلاسم به نیتریکاکسید (NO) تبدیل میشود. نیتریکاکسید با فعال کردن آنزیم گوانیلیل سیکلاز غلظت cGMP را افزایش میدهد. cGMP پروتئین کیناز G و این آنزیم فسفاتاز زنجیره سبک میوزین را فعال میکند. در نتیجه انقباض ماهیچه مهار میشود.
- هیدرولازین پس از ورود به ماهیچه صاف دیواره سرخرگ آنزیم گوانیلیل سیکلاز را فعال کرده و با مکانیسم مشابه ایزوسوربات دینیترید انقباض را مهار میکند. این دارو با کاهش مقاومت و فشار خون سیستمی به درمان نارسایی قلب کمک میکند.
داروهای ضد انعقاد
انعقاد یکی از مکانیسمهای طبیعی برای محافظت بدن در آسیبهای بافتی و مویرگی است. در مرحله اول این این مکانیسم لختهای ناپایدار از پلاکتها برای جلوگیری از خونریزی ایجاد میشود و در مرحله دوم آبشاری از واکنشها فاکتورهای انعقادی را فعال و لخته خونی (thrombi) پایدار برای ترمیم آسیب تشکیل میدهند.
اگر بخشی از این لخته جدا شده و وارد جریان خون شود، با مسدود کردن رگها احتمال فیبروز یا نکروز بافت و سکته قلبی یا مغزی را افزایش میدهد. داروهای ضدانعقادی ترکیباتی هستند که فعال شدن پلاکت، فعال شدن فاکتورهای انعقادی و تشکیل لختههای پلاکتی یا خونی را مهار میکنند. داروهای ترومپولایزیز دسته دیگری از داروها هستند که با تجزیه لخته خونی تشکیل شده از حرکت آن در جریان خون جلوگیری میکنند. کومارینها، اینداندیونها، هپارین، مهارکننده فاکتور Xa و مهارکنندههای ترومبین، داروهایی هستند که انعقاد خون را مهار میکنند.
- کومارینها: کورامینها ترکیبات آروماتیکی هستند که به روش خوراکی تجویز میشوند و با مهار سنتز ویتامین K، از سنتز فاکتورهای انعقادی وابسته به این ویتامین (فاکتورهای II، VII، IX و X) در کبد جلوگیری میکنند. وارفارین (Warfarin) در این گروه قرار دارد.
- اینداندیونها: اندادیونها ترکیباتی با ساختار و مکانیسم عمل مشابه کومارینها هستند که از روش خوراکی تجویز میشوند. فنیندیون (Phenindione) در این گروه قرار دارد.
- هپارین: هپارین گلیکوزآمینوگلایکان طبیعی و داروی ضدانعقادی است که به روش تزریقی (وریدی و زیرجلدی) و بیشتر برای بیماران بستری در بیمارستان تجویز میشود. این ترکیب با فعال کردن آنتیترومبین III (مهارکننده ترومبین و فاکتور Xa) از انعقاد خون جلوگیری میکند. این دارو به شکل ترکیبات با وزن مولکولی زیاد و کم (اناوکساپارین، دالتپارین و تینزاپارین) تهیه میشود.
- مهارکننده فاکتور Xa: این ترکیبات فاکتور Xa را به شکل اختصاصی و برگشتپذیر مهار میکنند. ریواروکسابان و ادوکسابان در این گروه قرار دارند. این ترکیبات جایگزین خوبی برای وارفاین در بیمارن تحت درمان با چند دارو است و برای درمان ترومبوز وریدی، پیشگیری از سکته و آمبولی از راه خوراکی تجویز میشود.
- مهارکنندههای ترومبین: این ترکیبات با اتصال به جایگاه فعال یا آلوستریک آنزیم ترومبین (فاکتور IIa) آزاد یا متصل به فیبرین واکنشهای انعقادی را مهار میکنند. هیرودین، بیوالیرودین، آرگاتروبان و اینوگتران در این گروه قرار دراند.
داروهای آریتمی
جریان الکتریکی قلب در گره سینوسی-دهلیزی شروع میشود. این جریان بهوسیله رشتههای بینابینی به گره دهلیزی-بطنی و از این گره به دیواره بطنها منتقل میشود. نتیجه این انتقال جریان الکتریکی انقباض قلب با نظم مشخصی در دقیقه (بین ۶۰ تا ۱۰۰ انقباض در دقیقه) است. عواملی که در محل شروع جریان الکتریکی، انتقال این جریان بین بخشها یا تعداد انقباضها در دقیقه تغییر ایجاد کنند منجر به ایجاد بیماری آریتمی قلب در فرد میشوند.
ضربان قلب تندتر، آهستهتر یا بینظم علامت اصلی این بیماری است. مهارکنندههای کانال ولتاژی سدیم، مهارکنندههای سیستم سمپاتیک قلب، ترکیبات افزایشدهنده زمان هایپرپلاریزاسیون و مهارکنندههای کانال کلسیمی داروهایی هستند که برای درمان آریتمی تجویز می شوند. بر این اساس داروهای آریتمی قلب را به چهار گروه اصلی تقسیم میکنند.
- داروهای آریتمی کلاس ۱: این ترکیبات با مهار کانالهای سدیمی زمان پتانسیل عمل و جریان یون سدیم در سلولها را تغییر میدهند. داروهای گروه A (کوئینیدین و دیزوپیرامید) این کلاس زمان پتانسیل عمل را افزایش میدهند و با سرعت متوسطی از کانالها جدا میشوند. داروهای گروه B (لیدوکائین و مکزیلتین) این کلاس زمان پتانسیل عمل در بافتها را افزایش میدهند و سریع از کانالها جدا میشوند و داروهای گروه C (پروپافنون و موریسیزین) این کلاس اثر کمی بر زمان پتانسیل عمل دارند، اما سرعت جدا شدن آنها از کانال کم است.
- داروهای آریتمی کلاس ۲: این ترکیبات فعالیت گیرندههای بتا آدرنرژیک و سیستم عصبی سمپاتیک در قلب را کاهش میدهند. پروپانول، اسمولول و سوتالول در این گروه قرار دارند.
- داروهای آریتمی کلاس ۳: این ترکیبات با مهار خروج پتاسیم از سیتوپلاسم زمان پتانسیل عمل در را افزایش میدهند. آمیودارون، دروندارون، ورناکالانت، ایبوتیلید و دوفتیلید در این گروه قرار دارند.
- داروهای آریتمی کلاس ۴: این ترکیبات با مهار کانالهای کلسیمی انتقال جریان الکتریکی بین بخشهای مختلف قلب را کاهش میدهند. وراپامیل و دیلتیازم در این گروه قرار دارند.
- دیگزوکسین: دیگزوکسین یک ترکیب گلیکوزیدی است که برای درمان نارسایی و آریتمی قلب تجویز میشود. این ترکیب با مهار پمپ سدیم-پتاسیم در غشای میوکارد، تعادل غلظت سدیم بین سیتوپلاسم و مایع میانبافتی را به هم میزند. در نتیجه غلظت سدیم در سلول افزایش یافته و تراسپورتر سدیم-کلسیم (انتقال سه سدیم به سیتوپلاسم و یک کلسیم به مایع میانبافتی) مهار میشود. افزایش غلظت کلسیم سلولی زمان انقباض قلب را افزایش و ضربان قلب را کاهش میدهد.
- آدنوزین: آدنوزین نوکلئوزید طبیعی بدن است با نیمهعمر کمتر از ۱۰ ثانیه در خون است. این ترکیب با مهار جریان پتاسیم و هایپرپلاریزه کردن سلولهای قلب از انتقال جریان الکتریکی در گره دهلیزی-بطنی جلوگیری میکند و برای درمان تاکیکاردی (افزایش ضربان قلب) تجویز می شود.
- منیزیم: منیزیم یکی از داروهای معدنی است که برای درمان آریتمی حاصل از مصرف دیجیتالیزها در بیمارانی که غلظت منیزم سرمی پایینی دارند، تجویز میشود. این ترکیب عملکرد پمپ سدیم-پتاسیم، کانالهای سدیمی، پتاسیمی و کلسیمی را تغییر میدهد.
- پتاسیم: هیپوکالمیا (کاهش پتاسیم خون) و هایپرکالمیا (افزایش پتاسیم خون) با تغییر پتانسیل عمل جریان هدایت قلب منجر به ایجاد آریتمی میشود. هیپوکالمیا با کاهش پتاسیم در مایع میانبافتی قلب، زمان پتانسیل عمل و بازگشت به پتانسیل استراحت را افزایش میدهد. هایپرکالمیا گره سینوسی دهلیزی را مهار میکند و سرعت انتقال جریان الکتریکی در قلب را کاهش میدهد.
داروهای کنترل چربی خون
لیپیدهای جذب شده در روده برای شرکت در فرایندهای متابولیکی و آنابولیکی مختلف به شکل لیپوپروتئینها در جریان خون حمل میشوند. لیپوپروتئینها از یک هسته هیدروفوب شامل کلسترول استر و تریگلیسرید تشکیل شده است که اطراف آن کلسترول غیراستری، فسفولیپیدها و آپوپروتئینها قرار دارند. بخش پروتئینی این ترکیبات در کیلومیکرونهای روده B48 و در لیپوپروتئینهای کبدی (لیپوپروتئینهای بسیار کمچگال، لیپوپروتئینهای کمچگال، Lp لیپوپروتئینها و لیپوپروتئینهای با چگالی بالا) B100 است. تغییر غلظت این ترکیبات در خون با اختلالهای قلب-عروقی مختلف همراه است.
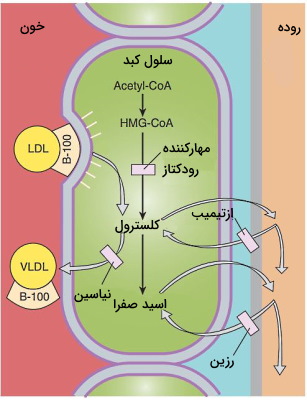
تغییر رژیم غذایی و سبک زندگی اولین درمان پیشنهادی برای کنترل چربی خون است. اما در مواردی که افزایش لیپوپروتئینهای خون منجر تصلب شریان و التهاب پانکراس شود، از داروهای مهارکنندههای آنزیم HMG-COA ردوکتاز یا استاتینها، نیاسین (نیکوتینیکاسید)، مشتقات فیبریکاسید (فیبراتها)، رزینهای اتصالی به اسیدهای صفراوی، مهارکننده جذب استرول از روده، مهارکننده پروتئین کلستریل استر ترانسفراز (CETP | در مرحله مطالعات بالینی است) برای کاهش چربی خون استفاده میشود.
- استاتینها: آنزیم HMA-COA ردوکتاز اولین مرحله در بیوسنتز استرولها را کاتالیز میکند. لواستاتین، آتروواستاتین، فلوواستاتین و پاراواستاتین در این گروه قرار دارند. این ترکیبات آنالوگهای HMA-COA (۳-هیدروکسی-۳-متیلگلوتاریل-کوآنزیم A) هستند و با مهار آنزیم ردوکتاز از تشکیل ایزوپرنوئیدها و LDL جلوگیری میکنند.
- نیاسین: نیاسین (ویتامین B3) ترشح VLDL از کبد، تولید LDL دفع استرولهای خنثی در مدفوع و غلظت فعالکننده پلاسمینوژن در بافت را افزایش میدهد.
- فیبراتها: فیبراتها (جمفیبروزیل و فنوفیبرات) به گیرندههای هستهای ($$PPAR-\alpha$$) متصل شده و رونویسی ژن لیپوپروتئین لیپاز و آپوپروتئینها را تغییر میدهند. در نتیجه اکسیداسیون اسیدهای چرب در کبد و ماهیچههای اسکلتی افزایش مییابد. به علاوه افزایش بیان لیپاز تجزیه لیپوپروتئینهای تریگلیسرید را افزایش میدهد.
- رزینهای اتصالی به اسیدهای صفراوی: کلستیپول، کلستریامین و کلسولام، پلیمرهای کاتیونی بزرگ و نامحلول در آب هستند که با اتصال به اسیدهای صفراوی، جذب آنها در روده را مهار میکنند. دفع اسیدهای صفراوی با افزایش آلفا هیدروکسیلاسیون کلسترول در کبد برای سنتز اسیدهای جدید همراه است. در نتیجه LDL بیشتری وارد سلولهای کبدی شده و چربی خون کاهش مییابد.
- مهارکننده جذب استرول از روده: ازتیمیب ترکیبی است که با مهار ناقل غشایی روده (NPC1L1) از جذب کلسترولهای گیاهی و جانوری در این بخش از لوله گوارش جلوگیری میکند و برای کاهش غلظت LDL تجویز میشود.
داروشناسی ترکیبات موثر بر دستگاه ادراری
دستگاه ادراری شامل کلیهها، مجاری ادراری و مثانه میشود. این سیستم با تشکیل ادرار در دفع مواد سمی، متابولیتها، تنظیم آب و الکترولیت بدن نقش مهمی دارد. تغییر جذب و ترشح مواد در گلرومرولهای کلیه با تجمع مواد سمی، ادم، دهیدراته شدن و تغییر فشار خون همراه است. داروهای ادرارآور یا ضدادراری دو دسته ترکیباتی هستند که برای درمان بیماریهای این دستگاه استفاده میشوند. در ادامه این مطلب داروشناسی این ترکیبات را توضیح میدهیم.
داروهای ادرارآور
ترکیبات ادرارآور دفع سدیم در کلیه را افزایش میدهند. دفع سدیم با افزایش فشار اسمزی ادرار در لولههای نفرونی، ترشح آب در نفرونها و افزایش حجم ادرار همراه است. کاهش حجم خون به دلیل دفع سبب کاهش فشار خون میشود. مهارکنندههای کربنیکانیداز، آنتاگونیست رسپتور آدنوزین A12، مهارکنندههای لوپ، تیازیدها و ترکیبات دفعکننده پتاسیم، داروهای ضدادراری هستند که برای کاهش فشار خون، ادم، مشکلات کبد و کلیه تجویز میشوند.
- مهارکنندههای کربنیکانیداز: آنزیم کربونیکانیدراز یکی از پروتئینهای غشا و سیتوپلاسمی سلولهای اپیتلیال نفرون است که در لوله پیچخورده نزدیک فعالیت بیشتری دارد. فعالیت این آنزیم در سیتوپلاسم سبب تشکیل اسیدکربونیک از دیاکسید کربن و آب در سیتوپلاسم و در غشای سلولی سبب تشکیل دیاکسید کربن و آب در ادرار میشود. مهار کربونیکانیدراز غشایی منجر به تشکیل سدیم بیکربنات، افزایش فشار اسمزی در نفرون و دفع آب بیشتر میشود.
- آنتاگونیست رسپتور آدنوزین A2: این آنتاگونیستها فعالیت سیمپورتر سدیم-پروتون در غشای لوله پیچخورده نزدیک را مهار میکند. در نتیجه توقف بازجذب سدیم از ادرار با تغییر فشار اسمزی، دفع آب و افزایش حجم ادرار همراه است.
- مهارکنندههای لوپ هنله: این داروها بازجذب سدیم کلرید از بخش ضخیم بالارونده در لوله هنله را مهار میکند. فعالیت این داروها برخلاف مهارکنندههای کربونیکانیدراز بر اثر اسیدوز متوقف نمیشود و موثرترین داروهای ادرارآور هستند.
- تیازیدها: تیازیدها از داروهایی هستند که با مهار بازجذب سدیم کلرید، افزایش فشار اسمزی لومن و دفع آب بیشتر، حجم ادرار را افزایش میدهند. اثر این داروها بر لوله پیچخورده دور از سایر بخشهای نفرون بیشتر است.
- ترکیبات دفعکننده پتاسیم: این ترکیبات آنتاگونیستهای آلدوسترون هستند که با اثر روی سلولهای اپیتلیال لوله جمعکننده ادرار از ترشح پتاسیم جلوگیری میکنند. اثر این داروها با اثر مستقیم روی گیرندههای آلدوسترون (اسپیرولاکتون و اپلورونون) یا با مهار بازجذب سدیم از ادرار (آمیلورید و تریامترنس) دفع آب و حجم ادرار را افزایش میدهند. داروهای دسته دوم بازجذب سدیم در لوله پیچخورده نزدیک و بازجذب سدیم و دفع پتاسیم در لوله جمعکننده ادرار را کاهش میدهند.
داروشناسی داروهای دستگاه عصبی
سیستم عصبی از دو بخش دستگاه عصبی مرکزی و محیطی تشکیل میشود. این سیستم کنترل تمام فعالیتهای بدن است. اختلال در فعالیت این دستگاه با توقف فعالیت بخشهای حرکتی (فلج اندام)، تغییر متابولیسم و بیحس شدن بخشهای مختلف بدن همراه است.
داروهای موثر بر این سیستم مولکولهای شبیه انتقالدهندههای عصبی هستند و با مکانیسم مشابه آنها فعالیت نورون را تغییر میدهند. مسکنها، الکلها، ضدتشنجها، داروهای بیهوشی عمومی، داروهای بیحسی موضعی، شلکننده عضلات، داروهای پارکینسون و داروهای روان ترکیباتی هستند که بر سیستم عصبی اثر دارند. در ادامه این بخش داروشناسی ترکیبات موثر بر قسمتهای مختلف دستگاه عصبی را بررسی میکنیم.
داروهای سیستم عصبی محیطی
داروهای موثر بر سیستم عصبی محیطی فعالیت اعصاب سمپاتیک و پاراسمپاتیک را تغییر میدهند. آنتاگونیستها و آگونیستهای گیرنده آدرنرژیک (نوراپینفرین)، آنتاگونیستهای گیرنده موسکارینی و آگونیست گیرنده کولینرژیک (استیل کولین) در این گروه قرار دارند.
آنتاگونیست آدرنرژیک
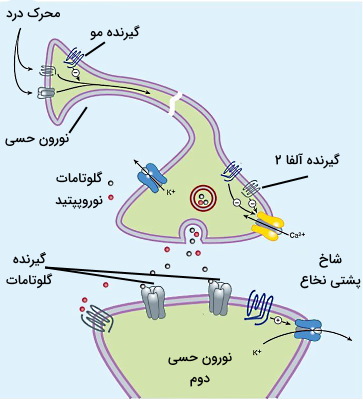
نوراپینفرین و اپینفرین لیگاند طبیعی گیرندههای آدرنرژیک در سیستم عصبی سمپاتیک هستند. این انتقالدهنده عصبی از مجموعه واکنشهای آنزیمی تبدیل آمینواسید تیروزین به ال-دوپامین، دوپامین و نوراپینفرین (یا اپینفرین) در سیتوپلاسم نورون سنتز و در وزیکولهای سیناپسی ذخیره میشود. پس از ایجاد پتانسیل عمل در پایانه آکسونی و باز شدن کانالهای ولتاژی کلسیم، وزیکولها با غشای نورون ادغام و نوراپینفرین اگزوسیتوز خواهد شد. نوراپینفرین آزاد شده در فضای سیناپسی به یکی از گیرندههای $$\alpha_1$$ $$\alpha_2$$ $$\beta_1$$ $$\beta_2$$ $$\beta_3$$ متصل میشود. تمایل نوراپینفرین به گیرندههای آلفا و تمایل اپینفرین به گیرندههای بتا بیشتر است.
- $$\alpha_1$$: اتصال لیگاند-گیرنده با فعال شدن $$G_q$$ و افزایش کلسیم سیتوپلاسمی همراه است. این گیرندهها در غشای ماهیچههای صاف، انقباض را تحریک میکنند.
- $$\alpha_2$$: اتصال لیگاند-گیرنده با فعال شدن $$G_i$$ و کاهش تولید cAMP همراه است. در نتیجه خروج پتاسیم از سیتوپلاسم افزایش یافته و هایپرپلاریزاسیون غشا منجر به مهار ترشح هورمون یا انتقالدهنده عصبی میشود.
- $$\beta_1$$: اتصال لیگاند-گیرنده با فعال شده $$G_s$$ و افزایش cAMP همراه است. در نتیجه انقباض، ترشح یا انتقال جریان الکتریکی در سلول تحزیک میشود.
- $$\beta_{2,3}$$: اتصال لیگاند به این گیرندهها با فعال شدن $$G_s$$ و افزایش سنتز cAMP همراه است. اما واکنشهای فسفوریلاسیون بعدی فعالیت سلول را مهار میکند.
آنزیم کتکول اُترانسفراز پس از پایان فعالیت اپینفرین این ترکیب را به متابولیتهای غیرفعال تجزیه میکند. بخشی از اپینفرین بهوسیله ناقلهای غشایی به نورون برمیگردد. آنزیم مونوآمین اکسیداز میتوکندری بخشی از نوراپینفرین را به متابولیتهای غیرفعال تبدیل میکند و بخش دیگر این انتقالدهنده عصبی دوباره در وزیکولهای سیناپسی ذخیره میشود. آنتاگونیستهای آدرنرژیک با مهار رسپتورها یا آنزیمهای مسیر سنتز و تجزیه این دو انتقالدهنده عصبی فعالیت اندامها را تغییر میدهند. مهارکننده آلفا (آلفا بلاکر) و مهارکننده بتا (بتا بلاکر) آنتاگونیستهای آدرنرژیک هستند.
- آلفا بلاکر: آلفا بلاکرها با اثر بر گیرندههای آلفا ۱ و آلفا ۲ فعالیت طبیعی سلول را تغییر میدهند.
- گیرندههای آلفا ۱ در غشای سلولهای ماهیچه دیواره رگها، اسفنکتر مثانه و اطراف مردمک قرار دارد. اتصال نوراپینفرین به این گیرندهها با افزایش انقباض رگ و فشارخون سیستمی، جلوگیری از خروج ادرار و افزایش قطر مردمک همراه است. درنتیجه آلفا ۱ بلاکرها برای کاهش فشار خون، کمک به دفع ادرار و کاهش قطر مردمک تجویز میشوند.
- گیرندههای آلفا ۲ در غشای نورونها، سلولهای ماهیچه قلب، رگها و سلولهای بتای پانکراس قرار دارند. اتصال لیگاند به این گیرندهها با کاهش ترشح اپینفرین در نورون پسسیناپسی، مهار ترشح انسولین و کاهش انقباض ماهیچه قلبی همراه است. به همین دلیل از آلفا ۲ بلاکرها برای افزایش ترشح انسولین (درمان دیابت) و افزایش ضربان قلب تجویز میشود.
- بتا بلاکر: بتا بلاکرها ترکیباتی هستند که با اتصال به گیرندههای بتا ۱-۳ از اتصال اپینفرین به گیرنده جلوگیری میکنند.
- بتا ۱ بلاکر: این گیرندهها در غشای سلولهای ماهیچه قلبی و سلولهای JG کلیه قرار دارند. اتصال لیگاند به آنها با افزایش انقباض، ترشح رنین و فشار خون همراه است. به همین دلیل از بتا ۱ بلاکرها برای درمان تاکیکاردی، آنژین صدری و فشار خون بالا استفاده میشود.
- بتا ۲ بلاکر: این گیرندهها در غشای سلولهای ماهیچه صاف نایژه و سلولهای بتای پانکراس قرار دارند. اتصال لیگاند طبیعی به گیرنده با کاهش انقباض ماهیچه، افزایش جریان خون ماهیچهها، افزایش ترشح گلوکاگون و افزایش جزئی فشار خون سیستمی همراه است. به همین دلیل تجویز بتا ۲ بلاکر با افزایش انقباض ماهیچههای صاف نایژه (کاهش اکسیژن ورودی و کاهش ترشح گلوکاگون (کاهش گلوکز خون) همراه است.
- بتا ۳ بلاکر: گیرندههای بتا ۳ در غشای سیتوپلاسممی سلولهای بافت چربی و ماهیچه صاف دیواره مثانه قرار دارد. اتصال لیگاند طبیعی به این گیرندهها با مهار انقباض ماهیچه (جلوگیری از خروج ادرار) و تحریک لیپولیز (تجزیه تریگلیسیرید به اسید چرب) همراه است. به همین دلیل مصرف بتا ۳ بلاکر منجر به انقباض ماهیچه صاف مثانه و افزایش غلظت تریگلیسرید خون میشود.
آگونیست آدرنرژیک
آگونیستهای آدرنرژیک ترکیباتی هستند که اثر کاملا مشابه اپینفرین و نوراپینفرین در بدن دارند. این ترکیبات مستقیم به گیرندههای آدرنرژیک متصل شده و رفتار نوراپینفرین را تقلید میکنند یا با مهار آنزیمهای تجزیه (مونوآمین اکسیداز و کتکول اُترانسفراز) و ناقل غشایی بازجذب، غلظت این مولکول در فضای سیناپسی را افزایش میدهند.
آگونیست کولینرژیک
استیل کولین انتقالدهنده عصبی سیستم عصبی پاراسمپاتیک و نورونهای حرکتی پیکری است. این ترکیب پس از ورود کولین به سیتوپلاسم نورون و بهوسیله آنزیم استیل ترانسفراز و استیل-کوآی میتوکندری سنتز و در وزیکولهای سیناپسی ذخیره میشود. ایجاد پتانسیل عمل در پایانه آکسون با اگزوسیتوز این انتقالدهنده عصبی در شکاف سیناپسی و اتصال آن به سلول پسسیناپسی (نورون یا ماهیچه) همراه است. گیرندههای استیل کولین در سیناپس عصب-عضله کانالهای یونی دریچهدار (گیرندههای نیکوتینی) و در غشای سلولهای دیگر از انواع موسکارینی است.
استوکولین استراز آنزیمی است که با تجزیه استیل کولین تحریک سلول پیشسیناپسی را مهار میکند. آگونیستهای کولینرژیک داروهای سیستم عصبی پاراسمپاتیک و نورونهای حرکتی پیکری هستند که مثل آگونیستهای آدرنرژیک با اثر مستقیم بر گیرندههای سلولی یا مهار آنزیمهای تجزیهکننده، اثر استیل کولین بر اندامها را افزایش میدهند.
- متاکولین، بتانیکول و پایلوکاربین آگونیستهای مستقیم گیرندههای موسکارینی و کارباکول آگونیست مستقیم گیرندههای نیکوتینی است.
- ادروفونیوم، فیزوستگمین (آمین نوع ۳)، نئوستگمین، پریدوستگمین (آمین نوع ۳)، ریواستگمین (آمین نوع ۳) و «دوناپزیل» (Donepezil) شبهآگونیستهایی هستند که با مهار برگشتپذیر آنزیم استیل کولین استراز، غلظت استیل کولین در سیناپس را افزایش میدهند. آمینهای نوع ۳ مولکولهای لیپوفیل هستند.
آنتاگونیست موسکارینی
گیرندههای موسکارینی بخشی از سیستم انتقال پیام در اعصاب پاراسمپاتیک و لیگاند طبیعی آن انتقالدهنده عصبی استیل کولین است. این گیرندهها از انواع پروتئینهای عرض غشایی همراه پروتئین G (گیرندههای m1 و m4 همراه Gi و گیرندههای m1، m3 و m5 همراه Gi,s) هستند.
این گیرندهها در غشای نورونهای گانگلیای پایه مغز، مرکز کنترل تهوع در مدولا، ماهیچههای صاف چشم، ماهیچههای قلبی، سلولهای غدد اگزوکرین (بزاقی، اشکی و عرق)، ماهیچههای صاف لوله گوارش، مثانه و کبد قرار دارند. اتصال استیل کولین به این گیرنده با تغییر حرکات بدن، تحریک انعکاس استفراغ، کاهش قطر مردمک، افزایش ترشح غدد اگزوکرین، افزایش حرکات لوله گوارش و دفع ادرار همراه است. آنتاگونیستهای موسکارینی ازجمله آتروپین اثر متضاد استیل کولین بر این گیرندهها دارند.
داروشناسی ترکیبات موثر بر سیستم عصبی مرکزی
داروهای موثر بر سیستم عصبی مرکزی آگونیستها و آنتاگونیستهای انتقالدهندههای عصبی نورونهای مغز و نخاع هستند که عملکردی شبیه داروهای سیستم عصبی محیطی دارند. این داروها با تقلید رفتار مولکول طبیعی یا مهار بازجذب آن ایجاد پتانسیل عمل در نورون پسسیناپسی را تحریک یا مهار میکنند. داروهای آرامبخش و خوابآور، داروهای کنترل تشنج، داروهای بیهوشی عمومی و بیحسی موضعی با اثر بر این گیرندهها عمل میکنند. در ادامه داروشناسی این ترکیبات را بررسی میکنیم.
داروهای آرامبخش و خوابآور
این داروها با فعال کردن چرخه خواب یا بدون تغییر این چرخه اضطراب فرد را کاهش میدهند. بنزودیازپینها، آنتاگونیستهای بنزودیازپین، باربیتوراتها، آگونیست رسپتور ملاتونین و آگونیست رسپتور 5-HT انواع آرامبخشهای خوابآور هستند.
- بنزودیازپینها: اتصال این ترکیبات به گیرندههای GABA-a با باز شدن کانالهای یونی Cl، غلظت این یون در سیتوپلاسم را افزایش و پتانسیل الکتریکی سلول را کاهش (افزایش بار منفی سیتوپلاسم) میدهند. در نتیجه غشا هایپرپلاریزه شده و ایجاد پتانسیل عمل مهار میشود. آلپروزولام، دیازپام، تریزولام و کلونوزپام، بنزودیازپینهایی هستند که برای درمان حمله اضطرابی، اختلال خواب، تشنج و اسپاسم عضله تجویز میشوند.
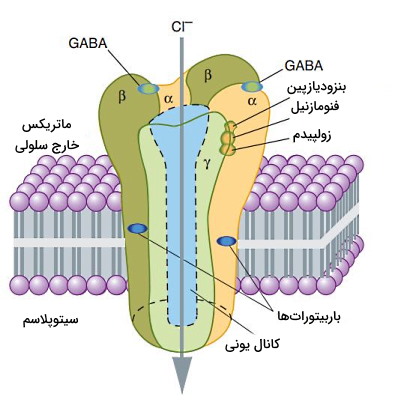
- باربیتوراتها: مکانیسم عمل این ترکیبات شبیه بنزودیازپینها است. اما به زیرواحد متفاوتی در گیرندههای GABA-a متصل میشوند. تیوبنتال (بیهوشی عمومی)، سکوباربیتال (درمان اختلال خواب) و فنوباربیتال (درمان تشنج) در این گروه آرامبخشها قرار میگیرند.
- آگونیست رسپتور ملاتونین: این ترکیبات گیرندههای MT1 و MT2 در هسته فوق کیاسمایی را فعال و شروع چرخه خواب را تحریک میکنند. این داروها برای درمان اختلال خواب تجویز میشوند.
- آگونیست رسپتور 5-HT: این ترکیبات آگونیست نسبی رسپتورهای 5-HT هستند برای القای بیهوشی عمومی تجویز میشوند.
داروهای کنترل تشنج
تشنج اختلالی است که به دلیل تحریک غیرطبیعی و همزمان تعداد زیادی از نورونهای قشر مخ ایجاد میشود. این اختلال انقباض ماهیچهها، حرکت، رفتار، هوشیاری و درک احساسات را تغییر میدهد. تب بالا، غلظت گلوگز خون بسیار کم یا بسیار زیاد، سومصرف الکل و مخدر، جهش ژنتیکی یا آسیب مغزی دلایل ایجاد تشنج هستند. این اختلال ممکن است به دلیل تحریک نورونهای بخش کوچکی از قشر مخ (متمرکز) یا تحریک تمام نورونهای این بخش (عمومی) ایجاد شود.
گلوتامات یکی از انتقالدهندههای عصبی تحریکی و GABA یکی از انتقالدهنده عصبی مهاری سیستم عصبی مرکزی است. هر عاملی که ترشح این دو ماده را بههم بزند منجر به تشنج میشود. گیرنده گلوتامات کانالهای یونی کلسیم و گیرنده GABA کانالهای یونی کلر هستند. با فعال یا مهار کردن این کانالها، ناقلهای غشایی بازجذب و آنزیمهای تجزیهکننده، میتوان تشنج را درمان کرد.
- مهار گلوتامات: مهار کانالهای ولتاژی سدیم از شروع پتانسیل عمل و مهار کانالهای ولتاژی کلسیم از اگزوسیتوز وزیکولهای سیناپسی در نورونهای گلوتامینرژیک جلوگیری میکند. لواتراستام (Levetiracetam) یکی از داروهای کنترل تشنج است که با مهار پروتئینهای وزیکول سیناپسی (SV2 A) از ترشح گلوتامات و تحریک نورون پسسیناپسی را مهار میکند. فلبامات (AMP Blocker) یکی دیگر از داروهای مهار گلوتامات است که به گیرندههای این مولکول در غشای نوورن پسسیناپسی متصل شده و از اتصال گلوتامات را مهار میکند.
- تحریک GABA: بنزودیازپینها (لورازپام و دیازپام) و باربیتوراتها (فنوباربیتال) آگونیستهای گیرنده GABA-a هستند که با افزایش ورود کلر به سیتوپلاسم و هایپرپلاریزه شدن غشا، ایجاد پتانسیل عمل و تشنج را مهار میکنند. بنزودیایزپینها دفعات باز شدن و باربیتوراتها زمان باز ماندن کانال کلر را افزایش میدهند. تایاگابین یکی از داروهای کنترل تشنج متمرکز است که با مهار ناقل غشایی GABA بازجذب این انتقالدهنده عصبی را مهار و غلظت سیناپسی آن را افزایش میدهد. وایگاباترین و ولپروئید شبهآگونیستهایی هستند که با مهار آنزیم GABA آمین ترانسفراز و تجزیه GABA غلظت سیناپسی این مولکول را افزایش میدهند.
داروشناسی هوشبری عمومی
بیهوشی عمومی به وضعیتی گفته میشود که فرد کاملا ناهشیار است، خاطرهای از اتفاقات این دوره در ذهنش باقی نمیماند، دردی احساس نمیکند و اعصاب خودمختار و پیکری او هیچ تحریکی ندارد. متخصصین بیهوشی برای رسیدن به این حالت از ترکیب داروهای مختلف استفاده میکنند. این داروها با مهار کانالهای یونی کلر و پتاسیم یا تحریک گیرندههای استیل کولین (نیکوتینی و موسکارینی)، گیرندههای آمینواسیدها و سروتونین هشیاری بیمار را کاهش میدهند. این داروها را به دو روش استنشاقی و وریدی تجویز میکنند. برای رسیدن به پنج فاکتور بیهوشی عمومی معمولا از ترکیب داروهای استنشاقی، وریدی، خوابآور، مهار انقباض عضله و مخدرها استفاده میشود.
داروهای بیهوشی استنشاقی
داروهای استنشاقی در دو حالت فیزیکی گاز و بخار تجویز میشود. هالوتان، افلوران و ایزوفلوران داروهای بیهوشی عمومی با فشار بخار پایین، دمای جوش بالا و در دمای اتاق مایع هستند که به حالت بخار استفاده میشوند. نیترواکسید و زنان ترکیباتی با فشار بخار بالا و نقطه جوش پایین که به حالت گاز برای القای بیهوشی عمومی استفاده میشوند. این دسته از داروها با مکانیسم تبادل گازی در آلوئولها ریه وارد جریان خون میشوند.
این داروها عملکرد مخ، سیستم قلبی-عروقی (کاهش میانگین فشار خون سرخرگی)، دستگاه تنفس (افزایش قطر مسیرهای تنفسی)، کبد (کاهش فشار خون سیاهرگ) و ماهیچههای صاف دستگاه ادراری (شل شدن عضلات) را تغییر میدهند. این داروها فعالیتهای متابولیکی و الکتریکی مغز را کاهش میدهند. تغییر جریان خون مغز به غلظت و نوع داروی بیهوشی بستگی دارد. برای مثال نیتریکاکسید با تحریک سیستم سمپاتیک جریان خون و فشار جمجمهای مغز را افزایش میدهد. به همین دلیل معمولا با ترکیبات دیگر (داروی وریدی) تجویز میشود.
داروهای بیهوشی وریدی
این داروها مستقیم وارد جریان خون میشوند و القای بیهوشی بهوسیله آنها سریعتر از داروهای استنشاقی است. این داروها ترکیبات لیپوفیلی هستند که توزیعپدیری بالایی در بافت مغز و نخاع دارند. پروپوفول، فسپروپوفول، باربیتوراتها، بنزودیازپینها و «اتومیدیت» (Etomidate) داروهای بیهوشی عمومی هستند که از روش تزریقی تجویز میشوند.
داروهای بیحسی موضعی
داروهای بیحسی موضعی انتقال پیام از نوورنهای وابران محیطی به سیستم عصبی مرکزی را مهار میکنند. این ترکیبات بر اساس ساختار شیمیایی به دو گروه آمیدها (لیدوکائین و بوپیواکائین) و استرها (کلروپروکائین و کوکائین) تقسیم میشوند. این ترکیبات با مهار کانالهای ولتاژی سدیم، ورود این یون به سیتوپلاسم و ایجاد پتانسیل عمل را مهار میکنند. داروهای بیحسی موضعی بازهای ضعیفی هستند که از نمک انها برای درمان استفاده میشود.
داروشناسی روان چیست ؟
بسیاری از اختلالهای روانی (افسردگی، دوقطبی و شیزوفرنی) به دلیل تغییر در تعادل انتقالدهندههای عصبی ایجاد میشوند. سروتونین، دوپامین، گلوتامات و اپینفرین نروترانسمیترهایی هستند که بیشترین نقش را در ایجاد اختلالهای روان دارند. در ادامه داروشناسی این ترکیبات را بررسی میکنیم.
- سروتونین: این مونوآمین بهوسیله سلولهای کرومافین روده، نورونهای مغز، سلولهای نورواندوکرین ریه، سلولهای مارکل در پوست سنتز و بخشی از آن در وزیکولهای سیتوپلاسمی پلاکتها ذخیره میشود. این ترکیب در تنظیم چرخه خواب، یادگیری، حافظه، درد، رفتار و دمای بدن نقش دارد. گیرندههای سرتونین به جز 5-HT3 (کانال یونی در غشای نورونهای دستگاه عصبی) از انواع همراه با G پروتئین است.
- دوپامین: دوپامین یکی دیگر از مونوآمینهای سیستم عصبی و انتقالدهنده عصبی مسیر پاداش در مغز است. انتظار یا دریافت پاداش سطح ترشح این ترکیب از نورونها را افزایش میدهد. مخدرها آنتاگونیستهای این انتقالدهنده عصبی هستند. به علاوه این انتقالدهنده عصبی تحریک نورونهای حرکتی و ترشح نوروهورمونها را کنترل میکند. در بیماریهای پارکینسون، شیزوفرنی، اختلال کمبود توجه بیشفعالی (ADHD) و در افسردگیهای خفیف ترشح دوپایمن در بدن کاهش مییابد. دوپامین در اندامهای محیطی نقش متفاوتی دارد.
- دوپامین با مهار ترشح نوراپینفرین اتساع رگها را افزایش میدهد.
- اتصال دوپامین به گیرندههای لوله نفرونی با افزایش دفع سدیم و حجم ادرار همراه است.
- اتصال دوپامین به گیرنده سلولهای بتا در پانکراس سنتز و ترشح انسولین را کاهش و گلوکز خون را افزایش میدهد.
- اتصال دوپامین-گیرنده در لوله گوارش حرکات این بخش را کاهش میدهد.
- گلوتامات: آمینواسید گلوتامات انتقالدهنده عصبی اصلی در سیناپسهای تحریکی مغز است. این ترکیب در فرایندهای شناختی (یادگیری و حافظه) نقش مهمی دارد. گیرندههای کلوتامات در مغز از انواع کانالهای یونی و همراه پروتئین G هستند.
- نوراپینفرین: نوراپینفرین یکی دیگر از کتکول آمینهاس تنظیمی فعالیتهای بدن انسان است. این ترکیب در نورونهای سیستم عصبی مرکزی و سلولهای نورواندوکرین غدد فوق کلیه سنتز میشود. نورونهای آدرنرژیک مغز در تحلیل اطلاعات حسی، توجه، حافظه بلندمدت و پاسخ به محرکها نقش دارند.
داروهای روان مثل سایر داروهای سیستم عصبی، با افزایش سنتز این مولکولها یا مهار بازجذب آن به درمان این اختلالها کمک میکنند. این داروها را میتوان به سه گروه ضد روانپریشی، ضدافسردگی و مخدرها تقسیمبندی کرد.
داروهای درمان شیزوفرنی
شیزوفرنی یکی از اختلالهای روانپریشی و وضعیتی همراه با توهم بینایی و شنوایی است. این اختلال به دلیل تغییر عملکرد و ساختار مغز ایجاد میشود و جهشهای ژنتیکی (حذف و ادغام ژنها) ایجاد میشود. مشتقات فنوتیازین، تیوکسانتن، بوتیروفنول، پیموزید و مولیندون داروهایی هستند که برای درمان انواع اختلالهای روانپریشی تجویز میشود. این ترکیبات با مهار گیرندههای D2 و 5-HT2A گیرندههای آلفا، بتا و موسکارینی در بخشهای مختلف بدن را مهار میکنند.
داروهای درمان دوقطبی
مشخصه اصلی بیماری دو قطبی تغییرات ناگهانی و شدید خلق بین افسردگی و شادی زیاد در فرد است. کاتیون تکظرفیتی لیتیوم متدوالترین دارویی است که به روش خوراکی برای درمان این اختلال تجویز میشود. این یون با مهار مسیر اینوزیتول (گیرندههای موسکارینی و آلفا آدرنرژیک) و کیناز سنتز گلیکوژن ۳ (GSK-3) متابولیسم انرژی را تغییر میدهد.
داروهای ضدافسردگی
مهارکننده انتخابی بازجذب سروتونین (SSRIS)، مهارکننده بازجذب سروتونین-نوراپینفرین (SNRIS)، ضدافسردگیهای سهحلقهای (TCAS)، آنتاگونیست 5-HT2، مهارکننده مونوآمین اکسیداز (MAOIS) و مهارکننده بازجذب نوراپینفرین و دوپامین (NDRI) داروهای ضدافسردگی هستند که غلظت سروتونین، نوراپینفرین و دوپامین در سیستم عصبی را تغییر میدهند.
- SSRIs: این ترکیبات با مهار ناقل سرتونین در غشای پایانه آکسون، غلظت این مولکول در سیناپس را افزایش میدهند. تمایل این ترکیبات به ناقل نوراپینفرین بسیار کمتر است. فلوکسیتین، سیتالوپرام و سرتالین در این گروه قرار دارند. این داروها برای درمان حمله اضطرابی، افسردگی عمیق، وسواس عملی اجباری (OCD)، اضطراب پس از سانحه (PTSD) و اختلال اشتهایی تجویز میشوند.
- SNRIs: این ترکیبات با مهار ناقلهای غشایی سروتونین و نوراپینفرین غلظت این مولکولها در سیناپس را افزایش میدهند. دولوکسیتین و ونلافاکسین در این گروه قرار دارند. این داروها برای درمان افسردگی عمیق، اختلال درد مزمن و سندروم پیشقاعدگی (PMS) تجویز میشوند.
- TCAs: این ترکیبات اثر متفاوتی بر ناقلهای غشایی سروتونین و اپینفرین دارند. این داروها برای درمان اختلال درد مزمن، افسردگی مقاوم به درمان و وسواس عملی اجباری تجویز میشوند. ایمپرامین یکی از داروهای این گروه است.
- آنتاگونیست 5-HT2: این ترکیبات گیرنده 5-HT2a را مهار میکنند و در درمان افسردگی عمیق تجویز میشوند. نفازودون و ترزودون در این گروه قرار دارند.
- MAOIs: مونوآمیناکسیداز آنزیم تجزیه سروتونین، دوپامین و نوراپینفرین است. مهار این آنزیم غلظت این مولکولها در سیناپس و تحریک نورون را افزایش میدهند. فنزلزین، ترانیلسیپرومین و سلژیلین شبهآگونیستهایی هستند که در این گروه قرار دارند.
- NDRI: این ترکیبات ناقل غشایی دوپامین و نوراپینفرین در نورونهای مغزی را مهار و غلظت سیناپسی این مولکولها را افزایش میدهند. آمینپتین، بوپروپیون، دیفنیل پرونیلول و ریتالین شبهآگونیستهای این گروه هستند.
مخدرها
مخدرها ترکیباتی هستند که با اثر بر سیستم عصبی مرکزی احساس درد را از بین میبرند. اندروفینها، انکفالینها و دینورفینها سه دسته مخدرهای پپتیدی طبیعی بدن هستند که به گیرندههای مو ($$\mu$$)، دلتا ($$\delta$$) و کاپا ($$\kappa$$) در سیستم عصبی مرکزی متصل میشوند. این گیرندهها از انواع پروتئینهای عرض غشایی همراه پروتئین Gi هستند که با مهار کانالهای ولتاژی کلسیم، اگزوسیتوز انتقالدهنده عصبی (گلوتامات، استیل کولین، نوراپینفرین و ماده P) از نورون پیشسیناپسی و با فعال کردن کانالهای پتاسیم (هایپرپلاریزه شدن سلول) ایجاد پتانسیل عمل در نورون پسسیناپسی را مهار میکنند.
- گیرندههای $$\mu$$: اتصال لیگاند به این گیرندهها با کاهش درد نخاعی و بالای نخاعی، کاهش تنفس، کاهش سرعت حرکات گوارشی، تغییر ترشح هورمونها و انتقالدهندههای عصبی همراه است. تمایل این گیرندهها به اندروفین بیشتر از انکفالین و به انکفالین بیشتر از دینورفین است.
- گیرندههای $$\delta$$: اتصال لیگاند به این گیرندهها با کاهش درد نخاعی و بالای نخاعی و تغییر ترشح هورمون و انتقالدهنده عصبی همراه است. تمایل این گیرنده به انکفالین بیشتر از اندروفین و دینورفین است.
- گیرندههای $$\kappa$$: اتصال لیگاند به این گیرندهها با کاهش درد نخاعی و بالای نخاعی، کاهش علائم روانپریشی و کاهش سرعت حرکات لوله گوارش همراه است.
آگونیستهای کامل و نسبی مخدرهای بدن، آنتاگونیستهای مخدرهای طبیعی بدن و داروهای ضدسرفه مخدرهایی هستند که برای کاهش درد تجویز میشوند.
- آگونیستهای کامل: مورفین، متادون و فنتالین آگونیستها کامل گیرنده $$\mu$$ هستند. که برای درمان درد شدید (مورفین و فنتالین)، ادم ریه (مورفین) و بازپروری سومصرف مخدر (متادون) تجویز میشوند.
- آگونیستهای نسبی: کودئین و هیدروکودئین آگونیستهای نسبی گیرنده $$\mu$$ و ضعیفتر از آگونیستهای کامل هستند. این ترکیبات برای درمان درد خفیف و سرفه تجویز میشود.
- ترکیب آگونیست-آنتاگونیست: این ترکیبات اثر متفاوتی بر گیرندههای درد دارند. برای مثال بوپرنورفین آگونیست نسبی گیرنده $$\mu$$ و آنتاگونیست گیرنده $$\kappa$$ است. این ترکیبات برای درمان دردهای خفیف و تثبیت بازپروری سو مصرف مخدر تجویز میشود.
- داروهای ضدسرفه: این ترکیبات آگونیستهای کامل و نسبی گیرنده $$\mu$$ هستند و برای درمان سرفه شدید تجویز میشود. دکسترومتورفان در این گروه قرار دارد.
- آنتاگونیستها: نالوکسون یکی از آنتاگونیستهای سه گیرنده درد است که اتصال مخدرهای طبیعی به این گیرندهها را مهار میکند و برای درمان اوردوز مخدر تجویز میشود.
- ترکیبات متفاوت: تاپندادول و ترامادول دو مخدر متفاوت برای درمان دردهای خفیف هستند. تاپندادول آگونیست نسبی گیرنده $$\mu$$ و مهارکننده قوی NET است. ترامادول آگونیست ضعیف گیرنده $$\mu$$، مهارکننده SERT (ناقل سروتونین)و NET (گیرنده نوراپینفرین) است.
داروشناسی ترکیبات موثر بر سیستم اندوکرین
سیتم اندوکرین از مجموعه غدد، هورمونها و گیرندههای سلولی تشکیل شده است که همراه دستگاه عصبی فعالیت اندامهای بدن را کنترل میکند. بسیاری از فرایندهای کاتابولیسمی (تجزیه) و آنابولیسمی (سنتز) بهوسیله این سیستم کنترل میشود. به همین دلیل افزایش یا کاهش ترشح هورمونها یا بیان رسپتورهای سلولی با اختلال در فعالیت بسیاری از اندامها همراه است. داروهای موثر بر این دستگاه مولکولهای پپتیدی یا استروئیدی هستند که ساختار و مکانیسم عمل مشابهی با هورمونهای طبیعی دارند.
داروهای دستگاه تولید مثل
داروهای موثر بر دستگاه تولیدمثل، ساختاری مشابه هورمونهای استروئیدی طبیعی دارند که برای تنظیم عملکرد این سیستم تجویز میشوند. استرادیاُل، پرمارین، اتینیل استرادیاُل، مسترانول و دیاتیلستیلبسترول داروهای استروئیدی شبیه استروژن هستند که از روشهای مختلف تجویز میشوند.
- استرادیاُل: این داروها بهوسیله تزریق عضلانی و پچ تراپوستی وارد بدن میشوند.
- پرمارین: پرمارین استروئید خوراکی است که از کانجوگه شدن استروژن با اکولین (equilin) سنتز میشود.
- اتینیل استرادیاُل و مسترانول: این دو استروئید خوراکی هستند.
- دیاتیلستیلبسترول: این استروژن غیراستروئیدی با روش خوراکی و صفاقی تجویز میشود.
فارماکولوژی داروهای دستگاه گوارش
معده و روده دو بخش اصلی لوله گوارش برای هضم و جذب غذا هستند. به همین دلیل تغییر ترشح اسید، آنزیمها و حرکات دیواره آنها جذب مواد و سطح انرژی بدن برای انجام فعالیتها را تغییر میدهد. آنتیاسیدها، مهارکنندههای پمپ پروتون، مسدودکنندههای هیستامین ۲ و تغییردهندههای حرکات گوارشی داروهای موثر بر این این دستگاه هستند. در ادامه این بخش داروشناسی این ترکیبات و مکانیسم عمل آنها را بررسی میکنیم.
مهارکنندههای پمپ پروتون
پمپ پروتون، ساختار پروتئینی عرض غشایی است که با هیدرولیز هر ATP یک یون هیدروژن را از سلولهای دیواره معده به لومن و یک یون پتاسیم را از لومن به سلولها منتقل میکند. پروتون در لومن با یونهای کلر ترکیب و اسید معده (HCl) را میسازد. رفلاکس معده به مری (GRED) بیماری است که بر اثر ضعف انقباضی اسفنکتر انتهایی مری، افزایش فشار معده (افزایش وزن، غذای سنگین یا لباس تنگ) ایجاد میشود.
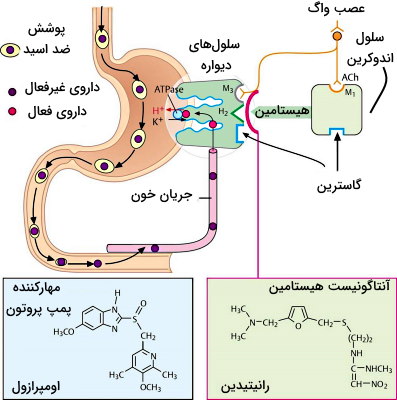
اومپرازل، ایزومپرازول، لانزوپرازول، پانتوپرازول و رابپرازول، ترکیباتی هستند که با مهار پمپ پروتون دیواره معده ترشح اسید کلریدریک را کاهش میدهند. این داروها برای درمان زخمهای پپتیک و GRED تجویز میشود.
آنتیاسیدها
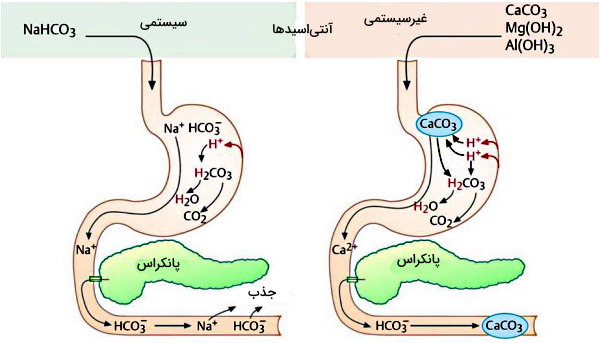
این داروها اسید معده را خنثی و فعالیت آنزیم پپسین را مستقیم یا با افزایش pH مهار میکنند. در نتیجه آسیب مخاط دیواره معده کاهش مییابد. این داروها برای درمان زخمهای پپتیک، سوهاضمه حاصل از اسید و ترشح اسید اضافه (هایپرکلوروهیدریا) این ترکیبات به دو دسته سیستمی و غیرسیستمی تقسیم میشوند.
- آنتیاسیدهای غیرسیستمی: این ترکیبات وارد جریان خون نمیشوند و گروههای آنیونی در ساختار آنها پروتون اسید معده را خنثی میکند. بخش کاتیونی این داروها با بیکربنات پانکراس ترکیب شده و همراه مدفوع دفع میشود. در نتیجه مصرف این داروها منجر به آلکالوز متابولیکی نمیشود. کلسیم کربنات، منیزیوم هیدروکسید و آلومینیوم هیدروکسید، آنتیاسیدهای معدنی و غیرسیستمی هستند.
- آنتیاسیدهای سیستمی: این ترکیبات جذب خون شده و به معده منتقل میشوند. بخش کاتیونی آنتیاسیدهای سیستمی با بیکربنات یون محلول تشکیل نمیدهند. سدیم بیکربنات آنتیاسید معدنی و سیستمی است.
آنتاگونیست هیستامین ۲
ترکیبات آنتاگونیست هیستامین ۲ یا مسدودکنندههای گیرنده هیستامین با اتصال به گیرندههای H2 در غشای سلولهای دیواره معده از تحریک این گیرندهها و ترشح اسید بیشتر جلوگیری میکنند. سرعت اثرگذاری این داروها از مهارکنندههای پمپ پروتون بیشتر است. سیمتیدین، رانیتیدین، فاموتیدین و نیزاتیدین، آنتاگونیستهای هیستامین هستند که برای درمان زخم پپتیک و GRED تجویز میشوند.
تغییردهنده حرکات گوارشی
ملینها و مسهلها دو دسته داروهایی هستند که حرکات دودی روده و دفع مدفوع را افزایش میدهند. حرکات دودی، انقباض غیرارادی ماهیچههای صاف لوله گوارش هستند که به دلیل انقباض ماهیچههای صاف دیواره این اندامها ایجاد میشود. این داروها با دو مکانیسم حرکات دودی را افزایش میدهند.
- تحریک غشای مخاطی: ملینها با تحریک غشای مخاطی تعادل ترشح و جذب مایعات در روده را به هم میریزد. افزایش مایع در لومن روده با افزایش حرکات دودی همراه است.
- تغییر اسمولاریته: مسهلها ترکیبات الکترولیتی هستند که با تغییر فشار اسمزی لومن روده از بازجذب آب در این بخش از لوله گوارش جلوگیری میکنند. افزایش آب در روده حرکات دودی و دفع را افزایش میدهد.
داروهای ضداسهال سومین دسته داروهای موثر بر حرکات گوارشی هستند. توکسین بعضی باکتریها جذب سدیمکلرید و آب در روده را مهار میکنند. در نتیجه با افزایش فشار اسمزی لومن ورده، آب از انتروسیتها وارد لومن میشود. افزایش مایع در روده با افزایش حرکات دودی و اسهال همراه است. داروهای ضداسهال با اتصال به توکسینها دفع آنها را افزایش و حرکات دودی را کاهش میدهند.
ضد تهوع
تهوع یکی از مکانیسمهای طبیعی بدن برای خارج کردن ترکیبات سمی از لوله گوارش است که به دلیل حرکات اضافه معده، بارداری و بعضی بیماری نیز تحریک میشود. مرکز کنترل تهوع در مدولای مغز میانی است که پیام تهوع را از گیرندههای شیمیایی مرکزی، مجرای دهلیزی گوش میانی، قشر مخ و لوله گوارش دریافت میکند. بر اساس محل گیرنده شیمایی تحریک شده و دلیل تحریک داروهای مختلفی برای درمان این انعکاس تجویز میشود.
- آنتیهیستامینها و آنتیکولینرژیکها داروهایی هستند که در بیماریهای تعادلی گوش میانی تجویز میشوند. آنتیهیستامینها ارسال پیام از گیرندههای شیمیایی گوش میانی و لوله گوارش و آنتیکولینرژیکها گیرندههای شیمیایی مرکزی، مجرای دهلیزی و لوله گوارش را مهار میکنند. دیفنهیدرامین یکی از آنتیهیستامینها و اسکوپولامین یکی از آنتیکولینرژیکهای تجویز شده است.
- آنتاگونیستهای دوپامین D2 برای درمان تهوع ناشی از داروها، توکسین باکتری و متابولیتها تجویز میشود. این داروها ارسال پیام از گیرندههای شیمیایی مرکزی و لوله گوارش به مدولا را مهار میکنند. پروکلرپرازین از داروهای این گروه است.
- آنتاگونیست سروتونین (5ht3) برای درمان تهوع ناشی از شیمیدرمانی، پرتودرمانی، بارداری و پس از جراحی تجویز میشود. این داروها گیرندههای شیمیایی مرکزی و لوله گوارش را مهار میکنند. اوندانستون از داروهای این خانواده است.
- آنتاگونیست NK1 یکی از داروهای درمان تهوع ناشی از شیمیدرمانی است که گیرندههای لوله گوارش را مهار میکند. آپرپیتانت از اعضای این خانواده داروهای ضدتهوع است.
- آگونیست کانابینوئید یکی دیگر از داروهای درمان تهوع شیمیدرمانی است که برای بیماران مقاوم به داروهای قبلی تجویز میشود. این دارو مستقیم مرکز کنترل تهوع را مهار میکند. درونابینول از داروهای این خانواده است.
فارماکولوژی داروهای دستگاه تنفسی
دستگاه تنفسی از حفرههای بینی، حلق، حنجره، نای، نایژهها، نایژکها، کیسههای هوایی و ریه تشکیل شده است. تغییر در ساختار بافتی، ویژگیهای مکانیکی (الاستیسیته) و ویژگیهای فیزیکی (حجم و فشار) در بخشهای مختلف این دستگاه منجر به تغییر فشار جزئی اکسیژن و دیاکسید کربن در خون شده و متابولیسم بافتها را تغییر میدهد.
داروهای درمان آسم، داروهای درمان آلرژی، داروهای درمان انسداد مزمن مجاری تنفسی (COPD) و داروهای درمان سرفه، ترکیباتی هستند که پس از برهمکنش با رسپتورهای این سیستم به درمان بیماری کمک میکنند. آنتیهیستامینها، آگونیستهای گیرنده آدرنرژیک $$\beta_2 ، $$ کوتیکواستروئیدها، آنتاگونیستهای لوکوترین، ضدالتهابهای غیراستروئیدی و آنتاگونیستهای گیرنده کولینرژیک، داروهای تجویزی برای درمان بیماریهای تنفسی هستند.
داروشناسی شیمی درمانی سرطان
سرطان بیماری است که به دلیل تقشیم کنترل نشده سلولها ایجاد میشود. این بیماری به دلیل جهشهای ژنتیک در اونکوژنها و ژنهای مهارکننده تومور ایجاد میشود. شیمیدرمانی یکی از روشهای درمان این بیمای است که با تجویز داروهای اصلی، نئواجوانت و ادجوانتها انجام میشود. در ادامه داروشناسی دراوهای درمان سرطان را بررسی میکنیم.
- داروهای اصلی: این داروها در درمان سرطانهای پیشرفتهای که جایگزین ندارند و برای کاهش علائم بیماری، افزایش کیفیت زندگی و مهار رشد تومور تجویز میشود.
- نئوادجوانت: این داروها برای درمان تومورهای متمرکزی تجویز میشوند که اثر درمانهای جایگزین مثل جراحی در آنها کمتر از شیمیدرمانی است.
- ادجوانت: این داروها به عنوان درمان کمی در کنار جراحی یا پرتودرمانی تجویز میشوند و بازگشت متمرکزی یا سیستمی تومور را مهار میکنند.
ترکیبات اضافهکننده آلکیل، آنتیمتابولیتها، ترکیبات گیاهی ضد سرطان، آنتیبیوتیکهای ضدتومور، ترکیبات مهارکننده گیرنده فاکتورهای رشد و آسپارژیناز داروهایی هستند که در شیمیدرمانی استفاده میشود.
- ترکیبات اضافهکننده آلکیل: در ساختار این ترکیبات یکی از گروههای بیس کلرواتیل آمین، اتیلن ایمین یا نیتروزورا (نیتروز و اوره) وجود دارد. این ترکیبات با اضافه کردن گروه آلکیل به مولکولهای سلول، فعالیتهای بیوشیمی را مهار و مرگ سلول را تحریک میکنند. اضافه شدن آلکیل به DNA دلیل اصلی القای مرگ سلولی است. مکلرواتامین (درمان لنفوم هاکجین و غیر هاکجین)، کلرامبوسیل (درمان لنفوم هاجکین) و سیکلوفوسفامید در این گروه قرار دارند.
- آنتیمتابولیتها: این داروها با مهار متابولیتهای مسیر سنتز DNA، مرگ سلولهای سرطانی را فعال میکنند. آنتیفولاتها، فلوروپیریمیدینها، آنالوگهای دئوکسی سیتیدین و آنتاگونیستهای پورین آنتیمتابولیتهای تجویزی در شیمیدرمانی سرطان هستند.
- ترکیبات گیاهی ضد سرطان: آلکالوئیدهای وینکا، تاکسانها، اپیپودوفیلوتاکسین، کامپتوتکینها ترکیبات گیاهی کاملا طبیعی یا نیمهسنتزی هستند که در درمان سرطان استفاده میشوند. این ترکیبات با مهار آنزیمهای همانندسازی، توبولهای دوک تقسیم و شکست DNA مسیر مرگ سلولهای سرطانی را فعال میکنند. پاکلیتاکسل (درمان سرطان، پروستات، سر و گردن، مثانه و سلولهای غیرکوچک ریه| NSCLC) در این گروه قرار دارد.
- آنتیبیوتیکهای ضدتومور: آنتراساکلینها (دوکسوروبیسین، دانوروبیسین، ایداروبسین، اپیروبسین و میتوگزانترون)، میتومایسین و بلئومایسین بین بازهای DNA و RNA قرار میگیرند و همانندسازی، رونویسی و بیان ژنها در سلول سرطانی را مهار میکنند. این ترکیبات از باکتریهای استرپتومایسز خاک استخراج میشود.
- ترکیبات مهارکننده گیرنده فاکتور رشد: بیان ژن گیرندههای فاکتور رشد و تعداد این گیرندهها در سلولهای توموری افزایش مییابد. مهارکنندههای این گیرندهها با مهار دومین آنزیم تیروزین کیناز (ارلوتینیب و جفیتینیب) و دومین خارج سلولی (جیتوکسیمب و پانتینومومب) اتصال فاکتور رشد و القای میتوز را مهار میکند.
- آسپارژیناز: سلولهای توموری در لوکمیای لنفوسیتی حاد (ALL) آنزیم سنتز L-آسپارژین وجود ندارد و این سلولها برای پروتئینسازی وابسته به آسپارزینهای دریافتی از خون هستند. آنزیم آسپارژیناز با هیدرولیز آسپارژین به آسپارتیکاسید و آمونیاک، غلظت این آمینواسید را کاهش و پروتئینسازی تومورهار ا مهار میکند.
داروشناسی آنتی بیوتیک ها
آنتیبیوتیکها ترکیبات شیمیایی هستند که اثر بر دیواره سلولی، غشای پلاسمایی، ژنوم یا آنزیمهای پاتوژنهای باکتریایی، ویروسی، قارچی و انگلی از گسترش بیماری در بدن جلوگیری میکنند. بتالاکتامها، آمینوگلیکوزیدها، تتراسایکلینها، ماکرولیدها و فلوروکوئينولونها آنتیبیوتیکهایی هستند که در درمان عفونت تجویز میشوند. در ادامه داروشناسی این ترکیبات را توضیح میدهیم.
داروشناسی بتالاکتام ها
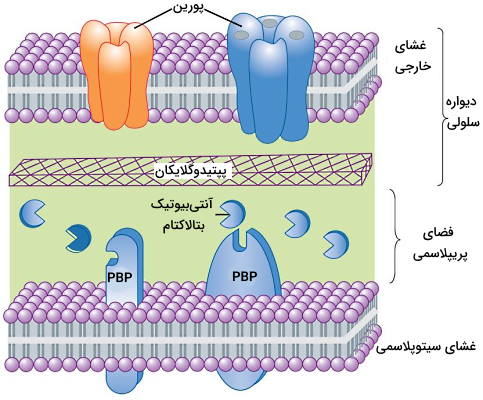
بتالاکتامها (β-lactam) ترکیبات شیمیایی هستند که آخرین مرحله در سنتز لایه پپتیدوگلایکان دیواره سلولی را مهار میکنند. این ترکیبات مشتقات پنیسیلین، سفالوسپورین، سفامایسن، مونوباکتام، کارباپنم و کارباسفم هستند که در ساختار شیمیایی همه آنها یک حلقه بتا-لاکتام وجود دارد.
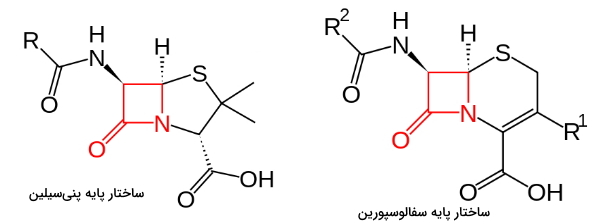
دیواره سلولی باکتریها لایهای از زیرواحدهای پپتیدی (توالی پنجآمینواسیدی) و پلیساکاریدی (زیرواحدهای N-استیلگلوکزآمین و N-استیلمورامیکاسید) است که استحکام سلول را افزایش میدهد. D-آلانیل-D-آلانین دو اسیدآمینه انتهایی توالی پپتیدی هستند. D-آلانین انتهای این توالی بهوسیله پروتئین اتصالی به پنیسیلین (PBP) هیدرولیز میشود. در نتیجه بین دو توالی پپتیدی نزدیک اتصال عرضی برقرار میشود. این اتصال نقش مهمی در استحکام دیواره سلولی دارد.
آنتیبیوتیکهای بتالاکتام، آنالوگهای سنتزی توالی D-آلانیل-D-آلانین هستند که با اتصال به PBP از تشکیل اتصال عرضی بین توالیهای پپتیدی جلوگیری میکنند. در نتیجه دیواره سلولی کامل تشکیل نشده و سلول میمیرد. این آنتیبیوتیکها از انواع باکتریوسیدال هستند و برای از بین بردن باکتریها در فاز رشد تجویز میشوند.
داروشناسی آمینوگلیکوزیدها
آنتیبیوتیکهای آمینوگلیکوزید ترکیباتی هستند که سنتز پروتئین در باکتریهای گرم منفی هوازی و بعضی باسیلهای بیهوازی را مهار میکنند. اما اثری بر باکتریهای گرم مثبت و باکتریهای گرم منفی بیهوازی ندارند. در ساختار تمام آمینوگلیکوزیدها یک قند با گروههای آمینی وجود دارد.
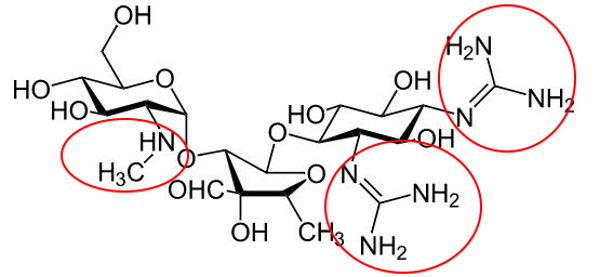
این ترکیبات پس از عبور از لیپوپلیساکاریدهای دیواره سلولی باکتری به زیرواحد ۳۰ s ریبوزم متصل شده و از شروع رونویسی یا طویل شدن زنجیره پلیپپتیدی جلوگیری میکند. این ترکیبات باکتریوسیدال در مرحله رشد باکتریها تجویز میشوند.
داروشناسی تتراسایکین ها
تتراسایکلینها گروهی از آنتیبیوتیکهای مهار سنتز پروتئین هستند که چهار (تترا-) حلقه (سایکلین) در ساختار تمام آنها وجود دارد. این ترکیبات از باکتریهای استرپتومایسیز (Streptomyces bacteria) استخراج شده یا با روشهای شیمیایی سنتز میشود. گروههای عاملی اضافه شده به این ساختار ویژگیهای داروشناسی ترکیب (نیمهعمر و تمایل اتصال به پروتئینهای خون) را تغییر میدهد.
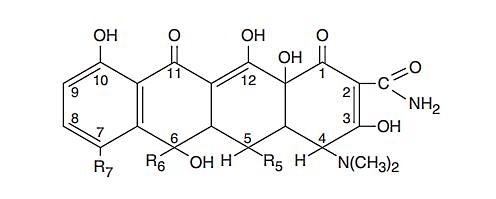
این ترکیبات باکتریواستاتیک (متوقفکننده رشد) با اتصال به زیروحد ۳۰s ریبوزوم ترجمه mRNA را مهار میکنند و برای از بین بردن باکتریهای گرم منفی و مثبت، کلامیدیوتا، مایکوپلاسماتوتا، ریکتسیا و انگلهای آغازی تجویز میشود.
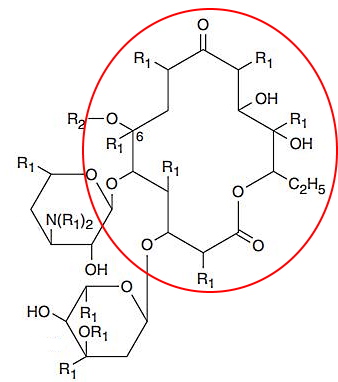
داروشناسی ماکرولیدها
ماکرولیدها ترکیباتی آلی هستند که ویژگی مشترک همه آنها وجود حلقه لاکتونی بزرگ (بین ۱۴ تا ۱۶ اتم) و متصل به قندهای دئوکسی در ساختار است. ماکرولیدها گروه دیگری از آنتیبیوتیکهای مهار سنتز پروتئین هستند که به زیرواحد ۵۰s ریبوزوم متصل میشوند. این آنتیبیوتیکها برای از بین بردن باکتریهای گرم منفی و مثبت تجویز میشود.
داروشناسی کوئینولون ها
فلوروکوئینولونها ترکیبات باکتریوسیدالی هستند که همه آنها از یک ساختار پایه دوحلقهای تشکیل شده است. این باکتریها برای درمان عفونتهای باکتریایی (گرم مثبت و منفی) تجویز میشوند. این آنتیبیوتیکها از پورینهای غشا وارد سیتوپلاسم باکتری شده و با مهار فعالیت لیگازی توپوایزمراز نوع II، DNA جیراز و توپوایزومراز IV همانندسازی DNA باکتریایی را مهار میکنند.
کتاب داروشناسی
فارماکولوژی یا داروشناسی یکی از دروس بین رشتهای است که در رشتههای پزشکی، پرستاری، داروسازی و رشتههای پیراپزشکی تدریس میشود. انواع داروها، مکانیسم اثر آنها در دستگاههای مختلف و واکنش بدن به این ترکیبات خارجی در داروشناسی یررسی میشود. به همین دلیل انتخاب کتاب جامعی که این مباحث پیچیده را با ادبیاتی روان بیان کرده باشد از دغدغههای دانشجویان و علاقهمندان به این رشته است. در این بخش ۷ عنوان کتابی را معرفی میکنیم که در یادگیری بخشهای مختلف داروشناسی کمک فراوانی به شما میکند.
کتاب فارماکولوژی کاتزونگ
کتاب فارماکولوژی پایه و بالینی کاتزونگ یکی از کاملترین کتابهای داروشناسی است. این کتاب داروشناسی در ۱۰ بخش اصلی ۶۶ فصل توسط دکتر بترام جی. کاتزونگ استاد دانشگاه کالیفرنیا و همکارانش نوشته شده است.

بخش اول کتاب مفاهیم اولیه فارماکولولوژی، فارماکودینامیک، فارماکوکینتیک و چگونگی تولید داروی جدید را توضیح میدهد. فصلهای بعدی با بررسی داروهای سیستم عصبی خودمختار، سیستم قلبی-عروقی و کلیهها، داروهای موثر بر ماهیچههای صاف، داروهای سیستم عصبی مرکزی، داروهای درمان بیماریهای خونی، التهاب و نقرس، داروهای اندوکرین، دروهای شیمیدرمانی (آنتیبیوتیکها، درمان سرطان و ایمونوفارماکولوژی)، تاکسیکولوژی داروها و موارد استثنا ادامه پیدا میکند.
کتاب فاماکولوژی مصور لیپینکات
کتاب داروشناسی مصور لیپینکات یکی از مجموعه کتابهای مصور لیپینکات (داروشناسی، فیزیولوژی، بیوشیمی، زیست شناسی سلولی و مولکولی، میکروبیولوژی و نوروساینس) است. تصاویر فراوان این کتاب آموزش مفاهیم پیچیده داروشناسی را تسهیل میکند.

این کتاب داروشناسی با توضیح فارماکوکینتیک داروها و فارماکودینامیک داروها شروع میشود. در فصلهای بعدی آگونیستها و آنتاگونیستهای دستگاه عصبی خودمختار، دراوهای موثر بر بیماریهای تحلیل اعصاب، داروهای سیستم عصبی مرکزی، مخدرها، ضدافسردگیها، مسکنها، داروهای ضدتشنج، داروهای سیستم قلبی-عروقی، داروهای ادرارآور، داروهای سیستم اندوکرین، داروهای موثر بر سیستم تنفسی و دستگاه گوارش، آنتیبیوتیکها، داروهای درمان سرطان و در فصل آخر سمشناسی داروها را توضیح میدهد.
فارماکولوژی رنگ و دیل
کتاب داروشناسی رنگ و دیل (Rang and Deal's Pharmacology) در ۶ بخش و ۶۰ فصل اطلاعات جامعی از مفاهیم پایه و بالینی داروشناسی در اختیار دانشجویان پزشکی، داروسازی، پرستاری و دیگر رشتههای مرتبط قرار میدهد. مفاهیم پایه، ترکیبات شیمیایی، داروهای اندامهای حیاتی، دستگاه عصبی، داروهای درمان عفونت و سرطان، و عناوین ویژه، اثر داروها بر بدن، سینتیک اثر دارو، تاکسیکولوژی، اثر دارو بر اندامها و روشها کشف داروهای جدید را توضیح میدهد.

مرجع دارویی کامل مارتیندل
مرجع دارویی کامل مارتیندل مجموعه چهارجلدی و رنگی از کلیه اطلاعات لازم در مورد داروهای گیاهی، تشخیصی و درمانی، رادیوداروها، توکسینها و سموم در سراسر جهان است. در این کتاب بیش از ۶۴۰۰ مونوگراف برای توضیح روشهای نامگذاری، ویژگیهای شیمیایی و مکانیسم عمل داروهای مختلف استفاده شده است.

داروشناسی بالینی کاربردی برای پرستاران
کتاب داروشناسی بالینی کاربردی برای پرستاران توسط گروه نویسندگان به سرپرستی دکتر عباس عبادی در۱۴ فصل تدوین شده است. این کتاب کاربرد داروهای بالینی را از دیدگاه پرستاری بررسی میکند. کتاب با توضیح مفاهیم پایه دراوشناسی شروع میشود. فصل دوم کتاب انواع محلولهای تزریقی و اصول مراقبت از خون در مراحل انتقال را توضیح میدهد.

نویسندگان در فصلهای سوم تا سیزدهم داروهای رایج ضد درد، شلکننده عضلات و بیحسکنندههای موضعی، بیماریهای تنفسی و آسم، بیماریهای قلبی-عروقی، بیماریهای گوارشی، بیماریهای مغز و اعصاب، دیابت و تیروئید، بیماریهای اعصاب و روان، آنتیبیوتیکها و ترکیبات آنتیمایکروبیال، بیماریهای پوست و سوختگی، بیماریهای چشم و شیمیدرمانی را توضیح میدهند. فصل آخر کتاب ترکیبات ضدسم (آنتیدوت)، تداخلات و ناسازگاریهای مهم دارویی شرح داده شده است.
داروشناسی کاربردی دکتر منصور رحمانی
کتاب داروشناسی کاربردی دکتر منصور رحمانی در یازده فصل اطلاعات ضروری داروشناسی را برای دانشجویان رشتههای پزشکی، داروسازی، پیراپزشکی و علاقهمندان به داروشناسی توضیح میدهد. این کتاب مثل سایر منابع داروشناسی با توضیح مفاهیم اولیه در مورد برهمکنش دارو با بدن و اثر این دو سیستم بر هم شروع میشود.
دکتر رحمانی در فصلهای دوم تا هشتم داروهای سیستم عصبی، داروهای ضددرد، تب و التهاب، داروهای موثر بر سیستم قلبی-عروقی، انواع آنتیبیوتیکها، داروهای موثر بر دستگاههای تنفس، گوارش و غدد درونریز را توضیح میدهد. کتاب با سه فصل مباحث تکمیلی داروشناسی (آنتیهیستامینها، ضدانعقادها، داروهای کمخونی، داروهای چشمی، مکملهای ویتامین و محلولهای حجیم تزریقی)، اطلاعات تکمیلی (دارو درمانی در دوران بارداری و شیردهی و تداخل داروها) و مشخصات داروهای رایج به پایان میرسد.
مرجع کامل داروهای ژنریک ایران
کتاب مرجع کامل داروهای ژنریک ایران توسط دکتر علی اسداللهی و همکارانش در سه فصل و ۱۹ ضمیمه تدوین شده و یکی از منابع کاربردی داروشناسی به زبان فارسی است. فصل اول کتاب داروهای موضوعی را بر اساس بیماریها توضیح میدهد. فصل دوم با اسامی داروهای ژنریک شروع شده و در ۸ ضمیمه محاسبه دوزها، داروهای کنترل شده ایالت متحده، طبقهبندی مصرف در بارداری بر اساس FAD، مراقب از زخمها، داروهای مورد سومصرف، دوزهای معادل مسکنها، داروهای شایع طبیعی، طول عمر، جنبههای فرهنگی و فارماکوژنومیک داروهای گیاهی را توضیح میدهد.
فصل بعدی کتاب با ۶ ضمیمه و توضیح مقادیر آزمایشگاهی نرمال، آنزیمهای سیتوکروم ۴۵۰، جدول پادزهر سموم، پیشگیری از خطاهای دارویی و بهبود ایمنی دارویی، تجویز تزریقی مایعات و معیارهای ترمینولوژی برای حوادث نامطلوب (CTCAE) ادامه مییابد. نویسنده کتاب را با توضیح عبارات مخفف معمول و خطرناک، پیوستهای کاربردی و اسامی ژنریک فارسی و انگلیسی کتاب را تمام میکند. این کتاب مرجعی کاربردی برای پزشکان و پرستاران است.
سوالات متداول
در این بخش به تعدادی از سوالات متداول پیرامون داروشناسی پاسخ میدهیم.
داروی پیوسته رهش چیست ؟
داروهای پیوسته یا آهسته رهش با روشهایی ساخته میشوند که پس از ورود به بدن در بازه زمانی مشخص مقدار مشخصی از دارو در بدن به شکل فعال تبدیل میشود. برای مثال بیمار به دریافت ۱۵۰ میلیگرم دارو در روز با فاصله زمانی ۵ ساعت نیاز دارد. در روشهای سنتی ممکن است مصرف پنج دوز ۳۰ میلیگرمی در روز برای بیمار تجویز شد. اما روش دارو پیوسته رهش، بیمار یک بار در روز دوز تجویزی را دریافت میکند و غلظت مشخصی از دارو هر ۵ ساعت یکبار در بدن به شکل فعال تبدیل میشود.
دوز دارو چیست ؟
دوز دارو مقدار دارویی است که بیمار در هر بار مصرف دریافت میکند و بر اساس نوع دارو با واحد وزن (میلیگرم)، حجم (میلیلیتر)، شکل دریافتی دارو (۱ کپسول، شیاف یا قرض) و پاف (داروهای استنشاقی) بیان میشود.