پروتئین چیست؟ | ساختار، اجزای سازنده، عملکرد و انواع پروتئین ها
پروتئین ها مولکولهای زیستی بزرگی هستند که از یک یا چند زنجیره آمینواسید تشکیل شدهاند و عملکردهای اساسی را در بدن بر عهده دارند. در این مطلب، ساختمان این ماکرومولکولها، انواع، عملکرد و نحوه تولید آنها توضیح داده شدهاند.
پروتئین چیست؟
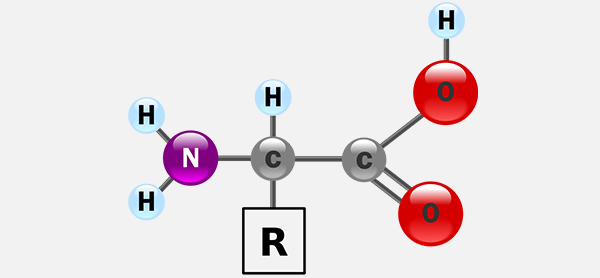
پروتئینها ماکرومولکولهای زیستی هستند که عملکردهای اساسی مانند نقش هورمونی، آنزیمی و ساختاری را در بدن بر عهده دارند. اکثر پروتئین ها از پلیمرهای خطی ساخته شده از مجموعهای تا 20 اسید آمینه مختلف ساخته شدهاند. همه اسیدهای آمینه دخیل در ساختمان پروتئینها، دارای ویژگیهای ساختاری مشترکی از جمله یک کربن آلفا، یک گروه آمین، یک گروه کربوکسیل و یک زنجیره جانبی با ساختار متغیر هستند.
اسیدآمینه پرولین به دلیل ساختار حلقهای غیرمعمول خود با دیگر اسیدهای آمینه متفاوت است. زنجیرههای جانبی آمینو اسیدهای استاندارد که در لیست اسیدهای آمینه استاندارد ذکر شدهاند، دارای تنوع زیادی در ساختارها و خواص شیمیایی هستند. این اثر ترکیبی تمام زنجیرههای جانبی آمینو اسید در یک پروتئین است که در نهایت ساختار سه بعدی و واکنش شیمیایی آن را تعیین میکند.
اسیدهای آمینه موجود در یک زنجیره پلیپپتیدی با پیوندهای پپتیدی مرتبط میشوند. به محض اتصال در زنجیره پروتئین، یک آمینواسید جداگانه باقیمانده نامیده میشود و مجموعه پیوند یافته اتمهای کربن، نیتروژن و اکسیژن به عنوان زنجیره اصلی یا ستون فقرات پروتئین شناخته میشوند.
کشف پروتئین ها
پروتئینها در قرن هجدهم توسط «آنتوان فورکروی» (Antoine Fourcroy) و گروهی دیگر از دانشمندان به عنوان گروهی از مولکولهای زیستی که توانایی متراکم شدن یا لخته شدن تحت تیمارهای حرارتی یا اسیدی را داشتند، از سایر بیومولکولها متمایز شدند. پروتئینهای که در آن زمان مورد توجه قرار گرفتند شامل آلبومین از سفیده تخم مرغ و سرم خون، فیبرین و گلوتن گندم بودند.
دشواری در استخراج و تخلیص پروتئینها در مقادیر بالا، مطالعه آنها را برای بیوشیمیستها بسیار دشوار کرده بود. از این رو، مطالعات اولیه بر روی پروتئین هایی متمرکز بود که در مقادیر بالا قابل تخلیص بودند مانند پروتئینهای خون، سفیده تخم مرغ، سموم مختلف و آنزیمهای گوارشی به دست آمده از دامها.
در دهه 1950، شرکت «Armor Hot Dog» با استخراج یک کیلوگرم ریبونوکلئاز A از لوزالمعده گاو و در دسترس قرار دادن آن، کمک کرد تا ریبونوکلئاز A برای دهههای بعدی به یک هدف اصلی برای مطالعه بیوشیمیایی تبدیل شود.
انسولین اولین پروتئینی بود که توالی آن توسط فردریک سنگر در سال 1949 مشخص شد. سنگر توالی اسید آمینه انسولین را به درستی تعیین کرد و اثبات کرد که پروتئینها از پلیمرهای خطی اسیدهای آمینه تشکیل شدهاند. سنگر برای این موفقیت در سال 1958 جایزه نوبل را از آن خود کرد و این روش به نام او شناخته شد.
هموگلوبین و میوگلوبین اولین ساختارهای پروتئینی بودند که در سال 1958 به ترتیب توسط ماكس پروز و سر جان كودری كندرو شناخته شدند. از سال 2017، بانک اطلاعات پروتئین بیش از ۱۲۶ هزار ساختار پروتئینی را با وضوح اتمی دارد. در سالهای اخیر، استفاده از میکروسکوپ الکترونی کرایو (cryo-EM) برای ماکرومولکولها و پیشبینی ساختار پروتئینها برای دامینهای کوچک پروتئینی، دو روش تعیین توالی پروتئینها با دقت اتمی هستند.
نقش پروتئین در بدن چیست؟
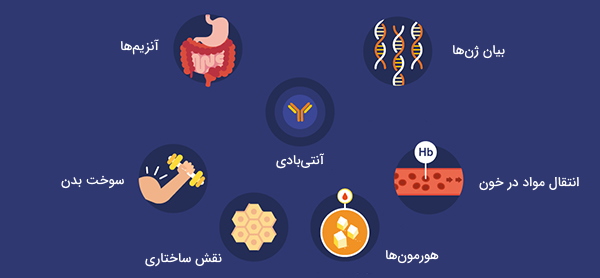
پروتئینها مجموعهای از عملکردهای حیاتی را در ارگانیسمها انجام میدهند و منجر به بروز فنوتیپ خاص آنها میشوند. از جمله فعالیتهای مهم پروتئینها میتوان موارد زیر را نام برد:
- واکنشهای متابولیکی کاتالیزوری
- همانندسازی DNA
- پاسخ به محرکها
- نقش ساختاری در غشای سلولی
- انتقال مولکولها از یک مکان به مکان دیگر
- تنظیم فعالیتهای سلولی
پروتئینها با مولکولهای فراوانی مانند پروتئینهای دیگر، لیپیدها، کربوهیدراتها و DNA میانکنش میدهند.
مقدار پروتئین ها در سلول
تخمین زده میشود که مقدار پروتئین در یک باکتری با اندازه متوسط، حدود دو میلیون عدد است. در باکتریهای کوچکتر مانند مایکوپلاسما و اسپیروشیتها، بین ۵۰ هزار تا یک میلیون مولکول پروتئینی وجود دارد. اما در سلولهای یوکاریوت به دلیل بزرگتر و پیچیدهتر بودن، مقدار پروتئینها نیز بیشتر است. به عنوان مثال، سلولهای مخمر حاوی حدود 50 میلیون پروتئین و سلول انسانی به میزان 1 تا 3 میلیارد پروتئین دارند.
تعداد نسخههای جداگانه پروتئین از چند مولکول در هر سلول تا 20 میلیون است. همه پروتئینهایی که کد ژنتیکی آنها در سلول وجود دارند، در یک سلول بیان نمیشوند بنابراین تعداد و نوع پروتئینهای هر سلول به نوع، عملکرد و محرکهای خارجی آن بستگی دارد.
از حدود ۲۰ هزار پروتئین رمزگذاری شده توسط ژنوم انسان، فقط 6000 پروتئین در سلولهای لنفوبلاستوئید شناسایی شدهاند. علاوه بر این، تعداد پروتئینهایی که ژنوم رمزگذاری میکند با پیچیدگی ارگانیسم ارتباط دارد. یوکاریوتها 15000، باکتریها 3200، آرکئیها 2400 و ویروسها 42 پروتئین دارند که به طور متوسط در ژنوم آنها رمزگذاری شدهاند.
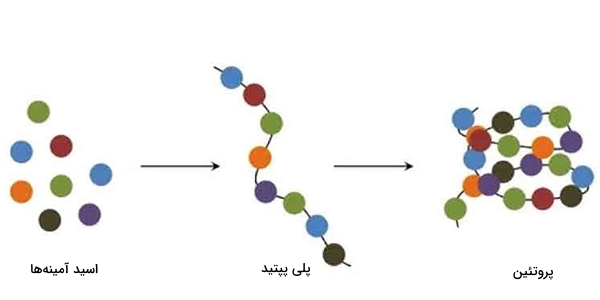
واحد سازنده پروتئین چیست؟
پروتئینها از به هم پیوستن واحدهای ساختاری یا مونومرهایی به نام اسیدآمینه تشکیل میشوند. اسیدهای آمینه، زنجیرهها جانبی متفاوتی دارند که باعث میشود پروتئین در نهایت و با توجه به اجزای سازنده، ترتیب و میانکنش بین آنها ساختار نهایی خود را پیدا میکنند. بزرگترین زنجیرههای جانبی، مربوط به اسید آمینههای غیر قطبی هستند.
زنجیره جانبی برخی از آنها دارای بار مثبت و برخی دارای بار منفی و تعدادی دیگر خنثی هستند. اسیدهای آمینهای که در ساختار پروتئینها به کار رفتهاند ۲۰ نوع دارند که اسید آمینه های استاندارد نامیده میشوند. اما برخی از انواع غیر استاندارد آنها هم در ساختار پروتئینها وجود ندارند اما در بعضی از قارچها و گیاهان و در مولکولهای دیگر مشاهده میشوند. برخی از اسید آمینه های غیر استاندارد حاصل تغییر اسیدآمینههای استاندارد، پس از ترجمه هستند.
پروتئین ها چگونه ساخته می شوند؟
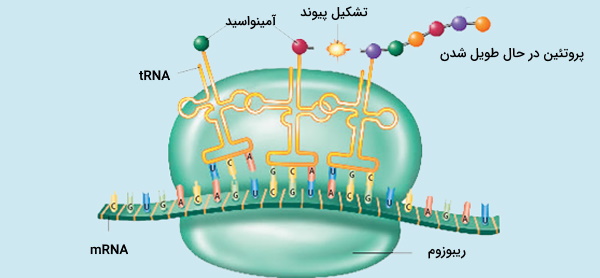
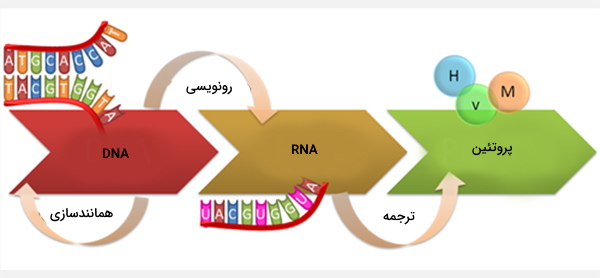
پروتئینها در بدن طی فرایندی به نام ترجمه تولید میشوند که در سیتوپلاسم رخ میدهد و شامل تبدیل رمزهای ژنتیکی شامل ۳ نوکلئوتید به نام کدون، به پروتئین است. کدهای ژنتیکی در DNA قرار دارند که ابتدا توسط پروتئینهایی مانند RNA پلیمراز به RNA پیامرسان (mRNA) رونویسی میشوند که پس از انجام پردازش، به mRNA بالغ تبدیل میشوند و سپس به عنوان الگویی برای سنتز پروتئین مورد استفاده قرار میگیرند.
ساختارهای سلولی به نام ریبوزوم، کدهای RNAها را به اسیدآمینه ترجمه میکنند و با اتصال این اسیدآمینهها به یکدیگر یک زنجیره پلیپپتیدی میسازند. هر ترکیب سه نوکلئوتیدی یک اسید آمینه را تعیین میکند، به عنوان مثال AUG (آدنین - یوراسیل - گوانین) کد اسید آمینه متیونین است. از آنجا که DNA از چهار نوکلئوتید ساخته میشود، تعداد کل کدونهای احتمالی 64 عدد است.
در پروکاریوتها ممکن است mRNA به محض تولید، بدون هیچ پردازشی مورد استفاده قرار بگیرد اما در یوکاریوتها mRNA درون هسته سلول ایجاد و سپس از طریق غشای هسته به داخل سیتوپلاسم منتقل میکنند. میزان سنتز پروتئین در پروکاریوتها بیشتر از یوکاریوتها است و میتواند تا 20 اسید آمینه در ثانیه برسد. بنابراین برخی از اسیدهای آمینه که توسط بیش از یک کدون دارند و برخی از کدونها به هیچ اسیدآمینهای ترجمه نمیشوند.
mRNA بر روی ریبوزوم قرار میگیرد و با تطبیق هر کدون با آنتیکدون، که روی یک RNA ریبوزومی قرار دارد، همزمان سه نوکلئوتید خوانده میشوند. آنزیم آمینواسیل tRNA سنتاز، مولکولهای tRNA را به اسیدهای آمینه صحیح متصل میکند، که در واقع حامل اسید آمینه هستند. پروتئینها همیشه از انتهای N (انتهای آمین) به انتهای C (انتهای کربوکسیل) بیوسنتز میشوند.
اندازه یک پروتئین سنتز شده را میتوان با تعداد اسیدهای آمینه موجود در آن و با توده مولکولی کل آن که به طور معمول در واحدهای دالتون (مترادف با واحدهای توده اتمی) یا واحد مشتق کیلو دالتون (kDa) گزارش میشود، اندازهگیری کرد. اندازه متوسط یک پروتئین از آرکئیها به باکتریها تا یوکاریوتها افزایش مییابد (به ترتیب 283، 311، 438 باقیمانده و 31، 34، 49 کیلو دالتون) به دلیل تعداد بیشتری از دامنههای پروتئینی که پروتئین های موجودات بالاتر را تشکیل میدهند.
به عنوان مثال، پروتئین های مخمر به طور متوسط تعداد 466 آمینو اسید و 53 کیلو دالتون جرم دارند. بزرگترین پروتئینهای شناخته شده تیتینها، در سارکومر عضله با جرم مولکولی نزدیک به 3000 کیلو دالتون و تعداد تقریبی 27000 اسید آمینه هستند.
برای مطالعه بیشتر در مورد چگونگی ترجمه و ساخت پروتئین در سلول، میتوانید مطلب زیر از فرادرس را نیز مطالعه کنید.
- برای مطالعه مطلب «پروتئین سازی و ترجمه چیست؟» — به زبان ساده + اینجا کلیک کنید.
سنتز شیمیایی پروتئین ها
پروتئین های کوتاه میتوانند با گروهی از روشهای معروف به سنتز پپتیدی، بر پایه تکنیکهای سنتز ارگانیک برای تولید پپتیدهای با بازده بالا تولید شوند. با استفاده از سنتز شیمیایی میتوان اسیدهای آمینه غیر استاندارد را هم به زنجیرههای پلیپپتیدی اضافه کرد. به طور مثال، اتصال پروبهای فلورسنت به زنجیرههای جانبی اسید آمینهها، با هدف شناسایی توالی پروتئینی، یکی از این روشها است.
این روشها کاربرد تجاری ندارند بلکه در بیوشیمی آزمایشگاهی و زیست سلولی استفاده میشوند. سنتز شیمیایی برای پلیپپتیدهای طولانی تر از حدود 300 اسید آمینه ناکارآمد است و پروتئین های سنتز شده ممکن است ساختار سوم سوم بومی خود را به راحتی دریافت نکنند. بیشتر روشهای سنتز شیمیایی، بر خلاف واکنش بیولوژیک و طبیعی، از انتهای کربوکسیل به آمین پیش میروند.
ساختار پروتئین ها
بیشتر پروتئینها بعد از سنتز، ساختارهای سه بعدی منحصر به فردی پیدا میکنند که به عنوان ساختار طبیعی آنها شناخته میشود. اگرچه بسیاری از پروتئینها میتوانند به طور خود به خودی و بر اساس خصوصیات اسیدآمینههای سازنده خود و میانکنش آنها با یکدیگر، ساختار سه بعدی خاصی پیدا کنند، اما برخی دیگر برای سازمانیابی نهایی و ایجاد فرم عملکردی فعال و طبیعی خود، به کمک مولکولهایی به نام «چاپرونها» (Chaperones) نیاز دارند.
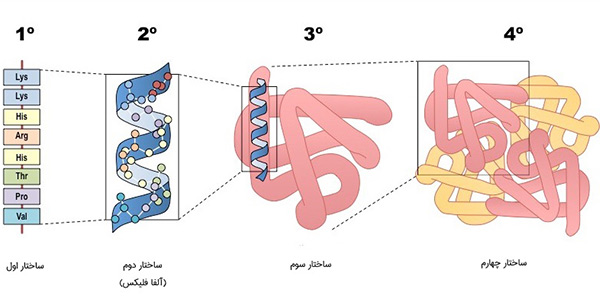
چاپرونها گروهی از پروتئینها هستند که عملکردهای مختلفی دارند اما کار اصلی آنها اتصال به پروتئینهای غیربومی، جلوگیری از تجمع غیر اختصاصی آنها و کمک به ایجاد ساختار سه بعدی پروتئینها است. پروتئینها بر اساس میزان پیچیدگی و سازمانیابی، ۴ ساختار دارند:
- ساختار اولیه: توالی اسید آمینه پروتئین و به صورت یک پلیآمید یا پلی پپتید خطی است.
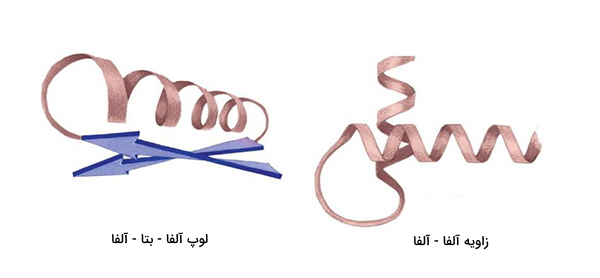
- ساختار ثانویه: تکرار منظم ساختارهای محلی تثبیت شده، که به دلیلی وجود پیوندهای هیدروژنی و پیوندهای دی سولفیدی شکل میگیرد. متداولترین نمونه ساختار ثانویه پروتئینها مارپیچ آلفا، صفحات بتا، turnها و لوپها هستند. از آنجا که ساختارهای ثانویه، محلی هستند، بسیاری از مناطق با ساختار ثانویه متفاوت میتوانند در یک مولکول پروتئین منفرد وجود داشته باشند.
- ساختار سوم: شکل کلی یک مولکول پروتئین و حاصل کنار هم قرار گرفتن چندین ساختار ثانویه در کنار یکدیگر است. ساختار سوم به طور کلی با فعل و انفعالات غیر محلی، اتصالات آبگریز و آبدوست، پلهای نمکی، پیوندهای هیدروژنی، پیوندهای دیسولفید و یا تغییرات پس از ترجمه ایجاد میشود. ساختمان سوم پروتئینها، عملکرد اساسی و نهایی آنها را تعیین میکند.
- ساختار چهارم: ساختاری است که توسط چندین مولکول پروتئین (زنجیرههای پلیپپتیدی) تشکیل شده است که زیر واحدهای پروتئینی گفته میشوند و به عنوان یک مجموعه پروتئینی واحد عمل میکنند.
- ساختار کوینری: جایگاههای فعال سطح پروتئین هستند که فضای داخلی سلول شلوغ را سازمان میدهد. ساختار کوین گذرا و لحظهای است و به فعل و انفعالات درون سلولی و میانکنشهایی که با ماکرومولکولها و سایر ترکیبات سلولی ایجاد میشود، بستگی دارد.
پروتئینها مولکولهای با ساختار ثابت و غیر منعطف نیستند. علاوه بر این سطوح ساختمانی که ذکر شد، ممکن است پروتئینها حین عملکردهایی که در سلول انجام میدهند، در حالتهای مختلفی سازمانیابی شوند. در این بازآراییهای عملکردی، ساختمانهای سوم یا چهارمی که به وجود میآیند تحت عنوان «کانفورماسیون» (Conformation) شناخته میشوند و تغییر حالت بین کانفورماسیونهای مختلف، تغییرات ساختاری نام دارد.
چنین تغییراتی غالباً با اتصال مولکول سوبسترا به جایگاه فعال آنزیم (ناحیه فیزیکی پروتئینی که در تجزیه شیمیایی شرکت دارد) ایجاد میشوند. پروتئینهای محلول نیز از طریق لرزش حرارتی و برخورد با سایر مولکولها دچار تغییرات ساختاری میشوند.
تغییرات پس از ترجمه پروتئین ها
پس از سنتز پروتئین در داخل سلول، معمولاً با اضافه شدن گروههای عملکردی مانند قندها یا فسفات، به زنجیره پلیپپتیدی، تغییراتی در آن اتفاق میافتد. این تغییرات ممکن است عملکردهای خاصی را در پروتئین ایجاد کنند. یک روش آسان برای بررسی اثر این تغییرات در ساختار و عملکرد پروتئین، استفاده از طیف سنجی جرمی است که با آن میتوان در نمونه سیگنالهای پروتئینی اصلاح شده و اصلاح نشده را مشاهده کرد.
تغییرات پس از ترجمه دو نوع عمده دارند:
- شکسته شدن پیوندهای پپتیدی: اصلاحات پس از ترجمه، آنزیمهای تخصصی به نام پروتئازها اسیدهای آمینه خاص یک پروتئین را تشخیص میدهند و پیوند پپتید مرتبط را میشکنند، در نتیجه ساختار اولیه را به صورت برگشتناپذیر اصلاح میکنند.
- اضافه شدن یا حذف شدن گروههای عملکردی به زنجیرههای جانبی آمینو اسیدها: زنجیرههای جانبی اسید آمینه پروتئین معین با واکنشهای آنزیمی اصلاحکننده یا خود به خود تشکیل میشوند (غیر آنزیمی). نمونههایی از اصلاحات زنجیره جانبی زیاد است اما موارد متداول آن شامل اکسیداسیون، آسیلاسیون، گلیکوزیلاسیون (افزودن گلیکان یا قند)، متیلاسیون و فسفوریلاسیون هستند.
هر دو نوع تغییرات پس از ترجمه، کنترل مثبت و منفی بر عملکرد پروتئین یا آنزیم و نقش تنظیمی در سلول دارند.
انواع پروتئین ها
پروتئینها را بر اساس ساختمان سوم آنها میتوان به سه گروه اصلی تقسیمبندی کرد:
- پروتئین های کروی: تقریباً تمام پروتئینهای محلول، کروی و شامل بسیاری از آنزیمها هستند.
- پروتئین های خطی: اغلب نقش ساختاری دارند مانند کلاژن که جزء اصلی بافت همبند است یا کراتین که در ناخن و مو وجود دارد.
- پروتئین های غشایی: پروتئینهای غشایی غالباً به عنوان گیرنده یا کانالهایی برای عبور مولکولهای قطبی یا باردار از غشای سلول عمل میکنند.
یک نوع خاص از پیوندهای هیدروژنی درون مولکولی پروتئین ها، که در برابر حمله مولکولهای آب محافظت نمیشود و در نتیجه فرایند آبگیری را خودش انجام میدهد دهیدروژنها هستند که عملکرد دهیدروژنیاسیون را انجام میدهند و باعث آبگیری از اطراف پروتئین میشوند.
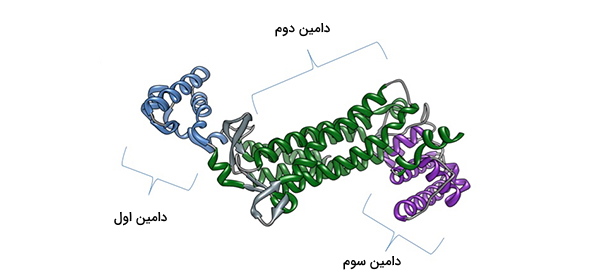
دامین پروتئین چیست؟
دامین یا دومین پروتئین بخشهای حفاظت شده از ساختار سوم پروتئین هستند که میتوانند به صورت مستقل از سایر بخشهای پروتئین، عملکرد داشته باشند. پروتئینها به طور معمول چندین دامین اختصاصی دارند که هریک عملکرد خاص خود را انجام میدهند و ممکن است در خانوادهای از پروتئینها مشترک باشند. به عنوان مثال، دومین SH3، از ۶۰ ریشه آمینواسیدی تشکیل شده است که در مولکولهای فسفولیپاز و چندین تیروزین کیناز سیتوپلاسمی همچون ABL1 و تیروزین - پروتئین کیناز CSK وجود دارد.
موتیف پروتئین چیست؟
توالی کوتاه اسیدهای آمینه در پروتئین ها، اغلب به عنوان مکانهایی برای شناسایی پروتئین های دیگر عمل میکنند. به عنوان مثال، دامینهای SH3 به طور معمول به توالیهای چهارتایی که در دو انتها پرولین وجود داشته باشد، متصل میشوند. «موتیفها» (Motifs) ساختارهای فرا ثانویهای هستند که عملکرد خاصی را بر عهده دارند.
از آنجایی که تعیین ارتباط بین ساختار اولیه و ساختار سوم پروتئین ها ساده نیست، دو بیوپلیمر ممکن است یا وجود توالی امینو اسیدی متفاوت، یک موتیف مشترک داشته باشند. از طرف دیگر، وجود یک موتیف مشابه لزوماً به معنای ساختار اولیه متفاوت نیست.
در پروتئین ها، موتیف ساختاری ارتباط بین عناصری که در ساختمان ثانویه پروتئین دخالت دارند را نشان میدهد. موتیفهای منفرد به طور معمول از چند جزء تشکیل شدهاند. به عنوان مثال، موتیف «مارپیچ - چرخش - مارپیچ» که فقط سه جزء دارد.
اگرچه توالی مکانی این اجزا ممکن است در همه نمونههای یک موتیف یکسان باشد، اما ممکن است ساختار اولیه پروتئین حامل موتیف، یکسان نباشد و یا رمزگذاری آن در ساختار DNA مشابه نباشد. علاوه بر عناصر ساختار ثانویه، موتیفهای ساختاری اغلب شامل حلقههایی با طول متغیر و ساختار نامشخص هستند.
موتیفهای ساختاری ممکن است به صورت تکرارهای پشت سر هم دیده شوند که انواع رایج آنها عبارتند از:
- «سنجاق بتا» (Beta hairpin): دو رشته بتای غیر موازی که با چرخش چند اسید آمینه، به یکدیگر متصل میشوند.
- «کلید یونانی» (Greek key): چهار رشته بتا، سه رشته با ساختار سنجاق سر به هم متصل شدهاند و رشته چهارم نیز در بالای آنها قرار گرفته است.
- «لوپ امگا» (Omega loop): یک حلقه که در آن باقی ماندههایی که ابتدا و انتهای حلقه را تشکیل می دهند بسیار به هم نزدیک هستند.
- «مارپیچ - لوپ- مارپیچ» (Helix-loop-helix): متشکل از مارپیچهای آلفا است که توسط کشش حلقوی اسیدهای آمینه متصل میشوند. این نقش و نگار در عوامل رونویسی دیده می شود.
- «انگشت روی» (Zinc finger): دو رشته بتا با انتهای مارپیچ آلفا روی هم جمع و به یون روی یا زینک متصل شدهاند. در پروتئین های اتصال دهنده DNA این ساختار اهمیت فراوانی دارد.
- «مارپیچ - چرخش - مارپیچ» (Helix-turn-helix): دو مارپیچ آلفا که با یک رشته کوتاه اسید آمینه به هم متصل شدهاند. این ساختمان در بسیاری از پروتئین های تنظیم کننده بیان ژن یافت میشود.
- «Nest»: سه باقیمانده اسید آمینه یک تقارب اتصال آنیونی تشکیل می دهد. موقعیت مناسب،
- «Niche»: سه یا چهار باقیمانده اسید آمینهای متوالی یک ویژگی اتصال کاتیونی را تشکیل می دهد.










درود وسپاس فراوان
این خیلی عالی است تشکر از زحماتتان
خیلی عالی بود.
خسته نباشید