الکترولیت و هدایت الکتریکی — از صفر تا صد

هدایت الکتریکی بر مبنای جریان الکترونها بنا شده است. از میان عنصرهای جدول تناوبی، فلزات که در میان آنها فلزات قلیایی و قلیایی خاکی نیز وجود دارند، به دلیل گذردهی خوب الکترونها از میان خود، به عنوان هادی خوب الکتریسیته شناخته میشوند. در مقابل، آب مقطر به دلیل قدرت کم در عبور دادن الکترونها، هادی ضعیف الکتریسته به حساب میآید. موادی که به شدت یونیزه شده باشند، الکترولیتهایی قوی هستند. اسیدهای قوی و نمکها نوعی از الکترولیت قوی محسوب میشوند چراکه به طور کامل در محلول یونیزه و سبب حمل بار الکتریکی در محلول و در نتیجه ایجاد جریان الکتریکی میشوند. موادی که به طور کامل یونیزه نشوند، در دستهبندی الکترولیتهای ضعیف جای میگیرند. اسید و بازهای ضعیف جزو این گروه هستند زیرا در محلولها به طور کامل یونیزه نمیشوند.
هدایت الکتریکی یک الکترولیت معیاری برای قابلیت گذردهی الکتریسیته و واحد آن در SI، «زیمنس بر متر» $$(S / m)$$ است. اندازهگیری هدایت الکتریکی در صنعت و محیط زیست به عنوان یک روش ارزان و قابل اعتماد برای بررسی میزان یون موجود در یک محلول، به طور گسترده مورد استفاده قرار میگیرد. به طور مثال، اندازهگیری هدایت الکتریکی و کنترل آن، از روشهای معمول در تصفیه آب برای مصارف خانگی و صنعتی است.

در بسیاری از موارد، هدایت الکتریکی به طور مستقیم با «کل مواد جامد محلول» (Total Dissolved Solids) مرتبط میشود. هدایت الکتریکی آب دیونیزه (یونزدوده) باکیفیت، معمولا در حدود $$5.5 \ \mu S / m$$ در دمای ۲۵ درجه سانتیگراد است. این مقدار برای آب آشامیدنی بین 5 تا 50 $$5.5 \ m S / m$$ و برای آب دریا در حدود $$5000000 \ \mu S / m$$ در نظر گرفته میشود. هدایت الکتریکی در گذشته از طریق اتصال الکترولیت به یک مدار پل وتسون اندازهگیری میشد. محلولهای رقیق از قانون «کولراش» (Kohlrausch) در رابطه با هدایت الکتریکی تبعیت میکنند.
واحد اندازهگیری
همانطور که گفته شد، واحد اندازهگیری هدایت الکتریکی الکترولیتها در SI، $$ S / m$$ است که در دمای 25 درجه سانتیگراد تعریف میشود. البته در صنعت، مقدار $$ \mu S / m$$ بدین منظور کاربرد دارد.
سلول استاندارد استفاده شده در این فرآیند با عرض ۱ سانتیمتر و برای آب خالصِ در تعادل با هوا، مقاومتی در حدود $$10 ^ 6 $$ اهم دارد. این مقدار به عنوان یک مگا اهم در نظر گرفته میشود. برای «آب فرا خالص» (Ultra- Pure Water) این مقدار در حدود 18 مگا اهم یا بیشتر است.
تبدیل هدایت الکتریکی به TDS، به نوع ترکیب شیمیایی نمونه بستگی دارد و میتواند از 0/54 تا 0/96 متغیر باشد. این مقدار با در نظر گرفتن سدیم کلرید به عنوان جامد، 0/64 در نظر گرفته میشود. به بیان بهتر، عدد $$1 \mu S / m$$ معادل با 0/64 میلیگرم $$ Na Cl$$ در هر کیلوگرم از آب است.

اندازهگیری هدایت الکتریکی در الکترولیت
با اندازهگیری دقیق هدایت الکتریکی، در موارد بسیاری میتوان از آن بهره برد. یکی از این کاربردها، اندازهگیری خلوص آب است. هدایت الکتریکی یک محلول الکترولیتی با اندازهگیری مقاومت محلول بین دو الکترود تیغهای یا استوانهای محاسبه میشود. لازم به ذکر است که این دو الکترود در فاصله معین از یکدیگر قرار گرفتهاند. برای جلوگیری از بروز پدیده برقکافت (الکترولیز)، از ولتاژ متناوب در دستگاه بهره میگیرند. مقاومت مورد نظر بوسیله «رسانا سنج» (Conductivity Meter) قابل محاسبه است.

دستگاههای مختلفی برای این امر وجود دارند. دو نوع اصلی در اندازهگیری هدایت الکتریکی الکترولیتها، مدل الکترودی و القایی است. بسیاری از دستگاههای جدید به طور خودکار تصحیحات مربوط به دما را نیز انجام میدهند.

توضیح دقیقتر اندازهگیری
در یک سیم فلزی، ذرات باردار، الکترونها هستند که در طول سیم حرکت میکنند. در یک محلول، یونها این وظیفه را به عهده دارند. همچنین، شدت جریان در یک الکترولیت به موارد زیر وابسته است:
- طبیعت یونها: بار، اندازه و قابلیت حرکت آنها
- طبیعت حلال: ثابت دی الکتریک و ویسکوزیته
- غلظت یونها
- دما
به طور کلی، هرقدر تعداد یونها در محلول بیشتر باشد، رسانایی آن نیز بیشتر است. همچنین هدایت الکتریکی تا یک میزان بیشینه، با افزایش غلظت، افزایش مییابد. بعد از این مقدار، رسانایی با افزایش غلظت، کاهش پیدا میکند.
نحوه حمل و نقل، میزان خلوص و پایداری یک محلول در اندازهگیری این مقدار موثر است. آلودگی، جذب دیاکسید کربن و خارج شدن گاز از محلول سبب خطا در سنجش هدایت الکتریکی خواهد بود.
غلظت و کل مواد جامد محلول
رابطه بین هدایت الکتریکی و تعداد یون در محلول، در اندازهگیری غلظت آن به ما کمک میکند و از این طریق میتوان به میزان «کل مواد جامد محلول» (TDS) دست یافت.
غلظت
برخی از مواد مانند $$NaCl$$ و $$HCl$$ توسط آب به خوبی یونیزه (آبپوشی) میشوند. در نتیجه محلول حاصل از این مواد رسانایی بالایی دارند. اسیدها، بازها و نمکها هرکدام دارای نمودار مشخصهای برای سنجش هدایت الکتریکی در مقابل غلظت هستند. به همین منظور محلولهای با اجزا و غلظت معین، نیاز به تصحیح در محاسبات دارند.
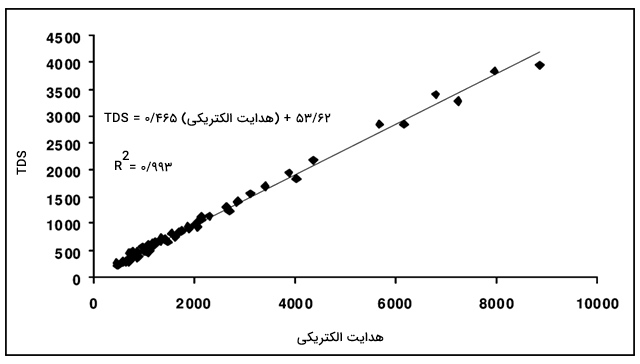
کل مواد جامد محلول
فرضیات متعددی به هنگام محاسبه TDS محلول از روی هدایت الکتریکی وجود دارند. به طور کلی از یک ضریب تبدیل در محاسبات استفاده میشود. این ضریب تبدیل به تصحیح نیاز دارد و بر اساس طبیعت محلول متغیر است. مقدار TDS، مجموع تعداد یونها با اندازه کمتر از 2 میکرون است. در آب تصفیه شده، مقدار TDS با میزان شوری (غلظت یونهای نمک در آب) برابر است. در آبهای آلوده، این میزان میتواند شامل ذرات حل شده نظیر هیدروکربنها و اوره نیز باشد. واحد اندازهگیری کل مواد جامد محلول، TDS، $$m g / L $$ است.
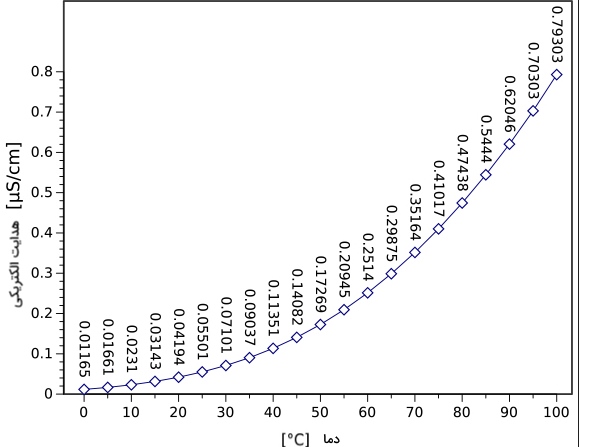
هدایت الکتریکی و دما
رسانایی الکتریکی با افزایش دما، افزایش مییابد. این افزایش رسانایی، به ازای هر افزایش درجه سانتیگراد، در حدود 1 تا 1/5 درصد افزایش پیدا میکند. در نتیجه نیاز به اعمال تصحیحات دما در محاسبات هدایت الکتریکی است.
دستهبندی الکترولیتهای قوی و ضعیف
در جداول زیر الکترولیتهای قوی، ضعیف و غیر الکترولیتها آورده شده است:
الکترولیتهای قوی
| اسید قوی | باز قوی | نمکهای محلول |
| $$H Cl$$ | $$Na O H$$ | $$Na Cl$$ |
| $$H Br$$ | $$K O H$$ | $$K _ 2 C O _3 $$ |
| $$H I$$ | $$C a ( O H ) _ 2$$ | $$Cu S O _ 4$$ |
| $$H N O _ 3$$ | $$B a ( O H ) _ 2$$ | |
| $$H _ 2 S O _ 4 $$ | ||
| $$H Cl O _ 4$$ | ||
| $$H Cl O _ 3$$ |
الکترولیتهای ضعیف
| اسید ضعیف | باز ضعیف | نمکهای کم محلول |
| $$C H _ 3 C O O H $$ | $$N H _ 3$$ | $$Ag Cl$$ |
| $$H _ 2 C O _3 $$ | $$N H _ 4 O H $$ | $$Ca C O _ 3$$ |
| $$C _ 6 H _ 8 O _ 7 $$ | $$M g ( O H ) _2 $$ | $$B a S O _ 4$$ |
| $$H _ 3 P O _ 4$$ |
غیر الکترولیتها
آب مقطر و اتانول در دسته غیر الکترولیتها قرار میگیرند.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش زبان تخصصی مهندسی شیمی
- هیدرولیز و کاربردهای آن — به زبان ساده
- میدان الکتریکی (Electric Field) چیست؟ — از صفر تا صد
^^











سلام
با تشکر از مقاله خوبی که در این زمینه نشر کردید ..سوالی که دارم که چرا برای ساخت استاندارد محلول کنداکتیوتی از محلول یا نمک جامد پتاسیم کلراید استفاده می کنند .
با تشکر از جواب شما
سلام
شما گفتید رسانایی الکتریکی با افزایش دما، افزایش مییابد. این افزایش رسانایی، به ازای هر افزایش درجه سانتیگراد، در حدود 1 تا 1/5 درصد افزایش پیدا میکند این مورد فقط در مورد نیمه رساناها صدق می کنه
ممنون
سلام و وقت شما بهخیر؛
این نکته که «رسانایی الکتریکی با افزایش دما افزایش پیدا میکند» در متن اشاره به الکترولیتها دارد.
در حالت کلی با افزایش دما، رسانایی الکتریکی رساناها کاهش مییابد و در مورد نیمهرساناها برعکس این صادق است. یعنی با افزایش دما، رسانایی الکتریکی در نیمهرساناها افزایش پیدا میکند.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس
سلام و وقتتون بخیر ممنون بابت اطلاعاتی که گذاشتید.
من در ابتدا یه سوال جنرال و بیسیک داشتم.
میخواستم تفاوت بین
conduction electron
electronic conductivity
electrical conductivity
ionic conductivity
متوجه بشم؟ و اینکه الکترونیک کانداکتیویتی مواد رو چطور میتونم پیدا بکنم؟ در مقالات که سرچ میکنم بیشتر الکتریک کانداکتیویتی مواد وجود داره؟
دنبال الکترونیک کانداکتیویتی
Ti
TiO2
TiC
TiN
TiN-TiO2
TiC-TiO2
هستم! در دمای حدود 300 تا 350 درجه. و اصلا نمیدونم الکترون کانداکتیویتی هم با دما تغییر میکنه؟!؟!
خیلی ممنون میشم راهنماییم کنید.
سلام سدیم هیدروکسید الکترولیت قوی تری هست یا HCl و به طور کلی مقاومت محلول در اسید هابیشتر است یا یون ها ؟؟
سلام. ببخشید یک سوال داشتم برای تفکیک هدایت الکترونی و هدایت یونی از هم چه راهکارهایی وجود دارد. یک مبحث در رابطه با تبدیل Kramer–Kronig K-K Transforms مطالعه کردم ولی خیلی خوب نفهمیدم چیکار کرد.
سلام چرا به جای سیم کشی برق، با استفاده از آب نمک درون لوله های پلیمری که قدرت تحمل جریان زیادی در برابر گرما دارند جهت هزینه های کمتر استفاده نمیشه؟ با تشکر
سلام
میخواستم بپرسم چراهدایت یون های HوOHبطورغیرعادی بالاست
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. هدایت الکتریکی به حرکت بار در پاسخ به یک میدان الکتریکی میگویند اما هدایت یونی نوعی هدایت الکتریکی است که به دلیل حرکت یون (ذره باردار یونی) رخ میدهد که این پدیده به عنوان ویژگی محلولهای الکترولیت شناخته میشود. برای درک بهتر نحوه حرکت الکترونها نیز میتوانید مطلب «پیوند فلزی — به زبان ساده» را مطالعه کنید.
با تشکر
سلام یه سوال داشتم .. ما یک محلول الکترولیتی درست کردیم و لامپ رو روشن کرده .. اما وقتی امپرسنج رو داخل محلول قرار میدیم چرا هیچ عددی نشون نمیده ؟ .. مگه حرکت یون ها نباید اثری روی امپرسنج داشته باشه ؟ ..ممنون میشم توضیح بدین
با سلام؛
از شما به خاطر مطالعه این مطلب سپاسگزاریم. همانطور که در متن هم ذکر شده است، برای الکترولیتها، میزان هدایت الکتریکی اندازهگیری میشود و همچنین بمنظور اندازهگیری شدت جریان در یک مدار الکتریکی (و نه در یک الکترولیت)، باید مولتیمتر را به صورت سری در یک مدار الکتریکی قرار داد. پیشنهاد میکنم برای آشنایی بیشتر با نحوه کار با مولتیمتر، مطلب «مولتی متر و روش استفاده از آن — به زبان ساده» را مطالعه کنید.
با تشکر