آنزیم چیست؟ — به زبان ساده
آنزیم یک نوع «کاتالیست» (catalyst) بیولوژیکی است که سرعت واکنش شیمیایی را در موجود زنده تنظیم میکند. اکثر آنزیمها پروتئینها هستند؛ اگرچه برخی نوکلئیک اسیدها به نام ریبوزومها هم قادر به انجام فعالیت کاتالیز محسوب میگردند.
آنزیمها برای حفظ حیات ضروری هستند؛ زیرا اکثر واکنشهای شیمیایی در سلولهای بیولوژیکی مانند هضم غذا، خیلی آرام اتفاق میافتند یا منجر به محصولات مختلفی بدون فعالیت آنزیمها میگردند. اکثر بیماریهای ارثی نتیجهی یک جهش ژنتیکی، تولید بیش از حد یا کمبود یک آنزیم حساس هستند. برای مثال، «عدم تحمل لاکتوز یا نارسایی لاکتاز» (lactose intolerance) که به معنای عدم توانایی هضم مقادیر قابل توجه لاکتوز که قند اصلی در شیر است، ناشی از کمبود آنزیم لاکتاز است.
یک آنزیم برای اینکه کاربردی باشد، باید به یک شکل سه بعدی دقیق تبدیل گردد. این که چطور چنین ساختار پیچیدهای شکل میگیرد، هنوز به شکل راز باقی مانده است. یک زنجیرهی کوچک از 150 آمینواسید یک آنزیم را شکل میدهد که تعداد بسیار زیادی پیکربندی مختلف دارد: اگر 1012 پیکربندی مختلف در هر ثانیه آزمایش گردند، حدود 1026 سال برای یافتن و درک یک مدل زمان مورد نیاز است.
با این حال یک آنزیم «دناتوره شده یا واسرشته» (denatured) میتواند در کسری از ثانیه تغییر شکل و سپس به طور دقیق در یک واکنش شیمیایی واکنش نشان دهد. برخی دانشمندان تصور میکنند، اثرات «کوانتومی» (quantum) حتی در فواصل بزرگ (با استانداردهای اتمی) که توسط یک مولکول پروتئین ظهور میکند، منجر به ایجاد رفتارهای اینچنینی میگردد. این آنزیمها نوعی پیچیدگی مبهوتکننده و توازن یا هارمونی را در جهان اثبات میکنند.
در حالی که تمام آنزیمها نقش بیولوژیکی دارند، بعضی از آنها به صورت تجاری مورد استفاده قرار میگیرند. به عنوان مثال، بسیاری از پاککنندههای خانگی از آنزیمها برای افزایش سرعت تجزیهی لکههای پروتئین یا نشاسته روی لباسها استفاده میکنند.
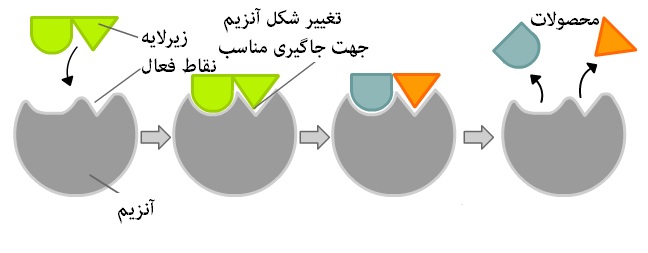
مانند تمام کاتالیستها، آنزیمها هم برای کاهش انرژی فعالسازی یک واکنش یا انرژی ابتدایی لازم برای رخ دادن اکثر واکنشهای شیمیایی به کار میروند. گرما را نمیتوان به یک سیستم زنده اضافه کرد، بنابراین آنزیمها یک مسیر جایگزین را فراهم میکنند: آنها با یک زیرلایه (مواد موجود در واکنش شیمیایی) برای تشکیل یک «حالت گذار» (transition state)، یک «کمپلکس واسطهی ناپایدار» (unstable intermediate complex) که نیاز به انرژی کمتری برای پیشروی واکنش دارد، پیوند میدهند.
همانند یک کاتالیست، آنزیم طی واکنش تکمیل شده بدون تغییر باقی میماند؛ بنابراین میتواند به فعل و انفعال با زیرلایهها ادامه دهد. آنزیمها ممکن است طی فرایندی به خصوص سرعت واکنشها را تا چندین میلیون برابر افزایش دهند. آنزیمها میتوانند توسط مولکولهایی که فعالیت آن را افزایش میدهد، «راهانداز» (activator)، یا مولکولهایی که باعث کاهش فعالیت آنها میگردد، «مهارکننده» (inhibitor) تحت تاثیر قرار گیرند. بسیاری از داروها با مهار آنزیمها در بدن عمل میکنند و اثر خود را نشان میدهند. «آسپیرین» (aspirin) از طریق مهار آنزیمهای «COX-1» و «COX-2» کار میکند. آنزیمهایی که «پروستاگلاندین» (prostaglandin) تولید میکنند، یک پیامرسان هورمونی برای نشان دادن التهاب به شمار میروند. با مهار فعالیت این آنزیمها، «آسپیرین» (aspirin) تجربهی ما از درد و التهاب را سرکوب میکند.
ساختار آنزیمها
ساختار آنزیم مهم است، زیرا عملکرد خاص آنزیم در بدن را تعیین میکند. آنزیمها (و سایر پروتئینها) از زنجیرههای اسید آمینه به نام زنجیرههای «پلیپپتیدی» (polypeptide) تشکیل شدهاند. دنبالهی خطی آمینواسیدها تعیینکنندهی مشخصات تاشدگی زنجیرهها به یک ساختار سه بعدی است. یک آنزیم ممکن است فقط یک زنجیرهی پلیپپتیدی داشته باشد که معمولا یک صد آمینواسید یا تعداد بیشتری را به هم پیوند میدهد یا ممکن است شامل چندین زنجیرهی پلیپپتیدی باشد که با هم به عنوان یک واحد عمل میکنند. اکثر آنزیمها بزرگتر از زیرلایههایی هستند که روی آن عمل میکنند. فقط یک قسمت خیلی کوچک از آنزیم، تقریبا 10 آمینواسید، دارای تماس مستقیم با زیرلایهها است. این ناحیه، جایی که پیوند بین زیرلایهها و واکنش اتفاق میافتد، به عنوان سایت فعال آنزیم شناخته میشود.
عمل اختصاصی (Specificity)
آنزیمها معمولا در واکنشهایی که کاتالیز میکنند و زیرلایههایی که در این واکنشها دخیل هستند، خاص و منحصر به فرد هستند؛ یعنی فعالیت آنزیم اختصاصی است. یک آنزیم با زیرلایهاش برای تشکیل یک کمپلکس آنزیم-زیرلایه کم دوام، ترکیب میگردد. دو مدل برای توضیح چگونگی ایجاد پیوند بین آنزیم و زیرلایه وجود دارد: مدل «قفل و کلید» (lock and key) و «تناسب القایی» (induced fit).
مدل قفل و کلید
برای شناخت اختصاصی بودن آنزیمها، «امیل فیشر» (Emil Fischer) شیمیدان آلمانی، پیشنهاد داد که آنزیم یک شکل خاص دارد که زیرلایهها دقیقا متناسب آن هستند. این مدل تناسب دقیق که در سال 1890 معرفی شد، غالبا به عنوان مدل قفل و کلید شناخته میشود؛ زیرا پیوند آنزیم به یک زیرلایه شبیه به تناسب خاصی از یک قفل در یک کلید است.
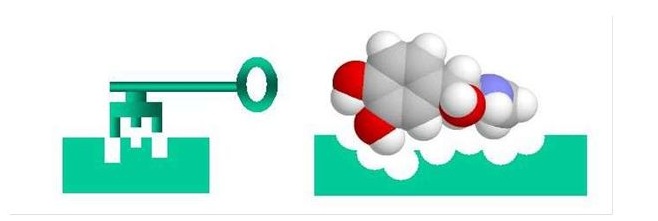
مدل تناسب القایی
در سال 1958، «دانیل کشلند» (Daniel Koshland) اصلاحیهای برای مدل قفل و کلید را پیشنهاد داد. بر خلاف کلیدها، آنزیمها ساختارهای انعطافپذیر را ترجیح میدهند. سایت فعال یک آنزیم میتواند به عنوان زیرلایهای که در تعامل با آنزیم است، اصلاح شود و یک تناسب القایی بین آنزیم و زیرلایه ایجاد کند. زنجیرههای جانبی آمینواسیدها که سایتهای فعال را ایجاد میکنند، به یک شکل دقیق قالب میشوند که آنزیم را قادر میسازد فعالیت کاتالیزوری آن را انجام دهد. در برخی موارد، مولکول زیرلایه به آرامی تغییر شکل میدهد، هنگامی که به سایتهای فعال وارد میگردد.
کوفاکتورهای آنزیم
برخی آنزیمها نیاز به اجزای اضافی برای نمایش فعالیت کامل ندارند. اگرچه، دیگر آنزیمها نیازمند مولکولهای غیر پروتئینی هستند تا برای فعالیت موثر به کمپلکس پیوند داده شوند. «کوفاکتورها» (cofactors) میتوانند غیرآلی (مانند یونهای فلزی و «خوشههای آهن-سولفور» (iron-sulfur clusters)) یا ترکیبات آلی باشند که به عنوان کوآنزیمها نیز شناخته میشوند.
اکثر کوفاکتورها «پیوند کووالانسی یا پیوند اشتراکی» (covalently bound) با یک آنزیم ندارند، اما خیلی به هم وابسته هستند. با این حال، برخی از کوفاکتورها معروف به «گروههای پروتز» (prosthetic groups) به طور محکم از طریق پیوندهای کووالانسی به آنزیم پیوند میشوند. اکثر کوفاکتورها در پایان واکنشها یا احیا میگردند یا از لحاظ شیمیایی بدون تغییر میمانند. بسیاری از کوفاکتورها مشتقات ویتامینها هستند. کوفاکتورها در طول واکنش به عنوان حاملی برای انتقال الکترونها، اتمها یا گروههای عاملی از آنزیم به زیرلایه به کار میروند. نمونههای مرسوم از این مورد شامل «NAD» و «NADP» هستند که در انتقال الکترون مشارکت دارند. نمونهی دیگر «کوآنزیمآ» (coenzyme A) است که در انتقال «گروههای استیل» (acetyl groups) دخیل است.
چگونه آنزیمها واکنشها را کاتالیز میکنند؟
یک واکنش کاتالیز شده توسط آنزیمها باید به صورت خود به خودی باشد. بدین معنا که با میل طبیعی بدون نیاز به فشار خارجی صورت پذیرد (از دید ترمودینامیکی، واکنش باید دارای یک انرژی خالص منفی گیبس باشد). به عبارت دیگر، واکنش بدون آنزیم در جهت یکسان با حالت آنزیمدار صورت میگیرد. منتها در حالت بدون آنزیم، واکنش به میزان قابل توجهی کندتر اتفاق میافتد. به عنوان مثال، تجزیهی ذرات مواد غذایی مانند «کربوهیدراتها» (carbohydrates) به اجزای کوچکتر قند به صورت خود به خودی صورت میگیرد، اما افزودن آنزیمها همانند «آمیلازها» (amylases) در بزاق ما باعث میشود واکنش سریعتر رخ دهد.
آنزیمها میتوانند دو یا چند واکنش را با هم جفت کنند، به طوری که یک واکنش خود به خودی میتواند برای انجام یک واکنش نامطلوب مورد استفاده قرار گیرد. به عنوان مثال، با آزادسازی ترکیب انرژی بالا «آدنوزین تری فسفات» (Adenosine triphosphate, ATP) انرژی واکنشهای شیمیایی نامطلوب مانند ساخت پروتئینها فراهم میگردد.
تنظیم فعالیت آنزیم
ترکیباتی به نام مهارکنندهها میتوانند سرعت واکنش آنزیم را از طریق مهار رقابتی یا غیر رقابتی کاهش دهند. در مهار رقابتی، مهار کننده به طور مستقیم به سایتهای فعال نشان داده شده متصل شده و از اتصال زیرلایه جلوگیری میکند؛ بنابراین زیرلایه و مهار کننده برای سایتهای فعال آنزیم با هم رقابت میکنند. مهار کنندههای غیر رقابتی به سایتهای فعال متصل نمیشوند. بلکه به دیگر قسمتهای آنزیم اتصال برقرار میکنند که باعث دور شدن از سایت فعال میگردد. میزان مهار کنندگی کاملا به غلظت مهار کننده بستگی دارد و تحت تاثیر غلظت زیرلایه قرار نخواهد گرفت. به عنوان مثال، «سیانور» (cyanide) سمی با «گروههای پروتز مس» (copper prosthetic groups) از آنزیم «سیتوکروم اکسیداز سی» (cytochrome c oxidase) برای مهار «تنفس یاختهای» (cellular respiration) ترکیب میشود. این مدل از مهارکننده معمولا غیر قابل برگشت پذیر است، به این معنا که آنزیم بعد از تعامل با مهارکننده، هیچ فعالیتی نخواهد داشت.
برخی از مهارکنندههای غیر رقابتی به طور فیزیکی از طریق انسداد سایتهای فعال عمل میکنند. مهارکنندههای دیگر طوری به آنزیم متصل میگردند که ساختار سه بعدی آنزیم (ترکیب آن) را تغییر میدهند. تغییر در ساختار آنزیم، سایت فعال را مختل و آنزیم را از اتصال به زیرلایه ناتوان میسازد. در حالت دوم از مهار کنندهی غیررقابتی که مهارکنندهی «آلوستریک» (allosteric) نامیده میشود، مهارکننده به سایتهای آلوستریک وصل شده و شکل مولکول آنزیم را تغییر میدهد، به طوری که از واکنش آن با زیرلایه جلوگیری میکند.
دگرریختاری یا آلوستریسم
مهارکنندههای آلوستریک غالبا برای تنظیم مسیرهای متابولیکی مورد استفاده قرار میگیرند که در آن چندیم آنزیم با یک نظم خاص با هم فعالیت میکنند. در یک مسیر متابولیکی، یک آنزیم محصول آنزیم دیگر را به عنوان یک زیرلایه در اختیار میگیرد. بعد از واکنش کاتالیز، محصول به آنزیم دیگر انتقال مییابد. محصولات نهایی چنین مسیری، اغلب مهارکنندههای آلوستریک برای یکی از اولین آنزیمهای مسیر است (معمولا اولین مرحلهی غیر قابل برگشتپذیر را «committed step» میگویند)؛ بنابراین تنظیم مقدار محصول نهایی توسط این مسیرها ایجاد میگردد. این فرآیند نظارتی بازخورد منفی نامیده میشود، زیرا مقدار محصول نهایی تولید شده توسط غلظت خودشان تنظیم میگردد.
مولکولهای آلوستریک همچنین میتوانند فعال باشند یا فعالیت آنزیمها را از طریق تغییر شکل سایت فعال آنزیم به منظور تسهیل تعامل با یک زیرلایه افزایش دهند. این دگرریختاری از عمل آنزیمی به حفظ محیط داخلی پایدار در موجودات زنده از طریق تحریک تولید منابع مورد نیاز و جلوگیری از تولید اضافی محصولات نهایی پس از تقاضا کمک مینماید.
قوانین نامگذاری آنزیم
آنزیمها بل ویژگیهای منحصر به فردشان شناخته میشوند. به این معنا که آنها اغلب فقط با یک زیرلایه برای کاتالیز یک واکنش خاص تعامل میکنند؛ بنابراین، آنزیمها غالبا از طریق اضافه کردن پسوند «ase» به اسم زیرلایه نامگذاری میگردند. مثالی از این مورد آنزیم لاکتاز است که تجزیهی لاکتوز را کاتالیز میکند. همهی آنزیمها به این طریق نامگذاری نشدهاند، در نتیجه جهت هماهنگی بیشتر یک روش بسیار رسمیتر نامگذاری برای طبقهبندی آنزیمها توسعه یافته است.
«اتحادیه بین المللی بیوشیمی و بیولوژی مولکولی» (The International Union of Biochemistry and Molecular Biology, IUBMB) یک روش نامگذاری برای آنزیمها به نام «عدد گروه آنزیم» (Enzyme Commission number, EC Number) ایجاد کرده است. عدد گروه آنزیم هر آنزیم را با استفاده از یک دنبالهی چهار رقمی قبل از عدد گروه آنزیم توصیف میکند. عدد اول آنزیم را براساس چگونگی عملکردش برای کاتالیز نمودن یک واکنش طبقهبندی میکند. تحت این سیستم، آنزیمها به شش دستهبندی اصلی، بر اساس نوع واکنشهایی که کاتالیز میکنند، سازماندهی میگردند.
- EC 1: «اکسیدورداکتاز» (oxidoreductases) آنزیمی است که انتقال الکترون را از یک مولکول (احیاکننده) به مولکول دیگر (اکسیدان) کاتالیز میکند.
- EC 2: «ترانسفراز» (transferases) آنزیمی است که انتقال یک گروه شیمیایی به نام گروه عاملی (مثل گروه متیل یا فسفات) را از یک ماده به مادهی دیگر کاتالیز میکند.
- EC 3: «هیدرولاز» (Hydrolases) آنزیمی که آبکافت پیوندهای شیمیایی را کاتالیز میکند. به بیان دیگر این آنزیمها با افزودن یک مولکول آب به ترکیبات مختلف آنها را تجزیه میکنند.
- EC 4: «لیاز» (lyase) آنزیمی است که شکستن پیوندهای شیمیایی مختلف را از راههایی جز آبکافت و اکسیداسیون کاتالیز میکند و اغلب باعث ایجاد یک پیوند دوگانه جدید یا یک ساختمان حلقوی میشود.
- EC 5: «ایزومراز» (isomerases) آنزیمی است که تبدیل ایزومرهای یک مولکول را به هم دیگر کاتالیز میکند.
- EC 6: «لیگاز» (ligases) آنزیمی که دو مولکول را با پیوندهای کووالانسی به هم متصل میکند.
ریشهشناسی و تاریخچه
کلمهی آنزیم از حروف یونانی «ένζυμο, énsymo» گرفته شده است. اگرچه خمیرمایه کردن نان و تخمیر شراب طی قرنها انجام میشد ولی تا اواخر قرن ۱۹ این فرآیندها را به عنوان نتیجهای از فعالیت آنزیم نمیدانستند. با مطالعهی تخمیر شکر به الکل توسط مخمر، «لوئیس پاستور» (Louis Pasteur) به این نتیجه رسید که این تخمیر توسط مادهی تخمیر موجود در مخمر کاتالیز میشود که به نظر میرسید فقط در حضور موجودات زنده فعالیت میکنند.

اگرچه در سال 1897، «هانس و ادوارد بوخنر» (Hans and Eduard Buchner) به صورت غریزی از عصارهی مخمر علیرغم نبود سلولهای مخمر زنده برای تخمیر شکر استفاده کردند. آنها علاقمند به ساخت عصارهی سلولهای مخمر برای اهداف پزشکی بودند و برای ماندگاری آنها مقادیر زیادی از «ساکارز» (sucrose) را به عصاره اضافه کردند. این دو دانشمند دریافتند که شکر به این شیوه تخمیر میگردد؛ هرچند هیچ سلول مخمر زندهای در ترکیب وجود ندارد. اصطلاح آنزیم برای توصیف ماده (ها) در عصارهی مخمر مورد استفاده قرار گرفت که باعث تخمیر ساکارز شد. تا سال 1926 اولین آنزیم در شکل خالص بدست آمد.
سینتیک آنزیم
در سال 1913 «لیونور میشائیلیس» (Leonor Michaelis) و «ماد منتن» (Maud Menten) یک تئوری «کمی» (quantitative) از سینتیک آنزیم را پیشنهاد دادند که به عنوان سینتیک میشائیلیس-منتن نام نهاده شد. کار آنها بعدا توسط «جورج ادوارد بریگس» (G. E. Briggs) و «جان برتون ساندرسون هالدین» (J. B. S. Haldane) توسعه یافت. کسی که معادلات سینتیکی زیادی را توسعه داد که امروزه هنوز به طور گسترده استفاده میشوند.
آنزیمها میتوانند تا چندین میلیون واکنش کاتالیزوری را در هر ثانیه انجام دهند. برای تعیین حداکثر سرعت یک واکنش آنزیمی، غلظت زیرلایه افزایش یافته تا تولید محصول با سرعت ثابتی بدست آید. این سرعت در واقع حداکثر سرعت (Vmax) آنزیم است. در این حالت، تمام سایتهای فعال آنزیم با زیرلایه اشباع میگردند. به این معنا که تمام آنها در تبدیل زیرلایه به محصول درگیر میشوند.
در هر حال، حداکثر سرعت تنها یک پارامتر سینتیکی است که «زیست شیمیدانها» (biochemists) را علاقمند میکند. آنها همچنین میخواهند قادر به محاسبهی مقدار زیرلایهی مورد نیاز برای دستیابی به یک سرعت مشخصی از واکنش باشند. این مقدار میتواند توسط ضریب میشائیلیس-منتن (Km) بیان شود که برای رسیدن به نصف حداکثر سرعت، غلظت زیرلایه برای آنزیم نیاز میشود. هر آنزیم یک ضریب Km مشخص برای یک زیرلایه داده شده دارد.
بازدهی یک آنزیم میتواند بر حسب kcat/Km بیان شود. مقدار kcat که «آهنگ تبدیل کاتالیزگر» (turnover number) نیز نامیده میگردد، ثابتهای سرعت برای تمام مراحل واکنش را ترکیب کرده و خارج قسمت سرعت حداکثر و غلظت آنزیم کل، kcat/Km، یک مقدار مفید برای مقایسهی کارایی نسبی آنزیمهای مختلف یا همان آنزیم که در تعامل با زیرلایههای مختلف به حساب میآید، در نظر گرفته میشود؛ زیرا «آفنیته» (affinity) و توانایی کاتالیزوری باید در نظر گرفته شوند.
آفنیته میل ترکیبی اجزای شیمیایی غیر مشابه با یکدیگر است. این اصلاح همچنین هنگامیکه دو چند اتم با ترکیب غیر یکسان با یکدیگر واکنش شیمیایی بدهند نیز بکار میرود. مقدار حداکثر تئوری برای kcat/Km که حد انتشار نامیده میشود، حدود 108 تا 109 (M-1 s-1) است. در این مرحله، هر برخورد آنزیم با زیر لایهاش به کاتالیز منجر میشود و سرعت تشکیل محصول توسط سرعت واکنش محدود نمیگردد بلکه محدودیت آن با سرعت انتشار است. آنزیمهایی که به مقدار kcat/Km میرسند، از لحاظ سینتیک یا کاتالیستی کامل هستند. نمونهای از این آنزیمها «تریوز فسفات ایزومراز» (triose-phosphate isomerase, TIM)، «کربنیک آنهیدراز» (carbonic anhydrase)، «استیلکولیناستراز» (acetylcholinesterase)، «کاتالاز» (catalase)، «فوماراز» (fumarase)، «بتالاکتاماز» (ß-lactamase) و «سوپراکسید دیسموتاز» (superoxide dismutase) هستند.
کاربردهای صنعتی
در این قسمت به برخی از کاربردهای رایج آنزیمها که از زمان درک علمی عملکرد کاتالیزی آنها در اواخر قرن نوزدهم، نقش مهمی در فرآیندهای صنعتی ایفا کردند، اشاره شده است.
«پروتئازها» (Proteases) که باعث تجزیهی پیوندهای بین آمینواسیدها، تشکیل شده از مولکولهای پروتئین، میشوند در پاک کنندههای بیولوژیکی برای کمک به حذف لکههای پروتئین استفاده میگردند. «رنین» (Renin) یک نوع پروتئاز است که از معدهی حیوانات پستاندار نشخوار کنندهی جوان (گوساله، بره) بدست میآید و برای تقسیم پروتئین طی تولید پنیر استفاده میگردد. نوع دیگری از پروتئاز که «تریپسین» (Trypsin) نامیده شده، برای پیش هضم غذاهای کودک مورد استفاده قرار میگیرد.
«آمیلاز» (Amylase) یک آنزیم گوارش غذا مورد استفاده در تجزیهی «کربوهیدراتها» (carbohydrates) است که به حذف باقیماندههای نشاستهی مقاوم در برابر پاککنندههای ظرفشویی کمک میکند. آنزیمهای «آمیلاز آلفا-قارچی» (Fungal-alpha amylase) تجزیهی نشاسته در آرد را به ترکیبات قند آن کاتالیز میکند. این آنزیمها در تولید نان سفید، نان کماج و نان ساندویچی استفاده میشوند. در صنعت پخت، انواع آنزیمهای آزاد شده از مالت (غالبا دانههای جو) در طول مرحلهی خمیر تولید آبجو به کار میروند. در این مرحله جو و آب ترکیب شده و حرارت میبینند. این آنزیمها شامل آمیلازها، «گلوکانازها» (glucanases)، پروتئازها، degrade starches و پروتئینها در مالت برای تولید قند ساده، آمینو اسیدها و پپتیدها باعث تقویت تخمیر میگردند.
اگر این مطلب برایتان مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزش های زیست شناسی
- مجموعه آموزش های مهندسی کشاورزی و زراعت
- کوآنزیم چیست؟ -- به زبان ساده
- معرفی بیوانرژی و کاربردهای آن -- به زبان ساده
- کاتالیست و واکنش کاتالیستی -- به زبان ساده
- فتوسنتز چیست؟ -- به زبان ساده
- با انواع مختلف پروتئینها آشنا شوید
^^