کانال ولتاژی سدیم چیست؟ — به زبان ساده

بار الکتریکی یونها با ترکیبات غشای سلولی برهمکنش میدهد. به همین دلیل این ترکیبات برای عبور از غشا نیاز به ناقل پروتئینی دارند. کانالهای یونی پروتئینهای عرضی غشای پلاسمایی هستند که مجرایی برای تبادل یونها بین ماتریکس خارج سلولی و سیتوپلاسم ایجاد میکنند. این کانالها نقش مهمی در تنظیم فشار اسمزی مایعات بدن و تغییر پتانسیل الکتریکی سلولهای تحریکپذیر دارند. در این مطلب مجله فرادرس ساختار و نقش کانال ولتاژی سدیم را توضیح میدهیم.
کانال ولتاژی سدیم چیست ؟
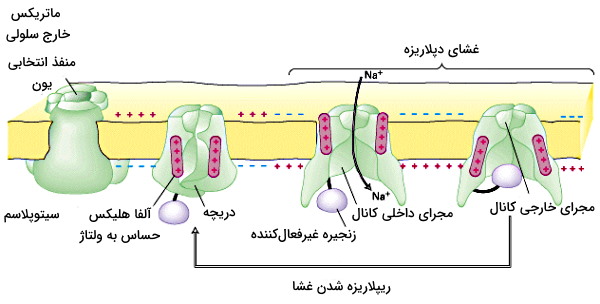
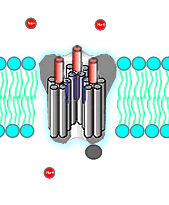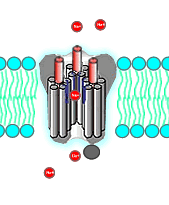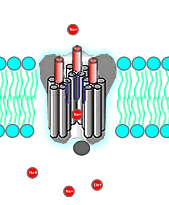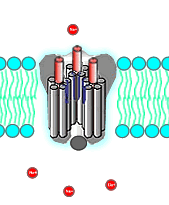
کانالهای یونی پروتئینهای عرض غشایی با یک بخش آبدوست (بین گروههای فسفات غشای دولایه) و آبگریز (بین اسیدهای چرب فسفولیپیدها) هستند و وظیفه آنها تبادل یونها بین ماتریکس خارج سلولی و سیتوپلاسم است. کانالهای ولتاژی سدیم یکی از انواع این کانالها در غشای سلولهای تحریکپذیر (ماتریکس خارج سلولی، ماهیچهها و نورواندوکرین) است که از یک زیرواحد آلفا و دو زیرواحد بتا تشکیل میشود.
- زنجیرههای پروتئینی زیرواحد آلفا شش بار از عرض غشا عبور میکند و چهار زیرواحد آلفا مجرا، دریچه فعال و غیرفعال کردن کانال را تشکیل میدهد.
- دریچه فعالکننده کانال بخشی از زیرواحدهای آلفا با توالی آمینواسیدهای آرژنین (اسیدی) است که تغییر بار الکتریکی آنها در پاسخ به تغییرات پتانسیل الکتریکی غشا با تغییر کنفورماسیون زنجیره پلیپپتیدی و باز شدن مسیر حرکت یونهای سدیم همراه است.
- دریچه غیرفعالکننده کانال بخش درونسلولی از زنجیره پلیپپتیدی است که با تغییر پتانسیل الکتریکی دهانه داخلی کانال را مسدود میکند.
- زنجیرههای گلیکوپروتئینی زیرواحد بتا یکبار از غشا عبور میکنند و بخشهای کمکی کانال را تشکیل میدهد. این زیرواحدها به مولکولهای ماتریکس خارج سلولی و اسکلت سلولی متصل میشوند و به قرار گرفتن ساختار کلی کانال در غشای پلاسمایی کمک میکند.
توالی آمینواسیدی و ساختار سهبعدی کانالهای سدیم، این پروتئینها را به مجرای اختصاصی عبور یون یون تبدیل میکند. توالی آمینواسیدهای منفی (گلوتامیکاسید) از ورود آنیونهایی مثل کلر به کانال جلوگیری میکند. به علاوه قطر بخشهای داخلی کانال بین ۰٫۳ تا ۰٫۵ نانومتر و فقط به اندازه عبور یون سدیم و مولکول آب همراه آن است.
نقش کانال ولتاژی سدیم
سدیم و پتاسیم دو یون مهم در تعیین پتانسیل الکتریکی غشای پلاسمایی تمام سلولهای بدن هستند و انتقال این دو یون بر اساس شیب الکتروشیمیایی از کانالهای همیشهباز پتانسیل فیزیولوژیک غشا را تعیین میکند. اما کانالهای دریچهدار ولتاژی سدیم با تغییر جریان یون سدیم و دپلاریزه کردن غشا به ایجاد پتانسیل عمل و انتقال پیام الکتریکی بین سلولها کمک میکنند.
کنفورماسیون دریچه کانال ولتاژی سدیم در پاسخ به تغییرات پتانسیل الکتریکی غشای سلولهای نورون ی، ماهیچهها و سلولهای نورواندوکرین بین سه حالت باز، بسته و غیرفعال تغییر میکند.
- حالت بسته: در حالت استراحت غشا که پتانسیل الکتریکی غشای نورون حدود ۷۰- میلیولت است، دریچه این کانالها در حالت بسته قرار دارد و سدیم بین سیتوپلاسم و ماتریکس خارج سلولی بهوسیله کانالهای همیشهباز و پمپ سدیم-پتاسیم منتقل میشود.
- حالت باز: تغییر پتانسیل غشا از ۵۰- به صفر منجر به تغییر کنفورماسیون زیرواحد آلفای کانال و باز شدن مسیر یونهای سدیم به سیتوپلاسم میشود. ورود یون سدیم به سیتوپلاسم با دپلاریزه شدن غشا همراه است.
- حالت غیرفعال: زمانی که پتانسیل غشا به ۳۰+ میلیولت برسد، کنفورماسیون بخش دیگری از زنجیره پلیپپتیدی زیرواحد آلفا تغییر کرده و دریچه کانال بسته میشود.
کانالهای ولتاژی پتاسیم دسته دوم کانالهای غشایی سلولهای تحریکپذیر هستند که کنفورماسیون آنها در پاسخ به تغییرات الکتروشیمیایی سلول، تغییر میکند. پتانسیل آستانه باز شدن دریچه این کانالها با پتانسیل غیرفعال شدن کانال سدیمی برابر است. در نتیجه باز شدن کانالهای ولتاژی پتاسیم منجر به خروج این کاتیون از سیتوپلاسم ریپلاریزه شدن غشای پلاسمایی میشود. کاهش پتانسیل غشا و منفیتر شدن سیتوپلاسم منجر به تغییرات کنفورماسیونی آهسته در بخش دیگر زیرواحد آلفا و بسته شدن دریچه کانال پتاسیمی میشود. در این وضعیت پتانسیل غشا ۹۰- میلیولت است که با فعالیت پمپ سدیم-پتاسیم به ۷۰- (پتانسیل استراحت) برمیگردد.
تفاوت کانال لیگاندی و ولتاژی سدیم
کانالهای لیگاندی انواعی از ناقلهای غشایی هستند که کنفورماسیون آنها در پاسخ به اتصال یک مولکول تغییر کرده و باز یا بسته میشوند. این کانالها مثل کانالهای دریچهدار ولتاژی از زنجیرههای پپلیپپتیدی عرض غشایی با بخشهای هیدروفوب و هیدروفیل تشکیل شدهاند.
کانالهای لیگاندی سدیم یا گیرندههای نیکوتینی از پنج زنجیره پلیپپتیدی تشکیل شده است که هر زنجیره چهار بار از عرض غشای عبور میکند. انتهای C و N (دومین اتصالی به لیگاند) این زنجیره خارج سلول قرار دارد. این کانالها برخلاف کانالهای ولتازی سدیم اختصاصی نیستند. در نتیجه همزمان با سدیم، کلسیم وارد سلول و پتاسیم از سلول خارج میشود. اما انتقال یون سدیم از دو یون دیگر بیشتر است.
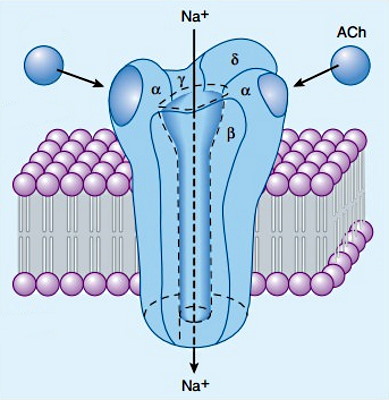
این کانالها در غشای نورونهای دستگاه عصبی مرکزی، ماهیچههای اسکلتی و رشتههای عصبی پاراسمپاتیک و سمپاتیک قرار دارند. اتصال دو انتقالدهنده عصبی استیل کولین به دومین اختصاصی این گیرندهها با ورود یون سدیم به سیتوپلاسم، تغییر پتانسیل الکتریکی سلول، باز شدن کانالهای ولتاژی سدیم، ایجاد پتانسیل عمل و انتقال جریان عصبی از سلول پیشسیناپسی (نورون) به سلول پسسیناپسی (نورون یا ماهیچه) همراه است. دریچه این کانالها پس از جدا شدن لیگاند بسته میشود.
تفاوت کانال ولتاژی و نشتی سدیم
کانالهای یونی نشتی یا بدون دریچه ناقلهای غشایی هستند که نفوذپذیری غشای سلولی به یونها را افزایش میدهند. این کانالها برخلاف کانالهای ولتاژی ولتاژی و لیگاندی سدیم از یک زنجیره پلیپپتیدی عرض غشایی با ۲۴ هلیکس عرض غشایی تشکیل شدهاند.
انتقال یونها از این ناقلها به تغییر پتانسیل الکتریکی سلول یا اتصال لیگاند به زیرواحدهای پروتئینی وابسته نیست. انتقال یونها در این کانالها بر اساس شیب الکتروشیمیایی و از پتانسیل الکتروشیمیایی بیشتر به کمتر است. در شرایط فیزیولوژیک غلظت یون سدیم در ماتریکس خارج سلولی و پتاسیم در سیتوپلاسم بیشتر است. به همین دلیل سدیم با عبور از این کانالها وارد سلول میشود.
کانال های سدیمی اپیتلیال
کانالهای سدیمی اپیتلیال هتروتریمرهای اختصاصی یون سدیم هستند. تعداد این کانالها در غشای نفرون کلیه (لوله جمعکننده ادرار)، ریه، پوست، مجاری تولیدمثلی و کولون از اندامهای دیگر بیشتر است و به بازجذب سدیم از مجاری کمک میکند. بازجذب سدیم از این کانالها با تغییر فشار اسمزی و بازجذب آب همراه است. ترکیبات ادرارآور این کانالها را مهار میکند.
تغییر فعالیت کانال سدیم
بسیاری از بیماریهای دستگاه عصبی و ماهیچهها با تغییر فعالیت کانالهای ولتاژی و لیگاندی سدیم درمان میشود. تغییر فعالیت کانالها با تجویز داروهایی انجام میشود که رفتار مولکولهای طبیعی بدن (آگونیستها) را تقلید یا این مولکولها را مهار (آنتاگونیستها) میکنند.
برای مثال آگونیستهای استیل کولین تمایل بیشتری به دومین اتصالی این مولکول طبیعی دارند، به همین دلیل زمان باز ماندن کانال یا دفعات باز شدن ان را تغییر میدهند. آنتاگونیستها با اتصال به دومین استیل کولین، اتصال این مولکول به دومین و باز شدن کانال را مهار میکنند. از این مکانیسم برای کاهش درد، درمان صرع، بیماریهای عصب-عضله، بیماریهای قلبی و بیماریهای تنفسی استفاده میشود.
کاهش درد
بسیاری از تغییرات شیمایی و آسیبهای فیزیکی ایجاد شده در اندامها به شکل درد در بدن حس میشود. این محرکها پتانسیل الکتریکی نورونهای حسی محیطی (گیرندههای درد) را تغییر میدهند. پتانسیل عمل ایجاد شده در نخاع از راه کانال ولتاژی سدیم نورونهای حسی دوم و از این نورونها به بخشهای بالایی سیستم عصبی مرکزی منتقل میشود. مهار این کانالها، انتقال جریان الکتریکی و حس درد را مهار میکند. داروهای بیحسی موضعی، داروهای ضدآریتمی کلاس I، داروهای ضدتشنج و بعضی داروهای ضدافسرگی با مهار کانال ولتاژی یا لیگاندی سدیم و مهار نورونها بیماری را درمان میکند.
داروهای ضدافسردگی و ضدتشنج ترکیبات هیدروفوبی هستند که نفوپذیری زیادی در بافتهای عصبی مرکزی دارند. این مهارکنندهها غیرانتخابی کانال ولتاژی سدیم در نورونهای حسی محیطی و نورونهای سیستم عصبی مرکزی را با اتصال به زیرواحد آلفا مهار میکنند.
درمان صرع
GABA (گاما آمینوبوتیریک اسید) انتقالدهنده عصبی اصلی در نورونهای مهاری سیستم عصبی مرکزی است. جهش ژن کانال ولتاژی سدیم در نورونهای ترشحکننده GABA، تغییر گیرنده نورون پسسیناپسی این انتقالدهنده عصبی و تغییر عملکرد ناقل غشایی بازجذب این مولکول با تحریک غیرطبیعی نورونها و ایجاد تشنج یا صرع همراه است.
داروهای ضدتشنج با دریچه کانالهای سدیمی در حالتهای مختلف برهمکنش میدهند و تحریک سلولهای پسسیناپسی را مهار یا ترشح انتقالدهنده عصبی GABA از نورون پیشسیناپسی را تحریک میکنند. برای مثال فنیتوئین و کاربامازپین مهارکنندههای غیرانتخابی کانال ولتاژی سدیم هستند که دریچه کانال را در حالت غیرفعال نگه میدارند. اما لاکوزامید با اتصال به دریچه بسته کانالهای سدیمی باز شدن آهسته این دریچه، ایجاد پتانسیل عمل، آزاد شدن GABA و مهار نورون پسسیناپسی را تحریک میکند.
بیماری های ماهیچه
فلج دورهای، پارامیوتونیای بدوتولد و سندروم میاستنیک به دلیل جهش در دویمن حساس به ولتاژ یا مجرای کانال ولتاژی سدیم در سیناپس عصب-عضله ایجاد میشود. در این بیماریها افزایش تحریک عصبی با انقباض غیرطبیعی ماهیچه و ضعف آن همراه است. کاتیونهای دوظرفیتی باریوم، روی و کلسیم با اتصال به دریچه کانال و تغییر کنفورماسیون آن، ایجاد پتانسیل عمل و انقباض ماهیچه را مهار میکند.
بیماری های قلب
سندروم QT طولانی یکی از بیماریهای قلبی است که به دلیل جهش در ژن کانال ولتاژی سدیم در ماهیچه قلبی یا در اثر بیماریهای دیگر ایجاد میشود. جهشهای مختلف این سندروم منجر به کاهش سرعت بسته شدن دریچه کانالهای سدیمی یا تغییر ساختار آن میشود. در نتیجه انقباض نامنظم بطنها، ضربان قلب را تغییر میدهد. داروهای درمان آریتمی قلب سرعت باز و بسته شدن دریچه کانال را تغییر میدهند (داروهای آریتمی کلاس I) یا عبور یون سدیم را مهار میکنند. به علاوه مهارکنندههای غیرانتخابی کانال ولتاژی سدیمی که برای درمان بیماریهای دیگر تجویز میشود با اثر بر کانالهای سدیمی میوکارد، ضربان قلب را تغییر میدهد.
بیماری های تنفسی
سرفه یکی از انعکاسهای طبیعی سیستم تنفسی است که به دلیل تحریک گیرندههای حسی لولههای تنفسی (نای و نایژهها) و انتقال پیام عصبی بهوسیله عصب واگ ایجاد میشود. این مکانیسم برای خارج کردن ذرات مزاحم ایجاد میشود. اما تغییرات ایجاد شده به دلیل بسیاری از بیماریها این انعکاس را فعال میکند. از مهارکنندههای کانال ولتاژی سدیم برای درمان این اختلال استفاده میشود. داروهای بیحسی موضعی و مخدرها (کودئین) ازجمله ترکیباتی هستند که با مهار کانالهای سدیمی از ایجاد پتانسیل عمل و انعکاس سرفه را مهار میکنند. مطالعه مطلب دستگاه تنفس انسان از مجله فرادرس به آشنایی بیشتر شما با عملکرد بخشهای مختلف این دستگاه کمک میکند.
سوالات متدوال
در این بخش به تعدادی از سوالات متداول پیرامون کانالهای یونی پاسخ میدهیم.
انواع کانال های دریچه دار کدام است ؟
کانالهای دریچهدار پروتئینهای غشایی هستند که مسیری برای عبور یونها از غشای پلاسمایی ایجاد میکنند. در ساختار این کانالها بخشی وجود دارد که تغییر کنفورماسیون آن سبب باز یا بسته شدن کانال میشود و به انواع کانالهای دریچهدار لیگاندی، ولتاژی و دمایی تقسیم میشوند.
دریچه کانالهای لیگاندی به دلیل اتصال مولکولهای تنظیمی، دریچه کانالهای ولتاژی به دلیل تغییر پتانسیل الکتریکی سلول و دریچه کانالهای دمایی با تغییر دمای محیط باز میشود. کانالهای لیگاندی در غشای سلولهای تحریکپذیر قرار دارند و جایگاه تنظیمی آنها به GABA، استیل کولین یا ATP متصل میشود. کانالهای پروتئینهای غشایی هستند که کنفورماسیون آنها در پاسخ به تغییرات دما باز میشود.
تفاوت کانال های ولتاژی چیست؟
در غشای پلاسمایی سلولهای پستانداران علاوه بر کانالهای ولتاژی سدیم، کانالهای حساس به ولتاژ پتاسیم، کلر و کلسیم وجود دارد. ساختار کلی این کانالها شبیه کانالهای ولتاژی سدیم از زیرواحد آلفا، بتا، دریچه فعالکننده و دومین غیرفعالکننده تشکیل شده است. اما قطر داخلی کانال و عملکرد آنها متفاوت است.
زیرواحد آلفا در کانالهای ولتاژی سدیم و کلسیم یک زنجیره پلیپپتدی است که چهار بار از عرض غشا عبور میکند و مجرای کانال را تشکیل میدهد. اما مجرای کانال ولتاژی پتاسیم از چهار زیرواحد آلفا با یک دومین عرض غشایی تشکیل میشود. توالی آرژینین حساس به تغییرات ولتاژ در این کانالهای ولتاژی سدیم، پتاسیم و کلسیم کاملا مشابه است.
ساختار انتهای سیتوپلاسمی کانال پتاسیم فقط به این یون اجازه عبور از غشار را میدهد. گروههای کربونیل باقیماندههای آمینواسیدی در این ساختار با پتاسیم برهمکنش داده و انحلال و عبور این یون را تسهیل میکنند. اندازه کوچک یون سدیم، فاصله این یون با گروههای کربونیل را افزایش داده و از برهمکنش آنها جلوگیری میکند.
کانالهای ولتاژی کلسیم در غشای پایانه آکسون نورونهای پیشسیناپسی و سلولهای ماهیچهای غدد فوق کلیه جریان مجرایی برای ورود یون کلسیم به سیتوپلاسم ایجاد کرده و با تغییر غلظت کلسیم انقباض ماهیچه، اگزوسیتوز انتقالدهنده عصبی، بیان ژنها یا ترشح هورمون را تحریک میکنند.
برخلاف سایر کانالهای ولتاژی، کانالهای ولتاژی کلر از ۱۰ تا ۱۲ هلیکس عرض غشایی تشکیل شده است. این کانالهای غیراختصاصی علاوه بر یون کلر به انتقال آنیونهای بیکربنات، نیترات و سیانید کمک میکنند و در حفظ ایجاد پتانسیل استراحت و تعیین حجم سلول نقش مهمی دارند.