غلظت محلول ها و واحدهای آنها — به زبان ساده

در این مطلب از مجله فرادرس در مورد غلظت محلولها و واحدهای آنها صحبت میکنیم. برای تعریف دقیق یک محلول، بهتر است غلظت آن را بیان کنیم. به عبارت دیگر باید ذکر کنیم که چه میزان حلشونده در مقدار مشخصی حلال، حل شده است. عباراتی مانند «رقیق» یا «غلیظ» به منظور توصیف مقدار ماده حل شده در محلولها بکار میروند. اما این عبارات، نسبی هستند و معنای دقیقی بدست نمیدهند.
مقدمه
غلظت، معیاری برای سنجش میزان اختلاط یک ماده، در مادهای دیگر است. محلولها میتوانند رقیق یا غلیظ باشند. به طور مثال وقتی میگوییم سرکه، محلول ۵ درصد استیک اسید در آب است، در حقیقت غلظت آن را ذکر کردهایم. اگر این میزان به ۱۰ درصد افزایش پیدا کند، محلول مورد نظر غلیظتر از سرکه است.
یک محلول غلیظ، محلولی است که مقادیر زیادی از حل شونده در مقدار مشخصی از حلال در آن حضور دارند. در مقابل، محلول رقیق، محلولی است که مقادیر حلشونده در آن برای مقدار مشخصی از حلال، کم باشد.
همانطور که اشاره شد، عبارات غلیظ و رقیق برای توصیف کیفی محلولها مورد استفاده قرار میگیرند اما نیاز داریم تا روشهایی برای توصیف کمی محلولها پیدا کنیم.
درصد جرمی
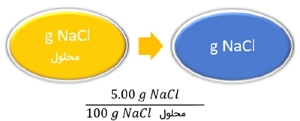
روشهای مختلفی برای توصیف غلظت یک محلول از طریق درصد وجود دارد. درصد جرمی (جرم/جرم) به صورت جرم حلشونده به جرم محلول توصیف میشود:
100 × جرم محلول \ جرم حلشونده = درصد جرمی
جرم حلشونده + جرم حلال = جرم محلول
اگر بتوانید جرمهای حلشونده و حلال را اندازهگیری کنید، تعیین درصد جرمی ساده است. فراموش نکنید که هر کدام از اجزا باید با یک واحد تعریف شوند تا غلظت مورد نظر عدد درستی باشد.
مثال
فرض کنید محلولی با حل کردن 25 گرم شکر در 100 گرم آب تهیه کردهایم. جرم محلول عبارتست از:
125 گرم = ۱۰۰ گرم آب + ۲۵ گرم شکر
درصد جرمی محلول نیز به صورت زیر محاسبه میشود:
محلول شکر ۲۰٪ = 100 × (125 گرم محلول / ۲۵ گرم شکر) = درصد جرمی

استفاده از درصد جرمی در محاسبات
در مواقعی ممکن است بخواهید محلولی با درصد جرمی مشخص بسازید و نیاز به محاسبه میزان مورد نیاز جرم ماده حل شونده داشته باشید. درصد جرمی را میتوان به عنوان ضریب تبدیل با شکل زیر در نظر گرفت:
گرم حلشونده / 100 گرم محلول یا 100 گرم محلول / گرم حلشونده
به طور مثال، اگر نیازمند تهیه 3000 گرم از یک محلول ٪۵ سدیم کلرید باشید، نیاز به تعیین جرم حلشونده دارید:
- معلوم: 3000 گرم محلول ٪۵
- مجهول: جرم حل شونده = ؟ گرم
- ضریب تبدیل = 100 گرم محلول / 5گرم
برای حل این مثال کافی است تا جرم محلول در ضریب تبدیل ضرب شود:
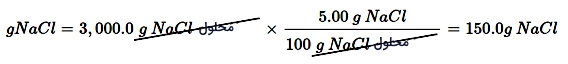
مولاریته
«مولاریته» (Molarity)، معمولترین واحد غلظت در محلولها و همچنین به دلیل اینکه این واحد، استوکیومتری واکنشها را نیز شامل میشود، استفاده از آن بسیار پرکاربرد است. مولاریته به صورت تعداد مول حل شونده در ۱ لیتر محلول تعریف و به طور مشابه، این واحد به صورت میلیمول حلشونده به ۱ میلیلیتر محلول نیز تعریف میشود.
در نتیجه واحد مولاریته، مول بر لیتر است که به اختصار با حرف نمایش داده میشود. به طور مثال، ۱ مول ساکاروز (342 گرم) در میزان کافی از آب که در نهایت حجم یک لیتر از محلول را بدست دهد دارای غلظت یا 1 مولار است. در شیمی، برای نمایش غلظت محلولها از کروشه استفاده میکنند. به طوریکه فرمول مولکولی یا نام ماده در داخل کروشه قرار بگیرد. مانند مثال زیر:
= [ساکاروز]
خوانش مثال بالا به این صورت است: غلظت ساکاروز، ۱ مولار است.
رابطه بین حجم، مولاریته و مول به شکل زیر قابل تعریف است:
غلظتها در آزمایشگاه معمولا بر اساس نسبتهای جرم به جرم یا جرم به حجم بیان میشوند.

واحدهای دیگر
در جدول زیر، واحدهای غلظت، نماد و نحوه محاسبه آن آورده شده است:
| نام | نماد | تعریف |
| مولاریته | تعداد مول حلشونده به یک لیتر محلول | |
| غلظت جرمی | یا | تعداد مول حلشونده به حجم محلول |
| نرمالیته | گرم حلشونده به یک لیتر محلول | |
| مولالیته | تعداد مول حلشونده به جرم (۱ کیلوگرم) حلال | |
| درصد جرمی | جرم حلشونده به جرم محلول ضربدر 100 | |
| غلظت حجمی | بدون واحد | حجم حلشونده به حجم مخلوط |
| عدد غلظت | تعداد ذرات (اتم، مولکول و ...) یک ترکیب به کل حجم مخلوط | |
| درصد حجمی | حجم حلشونده به حجم محلول ضربدر ۱۰۰ | |
| کسر مولی | تعداد مول حلشونده به کل مولها در مخلوط | |
| نسبت مولی | تعداد مول حل شونده به تعداد کل مولها (به جز حلشونده) در مخلوط | |
| کسر جرمی | جرم یک جزء به جرم کل مخلوط | |
| نسبت جرمی | جرم حلشونده به جرم کل (به جز حلشونده) | |
| قسمت در میلیون | ||
| قسمت در میلیارد |
برخی واحدها ممکن است به یکدیگر تبدیل شوند اما در تبدیل واحدها بهتر است که واحدهای حجمی به جرمی تبدیل نشوند چراکه حجم از دما تاثیر میگیرد.
تعریف سختگیرانه غلظت
در برخی متون علمی، همه واحدهای ارایه شده در بالا به عنوان تعریف غلظت در نظر گرفته نمیشوند بلکه تنها غلظت جرمی، غلظت مولی و غلظت حجمی به عنوان واحدهای صحیح در بیان این کمیت توصیه شدهاند.
غلیظ در مقابل رقیق
همانطور که گفته شد، عباراتی همچون غلیظ و رقیق نیز در توصیف کیفی محلولها بکار میروند. یک محلول غلیظ، تا جایی که میتواند در خود ماده حلشونده دارد. شیمیدانها ترجیح میدهند به این نوع از محلولها نام «اشباع» (Saturated) را اختصاص بدهند. در مقابل، برای تعداد کم ذرات حلشونده در محلول از عبارت رقیق استفاده میکنند.
برای غلیظ کردن یک محلول، باید مقدار بیشتری از حلشونده در داخل آن حل شود یا اینکه مقادیری از حلال کم شود. اگر محلول، فرار نباشد، با تبخیر یا جوشاندن، میتوان آن را غلیظ کرد.
به منظور رقیقسازی محلولها میتوان به محلولهای غلیظ، حلال اضافه کرد. تبدیل محلولهای غلیظ، به محلولهای رقیقتر، یک روش معمول در آمادهسازی محلولها است. همچنین این روش، نتیجه دقیقتری در مقابل با به غلظت رساندن محلولهای رقیق دارد؛ چراکه سنجش مقادیر کم از حلشونده دشوار خواهد بود.

غلظت یونها در محلول
برای توضیح غلظت یونها در یک محلول، واکنش حل شدن آمونیوم دیکرومات را در آب نظر بگیرید:
$$(NH_4 )_2 Cr_2 O_7 (s) \xrightarrow {H_2 O(l)} 2NH_4^+ (aq) + Cr_2 O_7^{2-} (aq)\label{4.5.5}$$
آمونیوم دیکرومات به عنوان ترکیبی یونی شناخته میشود که در هر مول از واحد فرمولی خود شامل یونهای و است. همانند دیگر ترکیبات یونی، این ترکیب نیز در دستهبندی الکترولیتهای قوی قرار میگیرد که به هنگام حل شدن در محلول آبی به یونهای تشکیل دهنده خود تفکیک میشود. در نتیجه، طبق واکنش بالا، هر مول آمونیوم دیکرومات به هنگام حل شدن در آب، یک مول و ۲ مول تولید میکند.
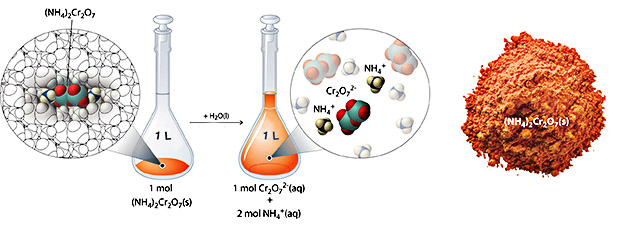
بنابراین، به هنگام محاسبات غلظت یونها در یک محلول باید واحد فرمولی آن و همچنین واکنش انحلال آنرا بدانیم. به طور مثال، به هنگام انحلال آمونیوم دیکرومات در آب، هر مول از آن به هنگام حل شدن، ۳ مول یون محلول در آب تولید میکند، یعنی اگر محلولی با غلظت از آمونیوم دیکرومات داشته باشیم، غلظت کل یونهای محلول عبارتست از:
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر از سایت و مجله فرادرس نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش محلول سازی در آزمایشگاه
- سرعت واکنش -- به زبان ساده
- خوردگی فلزات در شیمی — به زبان ساده
^^












سلام. وقت بخیر
ببخشید اگه پودری داشته باشیم که پودر مورد نظر شامل ذرات نانو و ذرات بزرگتر باشه وقتی در آب حل بشه اولویت حل شدن ذرات پودر در آب با ذرات نانو هست یا بزرگتر؟
پیشاپیش از پاسخگوییتان ممنونم.
با سلام،
نانوذرات در مقایسه با ذرات بزرگتر تمایل بیشتری به حل شدن یا پخش شدن در آب دارند. دلیل این موضوع به تفاوت سطح موثر و جرم دو نوع ذره مربوط میشود. نانوذرات نسبت سطح به حجم بزرگتری دارند. از اینرو، برهمکنش بیشتر و موثرتری با مولکولهای آب خواهند داشت و سریعتر در آب حل یا پخش میشوند.
در مقابل، ذرات بزرگتر نسبت سطح به حجم کوچکتری دارند. بنابراین، برهمکنش آنها با مولکولهای آب کمتر خواهد بود و مدت زمان بیشتری طول میکشد تا در آب حل یا پخش شوند. این نکته را به خاطر داشته باشید که ویژگیهای دیگر ذرات مانند ترکیب، پوشش سطحی و برهمکنش با مولکولهای آب نیز بر حلالپذیری آنها در آب تاثیر میگذاد.
با تشکر از همراهی سما با مجله فرادرس
غلظت خون چند برابر آب است؟
سلام میخوام بدونم که وقتی یک مایع را رقیق میکنیم آیا چگالی اون تغییر میکنه؟مثلا دانسیته اسیدسولفوریک تجاری1/98حالا اگر از اون اسیدسولفوریک 4مولار تهیه کیم آیا چگالی تغییر کرده؟
سلام و روز شما بهخیر؛
برای پاسخ به این سوال باید مروری بر مفهوم چگالی داشته باشیم. چگالی، جرم موجود از یک ماده در واحد حجم است، یعنی برای محاسبه چگالی جرم (برجسب کیلوگرم) را بر حجم ( برحسب متر مکعب) تقسیم میکنیم. در اینصورت با هر تغییری در جرم و حجم، چگالی نیز تغییر پیدا خواهد کرد. با رقیق کردن یک مایع، حجم آن زیاد میشود و مخرج این کسر بزرگ خواهد شد. در نتیجه مقدار چگالی کاهش پیدا میکند. عکس این مورد نیز صادق است. بهصورتی که با کاهش حجم، مخرج کسر کوچک میشود و مقدار چگالی افزایش پیدا میکند.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
سلام وقت بخیر
یه سوالی داشتم، ایا غلظت عسل 2% که به صورت حجمی/حجمی تهیه شده است با غلظت عسل 2 % که به صورت وزنی/حجمی تهیه شده است یکسان است؟
سلام
وقتی میگیم محلول 30 درصد آبی یعنی 30 تا حل شونده داریم 70 تا آب، یا 30 تا حل شونده در 100 تا آب؟
با سلام؛
برای پاسخ به این سؤال پیشنهاد میکنیم مطلب «تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام وقت بخیر و خسته نباشید
ببخشید یه سوالی خیلیی ذهنم رو درگیر کرده
الان ما برای بیان غلظت یک محلول از جرم یا حجم استفاده میکنیم مثل درصد جرمی
اما مگه ما با مول حل شونده در مول مشخصی از حلال برای بیان غلظت کار نداریم ؟
مثلا اگه دو ماده مختلف داشته باشیم که جرم مولی متفاوت داشته باشند و از هر کدام از این دو ماده مقدار مول یکسانی را در مقدار مشخصی حلال (مثلا اب) حل کنیم ، در این صورت مول حل شونده در مقدار مشخصی حلال برای هر دو محلول یکسانه ولی خب جرم حل شونده یکسان نیست
الان ما طبق درصد جرمی میگیم غلظت ها متفاوته ولی مگه در حقیقت این دو محلول یک غلظت ندارند؟
خیلی ممنون میشم جواب بدید
سلام
ببخشید من متوجه نمی شم چرا درصد جرمی یک حل شونده در محلول به مقدار جرم محلول بستگی نداره؟؟
با سلام؛
در داخل متن، چنین جملهای نوشته نشده است.
با تشکر از همراهی شما با مجله فرادرس
با سلام؛
تنها راه درک این موضوع، بررسی مجدد مثالهای حل شده و بحثهای مربوط به استوکیومتری است. پیشنهاد میکنیم برای درک بهتر، مطالب زیر را نیز مطالعه کنید.
نرمالیته چیست؟ — به زبان ساده
مولاریته چیست؟ — به زبان ساده
مولالیته چیست ؟ — به زبان ساده
استوکیومتری — به زبان ساده (+ دانلود فیلم آموزش گام به گام)
با تشکر از همراهی شما با مجله فرادرس
سلام ،ممنونم بابت مطالب مفیدی که گزاشتید، یک سوال داشتم میخواستم ببینم برای تبدیل یک محلول ۵۷٪ به محلول ۲۰٪ از چه روشی استفاده کنم که دقیق تر باشه؟…
با سلام؛
برای آشنایی با این موضوع پیشنهاد میکنیم مطلب «تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
فرمول غلظت محلول چیست
سلام ببخشید میشه بگین در مسئله های انحلال پذیری با روش تناسب چطوری جرم حلال رو بدست بیاریم
سلام
نیم میلی لیتر سدیم کلرید 0.1 داریم و اینو با ۴.۵ میلی لیتر آب مقطر حل میکنیم. محاسبه غلظت سدیم کلرید در این محلول چگونه است؟
نیم میلی لیتر سدیم کلرید 0.1 مساوی 0.0005 گرم سدیم کلرید در حجم نیم میلی لیتره؟
بعد این مقدار گرمو تقسیم بر حجم پنج میلی لیتر کنیم غلظت بدست میاد؟
باورم نمیشه تا این شیمیو فراموش کردم:/
با سلام؛
پیشنهاد میکنیم برای مرور این موضوعات، مطلب «تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام یه سوال داشتم
درصد جرمی چه ربطی به حجم مواد داره؟و چرا درصد جرمی استیک اسید 100درصد هستش منظور از این عبارت چیه نمیشه که اصلن مولکول های اب وجود نداشته باشه
4.9 گرم اسيد سولفوريک خالص در مقداری آب حل شده و حجم کل محلول به cc 250 رسيده مولاريته محلول را حساب کنيد (M=98 gr/mol).
با سلام؛
در رابطه با سوال اول باید گفت که در رابطه درصد جرمی، جرم مواد دخیل است. همچنین، آنچه که به طور معمول در محلولها مطرح میشود، شامل «محلولهای آبی» (Aqueous Solution) است. محلولهای غیرآبی (non aqueous Solution) محلولهایی هستند که حلال آنها آب نیست. استیک اسید خالص نیز جرمی همچون یخ دارد و موسوم به استیک اسید خالص یا «Glacial» است.
با تشکر از همراهی شما با مجله فرادرس
مخلوطی از حل کردن پنجاه میلی لیتر آب و پنجاه میلی لیتر اتانول چگونه حلال وحل شونده را کنم؟؟
با سلام؛
در این رابطه نظر قطعی وجود ندارد چراکه آب و اتانول امتزاجپذیر هستند و با هر نسبتی با یکدیگر مخلوط میشوند. البته به طور کلی و با توجه به شرایط میتوان گفت که آب نقش حلال را دارد چراکه یک حلال «همهکاره» (Universal) به شمار میآید. با این وجود، خواندن مطالب زیر را برای درک بیشتر محلولسازی و حلال و حلشونده پیشنهاد میکنیم.
«حلال و حل شونده در شیمی | به زبان ساده»
«تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده»
با تشکر از همراهی شما با مجله فرادرس
سلام
میخوام از محلول اسید سولفوریک 97 درصد، اسید 64 درصد جرمی/جرمی اماده کنم. از فرمول خاصی واسه تبدیل باید استفاده کنم؟
سلام ی تست داشتم حل میکردم که تغییر غلطت فرآورده مایع رو حساب کرده بود …مگه نمیگفتیم تغییر غلطت مایع و جامد صفره؟
با سلام؛
برای پاسخ به این سوال پیشنهاد میکنیم مطلب «تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام یک سوال دارم:
چرا درصنعت،برای محلول های با حجم زیاد؛استفاده از واحد مولالیته معمول تر از مولاریته است؟
باسلام جواب این سوال را برام می فرستید.
محلولی دارای 0.5مول اتانول در . 1000گرم آب است موارد زیر را محاسبه کنید.
-الف مولالیته محلولg.cm-3 =1چگالی محلول و ( =46الکل) M
-ب مولاریته محلول
-ج کسر مولی اتانول در آب
سلام، خیلی ممنون از این زیبایی توضیح تان
سوالم این بود که اگر بخواهیم از الکل 96%، الکل 10 درصد بسازیم یعنی رقیق نمائیم، این محاسبه را چگونه انجام دهیم؟؟
با احترام
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. برای رقیقسازی محلولها مطلب جامعی با نام «تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده» آماده کردهایم که میتوانید آنرا مطالعه کنید.
با تشکر
سلام
من یه ماده با غلظت 10پیکو مولار دارم که مقادیر مختلفی از اون رو در واکنش ها استفاده کردم مثلا 10، 20 و 30 میکرولیتر. حالا سوالم اینه که میتونم بجای اینکه بگم 20 میکرولیتر از محلول 10 پیکومولار استفاده کردم بگم 10 میکرولیتر از محلول با غلظت 20 پیکومولار استفاده کردم؟ یعنی در بیان مسئله از مقدار محلول کم کنم به غلظت اضافه کنم
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. با توجه به اینکه دیمانسیون لیتر و محلول مولار یکسان نیست، این امکان وجود ندارد اما برای آشنایی بیشتر پیشنهاد میکنیم مطالب زیر را مطالعه کنید:
«تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده»
«دیمانسیون — هر آنچه باید بدانید»
با تشکر
اگر شناسه گر نداشته باشیم چجوری میتونی غلظت محلول و حساب م
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزازیم. برای محاسبه غلظت، بهترین راه استفاده از تعاریف مختلف است. همچنین برخی روشها همچون کروماتوگرافی نیز میتوانند در تغیین غلظت، کمک کننده باشند.
با تشکر
سلام چرا با اینکه غلظت برای توصیف محلول بکار میره ما از غلظت مولاریته برای گازها و مایعات خالص نیز استفاده میکنیم مثلا میگم اب خالص ۵۵.۶ مولاریته است
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. با وجود اینکه از مولاریته برای تعریف غلظت محلولها استفاده میشود اما میتوان مفهوم آنرا برای یافتن تعداد مول ماده در یک لیتر نیز استفاده کرد. به طور مثال، میتوانیم با مفهوم مولاریته، تعداد مول موجود در یک لیتر آب را محاسبه کنیم. برای گازها اما باید شرایط دما و فشار در نظر گرفته شود یعنی یک مول گاز در شرایط STP، حجمی معادل ۲۲/۴ لیتر اشغال میکند.
با تشکر
سلام
یه سوال دارم
اگه ۲ میلی لیتر پراکسید۳۰برداریم و به ۳ میلی لیتر پراکسید ۲۵درصد اضافه کنیم و حجم محلول نهایی رو به ۱۰۰ میلی لیتر برسونیم.الان۱۰۰ میلی لیتر محلول چند درصد داریم؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. برای آشنایی با نحوه حل این نوع از سوالات پیشنهاد میکنیم مطلب «تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده» را مطالعه کنید.
با تشکر
سلام
چرا در دو حالت زیر از مولالیته به جای مولاریته استفاده می شود؟
الف)حل شونده گاز باشد
ب) حجم محلول خیلی بالا
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. مولایته به تعداد مول حلشونده در هر کیلوگرم از حلال میگویند. مولاریته به تعداد مولهای حلشونده در هر لیتر از محلول گفته میشود. اگر حلال، آب و محلولی با غلظت پایین داشته باشیم، مولالیته و مولاریته تقریبا با یکدیگر برابر هستند. با افزایش غلظت محلول و اضافه شدن حلالی به غیر آب، یا وجود تغییر دما (و در نتیجه، تغییر چگالی حلال)، از مولالیته استفاده میشود که این موارد در حجمهای بالا و انحلال گاز، بیشتر مشخض میشوند.
با تشکر
با سلام. سوال داشتم. در مقالهای نوشته، به طور مثال ۴۱۰ میلیلیتر از ۱ N سولفوریک اسید، و یا قسمت دیگهای نوشته ۶ میلیلیتراز ۳ N پتاسیم هیدروکسید…
این N به چه منظور هست؟ همان نرمالیته هست آیا؟
مترجم گوگل “نانولول” ترجمه کرده!! اصلا نداریم…
آیا این به این منظور هست که در ۱لیتر از محلول پتاسیم هیدروکسید ۳ گرم* پتاسیم هیدروکسید موجوده؟
معمولا محلول در آب هست دیگه؟
با تشکر صمیمانه از شما…
با سلام؛
از شما به دلیل مطالعه این مطلب سپاسگزاریم.
بله نماد «N» به نرمالیته اشاره دارد. همچنین در ابتدای مقالات معتبر (یا در پیوست آنها)، عبارتهایی از این دست به طور کامل توضیح داده شدهاند تا خواننده به طور کامل با حروف اختصاری متن آشنا شود و پیشنهاد میکنیم که به این بخش از مقاله (در صورت وجود) رجوع کنید. مفهوم نرمالیته، به گرم حلشونده در حجم محلول ارتباط دارد اما از آنجایی که در تعریفی دقیقتر، این غلظت با مفهوم «اکیوالان» در ارتباط است، پیشنهاد میکنیم برای آشنایی بیشتر با این مفهوم، مطلب «نرمالیته چیست؟ — به زبان ساده» و همچنین مطلب «تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده» را مطالعه کنید. همچنین، محلولها میتوانند به صورت آبی و غیرآبی وجود داشته باشند.
با تشکر
این برا کلاس چندمه؟؟؟؟
عالی بود
درود
بابت نشر اطلاعات ممنونم
یک محلول با غلظت مشخص را چطور میتونیم تهیه کنیم مثلا محلول سود 0.5 نرمال.(هیدروکسید سدیم)
منظور فیکس کردن محلول روی غلظت مورد نظر هستش.
پاینده باشید.
با سلام؛
از شما به دلیل مطالعه این مطلب، سپاسگزاریم.
به طور کلی، برای تهیه یک محلول از پودر جامد باید با وزن کردن آن (و در نظر گرفتن ناخالصی)، آنرا در یک ظرف مخصوص (مانند بالن حجمی) بریزیم و در حلال مناسب حل کنیم و به حجم برسانیم. در رابطه با سوال شما باید از غلظت داده شده به عنوان ضریب تبدیل استفاده کرد و با فرض ۱ لیتر محلول، وزن حلشونده به گرم را محاسبه کرد. با داشتن وزن حلشونده و حجم (۱ لیتر)، محلول مورد نظر با غلظت معین تهیه میشود. برای مطالعه بیشتر، پیشنهاد میکنیم مطلب «مولاریته چیست؟ — به زبان ساده» را مطالعه کنید.
با تشکر