مولکول قطبی چیست؟ – به زبان ساده

مولکولها را میتوان به دو دسته اصلی مولکول قطبی و ناقطبی تقسیم کرد. برخی از مولکولها به طور مشخص قطبی و برخی دیگر ناقطبی هستند و برخی دیگر نیز در بین این دو دسته قرار میگیرند. در این مطلب به بررسی قطبیت مولکول میپردازیم و میآموزیم که مولکول قطبی چیست و تفاوت مولکول قطبی و ناقطبی را بررسی خواهیم کرد.
قطبیت مولکول
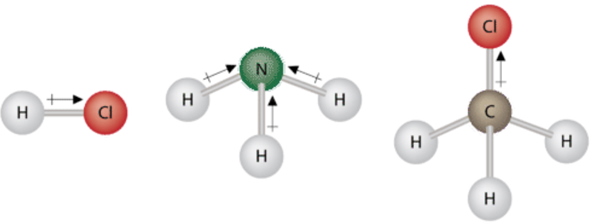
برای اینکه ببینیم یک مولکول قطبی یا ناقطبی داریم بهتر است به ساختار لوویس آن نگاه کنیم. ترکیبات ناقطبی، متقارن هستند به این معنی که اطراف اتم مرکزی، اتمها به شکل مشابه توزیع شده و همگی بدون وجود الکترون ناپیوندی، به اتم مرکزی متصل شدهاند. به طور مثال، در تصویر زیر، مولکول ناقطبی با شکل چهاروجهی را مشاهده میکنید. همچنین در مثالی دیگر از مولکول ناقطبی، مولکول بور تریفلوئورید نمایش داده شده است.
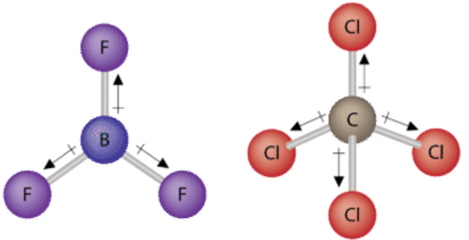
همانطور که گفته شد، مولکول قطبی چه همراه با جفتالکترون ناپیوندی در اتم مرکزی باشد چه اتمهایی با الکترونگاتیویهای مختلف با آن پیوند داشته باشند، شکلی متقارن دارد. در حقیقت، تا زمانی که هندسه مولکولی را به خوبی تجسم کنید، درک وجود مولکول قطبی یا ناقطبی ساده است که این امر، کار دشواری به شمار میآید. نحوه قرارگیری پیوندهای مولکول در فضا نیازمند درک صحیحی از ساختار لوویس و نظریه VSPER است. با فرض اینکه با این مفاهیم آشنا باشید، بدون اطلاع از الکترونگاتیوی هر اتم میتوانید با نگاه به ساختار اتم دریابید که با یک مولکول قطبی سروکار دارید یا ناقطبی چراکه تمامی پیوندها بین عناصر مختلف به صورت قطبی است و در این شرایط، جهت بردارهای گشتاور دوقطبی نیز اهمیتی ندارد.
اما مولکول قطبی مولکولی است که یک سر آن مقدار جزئی مثبت و سر دیگر مقداری جزئی منفی باشد. مولکولی دواتمی مانند HF که شامل پیوندهای قطبی کووالانسی است، یک مولکول قطبی به شمار میآید.
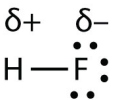
با توجه به اینکه در مولکول بالا، الکترونها به اتم فلوئور نزدیکتر هستند، این بخش از مولکول دارای سر منفی خواهد بود که با نشان داده شده است. سر دیگر مولکول یعنی اتم هیدروژن نیز بار جزئی مثبت خواهد داشت و با نشان داده میشود. نواحی باردار در دو سر این مولکول قطبی را قطبهای مولکول مینامند. در نتیجه، همانطور که قطبهای آهنربا دارای دو قطب شمال و جنوب است، در یک مولکولی قطبی نیز دو قطب مثبت و منفی خواهیم داشت. به مولکولی با دو قطب، «دوقطبی» (Dipole) میگویند و مولکول هیدروژن فلوئورید نیز از جمله این مولکولها است.

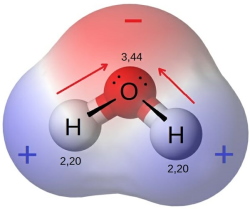
اما مولکول آب، مولکولی خمیده است زیرا دو جفتالکترون ناپیوندی بر روی اتم اکسیژن مرکزی قرار دارد. جهت ممان دوقطبی نیز از اتم هیدروژن به طرف اتم اکسیژن است. به دلیل شکل مولکول، گشتاورهای دوقطبی یکدیگر را خنثی نمیکنند و در نتیجه، مولکول آب، مولکول قطبی به شمار میآید. در تصویر زیر، ممان برآیند (خالص) با رنگ آبی نشان داده شده است.
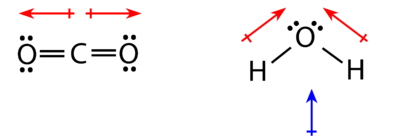
سه نوع مولکول قطبی دیگر نیز در تصویر زیر نشان داده شده که جهت گشتاور دوقطبی در آنها به طرف مولکول با چگالی الکترونی بیشتر است. مشاهده میکنید که همانند مولکول آب، هیچیک از گشتاورهای دوقطبی یکدیگر را خنثی نمیکنند.
بنابراین، برای اینکه مولکولی را به عنوان مولکول قطبی در نظر بگیریم باید شرایط زیر برقرار باشند:
- مولکول شامل حداقل یک پیوند کووالانسی قطبی باشد.
- ساختار مولکولی داشته باشیم که برآیند بردارهای گشتاور دوقطبی، یکدیگر را خنثی نکنند.
نحوه تشخیص مولکول قطبی و ناقطبی
به کمک ۵ مرحله زیر میتوانید قطبی یا ناقطبی بودن یک مولکول را مشخص کنید. این مراحل در ادامه آمدهاند.
- ساختار لوویس را رسم کنید.
- با استفاده از نظریه VSEPR، هندسه مولکولی (ساختار سهبعدی) را مشخص کنید.
- شکل مولکول را تجسم یا آنرا رسم کنید.
- گشتاور دوقطبی خالص را بیابید.
- اگر گشتاور خالص برابر با صفر بود، مولکول ناقطبی داریم و در غیر اینصورت، مولکول قطبی خواهیم داشت.
تفاوت بین مولکول قطبی و ناقطبی
مولکولها را میتوان در دو دسته بزرگ مولکولهای قطبی و ناقطبی تقسیم کرد. قطبیت مولکول همانطور که در بالا مشاهده کردید، توزیع بار الکتریکی اطراف مولکول را مشخص میکند. در یک مولکول ناقطبی، بار الکتریکی به طور مساوی در بین اتمها تقسیم شده و این درحالی است که در مولکول قطبی، این تقسیم بار به شکل مساوی انجام نمیگیرد. به بیان دیگر، یک مولکول قطبی دارای بار جزئی مثبت و منفی است.
در ادامه، مثالهایی از مولکول ناقطبی و قطبی را ذکر میکنیم.
مولکول قطبی
یک مولکول قطبی دارای یک دوقطبی است؛ یعنی دارای بخشی با بار جزئی مثبت و بخشی با بار جزئی منفی است. مولکول قطبی به طور معمول شکلی نامتقاران دارد و شامل جفتالکترون ناپیوندی است یا اینکه اتم مرکزی به اتمهایی با مقادیر الکترونگاتیوی مختلف، پیوند دارد.
در زیر، نمونههایی از مولکول قطبی آورده شده است.
- آب
- آمونیاک
- دیاکسید گوگرد
- سولفید هیدروژن
- مونواکسید کربن
- هیدروفلوئوریک اسید
- اتانول
- ساکاروز
مولکولهای قطبی به طور معمول آبدوست هستند و در حلالهای قطبی، انحلالپذیرند. همچنین در بیشتر موارد، این مولکولها نقطه ذوبی بالاتر از مولکولهای قطبی با جرم مولی مشابه دارند. این اختلاف را باید در نیروهای بینمولکولی در مولکولهای قطبی همچون پیوند هیدروژنی جستجو کرد.
مولکول ناقطبی
مولکولهای ناقطبی زمانی شکل میگیرند که یا الکترونها به طور مساوی بین اتمها در یک مولکول توزیع شده باشند یا اینکه مولکولی متقارن داشته باشیم به شکلی که گشتاورهای دوقطبی یکدیگر را خنثی کنند. در زیر ، مثالهایی از مولکول ناقطبی آورده شده است.
- مولکولهای جورهسته مانند و و و
- دیاکسید کربن
- بور تریفلوئورید
- بنزن
- کربن تترا کلرید
- متان
- اتیلن
- هیدروکربنهای مایع همچون گازوئیل و تولوئن
- بسیاری از مولکولهای آلی (البته الکل و شکر استثناء محسوب میشوند.)
مولکولهای ناقطبی خواص مشترکی نیز دارند. این مولکولها در دمای اتاق، در آب انحلالپذیر نیستند چراکه خاصیتی آبگریز دارند و به همین دلیل، به خوبی در ترکیبات ناقطبی حل میشوند.
مولکول های ناقطبی با پیوندهای قطبی
قطبیت مولکول به مقادیر نسبی الکترونگاتیوی بین دو اتم در پیوند شیمیایی ارتباط دارد. دو اتمی که الکترونگاتیوی یکسان داشته باشند، پیوندی کووالانسی را شکل میدهند و در این مولکول، الکترونها به شکلی مساوی بین اتمها توزیع شدهاند در نتیجه، نوع پیوند، ناقطبی است. اتمهایی که الکترونگاتیوی در آنها اختلافی جزئی داشته باشند، پیوندهای کووالانسی قطبی را تشکیل میدهند. هنگامی که اختلاف الکترونگاتیوی زیادی داشته باشیم به طور معمول پیوندهایی یونی تشکیل میشوند که به شدت قطبی هستند.
در بسیاری از موارد، قطبیت پیوند با قطبیت مولکول، یکسان است. با این وجود، مولکولهایی ناقطبی با پیوندهای قطبی و مولکولهایی قطبی با پیوندهایی ناقطبی نیز وجود دارند. به طور مثال، بور تریفلوئورید مولکولی ناقطبی شامل پیوندهای کووالانسی قطبی است. شکل به صورت سهضلعی مسطح است که در آن، الکترونها با وجود پیوند قطبی بور و فلوئور، به طور مساوی در مولکول توزیع شدهاند.
اوزون مثالی از یک مولکول قطبی حاصل از پیوندهای کووالانسی ناقطبی است. پیوندهای شیمیایی در مولکول به صورت کووالانسی است چراکه اتمها دارای الکترونگاتیوی برابر هستند. با این وجود، مولکول اوزون همانند آب، شکلی خمیده دارد. اتم مرکزی، بار جزئی مثبت و دو اتم دیگر، بار جزئی منفی دارند که ساختار آن را در مطلب «رزونانس در شیمی — به زبان ساده» بیان کردهایم.
معرفی فیلم آموزشی شیمی عمومی
از آنجایی که شیمی عمومی از جمله دروس پایهای در دبیرستان و دانشگاه به شمار میآید، «فرادرس» دوره آموزشی ۸ ساعت و ۲۴ دقیقهای را در قالب ۱۴ درس فراهم کرده است که در ادامه به توضیح دروس آن خواهیم پرداخت.
درس اول به ساختار اتم از جمله ایزوتوپها، الکترونخواهی، انرژی یونش و الکترونگاتیوی اختصاص دارد. در درس دوم، پیوندهای شیمیایی از جمله پیوند کووالانسی، یونی و فلزی به همراه قاعده اکتت و اوربیتالهای مولکولی توضیح داده میشوند. درس سوم به ساختار هندسی مولکولها اختصاص دارد و درس چهارم رفتار گازها را بررسی میکند که از جمله آنها میتوان به قانون بویل و قانون شارل و گازهای کامل و واقعی اشاره کرد.
در درس پنجم این آموزش ویدیویی به مایعات و جامدات پرداخته میشود که از جمله مباحث مهم آن، دمای ذوب و انجماد و انواع جامدات بلوری است. در درس ششم، محلولها بررسی میشوند که عوامل موثر بر انحلال و همچنین فشار بخار محلولها در این درس آموزش داده خواهند شد. قوانین ترمودنامیکی و همچنین قانون هس در درس هشتم بررسی خواهند شد. درس نهم نیز به اسیدها و بازها از جمله اسید قوی و شناساگرهای اسید و باز اختصاص دارد.
در درس دهم، به تعادلهای آبی پرداخته میشود و pH محلول، محلولهای بافر و تیتراسیون از جمله دروس مهم آن به شمار میآیند. در درس یازدهم، مبحث الکتروشیمی تدریس میشود و انواع سلولهای الکتروشیمیایی از جمله سلول ولتایی در این درس مورد بررسی قرار میگیرد. درس دوازدهم به شیمی عناصر غیرفلزی اختصاص دارد و روندهای تناوبی، گازهای نجیب، هالوژن و عناصری همچون اکسیژن، گوگرد و فسفر در این درس بررسی خواهند شد. در درس سیزدهم و چهاردهم، شیمی فلزات بررسی میشود که از میان مباحث مهم آن میتوان به فلزات قلیایی و قلیایی خاکی و ایزومرها اشاره کرد.
قطبیت و امتزاج پذیری
از قطبیت مولکول میتوان برای پیشبینی امتزاجپذیری دو ترکیب مختلف استفاده کرد. طبق یک قانون کلی، «شبیه، شبیه را در خود حل میکند». این عبارت بدین معناست که حلالهای قطبی، حلشوندههای قطبی را در خود حل میکنند و حلالهای ناقطبی نیز سبب انحلال حلشوندههای ناقطبی میشوند. به همین دلیل است که الکل و آب که هر دو قطبی هستند، به خوبی در یکدیگر حل میشوند و آب و روغن در یکدیگر امتزاجناپذیرند.
ترکیبی که قطبیت آن بین دو حالت قطبی و ناقطبی باشد را میتوان برای حل کردن مواد شیمیایی بکار برد که در حالت عادی در یکدیگر حل نمیشوند. به طور مثال، برای مخلوط کردن یک ترکیب یونی یا قطبی در یک حلال غیرقطبی میتوان آنرا ابتدا در اتانول حل کرد. اتانول ترکیبی با قطبیت کم است اما این قطبیت پایین برای انحلال حلشونده کفایت میکند. بعد از اینکه مولکول قطبی در اتانول حل شد، محلول اتانول را میتوان در یک حلال ناقطبی مثل زایلین یا بنزن حل کرد.










سلام cf4 قطبی هستش یا ناقطبی؟
سلام و روز بهخیر به شما دوست عزیز؛
با وجود قطبی بودن پیوند بین دو اتم کربن و فلوئور، مولکول CF4 ناقطبی است. یک پیوند بین کربن و فلوئور به دلیل اختلاف بسیاری که در میزان الکترونگاتیویته آنها وجود دارد، قطبی است با این حال در مولکولهایی مانند کربن تترافلوئورید، تقارنی که در مولکول وجود دارد این قطبیت را از بین میبرد. درواقع هر پیوند کربن-فلوئور قطبی توسط پیوندی مشابه که در تقارن با آن است بهنوعی خنثی شده و ناقطبی میشود.
خوشحالیم که ما مجله فرادرس همراه هستید.
در یک مولکول ناقطبی، بار الکتریکی به طور مساوی در بین اتمها تقسیم شده و این درحالی است که در مولکول ناقطبی، این تقسیم بار به شکل مساوی انجام نمیگیرد.
ناقطبی اخر باید قطبی بشه اطلاح بفرمایید !!
با سلام؛
از بازخورد شما بسیار سپاسگزاریم. متن به طور مجدد بازبینی و اصلاح شد.
با تشکر از همراهی شما با مجله فرادرس
مولکول های ناقطبی وناقطبی را در بین مولکول های زیر مشخص کنید
Cl2, pH3, SF2, CH3Cl
سلام و عرض ادب
ممنونم بابت مطالب مفید سایتتون
ان شاءالله سالم و موفق باشید
سلام
با توجه به اینکه مواد قطبی در حلال های قطبی حل می شوند .چگونه اکسیژن که یک مولکول ناقطبی است در آب حل میشوند؟؟!!
با سلام؛
به طور معمول، گاز اکسیژن (با توجه به دما و فشار) در آب حل میشود.
با تشکر از همراهی شما با مجله فرادرس