هیدرولیز و کاربردهای آن — به زبان ساده
ریشه واژه هیدرولیز از دو کلمه یونانی «هیدرو» (Hydro) به معنی آب و «لیز» (Lysis) به معنی آزادسازی بدست آمده است. آبکافت (هیدرولیز) یک واکنش شیمیایی است که در آن، ترکیب شیمیایی در واکنش با آب تجزیه میشود. در این واکنش، یک مولکول آب به یونهای () و () تجزیه میشود و در واکنش شرکت میکند. واژه هیدرولیز به جای واژه الکترولیز (برقکافت)، که در آن مولکولهای آب توسط جریان الکتریکی تجزیه میشوند نیز بکار میرود.
واکنش هیدرولیز سبب تجزیه پلیمرها، پروتئینها، کربوهیدراتها، چربیها و نوکلئواسیدها میشود. سرعت این واکنشها با استفاده از اسید و باز یا آنزیمها افزایش پیدا میکند. هنگام هضم غذا در بدن، این نوع از واکنشها رخ میدهد. علاوه بر این، به واکنش نمک با آب هم هیدرولیز میگویند.
انواع هیدرولیز
در این بخش به انواع واکنشهای هیدرولیز میپردازیم. در این مقاله، از واژههای هیدرولیز و آبکافت به جای یکدیگر استفاده میشود.
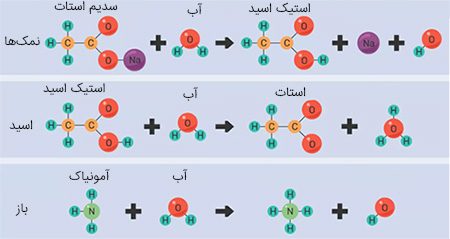
یک نوع از آبکافت در زمان حل شدن نمک یک اسید یا باز ضعیف (یا هردو) در آب اتفاق میافتد. در این واکنش، آب به طور خودبهخودی به () و () تبدیل میشود. نمک هم به آنیونها و کاتیونهای سازنده خود تجزیه میشود. به طور مثال، «سدیم استات» () به یونهای سدیم () و اَسِتات () تجزیه میشود. نتیجه واکنش استات با () به تولید «استیک اسید» () منجر میشود.
شیمی آلی
در شیمی آلی، آبکافت به عنوان فرآیند معکوس «چگالش» (Condensation) نیز بکار میرود. زمانی که هیدرولیز و چگالش به طور همزمان اتفاق بیافتند، نقطه همارزی (تعادل)، مقدار هر محصول را تعیین میکند.
بیوشیمی
در بیوشیمی، هیدرولیز، فرآیند مقابل «دهیدراته شدن» (Dehydration) یا آبگیری است. واکنش دهیدراته شدن سبب حذف یک مولکول آب میشود. در مقابل، در واکنش هیدرولیز، مولکول آب به فرآیند اضافه میشود.
الکتروشیمی
همانطور که گفته شد، هیدرولیز در الکتروشیمی هم کاربرد دارد. در این نوع از فرآیند، اختلاف پتانسیلی در طول یک محلول آبی اعمال میشود که نتیجه آن، تجزیه مولکول آب به اجزای سازنده خود، یعنی اکسیژن و هیدروژن است.
پلیمر
در شیمی پلیمر، هیدرولیز در واکنشهای با دمای زیاد مانند قالبسازی تزریقی اتقاق میافتد. این اتقاق در مواردی سبب تغییر ساختار انواع پلیمر و از بین رفتن خواص آن میشود.
در تصویر زیر، سه نوع از مهمترین واکنشهای آبکافت نمایش داده شدهاند:
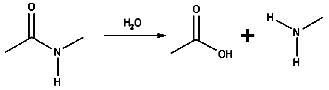
هیدرولیز آمیدها
در هیدرولیز یک آمید متصل به کربوکسیلیک اسید ()، بعد از واکنش با آب، یون هیدروژن توسط آمونیاک و گروه هیدروکسیل به کربوکسیلیک اسید جذب میشوند.
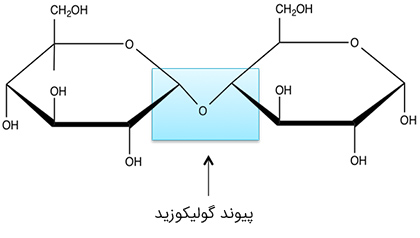
هیدرولیز پلی ساکاریدها
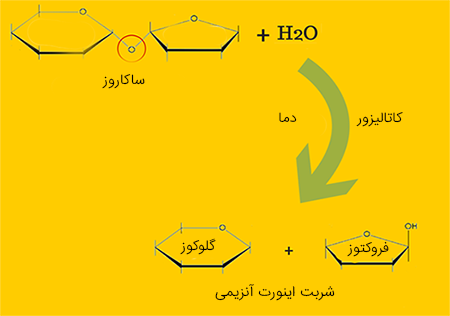
واحدهای مونوساکارید توسط پیوند «گولیکوزیدی» (Glycosidic) به یکدیگر متصل میشوند و تشکیل پلیساکارید میدهند. با آبکافت میتوان این پیوندها را شکست و آنها را به مونوساکارید تبدیل کرد. نمونهای از این کار، آبکافت ساکاروز برای بدست آوردن گلوکز و فروکتوز است که در بخش آنزیمها به آن میپردازیم.
آنزیمها و آبکافت
آنزیمهای زیادی در افزایش سرعت آبکافت پلیساکاریدها نقش دارند. از آنزیم اینورتاز به طور صنعتی برای آبکافت ساکاروز و تولید «شربت اینورت آنزیمی» (Invert Sugar) استفاده میشود. آنزیم لاکتاز با آبکافت لاکتوز شیر، به هضم بهتر آن کمک میکند. آنزیم سلولاز برای آبکافت سلولوز و تبدیل آن به گلوکز به کار میرود. حیوانات گیاهخوار به واسطه داشتن نوع خاصی از باکتری که قادر به تولید آنزیم سلولاز است، توانایی هضم گیاهان را دارند.
هیدرولیز یون های فلز محلول در آب
یونهای فلزی همان اسید لوییس است و وقتی در حالت محلول در آب باشند، با فرمول نمایش داده میشوند.
این یونها توسط آبکافت تجزیه میشوند. اولین مرحله آن در رابطه زیر آورده شده است:
همانطور که در بالا مشخص است این یونها رفتاری مشابه اسید لوری-برونستد دارند.
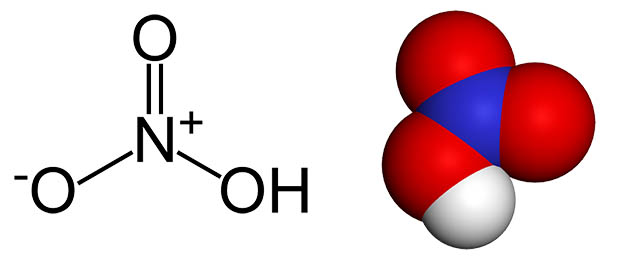
«ثابت تفکیک اسید» ()، برای این واکنش به نسبت «بار به اندازه» (Charge to size) وابسته است. یونهایی با بار مثبت کم، مانند یون ، به عنوان اسید ضعیف در نظر گرفته میشوند که آبکافت قابل توجهی ندارند. یونهای دوظرفیتی که بزرگ هستند همچون ، ()، () و ()، در حدود 6 یا بیشتر است و در طبقهبندی اسیدها قرار نمیگیرند؛ اما یونهای کوچکتر همچون به خوبی آبکافت میشوند. با بررسی استیک اسید، میتوان یونهای سه ظرفیتی همچون و را که نزدیک به آن دارند به عنوان اسید ضعیف در نظر گرفت. محلولهای نمکی نظیر و در آب به صورت اسید هستند. با افزایش حالت اسیدی این محلولها، مانند اضافه کردن نیتریک اسید، میتوان آبکافت را متوقف کرد.
هیدرولیز و معدن
آبکافت ممکن است از مرحله اول خود فراتر برود. این فرآیند همراه تشکیل ترکیبات چندهستهای و در برخی موارد مانند ، سمی است. با افزایش pH، هیدرولیز افزایش پیدا میکند؛ که در مواردی سبب رسوب یک هیدروکسید مانند میشود. این مواد از اجزای اصلی تشکیلدهنده بوکسیت و موسوم به «لاتریت» (Laterite) است. علاوه بر این، در فرآیند «کانهشویی» (Leaching) بیشتر سنگ معدنها و هیدرولیز باقیمانده آهن و آلومینیوم نیز تشکیل میشوند.

یونهای بیش از چهار ظرفیتی به خوبی آبکافت میشوند. اگر عدد اکسایش بیش از ۴ باشد، غلظت یون در محلول قابل صرفنظر است. در حقیقت، یون محلول در آب، یک اسید قوی است. به عنوان مثال، محلول «هگزاوالان کروم» () دارای () است.
فرمول واکنش:
توجه کنید که واکنشهای نظیر رابطه زیر کاربرد فراوانی در واکنشهای کاتالیستی «پلیاکسومتالاتها» (Polyoxometalates) دارند.
جمعبندی
در این مقاله سعی کردیم جنبههای مختلف آبکافت را بررسی کنیم. آبکافت را در شاخههای شیمی نظیر پلیمر و بیوشیمی بررسی کردیم. نقش آنزیمها را در این پدیده توضیح دادیم. سه نوع معمول آبکافت یعنی آبکافت اسید، باز و نمک را نشان دادیم. هیدرولیز آمیدها و پلیساکاریدها را مرور کردیم. در پایان، یک نمونه کاربرد صنعتی از آبکافت را بررسی کردیم.
اگر مطالب بالا برای شما مفید بوده است، آموزشهای زیر به شما پیشنهاد میشوند:
- مجموعه آموزشهای مهندسی شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی آلی 1
- واکنش اسید و باز -- از صفر تا صد
- موازنه واکنش شیمیایی — به زبان ساده
- جدول تناوبی — از صفر تا صد
^^












درود.با اب مقطر و پتاس یا سود در کاتالیز استفاده شد. ولی باز هم تغییر رنگ رخ داد؟! چگونه از تغییر رنگ جلوگیری کنیم؟ ممنون
هیدرولیز از کاربن و ولتاز ۹ ولت و از تشت واز
سلام، در مورد ابکافت بیشتر توضیح دهید. برای الکترولیز اب از چه فلزی باید استفاده کرد؟ از آلومینیوم یا استیل؟ از چه ولتاژی بهتره که استفاده کرد؟ و از چه محلولی به عنوان الکترولیت؟
ممنون و متشکر
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. برای آشنایی بیشتر با الکترولیز میتوانید مطلب «الکترولیز — به زبان ساده» را مطالعه کنید.
با تشکر