هیدروکربن های آروماتیک | به زبان ساده
هیدروکربنهای آروماتیک به هیدروکربنهای سیرنشدهای میگویند که دارای یک یا چند حلقه شش کربنه موسوم به حلقه بنزنی باشند. این هیدروکربن های آروماتیک فرمول هیدروکربنی به شکل دارند. واژه آروماتیک پیش از تعیین مکانیسم آروماتیسیته برای این ترکیبات در نظر گرفته شد و مفهومی همچون بوی شیرین یا لذتبخش داشت. با این وجود، تمامی ترکیبات آروماتیک، بوی شیرین ندارند و هر ترکیبی که چنین بویی داشته باشد نیز لزوما یک آروماتیک نیست. حلقههای بنزنی از طریق رزونانس به پایداری میرسند و الکترونهای پیوند پای در ساختار حلقه به صورت «غیرمتمرکز» (Delocalized) حضور دارند.
مقدمهای بر هیدروکربن های آروماتیک
هیدروکربنهای آروماتیک، ترکیبات آلی با ساختاری حلقوی و شامل الکترونهای پای در کنار پیوند سیگما هستند. به این نوع از هیدروکربنها، «آرن» (Arene) یا «آریل» (Aryle) میگویند. برخی از این هیدروکربنها در تصویر زیر آورده شدهاند. مشاهده میکنید که تمامی این ترکیبات شامل حلقه بنزنی هستند.
هیدروکربنهای آروماتیکی که فاقد حلقه بنزنی باشند را با نام «هتروآرنها» (Heteroarenes) میشناسند. تمامی این هتروآرنها از «قانون هوکل» (Huckel's Rule) پیروی میکنند. بر اساس این قانون، تعداد الکترونهای پیوند پای (الکترون پای) در یک حلقه تکعضوی برابر با خواهد بود و n، عددی مثبت و غیر صفر است.
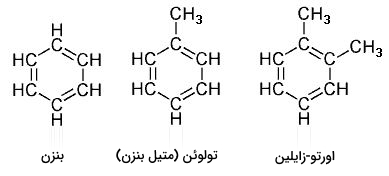
در این ترکیبات، اگر حداقل یک اتم کربن با نیتروژن، اکسیژن یا گوگرد جایگزین شود، هتروآرنهایی موسوم به فوران (شامل اکسیژن) و پیریدین (شامل نیتروژن) خواهیم داشت.
خواص هیدروکربن های آروماتیک
اولین ترکیبی که به عنوان یک هیدروکربن آروماتیک شناخته شد، بنزن بود. بنزن همچنین، پیچیدهترین نوع از هیدروکربن آریل به شمار میآید. هر اتم کربنی که به حلقه بنزنی تعلق داشته باشد، شامل دو پیوند سیگما کربن-کربن، یک پیوند سیگما کربن-هیدروژن و یک پیوند دوگانه به همراه اتم کربن همسایه است که الکترون پای در آن به صورت غیرمتمرکز قرار دارد.
غیرمتمرکز بودن الکترونهای پای در مولکول بنزن را به کمک دایرهای در داخل یک ششضلعی نشان میدهند. مرتبه پیوند در تمامی پیوندهای کربن-کربن این مولکول، برابر با عدد ۱/۵ در نظر گرفته میشود. برخی از خواص کلی هیدروکربنهای آروماتیک در زیر آورده شدهاند:
- این ترکیبات از خود، آروماتیسیته (پایداری ناشی از رزونانس) نشان میدهند.
- نسبت اتمهای کربن به هیدروژن، در این نوع از مولکولها بالا است.
- به هنگام سوختن هیدروکربنهای آروماتیکی، شعلهای به رنگ زرد و همراه با دوده خواهیم داشت.
- به طور کلی، این ترکیبات در واکنشهای جانشینی الکتروندوست و واکنشهای جانشینی آروماتیک هستهدوست شرکت میکنند.
لازم به ذکر است که این نوع از هیدروکربنها میتوانند به صورت تکحلقهای یا چندحلقهای وجود داشته باشند.
واکنش ها در هیدروکربن های آروماتیک
بسیاری از واکنشهای شیمیایی آلی از هیدروکربنهای آروماتیک به عنوان واکنشدهنده اصلی استفاده میکنند. این واکنشها به همراه توضیحی کوتاه در ادامه این مطلب آورده شدهاند:
واکنش های جانشینی آروماتیک
در این واکنشها، به طور معمول یک جانشین (همچون هیدروژن) با جانشین دیگری، جایگزین میشود. انواع مختلف واکنشهای جانشینی آروماتیک شامل موارد زیر است:
- واکنشهای جانشینی هستهدوست آروماتیک
- واکنشهای جانشینی الکتروندوست آروماتیک
- واکنشهای رادیکالی جانشینی هستهدوست آروماتیک
از نمونههای این نوع واکنشها میتوان به نیتروژندار کردن (نیتراسیون) سالیسیلیک اسید اشاره کرد.

واکنش های کوپلینگ (جفت شدن)
در این نوع از واکنشها، کوپلینگ (جفتشدگی) دو «پیشماده» (Fragments) رادیکالی از طریق یک کاتالیزور فلزی اتفاق میافتد. زمانیکه که هیدروکربنهای آروماتیک در واکنشهای کوپلینگ شرکت میکنند، سه نوع پیوند زیر در آنها رخ خواهد داد:
- تشکیل پیوند کربن-کربن: در اینصورت، فرآوردههایی همچون آرنهای وینیل، آلکیل و ... به تولید میرسند.
- تشکیل پیوند کربن-اکسیژن: در اثر این نوع واکنشها، ترکیبات «آریلوکسی» (Aryloxy) خواهیم داشت.
- تشکیل پیوندهای کربن-نیتروژن: در این نوع از واکنشها، فرآوردههایی همچون آنیلین تولید میشوند.
نمونهای از این واکنشهای کوپلینگ را در «آریلاسیون» (Arylation) پرفلوئوروبنزنها میتوان مشاهده کرد که تصویر آن در زیر آورده شده است:

هیدروژناسیون
در اثر هیدروژناسیون آرنها، حلقههایی سیرشده (اشباع) تشکیل میشوند. به طور مثال، ترکیبی به نام ۱-نفتول در واکنشی کاهشی به مخلوطی از ایزومرهای دکالینول تبدیل میشود.

کاربردهای هیدروکربن های آروماتیک
از هیدروکربنهای آروماتیک در فرآیندهای زیستی و سنتز بهره میگیرند. برخی از کاربردهای این نوع از هیدروکربنها در زیر آورده شده است.
- رنگ سبز برگهای درخت معروف به کلروفیل، حاوی هیدروکربنهای آروماتیک است و اهمیت بسیار زیادی در تولید مواد مغذی گیاهان دارد.
- نوکلئیک اسیدها و آمینو اسیدها در بدن انسان، شامل هیدروکربنهای آروماتیک هستند.
- ماده اصلی در چسبهای ماکتسازی، نوعی هیدروکربن آروماتیک به نام متیلبنزن است.
- از نفتالین به عنوان قرص دفع کننده حشرات در لباسها و سرویسهای بهداشتی بهره میگیرند.
- در سنتز داروها، رنگها و مواد منفجره، از هیدروکربنی به نام «فنانترن» (Phenanthrene) استفاده میشود.
- علاوه بر تمامی کاربردهای بالا، در صنایع پلاستیک و پتروشیمی، به وفور از هیدروکربنهای آروماتیک کمک میگیرند.
- تری نیترو تولوئن (TNT) به عنوان ماده اصلی در ساخت مواد منفجره شناخته میشود.
هیدروکربن های آروماتیک پلی سیکلیک (چندحلقهای)
هیدروکربنهای آروماتیک پلیسیکلیک (PAH)، به هیدروکربن های آروماتیکی میگویند که شامل «حلقههای جوشخورده» (Fused Rings) آروماتیکی باشند. این هیدروکربنها، حامل گروههای استخلافی یا شامل هترواتم نیستند. به عنوان سادهترین نوع از این هیدروکربنها میتوان به نفتالین اشاره کرد. چنین هیدروکربنهایی در نهشتههای نفتی یافت میشوند و به عنوان فرآورده فرعی به هنگام سوزاندن سوختهای فسیلی یا زیستی به تولید میرسند. برخی از این ترکیبات پلیسیکلیک را به عنوان آلاینده هوا نیز در نظر میگیرند.
مطالعات نشان دادهاند که مقادیر زیادی از این هیدروکربنها در غذاهای پخته شده وجود دارند. غذاهای گریل شده، تنوری یا پخته شده در دماهای بالا شامل این موارد میشوند.
نحوه نمایش ترکیبات آروماتیک
در ادامه متن قصد داریم تا به بررسی نحوه نمایش ترکیبات آروماتیک یا حلقه بنزنی بپردازیم. در حقیقت، برای درک بهتر این نوع از ترکیبات باید فهم دقیقی از ساختار رزونانس داشته باشیم. همانطور که پیشتر اشاره شد، معروفترین ترکیب آروماتیک، بنزن است. نمایش ساختاری بنزن معمولا به صورت یک ششضلعی انجام میشود و شامل سه پیوند دوگانه است. هر یک از کربنهای موجود در رئوس این ششضلعی با اتم دیگری (هیدروژن) پیوند دارند. شکلهای مختلف نمایش یک حلقه بنزنی در زیر نشان داده شدهاند.
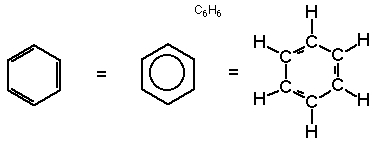
به خاطر داشته باشید که اگر ترکیبی به صورت ششضلعی نشان داده شده اما فاقد سه پیوند دوگانه یا یک حلقه باشد، این ترکیب، آروماتیک نیست بلکه یک سیکلوهگزان است.
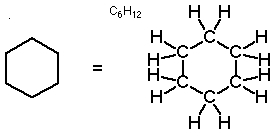
بررسی ساختارهای مختلف در آروماتیک ها
در ادامه، به بررسی ساختارهای مختلف ارائه شده برای هیدروکربن های آروماتیک همچون ساختار ککوله و رزونانس میپردازیم و در این رابطه، قانون هوکل را نیز بیان میکنیم.
ساختار ککوله
ساختار ککوله شامل سه پیوند دوگانه توسط دانشمند آلمانی، «آگوست ککوله» (August Kekulé) به عنوان تلاشی برای توضیح فرمول مولکولی ارائه شد. حلقه و سه پیوند آن در فرمول مولکولی صدق میکنند اما هیچ توضیحی در خصوص رفتار شیمیایی بنزن ارائه نمیدهند. در حقیقت، هر پیوند دوگانه، رفتاری همچون یک آلکن از خود نشان میدهد و در واکنشهای افزایشی شرکت میکند اما هیچکدام از این موارد در بنزن رخ نمیدهند.
به طور ویژه، انتظار داریم پیوند دوگانه کربن-کربن به سرعت با عنصر برم برای تشکیل ترکیب، واکنش دهد. چنین واکنشی در آلکنها به سادگی روی میدهد و آزمون مناسبی برای تشخیص یک آلکن در آزمایشگاه به شمار میآید. در مقابل، تا زمانیکه از نور شدید یا یک کاتالیزور قوی استفاده نکنیم، بنزن با برم واکنش نمیدهد و در مییابیم که چیزی غیرمعمول در خصوص پیوند دوگانه بنزن وجود دارد.
ککوله پیشنهاد داد دو شکل از بنزن وجود دارد که در محل پیوند دوگانه با یکدیگر تفاوت دارند. ایده او به این صورت بود که محل پیوندها به سرعت تغییر میکنند و با یکدیگر در تعادل هستند و به همین دلیل نمیتوان محل دقیقی برای پیوند دوگانه متصور شد. به بیان ساده، اتمِ برمی که به این مولکول نزدیک میشود، به طور دقیق محل پیوند دوگانه را برای انجام واکنش، شناسایی نمیکند.
رزونانس
ساختارهای دیگری نیز برای بنزن معرفی شدند اما زمانی این ساختارها به دقت لازم رسیدند که دانشمندان فهمیدند در پیوندهای کووالانسی، بین دو اتم، یک جفت الکترون به اشتراک گذاشته میشود. تفاوت بین دو ساختاری که ککوله پیشنهاد داده بود، تنها در محل سه جفت الکترون بود. در چنین شرایطی، بحث رزونانس مطرح میشود.
تصویر زیر در تطابق کامل با آزمایشات قرار دارد که نشان میدهد تمامی پیوندهای کربن-کربن در بنزن، طول یکسانی دارند و هیچکدام همچون پیوندهای دوگانه و یگانه، به ترتیب کوتاهتر و بلندتر نیستند. این تصویر همچنین کمک میکند تا توضیح دهیم چرا بنزن در واکنشهای افزایشی شرکت نمیکند. در حقیقت، هیچ پیوند پای برای انجام واکنش وجود ندارد.

ویژگی دیگر ساختار رزونانس این است که ساختار اصلی، بسیار پایدارتر از آن چیزی است که ما با رسم یک خط (معادل با دو الکترون) نشان میدهیم. این پایداری بیشتر که همراه با کاهش انرژی است، دلیل دیگری بر واکنشپذیری کم بنزن و سایر ترکیبات آروماتیک به شمار میآید.
قانون هوکل
زمانی که برای اولین بار، نظریه رزونانس برای درک ساختار بنزن به کار گرفته شد، ویژگی اصلی آن، هیبرید رزونانسی ساختار حلقه شامل تغییر متناوب پیوندهای یگانه و دوگانه بود. این اتفاق، به سرعت سبب مطالعه ترکیباتی همچون «سیکلوبوتادیِن» (Cyclobutadien) و «سیکلواکتاتترااِن» (Cyclooctaterraen) شد. چنین ترکیباتی نیز شامل ساختارهای حلقوی با پیوندهای متناوب یگانه و دوگانه بودند.
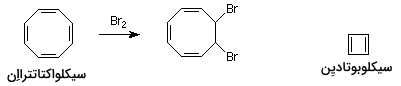
سیکلواکتاتتراان، پایداری بیشتر و مقاومت در برابر واکنشهای افزایشی را (مشخصه ترکیبات آروماتیک) از خود نشان نداد. به طور مثال، این ترکیب به راحتی با برم در واکنش شرکت میکرد. سیکلوبوتادین به شدت ناپایدار است و دو مولکول از این ماده، به سرعت حتی در دماهای بسیار پایین با یکدیگر واکنش میدهند. در نتیجه، به طور قطع این مولکول، رفتاری همچون یک مولکول آروماتیک نخواهد داشت و به همین دلیل به آن «ضد آروماتیک» (Antiaromatic) میگویند.
با توجه به مطالبی که گفته شد، به نظر میرسد که در آروماتیکها، چیزی به غیر از جابجایی تناوبی پیوندهای یگانه و دوگانه وجود دارد. بعد از توسعه مدلهای مختلف، دانشمندان به الگویی رسیدند که بیان میکرد تنها زمانی مشخصههایی از آروماتیک خواهیم داشت که حلقهای از الکترونهای پای داشته باشیم که تعداد آنها برابر با عدد باشد که در آن، یک عدد صحیح است. این قانون را به عنوان «قانون هوکل» (Hückel's Rule) میشناسند.
این قانون را میتوانیم در خصوص ترکیبات شناخته شده بررسی کنیم. بنزن، ۶ الکترون پای دارد. در حقیقت، در هر پیوند پای بنزن، ۲ الکترون خواهیم داشت. اگر در قانون هوکل، عدد n را برابر با ۱ در نظر بگیریم، این تعداد الکترون در این قانون صدق خواهد کرد. سیکلواکتاتتراان تعداد ۸ الکترون پای دارد. به ازای این عدد، هیچ عدد صحیحی برای n وجود ندارد که در قانون هوکل صدق کند. همچنین، سیکلوبوتادین نیز ۴ الکترون پای دارد و در این قانون جای نمیگیرد. البته، مثالهای بسیار دیگری نیز وجود دارند که در این قانون صدق میکنند.
به هنگام بررسی قانون هوکل باید اطمینان حاصل کنیم که حلقه موجود در ترکیب (پیوندهای یگانه و دوگانه)، کامل شده باشد. اگر یک کربن هیبرید شده در حلقه داشته باشیم، شرایط آروماتیکی نخواهیم داشت و نیازی به بررسی قانون هوکل نیست. به مثال زیر توجه کنید:
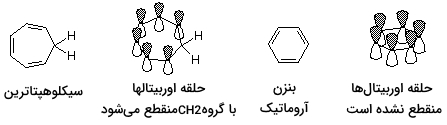
راه دیگری که به بررسی این موضوع بپردازیم، نگاه کردن به اوربیتالهای و ترکیب آنها برای تشکیل پیوند پای است. اگر این اوربیتالهای ، با یکدیگر ترکیب شوند تا حلقهای پیوسته را همچون بنزن بسازند، میتوانیم به قانون هوکل برای بررسی تعداد الکترونهای رجوع کنیم. اگر حلقه اوربیتالهای توسط یک گروه شکسته شوند و پیوند نداشته باشیم، به ترکیب مورد نظر نمیتوان خاصیت آروماتیکی نسبت داد و نیازی به بررسی قانون هوکل نیست.
اوربیتالهای که حلقه پیوسته را تشکیل میدهند ممکن است به همراه اتمهایی به غیر از کربن باشند. دو نمونه از این ترکیبات، «فوران» (Furan) و «پیرول» (Pyrrole) خواهند بود که در آنها،۲ الکترون از ۶ الکترون، حاصل الکترونهای ناپیوندی بر روی اکسیژن هستند.

این الکترونهای ناپیوندی را حتی میتوان از یک اتم کربن هم بدست آوردن که در این حالت باید بار منفی داشته باشیم. نمونهای از چنین ترکیبی، یون سیکلوپنتادینید است که در اثر واکنش سیکلوپنتادین با یک باز نسبتا قوی روی میدهد. این یون از طریق خاصیت آروماتیک خود، پایداری مناسبی دارد به گونهای که اسید مزدوج آن، یعنی سیکلوپنتادین، ثابت تفکیک اسید برابر با دارد. سیکلوپنتادین، به طور مشخصی یک اسید قوی برای هیدروکربنها به شمار میآید زیرا باز مزدوج آن به دلیل آروماتیسیته، پایداری بالایی دارد.
علاوه بر این، درصورتیکه ساختاری آروماتیک داشته باشیم، کاتیونهایی به شدت پایدار خواهیم داشت که از نمونههای آن، یونهای سیکلوپروپنیوم و سیکلوهپتاترینیوم هستند. توجه داشته باشید که در اینجا، اتم کربن با بار مثبت به صورت هیبرید شده قرار دارد و دارای اوربیتال خالی پای است که آرایش حلقوی اوربیتال پای را تکمیل میکند.

حلقههای آروماتیک
در ابتدای متن، به طور کلی به ترکیبات آروماتیک و حلقههای آروماتیکی پرداختیم اما در این بخش، بررسی دقیقتری را در این خصوص ارائه خواهیم داد. حلقهای که شامل چرخهای از الکترونهای پای باشد را آروماتیک مینامند.
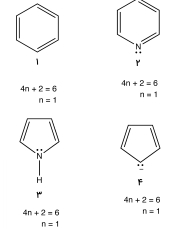
بنابراین، در تصاویر زیر، حلقههای شماره 1 تا ۴ به عنوان آروماتیک شناخته میشوند. ترکیبی که مولکولهای آن شامل یک یا بیشتر حلقه آروماتیک باشد، با نام ترکیب آروماتیکی شناخته میشود. بنابراین، حلقههای ذکرشده را میتوان جزو این ترکیبات دانست. روشهای طیفسنجی و شیمیایی وجود دارند که میتوان به طور آزمایشگاهی، نوع ترکیب را مشخص کرد. تمامی حلقههای آروماتیکی، دو ویژگی ساختاری دارند:
- حلقه به صورت «مسطح» (Planar) است.
- حلقه از قانون هوکل پیروی میکند.
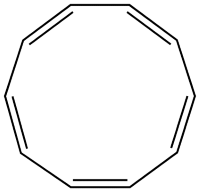
اینکه حلقه به صورت مسطح باشد یا خیر نیازمند در نظر گرفتن عوامل متعددی است. مثال زیر را در مورد مولکول آنولن در نظر بگیرید. اگر این ترکیب که از قانون هوکل پیروی میکند، مسطح بود، اتم هیدروژن در کربن ۲ و ۷ که در داخل حلقه قرار دارند، باید به یک میزان فضا اشغال میکردند که به طور فیزیکی غیرممکن است. برای اینکه این اتمها در داخل حلقه قرار بگیرند، به حلقه نیرو وارد خواهد شد تا از حالت مسطح خارج شود و درنتیجه، این ترکیب، آروماتیک نخواهد بود.

اگر فرض میکردیم آرایش آنولن به گونهای بود که تمامی پیوندهای دوگانه آن مشابه با ترکیب زیر بودند، حلقه به صورت مسطح و در نتیجه، آروماتیک بود.
حلقه ضد آروماتیک
حلقهای که فاقد الکترونهای پای باشد، بسیار ناپایدار خواهد بود. ترکیبی که مولکولهای آن شامل حلقههایی از این نوع باشند، موسوم به ترکیبات ضد آروماتیک هستند. این نوع از حلقهها، دو ویژگی اصلی دارند:
- حلقه به صورت «مسطح» (Planar) است.
- اگر به کمک ساختار لوویس متوجه شویم که حلقه شامل الکترونهای پای است، تعداد الکترونها در حلقه (چرخه) برابر با خواهد بود.
مکانیسم جانشینی آروماتیک الکترون دوست
در این بخش میخواهیم واکنشهای مخصوص به آروماتیکها یعنی واکنشهای جانشینی آروماتیکی را بررسی کنیم. مهمترین مشخصههای این نوع از واکنشها، پایداری حلقه آروماتیکی است. در ابتدا، این چنین واکنشهایی توسط الکتروندوستهای قوی (اسید لوویس) نظیر ، و کاتالیز خواهند شد. در ادامه نیز با توجه به اینکه واکنشهای افزایشی سبب ایجاد ناپیوستگی در حلقه اوربیتال p و از بین رفتن پایداری آروماتیک میشوند، واکنشهای جانشینی خواهیم داشت.
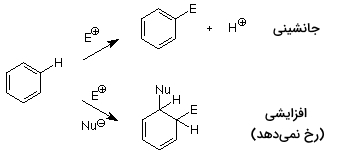
با وجود اینکه نتیجه حمله الکتروندوستها به بنزن، به جای واکنش افزایشی، نوعی واکنش جانشینی به شمار میآید، مرحله اول، مشابه با واکنش افزایشی الکترون دوست در آلکنها است. در این واکنش، در اثر حمله الکتروندوست به پیوند پای، تشکیل پیوندهای جدید سیگما بین یک اتم کربن و الکتروندوست را خواهیم داشت. کربوکاتیون تشکیل شده از محل کربن، از دست میدهد و الکترونهای پیوند کربن-هیدروژن به حلقه آروماتیک الکترونهای پای بازگشت میکنند و پایداری آروماتیکی خواهیم داشت.
این ترکیب واسط، نوعی کربوکاتیون و پایداری آن در تعیین سرعت واکنش بسیاری موثر است.












ممنون ساده و خوب