محلول چیست؟ – انواع محلول + مثال – به زبان ساده
محلول (Solution) مخلوطی حداقل از دو ماده به شکل همگن است. حلال و حلشونده دو جز اصلی محلولها هستند. غلظت، انحلالپذیری و عاملهای موثر بر آنها مانند دما از موضوعات مهم در مطالعه محلولها هستند. با پراکنده شدن ذرات حلشونده در حلال، محلولهای مایع، جامد و گاز تشکیل میشود که محلولهای آبی از پرکاربردترین انواع محلول بهشمار میآیند. در این مطلب از مجله فرادرس میخوانید که محلول چیست و با ویژگیها، انواع محلول، حلال، حلشونده و همچنین روشهای مختلف بیان غلظت محلول با مثال آشنا خواهید شد.
- میآموزید محلول چیست و چگونه تهیه میشود.
- با آنتالپی محلول و مفهوم انحلل پذیری آشنا میشوید.
- میتوانید اجزای محلول مانند حلال و حل شونده و انواع آنها را تشخیص دهید.
- با غلظت محلول و روشهای بیان آن آشنا میشوید.
- ویژگیهای محلول مانند نقطه جوش و چگالی را میشناسید.
- با انواع محلول و روشهای تهیه آنها آشنا میشوید.


محلول چیست ؟
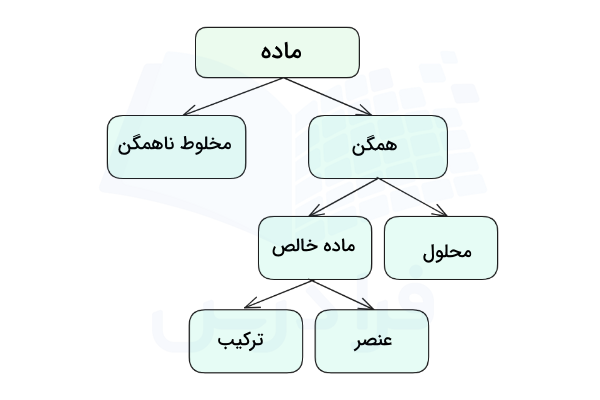
در تعریفی ساده، به مخلوطهای همگن محلول گفته میشود. دو جز اصلی محلولها حلال و حلشونده هستند. محلول مادهای است که در آن مادهای به نام حلشونده به طور یکنواخت در مادهای به نام حلال، حل و پراکنده شده است. در محلول نسبت حلال به حلشونده بیشتر است و فاز محلول را حلال تعیین میکند. ذرات حلشونده در محلول، بین مولکولهای حلال قرار میگیرند و حلال و حلشونده با یکدیگر واکنش نمیدهند. در شکل زیر تعریفی از مواد و محلول نمایش داده شده است.
مثال محلول
محلولها همه جا و در محیط زندگی ما حضور دارند. بیشتر موادی که میبینیم مخلوطی از یک حلشونده در ماده دیگر هستند. انواع گوناگونی از محلولها وجود دارند. محلولها میتوانند به حالت مایع، گاز یا جامد باشند. هوا که مخلوطی همگن از چند گاز است در دسته محلول گازی قرار میگیرد. نوشابههای گازدار مخلوطی همگن از گاز کربن دیاکسید در آب و قهوه یا چایی محلولی مایع از دانههای قهوه یا برگهای چای با آب داغ هستند. آب اقیانوسها و دریا محلولی از ترکیبات زیادی مانند نمک در آب است. نقره استرلینگ، محلولی جامد حاوی ۷ درصد مس در نقره و از آلیاژهای نقره است. تغییرات آنتالپی و آنتروپی به تشکیل محلولها کمک میکنند.

محلول چگونه تشکیل میشود؟
میزان برهمکنش، بین حلشونده و حلال، تعیینکننده تشکیل محلول است. برای جداسازی ذرات حلشونده و حل شدن در حلال به مقدار انرژی کافی نیاز است. انرژی لازم با حرکت ذرات حلشونده میان ذرات حلال و جاذبه بین آنها فراهم میشود. در شکل زیر گازهای اکسیژن و آرگون در محفظههای جداگانه توسط مانعی از یکدیگر جدا شدهاند.
اگر مانع بین آنها برداشته شود، گازها سریع با یکدیگر مخلوط شده و تشکیل محلول میدهند. برهمکنشهای بینمولکولی بسیار کمِ مولکولهای دو گاز و در نتیجه حرکت مولکولی بیشتر موجب میشود که ذرات در حجم بیشتری پخش شده و محلول گازی تشکیل دهند.
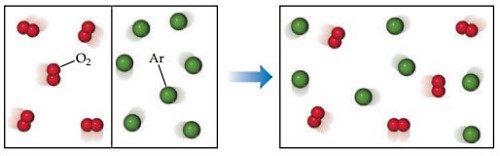
مخلوط شدن گازها فرایندی «خودبخودی» (Spontaneous) است، یعنی برای انجام این فرایند به هیچ انرژیِ خارج از سیستمی نیاز نیست. مخلوط شدن و سپس پخش شدن تصادفی مولکولها باعث افزایش «آنتروپی» (Entropy) میشود. افزایش بینظمی یا توزیع انرژی سیستم روی ذرات بیشتر با افزایش آنتروپی همراه است. برهمکنشهای بینمولکولی بسیار ضعیفی که بین مولکولهایِ گاز وجود دارد موجب تغییرات کمی در آنتالپیِ سیستم بعد از مخلوط شدن میشود.
کاهش آنتالپی، برهمکنشهای بینمولکولی مطلوب بین مولکولهای گاز را افزایش میدهد. تعادل بین افزایش آنتروپی و کاهش آنتالپی میتواند خودبخودی بودن فرایندها را نشان دهد. در کل افزایش آنتروپی پس از مخلوط شدن ذرات از شرایط مناسب تشکیل محلول است. هنگامی که انواع گوناگونی از مولکولها در کنار هم باشند، مخلوط شدن به صورت خودبخودی رخ میدهد، مگر اینکه نیروهای بینمولکولی قوی باشند یا از موانعی برای جدا کردن ذرات استفاده شده باشد.
نیروهای بینمولکولی در گازها بسیار ضعیف هستند، بنابراین در گازها، ذرات بهطور خودبه خودی مخلوط میشوند. هنگامی که حلال یا حلشونده به شکل جامد یا مایع است، نیروهای بینمولکولی نقش تعیینکنندهای در تشکیل محلول دارند. برای مثال نیروهای بینمولکولی بین یونهای نمک و بنزین بسیار ضعیف است بنابراین نمک در بنزین حل نمیشود.
تشکیل محلول به دو عامل مهم بستگی دارد:
- تمایل حلال و حلشونده به مخلوط شدن
- نیروها و برهمکنشهای بینمولکولی بین حلال و حلشونده
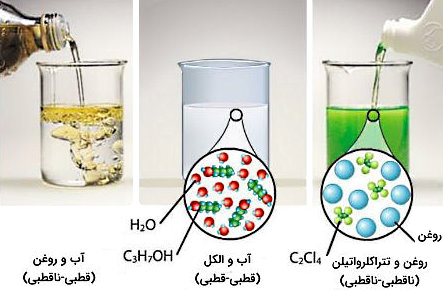
زمانیکه حلشونده و حلال از نظر قطبیت مشابه باشند بین ذرات نیروی جاذبه ایجاد میشود. معمولا برای نشان دادن این منظور و شرط تشکیل محلول از عبارت «شبیه، شبیه را در خود حل میکند» استفاده میشود.
ویتامین های محلول در آب و چربی
قسمتهای مختلف بدن انسان به دلیل ساختار شیمیایی ویتامینها بر انحلالپذیری آنها تأثیر میگذارد. ویتامین C و ویتامینهای B از ویتامینهای محلول در آب هستند و ویتامینهای A ،D ،E و K در حلالهای ناقطبی مانند بافت چربی بدن حل میشوند. به همین دلیل ویتامینهای محلول در آب مانند ویتامین C و B به مقدار کافی در بدن ذخیره نمیشوند و باید بهطور مرتب در رژیم غذایی روزانه افراد وجود داشته باشند.
در مقابل ویتامینهای محلول در چربی برای جلوگیری از بیماریهای ناشی از کمبود ویتامین به مدت طولانی در بدن ذخیره میشوند. با توجه با ساختار دو ویتامین ث و آ، از ویتامینهای محلول در آب و چربی و شرط تشکیل محلول «شبیه، شبیه را در خود حل میکند» علت حل شدن در آب و چربی را میتوان توضیح داد.
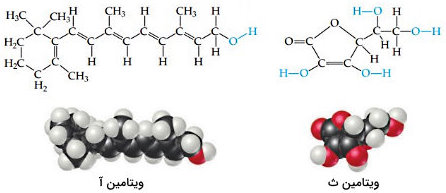
ساختار ویتامین آ یا رتینول ، الکلی با زنجیره کربنی بسیار طولانی است و گروه سهم کمی در ساختار این مولکول دارد. به همین علت رتینول مولکولی ناقطبی به حساب میآید. در مقابل ساختار مولکول ویتامین ث کوچکتر و چندین گروه دارد. گروههای توانایی تشکیل پیوندهای هیدروژنی با مولکول آب را دارند که موجب حل شدن این ویتامین قطبی در حلالی قطبی مانند آب میشوند.
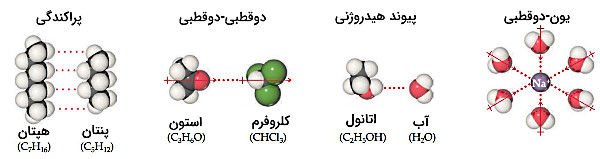
نیروهای بین مولکولی محلول چیست؟
نیروهای بینمولکولی که بهطور خلاصه در شکل زیر نمایش داده شدهاند میتوانند بر ذرات حلشونده و حلال در محلول تأثیرگذار باشند. نیروهای «پراکندگی» (Dispersion) که همچنین با نامهای نیروهای پراکندگی لندن و نیروهای «واندروالس» (Van der Waals) نیز شناخته میشوند، بین دو ماده ناقطبی مانند هپتان و پنتان موجب ایجاد محلول میشود. همچنین نیروهای «یون-دوقطبی» (Ion–dipole) در تشکیل محلولِ ترکیبات یونی شرایط مشابهی ایجاد میکنند.
هنگام تشکیل محلول، سه نوع برهمکنش بینمولکولی رخ میدهد که میزان حل شدن یا انحلالپذیری حلشونده در حلال به قدر نسبی آنها بستگی دارد. این سه برهمکنش و فرایند تشکیل محلول عبارتند از:
- برهمکنش حلشونده-حلشونده: برای پراکندگی ذرات حلشونده توسط حلال، باید بر برهمکنشهای بین ذرات حلشونده غلبه شود.
- برهمکنش حلال-حلال: باید بر برهمکنشهای بین ذرات حلال غلبه شود تا جایی برای ذرات حلشونده بین ذرات حلال بهوجود بیاید.
- برهمکنش حلشونده-حلال: پس از مخلوط شدن، بین ذرات حلال و حلشونده برهمکنش مطلوبی رخ دهد.
وقتی برهمکنشهای حلال و حلشونده بزرگتر از برهمکنش حلشونده-حلشونده و حلال-حلال باشد، محلول شکل میگیرد. در محلول هپتان و پنتان که هپتان نقش حلال و پنتان حل شونده است، هر دو ماده ناقطبی هستند. در این محلول بزرگی برهمکنشهای ذرات حلال و حلشونده با برهمکنش حلشونده-حلشونده و حلال-حلال تقریبا همسان است. در چنین شرایطی هیچ نیروی مانع مخلوط شدن این دو ماده نیست و حل شدن آنها با افزایش آنتروپی و به هر نسبتی انجام میشود.
در مثال حل شدن نمک در آب، نیروهایِ بین مولکولهای قطبی آب و یونهای نمک قدرت بالای دارد که باعث میشود بر نیروهای بینمولکولی در نمک (حلشونده-حلشونده) و آب (حلال-حلال) غلبه شود.
آنتالپی محلول چیست ؟
آنتالپی محلول یا آنتالپی انحلالپذیری، تغییر آنتالپی حل شدن مواد در شرایط فشار ثابت است که بر حسب «کیلوژول بر مول» در دمای ثابت بیان میشود. در فرایند تشکیل محلول تغییر انرژی شامل شکسته شدن پیوند مولکولها و ایجاد جاذبه است. تمام نیروهای بینمولکولی مانند «نیروهای پراکندگی» (Dispersion Forces)، «برهمکنشهای دوقطبی-دوقطبی» (dipole–dipole Interactions)، پیوند هیدروژنی و انرژی این نیروها بخشی از آنتالپی محلول را تشکیل میدهند.
از «قانون هس» (Hess’s Law) برای بررسی و تأثیر برهمکنشهای ذرات حلشونده-حلال، حلال-حلال و حلشونده-حلشونده بر آنتالپی محلول استفاده میشود. انحلال در سه مرحله رخ میدهد.
- : شکسته شدن پیوند حل شونده که فرایندی «گرماگیر» (Endothermic) است.
- : شکسته شدن پیوند حلال که فرایندی گرماگیر است.
- : ایجاد نیروی جاذبه بین حلشونده و حلال که فرایندی «گرماده» (Exothermic) است.
که آنتالپی محلول از مجموع این سه فرایند بهدست میآید.

فرایند تشکیل محلول بهطور معمول با تغییرات در آنتالپی همراه است. برخی از فرایندها گرماده یا گرماگیر هستند. مجموع سه عبارت آنتالپی در فرایند حل شدن میتواند عددی مثبت یا منفی باشد که گرماگیر یا گرماده بودن فرایند را مشخص میکند. با استفاده از تغییرات آنتالپی میتوان احتمال رخ دادن واکنشها را نیز بررسی کرد.
در زیر مثالهایی از فرایندهای گرماده و گرماگیر فهرست شده است.
- حل شدن نمک در آب نیاز به انرژی دارد و است.
- حل شدن بیشتر گازها در حلالهای مایع فرایندی گرماده هستند و انرژی به صورت گرما آزاد میشود.
- حل شدن آمونیوم نیترات در آب به گرما نیاز دارد که فرایندی گرماگیر و آنتالپی آن ۲۶٫۴ کیلوژول بر مول است. در این فرایند مقدار انرژی حل شدن یونهای آمونیوم و یونهای نیترات به مقداری نیست که بتواند موجب شکسته شدن شبکه یونی آمونیوم نیترات شود.
- حل شدن پتاسیم هیدروکسید و منیزیم سولفات فرایندی گرماده است. آنتالپی تشکیل محلول نمک منیزیم سولفات ۹۱٫۲- کیلوژول بر مول است.
از نمکهای آمونیوم نیترات و منیزیم سولفات با توجه به گرماگیر یا گرماده بودن آنتالپی تشکیل محلول آنها در تهیه کیسههای آب سرد (گرماگیر) و آب گرم (گرماده) استفاده میشود که برای درمان آسیبهای ورزشی کاربرد دارد.
حلال و حل شونده چیست ؟
به مادهای که حلشونده را در خود حل میکند حلال گفته میشود و به دو دسته کلی حلالهای قطبی و ناقطبی تقسیم میشوند. حلالها بیشتر در فاز مایع هستند ولی حلالهایی در فاز گاز، جامد و «سیال فوق بحرانی» (Supercritical Fluid) نیز وجود دارد.
آب رایجترین حلالِ مولکولهای قطبی است. یونها و پروتئینهای سلولِ موجودات زنده به صورت محلولهای آبی، درون سلول حل شدهاند. از حلالها در رنگسازی، پاککنندهها، ساخت جوهر و خشکشویی به فراوانی استفاده میکنند.
از «ثابت دیالکتریک یا گذردهی نسبی» (Relative Permittivity) حلالها به عنوان معیاری از قطبی و ناقطبی بودن آنها استفاده میشود. حلالهایی ناقطبی، گذردهی نسبی کمتر از ۱۵ دارند. گذردهی نسبی آب در دمای صفر درجه سلسیوس برابر با ۸۸ است.
حلال های آلی
حلالهای آلی از جمله ترکیات آلی هستند که در ساختار آنها عنصر کربن وجود دارد. حلالهای آلی برای حل کردن مواد، ساخت محلول و استخراج دیگر مواد کاربرد دارند. این ترکیبات به حلالهای طبیعی و مصنوعی تقسیم میشوند.
- حلالهای طبیعی: این دسته از حلالهای آلی به طور طبیعی توسط موجودات ساخته میشود.
- حلالهای مصنوعی: به حلالهایی گفته میشود که توسط انسان با واکنش شیمیایی ترکیبات آلی تولید میشوند.
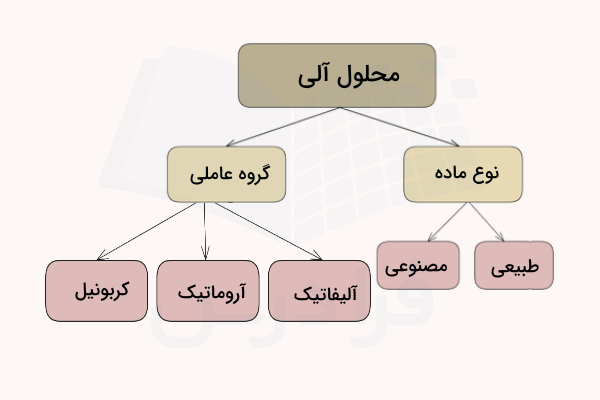
حلالهای آلی براساس گروههای عاملی موجود در ترکیب خود انواع گوناگونی دارند.
- حلالهای آلیفاتیک: حلالهای آلیفاتیک مبتنی بر آلکنها ساخته شده و حلالهایی ناقطبی هستند. این حلالها در استخراج نفت، صنعت رنگ و نقاشی، داروسازی، چسبها و بسپار کاربرد دارند.
- حلالهای آروماتیک: حلالهای آروماتیک نیز حلالهایی ناقطبی هستند و در ساخت چسبها، جوهرها، رنگ، حشرهکشها و فرآیندهای استخراج استفاده میشوند.
- حلالهای کربونیل: این دسته از حلالهای آلی شامل ترکیبات استری و حلالهایی قطبی هستند. از این حلالها در پاک کنندههای رنگ و لاک، پاککنندههای الکترونیکی، چسبسازی، فرایند کافئینزدایی و همچنین در طعمدهندههای غذا استفاده میکنند.

در جدول زیر برخی از رایجترین حلالهای آلی به همراه فرمول شیمیایی و نوع آنها فهرست شده است. هگزان از حلالهای پرکاربرد در صنعت تولید روغن خوراکی و بنزن که ترکیبی شیمیایی با پایداری بالا و واکنشپذیری کم است بیشتر در صنایع شیمیایی و دارویی کاربرد دارد.
| حلالهای آلی | |
|---|---|
| حلال | فرمول شیمیایی |
| حلالهای آلیفاتیک | |
| استیک اسید | |
| استون | |
| هگزان | |
| هپتان | |
| اتانول | |
| حلالهای آروماتیک | |
| بنزن | |
| تولوئن | |
| نفتالین | |
| زایلین | |
حلال معدنی غیرآبی
«حلال معدنی غیرآبی» (Inorganic Nonaqueous Solvent) از حلالهای غیرآبی هستند که برای محیطهای واکنشِ غیرآبی استفاده میشوند. حلال معدنی غیرآبی به دو دسته زیر تقسیم میشوند.
- «حلالهای پروتیک» (Protic Solvents): در واکنش الکترودها و محیطهای قلیایی کاربرد بیشتری دارند.
- «حلالهای آپروتیک» (Aprotic Solvents): برای مطالعه ترکیبات الکتروفیلی استفاده میشوند.
در جدول زیر برخی از رایجترین حلالهای معدنی غیرآبی به همراه فرمول شیمیایی و نوع آنها فهرست شده است.
| حلالهای معدنی غیرآبی | |
|---|---|
| حلال | فرمول شیمیایی |
| حلالهای پروتیک | |
| آمونیاک | |
| هیدروژن فلوئورید | |
| سولفوریک اسید | |
| هیدروژن سیانید | |
| حلالهای آپروتیک | |
| گوگرد دیاکسید | |
| سولفوریل کلرید فلوئورید | |
| دینیتروژن تتراکسید | |
| آنتیموان تریکلرید | |
| برم تریفلورید | |
برای تشکیل محلول با توجه به ویژگیهای حلشونده، نوع حلال انتخاب میشود.
حل شونده یونی
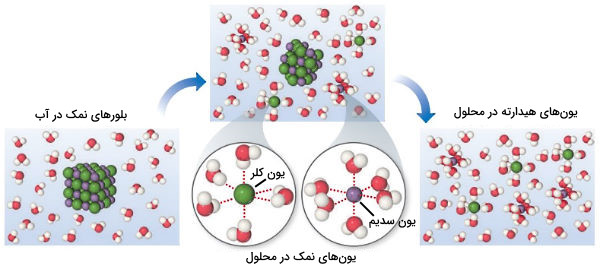
بین یونهای تشکیل دهنده حلشوندههای یونی مانند سدیم کلرید پیوند قوی یونی وجود دارد. در ترکیب بین یونهای سدیم با بار مثبت یونهای کلر با بار منفی پیوند یونی وجود دارند.
با وارد شدن بلورهای نمک در آب، اتمهای اکسیژن آب با بار منفی، یونهای سدیم و اتمهای هیدروژن بار جزئی مثبت یونهای کلر را جذب میکنند. یونهای نمک هنگام ورود، «آبپوشی یا هیدارته» (Hydration) میشوند یعنی مولکولهای آب، یونها را احاطه میکنند. آبپوشی موجب کاهش جاذبه بین یونهای سدیم و کلر و تشکیل محلول میشود. در فرایند حل شدن نمک، آب تنها نقش تفکیککننده را دارد و واکنش دهنده نیست.
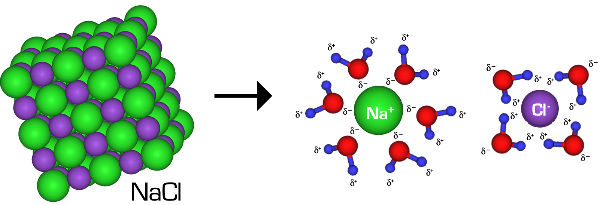
حل شونده قطبی
متانول یکی از ترکیبات قطبی در ساختار خود، گروه قطبی دارد. با برقراری پیوندهای هیدروژنی بین گروههای این ترکیب و اتمهای آب موجب حل شدن آن در آب میشود. حلشوندههای قطبی مانند متانول در حلالهای قطبی مانند آب حل میشوند.
حل شونده ناقطبی
مولکولهای ناقطبی مانند ید ، روغن یا گریس در حلالهای قطبی مانند آب حل نمیشوند. بین ذرات حلشوندههای ناقطبی و حلالهای قطبی هیچ جاذبهای وجود ندارد. چنین حلشوندههایی برای تشکیل محلول به حلالهایی ناقطبی نیاز دارند.
مثال برای حلال و حل شونده
در جدول مثالهای مختلفی از حلال و حلشونده فهرست شده است.
| حلشونده | حلال | محلول |
|---|---|---|
| اکسیژن | نیتروژن | هوا |
| هیدروکربنهای پیچیده | متان | گاز طبیعی |
| کربن دیاکسید | آب | نوشابه |
| گاز آمونیاک | آب | مایع سفیدکننده |
| استیک اسید | آب | سرکه |
| اتیلن گلیکول | آب | ضد یخ |
| نمک | آب | آب دریا |
| ید | اتانول | ضدعفونیکننده تنتور ید |
| گلوکز | آب | آب قند |
| روی | مس | برنز |
| کربن | آهن | فولاد |
| مس | نقره | نقره استرلینگ |
| جیوه | طلا | ملغمه |
| هگزان | پارافین | موم |
بیشتر حجم محلول را حلال تشکیل میدهد. بیشترین مقداری که ماده حلشونده میتواند در حلال حل شود، انحلالپذیری آن ماده را نشان میدهد. میزان انحلالپذیری به عاملهای گوناگونی مانند دما و فشار بستگی دارد.
انحلال پذیری محلول چیست ؟
«انحلالپذیری» (Solubility) بیشترین مقداری از ماده حلشونده است که میتواند در مقدار معینی از حلال در دمای مشخص حل شود. برای مثال، انحلالپذیری در آب با دمای ۰ درجه سلسیوس ۳۵٫۷ گرم در هر ۱۰۰ میلیلیتر آب است. ۳۵٫۷ گرم بیشترین مقداری از که میتواند در آب ۰ درجه سلسیوس حلشود و محلولی با تعادل پایدار ایجاد کند. محلولی که از حل شدن مقادیری کمتر ۳۵٫۷ گرم در آب ۰ درجه سلسیوس تشکیل شود، محلول غیراشباع یا سیرنشده و بیش از این مقدار محلول فراسیر شده است.
انحلالپذیری معیاری برای میزان حل شدن ماده حلشونده در حلالی برای تشکیل محلول است. میزان انحلالپذیری حلشونده به عاملهایی مانند دما و فشار بستگی دارد. گستره انحلالپذیری برای مواد مختلف متفاوت است. دو ماده میتوانند بدون هیچ محدودیتی به هر مقدار در یکدیگر حل شوند. برای مثال، اتانول در آب به هر میزانی حل میشود. در مقابل، حلشونده میتواند هرگز در حلال حل نشود. تیتانیم دیاکسید در آب حلنشدنی و انحلالپذیری آن صفر است.
مثال انحلال پذیری
در شکل زیر رسوب سدیم استات و تشکیل محلول فوق اشباع نمایش داده شده است. در این فرایند حدود ۱۷۰ گرم سدیم استات در دمای ۱۰۰ درجه سلسیوس در ۱۰۰ میلیلیتر آب حل شده است. با کاهش دما و سرد شدن محلول تا ۲۰ درجه سلسیوس رسوب تشکیل میشود. انحلالپذیری نمک سدیم استات در دمای ۲۰ درجه سلسیوس ۴۶ گرم در هر ۱۰۰ میلیلیتر آب است که مقادیر اضافه رسوب میشود. افزودن مقدار اندکی سدیم استات موجب متبلور شدن آن میشود.

اندازهگیری میزان ماده حلشونده در حلال بهصورت غلظت آن ماده در محلول اشباع یا سیر شده بیان میشود. بهطور معمول، انحلالپذیری مواد بهشکل گرم حلشونده در دسیلیتر یا لیتر حلال بیان میشود. همچنین درصد وزنی نیز از دیگر روشهای رایج بیان انحلالپذیری است.
درک مفهوم انحلالپذیری علاوه بر شیمی، در زمینههای دیگری مانند زمینشناسی، زیستشناسی، فیزیک، مهندسی، پزشکی، کشاورزی، اقیانوسشناسی و همچنین در فعالیتهای مانند نقاشی، نظافت و آشپزی اهمیت بالایی دارد.
محلول فراسیر شده
هنگامی که مقدارِ ماده حلشونده از میزان انحلالپذیری آن در حالت تعادل فراتر رود «فراسیرشدگی» (Supersaturation) رخ میدهد و محلول فراسیر شده تشکیل میشود. محلول فراسیر شده همچنین با تغییر دمای محلول سیر شده نیز ایجاد میشود. در موارد بسیاری انحلالپذیری با دما رابطه عکس داشته و با کاهش دما، انحلالپذیری نیز کاهش پیدا میکند و با کاهش دمای محلول، حلشونده اضافی به شکل بلور از محلول خارج میشود.
«بلورش، تبلور یا کریستالیزاسیون» (Crystallization) فرایند مخالف تشکیل محلول است. افزایش غلظت ماده حلشونده در محلول، احتمال برخورد برخی از ذرات حلشونده را افرایش میدهد که موجب تشکیل بلورهای ماده حلشونده میشود.از تکنیک «تبلور مجدد» (Recrystallization) و ویژگی فراسیرشدگی در خالصسازی ترکیبات شیمیایی استفاده میکنند.
یکی از راههای تولید نمک خوراکی استفاده از فراسیرشدگی آب اقیانوس است. برای تولید نمک، آب اقیانوس را به حوضچههای کمک عمقی هدایت میکنند. با تبخیر آب، محلول آبِ اقیانوس اشباع میشود و با تبخیر بیشتر محلول به نقطه فراسیر شده رسیده و موجب رسوب نمک میشود.

فراسیرشدگی در محلولهای گاز در مایع نیز میتواند تشکیل شود. انحلالپذیری گازها با افزایش فشار در مایع افزایش پیدا میکند و محلول فراسیر شده ایجاد میکند. نوشیدنیهای گازدار تحت فشار بالا و حل کردن گاز کربن دیاکسید در مایع تولید میشوند. هنگام استخراج نفت نیز گازهایی که تحت فشار در مایعات نفتی حل شده و به حالت فوق اشباع رسیدهاند خارج میشوند.
رگبار که میزان بسیار زیاد بارش باران در مدت زمان کوتاهی است، در نتیجه پدیده فراسیرشدگی مخلوطی از گازها در بخار آب موجود در جو ایجاد میشود. هوا در شرایط دمایی پایین و فشار بالا بیش از اندازه با بخار آب مخلوط میشود و با افزایش دما و کاهش فشار به شکل رگبار، آب اضافی تخلیه میشود.
غلظت محلول چیست ؟
در شیمی، غلظت مقدار یک جز در مقدار کل تعریف میشود. غلظت محلول را میتوان بهصورت کمی یا کیفی بیان کرد. برای بیان کیفی غلظت از اصطلاحاتی مانند رقیق و غلیظ استفاده میشود.
- رقیق: به محلولهایی گفته میشود که در آن حلشونده غلظت نسبتا کمی دارد.
- غلیظ: محلولهایی که در آن حلشونده غلظت بالایی دارد.
روشهای گوناگونی برای بیان کمی غلظت استفاده میشود. غلظت محلول را میتوان به روشهای گوناگونی برحسب جرم، حجم یا مول بیان کرد.
درصد جرمی
از سادهترین روشهای بیان کمی غلظت درصد جرمی است. که به صورت زیر تعریف میشود.
- : درصد جرمی
- : مقدار جرم کل
- : مقدار جرم ماده حلشونده
برای مثال، محلول ۳۶٪ هیدروکلریک اسید، ۳۶ گرم هیدروکلریک اسید در ۱۰۰ گرم محلول است.
مثال: محلولی از حل شدن ۱۳٫۵ گرم شکر در ۰٫۱۰۰ کیلوگرم آب تشکیل شده است. درصد جرمی ماده حلشونده در این محلول را به دست آورید.
پاسخ: برای محاسبه درصد جرمی، مقدار جرم کل (جرم حلال + حلشونده) و مقدار جرم ماده حلشونده مورد نیاز است.
- مقدار گرم حلشونده: ۱۳٫۵ گرم
- مقدار گرم حلال: ۰٫۱۰۰ کیلوگرم برابر با ۱۰۰ گرم
- جرم کل: مجموع جرم شکر و آب
%
قسمت در میلیون (ppm)
برای بیان غلظت محلولهای بسیار رقیق از قسمت در میلیون یا قسمت در میلیارد استفاده میشود. قسمت در میلیون مانند درصد جرمی، جرم حلشونده در جرم کل محلول است.
بنابراین محلولی که غلظت آن است یعنی یک گرم از ماده حلشونده در گرم از محلول حل شده است. غلظت همچنین بهصورت ۱ میلیگرم بر ۱ کیلوگرم نیز بیان میشود. چون چگالی آب ۱ گرم بر ۱ میلیلیتر است، ۱ کیلوگرم محلول آبی بسیار رقیق حجمی نزدیک به ۱ لیتر دارد.
مثال: نمونهای از آب چاه حاوی ۵٫۴ میکروگرم یون در ۲٫۵ گرم آب است. غلظت یون را محاسبه کنید.
پاسخ: ابتدا باید میکروگرم ماده حلشونده به گرم تبدیل شود.
پس ۵٫۴ میکروگرم برابر است با گرم و ppm یون به صورت زیر بهدست میآید.
قسمت در میلیارد (ppb)
قسمت در میلیارد به صورت زیر تعریف میشود.
غلظت مواد سمی یا سرطانزا در محیط بهصورت یا بیان میشود. به عنوان مثال حداکثر مقدار مجاز آرسنیک (As) در آب آشامیدنی توسط سازمان بهداشت جهانی یا اعلام شده است.
غلظت مولار محلول چیست؟
غلظت مولی یا مولاریته به صورت تعداد مول ماده حلشونده در ۱ لیتر محلول بهصورت زیر تعریف میشود. واحد غلظت مولار است که به اختصار با حرف نمایش داده میشود.
- : مقدار حلشونده (برحسب مول)
- : تعداد ذرات حلشونده در حجم
- : حجم محلول (برحسب لیتر)
- : ثابت آووگادرو برابر با تعریف شده است.
- : چگالی تعداد یا است.
غلظت جرمی محلول چیست؟
غلظت جرمی یکی دیگر از انواع غلظت محلول است که به صورت جرم حلشونده در حجم محلول تعریف شده است. غلظت جرمی و چگالی مواد خالص با هم برابر است به همین دلیل از نماد برای غلظت جرمی استفاده میشود.
- : جرم
- : حجم
نرمالیته محلول چیست؟
نرمالیته بهصورت غلظت مولی بر ضریب اکیوالان تعریف شده است.
- : غلظت مولار
- : عامل هم ارزی یا ضریب اکیوالان
مولالیته محلول چیست؟
مولالیته به صورت تعداد مول ماده حلشونده در ۱ کیلوگرم محلول بهصورت زیر تعریف میشود. واحد مولالیته مول بر کیلوگرم است.
- : مول حلشونده
- : جرم حلال (برحسب کیلوگرم)
کسر حجمی محلول چیست؟
کسر حجمی، سهم حجم اجزای محلول را نشان میدهد و به صورت حجم جز محلول به حجم کل محلول تعریف میشود. کسر حجمی کمیتی بدون واحد است.
- : حجم جز
- : حجم کل
کسر مولی محلول چیست؟
کسر مولی بر اساس تعداد مولهای ماده حلشونده و محلول بهصورت زیر تعریف میشود. معمولا از نماد برای کسر مولی استفاده میشود. برای مثال کسر مولی هیدروکلریک اسید در محلول به صورت نشان داده میشود. کسر مولی هیچ واحدی ندارد.
- : مول جز
- : مول کل
بنابراین، کسر مولی هیدروکلریک اسید در محلولی که حاوی ۱٫۰۰ مول هیدروکلریک اسید و ۸٫۰۰ مول آب است به صورت زیر محاسبه میشود:
مجموع کسرهای مولی همه اجزا محلول برابر با ۱ است. بنابراین برای محاسبه کسر مولی آب در این محلول، میتوان مقدار کسر مولی هیدروکلریک اسید را از یک کسر کرد تا کسر مولی آب بهدست أید.
کسر جرمی محلول چیست؟
کسر جرمی به صورت جرم جز محلول به جرم کل محلول تعریف میشود. کسر جرم کمیتی بدون واحد است.
- : جرم جز
- : جرم کل
ویژگی های محلول چیست ؟
مواد موجود در محلول در سطح مولکولی با یکدیگر تعامل دارند. در ماده محلول مولکولهای حلشونده توسط مولکولهای حلال، «حلالپوشی» (Solvation) میشوند یعنی، این مولکولها اطراف مولکولهای حلشونده قرار میگیرند. در محلولها با افزایش آنتروپی، پایداری ترمودینامیکی آن نیز نسبت به حلال افزایش پیدا میکند.
برخی از مهمترین ویژگیهای ماده محلول عبارتند از:
- محلولها موادی همگن هستند.
- ذرات حل شده در محلول با چشم دیده نمیشوند. برای مثال در مخلوطی ناهمگن مانند سوسپانسیون این ذرات قابل دیدن هستند.
- محلولها پراکندگی نور ندارند ولی سوسپانسیونها اثر تیندال و رایلی را ایجاد میکنند.
- محلولها رسوب نمیکنند و پایدار هستند.
- حلشونده توسط فیلتراسیون یا صافش قابل جداسازی نیست.
- محلولها تنها یک فاز دارند و فاز آنها همان حالت ماده حلال است.

نقطه جوش
یکی از ویژگیهای مهم حلال، نقطه جوش آن است. نقطه جوش تعیینکننده میزان سرعت تبخیر است. برخی از حلالها مانند دیاتیل اتر، دیکلرومتان یا استون در دمای اتاق به سرعت تبخیر میشوند. در مقابل حلالهایی مانند آب و دیمتیل سولفوکسید برای تبخیر شدن به دماهای بالاتری نیاز دارند.
چگالی نسبی محلول چیست؟
حلالهای آلی نسبت به آب چگالی کمتری دارند و روی سطح آب قرار میگیرند. در بین حلالهای آلی دیکلرومتان و کلروفرم چگالی بیشتر از آب دارند و در لایه پایینتر قرار میگیرد. برای حلالها، بیشتر از چگالی نسبی استفاده میشود.
اشتعال پذیری
بیشتر حلالهای آلی با توجه به فراریتی که دارند میتوانند بسیار قابل اشتعال باشند. برخی از حلالهای کلردار مانند دیکلرومتان و کلروفرم در این بین استثنا هستند. دیاتیل اتر و کربن دیسولفید دمای خود اشتعالی بسیار پایین و خطر آتشسوزی بالایی دارند. برخی از حلالها مانند متانول با شعله بسیار داغ و شعلهای بیرنگ میسوزند و میتواند موجب تأخیر در تشخیص آتشسوزی شوند. مخلوط بخار برخی از حلالها با هوا نیز میتواند موجب انفجار شود.

امتزاج پذیری محلول چیست؟
«امتزاجپذیری» (Miscibility) از ویژگیهای برخی مواد است که به هر میزان و هر غلظتی بدون محدودیت با یکدیگر مخلوط همگن تشکیل میدهند. برخی از مایعات، گازها و مواد جامد قابلیت امتزاجپذیری دارند. آب و اتانول از شناخته شدهترین مواد قابل امتزاج هستند که به هر نسبتی در یکدیگر حل شده و مخلوط همگن تولید میکنند. در مقابل موادی که در هر نسبتی در یکدیگر حل نمیشوند، امتزاجناپذیر نام دارند. برای مثال آب و روغن قابلیت امتزاج ندارند.
بوتانون یا متیل اتیل کتون انحلالپذیری بالایی در آب دارد ولی در برخی از نسبتها انحلال آنها با تشکیل دو فاز همراه است و قابلیت امتزاج ندارند. با توجه به زنجیره کربنی در ترکیبات آلی میتوان امتزاجپذیری آنها در آب را تعیین کرد. با افزایش تعداد کربن در ساختار این ترکیبات حل شدن آنها در آب کاهش پیدا میکند. در بین الکلها بوتانول و اکتانول به ترتیب با ۴ و ۸ کربن امتزاجناپذیر هستند. کربوکسیلیک اسیدهای راستزنجیر و بوتانوئیک اسید نیز از مواد امتزاجپذیر هستند.
خواص کولیگاتیو محلول چیست؟
«خواص کولیگاتیو» (Colligative properties) از ویژگیهای محلول است که به نسبت ذرات ماده حلشونده به حلال بستگی دارد و ماهیت خود ذرات مهم نیست. کاهش نقطه انجماد و افزایش نقطه جوش به غلظت مواد بستگی دارد و به نوع یا ماهیت ذرات وابسته نیست و از خواص کولیگاتیو محلولها هستند. برخی از ویژگیهای فیزیکی محلولها با ویژگی حلال خالص تفاوت دارد.
برای مثال، آب در دمای ۰ درجه سلسیوس یخ میزند ولی محلولهای آبی در دماهای پایینتر منجمد میشوند. در روزهای سرد فصل پاییز و زمستان وقتی اتیلن گلیکول به رادیاتور خودرو افزوده میشود موجب کاهش نقطه انجماد محلول آبی شده و به عنوان ضدیخ عمل میکند. مواد حل شده در محلولهای آبی میتوانند موجب افزایش نقطه جوش محلول شوند. از این ویژگی برای کارکرد بهتر موتورها در دماهای بالاتر استفاده میکنند.
خواص کولیگاتیو به اثر جمعی تعداد ذرات املاح بستگی دارد. این خواص عبارتند از:
- کاهش نسبی فشار بخار
- کاهش نقطه انجماد
- افزایش نقطه جوش
- فشار اسمزی
کاهش نسبی فشار بخار محلول چیست؟
بین مایع و بخار آن در ظرف بسته تعادل برقرار میشود. فشاری که بخار مایع در حالت تعادل، یعنی وقتی سرعت تبخیر و معیان برابر است، به مایع وارد میکند، فشار بخار نامیده میشود. به موادی که فشار بخار قابل اندازهگیری ندارد، مواد غیرفرار و موادی که فشار بخار قابل اندازهگیری دارند مواد فرار هستند.
در محلولی که از حل شدن ماده غیرفرار در حلالِ فرار تشکیل شده است، مولکولهای حلال در حالت محلول نسبت به حالت خالصِ حلال، آزادی حرکتی کمتری دارند. حرکت کمتر مولکولهای حلال موجب کاهش برخوردها و تمایل کمتری برای فرار دارند. در واقع حل شدن ماده در حلال و تشکیل محلول باعث کاهش فشار بخار آن نسبت به حالت خالص میشود که در شکل زیر نمایش داده شده است.
در وضعیت ایدهآل، فشار بخار حلالی که در آن ماده غیرفراری حل شده است با غلظت حلال در محلول متناسب است. این رابطه به صورت کمی براساس «قانون رائول» (Raoult’s law) بیان میشود که توسط شیمیدان فرانسوی «فرانسوا رائول» (François Raoult) به دست آمد.
- : فشار بخار حلال
- : کسر مولی حلال
- : فشار بخار
بر اساس این رابطه فشار جزئی بالای مایع با حاصلضرب کسر مولی حلال، در فشار بخار حلال خالص برابر است.
محلولهایی با دو یا چند جزو فرار
برخی از محلولها از چند جز فرار تشکیل میشوند. برای مثال، بنزین محلولی از چند مایع فرار است. فشارهای جزئی بالای محلولهایی با دو یا چند جزو فرار قانون رائول تعریف میشود. برای محلولی با دو جز فرار و فشار بخار به صورت زیر است.
در چنین محلولهایی وقتی محلول با بخار بالای مایع در تعادل است، جزیی که فرارتر است سهم بیشتر از بخار را تشکیل میدهد. این ویژگی اساس روش تقطیر است که برای جداسازی مخلوطهایی با اجزای فرار و تصفیه مواد مایع استفاده میشود. در صنایع پتروشیمی جداسازی نفت به سوخت دیزل، بنزین، روانکنندهها و سایر محصولات از روش تقطیر جز به جز به دست میآیند. شکل زیر برجهای تقطیر در مقیاس صنعتی هستند که برای جداسازی اجزای فرار مخلوطهای آلی کاربرد دارد.

افزایش نقطه جوش
افزودن مواد غیرفرار به حلال با افزایش فشار بخار محلول همراه است. به همین علت در شکل زیر منحنی فشار بخار محلول نسبت به منحنی فشار بخار حلالِ خالص به سمت پایین جابهجا شده است. نقطه جوش معمولی مایع دمایی است که در آن دما، فشار بخار برابر با ۱۰۱٫۳ کیلو پاسکال است. محلول نسبت به حلال خالص فشار بخار کمتری دارد، پس به دمای بالاتری نیاز داد تا به فشار بخار ۱۰۱٫۳ کیلو پاسکال برسد. به همین خاطر محلول دمای جوش بالاتری از حلال دارد. افزایش نقطه جوش محلول، نسبت به حلال به مولالیته ماده حلشونده بستگی دارد.
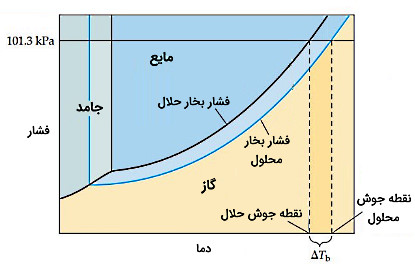
تغییر نقطه جوش محلول در مقایسه با حلال خالص به صورت زیر است که در آن «ثابت مولالی افزایش نقطه جوش» (Molal Boiling Point-Elevation Constant) برای حلال است که بهطور تجربی برای هر حلال تعیین میشود.
- : نقطه جوش محلول
- : نقطه جوش حلال خالص
- : مولالیته حلشونده
- : ثابت مولالی افزایش نقطه جوش
- : «ضریب وانتهوف» (Van 't Hoff factor)
برای غیرالکترولیتها، مقدار ضریب وانتهوف برابر با ۱ فرض میشود. برای الکترولیتها، این ضریب به چگونگی یونیزه شدن ماده در حلال بستگی دارد. برای پیشبینی اثر ماده حلشونده بر افزایش نقطه جوش محلول، آگاهی از الکترولیت یا غیرالکترولیت بودن آن مهم است.
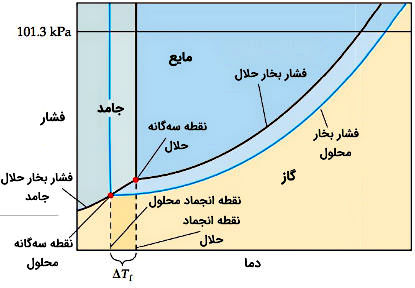
کاهش نقطه انجماد محلول چیست؟
نقطه انجماد محلول دمایی است که در آن اولین بلورهای حلال در حالت تعادل با محلول تشکیل میشوند. منحنیهای فشار بخار برای فازهای مایع و جامد در نقطه سهگانه نمودار فازی به هم میرسند. در نمودار فازی زیر، دمای سهگانه محلول کمتر از دمای سهگانه حلال است، زیرا فشار بخار محلول کمتر از حلال است. خط تعادل فاز جامد-مایع تقریبا به صورت عمودی از نقطه سهگانه بالا میرود. در شکل میتوان دید که دمای نقطه سهگانه محلول کمتر از دمای مایع خالص است و برای تمام نقاط منحنی تعادل جامد-مایع نیز صادق است.
تغییر در نقطه انجماد یا مولالیته ماده حلشده تناسب مستقیم دارد. تغییر نقطه انجماد محلول در مقایسه با حلال خالص به صورت زیر تعریف میشود.
- : نقطه انجماد محلول
- : نقطه انجماد حلال خالص
- : مولالیته حلشونده
- : ثابت مولالی کاهش نقطه انجماد
- : ضریب وانتهوف
در این رابطه «ثابت مولالی کاهش نقطه انجماد» (Molal Freezing-Point-Depression Constant) برای حلال است که بهطور تجربی برای هر حلال تعیین میشود. چون محلول در دمای کمتری نسبت به حلال منجمد میشود مقدار منفی است.
فشار اسمزی محلول چیست؟
برخی از مواد، از جمله بسیاری از غشاها در سیستمهای زیستی و مواد مصنوعی مانند سلفون، نیمهتراوا هستند. هنگامی که که مواد نیمهتراوا با محلول در تماس قرار میگیرد، فقط به یونها یا مولکولهای کوچک اجازه میدهند از شبکه منافذ ریز خود عبور کنند. در فرایندی به نام اسمز، مولکولهای حلال از غشای نیمه تراوا بین دو محلول با غلظتهای مختلف عبور میکنند. در این فرایند مولکولهای حلال از محلول با غلظت کمتر به محلول با غلظت بیشتر حرکت میکنند و محلولها برای رسیدن به غلظتهای برابر هدایت میشوند.

افزودن شکر به توت فرنگی باعث میشود که آب موجود در آن از داخل سلولها جذب شکر شود که یکی از کاربردهای اسمز است. اسمز یکی از چهار خواص کولیگاتیو بهشمار میآید. فشار اسمزی از قانون مشابه قانون گاز ایدهآل پیروی میکند و از رابطه زیر بهدست میآید.
- : ثابت گاز ایدهآل
- : دمای مطلق
- : مولاریته
- : حجم محلول
- : ضریب وانتهوف
- : مول ماده حلشونده
چون فشار اسمزی برای هر محلول به غلظت محلول بستگی دارد از خواص کولیگاتیو محلول است. تعاریف زیر با توجه به فشار اسمزی دو محلولی که توسط غشا جدا شده است بیان میشود.
- محلول «ایزوتونیک» (Isotonic): اگر دو محلول با فشار اسمزی یکسان توسط غشای نیمه تراوا از هم جدا شوند، اسمز رخ نخواهد داد. این دو محلول نسبت به یکدیگر ایزوتونیک هستند.
- محلول «هیپوتونیک» (Hypotonic): اگر یک محلول دارای فشار اسمزی کمتر باشد، نسبت به محلول غلیظتر هیپوتونیک است.
- محلول «هیپرتونیک» (Hypertonic): محلول غلیظتر نسبت به محلول رقیقتر هیپرتونیک است.
فرایند اسمز نقش مهمی در سیستمهای زنده دارد. برای مثال، غشای گلبولهای قرمز خون نیمهتراوا هستند. قرار دادن گلبول قرمز در محلولی که نسبت به محلول داخل سلولی هیپرتونیک است، باعث خروج آب از سلول میشود. در مقابل وارد شدن سلول در محلولی که نسبت به مایع درون سلولی هیپوتونیک است باعث حرکت آب به داخل سلول میشود که این فرایند که «همولیز یا خونکافت» (Hemolysis) نامید دارد ممکن است موجب پارگی سلول شود.
از این ویژگی در صنایع غذایی برای ذخیره سازی و حفظ میوه و گوشت استفاده میشود. افزودن نمک به گوشت موجب میشود باکتریهای موجود با از دست دادن آب از بین بروند.
انواع محلول ها با مثال
محلولها را میتوان به روشهای گوناگون و براساس انحلالپذیری، فاز حلال یا کاربردها و نوع ترکیبات آن تقسیمبندی کرد.
- انحلالپذیری
- محلول سیر نشده: محلولی که در آن، حلال توانایی حلکردن مقدار بیشتری از ماده حلشونده را در خود دارد.
- محلول سیر شده: وقتی بیشترین مقدار ماده حلشونده در حلال حل شده باشد.
- محلول فراسیر شده: با حل شدن مقدار بیشتری از ماده حلشونده در محلول سیر شده تشکیل میشود. حلشونده اضافی در محلول فراسیر شده رسوب میکند.
- فاز حلال
- محلول گازی: محلولی که در آن حلال بهصورت گاز است.
- محلول مایع: محلولی که در آن حلال بهصورت مایع است.
- محلول جامد: محلولی که در آن حلال بهصورت جامد است.
- کاربرد و ترکیب
- محلول آبی
- محلول بافر
- محلول ایدهآل
- «محلول فولک» (Folch Solution)، مخلوط کلروفرم و متانول است که در جداسازی ترکیبات قطبی از ناقطبی کابرد دارد.
- «محلول هالتفرتر» (Holtfreter's Solution)، محلولی نمکی () است که در پژوهش رویانهای دوزیستان و کاهش عفونتهای باکتریایی توسط زیستشناسان استفاده میشود.
- «ادبلو» (AdBlue) یا «مایع اگزوز دیزلی» (Diesel Exhaust Fluid)، محلول آبی از مخلوط اوره و «آب دیونیزه یا بییون» (Deionized Water | DI water) است. از این محلول برای کاهش آلودگی هوا توسط موتورهای دیزلی استفاده میکنند.
- «محلول کربس–هنسلیت» (Krebs–Henseleit Solution)، مخلوطی از ترکیبات مختلف است که برای پژوهشهای زیستی کاربرد دارد.
- محلول آلسور (Alsever's Solution) از گلوکز، سدیم سیترات ، سیتریک اسید و سدیم کلرید تشکیل میشود. محلول آلسور برای جلوگیری از انعقاد یا لخته شدن خون کاربر دارد.
مواد حلشونده و حلال میتوانند بهصورت گاز، مایع و جامد باشند. محلولها با توجه به نوع فاز و حالت فیزیکی حلال به حلالهای گازی، مایع و جامد تقسیم میشوند. در جدول زیر انواع محلول از نظر فاز آنها همراه با مثال فهرست شده است.
| انواع محلول چیست | ||
|---|---|---|
| نوع محلول | فاز حلشونده و حلال | مثال |
| گاز | گاز در گاز | هوا |
| مایع | گاز در مایع | نوشابه |
| مایع در مایع | سرکه | |
| جامد در مایع | آب دریا | |
| جامد | جامد در جامد | برنز |
| گاز در جامد | هیدروژن در پلاتین | |
| مایع در جامد | ملغمه | |
محلول گازی چیست ؟
محلول گازی زمانی تشکیل میشود که حلال و حلشونده در فاز گاز باشند. حرکت براونی و برخوردهای پیدرپی مولکولها موجب همگن ماندن حلالهای گازی میشوند.
- گاز در گاز: هوا نمونهای از محلول گازی است که گاز اکسیژن و گازهای دیگر در نیتروژن حل شدهاند.
محلول جامد چیست ؟
وقتی حلال در فاز جامد باشد، محلول جامد تشکیل میشود. گازها، مایعات و جامدها میتوانند در حلالهای جامد حل شده و محلولهای جامد را تشکیل دهند.
- گاز در جامد: حل شدن گاز هیدروژن در برخی فلزها مانند پلاتین (Pt)، از محلولهای گاز در جامد هستند. از این ویژگی برای ذخیرهسازی هیدروژن مورد پژوهش قرار گرفته است.
- مایع در جامد:
- تشکیل یک ملغمه یا آمالگام محلول جیوه (Hg) در طلا (Au) است.
- فتالات در پلیوینیل کلراید (PVC)
- هگزان در موم پارافین
- آب در جامدهای نمدار
- جامد در جامد:
- کربن در آهن و تولید فولاد، محلول جامد در جامد است.
- تشکیل آلیاژ برنز، محلول روی در مس است.
محلول مایع
محلول مایع رایجترین شکل محلول است. وقتی حلال در فاز مایع باشد، محلول مایع تشکیل میشود. گازها، مایعات و جامدها میتوانند در حلالهای مایع حل شده و محلولهای مایع را به وجود آورند. در زیر نمونههایی از محلولهای مایع فهرست شده است.
- گاز در مایع:
- اکسیژن در آب
- کربن دیاکسید در آب: حل شدن کربن دیاکسید در آب با واکنش شیمیایی و تشکیل یون همراه است. آب گازدار، سودا یا نوشابه مثالهایی از محلول گاز در مایع هستند. حبابهایی که در چنین محلولهایی دیده میشوند، گاز کربن دیاکسید نیستند بلکه تنها «جوششی» (Effervescence) از این گاز در سطح آب را نشان میدهند. گاز کربن دیاکسید در سطح مولکولی حل شده و قابل مشاهده نیست.
- مایع در مایع: شامل مخلوطی از دو یا چند ماده در فاز مایع با یکدیگر است.
- جامد در مایع: حل شدن مواد جامد در مایع، محلولهای جامد در مایع هستند. حل شدن قند و شکر در آبِ لیمو و تشکیل شربت آبلیمو یا نمک در آب مثالهایی از محلول جامد در مایع هستند.

مایعات بدن یا «زیستسیالها» (Biofluids) که بیش از ۵۰ درصد از وزن کل بدن را تشکیل میدهند، محلولهایی با اجزا بسیاری هستند. بسیاری از مایعات بدن به دلیل وجود یونهایی مانند پتاسیم، به شکل الکترولیت هستند. مایعات بدن همچنین حاوی مولکولهای مانند ساکاروز و اوره است. اکسیژن و کربن دیاکسید نیز از اجزا تشکیل دهنده خون هستند و اندازهگیری غلظت آنها برای شناسایی بسیاری از بیماری کاربرد دارد.
برخی از مخلوطهای مایع مانند کلوئیدها، سوسپانسیونها، امولسیونها محلول نیستند. این دسته از مواد به دلیل ناهمگن بودن ویژگیهای محلولها را ندارند.
محلول آبی چیست ؟
«محلول آبی» (Aqueous solution)، مخلوطی همگن است که آب در آن نقش حلال را دارد. گونههای حلشونده در محلولهای آبی با نماد «aq» که کوتاه شده واژه «Aqueous» است در معادلات شیمیایی نمایش داده میشوند. برای مثال وقتی سدیم کلرید در آب حل میشود به شکل نمایش داده میشوند.
به موادی که به آسانی در آب حل میشوند «هیدروفیل یا آبدوست» (Hydrophilic) میگویند. در مقابل مواد «آبگریز» (Hydrophobic) در آب حل نشده و تشکیل محلول آبی نمیدهند. برای مثال روغن از مواد آبگریزی است که در آب حل نمیشود. بسیاری از ترکیبات آلی آبگریز هستند. مولکولهای مواد آبگریز معمولا مولکولهای ناقطبی هستند و در حلالهای ناقطبی حل میشوند. این مولکولها با در کنار هم قرار گرفتن تشکیل «میسل» (Micelle) میدهند.

بهطور کلی به دلیل استفاده زیاد از آب و فراوانی این حلال در آزمایشهای شیمی، واژه محلول به محلولهای آبی اشاره دارد. بیشتر در محلولهای غیرآبی، حلال ذکر میشود. در محلولهای آبی واکنشها به صورت «متاتسیس» (Metathesis) انجام میشوند. متاتسیس اصلاحی برای واکنشهای جابجایی دوگانه است. واکنشهای رسوبی از جمله واکنشهای جابجایی دوگانه هستند. برای مثال، وقتی دو محلول الکترولیت قوی با هم مخلوط شوند تشکیل رسوب میدهند.
اصطلاحات اسید، باز و pH تنها برای محلولهای آبی کاربرد دارند. برای مثال، اندازهگیری pH آبلیمو یا سرکه که محلولهایی آبی هستند به راحتی انجام میشود ولی اندازهگیری روغن نباتی نتایج معناداری ارائه نمیدهد. برای تشکیل محلولهای آبی، نیروی جاذبه بین ماده حلشونده و مولکولهای آب باید بیشتر از پیوند هیدروژنی آب باشد.
الکترولیت
از ویژگیهای محلولهای آبی میتوان به رسانای الکتریکی و تشکیل «الکترولیت» (Electrolyte) اشاره کرد. اگر محلولهای آبی رسانای جریان الکتریکی باشند، تشکیل الکترولیت میدهند. الکترولیتها به دو دسته زیر تقسیم میشوند.
- الکترولیت قوی: رسانایی خیلی خوب جریان الکتریکی هستند. چنین موادی بهطور کامل در آب یونیزه میشوند. یونهای ماده حلشونده در الکترولیتهای قوی توانایی حرکتی بیشتری دارند و به راحتی جابهجا میشوند.
- الکترولیت ضعیف: رسانایی ضعیف جریان الکتریکی هستند و مواد حلشونده کمی در آب یونیزه شدهاند.
مواد غیرالکترولیت مانند قند، اوره، گلیسیرین و متیلسولفونیلمتان در آب حل میشوند ولی به شکل یون تجزیه نمیشوند.
محلول بافر چیست ؟
«محلول بافر» (Buffer solution) از محلولهای آبی است که با مخلوط کردن اسید ضعیف و باز مزدوج آن یا باز ضعیف و اسید مزدوج آن تشکیل میشود. محلولهای بافر در برابر تغییرات مقاوم هستند. اگر به آنها اسید یا باز قوی افزوده شود، غلظت یون هیدرونیوم آن تقریبا بدون تغییر باقی میماند. این ویژگی محلول بافر برای حفظ در آزمایشهای شیمی و بسیاری از موجودات زنده استفاده میشود.
سیستم بافر بیکربنات برای تنظیم pH خون عمل میکند. در این سیستم تعادل کربنیک اسید ، یون بیکربنات و کربن دیاکسید برای کارکرد مناسب متابولیسم یا سوخت و ساز سلولی بدن حفظ میشود. در صورت تغییر و تغییر جزئی غلظت یونهای هیدروژن در سلول، فعالیت آنزیم میتواند متوقف شود.
محلول بافر به دو دسته بافر اسیدی و بافر بازی تقسیم میشود.
- بافر اسیدی: از بافر اسیدی برای حفظ غلظت یون هیدروژن در محیط اسیدی استفاده میشود و از مخلوط اسید ضعیف و باز مزدوج آن تشکیل میشود. محلول آبی استیک اسید
و سدیم استات بافر اسیدی با pH=۴٫۷۴ است. - بافر بازی: بافرهای بازی از واکنش باز ضعیف و اسید مزدوج آن تشکیل میشود. محلول آبی آمونیوم هیدروکسید و آمونیوم کلرید با غلظتهای برابر بافری قلیایی با pH=۹٫۲۵ است.
محدوده pH مؤثر محلول بافری به ثابت تعادل اسید یا باز تشکیل دهنده آن بستگی دارد. محلولهای بافر در تخمیر، نگهدارندههای غذا، دارورسانی، آبکاری، صنعت چاپ، بررسی فعالیت آنزیمها کاربرد دارند.
محلول ایده آل چیست ؟
محلول ایدهآل در شیمی به مخلوطی گفته میشود که آنتالپی اختلاط در آن برابر با صفر است. یعنی تشکیل محلول ایدهآل با آزاد شدن یا جذب گرما یا تغییر حجم همراه نیست. آنتالپی اختلاط محلول هرچه به صفر نزدیکتر باشد، محلول رفتار ایدهآلتری دارد. در واقع در محلول ایدهآل مشابه گازهای ایدهآل، میانگین قدرت برهمکنشهای نیروهای بینمولکولی بین تمام مولکولهای محلول یکسان فرض میشود و آنتروپی آن مانند گازهای ایدهآل محاسبه میشود.
در محلول ایدهآل، فشار بخارِ حلال از قانون رائول و فشار حلشونده از «قانون هنری» (Henry's Law) پیروی میکند. «ضریب فعالیت» (Activity Coefficient) یا معیارِ انحراف از رفتار ایدهآل بودن، برای هر جز برابر با «۱» است. در ترمودینامیک شیمیایی و کاربردهای آن، مانند توضیح خواص کولیگاتیو مفهوم محلول ایدهآل از تعاریف بنیادی است. پیشنهاد میکنی برای درک بهتر روش های تهیه محلول، فیلم آموزش محلولسازی در آزمایشگاه فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
تهیه محلول چیست ؟
تهیه محلول در آزمایشگاه با توجه به غلظت نهایی و شرایط آن به روشهای گوناگونی انجام میشود. بهطور معمول، محلول با حل کردن جرم مشخصی از ماده حل شونده در مقدار مشخصی از حلال ساخته میشود. از رایجترین راههای بیان غلظت برای ساخت محلول استفاده از غلظت مولار است. هنگام کار با مواد شیمیایی و ساخت محلول حتما باید از تجهیزات حفاظتی مانند عینک و روپوش استفاده شود. در زیر به برخی از روشهای آمادهسازی محلول اشاره شدهاست.
چگونه محلول مولار درست کنیم ؟
یکی از تکنیکهای مهم در تمام سطوح شیمی، تهیه محلول با غلظت مشخص است. مولاریته تعداد مول ماده حل شده در یک لیتر از محلول تعریف میشود. تهیه محلول ۱ مولار از مواد مختلف به ترتیب زیر انجام میشود:
- جرم مولی ماده مورد نظر محاسبه شود.
- به اندازه یک مول از ماده مورد نظر که برابر با جرم مولی آن ماده است وزن میشود.
- بالنی به حجم ۱ لیتر تا خط نشانه با آب مقطر پر میشود.
- مقدار وزن شده به بالن افزوده میشود.
- برای حل شدن کامل ماده حلشونده به آن زمان داده میشود یا محلول روی همزن مغناطیسی قرار میگیرد.
مثال تهیه محلول ۱ مولار نمک:
تهیه محلول ۱ مولار از نمک (NaCl) به ترتیب زیر انجام میشود:
- ماده حلشونده: NaCl
- جرم مولی NaCl برابر است با ۵۸٫۴۴ گرم بر مول
- به اندازه یک مول نمک که برابر با جرم مولی آن ماده است وزن میشود. جرم یک مول نمک برابر با ۵۸٫۴۴ گرم بر مول است پس تقریبا باید مقدار ۵۸ گرم نمک وزن شود.
- مقدار وزن شده به بالنی به حجم ۱٫۰ لیتر که تا خط نشانه با آب مقطر پر است افزوده می شود.
- برای حل شدن کامل نمک در آب به آن زمان داده میشود یا محلول روی همزن مغناطیسی قرار میگیرد.
مثال تهیه محلول ۰٫۵ مولار سدیم هیدروکسید:
تهیه محلول ۰٫۵ مولار از سدیم هیدروکسید (NaOH) به ترتیب زیر انجام میشود:
- ماده حلشونده: NaOH
- جرم مولی NaOH برابر است با ۳۹٫۹۹ گرم بر مول
- یک مول از سدیم هیدروکسید تقریبا برابر با ۴۰ گرم بر مول است پس باید مقدار ۴۰ گرم سدیم هیدروکسید وزن شود.
- مقدار وزن شده به بالنی به حجم ۱٫۰ لیتر که تا خط نشانه با آب مقطر پر است افزوده میشود.
- به دلیل غلظت کمتر محلول مورد نظر میتوان محلول را در بالن ۱ لیتری تهیه و سپس رقیق کرد یا از ابتدا در بالنی با حجم ۲ لیتر محلول تهیه شود. پس در حالت معمول پس از تهیه محلول ۱ مولار، با افزودن آب بیشتر محلول را رقیق میکنیم تا به غلظت مورد نظر برسد.
مثال تهیه محلول ۱ مولار استیک اسید:
تهیه محلول ۱ مولار از استیک اسید به ترتیب زیر انجام میشود:
- ماده حلشونده:
- جرم مولی برابر است با ۶۰٫۰۵ گرم بر مول
- یک مول از استیک اسید تقریبا برابر با 6۰ گرم بر مول است پس باید مقدار 6۰ گرم استیک اسید وزن شود.
- مقدار وزن شده در ۵۰۰ میلیلیتر آب حل شده و سپس به حجم ۱٫۰ لیتر رسانده میشود.
- به دلیل مایع بودن اسید میتوان از حجم آن نیز استفاده کرد. مقدار حجم از چگالی استیک اسید بهدست میآید. چگالی استیک اسید ۱٫۰۴۹ گرم در میلیلیتر است. با تقسیم جرم به چگالی حجم مورد نظر برابر با ۵۷٫۲۴ میلیلیتر است. پس میتوان به جای ۶۰ گرم تقریبا از ۵۷ میلیلیتر استیک اسید برای تهیه ۱ مولار محلول استفاده کرد.
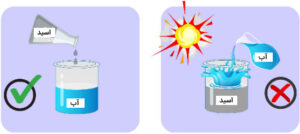
باید توجه داست که هنگام محلولسازی و کار با اسیدها، بهویژه اسیدهای قوی، همیشه اسید به آب افزوده میشود نه آب به اسید!
رقیق سازی محلول چیست
اگر قصد داشته باشیم از محلولی غلیظ، محلولی با غلظت کمتر تهیه کنیم با استفاده از معادله زیر میتوان مقدار حجم یا غلظت محلول مورد نظر را بهدست آورد.
- : غلظت محلول غلیظ یا اولیه
- : حجم محلول غلیظ یا اولیه
- : غلظت محلول غلیظ یا ثانویه
- : حجم محلول غلیظ یا ثانویه
مثال رقیق سازی محلول
برای تهیه ۱٫۰ لیتر محلول استیک اسید ۰٫۵۰ مولار چه حجمی از محلول اسید ۱۰ مولار مورد نیاز است؟
پس به مقدار ۵۰ میلیلیتر استیک اسید ۱۰ مولار برای تهیه ۰/۱ لیتر استیک اسید ۵۰/۰ مولار مورد نیاز است.
سوالات متداول محلول چیست
تا اینجا آشنا شدید که محلول چیست و چه کاربردهایی دارد. در زیر به برخی از پرسشهای رایج در مورد محلولها پاسخ داده شده است.
تفاوت مخلوط و محلول چیست ؟
در واقع محلول مخلوط همگن است که اجزای تشکیلدهنده بهطور یکنواخت یا همگن پراکنده شده باشند. در مقابل اجزای مخلوط ناهمگن پراکندگی یکسانی ندارند و به راحتی قابل جدا شدن هستند. در محلول ذرات پراکنده شده قابل مشاهده نیستند و پراکندگی نور ندارند. همچنین این ذرات رسوب نمیکنند و توسط فیلتراسیون قابل جدا شدن نیستند.
آجیل محلول جامد در جامد است ؟
آجیل محلول نیست و مخلوطی ناهمگن است.
محلول مایع در مایع نام ببرید ؟
تمام مواد امتزاجپذیر در آب محلولهای مایع در مایع هستند. محلول بوتانون، بوتانول و اکتانول در آب و همچنین محلول بوتانوئیک اسید در آب مثالهایی از محلولهای مایع در مایع هستند.
- سرکه: استیک اسید در آب است.
- ضدیخ: اتیلن گلیکول در آب است.
- دهانشویه: ستیل پیریدینیوم و عصاره نعنا در آب است.
- مواد شوینده خانگی: محلولی از مواد شیمیایی در آب هستند.
- ضدعفونی کنندهها: اتانول در آب است.
- هیدروژن پراکسید خانگی: محلول بسیار رقیق هیدروژن پراکسید خالص در آب است.
محلول آبی کدام ماده در آب رسانای جریان برق نیست ؟
مواد غیرالکترولیت که با حل شدن در آب بهصورت یون تجزیه نمیشوند مانند مانند قند، اوره، گلیسیرین و متیلسولفونیلمتان رسانای جریان برق یا الکتریسیته نیستند.
حلال چربی چیست ؟
چربی یا «لیپیدها» (Lipid) همگی در حلالهای قطبی مانند آب نامحلول هستند. این دسته از مواد ولی در حلالهای آلی ناقطبی از جمله «اتر» (Ether)، کلروفرم، بنزن و استون به راحتی حل میشوند. در واقع، این چهار حلال اغلب به عنوان حلالهای لیپیدی یا حلالهای چربی شناخته میشوند.
آزمون محلولها
۱. کدام تعریف بیشترین دقت را درباره محلول با توجه به همگن بودن و توزیع ذرات دارد؟
محلول فقط شامل مایعات است و ذرات قابل رویت هستند.
محلول مخلوطی است که در آن همیشه واکنش شیمیایی میان اجزا رخ میدهد.
محلول یک مخلوط ناهمگن است که ذرات در آن جدا از هم باقی میمانند.
محلول شامل ذرات حلشونده ی پراکنده به طور یکنواخت در حلال است.
تعریف «محلول شامل ذرات حلشونده ی پراکنده به طور یکنواخت در حلال است» صحیح است زیرا محلولها سیستمهای همگناند که در آنها ذرات حلشونده در سراسر فاز حلال به طور یکنواخت پخش میگردند و قابل تشخیص یا جداسازی با چشم نیستند.
۲. کدام عامل مهمترین تفاوت محلول با مخلوط ناهمگن و کلوئیدها را نشان میدهد؟
همگن بودن و جدا نشدن ذرات در محلول
وجود واکنش شیمیایی بین اجزای مخلوط
تغییر نقطه جوش و انجماد با اضافه کردن ماده حلشونده
میزان غلظت حلشونده در نمونه
برخلاف مخلوطهای ناهمگن و کلوئیدها، در محلول ذرات به طور یکنواخت پخش شدهاند و قابل جداسازی با فیلتر نیستند. این همگنی و جا نشدن ذرات محلول موجب میشود خواص آن متفاوت باشد.
۳. در محلول آبنمک، از نظر ساختار و نقش دو جز اصلی، آب و نمک چه عملکردی دارند؟
آب و نمک هر دو به عنوان حلال شناخته میشوند.
آب و نمک بدون نقشهای خاص فقط با هم واکنش شیمیایی میدهند.
آب به عنوان حلشونده و نمک به عنوان حلال عمل میکنند.
آب نقش حلال دارد و نمک به عنوان حلشونده در آب پراکنده میشود.
در محلول آبنمک، آب به عنوان «حلال» (solvent) مادهای است که قدرت حلکنندگی دارد و نمک به صورت «حلشونده» (solute) در آب به طور یکنواخت پخش میشود. آب و نمک واکنش شیمیایی انجام نمیدهند، بلکه نمک در مولکولهای آب حل و پراکنده میشود. بنابراین برخلاف «آب حلشونده» یا «هر دو حلال»، نقشهای اصلی در محلول با آب به عنوان حلال و نمک به عنوان حلشونده شکل میگیرد. این ساختار باعث همگنی مخلوط میشود.
۴. چه تفاوتی میان محلولهای قطبی و ناقطبی از نظر نوع برهمکنشهای بینمولکولی وجود دارد؟
در هر دو نوع محلول فقط نیروهای یون-دوقطبی موثرند و تفاوتی وجود ندارد.
در محلول قطبی، پیوند هیدروژنی و دوقطبی-دوقطبی رایج است، اما در محلول ناقطبی، نیروهای واندروالسی غالب هستند.
محلول قطبی بیشتر نیروهای بینمولکولی خود را به برهمکنشهای پراکندگی محدود میکند، ولی ناقطبی به پیوند هیدروژنی وابسته است.
محلولهای قطبی و ناقطبی فقط با تغییر دما تفاوت پیدا میکنند و نوع نیروها مشابه است.
در محلول قطبی، وجود مولکولهای دارای دوقطبی و گروههای قطبی قوی باعث شکلگیری پیوند هیدروژنی و نیروهای دوقطبی-دوقطبی میشود. این ویژگی موجب میگردد که مواد قطبی با یکدیگر بهتر حل شوند و انرژی برهمکنش بیشتری نیاز داشته باشند. اما در محلولهای ناقطبی، برهمکنشها عمدتا از نوع نیروهای واندروالس و پراکندگی ضعیف است و به دلیل نبود قطبیت قوی فقط همین نیروها نقش اصلی را بازی میکنند.
۵. برای انتخاب مناسبترین حلال جهت حل کردن یک ماده ناقطبی، کدام اصل بنیادی شیمی باید رعایت شود؟
استفاده از حلال قطبی برای افزایش پیوند هیدروژنی
انتخاب حلال ناقطبی با قطبیت مشابه بنابر اصل «شبیه، شبیه را حل میکند»
استفاده از حلالهای یونی برای افزایش اثر یون-دوقطبی
انتخاب حلالهای آلیفاتیک برای برهمکنش قوی با مواد قطبی
انتخاب حلال ناقطبی با قطبیت مشابه طبق اصل «شبیه، شبیه را حل میکند» باعث افزایش حلپذیری مواد ناقطبی میشود چون نیروهای بینمولکولی مشابه منجر به اختلاط بهتر بدون نیاز به انرژی زیاد میگردد. استفاده از حلال قطبی، حلالهای یونی یا آلیفاتیک برای مواد قطبی کاربرد دارد و نمیتواند حلپذیری ماده ناقطبی را به خوبی تضمین کند.
۶. برای تهیه یک محلول ۱ مولار NaCl، کدام ترتیب مراحل زیر صحیح است؟
ابتدا به بالن ژوژه آب مقطر اضافه کنید، سپس NaCl را وزن کنید و به آن بیافزایید، در نهایت حجم را با آب مقطر کامل کنید.
محاسبه جرم مورد نیاز NaCl، حل کردن در آب، انتقال به بالن ژوژه و رساندن حجم تا خط نشانه
محلول غلیظ NaCl بسازید، سپس حجم آن را با افزودن آب رقیق کنید تا محلول تهیه شود.
NaCl را مستقیم به بالن ژوژه بریزید، جرم را اندازه بگیرید، سپس آب اضافه کنید تا محلول همگن شود.
روش صحیح تهیه محلول ۱ مولار NaCl شامل محاسبه جرم لازم NaCl با توجه به حجم و غلظت مورد نظر است. این مقدار را وزن میکنند، سپس ابتدا آن را در مقداری آب مقطر حل میکنند و محلول حاصل را به بالن ژوژه منتقل میکنند. سپس حجم محلول را تا خط نشانه با آب مقطر به دقت کامل مینمایند. به کار بردن روشی که با افزودن آب به جرم مشخص NaCl تا حجم مورد نظر کامل میشود صحت و دقت بالاتری دارد. گزینههای دیگر یا ترتیب نادرستی دارند یا به مرحله حل کامل و انتقال به بالن اشاره نکردهاند و یا رقیقسازی از محلول مادر را پیشنهاد دادهاند که متناسب با ساخت مستقیم محلول ۱ مولار نیست.
۷. چرا اختلاط گازها معمولا بدون نیاز به انرژی خارجی خودبخودی انجام میشود؟
زیرا همه گازها برهمکنش یونی قوی دارند و آسان ترکیب میشوند.
زیرا افزایش آنتروپی سبب مطلوبتر شدن وضعیت انرژی سیستم میشود.
زیرا پیوندهای شیمیایی جدید زیادی در بین گازها ایجاد میشود.
زیرا دمای پایین همیشه حلالیت گازها را افزایش میدهد.
در فرآیند اختلاط گازها، افزایش آنتروپی یا همان بینظمی سیستم دلیل اصلی خودبخودی بودن واکنش است، زیرا پراکندگی ذرات، وضعیت انرژی سیستم را پایدارتر میکند. برهمکنش قوی یا ایجاد پیوند شیمیایی میان گازها رخ نمیدهد و دما نیز همیشه افزایش حلالیت را تضمین نمیکند. بنابراین فقط افزایش آنتروپی مسیر این رفتار را توجیه میکند.
۸. اگر مولکول حلشونده و حلال دارای قطبیت متفاوت باشند، معمولا چه تاثیری بر فرایند انحلال دیده میشود؟
فرایند انحلال همواره همراه با آزاد شدن انرژی است.
نوع نیروهای بینمولکولی اهمیتی ندارد و انحلال کاملا تصادفی است.
حلشونده سریعا و کاملا حل میشود.
انحلال به سختی انجام میشود یا رخ نمیدهد.
در حالتهایی که قطبیت حلشونده با قطبیت حلال متفاوت باشد، نیروهای بینمولکولی کافی برای ادغام آنها وجود ندارد و انحلال یا بسیار سخت انجام میشود یا حتی رخ نمیدهد. عبارت «شبیه، شبیه را در خود حل میکند» همین اصل را بیان میکند.
۹. در فرایند حل شدن در آب، چه دلیلی باعث سرد شدن محیط میشود؟
انرژی آزاد شده از پیوندهای جدید بیشتر از انرژی مصرف شده برای جداسازی ذرات است.
افزایش آنتروپی به تنهایی موجب آزاد شدن انرژی زیاد میشود.
انرژی مصرف شده برای جداسازی ذرات و آب بیشتر از انرژی آزاد شده هنگام تشکیل پیوندهای جدید است.
نیروهای بینمولکولی بسیار قوی باعث افزایش دمای محلول میشوند.
در حل شدن در آب، انرژی مصرف شده برای گسستن پیوندهای بین یونها در جامد و مولکولهای آب بیشتر از انرژی آزاد شده هنگام تشکیل پیوند بین یونها و مولکولهای آب است. بنابراین فرایند کلی گرماگیر است و محیط سرد میشود. «افزایش آنتروپی» موضوع مهمی در خودبخودی بودن واکنش است، اما به تنهایی عامل سرد شدن نیست. گزینههایی مانند «نیروهای بینمولکولی قوی» یا «آزاد شدن انرژی بیشتر» صحیح نیستند زیرا در این مورد انرژی آزاد شده کمتر از انرژی مصرف شده است.
۱۰. کدام جمله درستترین تفاوت میان مولاریته، مولالیته و نرمالیته را نشان میدهد؟
مولاریته به تعداد مول حلشونده در یک لیتر محلول اشاره دارد. مولالیته تعداد مول حلشونده در یک کیلوگرم حلال و نرمالیته غلظت مولی بر ضریب اکیوالان است.
مولالیته فقط در محلولهای گازی، و مولاریته و نرمالیته در جامدات به کار میروند.
نرمالیته برای محلولهایی با حلال غیرآبی، اما مولاریته و مولالیته فقط برای آب استفاده میشود.
مولاریته مقدار کل ماده حلشونده را بدون توجه به حجم یا جرم بیان میکند، اما مولالیته و نرمالیته به نسبت یونها بستگی دارند.
در تعریف مولاریته، مقدار ماده حلشونده بر حسب مول در یک لیتر از کل حجم محلول سنجیده میشود. مولالیته، بر اساس تعداد مول حلشونده در یک کیلوگرم حلال تعریف میشود و به حجم محلول وابسته نیست. نرمالیته نوعی روش بیان غلظت وابسته به اکیوالان حلشونده است.
۱۱. در زمان رقیقسازی محلول در آزمایشگاه، برای تعیین حجم محلول غلیظ مورد نیاز جهت تهیه محلول با غلظت کمتر، از چه رابطهای استفاده میشود؟
استفاده از ضریب وانتهوف برای ذرات موجود
فرمول درصد جرمی برای تعیین مقدار حلشونده
رابطه برای غلظت و حجم قبل و بعد
استفاده از قانون رائول برای فشار بخار
در رقیقسازی محلول به کمک رابطه « » میتوان حجم محلول غلیظ (با غلظت M1 و حجم V1) را برای رسیدن به حجم نهایی (V2) با غلظت جدید (M2) به دست آورد. این فرمول مخصوص محاسبه غلظت و حجم در فرآیند رقیقسازی است.
۱۲. کدام ویژگی محلول سبب میشود نتوان ذرات آن را با فیلتر جدا کرد؟
وجود چندین فاز در مخلوط
پراکندگی یکنواخت ذرات حلشونده در حلال
داشتن اندازه ذرات درشتتر از کلوئید
پراکندگی نور توسط ذرات محلول
در محلولها، ذرات حلشونده به صورت یکنواخت و بسیار ریز در سراسر حلال پراکندهاند به طوری که با چشم دیده نمیشوند و نمیتوان آنها را با فیلتر از هم جدا کرد. این ویژگی همان «پراکندگی یکنواخت ذرات حلشونده در حلال» است. مخلوطهایی که چندین فاز دارند یا ذرات بزرگ و قابل مشاهده دارند (مانند سوسپانسیون)، با فیلتراسیون قابل جداسازیاند. همچنین محلولها اثر تیندال یا پراکندگی نور ندارند و نور از آنها عبور میکند.
۱۳. کدام مورد، چهار خاصیت کولیگاتیو محلول را به درستی نام میبرد؟
افزایش فشار اسمزی، کاهش pH، افزایش چگالی، رسوب گذاری
کاهش فشار بخار، افزایش نقطه جوش، کاهش نقطه انجماد، فشار اسمزی
کاهش ویسکوزیته، افزایش حلالیت، تغییر رنگ، افزایش دما
افزایش نقطه جوش، افزایش نقطه ذوب، کاهش غلظت، تولید گرما
چهار خاصیت کولیگاتیو محلول شامل «کاهش فشار بخار»، «افزایش نقطه جوش»، «کاهش نقطه انجماد» و «فشار اسمزی» هستند که همگی به تعداد ذرات حلشونده بستگی دارند و نوع ماده تاثیر ندارد.
۱۴. در محلولها طبق قانون رائول، چگونه تعداد ذرات حلشونده بر کاهش فشار بخار تاثیر میگذارد؟
ذرات حلشونده تاثیری در تغییر فشار بخار ندارند.
کاهش فشار بخار فقط وابسته به نوع ذرات است نه تعداد
تعداد ذرات حلال مهمتر از ذرات حلشونده در تعیین فشار بخار است.
افزایش تعداد ذرات حلشونده موجب کاهش بیشتر فشار بخار میشود.
براساس قانون رائول، کاهش فشار بخار محلول بستگی به تعداد ذرات حلشونده دارد و هرچه این تعداد بیشتر باشد، میزان کاهش فشار بخار نسبت به حلال خالص بیشتر خواهد بود.
۱۵. برای تهیه یک محلول بافر مناسب آزمایشگاه، به کدام ویژگی باید بیشترین توجه را داشت؟
پایداری pH محلول در برابر افزودن اسید یا باز
سرعت حل شدن مواد در آب مقطر
شفافیت و رنگ ظاهری محلول بافر
حلالیت کلی مواد بافر در حلال
ویژگی کلیدی محلول بافر، توانایی آن در ثابت نگه داشتن pH در هنگام افزودن مقدار کمی اسید یا باز است. فقط «پایداری pH محلول در برابر افزودن اسید یا باز» بیانگر این خاصیت اساسی بافر است.
۱۶. اگر به یک محلول حلشونده بیشتری افزوده شود تا مقدار آن از بیشترین میزان قابل حل فراتر رود، این محلول چه نام دارد؟
محلول فراسیر شده
محلول رقیق
محلول غیراشباع
محلول اشباع
زمانی که مقدار حلشونده در حلال از بیشترین مقدار مجاز برای حل شدن (یعنی انحلالپذیری) فراتر میرود، محلول دیگر در حالت پایدار تعادل قرار ندارد و حالت «محلول فراسیر شده» به وجود میآید. در این شرایط، مقدار اضافی حلشونده معمولا رسوب میکند یا به صورت محلول ناپایدار باقی میماند. حالت «محلول اشباع» زمانی رخ میدهد که حلشونده دقیقا تا حد مجاز حل شده باشد. «محلول غیراشباع» کمتر از این مقدار حلشونده در حلال دارد و «محلول رقیق» صرفا به محلولی با غلظت پایین اشاره میکند.
۱۷. در محلولهای سیرنشده، اشباع و فراسیر شده، وضعیت تعادل انحلال چگونه با یکدیگر تفاوت دارد؟
در هر سه نوع محلول تعادل انحلال به طور یکسان برقرار است.
در محلول سیرنشده واکنش انحلال کامل به سمت حل شدن پیش میرود.
در محلول فراسیر شده اضافه حل شونده ناپایدار است و تمایل به رسوب دارد.
در محلول اشباع میزان حل شدن و رسوب برابر است و تعادل برقرار میشود.
در محلول اشباع، نرخ حل شدن و رسوب ماده حلشونده برابر و در تعادل است، در حالی که در محلول سیرنشده هنوز تعادل برقرار نشده و ماده میتواند بیشتر حل شود. در محلول فراسیر شده، محلول ناپایدار بوده و افزودن ماده اضافی یا تحریک باعث رسوب سریع میشود. بنابراین فقط عبارت «میزان حل شدن و رسوب برابر است و تعادل برقرار میشود» درباره محلول اشباع صحیح است و برای دیگر حالات صدق نمیکند.
۱۸. افزایش دما چه تاثیری بر انحلالپذیری یک نمک در آب دارد و علت علمی این پدیده چیست؟
انحلالپذیری کاهش مییابد چون افزایش دما پیوندهای یونی را تقویت میکند.
دما تنها روی سرعت حلشدن تاثیر گذاشته و انحلالپذیری تغییری نمیکند.
دما اثری ندارد چون انحلال نمکها مستقل از انرژی است.
انحلالپذیری بیشتر میشود چون افزایش دما انرژی حلشدن را تامین میکند.
افزایش دما معمولا باعث افزایش انحلالپذیری نمکها در آب میشود، زیرا گرما انرژی لازم برای جداسازی ذرات یونی و تشکیل پیوند جدید بین یونها و مولکولهای آب را فراهم میکند. این فرآیند در بسیاری از نمکها گرماگیر است و نیاز به انرژی خارجی برای حلشدن دارد. بنابراین، «انحلالپذیری بیشتر میشود چون افزایش دما انرژی حلشدن را تامین میکند» درست است.












