گاز ایده آل چیست؟– به زبان ساده + تعریف و قانون


گاز ایده آل مفهومی فرضی برای بررسی رفتار گازها در شرایط مختلف است. قوانینی که برای گاز ایده آل مشخص شدهاند با گازهای واقعی متفاوت است. بین مولکولهای یک گاز ایده آل هیچ برهمکنش و صرف انرژی وجود ندارد و برخوردهای بین این ذرات (ارتجاعی) الاستیک در نظر گرفته میشود. از حجم این ذرات چشمپوشی میشود و در شرایط مختلف از قانون گاز ایده آل که است پیروی میکنند. در این قانون نسبت حاصل ظرب حجم و فشار بر مول و دمای گاز همواره ثابت است. فهم این موضوع که گاز ایده آل چیست و چه قوانینی بر آن حاکم است در شناسایی رفتار تمامی گازهای موجود در طبیعت بسیار اهمیت دارد. در این مطلب از مجله فرادرس به بررسی خواص گاز ایده آل و قوانین آن و تفاوت آن با گاز حقیقی میپردازیم و کاربردهای این مفهوم را میآموزیم.
در ابتدای این مطلب به بررسی تعریف گاز ایده آل و رفتار آن میپردازیم. سپس میآموزیم گاز حقیقی چیست و قانون گاز ایده آل را همراه با مثال بررسی میکنیم. همچنین برخی از قوانین مهم مانند قانون واندروالس، قانون بویل و قانون شارل و ارتباط آنها با گازهای ایده آل را توضیح میدهیم. مفاهیم مهمی مانند ثابت جهانی گازها را مطالعه میکنیم. در نهایت انحراف گاز حقیقی از رفتار گاز ایده آل و علتهای این انحراف را میآموزیم. با مطالعه این مطلب تا انتها این مفهوم با اهمیت را به شکلی عمیق و کاربردی بیاموزید.
گاز ایده آل چیست؟
گاز ایدهآل یا گاز آرمانی یک گاز فرضی است که حجم آن به نسبت دما و معکوس فشار تغییر میکند. گاز ایده آل یک مفهوم فرضی برای محاسبات ریاضی مربوط به رفتار گازها است و وجود خارجی ندارد. یک گاز ایده آل گازی تئوری است که از مجموعه از اجزا تشکیل شده که به صورت غیریکنواخت و آزادانه حرکت میکنند. این ذرات تنها به وسیله حرکات ارتجاعی بر یکدیگر اثر میگذارند. در تعریف گاز ایده آل تصور میشود تمامی ذرات گاز به صورت آزادانه در تمامی جهات حرکت میکنند و تمامی برخوردهای بین آنها ارتجاعی است. این پدیده میتواند به این قضیه منجر شود که هیچ انرژی سینتیکی از بین نرود.
هرچند گازهای ایده آل در واقعیت وجود ندارند، اما گازهای واقعی (حقیقی) در غلظت بسیار پایین رفتاری مانند گاز ایده آل دارند. این پدیده به این علت اتفاق میافتد که مولکولها و ذرات گاز در غلظت بسیار پایین به اندازهای از یکدیگر فاصله دارند که نمیتوانند با یهم برخورد و برهمکنش داشته باشند. برای مثال گازهای نجیب به دلیل نداشتن نیروهای بین مولکولی میتوانند رفتاری شبیه به رفتار گاز ایده آل داشته باشند. در نتیجه با فهمیدن این که گاز ایده آل چیست میتوانیم به خواص و رفتارهای گاز حقیقی پی ببریم.
رفتار گاز ایده آل چیست؟
برای گازهای ایده آل رفتارهایی به شکل قراردادی در نظر گرفته شده که شامل برهمکنش و برخورد ذرات این گازها و حجم آنهاست. این رفتارها با رفتار ذرات گازهای حقیقی متفاوت است. گاز ایده آل یک مفهوم فرضی است که در آن برای مولکولهای گاز هیچ برهمکنشی در نظر گرفته نمیشود و مولکولها آزادانه حرکت میکنند.
برای بررسی گاز ایده آل سه ویژگی برای مولکولهای گاز در نظر گرفته میشود که به شرح زیر هستند:
- نداشتن برهمکنش بین مولکولی: مولکولهای گاز نباید یکدیگر را جذب یا دفع کنند.
- برخوردهای الاستیک (ارتجاعی): تنها برهمکنش بین مولکولهای گاز برخوردهای ارتجاعی است که در آن هیچ انرژی در برخورد از بین نمیرود.
- حجم صفر ذرات: فاصله بین ذرات گاز ایده آل به حدی زیاد است که در مقایسه با ظرفی که میتوانند در آن حضور داشته باشند، حجم آنها قابل چشم پوشی است.
هیچ گازی در واقعیت نمیتواند دقیقا گاز ایده آل در نظر گرفته شود اما در شرایط خاص در غلظت پایین یا در مورد گازهای نجیب، میتوانند رفتاری شبیه به رفتار گاز ایده آل داشته باشند. در دمای اتاق و فشار جو، بسیاری از گازهای مهم و مورد مطالعه میتوانند رفتاری مشابه گاز ایده آل داشته باشند. شناخت این رفتارها میتواند در درک این مفهوم که گاز ایده آل چیست موثر باشد.
یادگیری رفتار گازها با فرادرس
برخی از مفاهیم مانند مفهوم گاز ایده آل از پایه ای ترین و مهمترین مسائل بحثهای ترمودینامیک هستند. یادگیری صحیح این مفاهیم یکی از ضروریترین نیازمندیهای مفاهیم پیچیدهتر در ترمودینامیک شیمی و مهندسی شیمی است. برای آموزش عمیقتر این مباحث پیشنهاد میکنیم از مجموعه فیلم آموزش مهندسی شیمی در وبسایت فرادرس بهره ببرید که با زبانی ساده ولی کاربردی این مفاهیم را توضیح دادهاند. در آموزشهایی مانند شیمی فیریک میتوانید درباره رفتار گازها، قانون بویل، شارل و آووگادرو، شرایط استاندارد، معادله حالت، و ... بیاموزید.
همچنین با مراجعه به فیلمهای آموزشی فرادرس که لینک آن در زیر آورده شده میتوانید به آموزشهای بیشتری در زمینه گازهای ایده آل و قوانین آنها، دسترسی داشته باشید.
- فیلم آموزش گازهای ایده آل در شیمی فیزیک
- فیلم آموزش مخلوط های گازی در ترمودینامیک ۲
- فیلم آموزش ترمودینامیک مهندسی شیمی
گاز حقیقی چیست؟
گازهایی که رفتارشان از رفتار گاز ایده آل انحراف پیدا میکند، به عنوان گازهای حقیقی شناخته میشوند. این رفتار به دوگونه قابل ملاحظه است. اول اینکه با افزایش فشار، حجمگازهای حقیقی به صفر میل نمیکند. درحالی که در مطالعه رفتار گاز ایده آل با افزایش فشار، حجم آنها ناچیز در نظر گرفته میشود و قابل صرف نظر است. دوم اینکه برهمکنشهای بین مولکولی در گازهای حقیقی قابل توجه هستند. این در صورتی است که در گاز های ایده آل، برهمکنشهای بین مولکولی در نظر گرفته نمیشوند و ذرات گاز ایده آل برخوردهایی الاستیک دارند که در آنها انرزی سینتیکی مصرف نمیشود.
قانون گاز ایده آل چیست؟
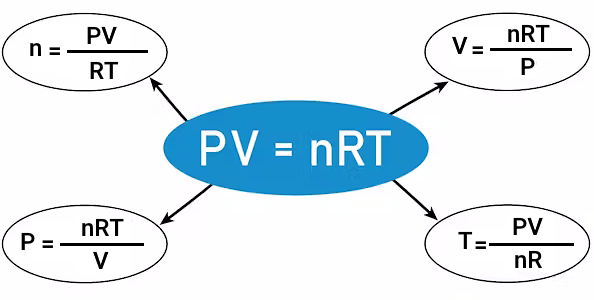
در قسمتهای قبل بیان کردیم که گاز ایده آل چیست و در غلظتهای بسیار پایین بسیاری از گازهای واقعی میتوانند رفتاری مشابه رفتار گازهای ایده آل داشته باشند. این رفتار در شرایط پایدار برای فشار، دما و حجم گازها بررسی میشود. در نتیجه بررسیهای انجام شده برای بسیاری از گازها قانونی به نام قانون گاز ایده آل بیان شده است که با معادله زیر نشان داده میشود.
در این معادله، P بیانگر فشار گاز، T بیانگر دما، V بیانگر حجم آن و n تعداد مول گاز در نظر گرفته میشود. مقدار R در معادله بالا نشاندهنده ثابت گازها است که صرف نظر از نوع گاز ، دما و فشار مقداری برابر دارد.
با اینکه قانون گاز ایده آل در بررسی برای گازهای حقیقی ممکن است محدودیتهایی داشته باشد، این قانون برای بسیاری از گازها در غلظتهای بسیار پایین برقرار است. همچنین این معادله برای یک گاز تنها یا مخلوطی از گازها نیز میتواند استفاده شود و در این صورت مقدار n برابر با جمع مولهای گاز در مخلوط مورد آزمایش است.
برای درک بهتر قانون گاز ایده آل به مثالهای زیر توجه کنید.
مثال اول قانون گاز ایده آل
مقدار مول گاز موجود در ۰٫۱ لیتر یک نمونه را در دمای ۳۰۰ کلوین و فشار ۰٫۹۸۷ اتمسفر محاسبه کنید.
پاسخ
طبق معادله گاز ایده آل و جایگذاری مقادیر داده شده، مقدار n به دست میآید.
مثال دوم قانون گاز ایده آل
یک نمونه از بنزن تا دمای ۱۰۰ درجه سانتیگراد حرارت داده شده است تا تبخیر شود. حجم ظرف گاز تولید شده برابر با ۲۴۷٫۲ میلیلیتر است. سپس بنزن تا رسیدن به حالت مایع سرد شده و مقدار جرم آن ۰٫۶۱۶ به دست آمده است. با فرض ثابت ماندن مقدار بنزن طی این فرایندها، فشار ظرف را محاسبه کنید.
پاسخ
با توجه به واحد ثابت گاز که لیتر-اتمسفر بر مول-کلوین است، باید مقدار دما به کلوین تبدیل شده ، مقدار میلیلیتر به لیتر تبدیل شود و مقدار مول بنزن از روی جرم آن و با توجه به جرم مولی محاسبه شود.
برای تبدیل واحد درجه سانتیگراد به کلوین باید مقدار آن را با ۲۷۳٫۱۵ جمع کنیم. همچنین جرم مولی بنزن برابر با ۷۸٫۱۱ گرم بر مول است. بنابراین خواهیم داشت:
با انجام این تغییر واحدها و جایگذاری آنها در معادله گاز ایده آل، فشار ظرف محاسبه میشود.
سایر فرم های معادله گاز ایده آل
تا اینجا آموختیم معادله گاز ایده آل چیست و چگونه استفاده میشود. قانون گاز ایده آل در شرایط مختلف میتواند به فرمهای دیگری نیز نوشته شود. برخی از این فرمها فرمهای مولکولی، مولی و نسبی هستند که در ادامه توضیح داده خواهند شد.
فرم اصلی معادله گاز ایده آل به شکل زیر است که یا برحسب تعداد مول و ثابت گازها بیان میشود یا بر حسب تعداد مولکول گازها و ثابت بولتزمان نوشته میشود. هردوی اینها به شدت کاربردی هستند و برای گازهای مختلف استفاده میشوند.
در معادلات بالا به ترتیب P فشار، V حجم، n تعداد مول، R ثابت گازها،T دما، N تعداد مولکولها و ثابت بولتزمان است. ثابت بولتزمان مقدار ثابتی برابر با دارد. در این معادله فشار باید بر حسب اتمسفر، حجم بر حسب لیتر، دما بر حسب کلوین و ثابت گاز برحسب «لیتر-اتمسفر» بر «مول-کلوین» باشد.
فرم مولی قانون گاز ایده آل
فرم دیگر محاسبه معادله گاز ایده آل، فرم مولی آن است که بسیار هم پرکاربرد است. زیرا این فرم مقادیر مشخصی از گاز را به میزان دقیق مشخص میکند. در این معادله به جای استفاده از جرم مولکول برای محاسبه تعداد مول، از جرم معادل شیمیایی آن استفاده میشود و ثابت گاز جدیدی در معادله جایگذاری میشود. این محاسبات به شکل زیر است.
معادله بالا فرم مولی قانون گاز ایده آل است که در آن P فشار است و V حجم مخصوص گاز است که به روش زیر، از چگالی آن به دست میآید.
همچنین R نیز ثابت مخصوص گاز است که از تقسیم ثابت گاز بر جرم مولی گاز به دست میآید.

فرم نسبی قانون گاز ایده آل
در قسمتهای قبل آموختیم که در معادله قانون گاز ایده آل یک مقدار ثابت R وجود دارد که نام آن ثابت گاز است و برای تمامی گازهای موجود قابل استفاده است. با تغییر معادله گاز آیده آل بر حسب ثابت گازها، میتوانیم برای شرایط مختلف این قانون را به شکل نسبی بررسی کنیم.
اگر در شرایط اولیه i و شرایط نهایی f این قانون را بررسی کنیم، از آنجا که مقدار R ثابت است، به معادله زیر خواهیم رسید.
از این فرم معادله گاز ایده آل بیشتر در مواقعی استفاده میشود که یک یا تعداد بیشتری از متغیرهای معادله ثابت نگه داشته شود. برای مثال در صورت ثابت نگه داشتن فشار این معادله به شکل زیر تغییر میکند.
برای درک بهتر این موضوع به مثال زیر توجه کنید.

مثال فرم نسبی قانون گاز ایده آل
تصور کنید یک بالون گاز هیدروژن ۱۸۵۵ لیتری در دمای ۳۰ درجه سانتیگراد و فشار ۷۴۵ میلیمتر جیوه داریم. این بالون تا ارتفاع ۲۳۰۰۰ فوتی زمین بالا رفته و فشار و دما در آن ارتفاع ۳۱۲ میلیمتر جیوه و ۳۰- درجه سانتیگراد باشد. بالون باید تا چه حجمی افزایش حجم پیدا کند تا همان مقدار گاز هیدروژن را درون خود نگه دارد؟
پاسخ
برای حل این مثال ابتدا جدولی از دادههای سوال رسم کرده و تغییر واحدهای لازم را انجام میدهیم. در این معادله فشار باید بر حسب اتمسفر، حجم بر حسب لیتر، دما بر حسب کلوین و ثابت گاز برحسب «لیتر-اتمسفر» بر «مول-کلوین» باشد.
| شرایط اولیه | شرایط نهایی |
| فشار : ۷۴۵ میلیمتر جیوه برابر با ۰٫۹۸۰ اتمسفر | فشار: ۳۱۲ میلیمتر جیوه برابر با ۰٫۴۱۱ اتمسفر |
| دما: ۳۰ درجه سانتیگراد برابر با ۳۰۳ کلوین | دما: ۳۰- سانتیگراد برابر با ۲۴۳ کلوین |
| حجم: ۱۸۵۵ لیتر | حجم: ؟ |
در این مورد در معادله قانون گاز ایده آل به دلیل اینکه هیچ مقداری از گاز هیروژن تغییر نمیکند و طبق صورت سوال ثابت است، معادله نسبی به شکل زیر نوشته میشود.
با جایگذاری مقادیر معلوم، مقدار لیتر مجهول به دست میآید.
معادله واندروالس و قانون گاز ایده آل
یکی از فرمهای تصحیح شده معادله گاز ایده ال که نتایج دقیقتری به دست میدهد، معادله واندروالس است. در این معادله مقادیر فشار، دما و حجم برای گازهای حقیقی مقادیر واقعیتری را نشان میدهند. این معادله به شکل زیر است.
معادله واندروالس درک بهتری از رفتار گازهای حقیقی را ارائه میدهد زیرا خواص فیزیکی که بین گاز ایده آل و گاز حقیقی متفاوت است را بررسی میکند. در این معادله مقادیر a و b مقادیر ثابتی هستند که برای هر گازی به صورت جداگانه محاسبه شده اند. برای درک بهتر این موضوع به مثال زیر توجه کنید.
مقدار فشار را برای دو مول از یک گاز در حجم ۱ متر مکعب و دمای ۳۰۰ کلوین محاسبه کنید. ثابتهای معادله واندروالس این گاز به شرح زیر هستند.
با جایگذاری مقادیر در معادله واندروالس خواهیم داشت:
این معادله به ما کمک میکند درک کنیم رفتار گاز ایده آل چیست و این رفتارها چه تفاوتی با شرایط حقیقی آزمایش دارند.

ثابت جهانی گازها و ثابت ویژه گازها
ثابت جهانی گازها یا ثابت گازها در واقع همان ثابت گاز ایده آل است که از معادله گاز ایده آل به دست میآید. مقدار این ثابت در واحد SI برابر با ۸٫۳۱۴۴۶۲۶۱۸۱۵۳۴۲ ژول بر کلوین مول است که در معادله گاز ایده آل بر حسب لیتر اتمسفر بر مول کلوین نوشته شده و مقدار آن ۰٫۰۸۲۰۵ است. این ثابت از مقادیر ثابت معادلات دیگر مربوط به گازها مانند قانون بویل، قانون شارل و قانون آووگادرو به دست امده است. این ثابت در بررسی رفتار گاز ایده آل همواره مقدار ثابتی دارد.
ثابت ویژه گازها مقدار ثابتی است که از تقسیم ثابت جهانی گاز بر جرم مولی ماده مورد نظر به دست میآید و میتواند اطلاعات دقیق تری را از قانون گاز ایده آل به دست آورد.
از این مقدار برای بررسی رفتار مخلوط گازها نیز میتوان استفاده کرد. برای مثال محاسبات مربوط به هوا که مخلوطی از چند گاز است در قانون گاز ایده آل، ممکن است به اطلاعات صحیحی نیانجامد. با استفاده از ثابت ویژه هوا که ثابت گاز ایده آل بر جرم مولی هوا است میتوان رفتار آن را به شکل دقیقتری بررسی کرد.

تفاوت گاز حقیقی و گاز ایده آل
پیش تر اشاره شد که گاز ایده آل یک مفهوم غیر واقعی برای محاسبات و مشاهده رفتار گازها است. در واقعیت رفتارهایی که گازها از خود نشان میدهند با مواردی که برای گاز ایده آل در نظر گرفته شده است متفاوت است. در جدول زیر این تفاوتها را توضیح دادهایم.
| گاز ایده آل | گاز حقیقی |
| حجم ثابت و مشخصی ندارد و به طور کامل شکل ظرفی که درون آن قرار دارد را پر میکند. | حجم مشخصی دارد و ممکن است تمام شکل ظرفی که درون آن قرار دارد را پر نکند. |
| هیچ برهمکنشی از نوع جاذبه و دافعه وجود ندارد. | بین مولکولها نیروهای دافعه و جاذبه وجود دارد. |
| برخورد بین مولکولهای گاز ایده آل ارتجاعی است. | برخورد بین مولکولها ارتجاعی نیست. |
| گاز ایده آل وجود خارجی ندارد. | گاز حقیقی در طبیعت وجود دارد. |
| مولکولها بدون الگوی مشخص و در همه جهات با فشار بالایی حرکت میکنند. | مولکولها بدون الگوی مشخص و در همه جهات اما با فشار پایینتری حرکت میکنند. |
انحراف گاز حقیقی از رفتار ایده آل
در قسمتهای قبل آموختیم رفتار گاز ایده آل چیست و چه قوانینی دارد. یک گاز واقعی نمیتواند در واقعیت و بسیاری از شرایط مانند گاز ایده آل رفتار کند. برای مثال در قوانین در نظر گرفته شده برای گاز ایده آل هیچ برهمکنش بین مولکولی در نظر گرفته نشده است در حالی که مولکولها نمیتوانند بدون نیروهای جاذبه و دافعه در محیطی نزدیک به یکدیگر قرار بگیرند. همچنین برخورد مولکولها با یکدیگر حالت ارتجاعی ندارد و از انرژی آنها هنگام برخورد کاسته و افزوده میشود.
در مورد دیگری که در این قانون بررسی میشود، صرف نظر از حجم گاز است. این درحالی است که گازها نمیتوانند بدون حجم باشند. بدین صورت همواره بین رفتارهای گاز واقعی با رفتارهای پیش بینی شده گاز ایده آل انحرافاتی وجود دارد.
قوانین مرتبط با گاز ایده آل
آزمایشهای انجام شده درباره فاز گازی طی گذر زمان این حقیقت را نشان داده است که رابطه بین فشار، دما، حجم و مول گاز روابط ریاضی مشخصی است. قانون آووگادرو بیان میکند در دما و فشار ثابت، حجم گاز نسبت مستقیمی با مقدار گاز دارد. قانون بویل بیان میکند که حجم گاز به شکلی معکوس با فشار آن در دمای ثابت رابطه دارد. و در آخر قانون شارل میگوید که حجم در فشار و مقدار مول ثابت گاز به شکلی مستقیم با دما ارتباط دارد. در ادامه این مطلب از مجله فرادرس به توضیح این قوانین میپردازیم.
قانون آووگادرو و گاز ایده آل
برای جامدات و مایعات، میزان ماده معمولا به وسیله جرم آن مشخص میشود. اما استفاده از جرم در مورد گازها میتواند چالش برانگیز باشد. وزن کردن یک گاز باید در یک مخزن خلأ مهر و موم شده انجام بگیرد که کاری پرخطر و غیر منطقی است. یک روش آسانتر و کاربردیتر برای محاسبه مقادیر گاز، استفاده از جرم مولی آنها در دمای استاندارد ( صفر درجه سانتی گراد یا یک اتمسفر) است. در این شرایط، ۶٫۰۲۲ در ۱۰ به توان ۲۳ مولکول (۱ مول) از هر گازی، برابر با ۲۲٫۴ لیتر است. این قانون به نام قانون آووگادرو شناخته میشود. این قانون نشان میدهد که حجمهای مساوی از گازهای مختلف، تعداد برابری مولکول در دمای ثابت و فشار ثابت دارند. این بیان به اندازهگیری مقدار گاز صرف نظر از نوع آن کمک میکند.
قانون آووگادرو همچنین بیان میکند که حجم گاز به شکلی مستقیم با مقدار آن در ارتباط است. دوبرابر کردن حجم گاز باعث دوبرابر کردن تعداد مولکولهای آن در دما و فشار ثابت میشود. اگر فشار و دما ثابت باشند، هر تغییر نسبی در حجم باعث تغییر نسبی در تعداد مولکولهای گاز میشود. این روابط به شکل ریاضی با معادله زیر بررسی میشوند.
مقدار پارامتر بسته به شرایط و مقادیر دما و فشار میتوان متغیر باشد. درک این رابطه و وابستگی پارامترها برای بررسی میزان حجم گاز و سپس استفاده از قانون گاز ایده آل بسیار با اهمیت است.
قانون بویل و گاز ایده آل
قانون بویل بیان میکند یک رابطه معکوس بین فشار و حجم گاز در دمای ثابت وجود دارد. با افزایش فشار، حجم کاهش مییابد و بالعکس. این قانون توسط دانشمند انگلیسی، رابرت بویل بیان شد. او مشاهده کرد که دوبرابر کردن فشار گاز، حجم آن را نصف میکند و سه برابر کردن فشار گاز، حجم آن را یک سوم میکند. این روابط به وسیله معادله ریاضی زیر مشخص میشوند که در آن در یک دمای مشخص برای مقادیر گاز مورد بررسی ثابت است.
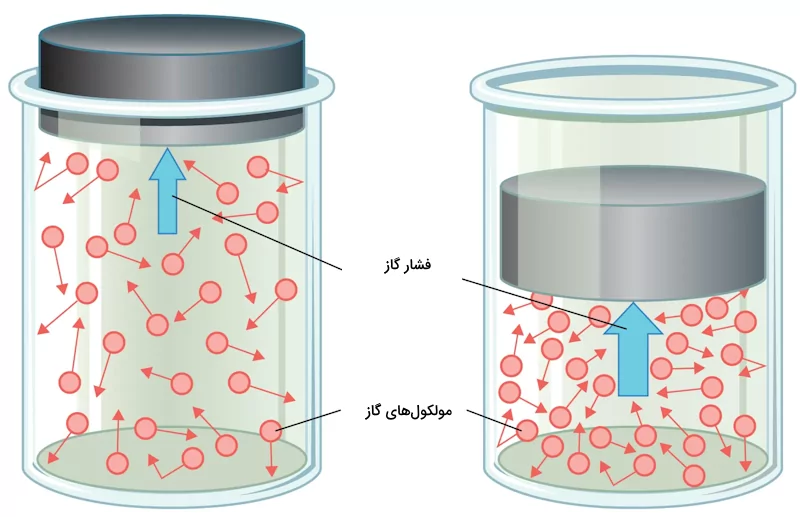
قانون بویل میتواند با انجام آزمایشهایی مشاهده شود. برای مثال فشرده کردن یک گاز در یک سرنگ یا مشاهده رفتار خوراکی مارشمالو در یک محفظه خلا و فشرده شدن آن انواع این آزمایشها هستند. همچنین، هنگامی که فشار و حجم در واحدهای SI بیان شوند، مقدار حاصل ضرب فشار در دما برابر با ۱۰۱٫۳ ژول میشود که این مقدار رابطه این پارامترها با انرژی را نیز بیان میکند. این دیدگاه، در مراحل پیشرفتهتر، تئوری سینتیکی گازها را نیز بررسی میکند. قانون بویل برای انجام محاسبات مربوط به تغییرات فشار و حجم در شرایط مختلف و به طبع آن بررسی رفتار گازها با استفاده از قانون گاز ایده آل در دمای ثابت مفید است. تصویر زیر اثر فشار را در قانون بویل به خوبی نشان میدهد.
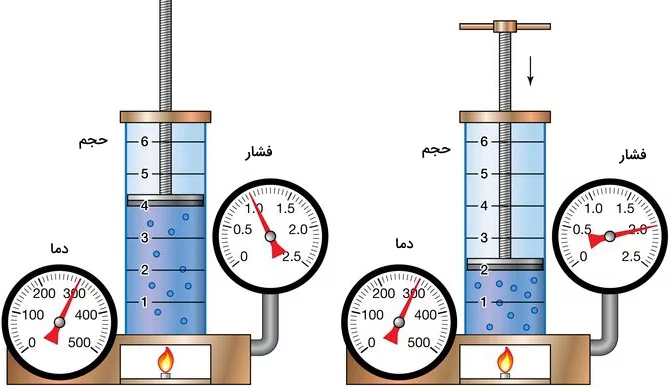
در تصویر بالا مشاهده میکنید که در دمای ثابت، با افزایش فشار از ۱ به ۲ حجم گاز در ظرف تقریبا نصف شده است.
قانون شارل و گاز ایده آل
قانون شارل بیان میکند رابطه بین حجم و دما در فشار ثابت برای گازها مستقیم است. این قانون که توسط دانشمندی به نام چالرز (شارل) کشف شد، بیان میکند که اگر در فشار و مقدار مول ثابت گاز، دما را افزایش دهیم، حجم آن نیز افزایش مییابد. اطلاعات تجربی نشان میدهد که افزایش دمای ۵۰ درجه سانتیگراد، باعث افزایش نسبی حجم گاز میشود. این قانون به شکل ریاضی با معادله زیر نشان داده میشود.
که در این معادله ثابت است. این قانون برای پیشبینی رفتار گازها در تغییرات دمای مختلف بسیار مفید است. از مشاهده این تغییرات میتوان رفتار گاز را بر اساس قانون گاز ایده آل بررسی کرد.
با بررسی این سه قانون میتوان پی برد که گاز ایده آل چیست و چه قوانین و محدودیتهایی بر آن حاکم است.
کاربردهای گاز ایده آل
مطالعه خواص و رفتار گاز ایده آل یکی از مهمترین مباحث در ترمودینامیک در شیمی است. فهم این مطالب کلید اصلی پیشبینی رفتار گازها در واقعیت است که این موضوع خود به پیشبینی و فهم بسیاری از واکنشها و فرایندهای شیمیایی کمک میکند. در واکنشهای شیمیایی که شامل گاز هستند، در نظر گرفتن قانون گاز ایده آل میتواند محاسبات ریاضی و پیشبینی واکنش را آسان کند. از این مفاهیم در صنایع مختلفی مانند علوم زیست محیطی، مهندسی و تحقیقاتی استفاده میشود. برخی از این کاربردها در ادامه توضیح داده شده است.
- مطالعه محیط زیست: در مطالعه علم محیط زیست، قانون گاز ایده آل برای الگوبرداری از رفتار گازهای اتمسفر استفاده میشود. برای مثال میتوان میزان پخش آلایندههای هوا یا تغییر نسبت گازهای اتمسفر در فشارهای مختلف و دماهای مختلف اطلاعات کسب کرد.
- علوم مهندسی: در علوم مهندسی، درک رفتار گازها یکی از اصول کلیدی طراحی سیستمهایی مانند موتورها وتوربینها است.
- تحقیقات علمی: در علوم مختلف، خصوصا شیمی و فیزیک، قانون گاز ایده آل و بررسی آن قدم ابتدایی برای توصیف تئوریهای جدید درباره رفتار گازها به شکلی دقیق است.
جمع بندی
در این مطلب از مجله فرادرس آموختیم گاز ایده آل مفهومی غیر واقعی است که برای بررسی رفتار گازها در شرایط مختلف بیان شده است و بر اساس قانون گاز ایده آل تعریف میشود. قانون گاز ایده آل با معادله به صورت بیان میشود. این قانون رابطه پیشرفتهتر قوانین آووگادرو، بویل و شارل است که ارتباط بین فشار، دما، حجم گاز و تعداد مول آن را مشخص میکند. رفتارهای گازهای حقیقی با رفتار تعریف شده برای گاز ایده آل متفاوت است. برای گاز ایده آل هیچ برهمکنش و حجمی در نظر گرفته نمیشود و تصور میشود برخورد بین ذرات گاز ایده آل حالت ارتجاعی داشته باشد و انرژی در اثر برخورد از بین نرود. قانون گاز ایده آل در مراحل پیشرفته تر به صورت معادله واندروالس استفاده میشود که مقادیر واقعیتر نسبت حجم و دما و فشار گاز را بررسی میکند. شناخت این موضوع که گاز ایده آل چیست برای بررسی رفتار گاز در بسیاری از واکنشهای شیمیایی در علوم مختلف و مهندسی اهمیت دارد.