پیوند هیدروژنی – به زبان ساده

پیوند هیدروژنی نوع ضعیفی از نیروهایی است که موجب ایجاد جاذبه دوقطبی-دوقطبی هستند. این پیوند زمانی تشکیل میشود که یک اتم هیدروژن با اتمی پیوند تشکیل دهد که آن اتم، الکترونگاتیوی بالایی داشته و همزمان در کنار یک اتم الکترونگاتیو دیگری باشد که دارای جفتالکترون ناپیوندی است. این نوع از پیوندها، از نیروهای دوقطبی-دوقطبی معمول و نیروهای پراکندگی، قدرت بیشتری دارند اما ضعیفتر از پیوندهای کووالانسی و یونی هستند.
لازم به ذکر است «فایل PDF پیوندهای شیمیایی» (تقلبنامه پیوندهای شیمیایی) را نیز میتوانید به طور جداگانه دانلود و مطالعه کنید. این تقلبنامه شامل تعریف انواع پیوندهای شیمیایی همچون پیوندهای یونی و کووالانسی است. همچنین، نیروهای بین مولکولی و پیوندهای هیدروژنی و فلزی نیز به طور کامل مورد بررسی قرار گرفتهاند.
آثار پیوند هیدروژنی
بسیاری از عناصر، با هیدروژن پیوند تشکیل میدهند. اگر نمودار نقطه جوش ترکیبات عناصر گروه ۱۴ جدول تناوبی را رسم کنید، متوجه خواهید شد که از بالا به پایین، نقطه جوش افزایش پیدا میکند.
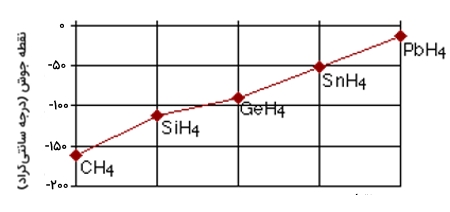
افزایش نقطه جوش به این دلیل اتقاق میافتد چون اندازه مولکولها با افزایش تعداد الکترونها بیشتر میشود و در نتیجه، نیروهای پراکندگی واندروالس بزرگتر میشوند. اگر این روند را برای عناصر گروه ۱۵، ۱۶ و ۱۷ انجام دهید با نکته عجیبی روبرو خواهید شد.
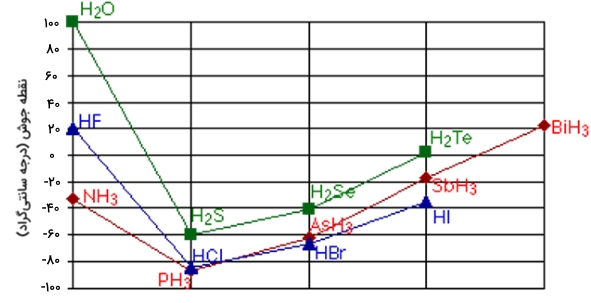
با وجود اینکه در بیشتر قسمتها، همان روند قبل را مشاهده میکنیم، اما نقطه جوش ترکیبات هیدروژن با اولین عنصر از هر گروه، به طور غیرعادی بیشتر است. در حقیقت، برای مولکولهای $$NH_3$$، آب و $$HF$$، باید نیروهای جاذبه بین مولکولی دیگری هم باشد که به این سبب، انرژی گرمایی بیشتری برای شکستن پیوندها نیاز داریم. این نیروهای قدرتمند بینمولکولی را با نام «پیوند هیدروژنی» (Hydrogen Bonds) میشناسند.
پیوند هیدروژنی بین کدام اتمها است
پیشتر، مولکولهایی را معرفی کردیم که پیوند قویتری داشتند، این مولکولها در تصویر زیر آورده شدهاند. توجه کنید که در هر یک از این مولکولها، هیدروژن به طور مستقیم به الکترونگاتیوترین عنصر متصل شده و همین امر سبب شده است تا هیدروژن، بار مثبت قابل توجهی را دریافت کند. علاوه بر این، عناصری که در این تصویر، هیدروژن با آنها پیوند تشکیل داده است، حداقل دارای یک جفتالکترون ناپیوندی هستند.
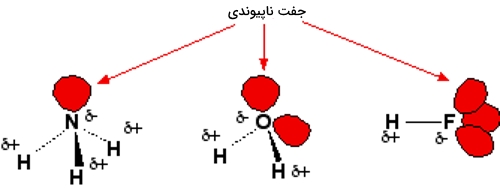
دو مولکول آب را در نظر بگیرید که به یکدیگر نزدیک میشوند. هیدروژن با بار $$\delta ^ +$$، به شدت جذب جفتالکترون ناپیوندی میشود و گویی قصد تشکیل پیوند کوردینانسی (داتیو) دارد. این جاذبه، به طور مشخص از برهمکنشهای دوقطبی-دوقطبی، قدرت بیشتری دارد. قدرت پیوند هیدروژنی در حدود ده درصد یک پیوند کووالانسی است. این نوع از پیوندها به طور پیوسته در آبِ مایع تشکیل و شکسته میشوند.
آب، نمونه بسیار خوبی از پیوند هیدروژنی است. توجه داشته باشید که هر مولکول آب توانایی تشکیل چهار پیوند هیدروژنی با مولکولهای آب اطراف خود را دارد. در حقیقت، تعداد هیدروژنهای $$\delta ^ +$$ به طور دقیق با جفتالکترونهای ناپیوندی برابر است و در نتیجه، هرکدام میتوانند در پیوندهای هیدروژنی شرکت کنند.
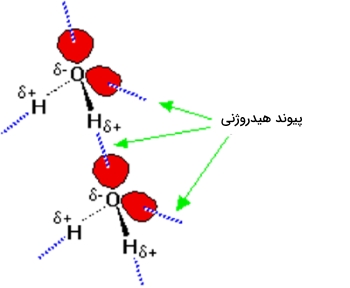
به همین دلیل است که نقطه جوش آب، بیشتر از آمونیاک یا هیدروژن فلوراید است. در خصوص آمونیاک، تعداد پیوندهای هیدروژنی به علت اینکه تنها یک جفتالکترون ناپیوندی داریم، محدودیت دارند. در گروهی از مولکولهای آمونیاک، تعداد کافی جفتالکترون ناپیوندی در اطراف هیدروژن وجود ندارد تا بتوانند شرایط این پیوند را تامین کنند. به همین شکل، در هیدروژن فلوراید، به تعداد کافی هیدروژن نداریم.
نمونههای پیچیدهتر برای پیوند هیدروژنی
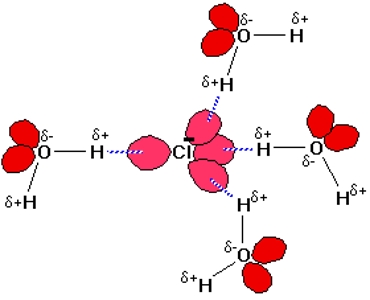
زمانی که یک ماده یونی در آب حل شود، مولکولهای آب در اطراف یون تفکیک شده جمع خواهند شد. به این فرآیند، «هیدراسیون» (Hydration) یا آبپوشی میگویند. مولکولهای آب به طور معمول توسط پیوندهای کوردینانسی (داتیو) به یونهای مثبت و از طریق پیوندهای هیدروژنی به یونهای منفی متصل میشود. تصویر زیر نحوه آبپوشی مولکولهای آب را در اطراف یون کلر نشان میدهد. جفتالکترونهای ناپیوندی در اتم کلر برای انجام پیوند هیدروژنی، به تنهایی مناسب نیستند اما الکترونگاتیوی بالای اتم کلر این امکان را فراهم میکند. هرقدر که یک یون، به لحاظ ساختاری پیچیده باشد، همواره یک جفتالکترون ناپیوندی هست که اتم هیدروژن بتواند با آن پیوند هیدروژنی دهد.
پیوند هیدروژنی در الکلها
یک الکل، مولکولی آلی شامل گروه $$-OH$$ است. هر مولکولی که در آن، هیدروژن به طور مستقیم متصل به اکسیژن یا نیتروژن باشد، توانایی تشکیل پیوند هیدروژنی دارد. چنین مولکولهایی که دارای گروههای $$-NH$$ یا $$-OH$$ هستند، همواره نقطه جوشی بالاتر از مولکولهای هماندازه خود دارند. پیوند هیدروژنی سبب میشود تا مولکول، چسبندگی بیشتری داشته و برای جدا کردن آنها از هم، گرمای بیشتری نیاز باشد.
پیوند هیدروژنی در اتانول
اتانول و متوکسیمتان، هر دو فرمول مولکولی یکسانی به صورت $$C _ 2 H _ 6 O $$ و تعداد یکسان الکترون دارند. حتی طول مولکولی و نیروهای جاذبه واندروالس در هر مولکول هم یکسان است اما اتانول، هیدروژنی با اتصال مستقیم به اکسیژن دارد و اکسیژن نیز همچون مولکول آب، دو جفتالکترون ناپیوندی دارد. البته پیوند هیدروژنی به خوبی آب در بین مولکولهای اتانول رخ نمیدهد چراکه در هر مولکول اتانول، تنها یک هیدروژن با مقدار مناسب بار $$\delta ^ +$$ وجود دارد.
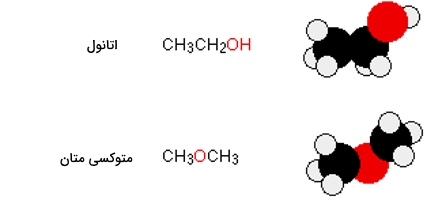
در متوکسیمتان نیز جفتالکترونهای ناپیوندی اکسیژن حضور دارند اما هیدروژن، مقدار مناسبی از $$\delta ^ +$$ را در اختیار ندارد تا پیوند هیدروژنی تشکیل دهد. همانطور که در ابتدای بحث نیز به آن اشاره شد، به جز در مواردی خاص، برای انجام یک پیوند هیدروژنی، اتم هیدروژن باید به طور مستقیم به اتمی با الکترونگاتیوی بسیار زیاد متصل شود. با نگاهی به نقطه جوش اتانول و متوکسیمتان، میتوان دریافت که وجود پیوند هیدروژنی، چه مقدار در چسبندگی مولکولها به یکدیگر تاثیر دارد.
| نام ماده | نقطه جوش (درجه سانتیگراد) |
| اتانول (با پیوند هیدروژنی) | $$78.5 C ^ \circ$$ |
| متوکسیمتان (بدون پیوند هیدروژنی) | $$-24.8 C ^ \circ$$ |
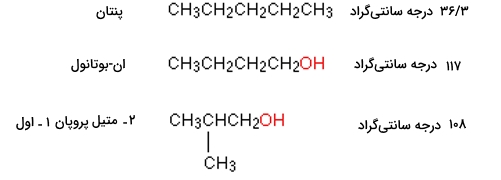
با نگاهی به جدول درمییابیم که پیوند هیدروژنی در اتانول موجب افزایش صد درجهای نقطه جوش شده است. توجه داشته باشید که این پیوند، علاوه بر نیروهای جاذبه واندروالس حضور دارد. به طور مثال، تمامی مولکولهای زیر دارای تعداد برابری الکترون هستند و دو مولکول اول نیز، طول یکسانی دارند. دلیل نقطه جوش بالاتر ان-بوتانول را میتوان در وجود پیوند هیدروژنی جستجو کرد.
شاخهدار شدن مولکول آلی و تاثیر آن بر نقطه جوش
با مقایسه دو مولکولی که دارای گروه $$-OH$$ هستند، میبینیم که هردو، نقطه ذوب بالایی دارند چراکه مولکول هیدروژن به طور مستقیم به اکسیژن متصل و پیوند هیدروژنی برقرار شده است. اما این پیوندها یکسان نیستند و نقطه جوش ایزوبوتانول (108 درجه سانتیگراد) به اندازه ۱-بوتانول بالا نیست چراکه شاخهدار شدن مولکول آلی موجب کاهش جاذبه واندرولس و به تبع آن کاهش نقطه جوش میشود.
پیوند هیدروژنی در مولکولهای آلی شامل نیتروژن
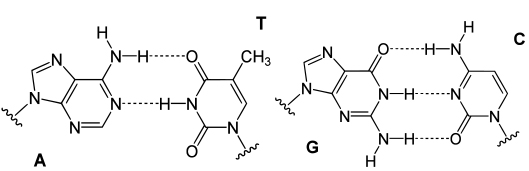
همانطور که گفته شد، تشکیل پیوند هیدروژنی در مولکولهای آلی شامل گروه $$-NH$$، همانند آنچه که در مولکول آمونیاک دیدیم نیز امکانپذیر است. این نوع از پیوندها را میتوان در مولکولهای کوچکی همچون آمینها یا مولکولهای بزرگتری مانند پروتئینها و DNA مشاهده کرد. در تصاویر زیر، پیوندهای هیدروژنی در ساختارهای مختلف مولکول DNA را ملاحظه میکنید:
شرط تشکیل پیوند هیدروژنی
برای اینکه یک پیوند هیدروژنی اتفاق بیافتد باید به طور همزمان یک «دهنده» (Donor) هیدروژن و یک «پذیرنده» (Acceptor) وجود داشته باشند. دهنده در پیوند هیدروژنی، اتمی است که در آن، اتم هیدروژنِ دخیل در پیوند هیدروژنی به طور کووالانسی با آن پیوند تشکیل داده و به طور معمول، اتمی الکترونگاتیو همچون نیتروژن، اکسیژن یا فلوئور است. پذیرنده هیدروژن نیز به مولکول یا یون الکترونگاتیو در همسایگی هیدروژن میگویند که برای تشکیل پیوند، دارای جفتالکترون ناپیوندی باشد.
دلیل ایجاد پیوند هیدروژنی
از آنجایی که دهنده هیدروژن، خاصیت الکترونگاتیوی بالایی دارد، جفتالکترون با پیوند کووالانسی در هیدروژن را به طرف هسته خود میکشد و آن را از اتم هیدروژن دور میکند. در نتیجه این عمل، اتم هیدروژن به صورت جزئی دارای بار مثبت و موجب تشکیل جاذبه دوقطبی-دوقطبی بین اتم هیدروژن و دهنده و همچنین بین جفتالکترون ناپیوندی در پذیرنده میشود. در نهایت، این نیروها علت ایجاد پیوند هیدروژنی خواهند بود.
انواع پیوند هیدروژنی
پیوند هیدروژنی میتواند بین دو مولکول تنها، دو مولکول شبیه به هم یا دو مولکول متفاوت تشکیل شود.
پیوندهای هیدروژنی درونمولکولی
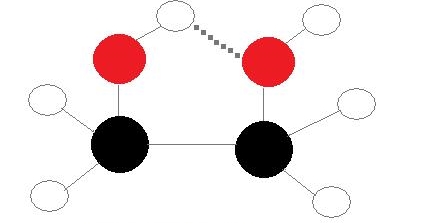
«پیوندهای هیدروژنی درونمولکولی» (Intramolecular Hydrogen Bonds)، پیوندهایی هستند که در داخل یک مولکول تنها اتفاق میافتند. این اتفاق زمانی انجام میشود که دو گروه عاملی یک مولکول بتوانند با یکدیگر پیوند هیدروژنی تشکیل دهند. برای انجام چنین پیوندی، دهنده و پذیرنده هیدروژن، هردو باید در یک مولکول وجود داشته و در مجاورت یکدیگر باشند. به طور مثال، در اتیلن گلایکول با فرمول شیمیایی $$C_2H_4(OH)_2$$، با توجه به هندسه مولکولی، پیوند هیدروژنی بین دو گروه هیدروکسیل آن رخ میدهد.
پیوندهای هیدروژنی بینمولکولی
«پیوندهای هیدروژنی بینمولکولی» (Intermolecular Hydrogen Bonds) بین دو مولکول مجزا در یک ماده تشکیل میشوند. این نوع از پیوندها بین هر دو مولکولی که شبیه یا غیرشبیه باشند بوقوع میپیوندند و فقط باید دهنده و پذیرنده هیدروژن، طبق شرایطی که قبلا گفته شد حضور داشته باشند. به طور مثال، پیوندهای هیدروژنی بینمولکولی میتواند بین مولکولهای آمونیاک، بین دو مولکول آب یا بین مولکول آب و آمونیاک تشکیل شود.
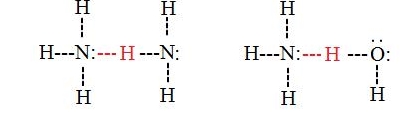
خواص و تاثیرات پیوند هیدروژنی
همانطور که دیدیم، پیوند هیدروژنی بر نقطه جوش مواد تاثیرگذار است اما این پیوند، تاثیرات دیگری هم بر روی ویسکوزیته دارد که در ادامه این دو موضوع را بررسی خواهیم کرد.
تاثیر پیوند هیدروژنی بر نقطه جوش
زمانی که نقطه جوش مولکولها را در نظر میگیریم، انتظار داریم تا مولکولهایی با جرم مولی بیشتر، نقطه جوش بیشتری نسبت به مولکولها با جرم مولی کمتر داشته باشند. این موضوع، زمانی که پیوندهای هیدروژنی را در نظر نگیریم، معمولا به علت نیروهای پراکندگیِ بزرگتر است. مولکولهای بزرگتر، فضای بیشتری برای توزیع الکترونها دارند و بنابراین احتمال بیشتری برای ایجاد شدن «ممان دوقطبی» (Dipole Moment) وجود دارد اما وقتی به جدول زیر نگاه کنیم، متوجه میشویم که این مورد همیشه صحیح نیست.
| مولکول | جرم مولی $$(g/mol)$$ | نقطه جوش (درجه سانتیگراد) |
| $$H _ { 2 } O$$ | $$18$$ | $$99/85$$ |
| $$HF$$ | $$20$$ | $$19/35$$ |
| $$N H _ { 3 }$$ | $$17$$ | $$-33.35$$ |
| $$H _ { 2 } S$$ | $$34$$ | $$-60.25$$ |
| $$H C l$$ | $$36.4$$ | $$-75.25$$ |
| $$P H _ { 3 }$$ | $$34$$ | $$-87.95$$ |
جدول بالا نشان میدهد که مولکولهای آب، هیدروژن فلوراید و آمونیاک، نقطه جوش بشتری نسبت به دیگر ترکیبات دارند. این ترکیبات، بین هیدروژن و عنصری تشکیل شدهاند که در جدول تناوبی، پایینتر از عنصر همگروه خود قرار دارند. این امر به این دلیل است که آب، هیدروژن فلوراید و آمونیاک همگی دارای پیوند هیدروژنی هستند و سایر ترکیبات در جدول، پیوند هیدروژنی ندارند. علاوه بر این، مولکول آب جرم مولی بیشتری نسبت به هیدروژن فلوراید دارد اما در هر مولکول آب، تعداد پیوند هیدروژنی بیشتری شرکت میکنند و بنابراین، نقطه جوش آن به طور مشخصی از $$HF$$ بیشتر است.
تاثیر پیوند هیدروژنی بر ویسکوزیته
همان تاثیری که پیوند هیدروژنی بر نقطه جوش داشت را به طور مشابه میتوانیم در ویسکوزیته برخی مواد هم ببینیم. موادی که میتوانند پیوند هیدروژنی تشکیل دهند، ویسکوزیته بیشتری از دیگر مواد دارند. علاوه بر این، موادی که چندین پیوند هیدروژنی تشکیل میدهند، ویسکوزیته بیشتری نیز خواهند داشت.
عوامل موثر در عدم تشکیل پیوند هیدروژنی
الکترونگاتیوی و اندازه اتم، عواملی هستند که در تشکیل شدن یا نشدن پیوند هیدروژنی تاثیر دارند که در ادامه به بررسی این دو مورد خواهیم پرداخت:
تاثیر الکترونگاتیوی در پیوند هیدروژنی
این پیوند زمانی تشکیل میشود که اختلاف الکترونگاتیوی زیادی بین اتم هیدروژن و اتم شرکتکننده در پیوند وجود داشته باشد. به طور مثال، در مولکول $$PH_3$$، پیوند هیدروژنی نداریم. شکل این مولکول همانند آمونیاک، به صورت هرم مثلثی است اما برخلاف $$NH_3$$ توانایی تشکیل پیوند هیدروژنی ندارد چراکه بین فسفر و هیدروژن، اختلاف الکترونگاتیوی زیادی نداریم و الکترونگاتیوی هردو برابر با 2/1 است. در نتیجه، هیج ممان دوقطبی نیز نخواهیم داشت. این امر سبب میشود تا بار جزئی مثبت مورد نیاز برای ایجاد این نوع از پیوند با جفتالکترون ناپیوندی تامین نشود.
تاثیر اندازه اتم در پیوند هیدروژنی
اندازه دهنده و پذیرنده پیوند هیدروژنی نیز در تشکیل شدن این پیوند موثر است. به همین دلیل، اتم کلر توانایی تشکیل پیوند هیدروژنی ندارد. زمانی که شعاع دو اتم تفاوت زیادی با یکدیگر داشته یا اینکه هر دو شعاع بزرگی داشته باشند، هسته اتمها به نمیتوانند به هنگام برهمکنش، در مجاورت یکدیگر قرار بگیرند و در نتیجه، برهمکنشهایی ضعیف خواهیم داشت.
پیوند هیدروژنی در طبیعت
این نوع از پیوند نقش مهمی در بسیاری از فرآیندهای بیولوژیکی ایفا میکند و دلیل بسیاری از پدیدههای طبیعی همچون خواص غیر عادی آب است. این پیوند علاوه بر حضور در آب، در موارد دیگر همچون سیستمهای انتقال آب در گیاهان، ساختارهای دوم و سوم در پروتئینها و DNA نقش دارد.
پیوند هیدروژنی و آب
پیوند هیدروژنی، دلیل برخی خواص منحصربهفرد آب است. با وجود اینکه این پیوند، قدرتی در حدود ۱۰ درصد پیوند کووالانسی دارد اما همین مقدار برای پایداری مولکولهای آب کفایت میکند. برخی از این خواص در ادامه آمدهاند:
- پیوند هیدروژنی سبب میشود تا آب در دماهای مختلف به حالت مایع وجود داشته باشد.
- آب برای تبخیر شدن نیاز به گرمای بسیار زیادی دارد و نقطه جوش آن هم به دلیل وجود پیوند هیدروژنی، بسیار بالا است.
- دلیل چگالی کمتر یخ و سر خوردن آن روی آب را وجود این نوع از پیوند ذکر میکنند.
گرمای مورد نیاز برای تبخیر آب، ابزاری برای کنترل دمای بدن موجودات زنده از طریق تعریق به شمار میآید. علاوه بر این، تاثیر بر «ظرفیت گرمایی» (Heat Capacity) موجب میشود تا آب در کنترل دمای زمین و جلوگیری از تغییرات ناگهانی دما نقش مهمی داشته باشد.
گیاهان
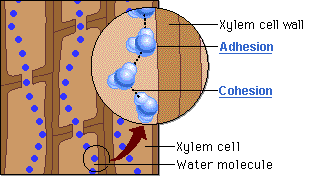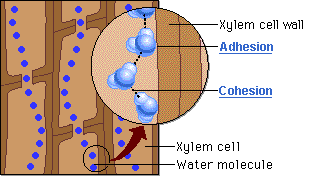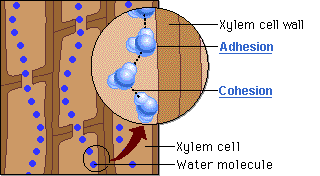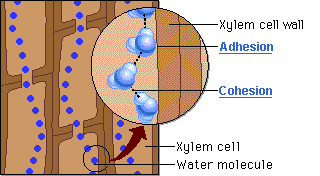
«نظریه چسبندگی-پیوستگی» (Cohesion-Adhesion Theory) در گیاهان آوندی، از پیوند هیدروژنی برای توضیح بسیاری از فرآیندهای اصلی در انتقال آب استفاده میکند. در آوندهای گیاهان، مولکولهای آب نهتنها با یکدیگر پیوند هیدروژنی تشکیل میدهند، بلکه با زنجیره سلولوزی دیواره سلولی گیاهان نیز این پیوند برقرار میشود.
در نتیجه این امر، مجموعهای از «لولههای مویین» (Capillary Tubes) بوجود میآیند که به سبب کوچکی آوندهای گیاهان، در نهایت حرکت مویین را به همراه خواهد داشت. این مکانیسم به گیاهان اجازه میدهد تا آب را به ریشههای خود وارد کنند. علاوه بر این، پیوند هیدروژنی میتواند زنجیره طویلی از مولکولهای آب را ایجاد کند که توانایی غلبه بر نیروی جاذبه را داشته باشند و تا ارتفاعات زیاد و برگها بالا بروند.
پروتئینها
پیوند هیدروژنی را به وفور در ساختارهای دوم و سوم پروتئینها میتوان دید. ساختار دوم پروتئینها شامل برهمکنشهایی از پیوند هیدروژنی بین پیکرههای پلیپپتیدی دارای پیوندهای نیتروژن-هیدروژنی و اتمهای اکسیژن هستند. از آنجایی که هر دو اتم اکسیژن و نیتروژن به شدت الکترونگاتیو هستند، اتمهای هیدروژن متصل به نیتروژن در یک پیکره پلیپپتید میتوانند با اتمهای اکسیژنِ دیگر زنجیرهها پیوند هیدروژنی تشکیل دهند و برعکس. با وجود اینکه این نوع از پیوندها قدرت کمی دارند، اما سبب پایداری در ساختار دوم پروتئینها خواهند بود چرا که در دفعات بسیاری تکرار میشوند.
در ساختارهای سوم پروتئینها، برهمکنشها به طور عمده بین گروههای عاملی R و زنجیر پلیپپتیدی اتفاق میافتند که یکی از این برهمکنشها موسوم به «برهمکنش آبگریز» (Hydrophobic Interaction) است. این برهمکنشها به دلیل پیوند هیدروژنی بین مولکول آب و بخش آبگریز بوقوع میپیوندند و موجب تقویت ساختار میشوند.
نمونههایی از پیوند هیدروژنی
در زیر، فهرستی از مولکولهایی نشان داده شده است که این نوع پیوند را دارند.
- آب: همانطور که پیشتر نیز اشاره شد، آب، نمونهای فوقالعاده از پیوند هیدروژنی است. پیوند بین هیدروژن یک مولکول آب با اتم اکسیژن مولکول دیگر تشکیل میشود. طبیعت قطبی مولکول آب کمک میکند تا هر اتم هیدروژن، جاذبهای را از طرف اکسیژنی که با آن پیوند دارد و بخش غیر هیدروژنی اتم اکسیژن مولکول دیگر احساس کند. این نوع پیوند در مولکول آب، علت وجود ساختار بلوری یخ و چگالی کمتر آن نسبت به آب است.
- کلروفرم $$(CH_3Cl)$$: این پیوند بین هیدروژنِ یک مولکول و کربن مولکول دیگر تشکیل میشود.
- استیلاستون $$(C_5H_8O_2)$$: این نوع پیوند از نوع پیوند هیدروژنی درونمولکولی بین هیدروژن و اکسیژن است.
- نایلون: پیوندهای هیدروژنی بین واحدهای تکرارشونده پلیمرها تشکیل میشوند.
- هیدروژن فلوراید: پیوندهای هیدروژنی که در هیدروژن فلوراید تشکیل میشوند موسوم به «پیوندهای متفارن هیدروژنی» (Symmetric Hydrogen Bond) هستند.
- پلیمرها: پلیمرهایی که شامل گروههای عاملی کربونیل یا آمید باشند، پیوند هیدروژنی تشکیل میدهند. اوره، پلیاورتان و پلیمرهای طبیعی سلولوزی از این دستهاند. پیوند هیدروژنی در این مولکولها سبب افزایش «مقاومت کششی» (Tensile Strength) و نقطه ذوب میشود.
تفاوت بین پیوند هیدروژنی و کووالانسی
جدول زیر، تفاوت بین این دو پیوند را مشخص میکند:
| پیوند هیدروژنی | پیوند کووالانسی |
| این پیوند از طریق جاذبه الکترواستاتیک بین هیدروژن و یک اتم الکترونگاتیو همچون اکسیژن، نیتروژن و فلوئور اتفاق میافتد. | پیوند کووالانسی از اشتراکگذاری الکترون بین اتمها بوجود میآید. |
| پیوندی ضعیف است. | در دسته پیوندهای قوی جای میگیرد. |
| انرژی پیوند بین 5-50 $$kJ/mol$$ است. | انرژی پیوند در حدود 100-1100 $$kJ/mol$$ است. |
| این پیوند تنها بین هیدروژن و یک اتم الکترونگاتیو بوجود میآید. | پیوند کووالانسی بین اتمهای مختلف بوجود میآید. |
| این پیوند تنها در مولکولهای قطبی تشکیل میشود. | بین اتمها یا مولکولهای قطبی و ناقطبی تشکیل میشود. |
| قدرت پیوند هیدروژنی، با افزایش اختلاف الکترونگاتیوی بین هیدروژن و اتم پیوندی، افزایش مییابد. | پیوند کووالانسی زمانی بیشترین قدرت را دارد که اتمهای پیوندی، الکترونگاتیوی مشابهی داشته باشند. |
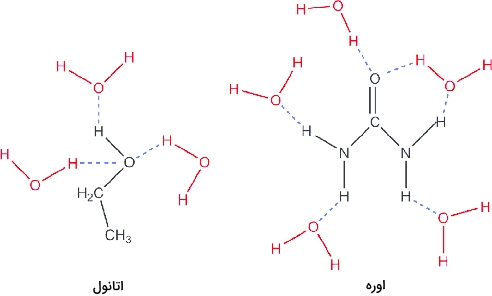
پیوند هیدروژنی اوره
مولکول اوره، مولکولی مسطح با ساختاری بلوری است اما هندسه اطراف اتمهای نیتروژن آن در فاز گازی، به شکل هرمی دیده میشود. در اوره جامد، اکسیژن مرکزی، دو پیوند $$N-H-O$$ دارد. در تصویر زیر، پیوندهای هیدروژنی الکل و اوره نمایش داده شدهاند:
اگر مطلب بالا برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- حجم مولی — به زبان ساده
- نظریه برخورد — به زبان ساده
- جدول تناوبی — از صفر تا صد
^^











با سلام خیلی ممنون از توضیح خوب و مفیدتان
بنده یک سوالی داشتم و اونم این است که چطور در استون پیوند هیدروژنی نداریم ولی وقتی در آب قرار میگیره بین آب و استون پیوند هیدروژنی ایجاد میشه؟
با سلام؛
پیشنهاد میکنیم پاراگراف ابتدای مطلب را بار دیگر با دقت بیشتری مطالعه کنید.
با تشکر
امونیاک چند پیوند هیدروژنی میده منظورن اینه که در قرار گیری ان تا مولکول امونیاک خودش چند پیوند هیدروژنی حد اکثرا میده
با سلام؛
با کمی دقت در بخشی از مطلب با تیتر «پیوندهای هیدروژنی بینمولکولی» میتوان با نحوه تشکیل پیوندهای هیدروژنی در این مولکول، آشنایی بیشتری پیدا کرد.
با تشکر از همراهی شما با مجله فرادرس
درود بر شما،
در مورد مقایسه پیوند هیدروژنی بین مولکول های آب و مولکول های HF (منظور بین دو مولکول آب و HF نیست بلکه هر نوع مولکول ها جداگانه، پیوند هیدروژنی بین آب و آب و پیوند هیدروژنی بین HF و HF) چرا پیوند هیدروژنی آب قوی تر از HF است؟ نوشته اند که مولکول آب چهار پیوند هیدروژنی برقرار می کند اما HF دو پیوند! آیا هر جفت الکترون ناپیوندی در HF که تعدادشان سه جفت است با اتم های هیدروژن مجاور در مولکول های مجاور، پیوند هیدروژنی برقرار نمی کند؟ اگه برقرار کند مولکول HF هم آنوقت چهار پیوند هیدروژنی می تواند با مولکول های مجاورش برقرار کند.
با سلام؛
با دقت در بارهای جزئی هر مولکول میبینیم که در مولکولی آب، دو بار جزئی مثبت داریم و در مولکول HF، یک بار جزئی و از اینرو تا حدی میتوان قدرت پیوند را توضیح داد.
با تشکر از همراهی شما با مجله فرادرس
سلام. خیلی ممنون
ببخشید مگه اتم هایی که از طریق پیوند کوالانسی باهمدیگه پیوند خورده اند هم بار الکتریکی دارند؟! باتوجه به اینکه تو پیوند کوالانسی، داد و ستد الکترونی اتفاق نمی افته و آنیون و کاتیون نداریم. پس چرا در مولکول آب، دواتم هیدروژن رو به شکل یون منفی و اتم اکسیژن رو به صورت یون مثبت نشون میدن؟
و آیا بدلیل همین بار الکتریکی هست که هیدروژن یک مولکول آب، با اکسیژن یک مولکول دیگه آب پیوند هیدروژنی برقرار میکنه؟
یک سوال دیگه هم دارم: آیا مولکول های اسیدهای مختلف قطبی هستند یا غیر قطبی؟ و آیا میشه اسید ها رو با الکترولیز تجزیه کرد یا خیر؟ (مثلا اسید فسفریک رو تجزیه کرد؛ اکسیژن و هیدروژن هاش جدا بشن و فسفرش ته نشین بشه)
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. اتمها را به صورت یون نشان نمیدهیم بلکه این اتمها دارای بار جزئی مثبت یا منفی حاصل از پخش شدگی الکترونها و همچنین وجود الکترونهای ناپیوندی هستند.
قطبیت مولکولها در اسیدها را باید در کنار سایر عوامل بررسی کرد که این موضوع در مطلب «عوامل موثر بر قدرت اسید و باز — به زبان ساده» به خوبی بیان شده است اما به طور کلی هرقدر پیوند قطبیتر باشد، اسید قویتری خواهیم داشت. اسیدها را نیز در حالت رقیق و محلول در آب میتوان الکترولیز کرد اما فرآوردههای حاصل را نمیتوان به صورت یک قانون کلی بیان کرد. الکترولیز بسیاری از نمکها یا محلولهای اسیدی در کاتد، هیدروژن تولید میکند و در خصوص فسفریک اسید نیز با توجه به اینکه نقش الکترولیت خواهد داشت، در نتیجه، تهنشین نخواهد شد.
با تشکر