فشار بخار (Vapor Pressure) — به زبان ساده

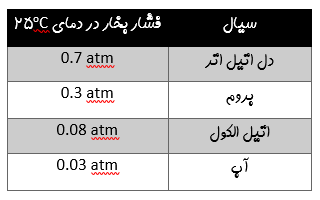
فشار بخار و ویسکوزیته از جمله مشخصات اساسی و ویژگیهای مهم یک مایع محسوب میشوند. این دو پارامتر، دو مفهوم پایهای و اساسی در فیزیک و مکانیک سیالات هستند. در واقع فشار بخار یک مایع، فشار تعادل بخار بالای سطح آن مایع را نشان میدهد و این فشار تعادل، فشاری است که بخار حاصل از تبخیر مایع، در بالای سطح مایعی اعمال میکند که درون یک محفظه در بسته قرار دارد. برای مثال فشار بخار چند سیال مختلف، در دمای اتاق (25 درجه سانتی گراد) در جدول زیر داده شده است.
توجه شود که فشار بخار یک مایع با تغییر دمای آن مایع تغییر میکند. برای مثال نمودار زیر، تغییرات فشار بخار آب در واحد اتمسفر را بر حسب دمای آب نشان میدهد. خطی که در نمودار رسم شده، دمای جوش آب در فشار یک اتمسفر را نشان میدهد. در قسمتهای بعد به صورت دقیق بیان میشود که نقطه آغاز جوشش زمانی است که فشار بخار مایع با فشار محیط برابر شود.
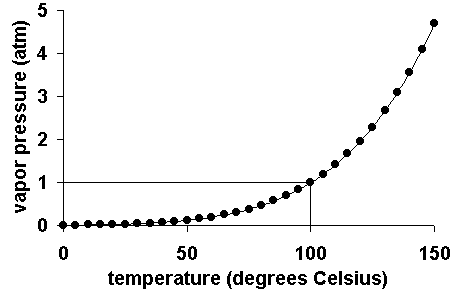
با دقت در شکل بالا متوجه میشود که با افزایش دمای سیال، فشار بخار آن نیز افزایش مییابد و زمانی که دمای سیال کاهش پیدا میکند، فشار بخار آن سیال، افت میکند.
فشار بخار مایع را میتوان با استفاده از روشهای مختلف اندازهگیری کرد. یکی از سادهترین راهها، این است که سیال را درون ظرف در بستهای قرار دهیم که به یک مانومتر متصل است. بنابراین در هر لحظه و هر دما، فشار تعادل و فشار بخار این سیال را میتوان اندازهگیری کرد.
بیان میکروسکوپیکی فشار بخار
نکاتی که درباره فشار بخار مایع بیان شد، برای فشار بخار جامد نیز قابل بیان هستند. بنابراین حالتی را در نظر بگیرید که یک مایع یا جامد درون یک ظرف در بسته، تبخیر میشود، در این شرایط مولکولهای بخار این مایع یا جامد توانایی خروج از ظرف را ندارند و برخی از مولکولهای بخار ممکن است دوباره به حالت فشرده و اولیه خود یعنی مایع یا جامد تبدیل شوند.
در شرایط ذکر شده و زمانی که نرخ مایع یا جامد شدن گاز با نرخ تبخیر شدن مایع یا جامد، برابر باشد، دیگر مقدار گاز و مایع یا جامد تغییری نمیکند. بنابراین در این حالت، گاز موجود در محفظه (ظرف در بسته) در حالت تعادل با مایع یا جامد موجود در آن ظرف قرار دارد.
انیمیشن زیر تعادل میکروسکوپیکی میان گاز و مایع موجود درون یک ظرف در بسته را نشان میدهد. در این حالت نرخ تبخیر مایع با نرخ میعان گاز برابر است.

مشابه انیمیشن بالا، تعادل میکروسکوپیکی میان گاز و جامد نیز در انیمیشن زیر به تصویر کشیده شده است. در این حالت، نرخ تبخیر جامد با نرخ چگالش گاز با یکدیگر برابر هستند.
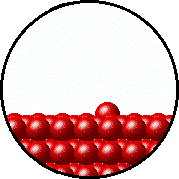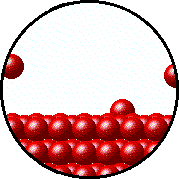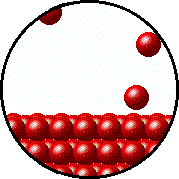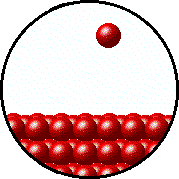
فشاری که توسط بخار و گاز موجود در محفظه اعمال میشود با فشار اعمالی توسط مایع یا جامدی که درون ظرف در بسته و در دمای معین قرار دارد، در حالت تعادل هستند و این فشار، فشار بخار نامیده میشود.
عوامل موثر در فشار بخار
یکی از عوامل بسیار مهم که تصور میشود نقش اساسی را در تعیین فشار بخار ایفا میکند، سطح مقطع است. در واقع سطح مقطعی از مایع یا جامد که با گاز در تماس است، هیچ تاثیری در فشار بخار این مایع یا جامد ندارد. شکل زیر به بررسی این موضوع میپردازد.
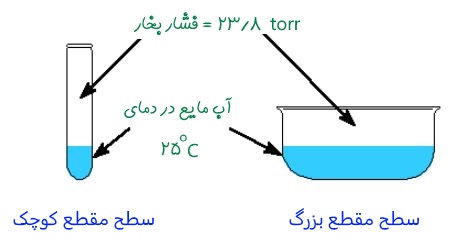
همانطور که مشاهده میشود، با تغییر سطح مقطع در یک دمای معین، فشار بخار مایع تغییر نکرده است. توجه کنید که «تور» (Torr) واحد فشار است و 1 تور، فشاری برابر با را نشان میدهد. 1 تور را میتوان به صورت حدودی برابر با 1 میلی متر جیوه نیز در نظر گرفت.
نوع مولکولهای تشکیل دهنده مایع یا جامد، پارامتر مهمی است که فشار بخار محصول نهایی را تعیین میکند. در واقع زمانی که نیروهای بین مولکولی در آن مایع یا جامد، قوی باشند فشار بخار آن مایع یا جامد پایین است و زمانی که نیروهای بین مولکولی در این مایع یا جامد ضعیف باشند، فشار بخار مایع یا جامد بالا است.
برای مثال، فشار بخار اتیل الکل که با نماد C2H6O نشان داده میشود، در دمای 25oC برابر با 75 تور است و فشار بخار اتیل اتر (C۴H10O) در همین دما برابر با 520 تور محاسبه شده است.
دمای مایع یا جامد، پارامتر مهم دیگری است که تاثیر مستقیمی در فشار بخار دارد. در واقع زمانی که دما افزایش مییابد، تعداد مولکولهای بیشتری انرژی کافی برای فرار از سطح مایع یا جامد را دارند بنابراین تعادل در فشار بالاتری برقرار میشود و این به آن معنا است که با افزایش دما، فشار بخار افزایش مییابد.
اندازهگیری فشار بخار
برای فهم دقیق مفهوم فشار بخار، دستگاه اندازهگیری فشاری را که در شکل زیر نشان داده شده را در نظر بگیرید.
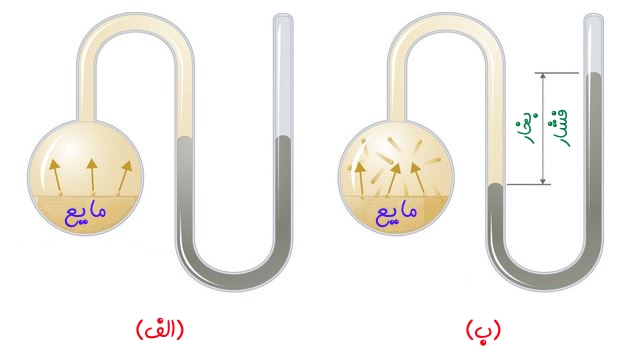
زمانی که سیال در یک محفظه مانند قسمت الف شکل بالا قرار داده میشود، فشار اولیه بالای مایع تقریبا برابر با صفر است. دلیل این موضوع این است که هنوز هیچ مولکولی در فاز بخار مجود نیست.
در این حالت، تعدای از مولکولها در سطح این مایع حضور دارند که دارای انرژی جنبشی کافی برای فرار از سطح و تبدیل شدن به بخار هستند. بنابراین فشار محفظه آرام آرام افزایش مییابد.
زمانی که دمای مایع ثابت نگه داشته میشود، نرخ فرار مولکولها از سطح تنها به سطح مقطع وابسته است. تحت این شرایط و به محض اینکه بخار تشکیل شود، بخشی از مولکولهایی که در فاز بخار هستند، با سطح مایع برخورد میکنند و دوباره به فاز مایع باز میگردند. این فرایند در قسمت ب شکل بالا تحت عنوان میعان یا چگالش شناخته میشود.
زمانی که تعداد مولکولهای موجود در فاز بخار افزایش مییابد، تعداد مولکولهایی که به صورت تصادفی بین فاز بخار و سطح مایع برخورد میکنند نیز افزایش پیدا میکنند. در این شرایط، «حالت پایا» (Steady State) ایجاد میشود. حالت پایا بیان میکند که تعداد مولکولهایی که در یک واحد زمان سطح مایع را ترک میکنند به صورت دقیق با تعداد مولکولهایی که از فاز بخار به درون مایع میآیند، برابر هستند.
تحت شرایطی که در بالا توضیح داده شد، فشار در ناحیه بالای سیال دیگر افزایش پیدا نمیکند و به صورت ثابت باقی میماند. در واقع این فشار یکی از ویژگیهای مهم سیال در یک دمای معین است. نمودار نرخ تبخیر و نرخ میعان در سیستمی که در این بخش توضیح داده شد، به شکل زیر بیان میشود. همانطور که در این شکل نشان داده شده، زمانی که حالت تعادل رخ میدهد نرخ تبخیر و میعان با یکدیگر برابر هستند.
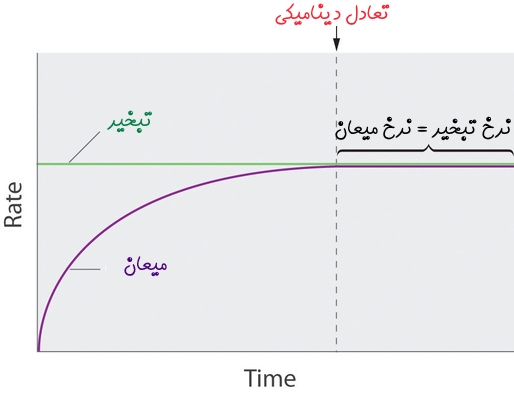
نقطه جوش
زمانی که دمای یک سیال افزایش پیدا میکند. فشار بخار این مایع نیز افزایش مییابد. این افزایش فشار تا زمانی ادامه پیدا میکند که مقدار آن با فشار محیط خارجی برابر شود. فشار خارجی در حالتی که در محفظه ما باز است، «فشار اتمسفری» (Atmospheric Pressure) نیز نامیده میشود.
در شرایط ذکر شده، حبابهای بخار، کم کم درون مایع شکل میگیرند و در این شرایط، مایع شروع به جوشش میکند. دمایی که مایع مورد نظر در فشار یک اتمسفر (1atm) شروع به جوشش میکند را «نقطه جوشش نرمال» (Normal Boiling Point) مایع مینامند. نقطه جوشش نرمال آب دقیقا دمای 100 درجه سانتیگراد است.
شکل زیر، نقطه جوشش نرمال آب در مکانهای مختلف زمین با ارتفاعها و فشارهای مختلف را نشان میدهد. این نقطه، نقطهای را نشان میدهد که منحنی فشار بخار، خط فشار یک اتمسفر را قطع میکند.
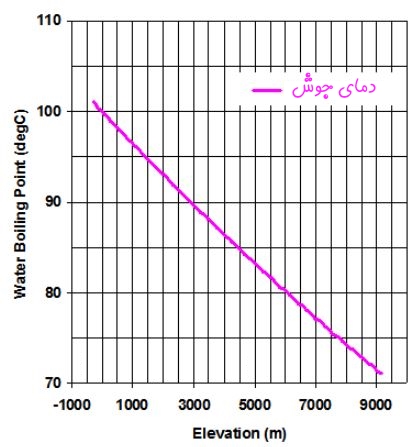
نکته دیگری که باید به آن اشاره کرد این است که نقطه جوشش حقیقی یک مایع به فشار بستگی دارد. این موضوع در شکل بالا نیز نشان داده شده است. در واقع زمانی که فشار بالاتر از یک اتمسفر است، آب در دمایی بالاتر از ۱۰۰ درجه سانتیگراد به جوش میآید.
دلیل بالا رفتن دمای جوش با افزایش فشار، این است که فشار افزایش یافته، مولکولهای بخار بالای سطح را مجبور به برخورد با سطح و میعان میکند. در این حالت، مولکولها نیاز به انرژی جنبشی بالاتری برای فرار از سطح دارند. در واقع فشار بخار مایع برای رسیدن به فشار اتمسفر، باید افزایش بیشتری پیدا کند. توجه شود که وقتی فشار کمتر از یک اتمسفر است، دمای جوش آب نیز کمتر از 100 درجه سانتیگراد است.
این مطلب ابتدا به صورت دقیق به بررسی مفهوم فشار بخار پرداخت و نشان داد که فشار بخار یک مایع، فشار تعادل بخار بالای سطح آن مایع درون یک ظرف در بسته را نشان میدهد. همچنین در ادامه بیان میکروسکوپیکی فشار بخار مورد بررسی قرار گرفت و نشان داده شد که فشار بخار مربوط به زمانی است که نرخ مایع شدن بخار با نرخ تبخیر شدن مایع برابر باشد. در این حالت دیگر مقدار گاز و مایع موجود درون ظرف در بسته تغییری نمیکند. بعد از آن، عوامل موثر در فشار بخار به صورت دقیق مورد بررسی قرار گرفتند. در این بخش دما و نوع مولکولهای تشکیل دهنده مایع، عوامل اصلی تعیین فشار بخار معرفی شدند. سپس شیوه اندازه گیری فشار بخار درون ظروف در بسته با شکل مورد بررسی قرار گرفت و در انتهای مطلب نیز مفهوم نقطه جوش و شیوه تغییرات آن با استفاده از مفهوم فشار بخار و به صورت دقیق نشان داده شد.
فهم دقیق این مطلب کمک بسیار زیادی به درک و بررسی دقیق پدیدههای مختلف موجود در طبیعیت و مکانیک سیالات میکند. برخی از این پدیدهها مانند کاویتاسیون و ضربه قوچ، میتوانند خسارات زیادی را در صنایع مختلف مانند توربوماشینها و صنایع آب ایجاد کنند.
در صورتی که به مباحث ارائه شده، علاقهمند هستید و قصد یادگیری بیشتر در زمینههای مطرح شده در مکانیک سیالات و فیزیک پایه را دارید، آموزشهای زیر به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس مهندسی مکانیک
- مجموعه آموزشهای فیزیک
- مجموعه آموزشهای نرمافزارهای مهندسی مکانیک
- ویسکوزیته (Viscosity) — به زبان ساده
- پیوستگی و بقای جرم در سیالات — از صفر تا صد
- کاویتاسیون (Cavitation) — به زبان ساده
- سیم داغ یا هات وایر (Hot Wire) — از صفر تا صد
- لوله پیتوت (Pitot Tube) — به زبان ساده












یک سوال: در داخل لولهای یک مایع در جریان است، یک طول مشخصی (به اندازه کافی بزرگ) از این لوله را گرم میکنیم به صورتیکه شار ثابتی حرارت به سیال اعمال گردد و سیال تبخیر گردد. اگر فشار درون لوله قبل از ناحیه گرمایش برابر با P1 باشد، فشار بعد از گرم شدن لوله چقدر است؟
درود
یک سوال دارم که خیلی علمی نیست
اگر دو دیگ داشته باشیم و در هر دو به یک میزان آب و دمای آب در هر دو یک میزان باشد ولی سطح مقطع آب در یکی دو برابر باشد ولی خروجی بخار هر دو یک اندازه باشد آیا میزان فشار بخار متفاوت است؟ چه مقدار؟
مرسی
سلام، در بالای انیمیشن تعادل میکروسکوپیکی میان گاز و جامد، باید به جای عبارت تبخیر جامد!، از تصعید جامد استفاده نمود چرا که تبخیر برای مایعات به کار میرود نه جامدات!!
با سلام؛
از ارائه بازخورد شما سپاسگزاریم. متن بازبینی و اصلاح شد.
با تشکر از همراهی شما با مجله فرادرس