آنتالپی چیست؟ – از صفر تا صد

در ترمودینامیک، آنتالپی به معنای انرژی کل سیستم است. این عدد نشان دهنده کمیتی مقداری است که انرژی حرارتی کل یک سیستم را نشان میدهد. برای سیستمی با حجم V و فشار P، آنتالپی برابر با مجموع انرژی درونی سیستم و حاصلضرب فشار در حجم آن است. در بسیاری از تحلیلهای ترمودینامیکی، حاصلضرب فشار p در حجم v ظاهر میشود؛ به این خاطر است که این خاصیت را به صورت مجزا در نظر میگیرند.
معمولا در سیستمهای شیمیایی، بیولوژیکی و یا فیزیکی، آنتالپی را به عنوان خاصیتی میبینند که در فرآیندی فشار ثابت اندازهگیری میشود. در جداول ترمودینامیکی در کنار فشار، دما و دیگر خواص، مقدار آنتالپی نیز ذکر میشود.
در فرآیندی که به صورت فشار ثابت اتفاق میافتد میتوان مجموع انتقال حرارت و کار صورت گرفته با محیط را برابر با تغییرات آنتالپی سیستم دانست.
آنتالپی چه نوع کمیتی است؟
آنتالپی به عنوان کمیتی مقداری شناخته میشود. این جمله به معنی آن است که آنتالپی به مقدار ماده موجود در یک سیستم وابسته است. همانند انرژی، واحد آنتالپی نیز ژول است. به اندازهگیری انرژی در سیستم ترمودینامیکی، آنتالپی گفته میشود. هنگامی که فرایندی در فشار ثابت رخ میدهد، گرمای آزاد شده یا جذب شده در فرایند برابر تغییر آنتالپی است. برای بهدست آوردن آنتالپی، حاصلضرب فشار در حجم را با انرژی درونی سیستم جمع میکنیم
همانطور که در بالا نیز بیان شد، کمیت آنتالپی را با حرف H نمایش میدهند؛ بنابراین تغییرات آنتالپی یک سیستم برابر با H2-H1 است. البته از نظر ریاضیاتی، آنتالپی را میتوان به شکلهای مختلفی نشان داد؛ مرسومترین روش محاسبه آنتالپی به صورت زیر است.
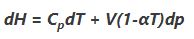
در رابطه بالا Cp ظرفیت حرارتی در فشار ثابت و α ضریب انبساط حرارتی در فشار ثابت است. با توجه به اینکه در گاز ایدهآل حاصلضرب αT برابر با یک است، بنابراین رابطه بالا را میتوان به شکل زیر بازنویسی کرد.
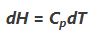
برای درک بهتر مفهوم آنتالپی توجه شما را به مثال زیر جلب میکنیم.
مثال ۱: پیستون بدون اصطکاک
مطابق شکل زیر سیستم سیلندر پیستونی، بدون اصطکاک را فرض کنید که حاوی بخاری با فشار ثابت ۵۰۰ کیلوپاسکال است. با فرض اینکه در حالت اولیه، حجم و دمای سیلندر به ترتیب برابر با ۲m3 و ۵۰۰ کلوین باشد. دمای نهایی سیستم را پس از انتقال انرژی ۳۰۰۰ کیلوژول به آن، به دست آورید.
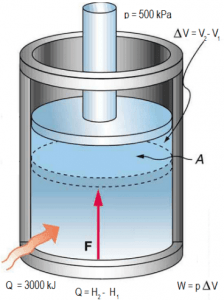
در ابتدا بایستی آنتالپی ویژه سیستم را در فشار ۵۰۰ کیلوپاسکال و دمای ۵۰۰ کلوین تعیین کنید. آنتالپی ویژه در این دما و فشار برابر با بدست میآید [این مقدار از جدول حالتهای ترمودینامیکی مواد خوانده میشود]. از آنجایی که چگالی بخار در این دما و فشار برابر با است، با ضرب کردن آن در حجم V مقدار جرم بخار موجود در سیلندر برابر با ۴.۴ کیلوگرم بدست میآید. با بدست آمدن جرم موجود در سیلندر، میتوان با ضرب کردن آن در آنتالپی ویژه، آنتالپی مطلق سیستم را نیز در این دما و فشار بدست آورد. بنابراین آنتالپی مطلق برابر است با:

با استفاده از معادله Q = H2 − H1 میتوان آنتالپی نهایی سیستم را به شکل زیر بدست آورد.
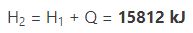
با بدست آمدن آنتالپی بخار پس از انتقال انرژی، به جدول مربوط به خواص ترمودینامیکی مراجعه میکنیم و دمای معادل با این آنتالپی را از جدول میخوانیم. با انجام این کار دمای بخار در حالت نهایی برابر با بدست میآید.
برای چالش بیشتر میتوانیم کار انجام داده شده توسط سیستم را نیز محاسبه کنیم. برای این کار در ابتدا بایستی حجم سیلندر را پس از انتقال انرژی محاسبه کنیم. در بالا گفتیم که بخار موجود در سینلدر را به صورت گاز ایدهآل فرض کردهایم. همچنین با توجه به اینکه فشار سیلندر در حالت اولیه و نهایی با یکدیگر برابر هستند، بنابراین نسبت تغییرات T و V نیز با یکدیگر برابر خواهند بود. در نتیجه میتوان نوشت:

با استفاده از رابطه بالا میتوان حجم ثانویه را به صورت زیر محاسبه کرد.
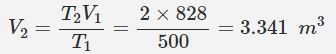
با بدست آمدن حجم ثانویه، میزان افزایش حجم سیلندر را میتوان به صورت زیر بدست آورد.
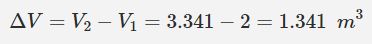
در بالا بیان کردیم که میزان کار انجام شده در فشار ثابت و برای یک گاز، برابر با حاصلضرب تغییرات حجم در فشار گاز است. در نتیجه میزان کار انجام شده در این مثال برابر است با:
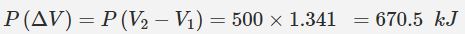
مفهوم آنتالپی ویژه
میتوان با تقسیم مقدار آنتالپی کل یک سیستم به جرم آن، مفهومی تحت عنوان آنتالپی ویژه تعریف کرد. در مبحث آنتروپی نیز مفهومی مشابه را تحت عنوان آنتروپی ویژه تعریف کردیم. در حقیقت این مفهوم، به نسبت خود آنتالپی در ترمودینامیک کاربردی بیشتر دارد.
آنتالپی ویژه h را میتوان بر حسب آنتالپی کل H به صورت زیر تعریف کرد.
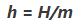
در معادله بالا h ,H ,m به ترتیب جرم، آنتالپی کل و آنتالپی ویژه سیستم هستند. توجه داشته باشید که آنتالپی کمیتی شدتی است که انرژی حرارتی یک سیستم را نشان میدهد. این در حالی است که آنتالپی ویژه یک سیستم برابر با حاصل جمع انرژی داخلی ویژه یک سیستم و حاصلضرب فشار در حجم است. از این رو فرمول عمومی آنتالپی ویژه به شکل زیر است.
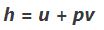
در حالت کلی همچون فشار یا دما، آنتالپی نیز خاصیتی از سیستم است؛ اما تفاوت این خاصیت این است که نمیتوان آن را به صورت مستقیم اندازه گرفت. معمولا آنتالپی یک سیستم را با استفاده از مقداری مرجع تعریف و اندازهگیری میکنند. برای نمونه آنتالپی آب یا بخار را نسبت به آنتالپی آب در دمای ۰.۰۱ درجه و فشار اتمسفر اندازهگیری میکنند. در حقیقت در این دما و فشار، آنتالپی آب را برابر با صفر در نظر میگیرند.
آنتالپی در واکنشهای شیمیایی
از مفاهیم آنتالپی به شکل گستردهای در شیمی نیز مورد استفاده قرار میگیرد. معمولا فرآیندهای شیمیایی را از دیدگاه قانون اول و دوم ترمودینامیک بیان میکنند. در ترمودینامیک به مجموع انرژیهای سیستم به جز پتانسیل و جنبشی، «انرژی درونی» (Internal Energy) گفته میشود. همچنین آنتالپی یک واکنش شیمیایی برابر با تغییر آنتالپی هریک از اجزای تشکیل دهنده فرآیند است.
از آنجایی که اکثر واکنشهای شیمیایی به صورت فشار ثابت رخ میدهند، بنابراین میتوان مفهوم تغییر آنتالپی را در یک واکنش نیز تعریف کرد. معمولا این تغییر را تحت عنوان «آنتالپی واکنش» (Reaction Enthalpy) میشناسند. آنتالپی یک واکنش، بسته به نوع آن میتواند مثبت، منفی و یا صفر باشد. مثبت یا منفی بودن آنتالپی واکنش به گرماده یا گرماگیر بودن آن وابسته است.
آنتالپی تبخیر
در حالت کلی زمانی که در فرآیندی، یک ماده دچار تغییر فاز میشود، بخشی از انرژی سیستم صرف تغییر فاز مذکور میشود. برای نمونه ظرفی را حاوی مقداری آب تصور کنید که در حال حرارت دادن به آن هستیم. بدیهی است که در این فرآیند دمای آب درون ظرف افزایش مییابد. پس از گذشت زمانی، آب موجود در ظرف شروع به بخار شدن میکند. با اندازهگیری متوجه میشویم که دمای آب در این حالت ثابت است.
بنابراین با ثابت بودن دما، این سوال مطرح میشود که انرژی حرارتی اضافه شده به سیستم صرف چه چیزی میشود؟ پاسخ این است که حرارت اضافه شده به آن، صرف تغییر فاز آب میشود. در این حالت انرژی اضافه شده به سیستم را «آنتالپی تبخیر» مینامند. به اینگونه انرژیها «نهان» نیز گفته میشود.
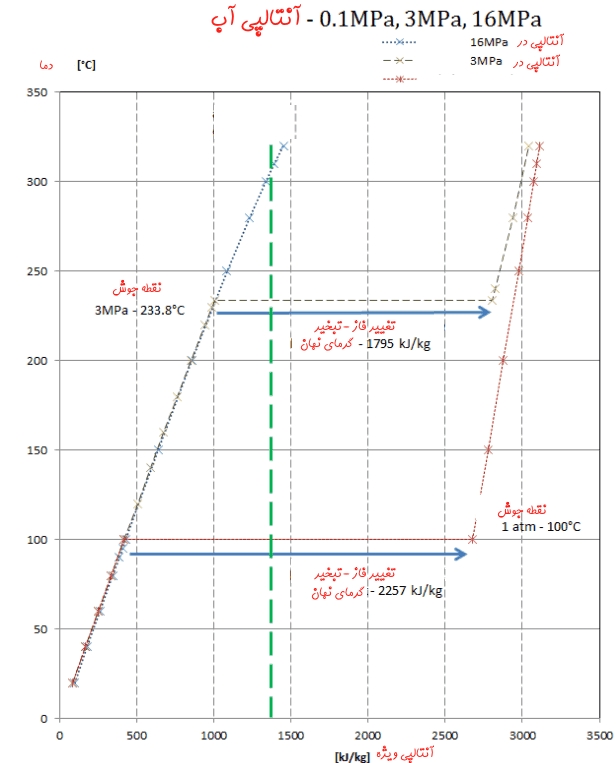
برای نمونه گرمای نهانِ تبخیر آب در فشار ۰.۱ مگاپاسکال برابر با مقدار زیر است:
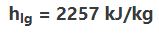
همین مقدار در فشار ۳ مگاپاسکال برابر است با:

گرمای تبخیر عبارت است از میزان گرمایی که به منظور تبخیر شدن کاملِ مایع نیاز است. این مقدار را میتوان با استفاده از فرمول زیر توصیف کرد.
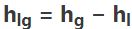
جالب است که با افزایش فشار سیال، مقدار گرمای نهان تبخیر آن کم میشود. نمودار زیر آنتالپی آب در دماها و فشارهای مختلف را نشان میدهد.
برای دیگر تغییر فازها نیز میتوان از این مفهوم استفاده کرد. برای نمونه به میزان انرژی مورد نیاز جهت ذوب کردن یک جرم، گرمای نهان ذوب ماده مذکور گفته میشود که میتوان آن را با استفاده از فرمول زیر توصیف کرد.
امیدواریم مفهوم آنتالپی را به خوبی درک کرده باشید چرا که در آینده و در مطلب حالتهای ترمودینامیکی مواد از آن استفاده خواهیم کرد. البته بهمنظور درک عمیقتر، بایستی مثالهای بیشتری از این مفهوم حل کنید.
در صورت علاقهمندی به مباحث مرتبط در زمینه فیزیک و مهندسی آموزشهای زیر به شما پیشنهاد میشود:






سلاموقت به خیر نوشتید که “در حقیقت اگر انرژیهای جنبشی و پتانسیل یک سیستم را از انرژی کل کم کنیم، مقدار باقی مانده انرژی حرارتی سیستم است که همان آنتالپی نامیده میشود.” و من درست متوجه نشدم ..یعنی در عمل و در دنیای واقعی , آنتالپی همون انرژی جنبشی و پتانسیل نیست و ما از جمع این دوتا صرفا کمک میگیریم تا غیر مستقیم آنتالپی رو حساب کنیم؟
با سلام،
به اندازهگیری انرژی در سیستم ترمودینامیکی، آنتالپی گفته میشود. هنگامی که فرایندی در فشار ثابت رخ میدهد، گرمای آزاد شده یا جذب شده در فرایند برابر تغییر آنتالپی است. برای بهدست آوردن آنتالپی، حاصلضرب فشار در حجم را با انرژی درونی سیستم جمع میکنیم:
H = U + PV
آنتالپی، ویژگی شبیه انرژي یا تابع حالت است و به توابع حالت مانند انرژی داخلی، دما و فشار وابسته است. برای درک بهتر مفهوم آنتلپی، تعریف این کمیت در متن نیز تغییر داده شد.
با تشکر از همراهی شما با مجله فرادرس
سلام
ممنونم از آموزشتون
در مثال 1 متوجه نشدم چطور آنتالپی ویژه محاسبه شد ، لینک جدولی که نام بردید رو میفرستید لطفا؟
سلام و روز شما بهخیر؛
اطلاعات مربوط به آنتالپی از جدولی به نام «جدول بخار» (Steam Table) استخراج شده است. در این جداول اطلاعات مهم و پایهای از آب و بخار آب مانند فشار، دما، آنتالپی، چگالی و ظرفیت گرمایی آورده شده است. این جدول را میتوانید با جستجو در منابع شیمی بیابید.
خوشحالیم که با مجله فرادرس همراه هستید.
در جدول خبری از نمودار عددی پاسکال وجود ندارد.دوم اینکه فقط از آب مثال زده میشود از عناصر دیگر هم مثال بزنید.
باسلام ممنون … در مورد پایداری انرژی در ترمودینامیک هم توضیح بدید
عالی بود کاش آنتالپی پیوندم یه مختصر توضیح میدادین
سلام، وقت شما بخیر؛
در این رابطه میتوانید این مطلب از مجله فرادرس با عنوان «انرژی پیوند» را مطالعه کنید.