محاسبه pH در شیمی — فرمول محاسبه پی اچ + مثال

محاسبه pH از پرکاربردترین مباحث شیمی است که در مقاطع گوناگون با آن سر و کار داریم. رایجترین فرمول محاسبه پیاچ محلولهای شیمیایی $$pH = -log_{{10}}[H_3O^+]$$ است. مقادیر $$pH$$، معمولا در بازه ۰ تا ۱۴ قرار میگیرند. محلولهایی با $$pH$$ کمتر از ۷ اسیدی و بالاتر از ۷ بازی نامیده میشوند. با خواندن این مطلب با روشها و مثالهای گوناگون محاسبه pH و کاربردهای آن آشنا خواهید شد.
محاسبه pH
برای محاسبه pH و درک مفهوم آن در مطالب و پرسشهایی با شرایط مختلف باید با مفاهیم زیر آشنا شوید.
- pH و pOH
- یون هیدرونیوم $$(H_3O^+)$$ و یون هیدروکسید $$(OH^-)$$
- واکنش اسید و باز
pH چیست؟
در ابتدا بهتر است بدانیم که pH چیست و چه چیزی را محاسبه میکند. واژه pH به معنای «پتانسیل یون هیدروژن» (Potential of Hydrogen Ion) است. غلظت یون هیدرونیوم $$(H_3O^+)$$ در محلول برابر با مقدار $$pH$$ آن محلول است. محلولی که غلظت یون هیدرونیم در آن بالا باشد محلول اسیدی و محلولی که غلظت کمی از یون هیدرونیوم داشته باشد محلول بازی یا قلیایی است. یون هیدرونیوم به صورت کوتاه به شکل یون هیدروژن $$(H^+)$$ نیز نوشته میشود.
اندازه pH
اندازه $$pH$$ بهطور معمول در بازه ۰ تا ۱۴ قرار میگیرد. هرچند برخی از محلولها، پیاچی خارج این بازه نیز دارند. دلیل انتخاب بازه قراردادی ۰ تا ۱۴ به این علت است که یون هیدروژن در محلولهای آبی غلظتی بین $$1M$$ تا $$10^{-14}M$$ دارد درحالیکه در برخی محلولها غلظت این یون میتواند بیشتر یا کمتر از این بازه باشد. عدد کمتر به معنی اسیدیتر بودن محلول است و هرچه این اندازه به ۱۴ نزدیکتر باشد، نشاندهنده محلولی با ویژگی قلیایی بالاتر است.
| اسیدی | خنثی | بازی |
| کمتر از ۷ | ۷ | بیشتر از ۷ |
آب پرتقال با $$pH=۳$$ مثالی از محلولی اسیدی است. در مقابل، مایع سفیدهکننده که $$pH=۱۲$$ دارد محلولی به شدت قلیایی است. هرچه محلول، عددی نزدیکتر به ۷ داشته باشد خاصیت اسیدی یا بازی کمتری نیز دارد. آب خالص با $$pH=۷$$ محلولی خنثی است.
باید توجه داشته باشید که تفاوت هر سطح در اندازه $$pH$$، ده برابر است. برای مثال، قدرت اسیدی محلولی که $$pH=۳$$ دارد نسبت به محلولی با $$pH=۴$$ ده برابر بیشتر است همچنین همین محلول نسبت به محلولی با $$pH=۵$$ صد برابر قدرت اسیدی بیشتری دارد. به طور قراردادی اندازه pH در بازه ۰ تا ۱۴ قرار میگیرد.

اندازه گیری pH چه کاربردی دارد؟
اندازهگیری pH در زندگی روزمره کاربردهای فراوان و چشمگیری دارد که به طور مستقیم روی زندگی و محیط زیست میتواند تاثیر بگذارد. اندازهگیری pH آب و خاک از پرکاربردترین موارد استفاده آن است.
کیفیت آب
از رایجترین کاربردهای اندازهگیری $$pH$$ برای سنجش و کنترل کیفیت آب است. مصرف آب با $$pH$$ بسیار بالا و بسیار پایین میتواند زیانآور باشد. آب با $$pH$$ بالا طعمی تلخ دارد و باعث ایجاد رسوب در لولهها و وسایل میشود، همچنین اثر گندزدایی کلر را کاهش میدهد. از طرفی آب با $$pH$$ پایین خوردگی یا حل شدن فلزات را در پیدارد. تغییر $$pH$$ میتواند به دلیل آلودگی آب باشد. برای نمونه آبی که از معادن فلزی خارج میشود $$pH$$ نزدیک به ۲ دارد که 100000 برابر اسیدیتر از آب معمولی است.
$$pH$$ آب باران معمولی حدود 5٫6 است که به دلیل انحلالپذیری گاز دیاکسید کربنِ جو، $$pH$$ آن کاهش پیدا میکند. باران اسیدی میتواند بر محیط زیست تأثیر منفی بگذارد.

pH خاک
بهطور طبیعی خاک میتواند اسیدی یا قلیایی باشد که با اندازهگیری، مقدار $$pH$$ آن مشخص میشود. در حقیقت، $$pH$$ خاک معیاری برای سنجش اسیدی یا قلیایی بودن خاک است. $$pH$$ مناسب از پارامترهای مهم برای رشد سالم گیاهان است که شیوههای مختلف مدیریت خاک و همچنین روشهای کشاورزی میتواند بهطور قابل توجهی آنرا تغییر دهند.
بیشتر خاکها دارای مقادیر $$pH$$ بین ۳٫۵ تا ۱۰ هستند. در مناطق پرباران، $$pH$$ طبیعی خاک معمولاً بین ۵ تا ۷ است در حالی که اندازه $$pH$$ خاک در مناطق خشک بین ۶٫۵ تا ۹ قرار میگیرد. بر اساس اندازه $$pH$$، خاک به صورت زیر طبقهبندی میشود:
- قلیایی: بیش از ۷٫۵
- خنثی: بین ۶٫۵ تا ۷٫۵
- اسیدی: کمتر از ۶٫۵
- به شدت اسیدی: کمتر از ۵٫۵
«خاکهای سولفاته اسیدی» (Acid Sulfate Soils) میتوانند مقادیر $$pH$$ به شدت اسیدی (کمتر از ۴) داشته باشند. خاکهای سولفاته اسیدی اشباع شده با آب، تقریباً بدون اکسیژن و حاوی بلورهای سولفید آهن ($$FeS_2$$) هستند. این نوع خاک تا زمانی که تخریب نشود بیضرر است اما در صورت تخریب و آسیب دیدن در تماس با اکسیژن قرار میگیرند.
واکنش بین پیریت موجود در خاک و اکسیژن موجب اکسید شدن آن میشود. در این فرایند، پیریت به سولفوریک اسید تبدیل میشود که میتواند به محیط زیست، ساختمانها، جادهها و سایر سازهها آسیب جدی وارد کند. سولفوریک اسید همچنین با مواد معدنی موجود در خاک واکنش میدهد و فلزاتی مانند آلومینیوم و آهن را آزاد میکند که هنگام بارندگی با شسته شدن همراه اسید، به آب و محیط اطراف وارد میشوند.
$$pH$$ خاک بر مقدار مواد مغذی در دسترس گیاهان نیز تأثیر میگذارد. در شرایط غیرطبیعی خاک (خارج از $$pH$$ معمول)، برخی از مواد مغذی در دسترس گیاه قرار نمیگیرند و برخی دیگر بیش از حد به گیاه منتقل میشوند. به همین دلیل، شناسایی بهموقع مشکلات $$pH$$ خاک اهمیت بالایی در سلامت غذایی و صنعت کشاورزی دارد.

آنالیز ترمیم زخم
فرایند بهبود و درمان زخم شامل ترمیم و بازسازی بافت است که به عوامل مختلفی بستگی دارد. $$pH$$ و دما از جمله نشانگرهایی به شمار میآیند که برای ارزیابی وضعیت بهبود زخم استفاده میشوند. به همین جهت پانسمانهایی با «حسگرهای پوشیدنی» (Wearable Sensors) ساخته شدهاند که به طور مرتب این دو عامل را آنالیز میکند. تشخیص سریع تغییرات این دو عامل، راه مفیدی برای بررسی و رسیدگی وضعیت زخم است.
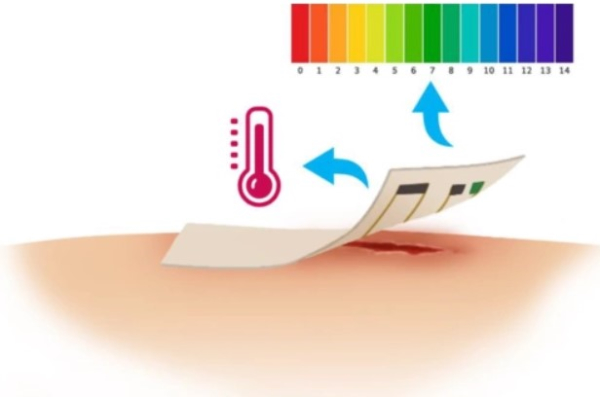
آزمایش گاز خون شریانی
«آزمایش گاز خون شریانی» (Arterial Blood Gas Test | ABG)، برای اندازهگیری سطح اکسیژن و دیاکسید کربن خون استفاده میشود. این آزمایش همچین تعادل $$pH$$ بدن را بررسی میکند که به عنوان مقدار $$pH$$ خون نیز شناخته می شود.
در این آزمایش اندازه $$pH$$ از رابطه زیر بهدست میآید
$$pH=6.1+log(\frac{[HCO_3^-]}{0.03times PaCO_2})$$
- ۶٫۱: ثابت تفکیک اسیدی $$(pKa)$$ کربنیک اسید است.
- $$PaCO_2$$؛ فشار جزئی دیاکسید کربن در خون شریانی بر حسب «میلیمتر جیوه» $$(mmHg)$$ است.
اندازه pH مواد مختلف
اندازهگیری $$pH$$ در زندگی موجودات زنده از جمله انسان، اهمیت بالایی دارد و در موارد بسیاری میتواند به شناسایی بیماری و برخی مشکلات زیستی کمک کند. در زیر، $$pH$$ بخشهای مختلف بدن و برخی از مواد رایج در زندگی روزمره فهرست شدهاند. مقدارها در دمای ۲۵ درجه سلسیوس و شرایط طبیعی اندازهگیری شدهاند.
بدن انسان
همانطور که در جدول زیر میبینید، $$pH$$ مایعات بدن بسته به مکان و عملکردشان بسیار متفاوت است. $$pH$$ پایین شیره معده، هضم را آسان میکند درحالیکه $$pH$$ بالای خون برای انتقال اکسیژن لازم است.
| قسمت | $$pH$$ |
| اسید معده | 1٫5 تا 3٫5 |
| لیزوزوم | 4٫5 |
| پوست | 4٫7 |
| سلولهای کرومافین | 5٫5 |
| ادرار | 6 |
| سیتوزول | 7٫2 |
| خون | 7٫34 تا 7٫45 |
| مایع مغزی-نخاعی | 7٫5 |
| ماتریکس میتوکندری | 7٫5 |
| ترشحات لوزالمعده | 8٫1 |
«همایستایی اسید-باز» (Acid–Base Homeostasis) فرایندی است که به حفظ شرایط پایدار و ثبات $$pH$$ بدن کمک میکند. «اسیدوز» (Acidosis) و «آلکالوز» (Alkalosis) از جمله اختلالاتی هستند که در صورت نبود شرایط پایدار $$pH$$ خون به وجود می آیند. $$pH$$ خون در گستره محلولهای قلیایی و برابر با 7٫36 است.
پلاک دندان که تجمعی از باکتریهاست، به صورت موضعی با ایجاد محیطی اسیدی موجب پوسیدگی دندان میشود. همچنین آنزیمها که کاتالیزورهای بیولوژیکی در بدن هستند محدوده $$pH$$ بهینهای دارند که خارج از آن غیرفعال میشوند یا از بین میروند. در شکل $$pH$$ اجزا مختلف دستگاه گوارش انسان نمایش داده شده است.
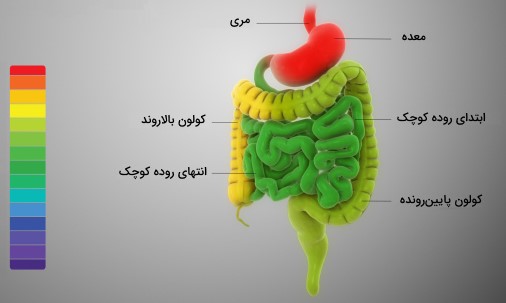
جدول pH مواد مختلف
| ماده | $$pH$$ |
| هیدروکلریک اسید | 3٫01 |
| سرکه | ۲ تا ۳ |
| هیدروفلوئوریک اسید | 3٫27 |
| جوهر نمک | نام دیگر هیدروکلریک اسید است. |
| نوشابه | 2٫5 تا 3٫5 |
| شامپو | 4 تا ۶ |
| چای سیاه | 4٫9 تا 5٫5 |
| گوجه فرنگی | 5٫5 تا 7٫5 |
| شیر | 6٫7 تا 6٫9 |
| چای سبز | 7 تا 10 |
| مایع ظرفشویی | 7 تا ۸ |
| خاک | 3٫5 تا 10 |
| شربت معده | 8٫0 تا 10٫5 |
| جوش شیرین | 8٫3 |
| ضد یخ | 10 |
| سفید کننده | ۱۲ |
پی اچ متر
در آزمایشگاه، برای اندازهگیری $$pH$$ محلولها از دستگاهی به نام «پیاچ سنج یا پیاچ متر» (pH Meter) استفاده میشود. در تعریفی ساده از سازوکار پیاچ سنج میتوان گفت که «پروب» (probe) این دستگاه که از جنس شیشه است دو حسگر الکترود دارد که ولتاژ را اندازه میگیرند. یکی از الکترودها در محلول مرجع قرار گرفته و $$pH$$ آن ثابت است و الکترود دیگر $$pH$$ محلول را اندازهگیری میکند. تفاوت ولتاژ بین دو الکترود با ولتمتر بهدست میآید که این اختلاف به $$pH$$ تبدیل میشود.

شناساگر pH
به جز روشهای محاسباتی، برای تشخیص محیطهای اسید و بازی و اندازه تقریبی $$pH$$ از شناساگرها استفاده میکنند. استفاده از شناساگرها روشی سریع و ارزان است چراکه شناساگرها نیازی به کالیبراسیون و نگهداری ندارند.
شناساگر $$pH$$، ترکیبی هالوکرومیک است که با افزوده شدن به محلول باعث تغییر رنگ آن میشود و با توجه به نوعِ رنگ ایجاد شده میتوان اسیدی یا بازی بودن محلول را تشخیص داد. در واقع با استفاده از شناساگرهای $$pH$$ میتوان به حضور یونهای هیدرونیوم یا هیدروژن در محلول پی برد.
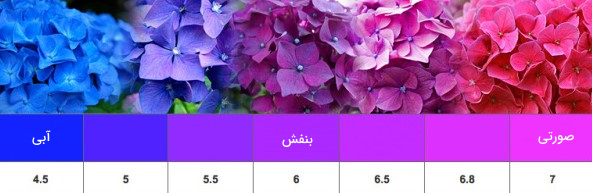
برخی از گیاهان، حاوی ترکیبهای شناساگر هستند. آنتوسیانین از جمله ترکیبهای شناساگر است که در کلم قرمز یافت میشود. گل ادریسی در خاک اسیدی به رنگ آبی و در خاکهای قلیایی به رنگ صورتی یا بنفش تغییر رنگ میدهد. زردچوبه از دیگر شناساگرهای گیاهی است که در تماس با محلولهای اسیدی به رنگ زرد و در محیطهای قلیایی به رنگ قهوهای مایل به قرمز در میآید.
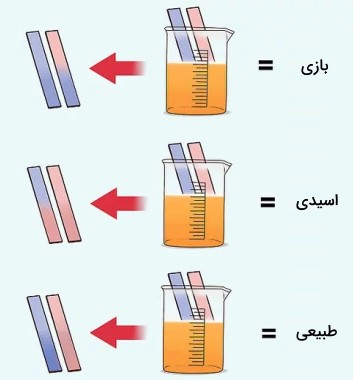
کاغذ تورنسل
اندازهگیری $$pH$$ با کاغذ تورنسل («تورنسل» (Tournesol) واژهای فرانسوی است که بهصورت تورنِسُل تلفظ میشود.) یا «لیتموس» ( Litmus) از آشناترین ابزارهای آزمایشگاه شیمی در دوران مدرسه است. کاغذهای تورنسل به دو رنگ آبی و قرمز هستند که کاغذهای آبی در محیطهای اسیدی به رنگ قرمز و کاغذهای قرمز در محیطهای بازی به رنگ آبی تغییر رنگ میدهند. با استفاده از کاغذ تورنسل بهطور تقریبی میتوان مشخص کرد که محلول اسیدی یا بازی است.
شناساگر یونیورسال
«شناساگر یونیورسال» (Universal Indicator)، حاوی چند محلول مختلف است و بازه گستردهتری از $$pH$$ را شامل میشود. برخی از رایجترین ترکیبهای تشکیلدهنده شناساگر یونیورسال به همراه رنگ آنها در جدول زیر آمده است.
| شناساگر | رنگ در $$pH$$ پایین | رنگ در $$pH$$ بالا |
|---|---|---|
| تیمول بلو (یونش اول) | قرمز | زرد |
| متیل اورانژ | قرمز | زرد |
| متیل رد | قرمز | زرد |
| برموتیمول آبی | زرد | آبی |
| تیمول بلو (یونش دوم) | زرد | آبی |
| فنولفتالئین | بیرنگ | بنفش |
در شناساگر یونیورسال محدوده رنگ معمولا در بازهای زیر قرار میگیرند:
- اسیدی: قرمز تا زرد
- خنثی: سبز
- بازی: آبی تا بنفش

محاسبه pH آنلاین
برخی از وبسایتها بهطور آنلاین محاسبه pH را انجام میدهند. در جدول زیر تعدادی از این وبسایتها فهرست شدهاند که میتوانید برای انجام سریع و دقیق محاسبه pH از امکانات آنها استفاده کنید.
| توضیح | وبسایت |
| در بخش محاسبه pH امکان انتخاب غلظتهای متفاوتی برای به دست آوردن $$pH$$ اسید و باز قرار دارد. | omnicalculator (+) |
| میتوانید با وارد کردن غلظت و حجم اولیه چند محلول اندازه $$pH$$ آنرا محاسبه کنید. | lattelog (+) |
| این امکان را به شما می دهد تا مقادیر $$pH$$ و $$pOH$$ و دیگر پارمترهای چون ثابت تفکیک اسیدی را پس از محاسبه مشاهده کنید. | wolframalpha (+) |
| طیف وسیعی از اسید و بازها را شامل می شود و امکان محاسبه pH چند مخلوط را به شما میدهد. | aqion (+) |
| میتوانید علاوه بر اسید و بازهای قوی $$pH$$ اسید و بازهای ضعیف را هم محاسبه کنید. | planetcalc (+) |
همچنین اپلیکیشن اندرویدی (+) Chemistry Calculator امکان محاسبه بسیاری معادلات پرکاربرد شیمی از جمله محاسبه pH را به شما میدهد.
محاسبه pH با لگاریتم
لگاریتم در شیمی برای سادهسازی اعداد غیرقابل فهم و مقایسه راحتتر آنها استفاده میشود. در محاسبات شیمی مقدار $$pA$$ برای هر متغییری مانند A به صورت زیر قابل تعریف است.
$$pA=-log[A]$$
اندازه $$pH$$ با لگاریتم منفی محاسبه میشود. معادله $$pH$$ برای بهدست آوردن اندازه غلظت یون هیدرونیوم در محلول به صورت زیر نوشته میشود:
$$pH = -log_{{10}}[H_3O^+]$$
گاهی اوقات به دلیل استفاده از یون هیدروژن $$(H^+)$$ بهجای یون هیدرونیوم $$(H_3O^+)$$ معادله را به شکل زیر نیز مینویسند که در هر دو صورت، نتیجه یکسان خواهد بود.
$$pH = -log_{{10}}[H^+]$$
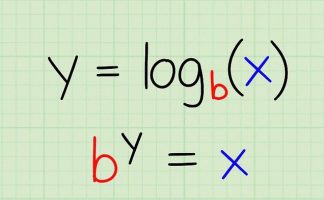
در معادله $$pH$$ غلظت یون هیدروژن بر اساس مولار بیان میشود. غلظت مولی یا مولار تعداد مولهای محلول در هر لیتر است که واحد آن بهصورت مول بر لیتر $$\frac{mol}{L}$$ یا مولار $$(M)$$ بیان میشود. در شیمی از کروشه یا براکت برای بیان غلظت استفاده میکنند و معادله $$pH$$ بهصورت زیر خوانده میشود:
$$pH$$ برابر است با منفی لگاریتم غلظت یون هیدرونیوم.
در مثالی ساده، روش محاسبه pH با استفاده از رابطه بالا در ادامه آمده است.
مثال: اگر غلظت یون هیدرونیوم برابر با $$۱۰٫۵times۱۰^{{-۵}}$$ مولار باشد خواهیم داشت:
$$pH = -log_{{10}}[H_3O^+]$$
$$[H_3O^+]=10.5times10^{{-5}}M$$
$$pH = -log_{{10}}[10.5times10^{{-5}}]$$
$$pH = 3.97$$
محاسبه غلظت با استفاده از pH
با داشتن $$pH$$ محلول و استفاده از رابطه زیر، غلظت یون هیدرونیوم محاسبه میشود.
$$[H_3O^+]=10^{{-pH}}$$
مثال: اگر $$pH$$ محلولی برابر با $$۵٫۶$$ باشد غلظت یون هیدرونیوم به صورت زیر بهدست میآید:
$$pH = 5.6$$
$$[H_3O^+]=10^{{-5.6}}$$
مانند معادله $$pH$$ برای $$pOH$$ نیز معادله زیر تعریف شده است:
$$pOH = -log_{{10}}[H_3O^+]$$
محاسبه pH با استفاده از اکتیویته
استفاده از غلظت یون هیدروژن برای به دست آوردن $$pH$$ محلول دقت کافی را ندارد و رابطه دقیقتر برای محاسبه pH استفاده از اکتیویته یا فعالیت یون هیدروژن است که از رابطه زیر بهدست میآید.
$$pH=-log(alpha_{{H^+}})$$
نکته ۱: به جز در محلولهای رقیق، $$pH$$ اندازهگیری شده معمولاً با آنچه در رابطه $$pH = -log[H^+]$$ محاسبه میشود یکسان نیست. دلیل این تفاوت برابر نبودن غلظت مولاریته یون هیدروژن از نظر عددی با مقدار اکتیویته آن است.
نکته ۲: در مطالبی که از غلظت، برای بیان بحثها استفاده میشود تنها نشاندهنده تقریبی از فرایندهایِ شیمیایی است که در فاز محلول رخ میدهد.
رابطه pH و pOH
محاسبه pH و pOH به ترتیب با استفاده از غلظت یون هیدروژن و یون هیدروکسید انجام میشود. رابطه pH و pOH با استفاده از معادله زیر بهدست میآید. لازم به ذکر است که این معادله از خودیونش آب حاصل میشود.
$$pOH+pH = ۱۴$$
این رابطه زمانی کاربرد دارد که از ما محاسبه pH محلولی قلیایی را بخواهند. همچنین، هر زمان که اطلاعات کافی برای محاسبه یکی را نداشته باشیم میتوانیم از غلظت دیگری با توجه به رابطه بالا برای محاسبه آن کمک میگیریم.
| غلظت $$H^+$$ | غلظت $$OH^-$$ | |
| اسید | زیاد | کم |
| باز | کم | زیاد |
| خنثی | برابر با $$[OH^-]$$ | برابر با $$[H^+]$$ |
محاسبه pH اسید و باز قوی
با استفاده از یونش اسید در آب، قدرت نسبی آن اندازهگیری میشود. به دلیل تفکیک کامل اسید قوی در آب، غلظت یونهای هیدرونیوم تقریبا با غلظت اسید برابر است و میتوان از معادله زیر برای محاسبه pH استفاده کرد. در واکنشِ اسیدهای قوی با آب، میتوان غلظت یونهای هیدرونیوم آب را نادیده گرفت.
$$pOH= ۱۴-pH$$
$$pH = -log[H_3O^+]$$
به همین ترتیب برای باز قوی نیز غلظت یونهای هیدروکسید تقریبا با غلظت باز برابر است و $$pOH$$ از معادله زیر محاسبه میشود.
$$pOH = -log[OH^-]$$

مثال محاسبه pH اسید قوی
$$pH$$ محلول ۰٫۰۱ مولار هیدروکلریک اسید را محاسبه کنید.
پاسخ: هیدروکلریک اسید $$(HCl)$$ اسیدی قوی است که در محلولهای آبی به طور کامل تفکیک میشود. $$pH$$ محلول ۰٫۰۱ مولار آن برابر است با:
$$pH = -log(0.01)$$
$$pH = 2$$
مثال محاسبه pH باز قوی
$$pH$$ محلول ۰٫۰۱ مولار سدیم هیدروکسید را به دست آورید.
پاسخ: سدیم هیدروکسید $$(NaOH)$$ بازی قوی است و در محلولهای آبی به شکل یونهای هیدروکسید کاملا تفکیک میشود. $$pH$$ محلول ۰٫۰۱ مولار برابر است با:
$$pOH = -log(0.01)$$
$$pOH = 2$$
$$pH= 14-pOH$$
$$pH = 12$$
نکته: در غلظتهای بسیار پایین اسید و بازهای قوی باید خودیونش آب نیز در محاسبات در نظر گرفته شود. برای مثال فرض کنید غلظتی از هیدروکلریک اسید برابر با $$۵times۱۰^{-۸}$$ داریم. با محاسبه pH مقدار آن 7٫3 بهدست میآید که با توجه به اسیدی بودن محلول کاملا اشتباه است و باید $$pH$$ کمتر از 7 باشد. اما اگر سیستم را مخلوطی از هیدروکلریک اسید و آب به عنوان مادهای آمفوتر در نظر بگیریم آنگاه $$pH=۶٫۸۹$$ بهدست میآید.
محاسبه pH اسید ضعیف
محاسبه pH اسید ضعیف نیز به سادگی مانند بهدست آوردن $$pH$$ اسید قوی است با این تفاوت که اسید ضعیف بهطور کامل تفکیک نمیشود. برای محاسبه pH همچنان از همان معادله اصلی $$(pH = -log[H^+])$$ کمک میگیریم.
پیش از استفاده از معادله اصلی در ابتدا باید غلظت یون هیدروژن $$([H^+])$$ محاسبه شود. برای بهدست آوردن غلظت یون هیدروژن باید از ثابت تفکیک اسیدی $$(Ka)$$ استفاده کنیم. محاسبه غلظت یون هیدروژن به دو روش انجام میشود:
- استفاده از معادله درجه دو
- استفاده از تقریب
انتخاب روش به نوع استفاده آن بستگی دارد. معمولا برای حل مسائل و بیان دقیق مقدار$$pH$$ از روش اول و در آزمایشگاه برای تخمین سریع از روش دوم استفاده میشود.
روش اول: استفاده از معادله درجه دو
محاسبه غلظت یون هیدروژن طی مراحل زیر انجام میشود.
مرحله اول: نوشتن واکنش
همانطور که بالاتر گفته شد برای برای بهدست آوردن غلظت یون هیدروژن باید از ثابت تفکیک اسیدی $$(Ka)$$ استفاده کنیم. تفکیک اسید ضعیف یا اسیدِ مزدوج یک باز ضعیف بهصورت زیر است:
$$HBrightleftharpoons H^++B^-$$
مرحله دوم: نوشتن معادله درجه دو با استفاده ثابت تفکیک
با توجه به واکنش بالا ثابت تفکیک اسیدی بهصورت زیر تعریف و مقدار آن بهصورت تجربی مشخص میشود.
$$K_a=\frac{[H][B]}{[HB]}$$
- $$[H^+]$$: غلظت یون هیدروژن
- $$[B^+]$$: غلظت یونهای باز مزدوج
- $$[HB]$$: غلظت باقیمانده مولکولهای اسید تفکیک نشده
برای بهدست آوردن معادله درجه دو و درک راحتتر موضوع، غلظتِ یون هیدروژن را $$x$$ در نظر میگیریم و با توجه به نسب مولی تفکیک که $$[H^+]=[B^+]$$ است، با بازنویسی معادله ثابت تفکیک داریم:
$$K_a=\frac{x.x}{C-x}$$
- $$x$$: غلظت یون هیدروژن
- $$C$$: غلظت اولیه اسید پیش از تفکیک
- $$C-x$$: غلظت باقیمانده مولکولهای اسید تفکیک نشده
نکته ۱: واکنش در حال تعادل است و $$HB$$ به شکل یونهای $$H^+$$ و $$B^+$$ تفکیک شده است. پس باید توجه داشته باشید که $$C-x$$ مقداری از غلظت اولیه اسید است که همچنان تفکیک نشده است.
نکته ۲: هنگام نوشتن معادله ثابت تعادل، باید به نسبتهای مولی یونهای تفکیک شده توجه کنید. در اینجا نسبت مولی ۱:۱ است که معادله ثابت تعادل برای آن برابر است با:
$$K_atimes(C-x)=x^2$$
و با جابجایی ساده، معادله زیر را خواهیم داشت که یک معادله درجه دو $$(ax^2-bx++c)$$ است.
$$x^2-K_ax+K_aC$$
مرحله سوم: محاسبه غلظت یون هیدروژن
اکنون میتوانیم با استفاده از روابط معادله درجه دو مقدار $$x$$ که همان غلظت یون هیدروژن است را از فرمول زیر بهدست آوریم.
$$x=\frac{[-k_a+(k_a^2+4Ck_a)^{{1٫2}}]}{2}$$
نکته: باید توجه داشته باشید که در معادله درجه دو برای $$x$$ دو جواب وجود دارد. از آنجایی که در این مبحث، $$x$$ نشاندهنده غلظت است، مقدار آن نمیتواند منفی باشد.
مرحله چهارم: محاسبه pH
در پایان با استفاده از معادله $$pH = -log[H^+]$$ مقدار $$pH$$ را محاسبه میکنیم.
محاسبه pH اسید ضعیف با استفاده از معادله درجه دو
مثال: اندازه $$pH$$ محلول بنزوئیک اسید 0٫01 مولار چقدر است؟ مقدار $$pK_a= ۴٫۱۹$$ است.
پاسخ
برای محاسبه pH مراحل زیر را دنبال میکنیم.
مرحله یک: بنزوئیک اسید ($$C_6H_5CO_2H$$) در آب بهصورت زیر تفکیک میشود.
$$C_6H_5COOH \rightleftharpoons H^++C_6H_5COO^-$$
مرحله دو: با توجه به واکنش بالا معادله ثابت تعادل برابر است با:
$$K_a=\frac{[H^+][C_6H_5COO^-]}{[C_6H_5CO_2H]}$$
به ازای هر یون هیدروژن یک یون $$C_6H_5COO^-$$ تولید میشود و نسبت ۱:۱ است:
$$x=[H^+]=[C_6H_5COO^-]$$
$$C-x=[C_6H_5CO_2H]$$
پس خواهیم داشت:
$$K_a=\frac{x.x}{C-x}$$
و با بازنویسی، رابطه تبدیل به معادله درجه دو $$(x^2-K_ax+K_aC)$$ میشود.
مرحله سوم: اکنون با استفاده از دادههای سوال و جایگذاری در معادله زیر میتوانیم مقدار غلظت هیدروژن را بهدست آوریم.
$$x=\frac{[-k_a+(k_a^2+4Ck_a)^{{1٫2}}]}{2}$$
- $$pK_a$$ = ۴٫۱۹
- $$C$$ = 0٫01 مولار
ابتدا $$K_a$$ را از $$pK_a$$ بهدست میآوریم.
$$K_a=10^{-4.19}=6.5times10^{-5}$$
سپس خواهیم داشت:
$$x=\frac{[6.5times10^{-5}+((6.5times10^{-5})^2+4(0.01)(6.5times10^{-5}))^{{1٫2}}]}{2}$$
$$x=\frac{6.5times10^{-5}+1.6times10^{-3}}{2}$$
$$x=\frac{1.5times10^{-3}}{2}$$
$$x=7.7times10^{-4}$$
مرحله چهارم: با توجه به مقدار بهدست آمده و معادله $$pH = -log[H^+]$$ خواهیم داشت:
$$x=[H^+]=7.7times10^{-4}$$
$$pH = -log (7.7times10^{-4})$$
$$pH =3.11$$
روش دوم: استفاده از تقریب
در سوال بنزوئیک اسید به عنوان اسیدی ضعیف، غلظت اولیه $$۱۰^{-۲}$$ مولار بود و میزان تفکیک یون هیدروژن $$[H^+]=۷٫۷times۱۰^{-۴}$$ محاسبه شد. این بدان معناست که غلظت اولیه اسید ۷۷۰ برابر قویتر از غلظت یون هیدروژن تفکیک شده است.
در چنین مواردی مقدار $$C-x$$ به $$C$$ بسیار نزدیک است و با جایگذاری در معادله $$K_a$$ داریم:
$$C-xcong C$$
$$K_a=x^²/(C-x)$$
$$K_a=x^²/C$$
$$x^²=K_atimes C$$
با قرار دادن مقادیر خواهیم داشت:
$$x^²=(6.5times10^{-5})\times (10^{-2})$$
$$x^²=6.5times10^{-7}$$
$$x=[H^+]=8.06times10^{-4}$$
و در نهایت محاسبه pH با استفاده از $$pH = -log[H^+]$$ داریم:
$$pH = -log (8.06times10^{-8})$$
$$pH =3.09$$
همانطور که مشاهده میکنید تفاوت مقدار به دستآمده برای $$pH$$ تنها 0٫02 است. از چنین اختلاف اندکی برای کارهای آزمایشگاهی میتوان چشمپوشی کرد و تقریب روش مناسبتری در آزمایشگاه برای محاسبه pH اسیدهای ضعیف است.
محاسبه pH محلول بافر
در تعریفی ساده، بافر محلولی است که در برابر تغییرات $$pH$$ مقاومت میکند و $$pH$$ آن تغییر نمیکند. بافر از ترکیب اسید ضعیف با بازِ مزدوجش یا باز ضعیف با اسیدِ مزدوجش ساخته میشود. برای محاسبه pH بافر از معادله معروف زیر استفاده میکنند که به معادله هندرسون-هاسلبالخ شهرت دارد.
$$HArightleftharpoons H^++A^-$$
$$pH = pKa + \log(\frac{[A^-]}{[HA]})$$
- $$Ka$$: ثابت تعادل تفکیک اسیدی
- $$[A^-]$$: غلظت باز مزدوج
- $$[HA]$$: غلظت اسید
به طور مشابه برای بازها معادله زیر به دست میآید.
$$pH=14-(pKb + \log(\frac{[B^+]}{[BOH]}))$$
دو عامل بر $$pH$$ بافر تاثیرگذارند.
- ثابت تعادل تفکیک اسید ضعیف $$(Ka)$$
- نسبت غلظت باز مزدوج بر اسید ضعیف $$(\frac{[A^-]}{[HA]})$$
ثابت تعادل برای اسیدهای مختلف متفاوت است و بیانگر این است که اسید به چه میزان در محلول تفکیک میشود. تفکیک بیشتر اسید و ایجاد بیشتر یونهای هیدروژن موجب اسیدیتر شدن محلول خواهد شد و در نتیجه $$pH$$ کاهش پیدا میکند. نسبت باز و اسید در بافر نیز باعث کاهش یا افزایش اندازه $$pH$$ میشود.
- اگر غلظت باز بیشتر از غلظت اسید باشد در نتیجه، یونهای $$OH^-$$ بیشتر است، پس $$pH$$ افزایش پیدا میکند.
- اگر غلظت اسید بیشتر از غلظت باز باشد در نتیجه، یونهای $$H^+$$ بیشتر است، پس $$pH$$ کاهش پیدا میکند.
در زمان برابری غلظت باز و اسید رابطه زیر برقرار است.
$$[H^+]=Ka$$
یا
$$pH=pKa$$
با توجه به ثابت بودن $$Ka$$ با تغییر نسبت اسید و باز مقدار $$pH$$ میتواند کنترل شود.
معادله pH
| معادله | کاربرد |
| $$pH = -log[H_3O^+]$$ | بر اساس غلظت یون هیدرونیوم |
| $$pH=-log[H^+]$$ | بر اساس غلظت یون هیدروژن |
| $$pH=-log(alpha_{{H^+}})$$ | بر اساس اکتیویته یون هیدروژن |
| $$pH=-log([HA])$$ | برای اسید یا باز قوی |
| $$pH=pK_a+log(\frac{[A^-]}{[HA]})$$ | محلولها (معادله هندرسون–هاسلبالخ) |
چند مثال از محاسبه pH
پس از یادگیری و آشنایی با روشهای مختلف محاسبه pH در این بخش چند مثال دیگر آورده شده است. این مثالها میتوانند در فهم موضوع کمک بیشتری کنند و با نحوه محاسبه pH بیشتر آشنا شوید. مثالهای زیر شامل اسید و بازهای قوی میشوند. چنین مسالههایی ممکن است شرایط زیر را داشته باشند.
- واکنش اسید با اسید
- افزوده شدن یک اسید به یک باز
- واکنش باز با باز
برخی از دانشآموزان با میانگین گرفتن از مقدار دو $$pH$$ به چنین پرسشهایی پاسخ میدهند که کاملا اشتباه است.
محاسبه pH هیدروکلریک اسید
هیدروکلریک اسید یک اسید قوی شناخته شده و رایج است که برای ساخت محلول استاندارد استفاده میشود و کاربردهای صنعتی فراوانی دارد.
مثال: $$pH$$ محلول ۰٫۱۰۰ مولار هیدروکلریک اسید را محاسبه کنید.
پاسخ: $$HCl$$ اسید قوی است و بهطور کامل یونیزه میشود. پس میتوان $$pH$$ آن را از غلظت یونهای هیدرونیوم (بر حسب مولار) محاسبه کرد.
$$[H_3O^+]=0.100$$
$$pH = -log (0.100)\Rightarrow-(logfrac{1}{10})$$
$$\Rightarrow-(log1-log10)\Rightarrow-(0-1)$$
$$pH=1$$
مثال محاسبه pH محلول دو اسید
$$pH$$ محلولی که حاوی ۱۰۰ میلیلیتر اسید با $$pH=۳$$ و ۴۰۰ میلیلیتر اسید با $$pH=۱$$ را محاسبه کنید. از $$[H^+]$$ آب چشمپوشی شود.
پاسخ:
1. ابتدا باید مقدار مول در کل محلول را از معادله زیر محاسبه کنیم.
$$M=\frac{mol}{L}$$
- برای $$pH=۳$$ غلظت یون هیدروژن برابر است با $$[H^+] = 0.0010$$
- برای $$pH=۱$$ غلظت یون هیدروژن برابر است با $$[H^+] = 0.10$$
2. مقدار مول از ضرب غلظت در حجم به دست میآید پس داریم:
- $$(0.0010 M)\times(0.100 L) = 0.00010 mol$$
- $$(0.10 mol/L)\times(0.400 L) = 0.040 mol$$
مجموع مولهای محلول:
$$0.040 mol + 0.00010 mol = 0.0401 mol$$
3. با داشتن تعداد مول کل محلول و حجم محلول میتوانیم مقدار غلظت کل را به دست آوریم که برابر است با:
$$\frac{0.0401 mol}{0.500 L}=0.0802 M$$
4. اکنون با داشتن غلظت کل محلول میتوانیم $$pH$$ را بهدست آوریم.
$$pH = −log (0.0802) = 1.096$$
مثال محاسبه pH افزودن اسید به باز
محلولی حاوی ۱۰۰ میلیلیتر از $$HCl$$ با $$pH=۲٫۵۰$$ و ۱۰۰ میلیلیتر از $$NaOH$$ با $$pH=۱۱٫۰۰$$ است. مقدار $$pH$$ را محاسبه کنید.
پاسخ:
1. در ابتدا باید با استفاده از رابطه زیر غلظت یونهای $$[H^+]$$ و $$[OH^¯] $$ را به دست آوریم.
$$[H_3O^+]=10^{{-pH}}$$
- $$[H^+] = 10^{{¯pH}} = 10^{{¯2.50}} = 0.0031623 M$$
- $$[OH^¯] = 10^{{¯pOH}} = 10^{{¯3.00}} = 0.00100 M$$
2. سپس باید میلیمول هر ماده را حساب کنیم.
- برای هیدروکلریک اسید:
$$(0.0031623 mmol / mL)\times(100mL) = 0.31623 mmol$$
- برای سدیم هیدروکسید:
$$(0.0031623 mmol / mL)\times(100mL) = 0.31623 mmol$$
۳. سپس مقدار مول اضافه را به دست میآوریم. واکنش $$HCl$$ و $$NaOH$$ با نسبت ضرایب مولی ۱:۱ انجام می شود. و $$NaOH$$ واکنشدهنده محدودکننده است و به کلی مصرف میشود.
$$0.31623 mmol − 0.100 mmol = 0.21623 mmol$$
۴. با توجه به مقدار میلیمول بهدست آمده مقدار غلظت یون هیدروژن را به دست میآوریم.
$$\frac{0.21623 mmol}{200 mL} = 0.00108115 M$$
۵. اکنون با داشتن غلظت یون هیدروژن میتوانیم $$pH$$ را به دست آوریم.
$$pH = −log (0.00108115) = 2.97$$
مثال محاسبه pH افزودن اسید به آب خالص
مقدار ۵ میلیلیتر از محلولی با $$pH=۱٫۰$$ به ۵ میلیلیتر از محلولی با $$pH=۷٫۰$$ افزوده شده است. اندازه $$pH$$ محلول جدید را محاسبه کنید. از $$[H^+]$$ آب چشمپوشی شود.
پاسخ:
۱. با فرض اینکه $$pH = ۷$$ متعلق به آب خالص است، غلظت یون هیدروژن در $$pH = ۱$$ برابر است با:
$$10^{¯1}= 0.1 M$$
2. با استفاده از رابطه $$M_۱V_۱ = M_۲V_۲$$ خواهیم داشت:
$$(0.1 mol/L)\times(5.0 mL) = (x)\times(10.0 mL)$$
$$x = 0.05 M$$
3. اکنون با به دست آوردن غلظت یون هیدروژن در حجم کل محلول میتوانیم مقدار $$pH$$ را به دست آوریم.
$$pH = −log [H^+] = −log (0.05) = 1.3$$
نکته: اگر $$pH=۷$$ متعلق به بافر بود، برای حل مساله به اطلاعات بیشتری نیاز داشتیم.
مثال واکنش اسید و باز
برای واکنش کامل ۲۰٫۲۰ میلیلیتر از محلول $$HNO_3$$ به ۳۰۰ میلیلیتر از محلول $$LiOH$$ با $$pH=۱۲٫۰۵$$ نیاز است. $$pH$$ محلول $$HNO_3$$ چقدر است؟
نکته: توجه داشته باشید که $$LiOH$$ بازی قوی است و به طور کامل تفکیک میشود.
پاسخ:
۱. ابتدا غلظت $$OH^¯$$ را به دست میآوریم:
$$[OH^¯] = 10^{¯pOH}= 10^{¯1.95} = 0.0112202 M$$
۲. با استفاده از غلظت بهدست آمده میتوانیم تعداد میلیمولهای $$OH^¯$$ موجود در محلول را محاسبه کنیم.
$$(0.0112202 mmol/mL)\times(300.0 mL) = 3.36606 mmol M$$
۳. $$OH^¯$$ و $$H^+$$ با نسبت مولی 1:1 واکنش می دهند، بنابراین $$3.36606 mmol M$$ از $$HNO_3$$ در $$20.20 mL$$ وجود دارد.
۴. حال با توجه به مقدار مول به دست آمده غلظت $$HNO_3$$ را به دست میآوریم:
$$\frac{3.36606 mmol}{20.20 mL}= 0.1666366 M$$
۵. با به دست آوردن غلظت نیتریک اسید میتوانیم مقدار $$pH$$ را محاسبه کنیم.
$$pH = −log (0.1666366) = 0.78$$
سوالات متداول در مورد pH
تا اینجا با مفهوم $$pH$$، روشهای محاسبه و کاربردهای آن در زندگی آشنا شدید در پایان به برخی از پرسشهای رایج در این زمینه پرداختهایم.
سطح pH بدن چقدر است؟
سیستم بدن به طور طبیعی تعادل $$pH$$ را تنظیم میکند. ریه و کلیهها نقش مهمی در حفظ این تعادل دارند. کلیهها با دفع اسیدهای اضافی از طریق ادرار و همچنین تولید بیکربنات به تنظیم $$pH$$ خون کمک میکند.
PH خون چقدر است؟
سطح pH طبیعی خون بین ۷٫۳۵ تا ۷٫۴۵ است.
PH آب چقدر است؟
pH آب خالص در دمای ۲۵ درجه سلسیوس برابر ۷ در نظر گرفته میشود. $$pH$$ آب در تماس با دیاکسید کربن $$(CO_2)$$ جو، هنگام بارش باران کاهش پیدا میکند و میتواند به مقدار ۵٫۲ برسد.
اهمیت pH چیست؟
$$pH$$ کمیت با اهمیتی است که شرایط شیمیایی محلولها را نشان میدهد. همچنین با $$pH$$ میتوان دسترسی به مواد غذایی، عملکرد بیولوژیکی، فعالیت میکروبها و رفتار مواد شیمیایی را کنترل کرد.
اگر PH خون خیلی بالا باشد چه اتفاقی می افتد؟
$$pH$$ بالای خون میتواند موجب آلکالوز شود که با کاهش یون هیدرونیوم پلاسمای خون همراه است.











عالی بود ممنون از اطلاعات بسیار مفید و کاربردی تون 🙏
عالی????