کسر مولی چیست؟ – به زبان ساده + فرمول و محاسبه

کسر مولی یکی از روشهایی است که برای بیان غلظت یک ماده از آن استفاده میشود. در این روش تعداد مولهای یک ماده را نسب به تعداد کل مولهای موجود به دست میآورند. این روش به دلیل سادگی بیان، کاربرد گستردهای در اندازهگیریهای متفاوت به خصوص در آزمایشگاههای شیمی دارد. همچنین تسلط به آن به دانشجویان در حل مسائل مربوط به غلظت کمک فراوانی خواهد کرد و از ایجاد سردرگمی و پیچیدگی جلوگیری میکند.
در این مطلب مجله فرادرس میخواهیم به بررسی مفهوم کسر مولی بپردازیم. در ادامه فرمول و نحوه محاسبه آن را در شرایط گوناگون آزمایشگاهی فرا میگیریم و تعدادی مثال و تمرین را حل میکنیم تا به آن تسط پیدا کنیم.
کسر مولی چیست؟
«کسر مولی» (Mole Fraction) یکی از روشهای متدوال برای بیان غلظت محلول است. همانطور که میدانید از روشهای متفاوتی برای اندازهگیری غلظت استفاده میشود. بنابر تعریف کسر مولی برابر با تعداد مولهای ماده ۱ در یک مخلوط، تقسیم بر تعداد مولهای اجزای دیگر موجود در همان مخلوط است. این کمیت اندازهگیری را بهطور معمول با نماد $$X$$ نمایش میدهند.
فرمول کسر مولی چیست؟
در این بخش میخواهیم فرمول این کمیت را برای ترکیبی بررسی کنیم که در آن دو جز $$A$$ و $$B$$ حضور دارد. در این صورت این کمیت را برای هر جزء، میتوان از رابطههای زیر به دست آورد.
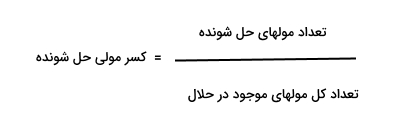
در این رابطه مقداری که در صورت کسر قرار میگیرد برابر با مولهای جزء مورد نظر و مقدار مخرج برابر با تعداد کل مولهای موجود است. به روابط زیر توجه کنید. در صورتی که مخلوط از ۲ جزء تشکیل شده باشد، استفاده از آنها مفید است.
- جزء $$A$$
$$\begin{array}{l}X_{A}= \frac{mol\ A}{mol\ A + mol\ B}\end{array}$$
- جزء $$B$$
$$\begin{array}{l}X_{B}= \frac{mol\ B}{mol\ A + mol\ B}\end{array}$$
همچنین رابطه زیر در محاسبات این کمیت صدق میکند و میتوان از آن برای حل مسائل محاسباتی بهره گرفت. طبق این رابطه مجموع کسرهای مولی اجزای موجود در یک مخلوط برابر با ۱ خواهد بود.
$$ X_A+X_B=1 $$
محاسبات
در این بخش به بررسی چند مثال میپردازیم که در آنها محاسبه این کمیت در شرایط مختلف انجام میشود.
مثال اول
مقدار کسر مولی $$NaCl$$ را در نمونهای از آب محاسبه کنید که در آن ۰٫۰۱ مول از سدیم کلرید در ۱۰۰ گرم آب خالص حل شده باشد.
پاسخ
در این مثال ابتدا نیاز داریم تعداد مولهای آب را بدانیم. با توجه به اینکه جرم مولکولی آب برابر با ۱۸٫۰۱۵۳ گرم بر مول است، از رابطه زیر تعداد مولهای آن به دست میآید.
$$ mole_{H_2O}\begin{array}{l}=\frac{100\ grams}{18.0153\ grams}\end{array}=5.56\; moles $$
با در دست داشتن تعداد مولهای آب، برای به دست آوردن کسر مولی سدیم کلرید از رابطه زیر استفاده میکنیم.
$$ X_{NaCl}\begin{array}{l}=\frac{0.100\ moles}{5.56\ moles + 0.100\ moles}\end{array}=0.018 $$
همچنین میتوان مقدار این کمیت را برای آب نیز به همین روش به دست آورد.
$$ X_{H_2O}\begin{array}{l}=\frac{5.56\ moles}{5.56\ moles + 0.100\ moles}\end{array}=0.982 $$
مثال دوم
محلولی از ترکیب ۲۵ گرم اتانول و ۲۵ گرم آب به دست میآید. کسر مولی هر کدام از این ترکیبات را به دست آورید.
پاسخ
ابتدا باید هر دو مقدار را با کمک جرم مولکولی به مول تبدیل کنیم. با توجه به جرم مولکولی اتانول، ۴۶٫۰۷ گرم بر مول، خواهیم داشت.
$$ moles_{C_2H_6O}\begin{array}{l}=\frac{25.0\ g}{46.07\ g/mol}\end{array}=0.543 \;moles $$
همچنین جرم مولکولی آب برابر با ۱۸٫۰ گرم بر مول است، بنابراین میتوانیم تعداد مولهای آن را نیز بهصورت زیر به دست آوریم.
$$ moles_{H_2O}\begin{array}{l}=\frac{25.0\ g}{18.0\ g/mol}\end{array}=1.34 \;moles $$
در این صورت تعداد کل مولهای موجود در محلول برابر است با:
$$ moles_{sol}=0.543\;mol + 1.34 mol=1.883 \;moles $$
سپس میتوانیم کسر مولی هر جزء را بهصورت زیر به دست آوریم.
$$ X_{C_2H_6O}=\begin{array}{l}=\frac{0.543\ moles}{1.886\ moles}\end{array}=0.29$$
$$ X_{H_2O}=\begin{array}{l}=\frac{1.34\ moles}{1.886\ moles }\end{array}=0.71$$
درصد مولی چیست؟
«درصد مولی» (mole percent) مفهومی بسیار مشابه کسر مولی است، به این صورت که اگر مقدار به دست آمده برای کسر مولی را در عدد ۱۰۰ ضرب کنیم، نتیجه، درصد مولی خواهد بود. این رابطه را میتوان بهصورت زیر نمایش داد.
$$\begin{array}{l}\text{Mole percent of solute}=\frac{\text{Moles of solute}}{\text{Total number of moles of all the solvent}}\times100\end{array}$$

مثال درصد مولی
در محلولی آبی، ۲۵ گرم آب و ۵ گرم سدیم کلرید موجود است. درصد مولی سدیم کلرید را بیابید.
پاسخ
برای به دست آوردن درصد مولی همیشه ابتدا کسر مولی را به دست میآوریم. بنابراین نیاز داریم جرم سدیم کلرید را به کمک جرم مولکولی به مول تبدیل کنیم.
$$ mol_{NaCl}=5\;g\times\frac{mol}{58.5 \;g}=0.086\; mol $$
به همین ترتیب، تعداد مول آب را نیز محاسبه میکنیم.
$$ mol_{H_2O}=25\;g\times\frac{mol}{18 \;g}=1.388\; mol $$
در مرحله بعد این کمیت را برای سدیم کلرید محاسبه میکنیم.
$$ X_{NaCl}=\frac{0.086\;mol}{0.086\;mol+1.3887\;mol}=0.058$$
سپس درصد مولی آن را بهصورت زیر به دست میآوریم.
$$ X_{NaCl}=0.058\times100=5.8 ٪$$
تبدیل کسر جرمی به کسر مولی
کسر جرمی نیز یکی از کمیتهایی است که به کمک آن به بیان غلظت میپردازیم. در این بخش ابتدا به تعریف آن میپردازیم و سپس رابطه آن را با کسر مولی مورد بررسی قرار میدهیم.
کسر جرمی چیست؟
«کسر جرمی» (Mass Fraction) نیز مانند کسر مولی مفهوم سادهای دارد. کسر جرمی یک جزء در مخلوط، مقدار آن جزء نسبت به مجموع مقدار اجزای سازنده است. در حقیقت در این مفهوم جرم جایگزین مول در کسر مولی میشود.
برای مثال اگر در مخلوطی، ۳ جزء متفاوت حضور داشته باشد، کسر جرمی آن را میتوان از رابطه زیر به دست آورد. توجه داشته باشید که مقدار کسر جرمی را با نماد $$Y$$ نشان میدهند. کسر جرمی نیز مانند کسر مولی کمیتی بدون واحد و بعد است.
$$ Mass \;Fraction=\frac{w_A}{w_A+w_B+w_C} $$
- $$w_A$$: جرم جزء $$A$$
- $$w_B$$: جرم جزء $$B$$
- $$w_C$$: جرم جزء $$C$$
در صورتی که مقدار به دست آمده از این رابطه را در عدد ۱۰۰ ضرب کنیم، نتیجه درصدی خواهد بود که آن را درصد جرمی مینامیم.
رابطه کسر مولی و کسر جرمی
در این بخش میخواهیم بدانیم این دو مفهوم با یکدیگر چه رابطهای دارند و چطور به هم تبدیل میشوند. جرم یک ماده به تعداد مولهای آن از طریق جرم مولی ربط پیدا میکند و این ارتباط را میتوان بهصورت زیر نمایش داد.
$$ moles=\frac{Mass\;(g)}{Molar \;mass \;(g/mol)} $$
همانطور که میدانید جرم مولی مقدار جرم موجود در واحد مول یک ماده است.
مثال
کسر مولی اکسیژن، نیتروژن و کربن دیاکسید گازی در مخلوطی به ترتیب برابر با ۰٫۱۹۶، ۰٫۷۴۴ و ۰٫۰۶ است. کسر جرمی نیتروژن را در این ترکیب محاسبه کنید. (جرم مولی اکسیژن برابر با ۱۶ گرم بر مول، جرم مولی نیتروژن برابر با ۱۴ گرم بر مول و جرم مولی کربن دیاکسید نیز برابر با ۴۴ گرم بر مول است.)
پاسخ
در ابتدا با توجه به اینکه کسر مولی و جرم مولی هر جزء را در دست داریم، جرم آن را به دست میآوریم.
$$ mass_{O_2}=0.196\times16=3.136\;g $$
$$ mass_{N_2}=0.744\times14=10.416\;g $$
$$ mass_{CO_2}=0.06\times44=2.64\;g $$
سپس نیاز داریم که جرم کل مخلوط را محاسبه کنیم. این کار را بهصورت زیر انجام میدهیم.
$$ mass=3.136+10.416+2.64=16.192\;g $$
برای به دست آوردن کسر جرمی بهصورت زیر عمل میکنیم.
$$ِY_{N_2}=\frac{10.416\;g}{16.192\;g}=64.3 $$
در صورتی که بخواهیم درصد جرمی را داشته باشیم، میتوانیم مقدار به دست آمده را در عدد ۱۰۰ ضرب کنیم که برابر با ۶۴.۳٪ خواهد بود.
کسر مولی و رابطه دالتون
کسر مولی مقیاسی مفید برای تحلیل ترکیبات گازی در همراهی با «قانون فشارهای جزئی دالتون» (Dalton's Law of Partial Pressures) است. برای روشن شدن این مورد، در ادامه مثالی را مورد بررسی قرار میدهیم.

ظرفی ۲۰ لیتری، حاوی ۱ مول از گاز هیدروژن در فشار ۶۰۰ میلیلیتر جیوه است. ظرفی دیگر با همان حجم حاوی ۳ مول از گاز هلیوم در فشار ۱۸۰۰ میلیمتر جیوه است. این دو گاز با یکدیگر در ظرف سومی با حجم ۲۰ لیتر مخلوط میشوند. از آنجا که هر گاز با توجه به قانون دالتون، فشار ویژه خود را خواهد داشت، فشار جزئی آنها را میتوان از رابطه زیر به دست آورد.
- فشار جزئی هیدروژن
$$ P_{H_2} = X_{H_2} \times P_\text{Total} $$
- فشار جزئی هلیوم
$$ \: \: \: P_{He} = X_{He} \times P_\text{Total}\nonumber$$
فشار جزئی یک گاز را میتوان با ضرب کسر مولی در فشار کل به دست آورد. آن را نیز میتوان برای هیدروژن بهصورت زیر نوشت.
$$ X_{H_2} = \frac{1.0 \: \text{mol}}{1.0 \: \text{mol} + 3.0 \: \text{mol}} = 0.25$$
بنابراین کسر مولی را برای گاز هلیوم نیز به همین شکل به دست میآوریم.
$$ X_{He} = \frac{3.0 \: \text{mol}}{1.0 \: \text{mol} + 3.0 \: \text{mol}} = 0.75\nonumber$$
همچنین با توجه به قانون دالتون، فشار کل برابر با ۲۴۰۰ میلیمتر جیوه است. با در دست داشتن این اطلاعات میتوان فشار جزئی را برای هر دو گونه مورد محاسبه قرار داد.
$$ P_{H_2} = 0.25 \times 2400 \: \text{mm} \: {Hg} = 600 \: \text{mm} \: {Hg}\nonumber$$
$$ P_{He} = 0.75 \times 2400 \: \text{mm} \: {Hg} = 1800 \: \text{mm} \: {Hg}\nonumber$$
همانطور که مشاهده میکنید، فشار جزئی گونهها تغییری نکرده است زیرا ترکیبات در حجمی یکسان با یکدیگر ترکیب شدهاند و دمال نیز تغییری نکرده است.
ویژگیهای کسر مولی
حال که با این کمیت آشنا شدیم و دانستیم که از چه روشی محاسبه میشود، به بررسی تعدادی از ویژگیهای آن میپردازیم.
- در صورتی که در مخلوطی چند جزء وجود داشته باشد، جمع کسر مولی آنها برابر با ۱ خواهد بود.
- با ضرب مقدار این کمیت در عدد ۱۰۰، درصد مولی آن جزء در محلول به دست میآید.
- کسر مولی کمیتی بدون واحد و بعد است.
- مقدار این کمیت به دما بستگی ندارد.
- برای محاسبه این کمیت نیازی به دانستن چگالی جزء مورد نظر و حالت فیزیکی آن وجود ندارد.
- در صورتی که بخواهیم مقدار این کمیت را برای ترکیب گاز ایدهال به دست بیاوریم، نسبت فشار جزئی را بر فشار کل ترکیب بیان میکنیم.
- در ترکیب گازهای ایدهال، نیاز به اندازهگیری کسر مولی و کسر حجمی بهصورت جداگانه نداریم زیرا با یکدیگر برابر هستند.
نمونه سوال کسر مولی
حال که میدانیم کسر مولی چیست و با نحوه محاسبات آن نیز آشنا شدیم، به بررسی تعدادی مثال و تمرین میپردازیم تا درک خود را از این مفهوم عمق ببخشیم.
مثال
در این بخش به بررسی تعداد مثال میپردازیم و در هر کدام با آوردن پاسخ تشریحی، نحوه به دست آوردن پاسخ صحیح را یاد میگیریم.
مثال اول
۲۵٫۷ گرم از فرمالدهید با فرمول شیمیایی $$CH_2O$$ را در ۳٫۲۵ مول از کربن تتراکلرید با فرمول شیمیایی $$CCl_4$$ حل میکنیم. کسر مولی فرمالدهید را به دست آورید.
پاسخ
از آنجا که در صورت سوال جرم فرمالدهید را داریم، به کمک جرم مولکولی آن، تعداد مولها را به دست میآوریم. جرم مولکولی فرمالدهید باربر با ۳۰٫۰۳ گرم بر مول است.
$$ mole_{CH_2O}\begin{array}{l}=\frac{25.7\ grams}{30.03\ grams/mol}\end{array}=0.856\;moles $$
بنابراین میتوانیم تعداد کل مولهای موجود در نمونه را بهصورت زیر به دست آوریم.
$$ mole_{sol}=0.856 \; moles+ 3.25 \;moles=4.406\;moles $$
در این صورت کسر مولی فرمالدهید را به راحتی محاسبه میکنیم.
$$ X_{CH_2O}=\begin{array}{l}=\frac{0.856\ moles}{4.106\ moles}\end{array}=0.208 $$
مثال دوم
در ظرفی ترکیبی شامل ۱٫۲۴ مول گاز هیدروژن و ۲٫۹۱ مول از گاز اکسیژن وجود دارد. در صورتی که فشار کل آنها برابر با ۱۰۴ کیلوپاسکال باشد، فشار جزئی هر کدام از گازها چه مقدار است؟
پاسخ
در ابتدا باید کسر مولی هر یک از گازها را به دست بیاوریم. سپس با ضرب آن در فشار کل، مقدار فشار جزئی به دست میآيد.
- کسر مولی هیدروژن
$$ X_{H_2} = \frac{1.24 \: \text{mol}}{1.24 \: \text{mol} + 2.91 \: \text{mol}} = 0.299$$
- کسر مولی اکسیژن
$$ X_{O_2} = \frac{2.91 \: \text{mol}}{1.24 \: \text{mol} + 2.91 \: \text{mol}} = 0.701 $$
- فشار جزئی هیدروژن
$$ P_{H_2} = 0.299 \times 104 \: \text{kPa} = 31.1 \: \text{kPa} r$$
- فشار جزئی اکسیژن
$$ P_{O_2} = 0.701 \times 104 \: \text{kPa} = 72.9 \: \text{kPa} r$$
مثال سوم
کسر مولی حلالی در یک محلول آبی برابر با ۰٫۸ است. مولالیته این محلول بر حسب مول بر کیلوگرم چقدر است؟
پاسخ
با توجه به اینکه مجموع این کمیت برای اجزای یک ترکیب برابر با ۱ است، میتوان با در دست داشتن کسر مولی حلال، مقدار کسر مولی حلشونده را بهصورت زیر نوشت.
$$ X_{Solute}=1-0.8=0.2$$
مقدار مولالیته را از رابطه زیر به دست میآوریم.
$$ m=\frac{0.2}{0.8}\times\frac{1000}{18}=13.88 \;mol/kg$$
مثال چهارم
در محلولی تشکیل شده از اتانول و آب، کسر مولی اتانول برابر با ۰٫۲۵ است. این کمیت را به کسر جرمی آن تبدیل کنید. (مقدار جرم مولی اتانول برابر با ۴۶٫۰۷ گرم بر مول و مقدار جرم مولی آب برابر با ۱۸٫۰۲ گرم بر مول است.)
پاسخ
با توجه به اطلاعات داده شده، میتوان مقدار جرم اتانول را بهصورت زیر محاسبه کرد.
$$ ِmass_{C_2H_5OH}=0.25\times46.07=11.5175\;g $$
سپس باید جرم آب را نیز به دست بیاوریم. از آنجا که مقدار مجموع کسر مولی در یک مخلوط برابر با ۱ است، این کمیت برای آب برابر با ۰٫۷۵ خواهد بود. با در دست داشتن جرم مولی آن، جرم را به دست میآوریم.
$$ِmass_{H_2O}=0.75\times18.02=13.515\;g $$
در نهایت نیز برای به دست آوردن کسر جرمی آن بهصورت زیر عمل میکنیم.
$$Y_{C_2H_5OH}=\frac{11.5175\;g}{11.5175\;g+13.515\;g}=0.46 $$
حل تمرین
حال که تعدادی مثال از محاسبات این کمیت را بررسی کردیم، در این بخش شاهد تعدادی تمرین به همراه پاسخ چندگزینهای هستیم. در موارد مورد نیاز، حل مسائل نیز در بخش پاسخ تشریحی آورده شده است.

تمرین اول
کسر مولی استون را در محلولی حاوی ۱ مول بنزن، ۲ مول کربن تتراکلرید و ۷ مول استون به دست آورید.
۰٫۷
۰٫۸
۰٫۴
۰٫۲
همانطور که در سوال مشاهده میکنید، تعدادی مولهای استون برابر با ۷ است. همچنین تعداد کل مولهای موجود در محلول را نیز میتوان بهصورت زیر به دست آورد.
تعداد کل مولها= تعداد مولهای بنزن + تعداد مولهای کربن تتراکلرید + تعداد مولهای استون
$$ Mole_{Sol}=1\;mole+ 2 \;moles+ 7 \;moles=10 \;moles $$
بنابراین کسر مولی استون بهصورت زیر قابل محاسبه است.
$$ X_{acetone}=\frac{7\;moles}{10\;moles}=0.7 $$
به همین ترتیب میتوان آن را برای بزن و کربن تتراکلرید به دست آورد.
$$ X_{benzene}=\frac{1\;mole}{10\;moles}=0.1 $$
$$ X_{CCl_4}=\frac{2\;moles}{10\;moles}=0.2 $$
همانطور که مشاهده میکنید، مجموع این کمیت برای اجزای دخیل در محلول برابر با عدد ۱ خواهد بود.
$$0.1+0.7+0.2=1$$
تمرین دوم
در صورتی که $$n$$ مول از سدیم در محلولی با تعداد مول $$N$$ حضور داشته باشد، مقدار کسر مولی سدیم را از کدام یک از روابط زیر میتوان به دست آورد؟
$$ \frac{N}{n}$$
$$ \frac{n}{N}$$
$$ \frac{n}{N+n}$$
$$ \frac{N}{N+n}$$
تمرین سوم
نمونهای حاوی ۲۵٪ جرمی آب، ۲۵٪ جرمی اتانول و ۵۰٪ جرمی استیک اسید است. کسر مولی آب در این نمونه در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
۰٫۲
۰٫۴
۰٫۵
۰٫۷
تمرین چهارم
در مخلوطی ۲٫۴ مول کلر و ۰٫۸ مول اکسیژن وجود دارد. کسر مولی کلر در این مخلوط برابر با ... است.
۰٫۵
۰٫۷۵
۰٫۸
۰٫۶
تمرین پنجم
کسر مولی هلیوم در مخلوطی برابر با ۰٫۱۶ است. اگر تعداد کل مولهای موجود در ترکیب برابر با ۵٫۲ باشد، چند مول هلیوم در آن وجود دارد؟
۰٫۶۸ مول
۰٫۱۶ مول
۰٫۸۳ مول
۰٫۹۴ مول
تمرین ششم
فشار جزئی گاز کربن دیاکسید در مخلوطی برابر با ۰٫۳۱ اتمسفر است. اگر کسر مولی آن در مخلوط برابر با ۰٫۴۶ باشد، فشار کل مخلوط با کدام یک از گزینههای زیر برابر خواهد بود؟
۰٫۸ اتمسفر
۰٫۶۲ اتمسفر
۰٫۶۷ اتمسفر
۰٫۷۲ اتمسفر
تمرین هفتم
فشار جزئی اجزای یک محلول بهطور مستقیم با کسر مولی آنها متناسب است. این عبارت ... نامیده میشود.
قانون هنری
قانون دالتون
قانون توزیع
قانون نیوتون
تمرین هشتم
کسر مولی سدیم کلرید در محلول حاوی ۱ مول از آن در ۱۰۰۰ گرم آب برابر است با ...
۰٫۰۱۷۷
۰٫۰۰۱
۰٫۵
۰٫۲۴۴
سوالات متدوال
حال که بررسی این کمیت برای اندازهگیری غلظت پرداختیم، در این بخش به برخی از مهمترین و پرتکرارترین سوالهای پیرامون آن پاسخ میدهیم.
واحد کسر مولی چیست؟
کسر مولی کمیتی بدون واحد و بعد است.
آیا کسر مولی به دما بستگی دارد؟
خیر، این کمیت روشی برای بیان غلظت است که تحت تاثیر دما قرار نمیگیرد.
فرمول کسر مولی چیست؟
فرمول آن، نسبت مول یک جزء بر تعداد کل مولهای موجود در ترکیب است.
دلیل عدم وابستگی کسر مولی به دما چیست؟
این کمیت تحت تاثیر دما قرار ندارد زیرا تعداد ذرههای موجود تغییر نمیکند.
تفاوت کسر جرمی و کسر مولی در چیست؟
کسر مولی و کسر جرمی دو روش متفاوت برای بیان غلظت هستند. کسر مولی نسبت مول یک جزء به مجموع مولهای اجزا است. به همین صورت کسر جرمی نسبت جرم یک جزء به مجموع جرم اجزای دیگر است.
جمعبندی
هدف از این مطلب مجله فرادرس این بود که بدانیم کسر مولی چیست و در هر مخلوطی چگونه قابل اندازهگیری است. کسر مولی در واقع تعداد مولهای یک ماده مشخص تقسیم بر تعداد کل مولهای موجود است. از همین تعریف میتوان برای محاسبه آن در موارد مختلف استفاده کرد. در نهایت نیز به بررسی تعدادی مثال و تمرین از این کمیت کاربردی پرداختیم.










