نقطه انجماد — به زبان ساده

نقطه انجماد به دمایی میگویند که در آن، مایع به جامد تبدیل میشود. همانند نقطه ذوب، تغییر فشار به طور معمول موجب تغییر نقطه انجماد میشود. به عبارت دیگر، پدیده انجماد، زمانی رخ میدهد که مایعی در اثر کاهش دما به زیر نقطه انجماد، به حالت جامد تبدیل شود. برای بیشتر مواد، نقطه انجماد و ذوب یکسان است اما در برخی از مواد، تغییر فاز جامد به مایع، دماهای متفاوتی را شامل میشود. به طور مثال، «آگار» (Agar) که از جلبک قرمز بدست میآید، نوعی پدیده هیسترزیس (پسماند) از خود نشان میدهد به طوریکه دمای ذوب آن، 85 درجه سانتیگراد است و نقطه انجماد آن از ۳۲ تا ۴۰ درجه سانتیگراد تغییر میکند.
زمانی که برخی از ترکیبات آلی همچون چربیها را بررسی میکنیم، نقطه انجماد از نقطه ذوب پایینتر است. زمانی که یک مخلوط منجمد میشود، جامد تشکیل شده در ابتدا، ترکیبی متفاوت از مایع دارد و ادامه فرآیند، ترکیب را به گونهای تغییر میدهد که به آرامی، نقطه انجماد کاهش پیدا میکند. از این اصل در خالصسازی مخلوطها، ذوبهای پیدرپی و همچنین در جداسازی مواد استفاده میشود. زمانی که یک مایع سرد میشود، انرژی متوسط مولکولهای آن کاهش مییابند.
گرمای ذوب به گرمایی میگویند که برای ذوب یک جامد مورد نیاز است. همچنین، برای انجماد یک مایع، این گرما باید از آن گرفته شود. علاوه بر این، برخی از مایعات را میتوان بدون تشکیل بلور، به مایع «فوق سرد» (Super Cooled) تبدیل کرد و قرار دادن ذرهای بلورین در یک مایع فوق سرد کافی است تا عمل انجماد را تحریک کند.
توصیف نقطه انجماد
در نقطهای، میزان گرمای گرفته شده از ماده به اندازهای هست که در اثر آن، نیروهای جاذبه بین مولکولها، آنها را به سمت یکدیگر بکشند و مایع را به جامد تبدیل کنند. در تصویر زیر، نمای میکروسکوپی از یک جامد و مایع را مشاهده میکنید.

نقطه انجماد را میتوان به عنوان مشخصهای از مایعات ذکر کرد که در آن نقطه، به جامد تبدیل میشوند. در بسیاری از موارد، نقطه ذوب یک جامد با نقطه انجماد آن برابر است اما در عمل، تفاوت کوچکی بین این مقادیر وجود دارد.

تبلور
بسیاری از مایعات در اثر تبلور، به انجماد میرسند. این حالت را تغییر فاز ترمودینامیکی مرتبه اول میگویند یعنی تا زمانی که جامد و مایع در کنار یکدیگر باشند، دمای کل سیستم، بسیار به دمای نقطه ذوب نزدیک است چراکه در این حالت، حذف گرما به دلیل هدایت گرمایی پایین هوا، به آهستگی صورت میگیرد. به دلیل وجود «گرمای نهان ذوب» (Latent Heat of Fusion)، عمل انجماد به آهستگی صورت میگیرد و دما در این حالت ثابت است اما با پایان یافتن انجماد، دما نیز کاهش پیدا میکند.
عمل تبلور شامل وقوع دو اتفاق به نامهای «هستهزایی» (Nucleation) و «رشد بلور» (Crystal Growth) است. هستهزایی به مرحلهای میگویند که در آن، مولکولها به شکل خوشهای در کنار یکدیگر جمع میشوند که البته این فرآیند در مقیاس نانو صورت میگیرد. این تشکیل خوشه به نحوی مرتب و دورهای صورت میگیرد که در نهایت سبب شکلگیری ساختار بلوری میشود. در مرحله بعد نیز هستهزایی را خواهیم داشت.
فراسرمایش
در تعریفی ساده، اگر برخی مایعات را بتوان تا دمایی کمتر از نقطه انجماد، بدون تشکیل بلور، سرد کرد، به مایع حاصل، مایع فوق سرد میگوییم. بر خلاف قانون دوم ترمودینامیک، تبلور مایعات خالص در دمایی پایینتر از نقطه ذوب صورت میگیرد. دلیل این امر، انرژی فعالسازی بالا در فرآیند هستهزایی همگن ذکر میشود. درصورتیکه کاهش دما، انرژی کافی برای تشکیل یک هسته پایدار را تامین نکند، عمل انجماد رخ نمیدهد. نقطه ذوب آب در فشار ۱ اتمسفر برابر با صفر درجه سانتیگراد است و در بسیاری از موارد، نقطه انجماد آب به نقطه ذوب بسیار نزدیک است. اما در برخی شرایط (عدم وجود مواد هستهزا)، آب را میتوان تا دمای درجه سانتیگراد و قبل از رسیدن به نقطه انجماد، سرد کرد. در فشارهای بسیار زیاد (2000 اتمسفر)، آب تا درجه سانتیگراد نیز سرد و به مایع فوق سرد تبدیل میشود.
بررسی گرماده بودن انجماد
انجماد همواره به عنوان یک فرآیند گرماده شناخته میشود به این معنی که تبدیل مایع به جامد، با آزاد شدن گرما و فشار همراه است. البته در ظاهر چنین فرآیندی را نمیبینیم زیرا دمای ماده به هنگام انجماد کاهش پیدا نمیکند مگر آنکه «فراسرمایش» (Supercooling) داشته باشیم. برای درک این حالت میتوان اینطور گفت که بمنظور ادامه فرآیند انجماد باید به حذف گرما (سرد کردن) ادامه داد و تا زمانی که اینکار انجام بگیرد، عمل انجماد متوقف نمیشود.
به انرژی آزاد شده به هنگام انجماد، «گرمای نهان» (Latent Heat) میگویند که با نام آنتالپی ذوب نیز شناخته میشود. این آنتالپی ذوب به طور دقیق با میزان انرژی مورد نیاز برای ذوب ماده جامد با همان مقدار، برابر است. ایزوتوپهای هلیوم همچون هلیوم ۳ و ۴ از این قانون پیروی نمیکنند. هلیوم ۳ در دمای زیر0/3 کلوین، آنتالپی ذوب منفی دارد و در هلیوم ۴ نیز این حالت در دمایی پایینتر از 0/8 کلوین دیده میشود به این معنی که در فشار ثابت، برای ذوب کردن این مواد باید به آنها گرما اضافه کنیم.

کاهش نقطه انجماد
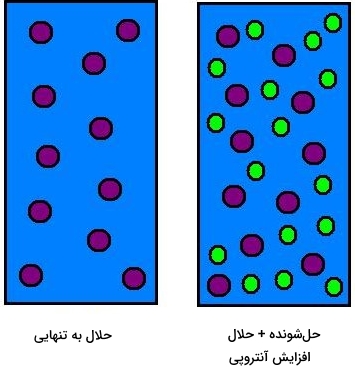
«کاهش نقطه انجماد» (Freezing Point Depression) از جمله خواص کولیگاتیو به شمار میآید و ناشی از اضافه کردن مولکولهای حلشونده به حلال است. نقطه انجماد محلولها همگی پایینتر از حلال خالص هستند و این نقطه به طور مستقیم با مولالیته حلشونده ارتباط دارد.
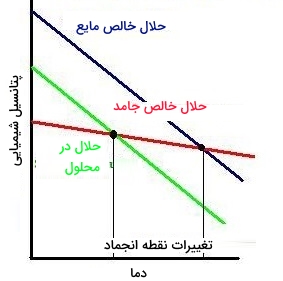
مقدار کاهش نقطه انجماد را میتوان از طریق اختلاف نقطه انجماد حلال و محلول بدست آورد. در این رابطه، موسوم به ثابت کاهش نقطه انجماد و غلظت مولال (مولالیته) است.
ترکیبات غیرالکترولیت، موادی بدون یون و تنها به صورت مولکول هستند. در مقابل، الکترولیتهای قوی در بیشتر موارد از ترکیبات یونی تشکیل شدهاند و به طور کلی، تمامی ترکیبات انحلالپذیر یونی، الکترولیتها را تشکیل میدهند. اگر ثابت کنیم که مادهای که با آن کار میکنیم، یکپارچه و غیریونی است، میتوان فرض کرد که این ماده، غیرالکترولیت است و از روابط مربوط به آن استفاده خواهیم کرد. در این خصوص باید توجه داشت که به هنگام بررسی کاهش نقطه انجماد و افزایش نقطه ذوب، با مادهای غیرالکترولیت سر و کار داریم اما باید نیمنگاهی نیز به یونها داشته باشیم.
خواص کولیگاتیو
با اضافه کردن مواد حلشونده به یک محلول ایدهآل، آنتروپی مثبت (افزایش آنتروپی) خواهیم داشت. به همین دلیل، محلول جدید، خواص فیزیکی و شیمیایی متفاوتی خواهد داشت. خواصی که به هنگام اضافه کردن حلشونده به حلال، دچار تغییر میشوند موسوم به «خواص کولیگاتیو» (Colligative Properties) هستند. این خواص به تعداد ذرات حلشونده مرتبط هستند و به ماهیت آنها وابستگی ندارند. نقطه انجماد و جوش را میتوان به عنوان دو نمونه از خواص کولیگاتیو نام برد که در اثر اضافه کردن مواد حلشونده، نقطه جوش افزایش و نقطه انجماد کاهش پیدا میکند.
زمانی که یک حلال خالص را به محلولی اضافه کنیم، نقطه انجماد و نقطه جوش آن تغییر میکند. در اثر این اتفاق، نقطه انجماد حلال خالص ممکن است کاهش و نقطه جوش آن افزایش یابد. میزان این تغییرات در نقطه انجماد و ذوب به ترتیب از طریق روابط زیر تعیین میشوند:
در جدول زیر، ثابت تناسب K برای برخی از حلالها آورده شده است:
| حلال | ||
| آب | 1/86 | 0/512 |
| استیک اسید | 3/90 | 3/07 |
| بنزن | 5/12 | 2/53 |
| فنول | 7/27 | 3/56 |
مولالیته در محاسبات کاهش نقطه انجماد
مولالیته را به صورت تعداد مولهای حلشونده به ازای هر کیلوگرم از حلال ذکر میکنند. توجه داشته باشید که به هنگام محاسبه مولالیته، جرم کل محلول را حساب نکنید. در حل چنین مسائلی به طور معمول، ثابت تناسب و تغییرات دما داده میشوند و شما باید برای یافتن پاسخ، در ابتدا مولالیته را محاسبه کنید.
از آنجایی که با اضافه کردن حلشونده، دیگر حلال خالص نداریم، میتوان گفت که پتانسیل شیمیایی حلال، کاهش پیدا کرده است. هرقدر پتانسیل شیمیایی یک حلال بیشتر باشد، توانایی آن برای پیشبرد واکنش، بیشتر است. در نتیجه، حلالهایی با پتانسیل شیمیایی بیشتر، فشار فخار بیشتر نیز خواهند داشت.
زمانی که پتانسیل شیمیایی یک ماده خالص در تعادل با پتانسیل شیمیایی بخار خالص قرار بگیرد، به نقطه جوش میرسیم. به دلیل کاهش پتانسیل شیمیایی در محلولی شامل حلال و حلشونده، به این تعادل در دمایی بالاتر میرسیم. به عبارت دیگر، نقطه جوش حلالهای ناخالص، از نوع خالص آنها بیشتر است. بنابراین، تحت چنین شرایطی، افزایش نقطه جوش خواهیم داشت که از رابطه زیر، محاسبه میشود.
- : «ثابت ابولیوسکوپی» (Ebullioscopic Constant)
- : مولالیته حلشونده
زمانی به نقطه انجماد میرسیم که پتانسیل شیمیایی حلال خالص مایع با پتانسیل شیمیایی حلال خالص جامد، برابر شود. با توجه به اینکه با مخلوطهایی سروکار داریم که پتانسیل شیمیایی آنها کاهش یافته است، انتظار تغییر در نقطه انجماد داریم. برخلاف نقطه جوش، پتانسیل شیمیایی یک حلال ناخالص به دمای کمتری نیاز دارد تا به پتانسیل شیمیایی حلال خالص جامد خود برسد که در نتیجه این اتفاق، شاهد کاهش نقطه انجماد خواهیم بود.
مثال برای محاسبه جرم مولی و کاهش نقطه انجماد
۲ گرم از ترکیبی ناشناخته، نقطه انجماد ۷۵ گرم بنزن را از 5/53 به 4/90 درجه سانتیگراد کاهش میدهد. جرم مولی ترکیب را محاسبه کنید.
در ابتدا باید مولالیته محلول بنزن را محاسبه کنیم. با این کار، تعداد مولهای حلشونده را پیدا میکنیم.
به کمک تعریف مولالیته که در بالا بیان کردیم و ضریب تبدیل زیر، تعداد مول ماده حلشونده را حساب میکنیم.
حال میتوانیم جرم مولی ترکیب ناشناخته را محاسبه کنیم:
کاربرد کاهش نقطه انجماد
از قابلیت کاهش نقطه انجماد برای نمکپاشی جادهها در زمان یخبندان استفاده میشود. پدیده کاهش نقطه انجماد سبب میشود تا برف و باران در دمای پایینتری یخ بزنند. با این روش و به کمک ، میتوان تا دمای درجه سانتیگراد، کاهش نقطه انجماد داشته باشیم. در نتیجه، اگر دمای محیط کمتر از این مقدار باشد، بهرهگیری از عملی نیست و به جای آن در استفاده میشود. البته استفاده از نمک موجب افزایش سرعت زنگ زدن و خوردگی فلزات خواهد شد به همین دلیل در فرودگاهها از مواد دیگری همچون سدیم فرمات با فرمول و پتاسیم فرمات بهره میگیرند.
از نمونههای دیگر میتوان به ضدیخ در سیستم خنککننده خودروها اشاره کرد. مایع خنککننده رادیاتور خودرو شامل مخلوطی از آب و اتیلن گلایکول است. به کمک این روش، رادیاتور خودروها در زمستان و تا دمای درجه سانتیگراد، یخ نمیزنند.

بسیاری از موجودات زنده، از پدیده کاهش نقطه انجماد برای زنده ماندن در محیطهای بسیار سرد استفاده میکنند. این موجودات با تولید غلظتهای بالا از ترکیبات مختلف همچون سوربیتول و گلیسرول، موجب کاهش نقطه انجماد آب در اطراف خود میشوند. با این کار، حتی اگر دمای آب یا هوای اطراف بسیار سرد باشد، این موجودات دچار یخزدگی نخواهند شد که در برخی از قورباغهها و ماهیها این خاصیت را میتوان پیدا کرد.
کاهش نقطه انجماد را به عنوان ابزاری برای آنالیز خلوص مواد در روش «گرماسنجی روبشی تفاضلی» (Differential Scanning Calorimetry) در نظر میگیرند. همچنین به کمک این روش اگر در شیر، آب اضافه شده باشد، میتوان آنرا تشخیص داد که از چنین روشی در صنایع لبنی بهره میگیرند. اگر کاهش دمای انجماد در شیر، بیش از 0/509 درجه سانتیگراد باشد، در آن آب اضافه شده است.
محاسبات در محلول ایدهآل و غلیظ
اگر محلولی را به عنوان محلول ایدهآل در نظر بگیریم، مقدار کاهش نقطه انجماد، تنها به غلظت ماده حلشونده بستگی دارد که به راحتی با رابطه خطی زیر قابل محاسبه است:
- : کاهش نقطه انجماد
- : «ثابت انجمادسنجی» (Cryoscopic Constant) که به خواص حلال (و نه حلشونده) وابسته است.
- : مولالیته
- : ضریب وانتهوف
رابطه ساده بالا، طبیعت حلشونده را در نظر نمیگیرد. بنابراین، این رابطه تنها در محلولهای رقیق کاربرد دارد. برای محاسبه دقیقتر در غلظتهای بالاتر و همچنین، حلشوندههای یونی، از رابطه زیر استفاده میکنیم:
- : نقطه انجماد نرمال حلال خالص
- : اکتیویته حلال در محلول
- : تغییرات آنتالپی ذوب حلال خالص در
- : اختلاف ظرفیتهای حرارتی فازهای مایع و جامد در
جمع بندی
در این آموزش به بررسی نقطه انجماد پرداختیم و دیدیم که برخلاف آنچه قبلا تصور میکردیم، نقطه انجماد با نقطه ذوب برابر نیست و هر یک شامل مفهومی جداگانه هستند. این مفهوم را به کمک بیان تبلور و عمل فراسرمایش بیان کردیم. علاوه بر این فهمیدیم که انجماد را میتوان به عنوان یک فرآیند گرماده شناخت زیرا تبدیل مایع به جامد با آزاد شدن گرما همراه است. دیدیم که با اضافه کردن ناخالصی (ماده حلشونده) به یک حلال خالص، نقطه انجماد محلول حاصل کاهش پیدا میکند.
برای محاسبه میزان کاهش نقطه انجماد، دو رابطه را بیان کردیم که در رابطه اول، کاهش نقطه انجماد را در یک محلول ایدهآل (رقیق) بررسی کردیم اما با توجه به اینکه این رابطه در محلولهای غلیظ، کاربردی نداشت، رابطه دقیقتری معرفی شد تا به کمک آن، کاهش نقطه انجماد محلولهای غلیظ، با دقت بیشتری محاسبه شود.












سلام
چطور میتونم نقطه انجماد سرکه5 درصد مشخص کنم؟ منظورم روش آزمون هست.باتشکر
سلام . وقت بخیر
میشه به صورت ساده توضیح بدین که چرا حل شدن نمکها در آب موجب کاهش نقطه انجماد میشه ؟ یعنی چه تغییرات مولکولی و ساختاری در آب رخ میده که نقطه انجماد پایین میاد ؟
استاد الان یعنی میشه گفت هر چی فشار بیشتر نقطه انجماد هم بیشتر؟
با سلام؛
تغییر در فشار میتواند نقطه انجماد یک ماده را کاهش یا افزایش دهد. به طور کلی، فشارهای کمتز از ۱ اتمسفر، نقطه انجماد را کاهش میدهند اما برای آب، فشار بیشتر، نقطه انجماد پایینتری را سبب میشود.
با تشکر از همراهی شما با مجله فرادرس