واکنش جانشینی — به زبان ساده

واکنش جانشینی یا واکنش جانشینی یگانه، نوعی واکنش شیمیایی است که در آن، یک گروه عاملی در یک ترکیب شیمیایی با گروه عاملی دیگری جایگزین میشود. واکنش جانشینی اهمیت بالایی در شیمی آلی دارد. بسته به نوع ریجنت (واکنشگر)، واکنش جانشینی به دو نوع هستهدوست و الکتروندوست تقسیم میشود. البته دستهبندیهای دیگری نیز وجود دارند که تمرکز ما در این مطلب بر روی واکنشهای هستهدوست خواهد بود. بسته به نوع مواد واسط فعال دخیل در واکنش جانشینی که کربوکاتیون، کربانیون یا رادیکال آزاد باشند، واکنش جانشینی را به صورتهای مختلف هستهدوست یا الکترون دوست طبقهبندی میکنند. فهم دقیق نوع واکنش شیمیایی به ما در پیشبینی فرآوردههای نهایی کمک میکند. علاوه بر این در بهینهسازی واکنشها برای دما یا حلال مورد نظر، به درک صحیحی از نوع واکنش جانشینی نیاز داریم.
واکنش جانشینی هسته دوست
در شیمی آلی و معدنی، واکنش جانشینی هسته دوست، دستهای اساسی از واکنشهایی است که در آنها یک «هستهدوست» (Nucleophile)، به طور انتخابی با یک بار مثبت، یک اتم یا گروهی از اتمها پیوند تشکیل میدهد. در اثر این اتفاق، هستهدوست ضعیفتر به یک «گروه ترک کننده» (Leaving Group) و اتم مثبت باقیمانده، به یک الکتروندوست تبدیل خواهد شد. به عبارت دیگر، ذرهای غنی از الکترون (هستهدوست) با ذرهای فقیر از الکترون (الکتروندوست) برهمکنش انجام میدهد و یک گروه ترک کننده را به جای میگذارد. در ادامه قصد داریم تا واکنشهای جانشینی هستهدوست را مورد بررسی قرار دهیم اما قبل از این کار بهتر است تا با برخی از نمادها و اصطلاحت عمومی در واکنش جانشینی آشنا شویم تا ادامه کار سادهتر شود.
به جای نشان دادن هستهدوست (نوکلئوفیل) خاصی همچون هیدروکسید، از نماد «Nu» بهره میگیریم. به طور مشابه نیز گروههای ترککننده را با «X» یا «LG» نشان میدهیم. در ادامه خواهیم دید که در برخی موارد، گروههای ترک کننده دارای بار مثبت، منفی یا خنثی هستند. برای سادگی کار، سه گروه دیگری که به کربن مرکزی متصل شدهاند را با «R» نشان میدهیم. این نماد هم نشاندهنده گروههای آلکیلی و هم نشاندهنده هیدروژن است. همچنین، برای اینکه تصویرها خیلی پیچیده و شلوغ نباشند، از ساختار خطچین و گوه کمک میگیریم که در آن، اتم مرکزی نشان داده نمیشود. در تصویر زیر، یک تصویر کلی از واکنش جانشینی هستهدوست مشاهده میکنید.
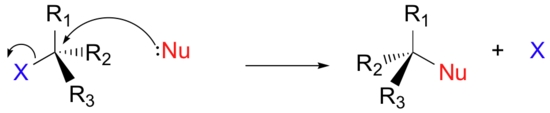
جانشینی هسته دوست تجمعی: واکنش
دو مدل برای نمایش نحوه پیشرفت یک واکنش جانشینی هستهدوست وجود دارد. در تصویر زیر، واکنش در یک مرحله انجام میشود و فرآیندهای تشکیل و شکست پیوندها به طور همزمان صورت میگیرند.
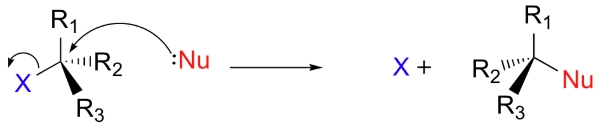
به این فرآیند، مکانیسم یا «تجمعی» (Associative) میگویند. در این مکانیسم، حرف «S» بیانگر «جانشینی» (Substitution) و حرف «N» نشاندهنده «هستهدوستی» (Nucleophilic) است. عدد ۲ نیز بیانگر یک واکنش «دو مولکولی» (Bimolecular) خواهد بود. سرعت کلی واکنش به مرحلهای بستگی دارد که دو مولکول مجزا (هستهدوست و الکتروندوست) با یکدیگر برخورد میکنند. دیاگرام انرژی پتانسیل برای این واکنش نشان میدهد که حالت گذار (TS)، بالاترین نقطه در مسیر واکنشدهنده به فرآورده است.
اگر با دقت به پیشرفت یک واکنش نگاه کنید، به نکته قابل توجهی برمیخورید. هستهدوست که ذرهای غنی از الکترون است باید به گونهای با الکتروندوست برخورد و برهمکنش داشته باشد که جهت آن در پشت محل گروه ترک کننده قرار گیرد. در صورتیکه این برخورد از روبرو باشد، واکنش انجام نخواهد شد.
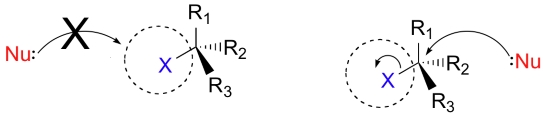
نتیجه این برهمکنش آن است که «کنفیگراسیون» (Configuration) فضایی اتم کربن به هنگام پیشرفت واکنش، وارونه میشود. به عبارت دیگر، مولکول وارونه خواهد شد. در حالت گذار، کربن الکتروندوست و سه گروه استخلافی R، همگی بر روی یک صفحه قرار دارند.
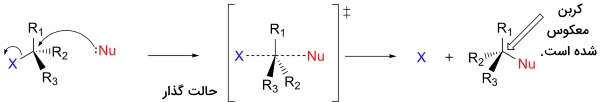
این بدان معنی است که مکانیسم ، به طور ذاتی «فضاگزین» (Stereoselective) است. زمانی که جانشینی در یک «مرکز فضایی» (Stereocenter) صورت بگیرد، با اطمینان، کنفیگراسیون (آرایش) فضایی فرآورده را پیشبینی خواهیم کرد.
جابجایی هسته دوست تفکیکی: واکنش
مدل دوم در واکنش جابجایی هسته دوست موسوم به «تفکیکی» (Dissociative) یا است.
در تصویر زیر میبینید که قبل از نزدیک شدن الکتروندوست، در ابتدا پیوند شکسته میشود.
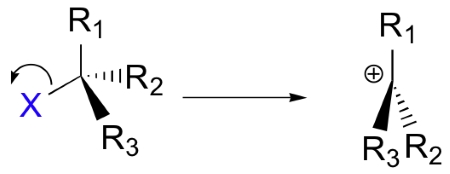
در اثر این اتفاق، یک کربوکاتیون ایجاد میشود زیرا با توجه به اینکه کربن مرکزی، تنها سه پیوند خواهد داشت، بار قراردادی را کسب میکند. کربوکاتیون شامل یک اوربیتال خالی p است. در مرحله دوم واکنش، الکتروندوست با اوربیتال خالی برهمکنش انجام میدهد (حمله میکند) تا یک پیوند جدید ایجاد کند و به شکل چهاروجهی خود بازگردد.

در مکانیسم قبل دیدیم که کربن مرکزی وارونه شد. این سوال پیش میآید که در خصوص مکانیسم دوم، آرایش فضایی چگونه خواهد بود. در مکانیسم نشان داده شده در بالا، پیش از حمله نوکلئوفیل، گروه ترک کننده به طور کامل تفکیک خواهد شد. با توجه به اینکه در این شرایط، گروه ترک کنندهای وجود ندارد، هستهدوست میتواند از هر دو طرف با کربوکاتیون برهمکنش انجام دهد. بنابراین، راسمیک شدن در کربن مرکزی خواهیم داشت. به طور مثال، انتظار میرود که آلکیل برمید در تصویر زیر، مخلوط راسمیک از الکلهای R و S با مکانیسم بدست دهد. در این واکنش، آب به عنوان هستهدوست عمل میکند.

در حالیکه تمامی واکنشهای غیرآنزیمی، فضاگزین نیستند، خواهیم دید که واکنشهای آنزیمی خواه به صورت یا ، همواره فضا گزین هستند. نتیجه مستقیم واکنش جابجایی هستهدوستی آنزیمی به طور معمول به صورت وارونگی کنفیگراسیون خواهد بود چراکه در بیشتر موارد، گروه ترک کننده در «جایگاه فعال» (Active Site) آنزیم به اندازه کافی باقی میماند تا از برهمکنش هستهدوستی در آن بخش جلوگیری کند.
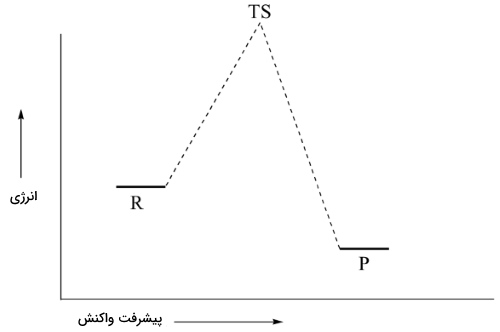
بسیاری از واکنشهای مهم آلی، به صورت تکمرحلهای انجام نمیگیرند بلکه مجموعهای از دو یا چند مرحله در تشکیل و شکستن پیوندها هستند. این مراحل، شامل تشکیل مواد واسطی هستند که در نظریه حالت گذار مورد بررسی قرار گرفتند. در مکانیسم ، کربوکاتیونها مواد واسط واکنش هستند. دیاگرام انرژی پتانسیل برای مکانیسم نشان میدهد که کربوکاتیونهای واسط را میتوان به عنوان باریکهای در مسیر واکنش در نظر گرفت که انرژی آن از واکنشدهندهها و فرآوردهها بیشتر اما از حالات گذار کمتر است.
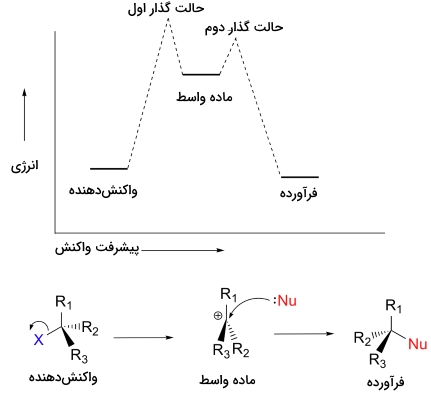
مرحله اول واکنش بالا، سرعت بسیار کمتری نسبت به دو مرحله دیگر دارد و بنابراین به عنوان مرحله تعیین کننده سرعت باید در نظر گرفته شود. این مورد را به راحتی در نمودار بالا میتوان تشخیص داد زیرا انرژی فعالسازی برای مرحله اول، بیشتر از دو مرحله دیگر است. لازم به ذکر است که مکانیسم ، از سینتیک مرتبه اول پیروی میکند چراکه مرحله تعیین کننده سرعت، ناشی از برخورد دو مولکول نیست بلکه شامل تقسیم شدن یک مولکول است.
مثال جهت پیشبینی سرعت واکنش در مکانیسمهای مختلف
دو واکنش جابجایی هستهدوست زیر را در نظر بگیرید که به صورت غیر کاتالیستی انجام میشوند. فرض کنید که واکنش A به صورت و واکنش B به صورت باشند. در هر حالت پیشبینی کنید که اگر تمامی شرایط ثابت باشند اما غلظت هستهدوست، دو برابر شود، سرعت واکنش چه تغییری خواهد کرد.
واکنش A به صورت تکمرحلهای انجام میشود که در حقیقت، شامل برخورد بین دو ذره است. بنابراین، اگر غلظت نوکلئوفیل در محلول، دو برابر شود، سرعت واکنش نیز باید دو برابر افزایش یابد. واکنش دوم، نوعی واکنش دو مرحلهای است. مرحله اول - شکستن پیوند - با سرعت آهسته انجام میشود و در نتیجه، تعیین کننده سرعت خواهد بود و در آن هیچ اثری از نوکلئوفیل نیست. بنابراین، تغییر غلظت نوکلئوفیل نباید تاثیری بر سرعت واکنش داشته باشد. به عبارت دیگر، اگر غلظت دو برابر شود، سرعت مرحله دوم نیز دو برابر خواهد شد اما مرحله آهستهتر (اول) تغییری نخواهد کرد. در نتیجه، سرعت کلی واکنش، تغییری نمیکند.
بسیاری از واکنشهای به دستهای موسوم به «حلالکافت» (Solvolysis) تعلق دارند که در آنها، یک مولکول حلال به عنوان هستهدوست در واکنش شرکت میکند. مکانیسم واکنش آلیل برمید در متانول، نمونهای از واکنشی است که به آن «متانکافت» (Methanolysis) یا متانولیز میگویند. اگر حلال در این واکنش، آب بود، نام هیدرولیز را به آن اختصاص میدادیم.
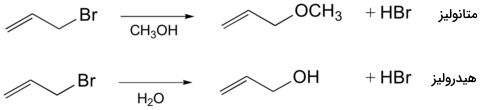
با توجه به اینکه آب و الکل از جمله هستهدوستهای ضعیف به شمار میآیند، در مکانیسم شرکت نمیکنند.
واکنش جانشینی هسته دوست در کربن هیبرید شده
قبل از ادامه باید به یک نکته مهم اشاره کنیم. واکنش جانشینی هسته دوست در کربن هیبرید شده انجام میشود و به محل اتصال گروه ترک کننده در کربن هیبرید شده ارتباطی ندارد.
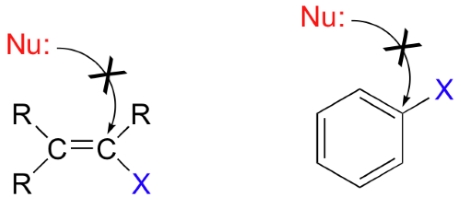
قدرت و طول پیوند در کربن هیبرید شده به طور ذاتی کوتاهتر و قویتر از است به این معنی که که پیوند ، سختتر شکسته میشود. وقوع مکانیسم نیز احتمال کمتری دارد چراکه کربن الکتروندوست به کمک چگالی الکترونی در پیوند p، از حمله هستهدوست، محافظت میشود.
واکنش نیز بسیار غیرمحتمل است زیرا ماده واسط حاصل، یعنی کربوکاتیون، بسیار ناپایدار خواهد بود. در ادمه قصد داریم تا به یک عضو اساسی در واکنش جانشینی هستهدوست یعنی نوکلئوفیل بپردازیم.
هسته دوست
به عنوان یک قانون کلی، واکنش جانشینی هسته دوست، شامل هستهدوستهای قوی، با مکانیسم انجام میگیرد درحالی هستهدوستهای ضعیف، به صورت مکانیسم هستند. حال این سوال پیش میآید که چه چیز سبب میشود که یک گروه، هستهدوست، ضعیف یا قوی باشد. گروههای عاملی هستهدوست، آنهایی هستند که اتمهایی غنی از الکترون داشته و این قابلیت را داشته باشند که برای ایجاد یک پیوند کووالانسی جدید، یک جفتالکترون را تامین کنند. در شیمی آلی و آزمایشگاه، معمولترین هستهدوستها عبارتند از:
همچنین، معمولترین گروههای عاملی هستهدوست در زیر آورده شدهاند:
- آب
- الکل
- فنول
- آمین
- تیول
- کربوکسیلات
البته کربنها نیز میتوانند به عنوان هستهدوست شناخته شوند چراکه در غیر اینصورت، پیوندهای جدید کربن-کربن در سنتز مولکولهای آلی بزرگ همچون DNA یا اسیدهای چرب رخ نمیداد. زمانی که در خصوص هستهدوستها صحبت میکنیم، اولین چیزی که باید به آن توجه کنیم این است که در بیشتر موارد، غنای الکترونی باعث میشود تا هستهدوست، خاصیت بازی داشته باشد. به عبارت دیگر، هستهدوستها میتوانند باز و بازها نیز میتوانند هستهدوست باشند.
حالات پروتون دهی و هسته دوستی
حالت پروتوندهی یک اتم هستهدوست، تاثیر بسیار زیادی بر «هستهدوستی» (Nucleophilicity) آن دارد. این نوع از بیان در حقیقت، حسی شهودی به دست میدهد به این معنی که یک یون هیدروکسید، هستهدوستی و به دنبال آن خاصیت بازی بیشتری نسبت به مولکول آب دارد زیرا اکسیژن با بار منفی در یون هیدروکسید، چگالی الکترونی بیشتری را نسبت به اتم اکسیژن در مولکول آب خنثی شامل میشود. در عمل، یک یون هیدروکسید نسبت به مولکول آب، واکنش سریعتری (در حدود 10000 بار سریعتر) را با متیل برمید در مکانیسم خواهد داشت. در مثالی دیگر میتوان به یک آمین خنثی اشاره کرد که هستهدوست است اما کاتیون آمونیوم پروتوندهی شده یک هستهدوست نیست. به همین دلیل، آنزیمهایی که در واکنشهای کاتالیستی هستهدوست شرکت میکنند به طور معمول یک زنجیر جانبی شامل آمینواسید دارند که در محلی قرار گرفتهاند تا پروتون را با آغاز برهمکنش (حمله) هستهدوست از اتم هستهدوست دریافت کنند.

بسته به نوع واکنش مورد بحث، از دست دادن پروتون (دپروتوناسیون) یک هستهدوست ممکن است قبل، حین یا بعد از حمله هستهدوست اتفاق بیافتد. البته به طور کلی در واکنشهای آنزیمی اینگونه تصویر میشود که دپروتوناسیون و حمله هستهدوستی به طور همزمان انجام میشوند.
روندهای تناوبی و اثرات حلال در هسته دوستی
روندهای تناوبی قابل پیشبینی را میتوان در هستهدوستی مشاهده کرد. اگر در جدول تناوبی، از چپ به راست در تناوب دوم حرکت کنیم، روند هستهدوستی مشابه با روند بازی خواهد بود. دلیل این روند افقی نیز همچون دلیل روند بازی است. هرقدر الکترونگاتیوی یک اتم بیشتر باشد، الکترونها با قدرت بیشتری نگهداشته میشوند و توانایی دهندگی الکترون برای تشکیل یک پیوند جدید را نخواهند داشت. این روند افقی همچنین بیان میکند با وجود اینکه آمینها و الکلها هردو در آزمایشگاه و واکنشهای بیوشیمی، رفتار هستهدوست دارند اما آمینها، هستهدوستتر از الکلها هستند.

در هر گروه از بالا به پایین، خاصیت بازی اتمها در جدول تناوبی کاهش پیدا میکند. به طور مثال، یونهای تیولات، خاصیت بازی کمتری نسبت به یونهای آلکوکسید دارند. همچنین در مثالی دیگر میتوان گفت یون برمید، خاصیت بازی کمتری نسبت به یون کلرید دارد. توجه داشته باشید که این روند را همچنین میتوان به کمک افزایش اندازه ابر الکترونی اطراف یون نیز توضیح داد به این صورت که چگالی الکترونی ذاتی در بار منفی، در مساحت بیشتری پخش خواهد شد و موجب افزایش پایداری و به دنبال آن، کاهش خاصیت بازی خواهد بود.
روند تناوبی عمودی در هسته دوستی
روند عمودی هستهدوستی، قدری پیچیدهتر از روند بازی است و به حلال واکنش بستگی دارد و هستهدوستی ممکن است روند متفاوتی را از خود نشان دهد. مثال ساده مکانیسم را در تصویر زیر در نظر بگیرید.
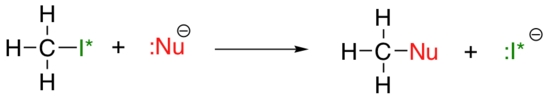
در تصویر بالا، یک یون هالید همچون فلوئور، کلر، برم یا ید است و گروه ترککننده هم یک ایزوتوپ رادیواکتیو ید به شمار میآید.
اگر این واکنش در یک «حلال پروتونی» (Protic Solvent) انجام شود و ید یک هستهدوست باشد، واکنش، بیشترین سرعت را خواهد داشت اما اگر هستهدوست، فلوئور باشد، آهستهترین سرعت واکنش را خواهیم داشت. این امر نشاندهنده قدرت نسبی یک هستهدوست است.
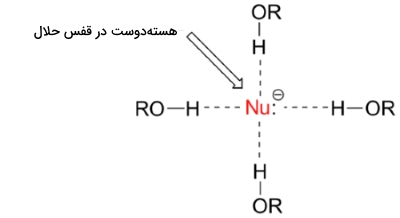
البته این مورد، مفهومی مقابل روند تناوبی عمودی در خاصیت بازی دارد. به یاد داشته باشید که در اینجا، واکنشهای شامل حلال پروتونی همچون اتانول را بررسی میکنیم. یک حلال پروتونی، به حلالی میگویند که هیدروژن متصل به اکسیژن یا نیتروژن داشته باشند که از نمونههای آن میتوان به آب، متانول و اتانول اشاره کرد. حلالهای پروتونی، برهمکنشهای بسیار قوی یوندوقطبی با هستهدوست منفی ایجاد میکنند. با این کار، در اطراف هستهدوست یک «قفس حلال» (Solvent Cage) بوجود میآید.
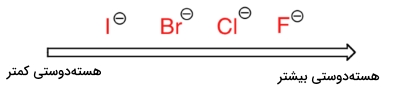
برای اینکه یک هستهدوست بتواند با یک الکتروندوست برهمکنش انجام دهد باید حداقل در یک بخش، قفس حلال را آزاد کند. جفتالکترون ناپیوندی در یون ید با خاصیت بازی کمتر، با شدت کمتری با مولکولهای حلال پروتونی برهمکنش انجام میدهد و بنابراین، نوکلئوفیل ید نسبت به یون فلوئور، توانایی بیشتری برای شکستن این قفس خواهد داشت. اگر به یک حلال غیرپروتونی همچون استون رجوع کنیم که در آن، دوقطبی مولکولی داریم اما هیچ هیدروژنی به اکسیژن یا نیتروژن پیوند ندارد، خوهیم دید که یون فلوراید، قویترین و یون ید، ضعیفترین هسته دوست خواهد بود.
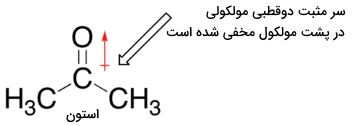
دلیل این امر این است که در یک حلال غیرپروتونی، برهمکنش یوندوقطبی بین حلال و هستهدوست بسیار ضعیف است. سر مثبت دوقطبی حلال، در پشت مولکول قرار دارد و بنابراین، نسبت به بار منفی هستهدوست، پوشیده شده است. هرقدر برهمکنش حلال-هستهدوست ضعیفتر باشد به این معنی است که قفس حلال ضعیفتری خواهیم داشت و بنابراین، اثر حلال، اهمیت کمتری پیدا خواهد کرد و یون فلوراید با خاصیت بازی بیشتری که دارد، هستهدوست بهتری به شمار میآید.
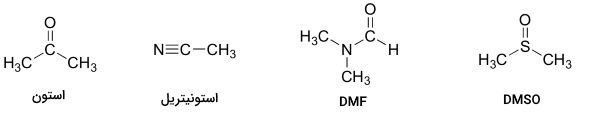
سوالی که در اینجا پیش میآید این است که چرا از یک حلال ناقطبی همچون هگزان استفاده نکنیم تا قفس حلال به کلی حذف شود. پاسخ به این سوال، بسیار ساده است. هستهدوست برای انجام واکنش با سرعتی مناسب با الکتروندوست، باید در یک محلول وجود داشته باشند و حلالی همچون هگزان نمیتواند یک هستهدوست باردار یا به شدت قطبی را در خود حل کند. به همین دلیل است که شیمیدانها از محلولهای غیرپروتونی قطبی در واکنشهای جانشینی هستهدوست استفاده میکنند زیرا به اندازه کافی قطبی هستند تا هستهدوست را در خود حل کنند اما این قطبیت به اندازهای نیست که قفس حلال غیرقابل نفوذ ایجاد شود. علاوه بر استون، سه نوع دیگر از حلالهای غیرپروتونی قطبی عبارتند از:
- استونیتریل
- دیمتیل فرمامید (DMF)
- دیمتیل سولفوکسید (DMSO)
در علم بیولوژی و زمانی که حلالی پروتونی همچون آب داشته باشیم، مهمترین پیامدی که روندهای تناوبی در هستهدوستی دارند این است که تیولها، هستهدوستهایی قویتر از الکلها خواهند بود. به طور مثال، آمینو اسید «سیستئین» (Cysteine) یک نوکلئوفیل قدرتمند در واکنشهای آنزیمی است.
اثر رزونانس بر هستهدوستی
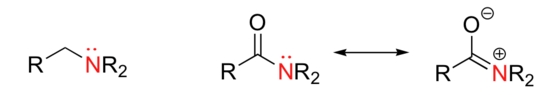
زمانی که هستهدوستی ذاتی مولکولهای مختلف را با یکدیگر بررسی میکنیم، باید اثر رزونانس را نیز لحاظ کنیم. اگر جفتالکترون ناپیوندی در یک هترواتم توسط پدیده رزونانس، «نامتمرکز» (Delocalized) شده باشد، به طور ذاتی، واکنشپذیری آن کمتر و به دنبال آن، هستهدوستی و خاصیت بازی نیز کمتر خواهد بود.
به طور مثال، یک یون آلکوکسید نسبت به گروه کربوکسیلات، خاصیت هستهدوستی بیشتری دارد. این درحالیست که در هر دو حالت، اتم هستهدوست، اکسیژن با بار منفی خواهد بود. در آلکوکسید، بار منفی بر روی اکسیژن متمرکز شده درحالیکه در کربوکسیلات، بار بر روی دو اتم اکسیژن از طریق رزونانس، نامتمرکز شده است.

اتم نیتروژن در یک آمید، هستهدوستی کمتری نسبت به نیتروژن در آمین دارد. این امر به دلیل پایداری رزونانسی جفتالکترون ناپیوندی نیتروژن در گروه عاملی آمید است.
ممانعت فضایی در هسته دوستی
«ممانعت فضایی» (Steric Hindrance) را به هنگام بررسی هستهدوستی نیز باید در نظر گرفت. به طور مثال، «ترت بوتانول» (Tert-Butanol) به عنوان یک هستهدوست، قدرت کمتری نسبت به متانول دارد. در حقیقت، حجم توده گروه متیل در الکل نوع سوم، به خوبی از حمله اکسیژن نوکلئوفیل جلوگیری میکند و سرعت واکنش را به شدت کاهش میدهد.

جمع بندی
در این آموزش به بررسی واکنش جانشینی یگانه پرداختیم و از این طریق، واکنشهای جانشینی هسته دوست را مورد بررسی قرار دادیم که از آن جمله، بررسی مکانیسم واکنشهای و بود. همچنین به کمک ارائه یک مثال، سرعت واکنش در مکانیسمهای مختلف را مورد بررسی قرار دادیم. علاوه بر این موارد، دیدیم که اگر در یک هترواتم، جفت الکترون نامتمرکز داشته باشیم، واکنشپذیری کمتری خواهیم داشت و در پایان نیز اثر ممانعت فضایی را بر هستهدوستی بررسی کردیم و دیدیم که چطور حجم توده در یک گروه عاملی، بر واکنشپذیری تاثیرگذار خواهد بود.










سپاس ا شما..مطالبتون بسیار تکان دهنده بود…
سلام وقت بخیر امکانش هست در مورد واکنش های هسته دوست پیریدین هم توضیح بدید ساختارش به چه شکل میشه؟
سلام .ممنون از مطالب مفیدی که ارائه دادید. بسیار جامع و کامل و بسیار کاربردی بودند. سپاسگزارم.
سلام و عرض ادب
خسته نباشید بابت این مطالب مفید
قدرت Nucleophile و رابطه اش با pKa چیه و conjugate acid چیه و رابطه اش با هسته دوستی و Nucleophile چی هست
سلام و عرض ادب . با توجه به اینکه یون سدیم باز اسید لوییس (الکتروفیل)هست و آب آمفوتری که در حضور یون سدیم نقش باز دارد(نوکلئوفیل)چرا باهم واکنش اسید و باز نمیدهند و پیوند کئوردینانس ایجاد نمیشه ؟
با سلام؛
پیشنهاد میکنیم برای آشنایی با پیوندهای داتیو و اسید و باز لویییس، مطالب «پیوند داتیو — به زبان ساده» و «اسید و باز چیست — به زبان ساده» را مطالعه کنید. البته یون سدیم نیز کمپلکسهای ضعیفی را تشکیل میدهد که از طریق طیفسنجی مورد بررسی قرار میگیرد که در حد مطالعات دانشگاهی میتوان به آن مراجعه کرد.
با تشکر
سلام.خسته نباشید چرا با اینکه هیدروژن های آب الکتروفیل هستند و اکسیژن آن نوکلئوفیل ولی آب رو یک نوکلئوفیل قوی میدونن؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. عوامل مختلفی را میتوان برای هستهدوستی یک مولکول در نظر گرفت که از جمله آنها میتوان به الکترونگاتیوی، بار الکتریکی و ممانعت فضایی اشاره کرد. مولکول آب، مولکولی قطبی است که بار جزئی منفی بر روی اتمهای اکسیژن آن قرار دارد. ممانعت فضایی به دلیل وجود دو هیدروژن متصل، عامل تاثیرگذاری نیست. با توجه به موارد گفته شده، میبینیم که دو عامل در هستهدوستی آن دخیل هستند. بنابراین، در صورتیکه هیچ هستهدوستی وجود نداشته باشد، مولکول آب را میتوان یک نوکلئوفیل دانست.
با تشکر