آب اکسیژنه چیست؟ — به زبان ساده

آب اکسیژنه یا هیدروژن پراکسید با فرمول $$H_2O_2$$، مایعی به رنگ آبی کمرنگ و کمی چگالتر از آب است و نوعی اسید ضعیف به شمار میآید. آب اکسیژنه اکسندهای قوی محسوب میشود و به همین دلیل از آن به عنوان ماده سفیدکننده بهره میگیرند. آب اکسیژنه را به عنوان سادهترین پراکسید یعنی ترکیبی با پیوند یگانه اکسیژن-اکسیژن میشناسند. این ماده، علاوه بر کاربردهای ذکر شده، به عنوان ماده ضدعفونی کننده نیز کاربرد دارد. لازم به ذکر است که از محلولهای غلیظ هیدروژن پراکسید موسوم به «High-test peroxide»، به عنوان سوخت موشک استفاده میکنند.
خواص آب اکسیژنه
نقطه جوش آب اکسیژنه را به کمک برونیابی در حدود 150/2 درجه سانتیگراد ذکر کردهاند. این مقدار، حدود ۵۰ درجه سانتیگراد بیشتر از نقطه جوش آب است. البته در عمل، زمانی که آب اکسیژنه را حرارت بدهیم، قبل از رسیدن به این دما، تحت تجزیه حرارتی و به صورت انفجاری، تجزیه خواهد شد. آب اکسیژنه را به طور ایمن و در فشار کاهشیافته، تقطیر میکنند.
محلول آبی آب اکسیژنه
در محلولهای آبی، هیدروژن پراکسید با نوع خالص آن تفاوت دارد. دلیل این تفاوت را باید به علت وجود پیوند هیدروژنی بین مولکولهای آب و هیدروژن پراکسید دانست. آب اکسیژنه و آب خالص، یک مخلوط «یوتکتیک» (Eutectic) را بوجود میآورند. نقطه انجماد چنین مخلوطی برابر با $$- 56 C ^ \circ$$ است. نقطه انجماد مخلوط حاصل، از نقطه انجماد هریک از مواد تشکیلدهنده آن پایینتر است. در حقیقت، نقطه انجماد آب خالص، ۰ درجه سانتیگراد و نقطه انجماد هیدروژن پراکسید، 0/43- درجه سانتیگراد ذکر میشود. این مخلوط، نقطه جوشی برابر با 114 درجه سانتیگراد دارد که از نقطه جوش آب اکسیژنه - برابر با 125/1 درجه سانتیگراد - کمتر و از نقطه جوش آب، بیشتر است.
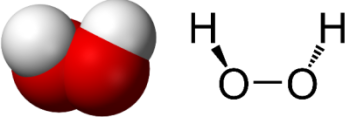
ساختار هیدروژن پراکسید
آب اکسیژنه مولکولی «غیرمسطح» (nonplanar) است و با وجود اینکه پیوند اکسیژن-اکسیژن از نوع پیوند یگانه دارد اما این پیوند برای دوران، ممانعتی با انرژی $$29.45\ kJ / mol$$ از خود نشان میدهد. اگر بخواهیم مقایسهای انجام دهیم، باید گفت که «ممانعت دورانی» (Rotational Barrier) برای اتان در حدود $$12.5\ kJ / mol$$ است. این مقدار زیاد را به دلیل جاذبه الکترونهای ناپیوندی دو اتم اکسیژن ذکر میکنند.
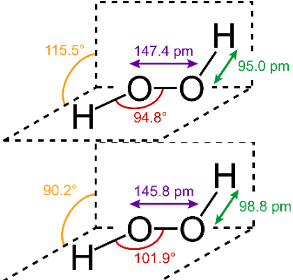
ساختار مولکولی بلور و گاز هیدروژن پراکسید با یکدیگر تفاوت دارند. این اختلاف در ساختار به دلیل عدم وجود پیوند هیدروژنی در حالت گازی ذکر میشود. در تصویر زیر، تفاوت این دو ساختار را مشاهده میکنید.
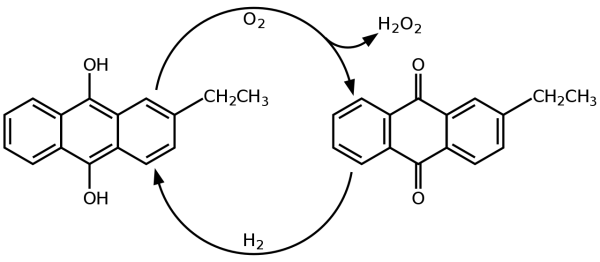
تولید آب اکسیژنه
در گذشته، آب اکسیژنه را به طریق صنعتی و به کمک هیدرولیز آمونیوم پرسولفات با فرمول $$\left(\mathrm{NH}_{4}\right)_{2} \mathrm{S}_{2} \mathrm{O}_{8}$$ تهیه میکردند. آمونیوم پرسولفات نیز از طریق الکترولیز محلول آمونیوم بیسولفات در سولفوریک اسید تهیه میشد. امروزه این ماده از واکنشهای کاتالیستی به تولید میرسانند. تصویر زیر، یک شمای کلی از فرآیند تولید آباکسیژنه را نشان میدهد.
واکنشهای هیدروژن پراکسید
در ادامه قصد داریم تا انواع واکنشها در آب اکسیژنه را بررسی کنیم.
واکنش تجزیه
هیدروژن پراکسید به لحاظ ترمودینامیکی ناپایدار است و با آنتالپی $$- 2884.5 kJ/kg$$ و آنتروپی $$70.5 \ \mathrm{J} /(\mathrm{mol} \cdot \mathrm{K})$$ به آب و اکسیژن تجزیه میشود.
سرعت این تجزیه با افزایش دما، غلظت و pH، افزایش پیدا میکند. به همین دلیل، محلولهای اسیدی خنک و رقیق، بیشترین پایداری را از خود نشان میدهند. واکنشهای تجزیه را به کمک ترکیبات مختلف میتوان کاتالیز کرد که از آنجمله میتوان به فلزات واسطه و ترکیبات آنها اشاره کرد.
واکنشهای ردوکس
بسته به میزان pH، هیدروژن پراکسید خواص اکسایشی و کاهشی از خود نشان میدهد. در یک محلول اسیدی، $$H_2O_2$$ به عنوان یکی از قویترین اکسندهها شناخته میشود که قدرتی بیش از کلر، دیاکسید کلر و پرمنگنات پتاسیم دارد. از مخلوط سولفوریک اسید و هیدروژن پراکسید برای از بین بردن لکهها در لوازم شیشهای آزمایشگاه بهره میگیرند. همچنین، از طریق واکنشهای کاتالیستی، هیدروژن پراکسید به رادیکالهای به شدت واکنشپذیر هیدروکسیل $$(. O H )$$ تبدیل میشوند.
در یک محلول بازی، آباکسیژنه میتواند بسیاری از یونهای معدنی را کاهش دهد. زمانی که این ماده به عنوان عامل کاهنده مورد استفاده قرار بگیرد، گاز اکسیژن تولید میکند. به طور مثال، به هنگام کاهش سدیم هیپوکلریت و پتاسیم پرمنگنات، گاز اکسیژن به تولید میرسد که از جمله روشهای آزمایشگاهی برای تولید اکسیژن به شمار میآید.
$$\begin{aligned}
&\mathrm{Na O Cl}+\mathrm{H}_{2} \mathrm{O}_{2} \rightarrow \mathrm{O}_{2}+\mathrm{Na Cl}+\mathrm{H}_{2} \mathrm{O}\\
&2 \mathrm{KMnO}_{4}+3 \mathrm{H}_{2} \mathrm{O}_{2} \rightarrow 2 \mathrm{MnO}_{2}+2 \mathrm{K OH}+2 \mathrm{H}_{2} \mathrm{O}+3 \mathrm{O}_{2}
\end{aligned}$$
واکنشهای معدنی
به طور معمول از آب اکسیژنه به عنوان عامل اکسنده استفاده میکنند. از نمونههای آن میتوان به اکسیداسیون تیواترها به سولفوکسیدها اشاره کرد.
$$\mathrm{P h}-\mathrm{S}-\mathrm{C H}_{3}+\mathrm{H}_{2} \mathrm{O}_{2} \rightarrow \mathrm{Ph}-\mathrm{S}(\mathrm{O})-\mathrm{C H}_{3}+\mathrm{H}_{2} \mathrm{O}$$
کاربردهای آب اکسیژنه
در این بخش، سایر کاربردهای هیدروژن پراکسید را مورد بررسی قرار خواهیم داد.
سفیدکننده
در حدود ۶۰ درصد تولید آب اکسیژنه در جهان به استفاده در صنایع چوب و کاغذ به عنوان ماده سفیدکننده اختصاص دارد. دومین کاربرد این ماده در تولید سدیم پرکربنات و سدیم پربورات است که به عنوان سفیدکننده ملایم در شستشوی لباسها بکار میروند. البته این مواد تنها در دمای بیش از ۶۰ درجه سانتیگراد کاربرد دارند اما با استفاده از مواد فعالساز، در دماهای پایینتر نیز میتوان از آنها استفاده کرد.
تولید ترکیبات آلی
آب اکسیژنه بمنظور تولید پراکسیدهای آلی همچون بنزوئیل پروکساید با فرمول $$C _ {14} H _ {10}O _ 4$$ مورد استفاده قرار میگیرد که در درمان آکنه موثر است. علاوه بر این، از هیدروژن پراکسید در تولید پروکسی اسیدها مانند پراستیک اسید و متا-کلورپروکسی بنزوئیک اسید بهره میگیرند.
مواد ضدعفونی کننده
از جمله دیگر کاربردهای هیدروژن پراکسید، بکارگیری آن در تصفیه فاضلابها بمنظور حذف ناخالصیهای آلی است. این کار از طریق آزاد کردن رادیکال آزاد هیدروکسیل انجام و موجب تخریب ترکیبات آلی همچون آروماتیکها و ترکیبات هالوژنه میشود. علاوه بر این، آب اکسیژنه قابلیت اکسید کردن ترکیبات شامل گوگرد را نیز دارد و از این طریق، بوی بد فاضلابها را کاهش میدهد.
از این ماده همچنین در ضدعفونی کردن ابزارآلات جراحی نیز بهره میگیرند. این ماده تاثیر زیادی نیز در از بین بردن ویروسها و باکتریها دارد. آب اکسیژنه را جایگزین مناسبی برای ضدعفونیکنندههای حاوی کلر میدانند زیرا در اثر واکنش، اکسیژن و آب آزاد میکند.
تاثیر مخرب بر زخمها
در گذشته از این ماده به علت دسترسی بالا و هزینه کم، در ضدعفونی کردن زخمها استفاده میشد. از آنجایی که این ماده، سلولهای پوستی جدید را تخریب میکند و موجب ایجاد «اسکار» (Scar) میشود، بهرهگیری از آن در ضدعفونی کردن زخمها منسوخ شده است.
چراغ اضطراری
واکنش هیدروژن پراکسید و فنیل اگزالات استر، خاصیت «نورتابی شیمیایی» (Chemiluminescence) ایجاد میکند که از آن در لامپهای میلهای بهره میگیرند.

اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی تجزیه ۱
- آلدهیدها — به زبان ساده
- پتانسیل شیمیایی — به زبان ساده
^^










