گروه عاملی کربونیل در شیمی چیست؟ – به زبان ساده + کاربرد و ساختار
در این مطلب از مجله فرادرس میخواهیم با ترکیباتی در شیمی آلی آشنا شویم که دارای گروه عاملی کربونیل در ساختار خود هستند. آشنایی با ترکیبات گروه کربونیل از این جهت دارای اهمیت است که در تعداد بسیار زیادی از ترکیبات آلی شاهد حضور آنها و گروههای عاملی نشات گرفته از آنها هستیم. کربونیل گروه عاملی در شیمی آلی است که مشخصه آن حضور یک کربن متصل به اکسیژن به کمک پیوند دوگانه است. در این مطلب ابتدا به بررسی چیستی کربونیل میپردازیم، سپس با ترکیبات مرتبط با آن آشنا میشویم. در نهایت نیز برای مرور آموختههای خود تعدادی تمرین را مورد بررسی قرار میدهیم.
کربونیل چیست ؟
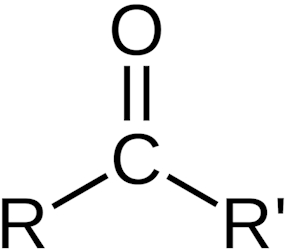
گروه «کربونیل» (Carbonyl) در شیمی نوعی از گروه عاملی با فرمول $$C=O$$ است که از یک اتم کربن در پیوند دوگانه با یک اکسیژن تشکیل شده است. کربونیلها به دستههای متنوعی تقسیمبندی میشوند.
کربونیل را میتوان در بسیاری از ترکیبات آلی بهخصوص هیدروکربنهای آروماتیک پیدا کرد. این گروه را میتوانید در تصویر زیر مشاهده کنید.
ترکیبات کربونیل چیست؟
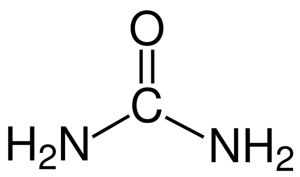
به ترکیباتی که در ساختار خود دارای گروه عاملی $$ C=O $$ باشند، «ترکیبات کربونیل» (Carbonyl Compounds) گفته میشود. توجه داشته باشید که هیبریداسیون کربن و اکسیژن در این ترکیبات همیشه بهصورت $$sp^2$$ است. از جمله ترکیبات آلی که در ساختار خود کربونیل دارند میتوان به اوره و کارباماتها اشاره کرد. ساختار اوره را در تصویر زیر مشاهده میکنید.
پیوند دوگانه کربونیل
همانطور که در تصویر بالا مشاهده کردید در این ترکیبات شاهد پیوندی دوگانه هستیم که تفاوت بسیاری با پیوند دوگانه موجود در «آلکن» (Alken) دارد. پیوند دوگانه کربن-کربن در آلکن واکنشپذیری بسیار کمتری دارد، در حالی که واکنشپذیری پیوند دوگانه کربن-اکسیژن در کربونیل به دلیل الکترونگاتیوی اکسیژن و وجود دو «جفت الکترون غیرپیوندی» (Lone Pairs Of Electron) روی آن است. این دو جفت الکترون را میتوانید در تصویر زیر مشاهده کنید.
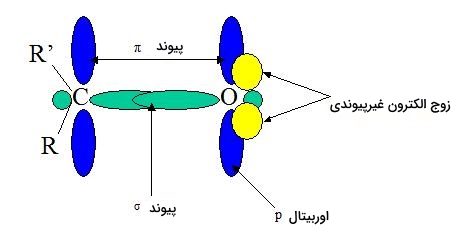
یک جفت الکترون غیرپیوندی اکسیژن روی اوربیتال $$2s$$ و دیگری روی اوربیتال $$2p$$ قرار دارد که محور آن جهتگیری عمود بر جهتگیری اوربیتالهای «پای» (Pi) دارد. ویژگیهایی که از این ترکیبات مشاهده میشود به ساختار الکترونیکی و موقعیت هندسی آنها بستگی دارد. برای مثال الکترونگاتیوی اکسیژن، پیوند پای را نیز قطبی میکند و به این طریق استخلاف پیوند یگانه متصل به آن الکترونکشنده خواهد بود.
مشخصات پیوند دوگانه کربونیل
طول پیوند دوگانه در گروه کربونیل حدود ۱٫۲ آنگستروم و قدرت پیوند آن بین ۱۷۶ تا ۱۷۹ کیلوکالری بر مول است. میتوان طول پیوند کربونیل را به میزان قطبیت آن ربط دارد، بهصورتی که هرچه طول پیوند بیشتر باشد، مقدار قطبیت آن کمتر خواهد بود.
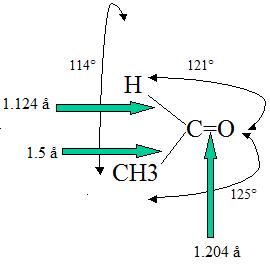
برای مثال به تصویر بالا دقت کنید. طول پیوند $$ C=O $$ در استالدهید بیشتر از طول پیوند در فرمالدهید است. البته در این مورد باید اثر القایی گروه $$CH_3$$ را نیز در نظر داشته باشیم.
قطبیت در کربونیل
همانطور که پیشتر اشاره کردیم، روی اکسیژن گروه کربونیل، دو زوجالکترون غیرپیوندی قرار دارد که باعث میشود مقدار الکترونگاتیوی اکسیژن بیشتر از کربن باشد. در این حالت کربن کربونیل به مقدار جزئی مثبت (الکتروندوست) و اکسيژن آن به مقدار جزئی منفی (هستهدوست) است و میتوان اینطور بیان کرد که کربونیلها بهطور کلی، مولکولهایی قطبی هستند.
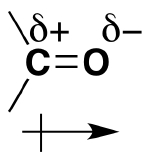
همانطور که در تصویر بالا مشاهده میکنید، برای نمایش قطبیت روی پیوندها از دلتای کوچکی استفاده میکنیم که به همراه علامت مثبت و منفی، نشاندهنده بار جزئی مثبت و منفی است.
قطبی بودن گروه کربونیل روی نقطه جوش آلدهیدها و کتونها نیز موثر است، بهصورتی که مقدار آن از هیدروکربنها بیشتر خواهد بود. از بین ترکیبات کربونیل، آمیدها از بقیه پایدارتر هستند زیرا وجود رزونانس بین نیتروژن-کربن و کربن-اکسیژن باعث پایداری آن میشود. در بخش پیش رو، در مورد هر کدام از این دسته ترکیبات صحبت خواهیم کرد.
ساختارهای کربونیل
کربونیل گروه عاملی در شیمی است که زیرشاخههای فراوانی دارد. ترکیباتی که در هر کدام از این زیرشاخهها قرار میگیرند با یکدیگر ویژگیهای مشترکی دارند.
به عبارتی با توجه به استخلافهای متصل به کربونیل میتوان آنها را به دستههای متنوعی طبقهبندی کرد که در جدول زیر برخی از آنها را مشاهده میکنید.
| ترکیب | ساختار | فرمول عمومی |
| آلدهید |
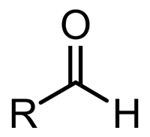 | $$ RCHO$$ |
| کتون |
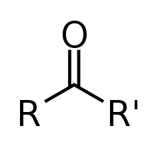 | $$ RCOR'$$ |
| کربوکسیلیک اسید |
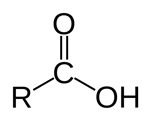 | $$ RCOOH$$ |
| استر |
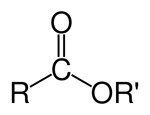 | $$ RCOOR'$$ |
| آمید |
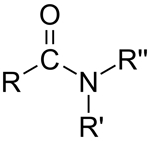 | $$ RCONR'R''$$ |
| انون |
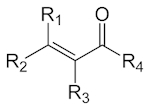 | $$ RC(O)C(R')CR''R''' $$ |
| آسیل هالید |
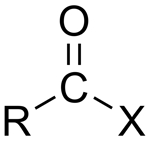 | $$ RCOX$$ |
| اسید انیدرید | 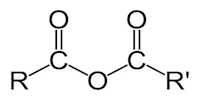 | $$( RCO)_2O $$ |
در ادامه در مورد هر کدام از این ترکیبات حاوی ساختارهای کربونیل صحبت خواهیم کرد.
آلدهید
همانطور که در تصویر جدول بالا نیز مشاهده کردید، کربونیل موجود در ترکیبات «آلدهید» (Aldehyde) دارای یک گروه متغیر $$R$$ متصل به کربن کربونیل است. آلدهید تنها دستهای از ترکیبات است که در آن گروه کربونیل بهصورت انتهایی حضور دارد، یعنی در انتهای زنجیره هیدروکربنی واقع شده است.
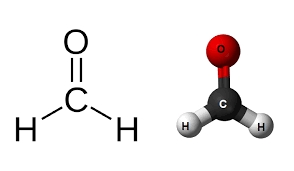
بسیاری از ترکیبهای آلدهیدی در دمای اتاق مایعاتی فرار و اشتعالپذیر هستند. سادهترین آلدهید، فرمالدهید نامیده میشود که در آن گروه متغیر $$R$$ تنها یک اتم هیدروژن است. این مولکول در دمای اتاق به فرم گازی حضور دارد که ساختار آن را در تصویر بالا مشاهده میکنید.
ویژگی آلدهید
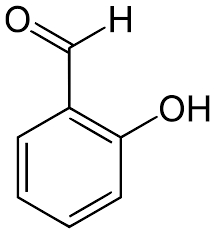
آلدهیدهای سبکتر (با تعداد اتم کربن پایینتر) بوی ناخوشایندی دارند. این مورد برای آلدهیدهای سنگین صدق نمیکند. در واقع بسیاری از آلدهیدهای بزرگ آروماتیک در صنایع عطرسازی کاربرد دارند. برای مثال به ساختار زیر توجه کنید. این مولکول از گیاه «عروس چمنزار اروپایی» (Meadow Sweet) با نام شیمیایی سالیسیل آلدهید به دست میآيد.
نقطه جوش آلدهیدها به دلیل ماهیت قطبی مولکول، بالاتر از آلکانهای ناقطبی است. همچنین آلدهیدهای سبک مانند متانال، اتانال و پروپانال با آب امتزاجپذیر هستند زیرا مانند تصویر زیر با آن پیوند هیدروژنی تشکیل میدهند.
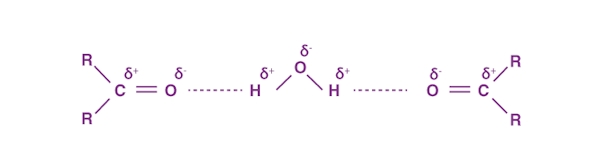
با افزایش جرم مولکولی به دلیل طولانی شدن زنجیره آلکیلی ناقطبی، انحلالپذیری آلدهیدها به شدت کاهش پیدا میکند. با این حال تمامی آلدهیدها در حلالهای آلی مانند بنزن حل میشوند.
کاربرد آلدهید
آلدهیدها حدواسطی بسیار مهم در شیمی به شمار میآیند که از آنها در تولید رزینها، نرمکنندهها، حلالها و رنگدانهها استفاده میشود. ترکیبات آلدهید در صنایع متنوعی مانند نساجی، غذایی، پلاستیک، چرم و شیمیایی مورد استفاده قرار میگیرند. همچنین از آلدهیدهای سنگینتر به دلیل رایحهای که از خود آزاد میکنند در صنعت عطر و ادکلن استفاده میشود. فرمالدهید کاربرد بسیار وسیعی به عنوان حلال و میکروبکش دارد.
نامگذاری آلدهید
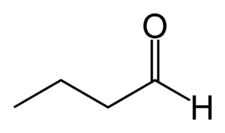
آلدهیدهای آسیلی و آلیفاتیک را میتوان با افزودن پسوند «ال» (al) به انتهای بلندترین زنجیر هیدروکربنی آنها نامگذاری کرد. برای مثال به مولکول زیر بوتانال میگوییم زیرا در زنجیره آن ۴ کربن وجود دارد و پسوند ال نیز به آن اضافه شده است.
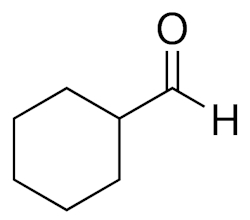
- زمانی که گروه عاملی آلدهید به حلقهای اضافه میشود باید به انتهای نام آن حلقه پسوند کربالدهید را اضافه کنیم. برای مثال به مولکول موجود در تصویر زیر توجه کنید که «سیکلوهگزان کربالدهید» نامیده میشود.
- همچنین برای برخی از ترکیبات آلدهیدی نام ویژهای وجود دارد که استفاده از آن در کنار نام آیوپاک آنها متدوال است. تعدادی از این ترکیبات آلدهیدی را در جدول زیر مشاهده میکنید.
| فرمول مولکولی | نام متدوال | نام آیوپاک |
| $$HCHO$$ | فرمالدهید | متانال |
| $$CH_3CHO$$ | استالدهید | اتانال |
| $$CH_3CH(CH_3)CHO$$ | ایزوبوتیرآلدهید | ۲-متیل پروپانال |
| $$CH_3CH=CHCHO$$ | کروتون آلدهید | ۲-بوتانال |
کتون
«کتونها» (Ketones) دستهای دیگر از ترکیباتی هستند که در ساختار خود گروه کربونیل دارند و با فرمول عمومی $$ RCOR'$$ شناخته میشوند. گروه کربونیل کتون، مانند آلدهید در انتهای ساختار آن قرار ندارد، به همین دلیل به آن، کربونیل میانی میگویند. زاویه پیوند در این ساختار تقریبا برابر با ۱۲۰ درجه است.
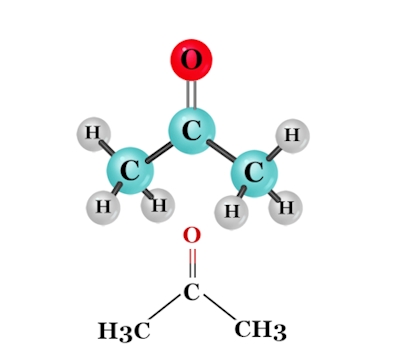
از آنجا که پیوند بین کربن و اکسیژن گروه کربونیل را قطبی میکند، کتونها در اکسیژن کربونیل خود الکتروندوست و در کربن کربونیل خود هستهدوست هستند. از مهمترین ترکیباتی کتونی میتوان به متیل کتون، سیکلوهگزانون و استون اشاره کرد که در تصویر بالا آورده شده است.
آمادهسازی کتون
از واکنش بین اسیدکلریدها با دیآلکیل کادمیوم میتوان به کتونها دست پیدا کرد. دیآلکیلها نیز از واکنشگر گرینیارد تولید میشوند. در زیر میتوانید واکنشهای مورد نظر را مشاهده کنید.
$$ 2R-Mg-X + CdCl_2 → R_2Cd + 2 Mg(X)Cl $$
$$ 2RCOCl + R_2Cd → 2R-CO-R + CdCl_2 $$
این روش برای تهیه مخلوطی از کتونها بسیار کارآمد است.
ویژگی کتون
کتونها به عنوان ترکیباتی که دارای گروه کربونیل هستند، ویژگیهایی مشابه با آلدهید از خود نشان میدهند. در این بخش میخواهیم به بررسی این ویژگیها و تفاوتها با موارد قبلی بپردازیم.
- کتونها نیز به دلیل حضور گروه قطبی کربونیل، ترکیباتی قطبی به شمار میآیند. به همین دلیل نیز نسبت به ترکیبات ناقطبی نقطه جوش بالاتری دارند.
- کتونها بر خلاف آلدهیدها توانایی برقراری پیوند هیدروژنی بین مولکولی را ندارند زیرا اتم هیدروژن متصل به اکسیژن در آنها با یک گروه متغیر $$R$$ جایگزین شده است.
- کتونها در مقایسه با الکلها و اترها دارای گشتاور دوقطبی بالایی هستند که به دلیل جابهجایی الکترونهای پای رخ میدهد.
- کتونها با «هیدروژن سیانید» با فرمول شیمیایی (HCN) وارد واکنش میشوند و «سیانو هیدرین» با فرمول عمومی $$R_2C(OH)CN$$ را به وجود میآورد. این واکنش معمولا در حضور باز به عنوان کاتالیزور انجام میشود. در غیاب باز این واکنش شیمیایی بسیار کند پیشروی میکند.
- بسیاری از کتونها در واکنش با «سدیم بیسولفیت» با فرمول شیمیایی $$NaHSO_3$$، محصولات افزایشی بیسولفیتی را به وجود میآورند.
نامگذاری کتون
برای نامگذاری کتونها میتوان به روش زیر عمل کرد.
- برای نامگذاری کتونها به نام آلکان والد آنها، پسوند «انون» (anone) را اضافه میکنیم. توجه داشته باشید که چون کتون، کربونیل میانی است باید موقعیت قرارگیری گروه کربونیل در نام آن مشخص باشد. برای مثال به ساختار زیر توجه کنید که ۳-پنتانون نامیده میشود.
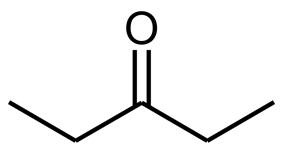
- روش دیگری نیز برای نامگذاری ترکیبات کتونی وجود دارد. در این روش گروههای آلکیلی متصل به گروه عاملی کتون نام برده میشوند و سپس به انتهای آنها واژه کتون را اضافه میکنیم. برای مثال ترکیب زیر را میتوان هم «بوتانون»، هم «متیل اتیل کتون» نامید.
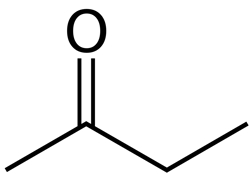
- مانند آلدهیدها، برخی از کتونها نیز نام متدوالی دارند که آنها را در جدول زیر به همراه نام آیوپاک آوردهایم.
| فرمول مولکولی | نام متداول | نام آیوپاک |
| $$CH_3C(O)CH_3$$ | استون | پروپانون |
| $$CH_3C(O)CH_2CH_3$$ | اتیل متیل کتون | بوتانون |
| $$CH_3CH_2C(O)CH_2CH_3$$ | دیاتیل کتون | پنتان-۳-اون |
| $$CH_3CH(CH_3)C(O)CH_3$$ | ایزوپروپیل متیل کتون | ۳-متیل بوتان-۲-اون |
کاربرد کتون
در فهرست زیر بهصورت مختصر به برخی از کاربردهای این ترکیبات دارای گروه عاملی کربونیل اشاره کردهایم.
- از پروپانون برای تولید پلیمرهایی مانند پلی(متیل متاکریلات) استفاده میشود.
- کتونها به عنوان حلال در واکنشهای سنتزی حضور دارند.
- استون و اتیل متیل کتون، حلالهایی هستند که در صنعت مورد استفاده قرار میگیرند.
کربوکسیلیک اسید
«کربوکسیلیک اسیدها» (Carboxylic Acids) ترکیباتی هستند که در ساختار خود گروه کربونیل متصل به $$OH$$ دارند. در این ترکیبات یک گروه متغیر $$R$$ نیز حضور دارد. در زیر یک کربوکسیلیک اسید را مشاهده میکنید. به گروه $$COOH$$ گروه عاملی «کربوکسیل» (Carboxyl) نیز گفته میشود.
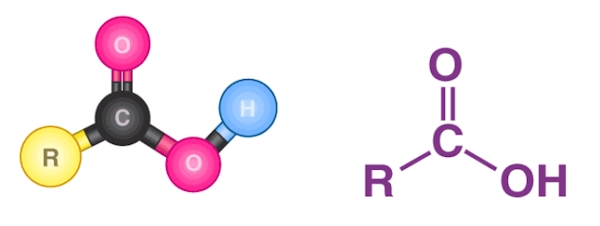
این دسته از ترکیبات میتوانند در تشکیل پیوند هیدروژنی شرکت کنند، بهصورتی که بخش $$C=O$$ آن پذیرنده پیوند هیدروژنی و بخش $$OH$$ آن دهنده پیوند هیدروژنی است. این ترکیبات نقطه جوش بالاتر از آب دارند و میتوانند دیمرهای پایداری تشکیل دهند. کاربرد این اسیدها در صنعت بسیار گسترده و مهم است.
تولید کربوکسیلیک اسید
الکلهای نوع اول به کمک اکسندههایی مانند پتاسیم پرمنگنات اکسایش مییابند و کربوکسیلیک اسید را به وجود میآورند. در صورتی که از این اکسنده استفاده شود نیاز به محیط خنثی یا بازی داریم. همچنین میتوان از پتاسیم دیکرومات و تریاکسید کروم در محیط اسیدی نیز بهره برد. واکنش تولید کربوکسیلیک اسید را میتوان بهصورت زیر نمایش داد.
$$ RCH_2OH \rightarrow RCOOH $$
$$ CH_3(CH_2)_8CH_2OH \rightarrow CH_3(CH_2)_8COOH $$
ویژگی کربوکسیلیک اسید
همانطور که میدانید ترکیبات حاوی گروه کربونیل در برخی ویژگیها با هم اشتراکهایی دارند. در ادامه به ویژگی کربوکسیلیک اسیدها اشاره میکنیم.
- کربوکسیلیک اسیدها نیز مولکولهایی قطبی هستند و در تشکیل پیوند هیدروژنی شرکت میکنند.
- کربوکسیلیک اسیدهای آروماتیک در آب سرد حل نمیشوند. تمامی اعضای این خانواده در حلالهای آلی مانند اتر، الکل و بنزن انحلالپذیر هستند.
- در بین اسیدهای آلی، کربوکسیلیک اسیدها قویترین هستند اما از اسیدهای معدنی مانند نیتریک اسید و اسید سولفوریک، اسید ضعیفتری به شمار میآیند.
نامگذاری کربوکسیلیک اسید
برای نامگذاری کربوکسیلیک اسیدها به روش زیر عمل میکنیم.
- به زنجیره هیدروکربنی والد آنها پسوند «وییک اسید» (oic Acid) اضافه میشود. برای مثال ساختار زیر بوتانوییک اسید نام دارد.
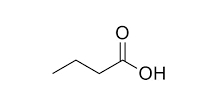
- در صورتی که روی زنجیره هیدروکربنی کربوکسیلیک اسید، استخلافی حضور داشته باشد، همیشه سر کربوکسیلیک اسیدی را به عنوان مبدا برای شمارهگذاری اتمهای کربن در نظر میگیریم. برای مثال در مولکول زیر یک استخلاف کلرو حضور دارند. این مولکول را «۳-کلرو پروپانوییک اسید» مینامیم.
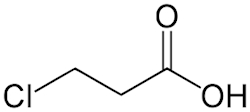
- به گروه $$COOH$$ کربوکسی نیز گفته میشود و میتوان آن را بهصورت استخلافی به نام ساختار اصلی اضافه کرد. مثلا ۲-فوروییک اسید را میتوان ۲-کربوکسی فوران نیز نامید. ساختار این مولکول را در زیر مشاهده میکنید.
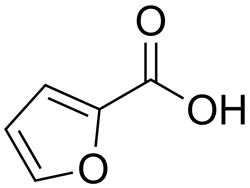
- همانند کتونها و آلدهیدها، برخی از کربوکسیلیک اسیدها نیز با نام متداول شناخته میشوند که در جدول زیر آنها را مشاهده میکنید.
| فرمول مولکولی | نام متداول | نام آیوپاک |
| $$HCOOH$$ | فرمیک اسید | متانوییک اسید |
| $$CH_3COOH$$ | استیک اسید | اتانوییک اسید |
| $$CH_3CH_2COOH$$ | پروپیونیک اسید | پروپانوییک اسید |
| $$C_6H_5COOH$$ | بنزوییک اسید | بنزن کربوکسیلیک اسید |
استر
تفاوت استر با کربوکسیلیک اسید که در بخش پیش به آن پرداختیم این است که در آن حداقل یک گروه $$O-alkyl$$ جایگزین گروه $$OH$$ شده است.
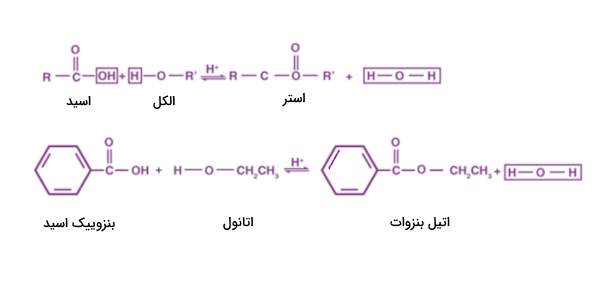
به عبارتی در این ترکیبات یک گروه الکلی با یک اسید آلی پیوند خورده است که طی این پیوند یک مولکول آب از دست میرود. این واکنش را میتوان بهصورت بالا نمایش داد.
استریفیکاسیون چیست؟
«استریفیکاسیون» یا «استری شدن» (Esterification) واکنش شیمیایی است که طی آن دو واکنشدهنده، برای مثال الکل و اسید، محصولی استری به وجود میآورند. در واکنش بالا شاهد یک استریفیکاسیون بودیم که به تولید محصول استری اتیل بنزوات انجامید.
هیدرولیز استر چیست؟
از آنجا که استرها از کربوکسیلیک اسید و الکل به وجود میآيند، طی واکنشی به نام «هیدرولیز استر» (Ester Hydrolysis) دوباره به ترکیبات اولیه خود تبدیل میشوند. این واکنش در حضور آب، اسید رقیق یا باز رقیق رخ میدهد.
ساختار استر
ویژگی بارز ساختار استری این است که در آن یک کربن با پیوند دوگانه به یک اتم اکسیژن و با یک پیوند یگانه به اتم اکسیژن دیگری متصل است. این اکسیژن دوم خود به یک گروه آریلی یا آلکیلی متصل میشود. استرها میتوانند ترکیباتی بسیار ساده تا پیچیده را تشکیل دهند.
کاربرد استر
در این بخش به برخی از کاربردهای این خانواده کربونیل میپردازیم.
- استر بوی شیرینی دارد و به عنوان طعمدهنده در محصولات غذایی و در صنعت عطر و ادکلن و محصولات آرایشی و بهداشتی به کار میرود.
- پلیمرهای پلیاستری کاربرد بسیاری در تولید بطریهای پلاستیکی دارند.
- از استرها به عنوان حلال آلی استفاده میشود.
- نیترات استرها مانند نیتروگلیسیرین در مواد منفجره به کار میرود.
- از پلیاسترها میتوان برای تولید برخی پارچهها در صنعت نساجی استفاده کرد.
آمید چیست؟
«آمیدها» (Amides) ترکیباتی حاوی یک گروه کربونیل هستند که از یک طرف به آمین و از طرف دیگر به زنجیرهای هیدروکربنی (یا اتم هیدروژن) متصل هستند. در این ترکیب آلی، میتوانیم تا ۳ گروه متغیر $$R$$ نیز داشته باشیم. توجه داشته باشید که در ساختارهای ساده، این گروهها میتوانند با اتم هیدروژن جایگزین شوند.
سنتز آمید
از روشهای متفاوتی میتوان به ساختارهای آمیدی دست پیدا کرد. در این بخش به برخی از این روشها اشاره کردهایم.
آسیلاسیون آمین
از واکنش یک گروه آسیلی با آمین، ترکیب آمیدی به دست میآید که به نام «آسیلاسیون آمین» (Amine Acylation) شناخته میشود. نیتروژن موجود در ترکیب آمینی یک الکترون ناپیوندی دارد که به کربن کربونیل به دلیل کمبود الکترون آن، حمله میکند. سپس حذف یک پروتون و گروه ترککننده، به تولید آمید مورد نظر میانجامد. نحوه انجام این واکنش را میتوانید در تصویر زیر مشاهده کنید.
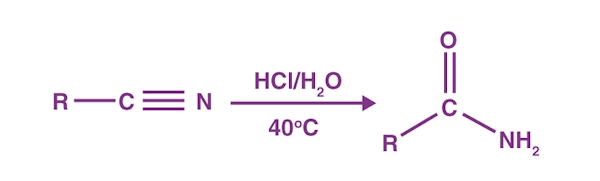
هیدرولیز نیتریل
هیدرولیز جزئی نیتریل (RCN) در محیط اسیدی یا بازی میتواند به تولید ترکیباتی با گروههای آمیدی بینجامد.
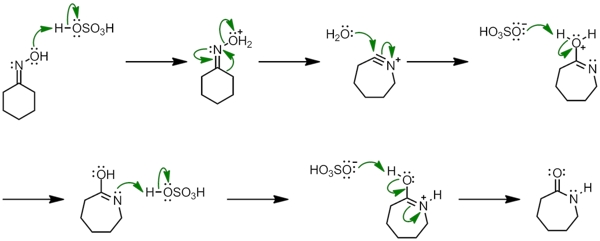
بازآرایی بکمن
«بازآرایی بکمن» (Beckamann Rearrangment) یکی از مهمترین روشهای سنتز آمیدها به شمار میآيد. در این بازآرایی از گروه اکسیمی، آمید به دست میآيد. این بازآرایی باید در حضور یک عامل فعالکننده مانند $$H_2SO_4$$ یا $$PCl_3$$ صورت بگیرد. نحوه انجام مکانسیم آن را در تصویر زیر آوردهایم.
ویژگی آمید
آمیدها به عنوان ترکیبات زیرمجموعه کربونیلها دارای ویژگیهایی هستند که در ادامه به آنها میپردازیم.
- پیوند آمیدی قطبی است و توانایی تشکیل پیوند هیدوژنی با آب را دارد. به همین دلیل آمیدهای سبک در آب حل میشوند. هرچه جرم مولی آمید بالاتر برود، استخلافهای هیدروکربنی ناقطبی بزرگتری در ساختار حضور دارد که باعث کاهش انحلالپذیری این ترکیبات در آب میشود.
- نقطه جوش و نقطه ذوب آمیدها به دلیل انحلالپذیری آنها بالاست.
- آمیدها از آمینها خصلت بازی کمتری دارند زیرا الکترون ناپیوندی روی نیتروژن با گروه کربونیل مزدوج میشود. این پدیده باعث میشود الکترونها کمتر در دسترس باشند.
طبقهبندی آمیدها
آمیدها را میتوان با توجه به استخلافهای متصل به اتم نیتروژن آنها به سه دسته طبقهبندی کرد که در فهرست زیر آنها را مشاهده میکنید.
- آمید نوع اول: در صورتی که اتم هیدروژن در جایگاه استخلافهای روی نیتروژن آمیدی قرار داشته باشند، آمید از نوع اول خواهد بود.
- آمید نوع دوم: در صورتی آمید را نوع دوم مینامیم که در جایگاه یکی از استخلافها، اتم هیدروژن و در جایگاه استخلاف دیگر، یک هیدروکربن وجود داشته باشد.
- آمید نوع سوم: آمیدی نوع سوم است که هر دو استخلاف نیتروژن آمیدی آن با یک هیدروکربن اشغال شده باشد.
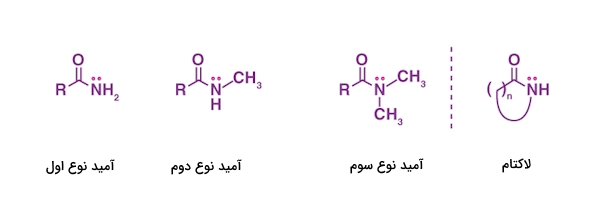
همچنین به آمیدهایی که بهصورت حلقوی حضور داشته باشند، بهطور کلی «لاکتام» (Lactam) گفته میشود. ساختار انواع آمیدهای موجود در تصویر بالا آورده شده است.
کاربرد آمید
آمیدها به دلیل ویژگیهایی که دارند کاربرد گستردهای پیدا کردهاند زیرا تولید آنها ساده است، در برابر هیدرولیز مقاوم هستند و به ساختار صلبیت میدهند. تعدادی از مهمترین داروهای موجود از جمله پنیسیلین و پاراستامول آمیدی هستند.
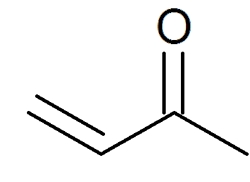
انون
«انون» (Enone) که با نام «آلکنون» (Alkenone) نیز شناخته میشود، ترکیبی آلی است که در ساختار خود هم گروه عاملی کتون، هم آلکن را دارد. در صورتی که انون از نوع آلفا و بتای اشباع باشد، آلکن با پیوند دوگانه کربونیل مزدوج میشود. سادهترین انون، متیل وینیل کتون نامیده میشود که ساختار آن را در زیر مشاهده میکنید.
سنتز انون
برای سنتز انونها معمولا از «تراکم آلدولی» (Aldol Condensation) و «تراکم نووناگل» (Knoevenagel Condensation) استفاده میشود. از جمله انونهای مهمی که از تراکم استون به وجود میآیند میتوان به «مسیتیل اکسید» با فرمول شیمیایی $$C_6H_{10}O$$ اشاره کرد. در تصویر زیر سنتز تراکمی انونها را مشاهده میکنید.
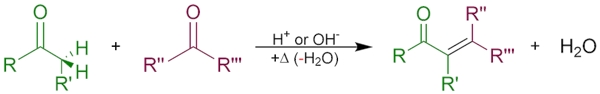
آسیل هالید
در شیمی آلی «آسیل هالید» (Acyl Halide) ترکیبی است که در آن یک اتم هالوژن به یک گروه آسیل متصل شده باشد. از آنجا که معروفترین آسیل هالید، آسیل کلرید است در ادامه بیشتر به بررسی این ترکیب به عنوان نماینده این خانواده خواهیم پرداخت.
در واکنش زیر نحوه سنتز آزمایشگاهی این ماده را مشاهده میکنید.
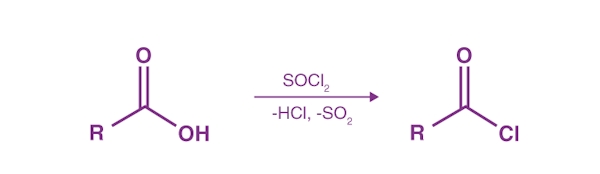
این ماده از واکنش یک کربوکسیلیک اسید با «تیونیل کلرید» $$(SOCl_2)$$ تشکیل میشود. در طی واکنش گروه هیدروکسیلی کربوکسیلیک اسید به حدواسط کلروسولفیت تبدیل میشود تا تبدیل به ترککننده بهتری شود.سپس آنیون به دست آمده، با هستهدوست وارد واکنش میشود و به محصول خواهیم رسید.
سنتز صنعتی آسیل کلرید
برای سنتز صنعتی آسیل کلرید، استیک انیدرید با هیدروژن کلرید وارد واکنش میشود و استیل کلرید به وجود میآید. این واکنش را میتوان به شکل زیر نمایش داد.
$$ (CH_3CO)_2O + HCl → CH_3COCl + CH_3CO_2H $$
برای تهیه آسیل کلرید میتوان از ترکیباتی مانند فسفر تریکلرید و فسفر پنتاکلرید نیز استفاده کرد. نمونهای از این واکنش را در زیر مشاهده میکنید.
$$ RCOOH + PCl_5 → RCOCl + POCl_3 + HCl$$
نامگذاری آسیل کلرید
به آسیل کلرید، اسید کلرید نیز گفته میشود. برای نامگذاری آسیل کلریدها میتوان به انتهای نام کربوکسیلیک اسید والد، پسوند «ایل» (yl) را اضافه کرد. تعدادی مثال از این نامگذاری را در جدول زیر آوردهایم.
| نام کربوکسیلیک اسید | نام آسیل کلرید | فرمول آسیل کلرید |
| اتانوییک اسید | اتانوییل کلرید | $$CH_3COCl$$ |
| پروپانوییک اسید | پروپانوییل کلرید | $$CH_3CH_2COCl$$ |
| بوتانوییک اسید | بوتانوییل کلرید | $$CH_3CH_2CH_2COCl$$ |
ویژگیهای آسیل کلرید
در فهرست زیر به تعدادی از ویژگیهای فیزیکی و شیمیایی این ماده اشاره کردهایم.
- آسیل کلریدهای ابتدایی با تعداد کربن پایین، مایعات بیرنگی با بوی شدید هستند.
- این ترکیبات در حلالهای آلی مانند الکل، اتر و کلروفرم حل میشوند.
- به دلیل عدم توانایی در تشکیل پیوند هیدروژنی، نقطه جوش و نقطه ذوب آسیل کلریدها نسبت به همتای کربوکسیلیک اسیدی آنها، پایینتر است.
- به دلیل واکنشپذیری بالا، این ترکیبات به راحتی، توسط جانشینی هستهدوستی آسیل، تبدیل به ترکیبات دیگر آسیلی میشوند.
- این ترکیبات نسبت به دیگر مشتقهای کربوکسیلیک اسیدی از واکنشپذیری بیشتری برخوردارند.
- این ترکیبات به راحتی هیدرولیز میشوند و کربوکسلیک اسید همتای خود را به وجود میآورند.
کاربرد آسیل کلرید
در این بخش میخواهیم بدانیم این ترکیبات چه کاربردهایی دارند. از آنجا که واکنشپذیری آنها بالا است، کاربردهای فراوانی در فرآیندهای متفاوت دارند.
- تولید محصولات دارویی
- سنتر ترکیبات آلی
- تولید محصولات کشاورزی
- تولید پلاستیک و رنگدانه
اسید انیدرید
«انیدرید» (Anhydride) در لغت به معنای بدون آب است و به هر ماده شیمیایی گفته میشود که از حذف آب از یک ماده شیمیایی دیگر به دست آمده باشد. انیدریدها در واکنش با آب، اسید یا باز تولید میکنند. در شیمی آلی اسید انیدرید ترکیبی است که در آن دو گروه کربونیل توسط یک اکسیژن با یکدیگر ترکیب شده باشند. این ترکیبات از «آبزدایی» (Dehydration) دو گروه گربوکسیلیک اسیدی به دست میآيد. در زیر این واکنش را مشاهده میکنید.
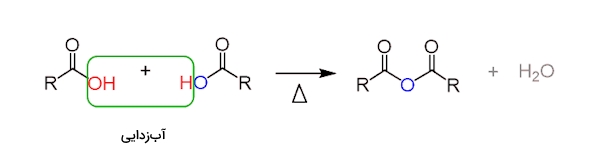
این فرآيند در دمای بسیار بالا و نزدیک به ۸۰۰ درجه سانتیگراد صورت میگیرد و همانطور که مشاهده میکنید طی آن یک مولکول آب از دست میرود. میتوان اسید انیدرید را از واکنش کربوکسیلیک اسید با $$P_2O_4$$ به دست آورد.
ویژگیهای اسید انیدرید
اسید انیدرید میتواند درگیر واکنش جانشینی هستهدوستی شود و گروه $$OCOR$$ خود را جایگزین کند. در زیر به برخی از ویژگیهای این ترکیب اشاره میکنیم.
- واکنشپذیری اسید انیدرید از اسید کلرید کمتر است زیرا اتم کلر نسبت به گروه $$OCOR$$ الکترونگاتیوی بیشتری دارد.
- در صورتی که دو گروه متغیر $$R$$ در این ساختار مشابه یکدیگر باشند، اسید انیدرید متقارن خواهد بود.
کاربرد اسید انیدرید
از اسید انیدرید در شیمی آلی استفاده فراوانی میشود که در زیر آنها را مشاهده میکنید.
- از اسید انیدریدها در تولید محصولات دارویی، مواد شیمیایی صنعتی، مواد منفجره و عطر استفاده میشود.
- این ترکیب در سنتز داروی پرمصرف آسپرین کاربرد دارد.
- اسید انیدرید به عنوان گروه ترککننده مورد استفاده قرار میگیرد.
ترکیبات کربونیل
برخی از ترکیبات کربونیل کوچک وجود دارند که بسیار پرکاربرد و معروف هستند، بنابراین میخواهیم در این بخش به بررسی تعدادی از آنها بهتفضیل بپردازیم.
کربونیل کلرید
«فسژن» (Phosgene) یا کربونیل کلرید ماده آلی با فرمول شیمیایی $$COCl_2$$ است. این ماده گازی شکل و سمی است و بوی شبیه به علف هرز دارد. میتوان این مولکول را مشابه مولکول فرمالدهیدی در نظر گرفت که اتمهای هیدروژن آن با کلر جایگزین شده است. ساختار این ماده را در تصویر زیر مشاهده میکنید.
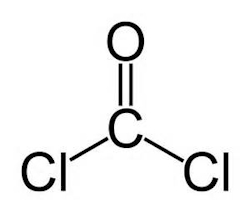
این ماده نقش بسیار مهمی در سنتزهای شیمیایی دارد، برای مثال در تهیه پلیاورتان و پلیکربنات به عنوان پیشساز به کار میرود. این ماده یکی از سادهترین آسیل کلریدهای موجود است.
کربونیل سولفید
کربونیل سولفید مولکول خطی با فرمول شیمیایی $$OCS$$ است. این ماده به حالت گازی وجود دارد که بیرنگ، اشتعالپذیر و دارای بویی ناخوشایند است. همانطور که در تصویر زیر مشاهده میکنید، گروه عاملی کربونیل در آن با پیوند دوگانه به یک اتم گوگرد متصل شده است. این مولکول را میتوان حدواسطی بین کربن دیاکسید و کربن دیسولفید در نظر گرفت.
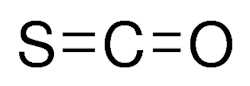
کربونیل آهن
کربونیل آهن، آهن بسیار خالصی است که از تجزیه شیمیایی مولکول پنتاکربونیل آهن با فرمول شیمیایی $$Fe(CO)_5$$ به دست میآيد. ساختار پنتاکربونیل آهن را در تصویر زیر مشاهده میکنید.
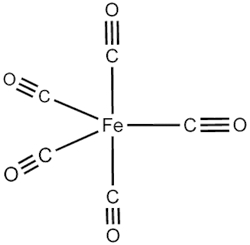
این ماده به فرم پودری به رنگ خاکستری است. از این ماده در تولید مکملهای دارویی برای جبران کمبود آهن در بدن انسان استفاده میشود. در سال ۲۰۱۷ میلادی، مطالعهای تاثیر احیاکنندگی آن را در گروههای نیتروژن آروماتیک، در آب نشان داد که واکنش بسیار مهمی در سنتز ترکیبات دارویی به شمار میرود.
کربونیل فلوئورید
کربونیل فلوئورید ترکیبی شیمیایی با فرمول شیمیایی $$COF_2$$ است. این مولکول مانند هم خانواده خود، کربن کلرید گازی بیرنگ و بسیار سمی است. ساختار این مولکول را در زیر مشاهده میکنید. این مولکول نیز مانند فرمالدهیدی است که دو اتم هیدروژن در آن با اتم فلوئور جایگزین شده باشد.
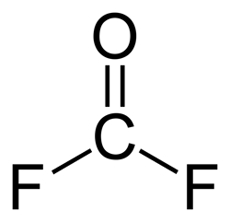
این مولکول بهطور معمولی در تجزیه شیمیایی هیدروکربنهای فلوئوردار به وجود میآید. برای مثال در واکنش زیر، این ماده از تترافلوئور متان در حضور آب به وجود آمده است.
$$ CF_4 + H_2O \rightarrow COF_2 + 2 HF $$
این ماده در حضور آب ناپایدار است و به کربن دیاکسید و هیدروژن فلوئورید هیدرولیز میشود. واکنش این هیدرولیز را در زیر آوردهایم.
$$ COF_2 + H_2O \rightarrow CO_2 + 2 HF$$
واکنشهای شیمیایی کربونیل
میدانیم که کربن گروه کربونیل، الکتروندوست است، بنابراین ترکیباتی که غنی از الکترون هستند را به خود جذب میکند. از این الکتروندوستها میتوان به یونها اشاره کرد. همچنین اتمهای اکسیژن هستهدوست هستند زیرا غنی از الکترون نیستند و هستهدوست نامیده میشوند. در ادامه میخواهیم نگاهی داشته باشیم به واکنشهایی که ترکیبات کربونیل وارد آنها میشوند.
افزایش هستهدوستی به گروه کربونیل
گروه کربونیل به دلیل بار مثبت کربن و بار منفی اکسيژن تمایل بسیاری برای حمله هستهدوستی دارد. رزونانس بار جزئی مثبت کربن به بار منفی روی هستهدوست، اجازه میدهد تا به گروه کربونیل حمله کند و بخشی از ساختار آن شود. همچنین بار مثبت (معمولا هیدروژن پروتونی) به اکسيژن دارای بار جزئی منفی حمله میکند.
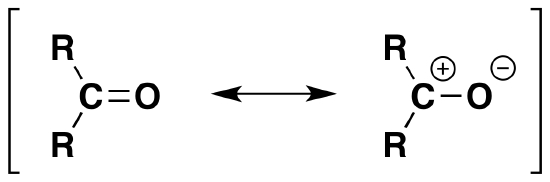
همانطور که میدانید هستهدوست اسید خوبی است و به پروتون تمایل دارد، به همین دلیل نیز به قسمتی از ساختار که بار مثبت دارد حمله میکند. در تصویر بالا جدایی بار موجود در ساختار کربونیل را مشاهده میکنید.
مراحل حمله هستهدوستی
در این بخش میخواهیم به بررسی مرحله به مرحله حمله هستهدوستی روی یک گروه کربونیل بپردازیم. برای درک بهتر به تصویر زیر مراجعه کنید.
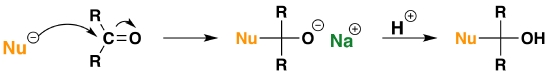
- هستهدوست ابتدا به کربن با بار مثبت حمله میکند و یکی از الکترونهای پیوند دوگانه را به روی اکسیژن منتقل میکند تا دارای بار منفی شود.
- در این مرحله هستهدوست بخشی از ساختار کربونیل است. در این ساختار اکسیژنی با بار منفی و یون سدیم در اطراف آن حضور دارد.
- اکسيژن با بار منفی به پروتون حمله میکند و محصول نهایی را مانند تصویر بالا به دست میدهد.
کاهش کربونیل
در این واکنش گروههای کربونیل توسط واکنشدهندههای هیدریدی مانند سدیم تتراهیدرو بورات با فرمول شیمیایی $$NaBH_4$$ و لیتیم آلومینیم هیدرید با فرمول شیمیایی $$LiAlH_4$$ کاهش پیدا میکند. در این فرآيند مخمر نانوایی حضور دارد همچنین میتوان فرآیند هیدروژناسیون کاتالیزوری را نیز به کار گرفت.
در صورتی که گروه کربونیل در ترکیب کتونی باشد، کاهش آن منجر به تولید الکل نوع دوم میشود. همچنین محصول کاهش گروه کربونیل در ترکیبات استری، کربوکسیلیک اسید و آلدهید از نوع الکل نوع اول خواهد بود.
آلکیلاسیون کربونیل
در واکنش «آلکیلاسیون کربونیل» (Carbonyl Alkylation) گروههای کربونیل به کمک ترکیبات فلزی آلی، آلکیله میشوند. از جمله این واکنشدهندههای آلی فلزی میتوان به «واکنشگر آلی لیتیم» (Organolithium Reagent)، «واکنشگر گرینیارد» (Grignard Reagent) و استالدهیدها اشاره کرد. همچنین مشابه واکنش آلدول، میتوان کربونیلها را توسط انولاتها نیز آلکیله کرد.
گروههای کربونیل میتوانند واکنشی مثل «واکنش مایکل» (Micheal) را نیز انجام دهند که در آن کربن غیراشباع مزدوج با گروه کربونیل به جای خود کربونیل، آلکیله میشود.
واکنش جانشینی آلفا کربونیل
در این «واکنش جانشینی» (Substitution Reaction) هیدروژن آلفا به کمک یک الکتروندوست جایگزین میشود.
ویژگیهای گروه کربونیل
تا اینجا به بررسی گروه کربونیل و ترکیبات حاوی آن پرداختیم. در این بخش شاهد فهرستی از مهمترین ویژگیهای این ترکیبات هستید.
- پیوند کربونیل در ترکیبات کربونیل قطبی است، بهصورتی که اکسیژن دارای بار جزئی مثبت و کربن دارای بار جزئی منفی است.
- طول پیوند کربونیل با افزایش قطبیت کاهش پیدا میکند.
- ترکیبات کربونیل هرچه بزرگتر باشند انحلالپذیری کمتر در آب دارند.
- ترکیبات کربونیل با بیش از ۶ اتم کربن در آب نامحلول هستند.
- ترکیبات کربونیل مولکولهایی قطبی هستند و میتوانند بار مثبت و منفی را به یک مقدار جذب خود کنند.
- ترکیبات کربونیل مولکولهای قطبی را در خود حل میکنند.
- این ترکیبات از نظر شیمیایی فعال هستند و به همین دلیل میتوانند کنترل واکنشهای شیمیایی را به دست بگیرند.
- هر چه ساختار مولکول حاوی گروه کربونیل بزرگتر باشد، نقطه جوش آن افزایش پیدا میکند.
کاربرد ترکیبات کربونیل
در فهرست زیر به برخی از کاربردهای این خانواده گسترده اشاره کردهایم.
- از پروپانون به عنوان حلال استفاده میشود زیرا در آب و دیگر محلولهای آلی انحلالپذیر است.
- از فرمالدهید در صنایع تولید پلاستیک استفاده میشوند. همچنین در آزمایشگاههای زیستشناسی از آن برای نگهداری برخی مواد بهره میبرند.
- بوتانول رایحهای در اختیار قرار میدهد که از آن برای تازه نگه داشتن نان کمک میگیرند.
- استالدهید در بسیاری از واکنشهای آلی حضور پررنگی دارد.

طیفسنجی گروههای کربونیل
از آنجا که در بسیاری از ترکیبات آلی شاهد حضور گروه کربونیل هستیم، در شناسایی ترکیبات آلی بهوفور به آن بر میخوریم. در این بخش میخواهیم بدانیم با چه روشهایی میتوان به حضور آن در ترکیبات پی برد.
طیفسنجی مادون قرمز
در تعیین گروه عاملی به کمک طیفسنجی مادون قرمز، پیوند دوگانه کربن و اکسیژن در ترکیبات کربونیل نور مادون قرمز را در طول موجی بین ۱۶۰۰ تا ۱۹۰۰ $$cm^{-1}$$ معادل ۵۲۶۳ تا ۶۲۵۰ نانومتر به خود جذب میکند. مکان دقیق جذب را میتوان در مولکول پیدا کرد. به این بازه جذب در طیف، «کشش کربونیل» (Carbonyl Stretch) گفته میشود. به علاوه پروپانون در طیف فرابنفش-مرئی در آب، جذبی در طول موج ۲۵۷ نانومتر به دست میدهد
طیفسنجی رزونانس مغناطیسی هسته
پیوند دوگانه کربونیل با توجه به اتمهایی که در مجاورت آن قرار دارد، رزونانسهای مختلفی را از خود نشان میدهد. کربن کربونیل در طیفسنجی رزونانس مغناطیسی هستهای $$^{13}C$$ در بازه ۱۶۰ تا ۲۲۰ ppm از خود جذبی نشان میدهد.
مثال و تمرین از کربونیل
حال که میدانیم گروه کربونیل چیست و در چه ترکیباتی حضور دارد، میخواهیم به بررسی تعدادی مثال بپردازیم. توجه به پاسخ تشریحی این مثالها میتواند به درک عمیقتر این مفهوم بینجامد.
مثال از کربونیل
در این بخش تعدادی مثال از گروههای کربونیل را به همراه پاسخ تشریحی آنها مورد بررسی قرار میدهیم.
مثال اول
کتونها و آلدهیدها ترکیباتی هستند که در ساختار خود گروه کربونیل دارند. در هر مورد چند مثال بزنید.
پاسخ
از جمله کتونهای دارای گروه کربونیل میتوان به پروپانون و بوتانون اشاره کرد. همچنین متانال، اتانال و پروپانال نمونهای از آلدهیدهای حاوی گروه کربونیل هستند.
مثال دوم
چرا واکنشپذیری آلدهیدها از کتونها بیشتر است؟
پاسخ
آلدهیدها با در نظر گرفتن اثرات فضایی و الکترونیکی نسبت به کتونها واکنشپذیری بیشتری دارند. در آلدهید همیشه یک طرف گروه کربونیل آزاد است و به استخلافی متصل نمیشود اما در کتون به جای اتم کوچک هیدروژن، استخلاف متغیر $$R$$ حضور دارد.
مثال سوم
آزمون شیفت چیست؟
پاسخ
آزمون شیف روشی است که میتوان توسط آن حضور یا عدم حضور گروه آلدهیدی را در مادهای تشخیص داد. در این آزمون مقدار اندکی از نمونه با واکنشگر شیف واکنش داده میشود. در صورتی که طی این واکنش شاهد رنگ بنفش یا ارغوانی باشیم به این نتیجه میرسیم که آلدهید در آن حضور دارد.
مثال چهارم
کتونها بیشتر اسیدی هستند یا آلدهیدها؟
پاسخ
آلدهیدها اسیدیتر از کتونها هستند، یعنی مقدار $$pKa$$ آنها پایینتر است. دلیل این امر پایینتر بودن اثر الکتروندهی در پروتونهای آلدهید است.
مثال پنجم
دلیل معطر بودن استرها چیست؟
پاسخ
استرها بوی شیرینی دارند زیرا نیروهای بین مولکولی در آنها بسیار ضعیف است، بنابراین در صورتی که در فاز گازی وجود داشته باشند، به راحتی ساختار خود را ترک کرده و باعث تحریک بویایی انسان میشوند. برای مثال میتوان به اتیل بوتیرات اشاره کرد که بوی شبیه به آناناس از خود ساطع میکند.
مثال ششم
تفاوت ترکیب آمینی و آمیدی در چیست؟
پاسخ
مهمترین تفاوت بین آمین و آمید در حضور گروه کربونیل است. به این صورت که در آمینها کربونیل حضور ندارد، در حالی که در ساختار آمیدی یک گروه کربونیل به اتم نیتروژن متصل است.
مثال هفتم
آیا اسید کلرید، خاصیت اسیدی دارد؟
پاسخ
از آنجا که این ترکیب فاقد یون پروتون است، در حالت عادی اسیدی نیست. با این حال در صورتی که در محیط آبی قرار بگیرد، میتواند با آب واکنش دهد و کربوکسیلیک اسید همتای خود و اسید هیدروکلریک را به وجود بیاورد.
مثال هشتم
واکنشپذیری آسیل کلرید بیشتر است یا کربوکسیلیک اسید؟
پاسخ
از آنجا که در آسیل کلرید به کربن کربونیل، ترککننده خوبی متصل است، راحتتر وارد واکنش میشود و از کربوکسیلیک اسید نیز واکنشپذیری بیشتری دارد.
مثال نهم
دلیل سمی بودن آسیل کلرید چیست؟
پاسخ
آسیل کلریدها بهطور کلی سمی هستند و باید هنگام کار با آنها موراد ایمنی را با دقت رعایت کرد زیرا میتواند با رطوبت موجود در سطح چشم انسان وارد واکنش شود. در نتیجه این واکنش، هیدروکلریک اسید و کربوکسیلیک اسید به وجود میآید که باعث تحریک چشم میشوند.
مثال دهم
آیا اسید انیدریدها همیشه متقارن هستند؟
پاسخ
خیر. در اسید انیدریدها دو گروه متغیر $$R$$ حضور دارد. این ترکیب تنها در صورتی متقارن است که دو گروه $$R$$ متغیر آن کاملا مشابه یکدیگر باشند.
حل تمرین از کربونیل
در این بخش به بررسی تعدادی تمرین چندگزینهای میپردازیم. در مواردی که نیاز باشد، پاسخ تشریحی آنها را نیز آوردهایم.
تمرین اول
هیبریداسیون کربن و اکسیژن در ساختار کربونیل در کدام گزینه به ترتیب صحیح آورده شده است؟
$$sp^2$$ و $$sp^2$$
$$sp^2$$ و $$sp$$
$$sp$$ و $$sp^2$$
$$sp^2$$ و $$sp^3$$
تمرین دوم
قطبیت گروه کربونیل به صورتی اتفاق میافتد که کربن دارای بار جزئی ... و اکسیژن دارای بار جزئی ... باشد.
منفی، مثبت
مثبت، مثبت
مثبت، منفی
منفی، منفی
تمرین سوم
در کدام یک از گزینههای زیر گروه کربونیل حضور ندارد؟
$$ HCHO $$
$$CH_3 COCH_3 $$
$$HCH_2OH$$
$$CH_3COH$$
تمرین چهارم
کدام یک از ترکیبات آلی زیر شامل گروه کربونیل است؟
کتون
آلدهید
کربوکسیلیک اسید
هر ۳ گزینه دارای گروه کربونیل هستند.
تمرین پنجم
گروه کربونیل کدام یک از ساختارهای زیر را دارد؟
چهاروجهی
مسطح مثلثی
هرمی
خطی
تمرین ششم
فرمول عمومی کربوکسیلیک اسید در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
$$RCOOH$$
$$ROH$$
$$RCHO$$
$$RCO$$
تمرین هفتم
در ساختار شیمیایی کربوکسیلیک اسید کدام یک از گروههای زیر حضور دارند؟
گروه کربونیل
گروه هیدروکسیل
هر دو گروه حضور دارند.
هیچ کدام حضور نداند.
تمرین هشتم
ترکیبی در دست داریم که فرمول عمومی آن بهصورت $$RCHO$$ است. این ترکیب به کدام دسته از ترکیبات دارای گروه کربونیل تعلق دارد؟
آلدهیدها
کتونها
کربوکسیلیک اسیدها
استرها
تمرین نهم
فرمول شیمیایی فرمالدهید، استالدهید و پروپانال در کدام یک از گزینههای زیر به ترتیب صحیح آورده شده است؟
$$CH_2O$$ و $$C_2H_4O$$ و $$C_3H_5O$$
$$CH_2O$$ و $$C_2H_4O$$ و $$C_3H_6O$$
$$C_2H_4O$$ و $$C_3H_6O$$ و $$CH_2O$$
$$C_2H_4O$$ و $$CH_2O$$ و $$C_3H_6O$$
تمرین دهم
مولکول موجود در تصویر زیر به کدام دسته از ترکیبات گروه کربونیل تعلق دارد؟
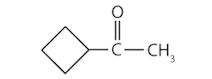
استر
کربوکسیک اسید
کتون
آلدهید
تمرین یازدهم
اکسایش الکلهای نوع اول به تولید ... میانجامد.
کتون
کربوکسیلیک اسید
استر
آلدهید
تمرین دوازدهم
از واکنش بین یک کربوکسیلیک اسید و یک الکل به کدام یک از گزینههای زیر میرسیم؟
استر
کتون
آلدهید
اسید انیدرید
تمرین سیزدهم
طبق سیستم نامگذاری آیوپاک، از کدام یک از پسوندهای زیر برای نامگذاری استرها استفاده میشود؟
وییک اسید (oic acid)
ال (al)
اوات (oate)
انون (enon)
تمرین چهاردهم
از کدام یک از روشهای زیر برای سنتز ترکیبات آمیدی استفاده نمیشود؟
آسیلاسیون آمین
هیدرولیز نیتریل
واکنش بین کربوکسیلیک اسید و الکل
بازآرایی بکمن
تمرین پانزدهم
اسید انیدریدها از ... مشتق میشوند.
کربوکسیلیک اسید
الکل
کتون
فنول
سوالات متداول کربونیل
حال که میدانیم کربونیل چیست و چه کاربردی دارد، میخواهیم در این بخش به برخی از مهمترین و پرتکرارترین سوالهای پیرامون آن بپردازیم.
کاربرد ترکیبات کربونیل چیست؟
ترکیبات کربونیل کاربردهای فراوان و گستردهای دارند. برای مثال پروپانون دارای گروه کربونیل است و از آنجا که هم در آب، هم در محلولهای آلی انحلالپذیر است از آن به عنوان حلال استفاده میشود.
فرمول ساختاری گروه کربونیل چیست ؟
فرمول ساختاری گروه کربونیل را میتوان بهصورت $$C=O$$ نشان داد که در آن اتم کربن به دو اتم دیگر متصل است. با توجه به استخلافهایی که در این اتصال وجود دارند، کربونیل میتواند ترکیبات متنوعی را به وجود بیاورد.
گروه عاملی کربونیل چیست ؟
کربونیل گروهی است که در آن یک اتم کربن و یک اتم اکسیژن به کمک پیوندی دوگانه به یکدیگر متصل شدهاند.
هیبریداسیون کربن گروه کربونیل به چه صورت است؟
کربن درگیر در گروه کربونیل دارای هیبریداسیون $$sp^2$$ است و سه پیوند آن از نوع سیگما و دیگری از نوع $$\pi$$ است.
انواع ترکیبات حاوی گروه کربونیل کدامند؟
از ترکیباتی که در ساختار خود حاوی گروه کربونیل هستند میتوان به کتون، آلدهید، کربوکسیلیک اسید، استر، آمید و اسید انیدرید اشاره کرد.
چرا از آلدهیدها در صنعت عطر و ادکلن استفاده میشود؟
آلدهیدهای سنگین عطر بسیار خوشایندی دارد به همین دلیل از آنها در این صنایع استفاده میشود.
جمعبندی
هدف از این مطلب مجله فرادرس، بررسی ساختار گروه عاملی کربونیل بود. در ادامه ترکیبات و واکنشهای آن را مورد بررسی قرار دادیم و به تعدادی مثال و تمرین پرداختیم.










