تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده


در مطالب قبلی مجله فرادرس به بررسی غلظت محلولها همچون مولاریته پرداختیم. اطلاع از غلظت محلول در کنترل استوکیومتری واکنشدهندهها برای انجام واکنشها در محلول بسیار ضروری است. در این بخش به بررسی نحوه آمادهسازی و تهیه محلول ها در آزمایشگاه از جمله تهیه محلولهای درصدی و مولار خواهیم پرداخت.
تهیه محلول
برای تهیه محلولی که شامل غلظت مشخصی از یک ماده است باید تعداد مول مورد نظر از حلشونده را در مقدار کافی حلال، حل کنیم تا به حجم نهایی از محلول برسیم. این فرآیند تهیه محلول در تصویر زیر نشان داده شده است. در این تصویر، تهیه محلول کبالت (II) کلرید در اتانول را مشاهده میکنید. توجه داشته باشید که حجم حلال مشخص نشده است. از آنجایی که حلشونده در فضای محلول، حجم اشغال میکند، حجم حلال مورد نیاز همواره کمتر از حجم محلول مورد نظر خواهد بود.

به طور مثال، اگر حجم مورد نیاز، ۱ لیتر بود، نباید ۱ لیتر آب را به ۳۴۲ گرم پودر جامد اضافه میکردیم چراکه در اینصورت، حجم محلول حاصل، به بیش از ۱ لیتر میرسید. این مورد در تصویر زیر به خوبی نشان داده شده است.
در این مثال، میخواهیم محلولی با حجم ۲۵۰ میلیلیتر تهیه کنیم. مقدار ۹۰ گرم از محلول آمونیوم دیکرومات را در یک بالن حجمی با حجم ۲۵۰ میلیلیتر قرار میدهیم. یک استوانه مدرج هم با حجم ۲۵۰ میلیلیتر آب نیز در اختیار داریم. در پایان، میبینید که با به حجم رساندن محلول مورد نظر به خطِ نشان در بالن حجمی، ۴۵ میلیلیتر آب در استوانه باقی میماند که یعنی، به مقدار کمتری از ۲۵۰ میلیلیتر آب نیاز داشتیم.

مثال تهیه محلول کبالت (II) کلرید
محلولی که در تصویر اول مشاهده کردید، شامل ۱۰ گرم کبالت (II) کلرید دوآبه به همراه حجم کافی از اتانول برای تهیه محلول با حجم ۵۰۰ میلیلیتر است. غلظت مولی را حساب کنید.
- معلوم: جرم حلشونده و حجم محلول
- مجهول: غلظت
برای پیدا کردن تعداد مول ، جرم ترکیب را بر جرم مولی آن تقسیم کنید. با تقسیم تعداد مول حلشونده به حجم محلول (لیتر)، مولاریته آن محاسبه میشود. جرم مولی برابر با 165/87 گرم بر مول است. بنابراین، برای محاسبه تعداد مول حلشونده خواهیم داشت:
$$\require {cancel} moles\: C o C l_2 \cdot 2 H_2 O = \left( \dfrac{10.0 \: \cancel {g }} {165 .87\: \cancel {g } /mol} \right) = 0 .0603\: mol$$
حجم محلول به لیتر به صورت زیر محاسبه میشود:
طبق تعریف، مولاریته برابر است با تعداد مول حلشونده به ازای هر لیتر محلول. بنابراین، مولاریته محلول به صورت زیر محاسبه خواهد شد:
تهیه محلول با حجم مشخص از حلشونده با غلظت معین
برای تهیه محلول با حجم مشخص شامل حلشونده با غلظت معین، در ابتدا باید تعداد مول حلشونده در حجم مورد نظر محلول را محاسبه کنیم. در ادامه، تعداد مولهای حلشونده را به جرم متناظر با آن تبدیل میکنیم. این فرآیند در مثال زیر بررسی میشود.
مثال تهیه محلول با حجم مشخص از حلشونده
از محلولی به نام با غلظت 0/310 مولار به عنوان سرم وریدی در پزشکی استفاده میشود. به طور معمول شامل محلول ۵ درصد دکستروز (نام پزشکی گلوکز) در آب است. جرم گلوکز مورد نیاز برای تهیه سرم ۵۰۰ میلیلیتر را محاسبه کنید. جرم مولی گلوکز برابر با 180/16 گرم بر مول است.
- معلوم: مولاریته، حجم، جرم مولی حلشونده
- مجهول: جرم حلشونده
برای حل این سوال، مراحل زیر را دنبال میکنیم:
- تعداد مول گلوکز در حجم مشخص از محلول را به کمک ضرب حجم محلول در مولاریته، محاسبه کنید.
- جرم گلوگز مورد نیاز را با ضرب تعداد مول ترکیب در جرم مولی آن بدست آورید.
در ابتدا تعداد مول گلوگز موجود در ۵۰۰ میلیلیتر محلول 0/310 مولار را محاسبه میکنیم.
در ادامه نیز تعداد مول گلوکز را به جرم مورد نیاز برای تهیه محلول تبدیل میکنیم:
تهیه محلول های رقیق از محلول های غلیظ (رقیق سازی محلول ها)
محلولی با غلظت معلوم را همچنین میتوان به کمک رقیقسازی حجم کمتری از محلول غلیظتر با آب، تهیه کرد. یک «محلول مادر» (Stock Solution)، محلولی است که به صورت تجاری با غلظت معین تهیه شده باشد. به طور معمول سعی بر این است که محلول مادر را رقیق کنند چراکه روش دیگر، یعنی وزن کردن مقادیر کم از حلشونده، دقت آزمایش را کاهش میدهد. همچنین، در مواردی همچون اسیدهای قوی، که محلولها را به صورت غلیظ به فروش میرسانند، از رقیق سازی استفاده میشود.
در این روش، با توجه به اینکه تعداد مولی حلشونده در محلول اولیه (غلیظ) و محلول ثانویه (رقیق) یکسان است، از تساوی بوجود آمده استفاده میکنیم تا موارد مجهول محاسبه شوند. در اینصورت روابط زیر برقرار خواهند بود. در این روابط، زیروندهای «s» و «d» به ترتیب معادل محلول مادر و رقیق هستند.

مثال رقیقسازی محلولها
چه حجم از محلول مادر ۳ مولار گلوکز برای تهیه محلول مثال قبل با حجم ۲۵۰۰ میلیلیتر نیاز داریم.
- معلوم: حجم و مولاریته محلول رقیق
- مجهول: حجم محلول مادر
برای حل این سوال، مراحل زیر را دنبال میکنیم:
- تعداد مولهای گلوکز در محلول رقیق را به کمک ضرب حجم در مولاریته محاسبه خواهیم کرد.
- برای تعیین حجم محلول مادر مورد نیاز، تعداد مول گلوکز را بر مولاریته تقسیم میکنیم.
غلظت محلول مثال قبل برابر با 0/310 مولار بود. تعداد مول گلوکز در ۲۵۰۰ میلیلیتر محلول را محاسبه میکنیم.
حال باید حجم محلول ۳ مولار شامل این مقدار گلوکز را حساب کنیم:
در تعیین حجم محلول مادر مورد نیاز، باید تعداد مول مورد نیاز گلوکز را بر غلظت محلول مادر تقسیم میکردیم تا به واحد مناسبی دست پیدا کنیم. همچنین، تعداد مول حلشونده در ۲۵۸ میلیلیتر از محلول مادر، برابر با همان تعداد مول در محلول رقیق با حجم ۲۵۰۰ میلیلیتر خواهد بود و تنها مقدار حلال عوض شده است.
بهتر است جوابی که به آن رسیدیم را تحلیل کنیم. با رقیق کردن محلول مادر به میزان ده برابر، حجم آن نیز در حدود ده برابر افزایش پیدا میکند یعنی از ۲۵۸ میلیلیتر به ۲۵۰۰ میلیلیتر رسیدیم. در اثر این اتفاق، غلظت حلال نیز باید در حدود ده برابر کاهش پیدا کند که از ۳ مولار به 0/310 مولار رسیدیم. لازم به ذکر است، این سوال را میتوانستیم در یک مرحله و به شکل زیر حل کنیم:

۳ روش کلی در تهیه محلول ها
پس از اینکه با حل چندین مثال، روش تهیه محلولها را بررسی کردیم. در این بخش قصد داریم تا ۳ روش کلی در تهیه محلول ها را با یکدیگر بررسی کنیم.
روش اول: تهیه محلول به کمک درصد وزنی (W/V)
فرمولی که برای این روش بکار میگیریم به صورت زیر نمایش داده شده است:
۱۰۰ × حجم محلول (میلیلیتر) / جرم حلشونده (گرم) = فرمول برای درصد وزنی
به طور مثال، محلول ۱۰ درصد شامل ۱۰ گرم سدیم کلرید حل شده در ۱۰۰ میلیلیتر محلول است که در ادامه، نحوه تهیه این محلول را بررسی خواهیم کرد.
دستورالعمل تهیه محلول به کمک درصد وزنی
به کمک ترازو، ۱۰ گرم سدیم کلرید را وزن کنید و آنرا داخل استوانه مدرج یا بالن حجمی با حجم تقریبا ۸۰ میلیلیتر بریزید. زمانی که با همزدن، سدیم کلرید به طور کامل در آب حل شد، به ظرف، آب اضافه کنید و محلول را به حجم مورد نظر (۱۰۰ میلیلیتر) برسانید. بار دیگر تاکید میکنیم که به هیچ عنوان پودر حلشونده را در ۱۰۰ میلیلیتر آب حل نکنید چراکه غلظت نهایی با غلظت مورد نظر به دلیل تفاوت در حجم محلول (بیش از ۱۰۰ میلیلیتر) متفاوت خواهد بود.
روش دوم: تهیه محلول به کمک درصد حجمی (V/V)
زمانیکه حلشونده، مایع باشد، به طور معمول میتوان غلظت محلول را به صورت درصد حجمی بیان کرد. رابطهای که برای درصد حجمی بیان میشود به صورت زیر خواهد بود:
۱۰۰ × حجم محلول (میلیلیتر) / حجم حلشونده (میلیلیتر) = درصد حجمی
در مثال زیر، نحوه تهیه ۱۰۰۰ میلیلیتر محلول ۵ درصد حجمی از اتیلن گلایکول (ماده اصلی در ضدیخ) را بررسی میکنیم.
دستورالعمل تهیه محلول با درصد حجمی مشخص
در ابتدا، درصد حلشونده را به صورت یک عدد اعشاری بیان کنید یعنی محلول ۵ درصد وزنی به شکل 0/05 بیان میشود. در ادامه، این عدد را در حجم کلی محلول ضرب کنید تا حجم حلشونده مورد نظر (اتیلن گلایکول) بدست آید:
حجم حلشونده (۵۰ میلیلیتر) را از حجم کل محلول کم کنید تا حجم آب مورد نیاز محاسبه شود که در اینجا با کم کردن ۵۰ میلیٰلیتر حلشونده از ۱۰۰۰ میلیٰلیتر محلول، به حجم ۹۵۰ میلیلیتر آب نیاز خواهیم داشت. برای تهیه این محلول، 50 میلیلیتر اتیلن گلایکول را در حجمی کمتر از ۹۵۰ میلیلیتر آب حل کنید. پس از انحلال، محلول ایجاد شده را با اضافه کردن آب، به حجم مورد نظر برسانید. با این کار، خطای فرآیند به حداقل میرسد چراکه حجم نهایی محلول، با مجموع حجمهای محاسبه شده، برابر نخواهد بود.
روش سوم: تهیه محلولهای مولار
محلولهایی با غلظت مولاریته، پرکاربردترین محلولها در محاسبات مربوط به واکنشهای شیمیایی به شمار میآیند چراکه به طور مستقیم، تعداد مول حلشونده را به حجم محلول، مرتبط میکنند. همانطور که میدانید، مولاریته یک محلول به صورت زیر محاسبه میشود:
یک لیتر محلول / مول حلشونده = مولاریته
مثال تهیه محلول با غلظت مولار
جرم مولی در مولکول سدیم کلرید (NaCl)، برابر با 58/44 گرم بر مول است. اگر ۵۸/۴۴ گرم سدیم کلرید را در حجم نهایی ۱ لیتر محلول، حل کنیم، محلول سدیم کلرید با غلظت ۱ مولار تهیه کردهایم. اگر بخواهیم محلول سدیم کلرید با سایر غلظتها را تهیه کنیم، مقدار جرم مورد نیاز به سادگی با روش زیر تهیه میشود:
- محلول 0/1 مولار:
- محلول 0/5 مولار:
- محلول ۲ مولار:
بررسی غلظت یون ها در محلول
در بخش «غلظت محلولها»، محاسبه کردیم که محلولی شامل 90 گرم آمونیوم دیکرومات در حجم نهایی 250 میلیلیتر، غلظتی برابر با 1/43 مولار دارد. حال، این مطلب را با جزئیات بیشتری بررسی خواهیم کرد. آمونیوم دیکرومات در هر واحد فرمولی خود، ترکیبی یونی شامل ۲ یون و یک یون است. مانند سایر ترکیبات یونی، این ترکیب نیز الکترولیتی قوی به شمار میآید که با تفکیک در محلولهای آبی، یونهای بیآب ذکر شده در بالا را بدست میدهد.
بنابراین، یک مول از آمونیوم کلرید، با حل شدن در آب، یک مول آنیون و ۲ مول کاتیون ایجاد میکند. زمانیکه بخواهیم واکنشی شیمیایی را بوسیله محلول نمکی همچون آمونیوم دیکرومات انجام دهیم باید از غلظت یونهای موجود در محلول اطلاع داشته باشیم. اگر محلول با غلظت 1/43 مولار داشته باشیم، در نتیجه، غلظت برابر با ۱ مولار و غلظت یونهای برابر با ۲/86 مولار خواهد بود زیرا در هر واحد فرمولی، ۲ یون داریم.
از آنجایی که هر واحد فرمولی از ، به هنگام انحلال در آب، ۳ یون تولید میکند، غلظت کل یونها در محلول، به صورت زیر محاسبه خواهد شد:
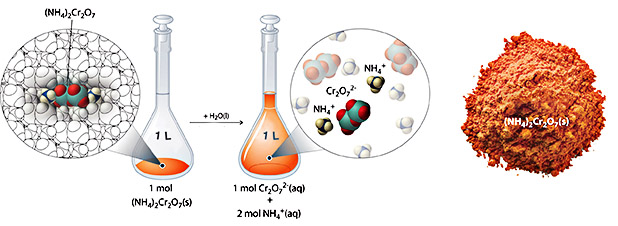
مثال برای محاسبه غلظت یون ها در محلول
غلظت هریک از ذرات موجود در محلولهای آبی زیر را بیان کنید.
- محلول 0/21 مولار
- محلول ۳/۷ مولار
- محلول 0/032 مولار
در این مثال، مقادیر مولاریته محلولها داده شده و غلظت هر یک از یونها خواسته شده است. برای حل این سوال، مراحل زیر را دنبال میکنیم:
- هر ترکیب را به دستههای غیر الکترولیت یا الکترولیت قوی تقسیم میکنیم.
- اگر ترکیب، غیرالکترولیت باشد، غلظت آن با مولاریته محلول، برابر است. اگر ترکیب، الکترولیتی قوی باشد، تعداد یونها در هر واحد فرمولی را مشخص کنید. با ضرب تعداد یونها در مولاریته محلول، غلظت هریک از ذرات، محاسبه میشود.
سدیم هیدروکسید، ترکیبی یونی و یک الکترولیت قوی در محلولهای آبی به شمار میآید. معادله تفکیک آن در آب به صورت زیر است:
با توجه به اینکه هر واحد فرمولی سدیم هیدروکسید، یک یون و یک یون تولید میکند، غلظت هر یون برابر با غلظت سدیم هیدروکسید است.
فرمول شامل گروه عاملی و بیانگر یک الکل است. الکلها ترکیباتی کووالانسی هستند که در اثر انحلال در آب، محلولی با مولکولهای خنثی ایجاد میکنند و به عبارت دیگر، الکلها، غیرالکترولیت هستند. در نتیجه، تنها ذره حلشونده در محلول، مولکول خواهد بود و غلظت آن برابر با ۳/7 مولار است.
ایندیم نیترات، ترکیبی یونی شامل یون و ۳ یون خواهد بود. بنابراین، انتظار داریم تا رفتاری همچون یک الکترولیت قوی در محلول آبی داشته باشیم.
یک واحد فرمولی از ، یک یون و ۳ یون تولید میکند. بنابراین، 0/032 مولار از محلول ، غلظتی برابر با 0/032 مولار یون ایندیوم و 0/096 مولار یون خواهد داشت.
معرفی فیلم آموزش محلول سازی در آزمایشگاه
از آنجایی که در علم شیمی، آشنایی با نحوه تهیه محلولها برای پیشبرد اهداف مختلف و بررسی صحیح نتایج آزمایشات، اهمیت بسیاری دارد، فرادرس اقدام به انتشار دوره ویدیویی تحت عنوان «آموزش محلولسازی در آزمایشگاه» کرده است. این دوره آموزشی، در ۸ فصل به بررسی روش تهیه محلول در آزمایشگاه میپردازد. در فصل اول، مفاهیم پایه همچون تعریفها و همچنین، روش استفاده از استوکیومتری در محاسبات، مورد بررسی قرار میگیرد. لوازم آزمایشگاه و دانستنیهای مهم در خصوص آزمایشگاه را در فصل دوم میآموزیم.
محلولسازی از ترکیبات جامد نمکهای معدنی، محلولسازی از اسیدهای تجاری، روش تهیه محلول بازی و محلول بافر، دستورالعمل ساخت معرفهای پرکاربرد و مفاهیم پیشرفته در محلولسازی، از جمله مواردی هستند که در این دوره ویدیویی بیان میشوند.
ا











لطفا” روش ساخت اسید سولفوریک 10ppm از اسید سولفوریک 98 درصد به چه شکلی است؟
سلام چگونه میتونیم محلول 30آمونیاک تهیه کنیم
سلام میخوام باز اتوکسید سدیم بسازم اگر ۲۵ گرم سدیم را در ۷۵ میلیتر اتانول مطلق حل کنم چه مقدار پودر سدیم اتوکسید بهم میده بعد از تبخیر و روتاری ؟؟؟
سلام.چطوری میتونم محلول باریوم کلرور 5درصد بسازم؟
سلام
میخواهم محلولی از دو جزء یکی با دانسیته ۷۷۰ و دیگری ۷۰۳ با درصد وزنی ۷۰ به ۳۰ بسازیم، لطفا راهنمایی کنید
سلام . ۵۰ سی سی محلول استوک ۱۰۰۰ ppm از تیوفن میخوام بسازم باید چطوری محاسبه کنم. چگالی تیوفن ۱/۰۵۱
سلام وقت بخیر
۵۰۰ میلی لیتر محلول اتانول ابی ۱۶ درصد وزنی_ حجمی را با جرم مولی ۴۶.۱ چگونه تهیه می شود؟
ممنون از راهنمایی شما??
سلام می خواهم از سود غلیظ ۹۱ درصد(جامد) ،۴۰۰لیتر محلول سود ۴۰درصد تهیه کنم ممنون میشم راهنمایی کنید🙏
سلام ـ محلول ۳مولار سدیم هیدروکسید چگونه تهیه میشود. ممنونم از راهنمایی شما