اسید سولفوریک چیست؟ – به زبان ساده + فرمول و کاربردها

اسید سولفوریک با فرمول شیمیایی یکی از قویترین اسیدها است که خورندگی بالایی دارد. این اسید که با نام جوهر گوگرد نیز شناخته میشود یک اسید معدنی به شمار میرود و به عنوان اکسیدکننده قوی و ماده خشککننده (رطوبتگیر) رفتار میکند. در هر نسبتی در آب حل میشود که در اثر این واکنش گرمای بسیار زیادی را آزاد میکند. این اسید در صنعت کاربرد بسیار زیادی دارد و به عنوان یکی از مهمترین مواد صنعتی در بین مواد شیمیایی به شمار میرود. در این مطلب با بررسی ساختار و ویژگیهای فیزیکی و شیمیایی یاد میگیریم اسید سولفوریک چیست و چه کاربردهایی دارد و در صورت عدم رعایت نکات ایمنی در حین کار با این اسید چه خطراتی میتواند سلامتیمان را تهدید کند.
اسید سولفوریک چیست ؟
اسید سولفوریک قدرت اسیدی بالایی دارد که در غلظتهای بالا به عنوان اکسیدکننده قوی و رطوبتگیر رفتار میکند. جوهر گوگرد مایعی بیرنگ و بدون بو است که در هر نسبتی در آب حل میشود و این واکنش شیمیایی بهشدت گرماده است. ازجمله کاربردهای مهم آن میتوان به استفاده از در تهیه انواع کودها، در سنتز مواد شیمیایی مختلف و فرآیندهای مربوط به تصفیه آب اشاره کرد. ثابت دیالکتریک در سولفوریک اسید غلیظ برابر ۱۰۰ بوده که سبب قطبی شدن محلول میشود.
میتوان گفت که این اسید یکی از مهمترین مواد شیمیایی در صنایع به شمار میرود که به طور گستردهای در زمینههای مختلفی مورد استفاده قرار میگیرد. از آنجا که قدرت اسیدی جوهر گوگرد بالاست بهمنظور تشکیل یونهای هیدرونیوم () و یونهای سولفات هیدروژن () به طور کامل یونیده میشود.

سولفات هیدروژن در محلولهای بسیار رقیق به منظور تشکیل یونهای سولفات دچار یونش میشود. اسید سولفوریک غلیظ بسیار خورنده است بهگونهای که میتواند سنگ و فلزات را نیز در خود حل کند. فراریت اسید سولفوریک در مقایسه با سایر اسیدها پایین است به همین دلیل در تهیه اسیدهای فرار از نمکهای مکمل آنها استفاده میشود.
ساختار سولفوریک اسید
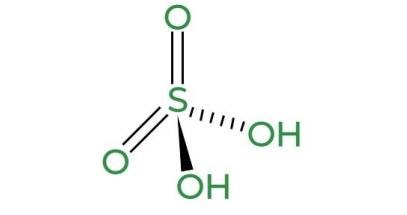
همانطور که از فرمول شیمیایی اسید سولفوریک مشخص است این اسید از ترکیب سه عنصر گوگرد، اکسیژن و هیدروژن در کنار هم تشکیل میشود. پیوند شیمیایی در این ترکیب از نوع کوالانسی است که در آن یک اتم گوگرد به دو اتم اکسیژن از طریق پیوند دوگانه و دو مولکول دو اتمی هیدروکسیل از طریق پیوند یگانه متصل میشود.
ساختار سولفوریک اسید به صورت تتراهدرال بوده که در تصویر زیر نشان داده شده است. به دلیل اینکه این اسید دو پروتون آزاد میکند به آن اسید دو پروتونی میگویند.
خواص جوهر گوگرد
برای اینکه بدانیم اسید سولفوریک چیست بررسی خواص فیزیکی و شیمیایی آن کمک بسیار بزرگی میکند. به همین دلیل این قسمت از مطلب را به خواص فیزیکی و شیمیایی جوهر گوگرد اختصاص دادیم.
خواص فیزیکی
ازجمله خواص فیزیکی جوهر گوگرد میتوان به درجه غلظت، قطبی، رسانایی، چگالی آن و غیره اشاره کرد.
غلظت های اسید سولفوریک
اگرچه محلول اسید سولفوریک را میتوان با غلظت ۱۰۰ درصد هم تهیه کرد اما محلول مورد نظر با رسیدن به نقطه جوش را از ساختار جدا میشود و غلظت آن به ۹۸/۳٪ میرسد. این غلظت (۹۸/۳٪) بیشترین پایداری را دارد و به جوهر گوگردی با این غلظت، اسید سولفوریک غلیظ میگویند.
سایر غلظتهای این اسید با نامهای خاصی ازجمله اسید باتری شناخته میشوند که برای برخی موارد کاربرد دارند. در جدول زیر غلظتهای مهم اسید سولفوریک بر اساس درصد جرمی و چگالی تقسیمبندی شدهاند.
| درصد جرمی | دانسیته | غلظت |
| ۲۹> | ۱/۲۵-۱/۰۰ | ۴/۲> |
| ۳۲-۲۹ | ۱/۲۸-۱/۲۵ | ۵/۰-۴/۲ |
| ۷۰-۶۲ | ۱/۶۰-۱/۵۲ | ۱۱/۵-۹/۶ |
| ۸۰-۷۸ | ۱/۷۳-۱/۷۰ | ۱۴/۰-۱۳/۵ |
| ۹۳/۲ | ۱/۸۳ | ۱۷/۴ |
| ۹۸/۳ | ۱/۸۴ | ۱۸/۴ |
رسانایی و قطبیت
غلیظ محلولی است که دیالکتریک آن چیزی حدودا ۱۰۰ بوده و رسانایی الکتریکی بالایی دارد. دلیل رسانایی الکتریکی تفکیک یونهای مثبت و منفی از طریق ایجاد پروتون توسط خود جوهر گوگرد است. به این فرایند، فرایند خود پروتونکافت میگویند که واکنش آن را به صورت زیر میتوان تعریف کرد:
ثابت تعادل برای واکنش فوق در دمای اتاق به صورت زیر محاسبه میشود:
K_{ap} ([H_3SO_4]^+[HSO_4]^−)= 2.7×10^{−4}
با وجود ویسکوزیته اسید، به دلیل رسانایی موثر یونهای و جوهر گوگرد به عنوان رسانا به خوبی میتواند عمل کند. همچنین استفاده از این اسید به عنوان حلال در بسیاری از واکنشهای شیمیایی گزینه بسیار خوبی میتواند باشد.
خواص شیمیایی اسید سولفوریک
در این قسمت برای بررسی خواص شیمیایی اسید سولفوریک به واکنشهایی که در آنها به عنوان واکنشدهنده شرکت دارد میپردازیم تا یاد بگیریم اسید سولفوریک چیست و شیمیایی آن چگونه خواهد بود.
واکنش با آب
همانطور که در قسمتهای قبلی اشاره کردیم واکنش آب و اسید سولفوریک به شدت گرماده است. به همین جهت برای رقیقسازی اسید، باید اسید به آب اضافه شود و نه آب به اسید که دلیل این امر را به صورت مفصل در همین مطلب بررسی میکنیم. واکنش ترکیب اسید و آب را میتوان به عنوان واکنشی برای تشکیل یون در نظر گرفت:
و به ترتیب آنیونهای بیسولفات و سولفات هستند. و ثابتهای تفکیک اسید را نشان می دهند که در بالا مقدار آنها مشخص شده است.
خواص اسید و باز
سولفوریک اسید با بیشتر بازها برای تشکیل محصولات سولفاتی وارد واکنش میشود.
برای مثال نمک مس (II) سولفات آبیرنگ که اغلب برای رسوب الکتروشیمیایی کاربرد دارد از طریق ترکیب سولفوریک اسید با مس (II) اکسید مطابق واکنش زیر تشکیل میشود.

همچنین جوهر گوگرد طی واکنشهای جابجایی یا جانشینی میتوانند با برخی نمکها باعث ایجاد تشکیل اسیدهای ضعیف میشود. همانند واکنش زیر که طی آن سدیم استات با سولفوریک اسید واکنش میدهد. این واکنش از نوع واکنش جانشینی دوگانه بوده که طی آن کربوکسیلیک اسید و سدیم بیسولفات حاصل میشود. کربوکسسلیک اسید جزء اسیدهای ضعیف به شمار میرود.
از طرفی واکنش سولفوریک اسید با پتاسیم نیترات میتواند برای تولید نیتریک اسید و رسوب پتاسیم بیسولفات مورد استفاده قرار بگیرد. زمانی هم که با نیتریک اسید ترکیب میشود دو نقش اکسیدکننده و خشککننده را با هم میتواند داشته باشد. در اثر این ترکیب یون نیترویوم را به وجود میآورد که برای واکنشهای نیتراسیون ازجمله جانشینیهای آروماتیک الکترودوست نقش بسیار مهمی را دارد.
یکی از واکنشهای بسیار مهم سولفوریک اسید، واکنش آن با باز قوی است. زمانیکه این اسید و باز با هم ترکیب میشوند محلول مورد نظر به رنگ آبی لاجوردی در میآید. در اثر این واکنش دو نوع نمک میتواند به وجود آید که در دو واکنش زیر آورده شدهاند.
همانطور که از دو واکنش فوق مشخص است در اثر ترکیب سدیم هیدروکسید با اسید سولفوریک دو نمک و به وجود میآید. به این گونه واکنشهای ترکیب اسید با باز، واکنش خنثی شدن میگویند.
واکنش اسید سولفوریک با فلزات
سولفوریک اسید رقیق با بسیاری از فلزات طی واکنش جانشینی یگانه وارد واکنش میشود و همانند سایر اسیدها در اثر این چنین واکنشی گاز هیدروژن و نمکهای سولفات را به عنوان فراورده به وجود میآورد. جوهر گوگود فلزاتی را مانند آهن، آلومینیوم، روی، منیزیم و نیکل را مورد حمله قرار میدهد، به این دلیل واژه حمله را به کار میبریم زیرا سبب خوردگی آنها میشود و اثر مخربی بر روی آنها دارد. واکنش آهن با سولفوریک اسید در زیر نشان داده است.
سولفوریک اسید غلیظ میتواند به عنوان اکسیدکننده نقش داشته باشد که در این صورت در اثر ترکیب با فلزاتی مانند مس، گاز گوگرد دیاکسید آزاد میکند. این واکنش به صورت امکانپذیر خواهد بود:
نکته: البته فلزاتی مانند تنگستن و جیوه در مقابل این اسید مقاومت بالایی از خود نشان میدهند.
واکنش کربن و گوگرد
سولفوریک اسید غلیظ کربن و گوگرد را مانند زغالسنگ قیری - بیتومین یا زغالسنگ قیری نوعی از زغالسنگ است که به دلیل داشتن ماده قیرمانند، بیتومین یا آسفالت نام دارد - اکسید میکند. واکنش اکسایش این دو عنصر با سولفوریک اسید در زیر نشان داده شده است:
واکنش با سدیم کلرید
سولفوریک اسید با سدیم کلرید واکنش میدهد و گاز هیدروژن کلرید و سدیم بیسولفات را طی واکنشی که در زیر نشان داده شده به وجود میآورد.
جانشینی آروماتیک الکتروفیل
جوهر گوگرد غلیظ با بسیاری از مواد آلی مانند بنزن، تلورن و غیره واکنش میدهد و ترکیبات اسیدهای سولفونیک را به وجود میآورد. ترکیب بنزن با اسید سولفوریک تحت واکنش جانشینی آروماتیک الکتروندوست مانند تصویر است.
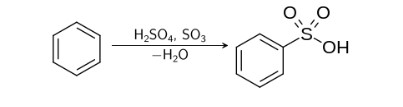
واکنش تصویر فوق نیز به صورت زیر خواهد بود:
واکنشهای رسوبی با سولفوریک اسید
در ترکیب با محلولهای آبی باریم، سرب و سایر نمکها رسوبهایی را به وجود میآورند که مربوط به سولفاتهای انحلالناپذیر است. این واکنشها از نوع جانشینی دوگانه هستند. به عنوان مثال:

نکته: در واکنش فوق استفاده از پیکان با جهت رو به پایین به معنای تشکیل شدن رسوب بوده و برای واکنشهایی مورد استفاده قرار میگیرد که در اثر ترکیب واکنشدهندهها با هم رسوب ایجاد میشود. در صورتی که جهت پیکان رو به بالا باشد به این معناست که فراورده (ها) در حالت گاز قرار دارند.
واکنش سولفوریک اسید با گوگرد تریاکسید
اولئوم که به اسید سولفوریک بخاری شکل نیز شناخته میشود زمانی به وجود میآید که گوگرد تریاکسید را همانند واکنش زیر در خود حل کند.
در جدول زیر مهمترین خواص فیزیکی و شیمیایی سولفوریک اسید فهرست شده است.
| نام اسید | سولفوریک اسید، جوهر گوگرد |
| شکل ساختاری | تتراهدرال |
| فرمول مولکولی | |
| نقطه ذوب | ۱۰/۳۱ درجه سانتیگراد |
| نقطه جوش | ۳۳۷ درجه سانتیگراد |
| حلالیت در آب | انحلالپذیر |
| اسیدیته |
|
| چگالی | 1/83 گرم بر سانتیمتر مکعب |
| جرم مولی | ۹۸/۰۷۹ |
| انحلالپذیری در آب | انحلال پذیر است (فرایند گرمازاست) |
| pH | ۲/۷۵ (۱mM)
۱/۸۷ (۱۰mM) ۱/۰۱ (۱۰۰mM) |
| بافت اسید | روغنی |
روش های تولید اسید سولفوریک
سولفوریک اسید علاوه بر اینکه در طبیعت به صورت طبیعی یافت میشود طی روشهای شیمیایی نیز سنتز و تولید میشود.
جوهر گوگرد در طبیعت
اسید سولفوریک یا جوهر گوگرد به طور طبیعی توسط اکسایش مینرالهای سولفیدی مانند سولفید آهن در طبیعت تولید میشوند. مایعی که از این روش به دست میآید میتواند خاصیت اسیدی بسیار بالایی داشته باشد به گونهای که قادر خواهد بود فلزات موجود در سنگ معدنی سولفیدی را در خود حل کند. این امر منجر به تشکیل محلولهای سمی با رنگ روشن میشود. اکسایش پیرت (سولفید آهن) توسط مولکولهای اکسیژن مطابق واکنش زیر سبب تولید آهن (II) یا میشود:
یون میتواند مطابق واکنش زیر مجددا اکسایش شود و یون را به وجود بیاورد.
که طی واکنش فوق به وجود آمد در اثر ترکیب با آب میتواند رسوب هیدروکسید آهن را به وجود بیاورد که در واکنش زیر نشان داده شده است.
آئروسل استراتوسفر
در استراتوسفر - لایه دوم اتمسفر که معمولا ۱۰ تا ۵۰ کیلومتر از سطح زمین فاصله دارد - اسید سولفوریک توسط اکسایش گوگرد دیاکسید فرار و رادیکال هیدروکسیل به وجود میآید. واکنش سه مرحلهای زیر تشکیل سولفوریک اسید در استراتوسفر را نشان میدهد.
به این دلیل که جوهر گوگرد در استراتوسفر به حالت فوق اشباع در میآید میتواند باعث جوانهزنی ذرات آئروسل شود. همچنین از طریق تراکم و انعقاد با دیگر آئروسلهای اسید سولفوریک رقیق میتواند سطحی را برای رشد آئروسل فراهم کند.
تولید اسید سولفوریک
در قسمت قبلی آموختیم که در طبیعت و بدون هیچ عامل خارجی چگونه اسید سولفوریک میتواند به وجود آید. در ادامه به معرفی و بررسی روشهای تولید آن میپردازیم که در کارخانهها و با ترکیب مواد شیمیایی مختلف اسید سولفوریک تولید میشود. از مهمترین روشهای تولید سولفوریک اسید عبارتند از:
- فرایند تماس
- فرایند اسید سولفوریک تر
فرایند تماس
این فرایند از ۴ مرحله تشکیل شده که عبارتند از:
- سوختن و تشکیل گوگرد دیاکسید
- اکسایش گوگرد دیاکسید و تولید گوگرد تریاکسید
- جذب گوگرد تریاکسید توسط اسید سولفوریک غلیظ برای تولید اولئوم
- رقیق کردن اولئوم با آب برای تولید اسید سولفوریک رقیق
- مرحله ا: در این مرحله گوگرد در حضور اکسیژن بر اساس واکنش زیر میسوزد:
- مرحله ۲: گوگرد دیاکسید به گوگرد تریاکسید در حضور وانادیم اکسید به عنوان کاتالیست، اکسیده میشود. این واکنش برگشتپذیر و گرماده است.
- مرحله ۳: گوگرد تریاکسید توسط سولفوریک اسید غلیظ با هدف تشکیل اولئوم جذب میشود. این واکنش را میتوان به صورت زیر تعریف کرد:
- مرحله۴: در آخرین مرحله اولئوم تشکیل شده با آب رقیق میشود و سولفوریک اسید رقیق به وجود میآید.
در صورتیکه گوگرد تریاکسید به صورت مستقیم در آب حل شود به این روش فرایند سولفوریک اسید تر میگویند. البته در صنعت این روش به ندرت برای تولید سولفوریک اسید مورد استفاده قرار میگیرد زیرا این فرایند به شدت گرمازا بوده و باعث تشکیل آئروسل اسید سولفوریک با حرارت بالا میشود. آئروسل اسید سولفوریکی که حرارت آن بالاست نیاز به تراکم و روشهای جداسازی دارد، به همین دلیل این روش در صنعت در مقایسه با فرایند تماس کمتر مورد استفاده قرار میگیرد.
فرایند اسید سولفوریک تر
این فرایند شامل ۴ مرحله است که هر یک از این مراحل را به طور جداگانه بررسی میکنیم.
- مرحله۱: در این مرحله گوگرد در تماس با اکسیژن میسوزد و طی این واکنش ۲۹۷ کیلوژول انرژی آزاد میشود.
یا اینکه گاز هیدروژن سولفید مطابق واکنش زیر با مولکول اکسیژن میسوزد و گاز را به وجود میآورد. این واکنش گرمای بیشتری را در مقایسه با واکنش فوق آزاد میکند.
یادآوری: علامت منفی برای انرژی نشاندهنده این است که در اثر این واکنشها گرما آزاد میشود و واکنش مورد نظر گرماده است.
- مرحله ۲: گوگرد دیاکسید طی فرایند اکسایش به گوگرد تریاکسید تبدیل میشود که این واکنش در حضور وانادیم اکسید به عنوان کاتالیزور صورت میپذیرد. لازم به ذکر است که این واکنش نیز از نوع برگشتپذیر است.
- مرحله ۳: گوگرد تریاکسید طی واکنش با آب و هیدراته شدن، گاز سولفوریک اسید را به وجود میآورد. این واکنش را میتوان به صورت تعریف کرد:
- مرحله ۴: آخرین مرحله از این فرایند متعلق به تراکم سولفوریک اسید و تبدیل آن به مایع اسید سولفوریک ۹۷-۹۸٪ خواهد بود که این واکنش به صورت زیر نشان داده میشود:
البته علاوه بر روشهای فوق روشهای دیگری هم مانند ترکیب گوگرد دیاکسید با اسیدنیتریک و آب وجود دارد اما مهمترین روشها برای تولید این اسید همان دو روش تماس و سولفوریک اسید تر است.
خطرات اسید سولفوریک چیست ؟
اسید سولفوریک منجر به سوختگیهای شدید میشود به خصوص اگر غلظت آن بالا باشد. این اسید مانند سایر اسیدهای خورنده و قلیایی در تماس با برخی از بافتهای بدن مانند پوست و گوشت در اثر هیدرولیز استر و آمید، پروتئینها و لیپیدها را تجزیه میکند. علاوه بر این موضوع، اسید سولفوریک به سرعت رطوبت موجود در اطراف را به خود جذب میکند و در اثر این جذب رطوبت، حرارت بسیار بالایی آزاد میشود. این امر منجر به سوختگیهای ثانویه و همچنین نابینایی در اثر تماس اسید با چشم میشود که دلیل آن حمله به قرنیه است.
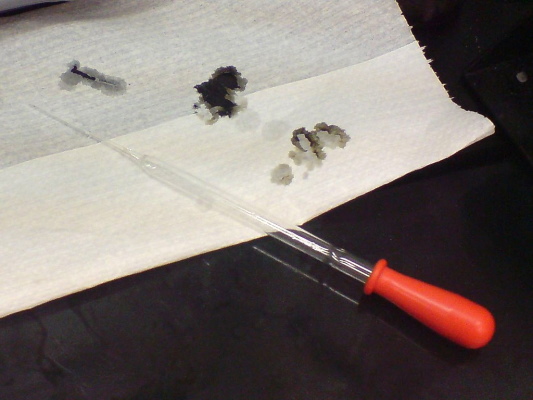
اگر سولفوریک اسید به طور کامل استنشاق یا بلعیده شود میتواند به اندامهای داخلی آسیب جدی بزند یا حتی در موارد حادتر کشنده باشد. به همین دلیل زمانیکه افراد چه در آزمایشگاههای دانشگاهی، تحقیقاتی و چه در صعنت سر و کار دارند باید از وسایل ایمنی مانند دستکش، عینک و روپوش ایمنی استفاده کنند. همچنین حتما برای وزن کردن، تیتراسیون و یا انجام کارهایی از این قبیل اسید را زیر هود قرار دهید. به همین دلایل این اسید به مراتب بسیار خطرناکتر از سایر اسیدهای قوی مانند هیدروکلریک اسید و اسید نیتریک است.
در تصویر زیر میتوانید ببینید در اثر تماس جوهر گوگرد با دستکش، چگونه دستکش سوراخ شده است.

اسید سولفوریک باید به خوبی در ظروفی غیرواکنشی مانند شیشه نگهداری شود. بر روی ظروف حاوی محلولهای اسید سولفوریک با غلظت ۱/۵ مولار یا بیشتر از این مقدار برچسبی با مفهوم «خورنده» قرار دارد. در حالیکه بر روی ظروف حاوی محلولهایی با غلظتی بین ۰/۵ تا ۱/۵ مولار برچسبی با مضمون «تحریککننده» یا «سوزشآور» چسبانده میشود.

همچنین غلظتهای رقیق اسید در آزمایشگاه (حدود ۱مولار ، ۱۰٪) اگر در مدت طولانی در تماس با کاغذ قرار بگیرد مانند تصویر سبب تغییر رنگ کاغذ میشود.
خطرات رقیق سازی جوهر گوگرد
رقیقسازی جوهر گوگرد و یا هر اسید قوی دیگر خطرناک به شمار میرود زیرا در اثر ترکیب اسید با آب، گرمای بسیاری آزاد میشود. به همین دلیل برای رقیقسازی باید اسید به آب اضافه شود و نه آب به اسید! ممکن است از خود بپرسید که این که آب به اسید یا اسید به آب اضافه شود چه تفاوتی را میتواند ایجاد کند. در پاسخ به این سوال باید گفت که آب، گرمای نهان بالاتری در مقایسه با اسید سولفوریک دارد به همین دلیل ظرفی که درون آن آب قرار دارد در اثر افزودن اسید به آب، گرمای آزاد شده را به خود جذب میکند.
از طرفی اسید چگالتر از آب است و در اثر افزوده شدن اسید به آب، اسید به ته ظرف میرود. گرما در فصل مشترک بین آب و اسید آزاد میشود بنابراین در این حالت، گرمای آزاد شده در کف ظرف خواهد بود. آبی که در اثر گرمای آزاد شده گرم میشود به دلیل انتقال گرمایی از نوع همرفت در جهت بالا حرکت میکند که باعث میشود فصل مشترک خنک شود. در نتیجه این امر از به جوش آمدن اسید و آب جلوگیری میکند.
در صورتی که آب به اسید غلیظ افزوده شود، لایهای با ضخامت کم در سطح بالای آب ایجاد میشود. گرمای آزاد شده در این لایه میتواند آب را به جوش آورد زیرا حرارت آزاد شده بالاتر از ۱۰۰ درجه سانتیگراد (دمای جوش آب) است. این امر منجر به پراکندگی آئروسل سولفوریک اسید می شود یا در حالت خطرناکتر میتواند انفجار رخ دهد.

تهیه کردن محلولهایی با غلظت بیش از ۶ مولار (۳۵٪) به شدت خطرناک است زیرا حرارتی که در این غلظت آزاد میشود امکان دارد توانایی به جوش آوردن اسید را داشته باشد. به همین دلیل در این حالت باید از همزن مکانیکی به همراه سیستم خنک کننده طبیعی مانند حمام یخ استفاده کرد. همچنین در نظر داشته باشید علاوه بر افزودن اسید به آب در فرایند رقیقسازی باید این نکته را به خاطر داشته باشیم که برای این کار استفاده از آب سرد ضروری است. زیرا در صورت استفاده از آب گرم واکنش انفجاری خطرناکی میتواند رخ دهد.
در مقیاس آزمایشگاهی در اثر ریختن جوهر گوگرد بر روی تکههای یخ خرد شده (که از آب دیونیزه تشکیل شده است) میتوان آن را رقیق کرد. تکههای یخ هنگامی که اسید را در خود حل میکنند طی فرایند گرماده ذوب میشوند. در این فرایند مقدار گرمایی که تکههای یخ برای ذوب شدن به آن نیاز دارند بیشتر از مقدار گرمایی است که از حل شدن اسید در آب آزاد میشود به همین دلیل در این حالت محلول خنک باقی میماند. در صورتی که همه تکههای یخ ذوب شدند میتوان فرایند رقیقسازی را با همان آب ادامه داد.
خطرات صنعتی جوهر گوگرد
جوهر گوگرد اشتعالپذیر نیست اما در حالت کلی مهمترین خطری که این اسید در صنعت میتواند داشته باشد همان سوختگی است که در اثر تماس پوست با اسید و پراکندگی ذرات معلق در هوا رخ میدهد.
کاربرد های اسید سولفوریک
در زمینههای بسیاری کاربرد دارد. از جمله این کاربردها میتوان به موارد زیر اشاره کرد:
کودهای فسفاتی: مهمترین و اصلیترین کاربرد اسید سولفوریک استفاده از آن برای تهیه و تولید کودهای فسفاتی است. به عنوان مثال آمونیوم سولفات مهمترین کود نیتروژندار است که محصول جانبی کارخانههای زغال سنگ به شمار میرود. در اثر تجزیه زغالسنگ، آمونیا به وجود میآید که با اسید سولفوریک واکنش میدهد. در اثر این واکنش فراورده به صورت نمکی با رنگ قهوهای (به دلیل حضور آهن) متبلور میشود و کود را به وجود میآورد. این کود در صنعت کشاورزی مورد استفاده قرار میگیرد.

چرخه گوگرد - ید: چرخه گوگرد - ید مجموعهای از فرایندهای حرارتی - شیمیایی است که برای تولید هیدروژن از آب کاربرد دارد.
این چرخه شامل سه واکنش شیمیایی است که در زیر آورده شدهاند.
به این واکنش، واکنش «بونزن» میگویند یعنی واکنشی که در آن ید با گوگرد دیاکسید با آب واکنش میدهد و طی آن هیدروژن یدید و جوهر گوگرد به وجود میآیند. این دو فراورده به ترتیب در دماهای ۳۲۰ و ۸۳۰ درجه سانتیگراد میتوانند تجزیه شوند که واکنش تجزیه هر یک از آنها به صورت زیر خواهد بود:
در واکنش فوق اسید سولفوریک در دمای ۸۳۰ درجه سانتیگراد تجزیه و به اجزای سازنده خود یعنی اکسیژن، آب و گوگرد دیاکسید تبدیل میشود. از طرفی هیدروژن یدید نیز میتواند در دمای ۳۲۰ درجه سانتیگراد طبق واکنش زیر تجزیه و به ید و هیدروژن تبدیل شود.
ترکیبات گوگرد و ید دوباره میتوانند مورد استفاده قرار بگیرند به همین دلیل به آن چرخه میگویند. در حال حاضر این چرخه برای اینکه به یک روش عملی برای به دست آوردن هیدروژن تبدیل شود بسیار مورد مطالعه قرار میگیرد اما به دلیل غلیظ و خورنده بودن اسید که در دمای بالا منجر به آسیب میشود استفاده از این روش محدویت دارد.
چرخه هیبرید گوگرد: «چرخه هیبرید گوگرد» (HyS) یک فرایند شکافت آب دو مرحلهای است که از آن برای تولید هیدروژن استفاده میشود.
شویندههای صنعتی: از جوهر گوگرد به عنوان مواد شوینده برای از بین بردن گرد و غبار از فولاد و آهن استفاده میشود.
کاتالیست: سولفوریک اسید میتواند به عنوان کاتالیزور در بسیاری از واکنشهای شیمیایی ازجمله تبدیل «سیکلوهگزانون اکسیم» به «کاپرولاکتام» برای تولید نایلون، تولید هیدروکلریک اسید از نمک آن، واکنش ایزوبوتان با ایزوبوتیلن برای تولید ایزواوکتان و غیره شرکت داشته باشد.
الکترولیت: در باتریهای اسید-سرب به عنوان الکترولیت نقش دارد.
علاوه بر کاربردهای بالا از سولفوریک اسید در تصفیه نفت، در باتریهای حافظهدار، در تولید آهن و فولاد، به عنوان ماده شوینده نیز در مصارف خانگی استفاده میشود.
سوالات متداول مرتبط با اسید سولفوریک
در این مطلب با بررسی ساختار و خواص فیزیکی و شیمیایی اسید یاد گرفتیم سولفوریک اسید چیست، در ادامه به سوالاتی که ممکن است در رابطه با این اسید پیش آید پاسخ میدهیم.
اسید سولفوریک چه رنگی است ؟
جوهر گوگرد مایعی بیرنگ و بدون بو است که در هر نسبتی در آب حل میشود و در اثر واکنش با آب گرمای بسیار زیادی را آزاد میکند.
اسید سولفوریک چه کاربردی دارد ؟
کاربرد اصلی اسید سولفوریک در فرایند کودسازی است به عنوان مثال سوپرفسفات آهک و آمونیوم فسفات دو نمونه از مهمترین کودها هستند که در ساخت آنها از جوهر گوگرد استفاده میشود. همچنین این اسید در تولید هیدروکلریک اسید، نیتریک اسید، نمکهای سولفات، دترجنت، رنگ، رنگدانه و در داروسازی نیز کاربرد دارد.
قویترین اسید در جهان متعلق به کدام اسید است؟
کربوران سوپراکسید میتواند به عنوان اسیدی در نظر گرفته شود که در جهان به عنوان قویترین اسید خورشیدی شناخته میشود.
سولفوریک اسید چگونه خنثی میشود؟
ترکیب جوش شیرین با اسید موجب خنثی شدن آن میشود به طور کلی این کار سبب خنثی شدن اسیدهای ضعیفتر مانند سرکه (استیک اسید) یا حتی سمی و قوی مانند هیدروکلریک و سولفوریک اسید میشود.
سولفوریک اسید ترکیب یونی است یا مولکولی؟
سولفوریک اسید یک ترکیب معدنی با پیوند کوالانسی است به دلیل اینکه در ساختار شیمیایی آن پیوند همه اجزاء کووالانسی است. اما این اسید در محلول یونیده میشود و یونهای هیدرونیوم و سولفات به وجود میآید.