واکنش اسید و باز — از صفر تا صد

واکنش اسید و باز نوعی واکنش شیمیایی است که بین یک اسید و یک باز اتفاق میافتد. مفاهیم متعددی وجود دارند که تعاریف مختلفی را برای مکانیسمهای واکنش و کاربرد آنها در حل مسایل مربوطه ارائه میدهد.
علیرغم شباهتهای زیادی که در تعاریف مشاهده خواهید کرد، وجود تمام آنها ضروری است. اهمیت این موضوع آنجا روشن میشود که بخواهیم واکنش اسید و باز را در محیطهای گازی یا مایع تحلیل کنیم. همچنین گاهی ویژگیهای واکنش چنان در هم تنیده میشود که شناسایی و دستهبندی آن در دستهی واکنشهای اینچنینی با تعاریف ساده بسیار مشکل است.
نظریههای عمومی اسید و باز
در این بخش تعاریف مختلفی از واکنش اسید و باز به ترتیب تاریخی آورده شده است.
تعریف لاووازیه
از لحاظ تاریخی، اولین مفاهیم علمی اسید و باز توسط شیمیدان فرانسوی به نام «آنتوان لاووازیه» (Antoine Lavoisier) در حدود سال 1776 میلادی ارائه شد. اطلاعات لاووازیه از اسیدهای قوی به طور عمده محدود به «اکسیاسیدها» (oxyacids) بود که متمایل به داشتن اتمهای مرکزی در حالتهای اکسیداسیون بالا و احاطه شده توسط اکسیژن بودند. در این مورد میتوان به اسید نیتریک (HNO3) و اسید سولفوریک (H2SO4) اشاره کرد.
او از ترکیب واقعی اسیدهای با هالید هیدروژن یا هیدروهالیک (hydrohalic acids)، اسید کلریدریک (HCl)، هیدروژن برمید (HBr) و هیدروژن یدید (HI) آگاهی نداشت. لاووازیه با استفاده از اطلاعات محدود خودش، اسیدها را از دیدگاه محتوای اکسیژن آنها تعریف میکرد.

او اکسیژن را از ترکیب دو کلمهی یونانی «οξυς» در انگلیسی معادل (oxys) و «γεινομαι» معادل (geinomai) به ترتیب به معنای اسید یا تند و سازنده به دست آورد.
تعریف لاووازیه به عنوان حقیقت مطلق برای بیش از 30 سال در دسترس و مورد قبول همگان بود؛ تا زمانی که در سال 1810، «سر همفری دیوی» (Sir Humphry Davy) شیمیدان بریتانیایی طی مقالات و سخنرانیهای خود، فقدان اکسیژن در ترکیبات هیدروژن سولفید (H2S)، هیدروژن تلورید (H2Te) و اسیدهای هیدروژن هالید را اثبات کرد.
تعریف لیبیش
در حدود سال 1838، «یوستوس فون لیبیش» (Justus von Liebig) شیمیدان آلمانی یک تعریف جدید از اسیدها، بر مبنای کارهای گستردهاش روی ترکیب شیمیایی اسیدهای آلی مطرح کرد. تغییر نظریه از اسیدهای پایه اکسیژن به اسیدهای پایه هیدروژن که توسط دیوی شروع شده بود، پایان یافت. طبق تعریف لیبیش، اسید یک مادهی حاوی هیدروژن است که هیدروژن آن میتواند با یک فلز جایگزین شود. تعریف لیبیش در حالی که کاملا تجربی بود، حدود ۵۰ سال تا زمان تصویب تعریف «آرنیوس» (Arrhenius) مورد استفاده قرار گرفت.
تعریف آرنیوس
تعریف آرنیوس از واکنش اسید و باز مفهوم سادهتری از چنین واکنشهایی است که توسط «سوانت آرنیوس» (Svante Arrhenius) معرفی شد. این تعریف البته برای توضیح بهتر و مدرنتری از عملکرد بازها تهیه شده بود و به نوعی ادامه کار او با «Friedrich Wilhelm Ostwald» در اثبات حضور یونها در محلول آبی محسوب میشد. تلاشهای او در ادامه منجر به دریافت جایزهی نوبل توسط به خاطر کارهای ارزشمندش در ارائهی «نظریهی حلالیت» (theory of dissociation) گشت.

همانطور که در زمان کشف این موضوع بیان شد، اسیدها در محلول آبی از هیدروژن یا یونهایی که بعدا اکسونیوم (+H3O) نامیده شدند و بازها از یونهای هیدروکسید (-OH) جدا میشوند. اخیرا اتحادیهی بینالمللی شیمی محض و کاربردی (International Union of Pure and Applied Chemistry, IUPAC) اصطلاح جدیدتر «هیدرونیوم» (hydronium) را به جای واژهی پذیرفته شدهی قدیمی «اکسونیوم» (oxonium) پیشنهاد داده است تا از این طریق مکانیسمهای واکنش مانند آنهایی که در نظریهی «برونستد-لوری» (Brønsted-Lowry) و سیستم حلال تعریف میگردند، به شکل واضحتری تعیین شوند. با تعریف آرنیوس شرحی کامل و ساده از مشخصات واکنش اسید و باز به نمایش گذاشته میشود. به طور خلاصه و واضح، تعریف آرنیوس به شکل زیر است.
اسیدهای آرنیوس در محلول آبی یونهای هیدروژن و بازهای آرنیوس یونهای هیدروکسید تشکیل میدهند.
تعریف عمومی اسید و باز محلول از دیدگاه آرنیوس به صورت تشکیل آب از یونهای هیدروژن و هیدروکسید یا یونهای هیدرونیوم و یونهای هیدروکسید تولید شده از تجزیهی یک اسید و باز در محلول آبی است.
2 H2O → OH- + H3O+
در این صورت واکنش اسید و باز آرنیوس به صورت تشکیل یک نمک و آب از واکنش بین یک اسید و یک باز تعریف میشوند. در تعاریف علمی سادهتر، این گونه از واکنش، واکنش خنثیسازی نام گذاری میگردد.
نمک + آب → اسید + باز
یون مثبت باز با یون منفی یک اسید میتواند یک نمک را تشکیل دهد. به عنوان مثال، دو مول از باز سدیم هیدروکسید (NaOH) میتواند با یک مول از سولفوریک اسید (H2SO4) ترکیب شوند و دو مول آب و یک مول سدیم سولفات را تشکیل دهند.
2NaOH + H2SO4 → 2 H2O + Na2SO4
تعریف برونستد - لوری
تعریف برونستد - لوری به طور مستقل توسط دو دانشمند به نامهای «یوهانس نیکولاس برونستد» (Johannes Nicolaus Bronsted) و «ماتین لوری» (Martin Lowry) در سال 1923 بر مبنای ایدهی پروتوندار کردن بازها ارائه شد.
به طور معمول اسیدها با توانایی برای اهدای یونهای هیدروژن (H+) یا پروتونها به بازها شناخته میشوند.
بر خلاف تعریف آرنیوس، تعریف برونستد - لوری به محصولات یک واکنش اسید و باز به عنوان «اسید و باز مزدوج» (conjugate acids and bases) نگاه میکند. چنین نگاهی در این تعریف یعنی به جای استفاده از فرایند منجر به تولید نمک و آب، (تعریف آرنیوس) از واکنش بین دو کمیت و انتقال پروتون صحبت به عمل میآید.
این تعریف نشان میدهد که در چنین واکنشهایی یک گیرنده و یک آزاد کنندهی پروتون وجود دارد. این فرایند اساسا به حذف یک یون هیدروژن دارای پیوند با یک ترکیب و واکنش آن با ترکیب دیگر اشاره میکند. باید دقت کنید که این فرایند به معنای حذف یک پروتون از هستهی یک اتم نیست. چنین عملی نیازمند مقادیر زیادی از انرژی است که از طریق تجزیهی سادهی اسیدها قابل دستیابی نیستند.
در مقایسه با تعریف آرنیوس، تعریف برونستد لوری فرض میکند که برای هر اسید، یک اسید مزدوج و باز مزدوج یا جفت اسید- باز مزدوج وجود دارد، که از طریق یک واکنش کامل تشکیل میگردند. همچنین این واکنش شامل تعدادی مولکول آب هم است که «آمفوتر» (amphoteric) نامیده میشوند. آمفوتر مادهای است که میتواند در واکنش با باز به عنوان اسید و با اسید به عنوان باز شرکت کند.
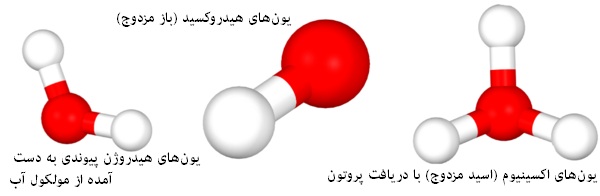
فرمول عمومی برای نمایش واکنشهای برونستد لوری به شکل زیر است.
AH + B → BH+ + A-
اسید هیدروکلریک به طور کامل با آب واکنش میدهد و یونهای هیدرونیوم و کلرید را تشکیل میدهد.
(HCl (aq) + H2O → H3O+ (aq) + Cl- (aq
اسید استیک به طور کامل با آمونیاک واکنش نمیدهد و هیچ یون هیدرونیومی شکل نمیگیرد.
CH3COOH + NH3 → NH4+ + CH3COO-
تعریف لوییس
تعریف لوییس واکنش اسید و باز و ثبت شده توسط «گیلبرت نیوتون لوویس» (Gilbert Newton Lewis) در سال 1923، نظریههای برونستد لوری و سیستم حلال را در بر میگیرد. این تعریف به یک نوع مکانیسم اهدا اشاره دارد که طی آن در واقع فرایند آزاد شدن جفت الکترون از بازها و دریافت جفت الکترون توسط اسید بهجای پروتونها یا دیگر مواد پیوندی اتفاق میافتد. تعریف لوییس همچنین هر دو واکنشهای آبی و غیرآبی را در بر میگیرد.
Ag+ + 2 :NH3 → [H3N:Ag:NH3]+
در واکنش بالا یک کاتیون نقره به عنوان یک اسید با آمونیاک به عنوان یک دهندهی جفت الکترون واکنش میدهند و «اداکت» (adduct) نقره-آمونیاک را تولید میکند. در واکنش اسید و باز لوییس، هنگامی که «بالاترین اوربیتال مولکولی دارای الکترون» (Highest occupied molecular orbital, HOMO) از یک مولکول مانند آمونیاک (NH3)، جفت الکترونهای غیر پیوندی خود را از طریق یک «پیوند داتیو یا کئوردینانس» (co-ordinate covalent bond) به مولکولهای «کم الکترون» (electron-deficient molecule) از «پایینترین اوربیتال مولکولی فاقد الکترون» (Lowest unoccupied molecular orbital, LUMO) میدهد، اداکت تولید میگردد.
در این واکنش، مولکول درگیر HOMO به عنوان یک باز و مولکول درگیر LUMO به عنوان یک اسید عمل میکنند. مولکولهای با قطبیت بالا همانند «تری فلورید بور» (boron trifluoride, BF3)، الکترونگاتیوترین عنصر موجود در جدول، الکترونها را به سمت اوربیتالهای خودش میکشد؛ این فرایند منجر به ایجاد یک بار مثبت بیشتر روی عنصر با الکترونگاتیوی کمتر میشود که نوعی اختلال در ساختار الکترونیکی آن به خاطر موقعیتهای اوربیتالی استوایی یا محوری ایجاد میکند.
- اداکت یا ترکیب اضافی، فراوردهی یک افزایش مستقیم دو یا چند مولکول متمایز است، به طوری که همه اتمها و اجزای شرکت کننده در واکنش در آن فراورده تجمیع یابند.
- در علم شیمی بر حسب سطح انرژی اوربیتالهای مولکولی، بالاترین اوربیتال مولکولی دارای الکترون را HOMO و پایین ترین اوربیتال مولکولی فاقد الکترون را «Highest occupied molecular orbital, HOMO» مینامند.
- پیوند داتیو نوعی پیوند کووالانسی بین دو اتم است که دو الکترون از یک اتم وارد اوربیتال خالی اتم دیگر میشوند.
تعریف سیستم حلال
این تعریف بر مبنای تعمیم تعریف قبلی آرنیوس برای تمام حلالهای «خود حل شونده» (autodissociating) بنا شده است. در تمام این حلالها، یک غلظت خاص از گونههای مثبت، کاتیونهای «سالونیم» (solvonium) و گونههای منفی یا آنیونهای (سالویت) (solvate) در تعادل با مولکولهای حلال بیاثر وجود دارند. مثالی از این مورد در ادامه آمده است:
(2H2O ⇌ H3O+ (hydronium) + OH- (hydroxide
(2NH3 ⇌ NH4+ (ammonium) + NH2− (amide
یا حتی برخی از حلالهای «غیر پروتونی» (aprotic) مانند:
(N2O4 ⇌ NO+ (nitrosonium) + NO3− (nitrate
(2SbCl3 ⇌ SbCl2+ (dichloroantimonium) + SbCl4- (tetrachloroantimonate
نکته: حلال غیرپروتونی گونهای خاص از یک حلال است که قادر به دادن یک یون هیدروژن یا پروتون نیست.
جسم حل شدهای که باعث افزایش در غلظت یونهای سالوینیم و کاهش در یونهای سالویت میشود، نوعی اسید است. همچنین جسم حل شدهای که باعث عکس این عمل گردد، یک باز است. بنابراین، در آمونیاک مایع، KNH2 (جهت تهیهی NH2-) یک باز قوی است و NH4NO3 (جهت تهیهی NH4+) یک اسید قوی است. در سولفور اکسید مایع (SO2)، ترکیبات «تیونیل» (thionyl) (جهت تهیهی SO2+) مانند اسید و سولفیتها (SO32-) مانند باز رفتار میکنند.
چند نمونه از واکنش اسید و باز غیر آبی را در آمونیاک مایع مشاهده میکنید.
2NaNH2 (base) + Zn(NH2)2 (amphiphilic amide) → Na2[Zn(NH2)4]
2NH4I (acid) + Zn(NH2)2 (amphiphilic amide) → [Zn(NH3)4)]I2
نیتریک اسید میتواند در سولفوریک اسید مایع نوعی باز باشد.
-HNO3 (base) + 2H2SO4 → NO2+ + H3O+ + 2HSO4
در دنیای محلولهای غیرپروتوونی مسائل حتی عجیبتر به نظر میرسد. برای مثال در دی نیتروژن تترا اکسید (N2O4) مایع:
AgNO3 (base) + NOCl (acid) → N2O4 + AgCl
از آنجایی که تعریف سیستم حلال هم به حلال و هم به خود ترکیب بستگی دارد، ترکیب میتواند نقش خود را بسته به انتخاب حلال تغییر دهد. بنابراین HClO4 یک اسید قوی در آب، یک اسید ضعیف در استیک اسید و یک باز ضعیف در فلوئوروسولفونیک اسید (FHO3S) است.
سایر نظریه ها در خصوص واکنش اسید و باز
تعریفهایی دیگری از نوع و فرایند واکنشهای اینچنینی در درسترس است که در ادامه به آنها میپردازیم.

تعریف میخائیل یوسانویچ
کلیترین تعریف موجود از «میخائیل یوسانویچ» (Mikhail Usanovich) شیمیدان روسیهای به صورت خلاصه به شکل زیر است:
هرچیزی که گونههای منفی را بگیرد یا یک گونهی مثبت را از دست بدهد، اسید و بر عکس آن باز است.
به دلیل این که تعریف یوسانویچ با با موضوع اکسایش– کاهش (Redox) همپوشانی دارد، خیلی مورد توجه شیمیدانها قرار نمیگیرد. واکنشهای اکسایش- کاهش تمرکز زیادی روی فرآیندهای انتقال الکترون فیزیکی به جای فرآیندهای شکست پیوند و ایجاد پیوند دارند؛ البته باید بدانید تشخیص بین این دو فرآیند تا حدی مبهم است.
تعریف «Lux-Flood»
این تعریف توسط یک شیمیدان آلمانی به نام «Hermann Lux» در سال 1939 پیشنهاد شد و در حدود سال 1947 توسط دانشمندی دیگر به «hakon Flood» بهبود یافت. تعریف Lux-Flood اکنون به طور معمول در ژئوشیمی و الکتروشیمی نمکهای مذاب مورد استفاده قرار میگیرد. در این تعریف، اسید یک گیرندهی یون اکسید و باز به عنوان یک دهندهی یون اکسید در نظر گرفته میشود. به عنوان مثال:
MgO (base) + CO2 (acid) → MgCO3
CaO (base) + SiO2 (acid) → CaSiO3
-NO3- (base) + S2O72- (acid) → NO2+ + 2SO42
تعریف پیرسون
در سال 1963، «رالف پیرسون» (Ralph Pearson) نوعی مفهوم کیفی پیشرفته که با عنوان اصل «HSAB»، مخففی از کلمات «اسیدها و بازهای قوی و ضعیف» (Hard Soft Acid Base) شناخته شده، را پیشنهاد داد. این تئوری بعدها به کمک «رابرت پر» (Robert Parr) در سال 1984 به صورت کمی هم تعریف شد. صفت «قوی» (Hard) برای گونههایی کوچک، دارای حالتهای با بار بالا و قطبشپذیری ضعیف، به کار میرود؛ به همین ترتیب صفت «ضعیف» (Soft) برای گونههای بزرگ، دارای حالتهای با بار پایین و قطبشپذیری قوی به کار میرود. اسیدها و بازها با یکدیگر واکنش میدهند. پایدارترین تعاملها مربوط به تعامل اسید و باز قوی- قوی یا اسید و باز ضعیف- ضعیف هستند. این تعریف در هر دو رستهی شیمی آلی و غیرآلی استفاده میگردد.
اگر مطلب بالا برایتان مفید بوده است و علاقهمند به یادگیری مباحث مشابه هستید، آموزشهای زیر نیز به شما پیشنهاد میشوند:











دو اسید برای مخلوط شدن ، چه ویژگی باید داشته باشند؟؟
فراورده اسید قوی و باز ضعیف چی میشه؟
همینطور فراورده باز قوی و اسید ضعیف چی میشه ؟و فراورده باز ضعیف و اسید ضعیف چی میشه؟
ممنون میسم اگه بگید استاد
خیلی ممنون از مطالب کاملتون.
زحمت کشیدی. دستت درد نکنه