انواع پیوند ها در شیمی – به زبان ساده

انواع پیوند ها در شیمی گستردگی فراوانی دارند و به روشهای متفاوتی تشکیل میشوند. از جمله معروفترین این پیوندها میتوان به پیوند کووالانسی، پیوند یونی، پیوند هیدروژنی و پیوند داتیو اشاره کرد. اهمیت انواع پیوند ها در شیمی بسیار زیاد است زیرا پایه و اساس تشکیل تمام ترکیبات شیمیایی، از ساده تا پیچیده است. به دلیل همین اهمیت تمامی افرادی که با رشته شیمی و رشتههای مرتبط سروکار دارند باید با این مفهوم آشنایی کامل داشته باشند.
در این مطلب از مجله فرادرس میخواهیم با انواع پیوند ها در شیمی آشنا شویم. پیوندهایی که به آنها میپردازیم شامل پیوند هیدروژنی، پیوند یون، پیوند کووالانسی و پیوند داتیو هستند. در هر مورد با ارائه مثالهایی درک خود را از تفاوتهای آنها بیشتر میکنیم. در ادامه به میزان تفاوت قدرت در انواع پیوند ها در شیمی میپردازیم. در نهایت نیز تعدادی مثال را به همراه پاسخ تشریحی مورد بررسی قرار میدهیم و سپس تعدادی تمرین چندگزینهای را مرور میکنیم.
انواع پیوند ها در شیمی
منظور از «پیوند شیمیایی» (Chemical Bond) نیرویی است که اتمها و یونها را کنار یکدیگر قرار میدارد و به تولید مولکولها و جامدات میانجامد. در واقع جادبه بین الکترونهای یک اتم با هسته اتم دیگر است که باعث تشکیل پیوندها میشود. گرچه الکترونهای یک اتم، الکترونهای اتم دیگر را دفع میکنند اما مقدار این دافعه کم است و مانع تشکیل پیوند نمیشود. همین نکته در مورد دافعه بین هسته دو اتم نیز صدق میکند.
با توجه به اجزای تشکیلدهنده، انواع پیوند ها در شیمی وجود دارند که در ادامه میخواهیم هر کدام از آنها را با جزئیات مورد بررسی قرار دهیم و مثالهایی از آنها را نیز ارائه خواهیم داد.
پیوند یونی
«پیوند یونی» (Ionic Bonding) نوعی از پیوند شیمیایی است که در آن بین اتمها انتقال کامل الکترون صورت میگیرد و یونهایی با بار الکتریکی مخالف به وجود میآورد. وجود نیروی الکتروستاتیکی بین یونهای مثبت و منفی باعث کنار هم قرار گرفتن آنها میشود و پیوندی را به وجود میآورد.
این نوع پیوند در فلزهایی با چند الکترون در لایه ظرفیت مشاهده میشود که با از دست دادن این الکترونها، آرایش الکترونی گازهای نجیب را به دست میآورند و به قاعده اکتت میرسند. از طرفی نافلزهایی که تعداد الکترونهای لایه ظرفیت آنها نزدیک به ۸ است، با گرفتن الکترون به آرایش الکترونی گازهای نجیب میرسند و پایدار میشوند.
نحوه تشکیل پیوند یونی
نحوه انتقال الکترون بین دو اتم و تشکیل پیوند یونی را در این بخش مورد بررسی قرار میدهیم. برای مثال به ساختار سدیم کلرید با فرمول شیمیایی $$NaCl$$ توجه کنید. در زیر آرایش الکترونی این دو عنصر را مشاهده میکنید.
$$ 1s^2\;2s^2\;2p^6\; 3s^1 $$
$$ 1s^2\;2s^2\;2p^6\; 3s^2\;3s^5 $$
همانطور که مشاهده میکنید در آرایش الکترونی عنصر سدیم ۱ الکترون بیشتر از گاز نجیب پیش از آن وجود دارد در حالی که عنصر کلر میتواند با دریافت ۱ الکترون به آرایش گاز نجیب پس از خود برسد. در نتیجه اگر ۱ الکترون از سدیم به کلر منتقل شود، پایداری در هر دو آنها افزایش پیدا میکند. برای درک بهتر به تصویر زیر توجه کنید.

سدیم در این فرآيند ۱ الکترون از دست داده است، در نتیجه تعداد الکترون و پروتون نابرابر دارد و دارای ۱ بار مثبت است. بنابراین در این فرآيند سدیم تبدیل به کاتیون شده است. از طرفی کلر ۱ الکترون به دست آورده است و دارای ۱ بار منفی است و تبدیل به آنیون شده است. در زیر میتوانید واکنش شیمیایی بین این دو را نیز مشاهده کنید که به تشکیل یک پیوند یونی میانجامد.
$$ 2Na_{(s)} + Cl_{2(g)} \rightarrow 2NaCl_{(s)} $$
در این صورت این دو اتم میتوانند در مجاورت یکدیگر با انتقال ۱ الکترون به پایداری برسند و یک پیوند یونی نیز بین آنها تشکیل میشود. نسبت آنها بهصورت ۱:۱ است و به همین دلیل فرمول شیمیایی این مولکول را با $$NaCl$$ نشان میدهیم. یونهای تشکیلدهنده این مولکول در کنار یکدیگر شبکهای سهبعدی تشکیل میدهند که همان بلور نمک است.
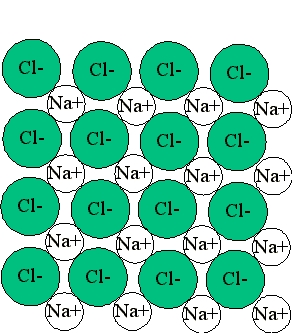
مثال از پیوند یونی
در این بخش میخواهیم مثالهای بیشتری از این نوع پیوند شیمیایی را مورد بررسی قرار دهیم.
پیوند یونی در مولکول منیزیم اکسید
همانطور که در تصویر زیر مشاهده میکنید، عنصر منیزیم با از دست دادن ۲ الکترون و اکسیژن با به دست آوردن ۲ الکترون به آرایش پایدار گاز نجیب میرسند. بنابراین ۲ الکترون از منیزیم به اکسیژن منتقل میشود و در این فرآيند منیزیم تبدیل به کاتیون و اکسیژن تبدیل به آنیون میشود و با جاذبه الکتروستاتیکی در کنار یکدیگر قرار میگیرند.

در صورتی که این پیوند یونی را با پیوند یونی بین سدیم و کلر مقایسه کنیم، متوجه میشویم که این پیوند قویتری است زیرا جاذبه بین ۲+ و ۲- وجود دارد. بنابراین میتوانیم اینطور جمعبندی کنیم که هرچه بار آنیون و کاتیون بیشتر باشد، جاذبه بین آنها نیز بیشتر خواهد بود. فرمول شیمیایی این مولکول بهصورت $$MgO$$ است.
پیوند یونی بین کلسیم کلرید
فرمول شیمیایی این مولکول بهصورت $$CaCl_2$$ است، یعنی در آن ۱ اتم کلسیم با ۲ اتم کلر پیوند برقرار کرده است. همانطور که در تصویر زیر مشاهده میکنید کلر برای رسیدن به آرایش پایدار باید ۱ الکترون دریافت کند، از طرفی کلسیم ۲ الکترون باید از دست بدهد تا پایدار شود. در این صورت هر کلر ۱ الکترون به کلسیم میدهد و هر سه به پایداری میرسند.
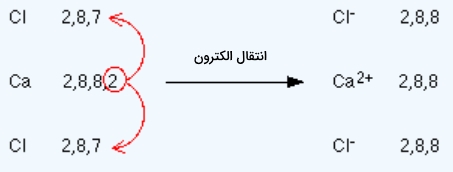
یونهای مثبت و منفی تشکیل شده با جاذبه الکتروستاتیک در کنار یکدیگر قرار میگیرند و پیوند آنها از نوع یونی است.
پیوند هیدروژنی
«پیوند هیدروژنی» (Hydrogen Bond) یک «نیروی بینمولکولی» (Intermolecular Force) است که نوعی ویژه از جاذبه دوقطبی-دوقطبی را از طریق پیوند یک اتم هیدروژن با یک اتم با الکترونگاتیوی بالا ایجاد میکند و به همین دلیل نیز به نام پیوند هیدروژنی شناخته میشود.
همانطور که از نام نیروی بینمولکولی نیز پیداست، این نیرو بین مولکولهای متفاوت ایجاد میشود و درونمولکولی نیست. نیروی درونمولکولی انواع دیگری مانند نیروی پراکندگی و دوقطبی-دوقطبی نیز دارد که همگی از پیوند هیدروژنی ضعیفتر هستند اما تمامی نیروهای درونمولکولی از پیوند کووالانسی و یونی قدرت کمتری دارند.
اثبات وجود پیوند هیدروژنی
در این بخش میخواهیم با یک بررسی وجود پیوند هیدروژنی را ثابت کنیم. در تصویر زیر مقایسهای بین نقطه جوش ترکیبات گروه ۱۴ جدول تناوبی با هیدروژن مشاهده میکنید. در این تصویر با پیشروی در گروه جدول تناوبی به سمت پایین شاهد افزایش در مقدار نقطه جوش هستیم.
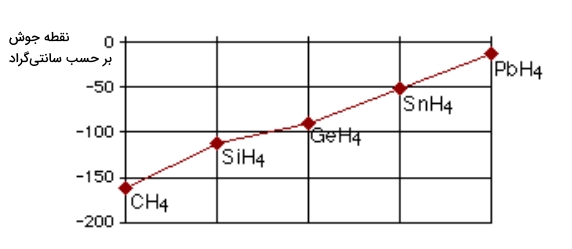
افزایش در نقطه جوش به دلیل افزایش سایز مولکول اتفاق میافتد که به وجود الکترونهای بیشتر میانجامد. در صورتی که همین جدول را برای عنصرهای گروه ۱۵، ۱۶ و ۱۷ نیز رسم کنیم، نتایج جالبی به دست میآید که آنها را در تصویر زیر مشاهده میکنید.
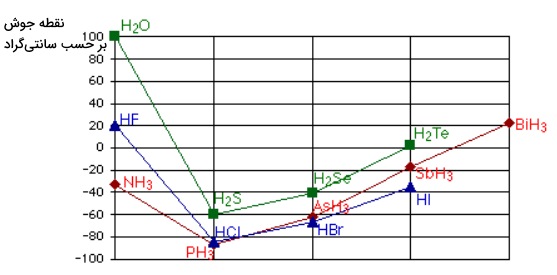
همانطور که مشاهده میکنید نقطه جوش ترکیبات در همراهی با هیدروژن برای اولین عنصر هر سری به مقدار غیرمعمولی زیاد است. بنابراین احتمال این وجود دارد که در ترکیبات $$NH_3$$ و $$H_2O$$ و $$HF$$ شاهد حضور نیروهای جاذبه بینمولکولی مازادی باشیم که باعث میشوند برای شکسته شدن پیوندها نیاز به مقدار بسیار بیشتری انرژی گرمایی وجود داشته باشد. به این نیروهای بینمولکولی پیوند هیدروژنی گفته میشود.
منشا پیوند هیدروژنی
در این بخش میخواهیم کمی بیشتر با جزئیات اتمهایی که درگیر این نوع پیوند میشوند، آشنایی پیدا کنیم. در تصویر زیر مولکولهایی را مشاهده میکنید که توانایی تشکیل پیوند هیدروژنی دارند.
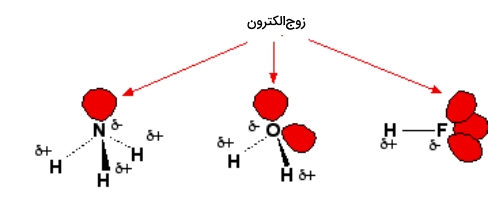
همانطور که مشاهده میکنید وجود زوجالکترون غیرمزدوج مسئول تشکیل پیوند هیدروژنی در این دسته از ترکیبات است. توجه داشته باشید که در هر مولکول هیدروژن بهصورت مستقیم به اتمهایی با الکترونگاتیوی بالا متصل است و این باعث میشود که هیدروژن دارای مقدار زیادی از بار مثبت شود.
در این مولکولها اتمهای با الکترونگاتیوی بالا دارای بار منفی زیادی هستند و حداقل یک زوجالکترون غیرمزدوج دارند. از آنجا که این زوجالکترون در فضای بسیار محدودی قرار دارد، چگالی بار در آن بالا خواهد بود. هر چه فضای در اختیار این زوجالکترون بیشتر باشد توزیع بار منفی کمتر میشود. در تصویر زیر دو مولکول آب را مشاهده میکنید که در مجاورت یکدیگر قرار دارند.
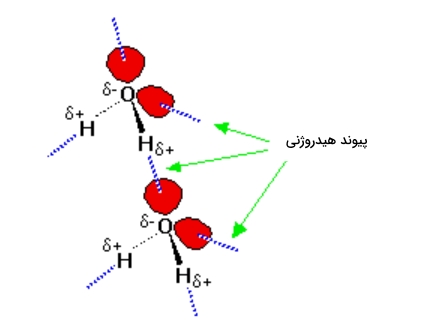
در تصویر بالا هیدروژن دارای بار جزئی مثبت به شدت به زوجالکترون جذب میشود و در ابتدا تصور بر این است که در نتیجه این جاذبه یک پیوند داتیو به وجود میآيد. اما میزان جاذبه برای تشکیل پیوند کم است. با این حال از یک برهمکنش دوقطبی-دوقطبی معمولی نیز بیشتر است و به تشکیل پیوند هیدروژنی میانجامد. این پیوند یک دهم قدرت پیوند کووالانسی را دارد و شکسته میشود و آب در حالت مایع خواهد بود.
مولکول آب یکی از بهترین مثالها در تشکیل پیوند هیدروژنی است. هر یک مولکول آب میتواند با مولکولهای اطراف خود ۴ پیوند هیدروژنی تشکیل دهد، دو پیوند هیدروژنی با دو هیدروژن و دو پیوند هیدروژنی با یک اکسیژن. امکان تشکیل این ۴ پیوند هیدروژنی باعث بالا بودن نقطه جوش آب نسبت به ترکیباتی مانند آمونیاک و هیدروژن فلوئورید است.
در مولکول آمونیاک تعداد پیوندهای هیدروژنی که امکان تشکیل دارند بسیار محدود است زیرا نیتروژن تنها یک زوجالکترون غیرمزدوج روی خود دارد. همچنین در هیدروژن فلوئورید با کمبود هیدروژن مواجه هستیم. بنابراین مولکول آب یکی از بهترین ترکیباتی است که میتواند پیوند هیدروژنی را انجام دهد و شبکهای را به وجود آورد.
گیرنده و دهنده در پیوند هیدروژنی
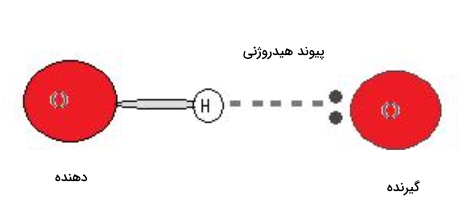
برای تشکیل پیوند هیدروژنی باید همزمان دهنده و گیرنده هیدروژن در محیط وجود داشته باشد. «دهنده» (Donor) در پیوند هیدروژنی بهطور معمول اتمی الکترونگاتیو مانند نیتروژن، اکسیژن و فلوئور است که بهصورت کووالانسی به یک هیدروژن متصل شده است. همچنین «گیرنده» (Acceptor) نیز اتمی الکترونگاتیو است که در مجاورت اتم یا یونی با زوجالکترون حضور دارد این دو مورد را میتوانید در تصویر زیر مشاهده کنید.
انواع پیوند هیدروژنی
گرچه معمولا پیوند هیدروژنی نوعی از نیروی بینمولکولی شناخته میشود اما در شرایطی ویژه میتواند درون یک مولکول نیز تشکیل شود. بنابراین پیوند هیدروژنی دو نوع دارد که در فهرست زیر به آن اشاره کردهایم.
- پیوند هیدروژنی درونمولکولی
- پیوند هیدروژنی بینمولکولی
در ادامه به بررسی دقیقتر هر کدام از انواع این پیوندهای هیدروژنی میپردازیم.
پیوند هیدروژنی درونمولکولی چیست؟
«پیوند هیدروژنی درونمولکولی» (Intramolecular Hydrogen Bond) نوعی از پیوند است که در آن گیرنده و دهنده در یک مولکول حضور دارند. این دهنده و گیرنده باید به همدیگر نزدیک باشند تا توانایی برهمکنش وجود داشته باشد. برای مثال میتوان به مولکول اتیلن گلیکول با فرمول شیمیایی $$C_2H_4(OH)_2$$ اشاره کرد که در آن دو گروه هیدروکسیلی به دلیل شکل مولکول یک پیوند هیدروژنی را به وجود میآورند.
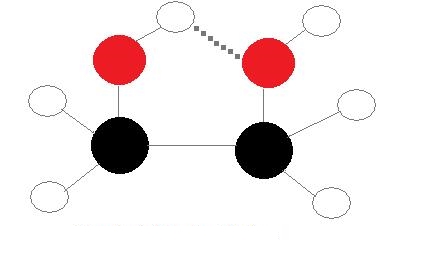
در تصویر بالا نحوه تشکیل پیوند هیدروژنی در مولکول اتیلن گلیکول را مشاهده میکنید که با نقطهچین مشتخص شده است.
پیوند هیدروژنی بینمولکولی چیست؟
«پیوند هیدروژنی بینمولکولی» (Intermolecular Hydrogen Bons) نوعی از پیوند است که بین مولکولهای مجزا در یک ترکیب تشکیل میشود. این نوع پیوند میتواند بین مولکولهای همنوع یا متفاوت صورت گیرد و تنها حضور گیرنده و دهنده در جایگاه مناسب مورد نیاز است. برای مثال پیوند هیدروژنی بینمولکولی میتواند بین دو مولکول آب، دو مولکول آمونیاک یا یک مولکول آب و یک مولکول آمونیاک به وجود آید. در این مورد به تصویر زیر توجه کنید.
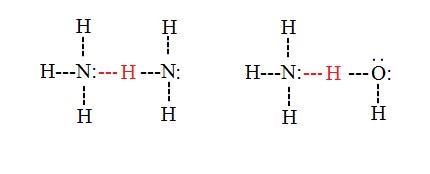
تاثیر پیوند هیدروژنی بر نقطه جوش
معمولا در بررسی نقطه جوش به روندی میرسیم که در آن هرچه مولکولی جرم بیشتری داشته باشد، نقطه جوش بالاتری دارد و از مولکولهای کوچک انتظار مشاهده نقطه جوش بالا نداریم. با این حال با در نظر داشتن امکان تشکیل پیوند هیدروژنی در ترکیبات این روند بر هم میخورد. در جدول زیر به تعدادی از این مولکولهای کوچک با نقطه جوش بالا اشاره کردهایم.
| فرمول شیمیایی مولکول | جرم مولی بر حسب گرم بر مول | نقطه جوش بر حسب کلوین |
| $$H_2O$$ | ۱۸ | ۳۷۳ |
| $$HF$$ | ۲۰ | ۲۹۲٫۵ |
| $$NH_3$$ | ۱۷ | ۲۳۹٫۸ |
| $$H_2S$$ | ۳۴ | ۲۱۲٫۹ |
| $$HCl$$ | ۳۶٫۴ | ۱۹۷٫۹ |
| $$PH_3$$ | ۳۴ | ۱۸۵٫۲ |
همانطور که در جدول بالا مشاهده میکنید نقطه جوش $$H_2O$$ و $$HF$$ و $$NH_3$$ از مولکولهای دیگر بیشتر است که به دلیل تشکیل پیوند هیدروژنی در این دسته از ترکیبات است. به علاوه نقطه جوش آب نسبت به هیدروژن فلوئورید بیشتر است در حالی که جرم مولی کمتری از آن دارد. این موضوع را میتوان به امکان تشکیل چندین پیوند هیدروژنی در مولکول آب ربط داد.
پیوند کووالانسی
«پیوند کووالانسی» (Covalent Vond) زمانی به وجود میآيد که اتمها الکترونهای خود را با یکدیگر به اشتراک بگذارند. در این اشتراکگذاری اتمها به پایداری میرسند زیرا آرایش الکترونی لایه ظرفیت آنها بهصورت پر در میآید. نافلزها میتوانند با نافلزهای دیگر بهسرعت وارد پیوند کووالانسی شوند و به پایداری برسند. توجه داشته باشید که بهطور معمول این اشتراکگذاری بهصورت مساوی انجام نمیشوند. در ادامه این نوع پیوند شیمیایی را با جزئیات بیشتری مورد بررسی قرار میدهیم.
تنها در صورتی اشتراکگذاری الکترونها بهصورت یکسان انجام میشود که بین دو اتم یکسان باشد. زمانی که پیوند کووالانسی بین دو اتم متفاوت تشکیل میشود، الکترون اشتراکی در پیوند کووالانسی به اتم با الکترونگاتیوی بالا نزدیکتر خواهد بود و این باعث قطبی شدن پیوند بین آنها میشود. با مقایسه ترکیبات کووالانسی با ترکیبات یونی متوجه میشویم که مقدار نقطه جوش و نقطه ذوب در آنها پایینتر است و تمایل کمتر برای حل شدن در آب از خود نشان میدهند.
ویژگی ترکیبات کووالانسی
«ترکیبات کووالانسی» (Covalent Compounds) میتوانند به حالتهای فیزیکی جامد، مایع و گاز حضور داشته باشند و ترکیبات خوبی برای هدایت گرما و الکتریسیته به شمار نمیروند. نوع پیوند بین ترکیبات را میتوان از روی ساختار لوویس آنها مشخص کرد که در ادامه به آنها میپردازیم.
پیوند یگانه
«پیوند یگانه» (Single Bond) زمانی تشکیل میشود که دو الکترون بین دو اتم به اشتراک گذاشته شود و آن را با یک خط بین دو اتم نمایش میدهند. گرچه پیوند یگانه از پیوندهای دوگانه و سهگانه ضعیفتر است اما پایداری بیشتری نسبت به آنها دارد. دلیل این امر این است که پیوند یگانه واکنشپذیری کمتری دارد و کمتر دستخوش تغییر میشود، بنابراین برای بررسی یک مولکول باید مرتبه پیوند آن را نیز در نظر داشت.
مثال از پیوند یگانه
در تصویر زیر ساختار لوویس مولکول هیدروژن کلرید را مشاهده میکنید که دارای پیوند یگانه است. این مولکول دارای ۱ اتم هیدروژن و ۱ اتم کلر است. هیدروژن در لایه ظرفیت خود تنها ۱ الکترون دارد در حالی که تعداد الکترونهای لایه ظرفیت کلر ۷ عدد است. برای رسیدن به قاعده اکتت، هر کدام از آنها ۱ الکترون را با یکدیگر به اشتراک میگذارند تا به پایداری برسند و یک پیوند یگانه نیز بین آنها تشکیل میشود.
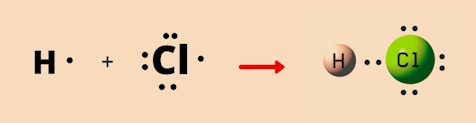
پیوند دوگانه
در «پیوند دوگانه» (Double Bond) دو اتم دو جفت الکترون را با یکدیگر به اشتراک میگذارند و برای نشان دادن آن از دو خط بین اتمها استفاده میشود. این نوع پیوند کووالانسی از پیوند یگانه قویتر است اما پایداری کمتری دارد زیرا واکنشپذیری بیشتری از خود به نمایش میگذارد. برای مثال به تصویر زیر توجه کنید که مربوط به تشکیل پیوند دوگانه کووالانسی بین ا اتم کربن و ۲ اتم اکسیژن است و مولکولی با فرمول شیمیایی $$CO_2$$ به دست میدهد.
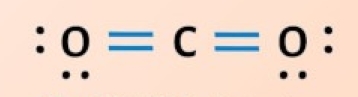
هر اتم اکسیژن دارای ۶ الکترون در لایه ظرفیت است و الکترونهای لایه ظرفیت اتم کربن نیز برابر با ۴ عدد است. در اینصورت کربن برای رسیدن به قاعده اکتت نیاز به ۴ الکترون دیگر دارد که هر کدام از اکسیژنها ۲ الکترون را در اختیار آن قرار میدهند. هر اکسیژن ۳ جفت الکترون دارد و همانطور که مشاهده میکنید پس از تشکیل پیوند، ۲ زوجالکترون آن دستنخورده باقی میماند و باید روی آن نمایش داده شود.
پیوند سهگانه
«پیوند سهگانه» (Triple Bond) زمانی به وجود میآید که دو اتم ۳ جفت الکترون را با یکدیگر به اشتراک بگذارند. این پیوند از دو پیوند کووالانسی دیگر قویتر است اما کمترین پایداری را دارد. برای بررسی بیشتر پیوند سهگانه، مثالی را در زیر مورد بررسی قرار میدهیم که مربوط به استیلن است.
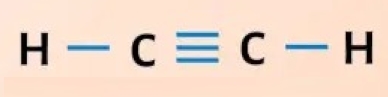
همانطور که در تصویر بالا مشاهده میکنید در این مولکول ۲ اتم هیدروژن و ۲ اتم کربن وجود دارد. هر هیدروژن در لایه ظرفیت خود ۱ الکترون دارد در حالی که الکترونهای لایه ظرفیت کربن برابر با ۴ است و به ۴ الکترون دیگر برای رسیدن به قاعده اکتت نیاز دارد. هیدروژن تنها الکترون خود را با کربن به اشتراک میگذارد و تعداد الکترونهای لایه ظرفیت آن را به ۴ عدد میرساند. در ادامه کربنها سه الکترون غیراشتراکی خود را با یکدیگر به اشتراک میگذارند و به این صورت تعداد الکترونها در آن برابر با ۴ خواهد شد. در نهایت بین هیدروژن و کربن پیوند یگانه و بین کربن و کربن پیوند از نوع سهگانه تشکیل میشود.
پیوند کووالانسی قطبی
«پیوند کووالانسی قطبی» (Polar Covalent Bomd) زمانی تشکیل میشود که اشتراک الکترونها بین دو اتم بهصورت مساوی انجام نشود، یعنی یکی از اتمها الکترونگاتیوی بالاتری دارد و الکترون اشتراکی را بیشتر به سمت خود میکشد. در نتیجه در پیوند کووالانسی قطبی الکترون اشتراکی به یکی از اتمها نزدیکتر است. در این مولکول روی اتم الکترونگاتیوتر بار جزئی منفی و روی اتم دیگر بار جزئی مثبت وجود خواهد داشت.
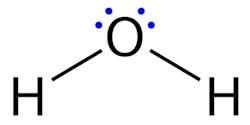
پیوند کووالانسی قطبی، به مقدار کمی مولکول مورد نظر را قطبی میکند، بهصورتی که توانایی تشکیل پیوند با دیگر مولکولهای قطبی را خواهد داشت. برای مثال به مولکول ساده آب توجه کنید. در این مولکول اکسیژن به سمت مولکول الکترونگاتیوتر اکسیژن کشیده میشود و مقداری بار جزئی منفی روی آن به وجود میآید. از طرفی هیدروژن دارای بار جزئی مثبت است و این مولکول را قطبی میکند و همانطور که میدانید آب یک حلال قطبی است.
پیوند کووالانسی ناقطبی
«پیوند کووالانسی ناقطبی» (Nonpolar Covalent Bond) زمانی به وجود میآید که الکترونها بین دو اتم بهصورت یکسان به اشتراک گذاشته شوند. این اتمها باید دارای الکترونگاتیوی مشابه یکدیگر باشند. مثالی از این نوع پیوند را میتوانید در مولکولهای گازی یا عنصرهای دواتمی مشاهده کنید. از آنجا که الکترونگاتیوی اتمهای یک عنصر با یکدیگر مشابه است، الکترون ها به یک سمت کشیده نمیشوند و قطبیت پدید نمیآید.

برای مثال میتوان به گاز هیدروژن اشاره کرد که در آن دو اتم هیدروژن توسط یک پیوند کووالانسی یگانه به یکدیگر متصل شدهاند. ساختار این مولکول را میتوانید در تصویر بالا مشاهده کنید.
پیوند واندروالسی
«نیروهای واندروالسی» (Van der Waals Forces) که بیشتر با نام «پیوند واندروالسی» شناخته میشود، نوعی برهمکنش بین دو اتم یا مولکول است که در مجاورت یکدیگر قرار دارند. این نوع برهمکنش از دیگر برهمکنشهای بینمولکولی ضعیفتر است با این حال در صورتی که مقدار آن زیاد باشد، قدرت بالایی خواهد داشت.
منشا پیوند واندروالسی
برای آشنایی با منشا این پیوند شیمیایی باید سراغ مکانیک کوانتوم برویم که به حرکت دائمی الکترونها در یک اتم اشاره میکند و برای اثبات آن از «معادله شرودینگر» (schrodinger Equation) و «اصل عدم قطعیت هایزنبرگ» (Heisenberg's Uncertainty Principle) بهره میبرد.
طبق اصل عدم قطعیت هایزنبرگ، انرژی یک الکترون هرگز برابر با صفر نخواهد بود و به همین دلیل بهطور مدام در اوربیتال خود حرکت میکند. همچنین طبق معادله شرودینگر یک الکترون را میتواند در هر جای اوربیتال اتم یافت. چکیده این دو را میتوان اینطور خلاصه کرد که الکترونها در اوربیتال خود همیشه در حال حرکت هستند و میتوانند دوقطبیهایی را به وجود بیاورند
یک دوقطبی، مولکول یا اتمی است که در آن بارهای الکتریکی برابر و با علامت مخالف در فاصله کمی از یکدیگر قرار دارند. برای درک بهتر به تصویر زیر توجه کنید.
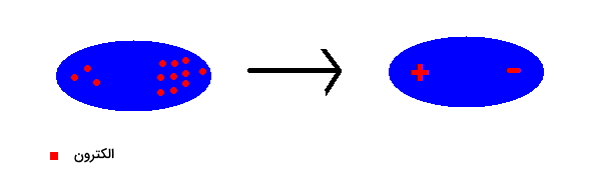
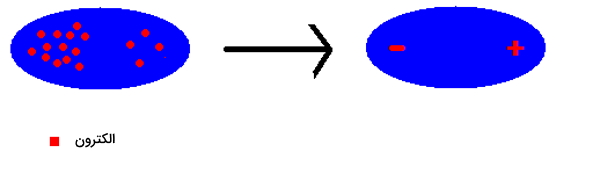
به این روش یک «دوقطبی لحظهای» (Spontaneous Dipole) تشکیل میشود. همانطور که مشاهده کردید با حرکت الکترونهای یک اتم به یک سمت، دوقطبی به وجود خواهد آمد. این الکترونها مدام در حال حرکت هستند و از یک سر اتم به سر دیگر آن میروند و سر مثبت و منفی در این دو قطبی تغییر میکند و به شکل زیر در میآيد.
برهمکنش دوقطبی دوقطبی
برهمکنش دوقطبی دوقطبی بین مولکولهایی با دوقطبی دائمی صورت میگیرد که آنها را به نام مولکولهای قطبی نیز میشناسیم. در تصویر زیر میتوانید برهمکنش الکتروستاتیکی بین دو دوقطبی را مشاهده کنید.
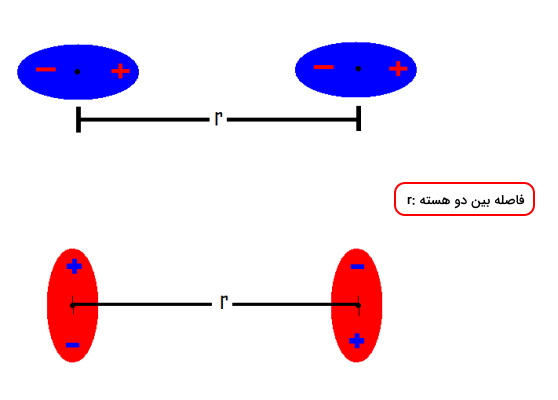
مقدار انرژی پتانسیلی برهمکنش اول که با رنگ آبی مشخص شدهاند را میتوان با فرمول زیر به دست آورد.
$$ V = -\dfrac{2\mu_A\mu_B}{4\pi\epsilon_o r^3} $$
برای برهمکنش دوم نیز میتوان از رابطه نیز برای به دست آوردن مقدار انرژی پتانسیلی استفاده کرد.
$$ V = -\dfrac{\mu_A\mu_B}{4\pi\epsilon_o r^3}$$
در ادامه میخواهیم بدانیم هر کدام از اجزای این معادلات نشاندهنده چه مولفهای هستند.
- $$V$$: مقدار انرژی پتانسیلی
- $$ \mu$$: گشتاور دوقطبی
- $$\mu $$: گذردهی خلاء
- $$r$$: فلاصله بین هسته دو اتم
توجه داشته باشید که علامت منفی در این معادلات به این معناست که در اثر این برهمکنش انرژی از سیستم خارج میشود زیرا در آن پیوندی تشکیل میشود. مقدار این انرژی برای پیوندهایی با استحکام بالا، بیشتر خواهد بود. در صورتی که تمامی شرایط برای دو مثال بالا با یکدیگر برابر باشند، مورد دوم مقدار انرژی پتانسلی بیشتری خواهد داشت زیرا در آن هم سر مثبت، هم منفی در برهمکنش شرکت میکنند.
دوقطبی القایی
«دو قطبی القایی» (Induced Dipole) شرایطی موقتی است که در آن اتمهای ناقطبی خنثی دستخوش جدایی بار میشوند که به دلیل مجاورت در محیطی با جدایی بار صورت میگیرد. زمانی که یک دوقطبی لحظهای در مجاورت اتمی قرار میگیرد، میتواند آن را نیز تبدیل به دوقطبی کند که همان دوقطبی القایی نامیده میشود. در تصویر زیر میتوانید نحوه تشکیل آن را مشاهده کنید.
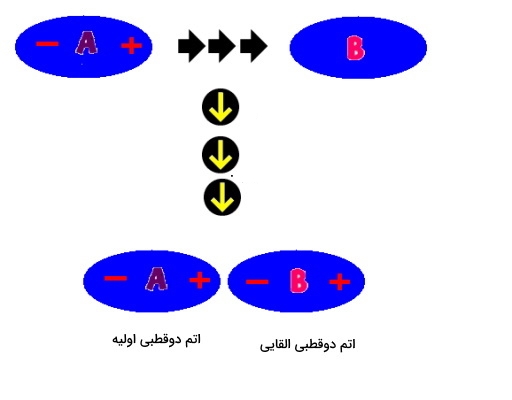
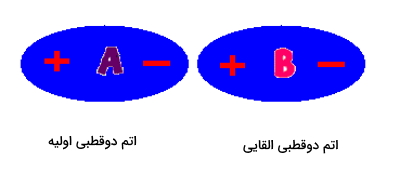
این اتمها میتوانند در برهمکنش با یکدیگر جهت سر مثبت و منفی دوقطبی خود را تعویض کنید که این را در تصویر زیر مشاهده میکنید.
از رابطه زیر میتوان برای به دست آوردن انرژی پتانسیلی برهمکنش دوقطبی القایی و دوقطبی استفاده کرد.
$$ V = -\dfrac{\alpha\mu^2}{4\pi\epsilon_o r^6} $$
تمامی مولفههای این رابطه مانند رابطههای قبلی است و منظور از $$ \alpha$$ قطبشپذیری مولکول ناقطبی است.
برهمکنش بین دوقطبی ذاتی و دوقطبی القایی
بین دوقطبی القایی و دوقطبی ذاتی نوعی از برهمکنش وجود دارد که از آن به عنوان پراکندگی یاد میشود. بین مولکولها و اتمهای قطبی و ناقطبی شبکه وسیعی از نیروهای بینمولکولی وجود دارد. در بخش قبلی در مورد نحوه تشکیل دوقطبی القایی صحبت کردیم. این دوقطبیها پس از تشکیل میتوانند مانند یک دوقطبی ذاتی عمل کنند و باعث دوقطبی شدن اتمهای دیگر شوند. هر اتمی میتواند اتم کنار خود را دوقطبی کند و به این صورت شبکهای وسیع به وجود میآید که آن را در تصویر زیر مشاهده میکنید.
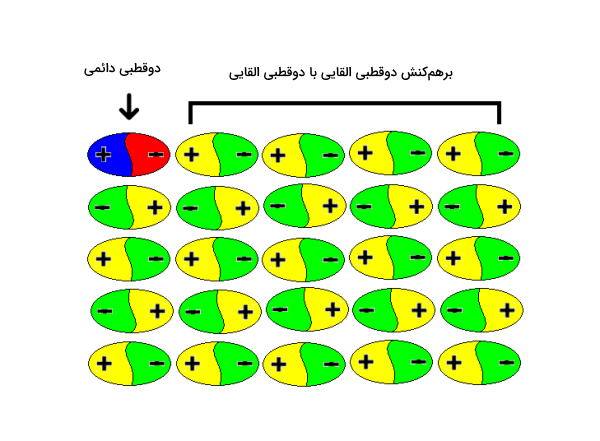
برای اندازهگیری مقدار انرژی برهمکنش بین دوقطبی القایی با دوقطبی القایی میتوان از رابطه زیر استفاده کرد. مولفههای این رابطه مانند رابطه قبلی است و در آن منظور از $$I$$ انرژی یونش اول مولکول است.
$$ V = -\frac{3}{2}\dfrac{I_aI_b}{I_a + I_b}\dfrac{\alpha_a \alpha_b}{r^6} $$
به دلیل توان شعاع در این معادله که برابر با ۶ است و در مخرج کسر حضور دارد، با کمترین افزایش در آن، انرژی پتانسیلی کاهش قابلتوجهی خواهد داشت.
پیوند داتیو
«پیوند داتیو» (Dative Bond) که به خانواده پیوندهای کووالانسی تعلق دارد، نوعی از پیوند شیمیایی است که در آن هر دو الکترون درگیر در پیوند از یک اتم یکسان تامین میشوند. اتمها در این پیوند کنار یکدیگر قرار میگیرند زیرا الکترون اشتراکی توسط هر دو هسته جذب میشود. برای درک بهتر این نوع پیوند در ادامه مثالی را مورد بررسی قرار میدهیم که مربوط به واکنش بین آمونیاک و هیدروژن کلرید است. و آن را در زیر آوردهایم.
$$ {NH_3 (g) + HCl (g) \rightarrow NH_4Cl (s)} \nonumber $$
در این واکنش یونهای آمونیوم با فرمول شیمیایی $$NH_4^+$$ از انتقال یک یون هیدروژن (یک پروتون) از مولکول هیدروژن کلرید به زوجالکترون روی مولکول آمونیاک به وجود میآيد. میتوانید نحوه این انتقال را در تصویر زیر مشاهده کنید.
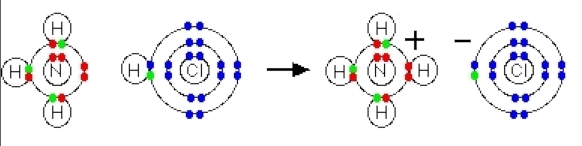
زمانی که یون آمونیوم تشکیل میشود، چهارمین اتم هیدروژن به کمک یک پیوند داتیو متصل خواهد شد زیرا تنها هسته هیدروژن از کلر به نیتروژن منتقل میشود. همانطور که در تصویر بالا مشاهده میکنید الکترون هیدروژن سر جای خود باقی میماند تا یون کلرید منفی را به وجود آورد. توجه داشته باشید که پس از تشکیل یون آمونیوم نمیتوان تفاوتی بین پیوند داتیو و پیوند کووالانسی معمولی پیدا کرد. برای نمایش پیوند داتیو به جای خط تیره از یک فلش کوچک استفاده میشود اما در واقعیت تفاوتی بین آن و پیوند کووالانسی وجود ندارد.
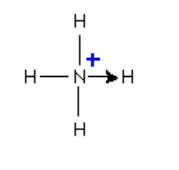
تصویر بالا مربوطه به یون آمونیوم است که در آن یکی از هیدروژنها با پیوند داتیو مشخص شده است. جهت این فلش از سمت اتم دهنده الکترون به سمت اتم گیرنده آن است.
مثال از پیوند داتیو
در این بخش میخواهیم پیوند داتیو بین آمونیاک و $$BF_3$$ را مورد بررسی قرار دهیم. در ترکیب بور تریفلوئورید، بور تنها ۳ زوجالکترون دارد در حالی که ظرفیت برای وجود ۴ زوجالکترون وجود دارد، بنابراین میتوان اینطور گفت که این مولکول با کمبود الکترون مواجه است.
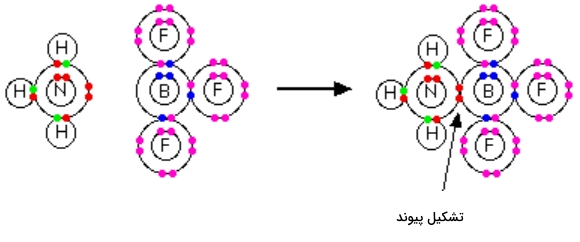
در این صورتی میتوان از زوجالکترون نامزدوج روی اتم نیتروژن مولکول آمونیاک برای جبران این کمبود استفاده کرد. در این فرآیند ترکیبی تشکیل میشود که دارای یک پیوند داتیو است. در تصویر بالا نحوه اشتراک زوج الکترون تنهای روی نیتروژن را مشاهده میکنید. همانطور که پیشتر گفتیم پیوند داتیو را میتوان به یکی از دو شکل زیر نیز نمایش داد.
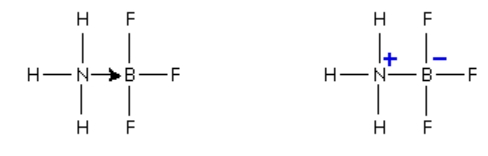
همانطور که در تصویر بالا مشاهده میکنید سر نیتروژنی پیوند جدید دارای بار مثبت است زیرا زوجالکترون از آن دور میشود و به سمت بور میرود و باعث مثبت بودن آن خواهد شد. با این حال توجه داشته باشید که روش استفاده از فلش برای نشان دادن پیوندهای داتیو متداولتر و گویاتر است.
پیوند فلزی
«پیوند فلزی» (Metallic Bond) نوعی از پیوند شیمیایی است که بین اتمهایی با بار مثبت تشکیل میشود که در آن ها الکترونهای آزاد در شبکهای از کاتیونها به اشتراک گذاشته شدهاند. ین نوع پیوند متداولترین پیوند شیمیایی است که در در فلزها مشاهده میشود و به همین دلیل به نام پیوند فلزی شناخته میشود.
پیوند فلزی علاوه بر فلزهای خالص در آلیاژها نیز مشاهده میشود. برای مثال در ساختار گرافن که آلوتروپی از کربن است دو پیوند فلزی دوبعدی وجود دارد. فلزها توانایی تشکیل پیوندهای دیگر مانند پیوند کووالانسی را نیز با یکدیگر دارند.
نحوه تشکیل پیوند فلزی
برای تشکیل پیوند فلزی لایه بیرونی اتمها (اوربیتالهای $$s$$ و $$p$$) با یکدیگر همپوشانی میکند. حداقل یکی از الکترونهای ظرفیت در پیوند فلزی با اتم مجاور به اشتراک گذاشته نمیشود. به جای اشتراکگذاری الکترونها فضایی را به وجود میآورند که به نام «دریای الکترون» (Electron Sea) شناخته میشود و در آن الکترونهای ظرفیت آزادی حرکت دارند و از اتمی به اتم دیگر میروند.
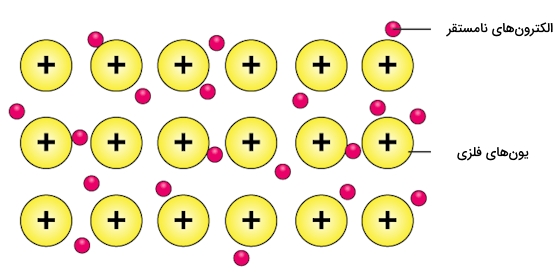
از مفهوم دریای الکترون میتوان برای سادهسازی تشکیل پیوند بهره برد. تشکیل پیوند فلزی میتواند در نتیجه داشتن حالت انرژی نامستقر بیشتر از الکترونهای مستقر باشد. در این صورت الکترونهای مستقر تنها نامستقر و متحرک خواهند شد. این الکترونهای میتوانند حالت انرژی خود را تغیر دهند و در شبکهای در جهتهای مختلف حرکت کنند.
ویژگیهای پیوند فلزی
از آنجا که الکترونها پیرامون هستههای مثبت نامستقر هستند، میتوان از این پیوند برای توجیه ویژگیهای فلزات استفاده کرد که در ادامه به تعدادی از آنها خواهیم پرداخت.
هدایت الکتریکی
بیشتر فلزها هادی الکتریسیته هستند زیرا به دلیل وجود دریای الکترون، توانایی حرکت آزادانه و انتقال بار را دارند. در صورتی که نافلزی دارای هدایت الکتریکی باشد متوجه میشویم که در آن امکان حرکت آزادانه الکترونها وجود دارد.
هدایت گرمایی
فلزها توانایی هدایت گرما را دارند زیرا الکترونهای آزاد در آنها میتواند انرژی را از منبع گرما به نقاط دیگر منتقل کند.
مقایسه انواع پیوند ها در شیمی
حال که با انوع پیوندها در شیمی آشنا شدیم، میخواهیم بدانیم کدام یک از آنها بیشترین قدرت را دارد و کدام یک ضعیفترین پیوند به شمار میرود.
قویترین پیوند از انواع پیوند ها در شیمی ، پیوند یونی است زیرا همانطور که پیشتر توضیح دادیم در آن انتقال الکترون بین دو اتم بهصورت کامل انجام میشود. پیوند کووالانسی از پیوند یونی ضعیفتر است زیرا برای تشکیل تنها به اشتراکگذاری الکترون نیاز دارد.

در مرحله بعد پیوند هیدروژنی قرار دارد که از پیوند کووالانسی ضعیفتر است و در نهایت نیز پیوند واندروالسی را داریم زیرا همانطور که توضیح دادیم برهمکنش ضعیفی است که بهصورت بین مولکولی صورت میگیرد.
سادهترین راه برای مقایسه بین انواع پیوند ها در شیمی، مقایسه مقدار انرژی است که برای شکستن آن نیاز داریم که به نام «انرژی تفکیک» (Dissociation Energy) شناخته میشود. هر چه مقدار انرژی تفکیک برای پیوندی بیشتر باشد، آن پیوند قویتر است زیرا به انرژی بیشتری برای شکستن آن نیاز داریم.
مثال و حل تمرین
تا اینجا با انواع پیوند ها در شیمی آشنا شدیم و هر کدام را با جزئيات مورد بررسی قرار دادیم. در این بخش میخواهیم به تعدادی مثال بپردازیم و سپس تمرینهایی چندگزینهای را مرور خواهیم کرد.
مثال
در این بخش شاهد تعدادی مثال هستیم و در هر مورد پاسخهای تشریحی مناسب را خواهیم آورد. با توجه به این پاسخهای تشریحی میتوانیم به پرسشهای مشابه پاسخ دهیم.
مثال اول
پیوند شیمیایی مولکول $$K_2O$$ از چه نوعی است؟
پاسخ
این پیوند از نوع یونی است و نحوه انتقال الکترون در اتمهای آن بهصورت زیر است که در نتیجه باعث تولید آرایش الکترونی به شکل گازهای نجیب میشود.
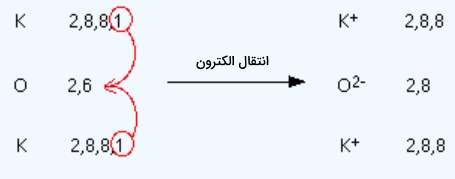
همانطور که مشاهده میکنید در این مولکول دو اتم پتاسیم وجود دارد که هر کدام با از دست دادن ۱ الکترون به آرایش پایدار میرسند. همچنین در لایه ظرفیت اکسیژن به ۲ الکترون برای رسیدن به پایداری لازم است که آنها را از ۲ پتاسیم تامین میکند.
مثال دوم
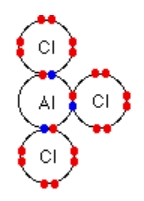
پیوند شیمیایی مولکول آلومینیوم کلرید به کدام دست از پیوندهای شیمیایی تعلق دارد؟ این مولکول در دمای ۱۸۰ درجه سانتیگراد تصعید میشود.
پاسخ
در صورتی که ترکیبی دارای پیوند یونی باشد۷ نقطه ذوب و جوش آن بسیار بالا است و میتوان حدس زد که این پیوند از نوع کووالانسی باشد. در تصویر زیر میتوانید نحوه اتصال اتمهای این مولکول را مشاهده کنید.
مثال سوم
قدرت پیوند فلزی چقدر است؟
پاسخ
فلزها دارای جاذبهای قوی بین اتمهای خود هستند و برای فائق آمدن بر آن به انرژی زیادی نیاز است و همین دلیل بالا بودن نقطه جوش آنهاست. میدانیم که انرژی مورد نیاز برای برای شکستن یک پیوند یکی از معیارهای قدرت آن است. بنابراین پیوند فلزی از جمله پیوندهای قوی به شمار میرود.
مثال چهارم
تفاوت پیوند یونی و پیوند فلزی در چیست؟
پاسخ
در پیوند یونی بین دو گونه شیمیایی انتقال کامل الکترون صورت میگیرد. این گونهها تفاوت الکترونگاتیوی بالایی نسبت به یکدیگر دارند. در حالی که پیوند فلزی زمانی تشکیل میشود که یک شبکه صلب از کاتیونهای فلزی دریایی از الکترونهای ظرفیت نامستقر خود را با یکدیگر به اشتراک میگذارند. از شباهتهای این دو پیوند میتوان به این نکته اشاره کرد که در هر دوی این پیوندهای شیمیایی نیروی جاذبه الکتروستاتیک وجود دارد.
حل تمرین
حال به مرور تعدادی مثال پرداختیم، در این بخش به تمرینهای چندگزینهای پاسخ میدهیم.
تمرین اول
کدام یک از گزینههای زیر در مورد پیوند هیدروژنی در آب صحیح است؟
در مولکول آب دو اتم هیدروژن حضور دارد که باعث دو برابر شدن بار الکتریکی مثبت در آن میشود.
هیدروژن از اکسیژن الکترونگاتیوی بالاتری دارد و از همین جهت تمایل بیشتری نیز برای اهدای الکترونهای خود به اکسیژن دارد.
اکسیژن بسیار الکترونگاتیو است و الکترونهای هیدروژن را با شدت زیادی به خود جذب میکند.
هیدروژنهای موجود در مولکول آب بهصورت یونی به اکسیژن متصل شدهاند.
تمرین دوم
پیوند هیدروژنی در کدام یک از گزینههای زیر از بقیه قویتر است؟
$$O-H-F$$
$$O-H-H$$
$$F-H-F$$
$$O-H-O$$
تمرین سوم
کدام یک از انواع پیوندهای کووالانسی زیر قویتر است و کدام پایداری بیشتری دارد؟
پیوند دوگانه، پیوند سهگانه
پیوند سهگانه، پیوند یگانه
پیوند یگانه، پیوند دوگانه
پیوند یگانه، پیوند سهگانه
تمرین چهارم
کدام یک از گرینههای زیر از قاعده اکتت پیروی نمیکند؟
$$NO$$
$$NO_2$$
$$CO_2$$
$$N_2O$$
تمرین پنجم
کدام یک از گرینههای زیر از قاعده اکتت پیروی میکند؟
$$SnCl_{2}$$
$$CO$$
$$BF_3$$
$$SF_6$$
تمرین ششم
کدام یک از گزینههای زیر در تشکیل پیوند یونی به چشم نمیآید؟
اشتراکگذاری الکترون
انتقال الکترون
از دست دادن الکترون
به دست آوردن الکترون
تمرین هفتم
مولکولها در یک شبکه بلوری توسط ... در کنار یکدیگر نگه داشته میشوند.
پیوند هیدروژنی
جاذبه الکتروستاتیکی
جاذبه واندروالسی
جاذبه دوقطبی دوقطبی
تمرین هشتم
... نوعی پیوند شیمیایی است که در آن اتمها الکترونهای ظرفیت خود را با یکدیگر به اشتراک میگذارند.
پیوند یونی
پیوند فلزی
پیوند واندروالسی
پیوند کووالانسی
تمرین نهم
کربن در لایه ظرفیت خود ۴ الکترون و هیدروژن ۱ الکترون دارد. چه تعداد اتم هیدروژن میتوانند با ۱ اتم کربن پیوند شیمیایی تشکیل دهند؟
۱
۲
۸
۴
تمرین دهم
پیوند فلزی پیوندی شیمیایی است که بین یک یون با بار مثبت و یک ... تشکیل میشود.
یک یون نافلزی با بار منفی
الکترونهای ظرفیت چندین یون فلزی دیگر
الکترونهای ظرفیت هالوژنها
یون هالوژن با بار منفی
تمرین یازدهم
نقطه جوش بالاتر هیدروژن فلوئورید نسبت به هیدروژن کلرید به چه علت است؟
ویژگیهای قطبی مولکول
ساختار خطی مولکول
وجود پیوند یونی بین مولکولها
وجود پیوند هیدروژنی بین مولکولها
تمرین دوازدهم
در کدام یکی از مولکولهای زیر پیوند کووالانسی وجود دارد؟
سدیم کلرید
کربن دیاکسید
سدیم برمید
تمامی گزینهها
تمرین سیزدهم
پیوند کووالانسی بین چه عنصرهایی تشکیل میشود؟
عنصرهایی که دارای مقادیر مشابهی از الکترونگاتیوی باشند.
عنصرهایی که نقطه ذوب آنها پایین باشد.
عنصرهایی که توانایی تشکیل یون با بار کم را داشته باشند.
عنصرهایی که انرژی یونیزاسیون پایینی داشته باشند.
تمرین چهاردهم
پیوند شیمیایی بین دو اتم نافلز یکسان دارای زوجالکترونی است که ...
بهصورت نامساوی بین دو اتم به اشتراک گذاشته شدهاند.
از یک اتم به اتم دیگر منتقل شده است.
دارای اسپین یکسان هستند.
بهصورت مساوی بین دو اتم به اشتراک گذاشته شدهاند.
تمرین پانزدهم
پیوند یونی چگونه به وجود میآید؟
تنها با از دست دادن الکترون
تنها با گرفتن الکترون
با اشتراکگذاری الکترون
با از دست دادن و گرفتن الکترون
تمرین شانزدهم
کدام یک از گزینههای زیر به تشکیل پیوند کووالانسی میانجامد؟
زمانی که دو اتم الکترونهای خود را با یکدیگر به اشتراک میگذارند تا لایه ظرفیت آنها تکمیل شود.
طی حرکت دائمی الکترونها و ایجاد پیوندی که از نظر بار یکسان نباشد.
از جاذبه یک اتم هیدروژن با بار مثبت به مولکول یا اتمی دیگر با بار منفی تشکیل میشود.
یک اتم تعدادی الکترون را از دست میدهد و اتمی دیگر همان تعداد الکترون را به دست میآورد.
سوالات متداول
حال که با انواع پیوند ها در شیمی آشنا شدیم و ویژگیهای هر کدام را مورد بررسی قرار دادیم، میخواهیم در این بخش به تعدادی از مهمترین و پرتکرارترین پرسشهای موجود پیرامون آن پاسخ دهیم.
پیوند فلزی چیست؟
پیوند فلزی نوعی از پیوند شیمیایی است که بین اتمهایی با بار مثبت تشکیل میشود که در آن ها الکترونهای آزاد در شبکهای از کاتیونها به اشتراک گذاشته شدهاند
پیوند هیدروژنی چیست؟
پیوند هیدروژنی یک نیروی بینمولکولی است که نوعی ویژه از جاذبه دوقطبی-دوقطبی را از طریق پیوند یک اتم هیدروژن با یک اتم با الکترونگاتیوی بالا ایجاد میکند و به همین دلیل نیز به نام پیوند هیدروژنی شناخته میشود.
پیوند واندروالسی چیست؟
نیروهای واندروالسی که بیشتر با نام پیوند واندروالسی شناخته میشود، نوعی برهمکنش بین دو اتم یا مولکول است که در مجاورت یکدیگر قرار دارند.
پیوند داتیو چیست؟
پیوند داتیو نوعی از پیوند شیمیایی است که در آن هر دو الکترون درگیر در پیوند از یک اتم یکسان به تامین میشوند.
پیوند یونی چیست؟
پیوند یونی نوعی از پیوند شیمیایی است که در آن بین اتمها انتقال کامل الکترون صورت میگیرد و یونهایی با بار مخالف به وجود میآورد. وجود نیروی الکتروستاتیکی بین یونهای مثبت و منفی باعث کنار هم قرار گرفتن آنها میشود.
پیوند کووالانسی چیست؟
پیوند کووالانسی زمانی به وجود میآيد که اتمها الکترونهای خود را با یکدیگر به اشتراک بگذارند.
جمعبندی
هدف از این مطلب مجله فرادرس آشنایی با انواع پیوند ها در شیمی بود. ابتدا به برررسی چیستی انواع پیوند ها در شیمی پرداختیم و سپس تعدادی از مهمترین آنها از جمله پیوند داتیو، پیوند یونی، پیوند هیدروژنی و پیوند کووالانسی را معرفی کردیم. در هر مورد تعدادی مثل را مورد بررسی قرار دادیم تا بهتر با چگونگی تشکیل آنها آشنا شویم.
در ادامه به تفاوت قدرت انواع پیوند ها در شیمی پرداختیم. در نهایت نیز تعدادی مثال را به همراه پاسخ تشریحی مورد بررسی قرار دادیم تا درک خود از این مفهوم را عمیق ببخشیم و سپس تعدادی تمرین چندگزینهای را مرور کردیم.










