فرآیند احتراق یا سوختن — از صفر تا صد

واکنشهای متوالی پیچیده گرمازا را بین یک ماده اکسنده یا اکسید کننده و سوخت که همراه با تولید گرما، نور یا هردو است و به شکل شعله نمایان میشود، «احتراق یا سوختن» (combustion) مینامند.
در واکنش سوختن کامل، یک ماده با عامل اکسنده همانند اکسیژن یا فلوئور واکنش میدهد که محصولات واکنش، ترکیبی از هر دو یعنی ماده سوختنی و اکسنده خواهد بود. برای مثال واکنشهای زیر طی سوختن مشاهده میشود:
CH4 + 2O2 → CO2 + 2H2O + گرما
CH2S + 6F2 → CF4 + 2HF + SF6 + گرما
مثالی سادهتر از سوختن را میتوان به این شکل بیان کرد؛ جایی که هیدروژن و اکسیژن با هم واکنش میدهند و معمولا در موتورهای موشک از آن استفاده میشود:
2H2 + O2 → 2H2O + گرما
محصول این واکنش بخار آب است.

بیشترین ماده اکسنده مورد استفاده برای سوختن در دنیا اکسیژن است که در هوای اطراف ما به وفور وجود دارد. ضمن اینکه در زمان استفاده از آن نیتروژن موجود در هوا نیز در هنگام واکنش حضور دارد؛ اما نیتروژن طبق واکنش زیر در آن دخالتی نمیکند:
CH4 + 2O2 + 7.52N2 → CO2 + 2H2O + 7.52N2 + گرما
همانطور که مشاهده میگردد منبع اکسیژن هوا است و درنتیجه بیشترین ماده تشکیل دهنده گازهای خروجی حاصل از احتراق را نیتروژن به خود اختصاص میدهد.
در واقعیت، واکنشهای احتراق هیچوقت کامل انجام نمیشوند. در گاز خروجی از سوختن کربن و ترکیبات کربنی ازجمله زغالسنگ، هیدروکربنها، چوب و ... ترکیبات کربنی و کربن سوخته نشده نیز وجود دارند. علاوه بر آن زمانی که اکسیژن از هوا وارد واکنش میشود، برخی از ترکیبات خطرناک نیتروژن (NOx) نیز بر اثر گرمای حاصل از سوختن و ترکیب با اکسیژن به وجود میآیند.
انواع مختلف احتراق
در این بخش به انواع سوختن از نظر سرعت احتراق، کامل یا ناقص بودن و .. اشاره میکنیم.
احتراق سریع
«احتراق سریع» (rapid combustion) نوعی از سوختن است که مقدار زیادی انرژی، گرما و شعله به سرعت در آن آزاد میگردد. این نوع احتراق معمولا با شعله همراه است و از آن در موتور ماشینها و سلاحهای «گرمافشاری» (Termobaric) (نوعی بمب یا سلاح است که در ابتدا تودهای از مواد آتشزا در شعاع انفجاری خود ایجاد میکند که با اکسیژن موجود در جو مخلوط میشود. سپس در مرحله بعد، این توده آتش میگیرد. به نحوی که تمام منطقه شعلهور شده را نابود میکند) استفاده میشود.
احتراق یک واکنش جابهجایی دوگانه محسوب میگردد و این در حالی است که واکنش شیمیایی یک واکنش جابهجایی تکی در نظر گرفته میشود.
احتراق آرام
«احتراق آرام» (slow combustion) نوعی از سوختن است که در دمای پایین رخ میدهد. تنفس مثالی از این گونه سوختن است. تنفس را میتوان این گونه تعریف کرد: تبادل گازها بین موجود و محیطی که در آن زندگی میکند. با این تعریف دو نوع تنفس در موجودات زنده خواهیم داشت:
- تنفس داخلی (سلولی)
- تنفس خارجی (ریوی)
در تنفس داخلی، تبادل گازها بین جریان خون و سلولهای مجاور صورت میگیرد. خون طی عبور از میان بافتهای بدن، تقریبا به اندازه ۵ تا ۷ ٪ از حجم خود، اکسیژن از دست میدهد و ۴ تا ۶ ٪ دی اکسید کربن دریافت میکند. هنگامی که دما یا pH، افزایش پیدا مینماید، اکسیژن بیشتری به بافتها میرسد.
احتراق کامل
در «سوختن کامل» (complete combustion) واکنش دهنده (ماده سوختنی) به همراه اکسیژن میسوزد و تعداد محدودی محصول تولید میکند. زمانی که هیدروکربنی در قالب این احتراق قرار میگیرد، فقط دیاکسید کربن و آب تولید میشود. در حالتی که هیدروکربن یا هر نوع سوختی در هوا میسوزد، نیتروژن نیز در محصولات احتراق قرار میگیرد. اگر عناصری همچون کربن، نیتروژن، سولفور و آهن در واکنش شرکت کنند، اکسیدهای معمول تشکیل میگردند. کربن باعث تولید کربن اکسید، نیتروژن باعث تولید نیتروژن اکسید، گوگرد باعث تولید سولفور اکسید و آهن باعث تولید آهن اکسید میشود.
لازم به ذکر است که سوختن کامل تقریبا غیرممکن است. در واقعیت، وقتی که فرایند سوختن اتفاق میافتد بسیاری از مواد مختلف تولید میشوند. برای مثال سوختن متان با هوا علاوه بر محصولات اصلی آب و دی اکسید کربن، محصولات فرعی چون: کربن منو اکسید، هیدروکسیل، نیتروژن اکسید، هیدروژن و اکسیژن تک اتمی تولید میکند.
احتراق متلاطم
«احتراق متلاطم» (turbulent combustion) نوعی از سوختن است که با ویژگی جریان متلاطم شناخته میشود. مهمترین استفاده از این نوع احتراق برای استفادههای صنعتی در توربینهای گازی، موتورهای دیزلی و ... است. از مهمترین مزیتهای استفاده از احتراق متلاطم میتوان به اختلاط بهتر سوخت و اکسنده با یکدیگر اشاره کرد.
احتراق ناقص
«احتراق ناقص» (incomplete combustion) زمانی رخ میدهد که اکسیژن کافی برای واکنش با سوخت (معمولا هیدروکربن) و تولید دی اکسید کربن و آب وجود ندارد. همچنین وقتی آتش با استفاده از روشهای خفه کردن و جذب گرمای آن خاموش گردد، احتراق ناقص اتفاق میافتد.
زمانی که هیدروکربن در هوا میسوزد، واکنش سوختن کربن دی اکسید، آب، کربن منو اکسید، کربن خالص (به شکل دوده یا خاکستر) و بسیاری مواد دیگر همانند نیتروژن اکسید تولید میکند. معمولترین نوع سوختن احتراق ناقص است که دامنهی وسیعی از محصولات را تولید مینماید. در صورتی که احتراق ناقص در خودرو رخ دهد، محصولات جانبی میتوانند برای سلامت انسانها و محیط زیست بسیار مضر باشند.

کیفیت احتراق را میتوان با طراحی تجهیزات مربوطه همانند مشعلها و موتورهای احتراق داخلی بهبود بخشید. برای بهبود بیشتر باید از تجهیزات کاتالیستی استفاده نمود. برخی از این تجهیزات همانند مبدلهای کاتالیستی که در خودروها استفاده میشوند در اکثر کشورهای دنیا نیاز به مجوزهای زیست محیطی دارند. برای رسیدن به استاندارد رهایش گازهای حاصل از سوختن در مقیاس صنعتی مثل نیروگاههای گرمایی نیز استفاده از مبدلهای کاتالیستی مرسوم است.
سوختن بدون شعله
نوعی از سوختن را که هیچگونه شعلهای ایجاد نمیکند و معمولا در سطح سوخت جامد در مجاورت اکسنده طی واکنشی ناهمگون رخ میدهد «سوختن بدون شعله» (Smoldering) مینامند.
مهمترین تفاوت بین سوختن بدون شعله و احتراق در این است که واکنشدهندهها در سطح روی جامد بهجای فاز گاز با یکدیگر واکنش میدهند. میزان گرمای آزاد شده و دمای سوختن در سوختن بدون شعله در مقایسه با انواع دیگر احتراق کمتر است.

میزان دما و انرژی آزاد شده در سوختن بدون شعله و همراه با شعله به ترتیب ۶۰۰ درجه سانتیگراد و پنج کیلوژول انرژی بر هر گرم اکسیژن و ۱۵۰۰ درجه سانتیگراد و ۱۳ کیلوژول انرژی بر هر گرم اکسیژن خواهد بود. این ویژگیها باعث میشود که سرعت پیشروی سوختن بدون شعله کم و در حدود یک میلیمتر بر ثانیه باشد در صورتی که وقتی شعله وجود داشته باشد این سرعت تقریبا دو برابر خواهد بود. علیرغم ویژگیهای یاد شده، سوختن بدون شعله خطری جدی برای ایجاد حریق است.
احتراق توسط اکسندههای دیگر
معمولا زمانی که از احتراق سخن به میان میآید، اکسیژن به عنوان ماده اکسنده در نظر گرفته میشود؛ این در حالی است که اکسندههای دیگری نیز وجود دارند. دی نیتروژن اکسید مادهای است که در موشک و موتورهای اسپرت استفاده میشود و در دمای بالای ۱۳۰۰ درجه سانتیگراد اکسیژن تولید میکند.
فلوئور نیز عنصر اکسنده دیگری است که میتواند باعث احتراق و تولید محصولاتی با فلوئور (به جای اکسیژن) شود. برای مثال مخلوط گازهای فلوئور و متان همانند مخلوط گازهای اکسیژن و متان قابل انفجار است. ترکیب تری فلوراید کلر عاملی قویتر و سریعتری از اکسیژن برای اشتعال سوخت به حساب میآید.
معادله شیمیایی
معادله شیمیایی و استوکیومتری واکنش سوختن هیدروکربن با اکسیژن معمولا به شکل زیر است:
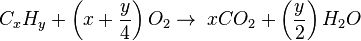
برای مثال سوختن پروپان:
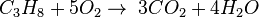
معادله سادهشده و توضیحی سوختن هیدروکربن و اکسیژن:
کربن دی اکسید + آب + گرما → اکسیژن + سوخت
اگر احتراق در هوای آزاد اتفاق بیفتد معادله متناظر برابر خواهد بود با:
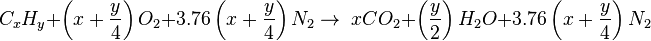
برای مثال سوختن پروپان:
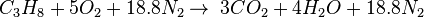
معادله ساده و توضیحی احتراق هیدروکربن در هوا برابر است با:
نیتروژن + کربن دی اکسید + آب + گرما → هوا + سوخت
انواع سوختها
در این قسمت خالی از لطف نیست به انواع سوختها نیز بپردازیم.
سوختهای مایع
احتراق سوختهای مایع در فشار اتمسفر در فاز گازی صورت میگیرد. در حقیقت بخار مایع میسوزد نه خود آن؛ بنابر این یک مایع زمانی آتش میگیرد که دمایش از حد نصابی بالاتر باشد که به آن «نقطه اشتعال» (Flash Point) میگویند. نقطه اشتعال یک مایع کمترین دمایی است که میتواند با هوا مخلوط قابل احتراق بسازد یا به عبارتی دیگر کمترین دمایی است که بخارهای کافی از سوخت در هوا برای شروع احتراق وجود دارد.
سوختهای جامد
احتراق سوختهای جامد تقریبا از سه مرحله مجزا تشکیل شده که فازهای مشترکی نیز دارند:
فاز پیش گرم شدن
زمانی این فاز رخ میدهد که سوخت تا حد نقطه اشتعال گرم شده و آتش میگیرد. گازهای قابل اشتعال در فرآیندی شبیه به تقطیر خشک رفتار میکنند.
فاز تقطیر یا گازی
وقتیکه مخلوط گازهای قابل اشتعال با اکسیژن شعلهور شد، انرژی بهصورت گرما و نور متصاعد میگردد. شعله ایجاد شده معمولا قابل رویت است. انتقال حرارت از احتراق به سوخت جامد باقی مانده باعث تولید بخارهای قابل اشتعال بیشتری خواهد گشت.
فاز زغال شدن یا جامد
زمانی که مقدار گازهای قابل اشتعال خروجی برای تداوم شعله کافی نباشد و دیگر سوخت به سرعت آتش نگیرد، احتراق وارد این فاز شده است. بعد از مدتی کمی نیز سوختن بدون شعله ادامه پیدا خواهد کرد.
دما
اگر شرایط کاملی برای احتراق همانند سوختن در شرایط آدیاباتیک (که نه گرمایی دفع و نه جذب شود) در نظر بگیریم، دمای احتراق آدیاباتیک را میتوان اندازهگیری کرد. فرمولی که از آن دمای سوختن اندازهگیری میشود بر اساس قانون اول ترمودینامیک خواهد بود. با شرط آنکه تمامی گرمای حاصل از احتراق برای گرم کردن سوخت، هوا و محصولات سوختن استفاده گردد.
در حالتی که سوخت فسیلی در هوا بسوزد، دمای سوختن به موارد زیر بستگی خواهد داشت:
- مقدار گرما
- نسبت استوکیومتری هوا به سوخت که با نماد λ مشخص میشود.
- ظرفیت گرمایی سوخت و هوا
- دمای ورودی سوخت و هوا
دمای سوختن آدیاباتیک که به دمای شعله آدیاباتیک نیز معروف است با مقدار گرمای بیشتر و دمای بیشتر سوخت و هوای ورودی افزایش مییابد و برای هر نسبت استوکیومتری هوا به سوخت مقداری ثابت خواهد بود.
دمای سوختن آدیاباتیک در دمای متعارفی سوخت و هوا و نسبت λ = 1.0 برای زغالسنگ، نفت و گاز طبیعی به ترتیب برابر با ۲۲۰۰، ۲۱۵۰ و ۲۰۰۰ درجه سانتیگراد است.
در محیطهای صنعتی که احتراق به صورت گسترده در آنها انجام میشود مثل نیروگاههای تولید بخار، توربینهای گازی و ... معمولترین راه برای بیان مقدار مصرف اکسیژن درصد اضافی آن علاوه بر نسبت استوکیومتری است. برای مثال درصد اضافی هوای سوختن برابر با ۱۵ درصد یعنی ۱۵ درصد هوا علاوه بر نسبتهای استوکیومتری موردنیاز است.
آنالیز
در این بخش آنالیزی برای برخی سوختهای معمولی همچون کربن، هیدروژن، گوگرد، زغالسنگ، نفت و گاز زمانی که با هوا در نسبت استوکیومتری واکنش میدهند، انجام خواهد شد.
برای انجام این آنالیز سوخت و هوا در دمای ورودی ۲۹۸ درجه کلوین و فشار مطلق یک اتمسفر قرار دارند و سوختن کامل و بدون هیچگونه هدر رفت گرما انجام خواهد شد. در طول احتراق مقادیر زیادی از انرژی شیمیایی واکنشدهندهها به شکل انرژی گرمایی آزاد میگردد.
در این قسمت باید به مفهوم «آنتالپی» (Enthalpy) بپردازیم. در ترمودینامیک، آنتالپی به معنای انرژی کل سیستم است. این عدد نشان دهنده کمیتی مقداری است که انرژی حرارتی کل یک سیستم را نشان میدهد. برای سیستمی با حجم V و فشار P، آنتالپی برابر با مجموع انرژی درونی سیستم و حاصلضرب فشار در حجم آن است. معمولا در سیستمهای شیمیایی، بیولوژیکی و یا فیزیکی، آنتالپی را به عنوان خاصیتی میبینند که در فرآیندی فشار ثابت اندازهگیری میشود.
بنابراین برای اندازهگیری مقدار آنتالپی یک واکنش تفاوت انرژی گرمایی محصولات و فرآوردهها را در فشار ثابت میسنجند. آنتالپی سوختن نیز تفاوت آنتالپی سوخت و هوا با محصولات واکنش است که بر اساس دمای مرجع ۲۹۸ درجه کلوین اندازهگیری میشود.
زمانی که مقدار آنتالپی واکنش دهندهها برابر با مقدار آنتالپی فرآوردههای سوختن باشد، با حسابی ساده میتوان متوجه شد که دمای به دست آمده، دمای سوختن آدیاباتیک خواهد بود؛ چراکه هیچگونه جذب یا هدر رفت انرژی رخ نداده است.
مقدار آنتالپی واکنش دهندهها و فرآوردههای سوختن با افزایش دما تغییر میکند. شرایط فیزیکی برای واکنش دهندهها و محصولات سوختن بسیار مهم و برای محاسبات دقیق و موفق احتراق لازم است.
شکل زیر نشان دهنده آن است که چگونه آنتالپی واکنشدهندهها و فرآوردههای سوختن با تغییرات دما مرتبط است.
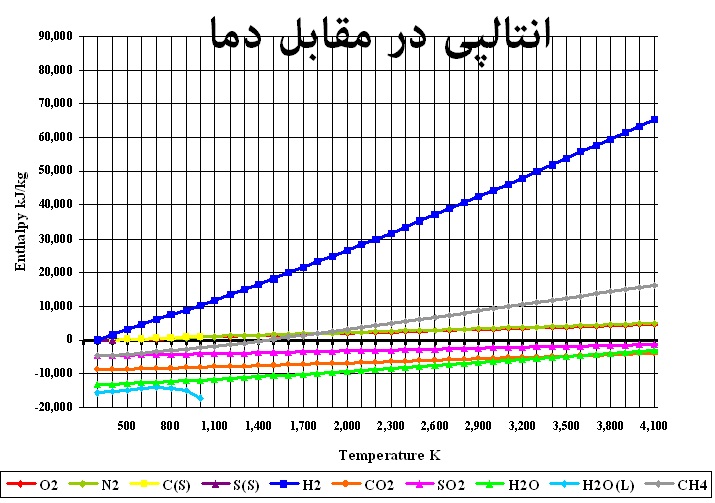
نکته جالب و مهم این است که مقدار آنتالپی برای عناصر پایه احتراق همانند هیدروژن، کربن، گوگرد، اکسیژن، نیتروژن در شرایط ۲۹۸ درجه کلوین و فشار یک اتمسفر برابر با صفر در نظر گرفته میشود. همچنین خالی از لطف نیست که بدانیم مقدار آنتالپی گازهای ایده آل فقط به دمای آنها بستگی دارد.
علاوه بر دانستن ویژگیهای فیزیکی محصولات و فرآوردههای احتراق، اطلاع کامل از ترکیب دقیق سوخت و ماده اکسنده برای محاسبات الزامی است. برای سوختهای جامد و مایع، ترکیب سوخت بر اساس نسبت وزنی آنها محاسبه میشود. در این آنالیز، گاز متان تنها گازی است که مورد استفاده قرار گرفته است و برای ساده نگه داشتن کار ترکیب این گاز نیز بر اساس وزن اعلام میگردد. ترکیب اکسنده معمولا بر اساس مول بر حجم بیان خواهد شد.
در جدول زیر ترکیب درصد برخی از سوختها را مشاهده میکنید.
| سوخت | کربن | هیدروژن | گوگرد | نیتروژن | اکسیژن | آب | متان |
| کربن | ۱.۰۰ | ۰ | ۰ | ۰ | ۰ | ۰ | - |
| هیدروژن | ۰ | ۱.۰۰ | ۰ | ۰ | ۰ | ۰ | - |
| گوگرد | ۰ | ۰ | ۱.۰۰ | ۰ | ۰ | ۰ | - |
| زغالسنگ | ۰.۷۸۰ | ۰.۰۵۰ | ۰.۰۳۰ | ۰.۰۴۰ | ۰.۰۸۰ | ۰.۰۲۰ | - |
| نفت | ۰.۸۶۰ | ۰.۱۴۰ | ۰ | ۰ | ۰ | ۰ | - |
| گاز | - | - | - | - | - | - | ۱.۰۰ |
جدول زیر نشاندهنده ترکیب هوا است.
| اکسنده | N
(Kg/Kg) | O
(Kg/kg) | N2
(mol/mol) | O2
(mol/mol) |
| هوا | ۰.۷۶۷ | ۰.۲۳۳ | ۰.۷۹۰ | ۰.۲۱۰ |
مجددا بیان میشود که در این آنالیز احتراق، فقط نسبتهای استوکیومتری در نظر گرفته شده است.
جدول سوم فرآوردههای احتراق را بر اساس وزن نشان میدهد.
| سوخت | CO2 | H2O | SO2 | N2 | O2 |
| کربن | ۰.۲۹۵ | ۰ | ۰ | ۰.۷۰۵ | ۰ |
| هیدروژن | ۰ | ۰.۲۵۵ | ۰ | ۰.۷۴۵ | ۰ |
| گوگرد | ۰ | ۰ | ۰.۳۷۸ | ۰.۶۲۲ | ۰ |
| زغالسنگ | ۰.۲۴۹ | ۰.۰۴۱ | ۰.۰۰۵ | ۰.۷۰۵ | ۰ |
| نفت | ۰.۲۰۳ | ۰.۰۷۹ | ۰ | ۰.۷۱۸ | ۰ |
| گاز | ۰.۱۵۱ | ۰.۱۲۴ | ۰ | ۰.۷۲۵ | ۰ |
جدول چهارم بیانکننده ترکیب فرآوردههای گازی سوخت بر اساس مول است.
| سوخت | CO2 | H2O | SO2 | N2 | O2 |
| کربن | ۰.۲۱۰ | ۰ | ۰ | ۰.۷۹۰ | ۰ |
| هیدروژن | ۰ | ۰.۳۴۷ | ۰ | ۰.۶۵۳ | ۰ |
| گوگرد | ۰ | ۰ | ۰.۲۱۰ | ۰.۷۸۹ | ۰ |
| زغالسنگ | ۰.۱۷۰ | ۰.۰۶۸ | ۰.۰۰۲ | ۰.۷۵۹ | ۰ |
| نفت | ۰.۱۳۳ | ۰.۱۲۷ | ۰ | ۰.۷۴۰ | ۰ |
| گاز | ۰.۰۹۵ | ۰.۱۹۰ | ۰ | ۰.۷۱۵ | ۰ |
زغالسنگ، نفت و گاز را در نظر میگیریم، در این میان زغالسنگ بیشترین مقدار کربن دیاکسید را بر اساس مول یا وزن تولید میکند.
جدول پنجم دمای شعله آدیاباتیک، نسبتهای استوکیومتری و «مقدار گرمای بیشینه» (higher heating value) سوخت را نشان میدهند. مقدار گرمای بیشینه سوخت همان مقدار گرمایی است که براثر سوختن مقدار مشخصی از سوخت آزاد میگردد.
| سوخت | دمای شعله آدیاباتیک (کلوین) | نسبتهای استوکیومتری | مقدار گرمای بیشینه (kj/kg) |
| کربن | ۲۴۶۰ | ۱۱.۴۴۴ | ۳۲۷۷۹.۸ |
| هیدروژن | ۲۵۲۵ | ۳۴.۳۳۳ | ۱۴۱۸۶۶.۸ |
| گوگرد | ۱۹۷۲ | ۴.۲۹۲ | ۹۲۶۱.۳ |
| زغالسنگ | ۲۴۸۴ | ۱۴.۵۸۰ | ۴۷۶۳۰ |
| نفت | ۲۴۸۴ | ۱۴.۵۸۰ | ۴۷۶۳۰ |
| گاز | ۲۳۲۷ | ۱۷.۱۶۷ | ۵۰۱۵۱.۲ |
نکته: نسبت استوکیومتری مقدار هوایی است که برای سوختن کامل یک واحد سوخت استفاده میشود؛ بنابراین برای سوختن یک کیلوگرم کربن ۱۱.۴۴۴ کیلوگرم هوا در شرایط ایده آل لازم است.
امروزه گرمایش جهانی کاملا قابل لمس و مشهود شده که یکی از پایههای اصلی آن رهایش گاز دیاکسید کربن در هوا است. آنالیز با جزئیات و دقیقی که ارائه گردید میتواند به ایجاد راهحلها و سناریوهای مختلف برای پیشبرد فنّاوری در جهت کاهش رهایش گاز دیاکسید کربن منجر شود.
چنانچه به مطالبی از این دست علاقهمندید، پیشنهاد میکنیم به لینکهای زیر نیز سر بزنید.









سلام عرض ادب و احترام
و بابت ویدیویی که گذاشتین خیلی ممنونم
من موتور برق بنزینی 200ccرو با گاز هیدروژن روشن کردم ولی مقدار مصرف گاز هیدروژن نسبت به گاز شهری تقریبا دوبرابر هستش یعنی هیدروژن رو دوبرابر بیشتر میسوزونه
توی این ویدیو نوشتین که مقدار استوکیومتری هیدروژن 1-34هستش الان اینجا نسبت به وزن یا حجم؟
سوالم اینه ایا موتور منم تراکمش پایین بوده یا ذات گاز هیدروژن همینه؟
هر کیلو گاز طبیعی حدود1300 لیتر هستش ولی گاز هیدروژن11000 لیتر. حالا اگه نسبت به وزن باشه یعنی تراکم موتور با سوخت هیدروژن 1-2/5میشه