الکترولیز — به زبان ساده
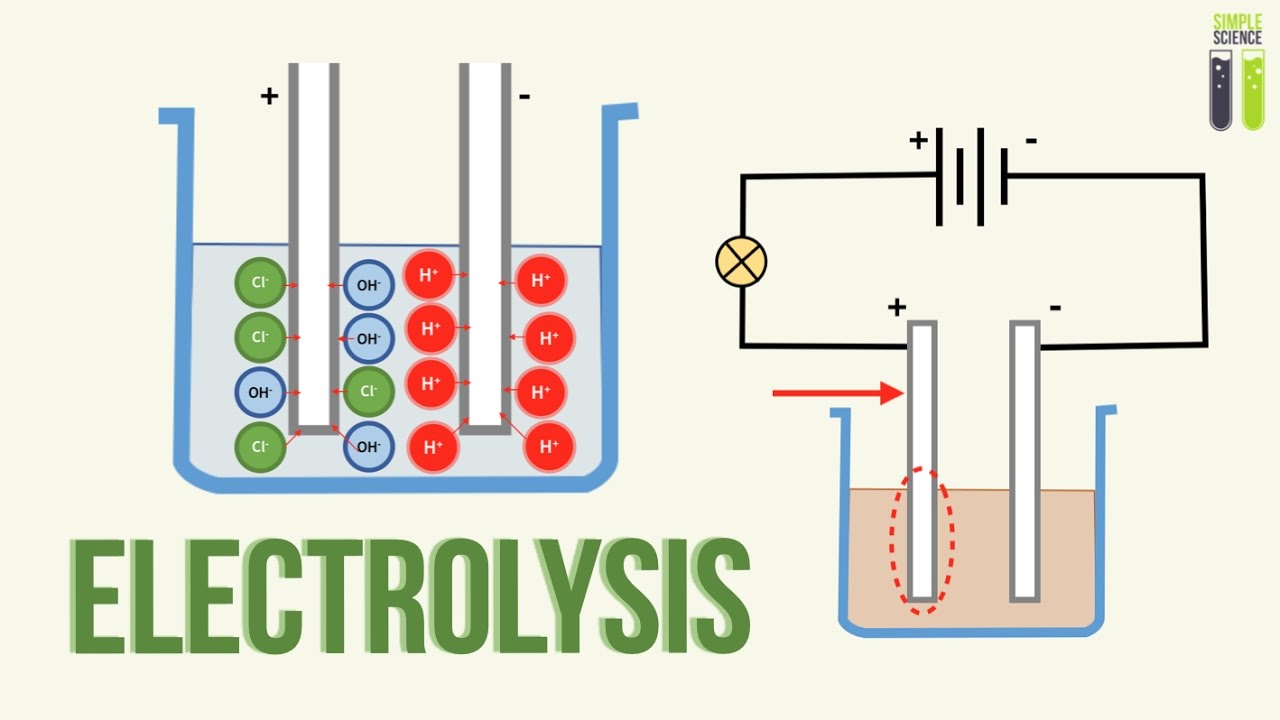
«الکترولیز» (Electrolysis) یا برقکافت، استفاده از جریان الکتریکی برای انجام واکنشهایی است که به طور خود به خودی انجام نمیشوند. از الکترولیز برای تبدیل مواد مختلف به عناصر سازنده خود بهره میگیرند و از همین راه عناصر مختلفی نیز کشف شدهاند. امروزه برقکافت در صنعت کاربردهای بسیاری دارد. در الکترولیز، از طریق الکترولیت، جریانی الکتریکی به محلول فرستاده میشود تا یونهای مورد نیاز برای انجام یک واکنش را تحریک کند. همانطور که اشاره شد، این نوع از واکنشها به طور خود به خودی انجام نمیشوند. به ولتاژ مورد نیاز برای انجام الکترولیز، «ولتاژ تجزیه» (Decomposition Potential) میگویند.
مقدمه
برقکافت عبور یک جریان برق مستقیم (DC) از طریق مادهای یونی است. این ماده میتواند مذاب یا حل شده در یک حلال باشد که در نهایت موجب انجام واکنشهای شیمیایی در الکترودها و تجزیه مواد میشود.
اجزای اصلی برای انجام فرآیند الکترولیز عبارتند از:
- الکترولیت: مادهای که معمولا به صورت پلیمری است که یونهای آزاد داشته باشد. این پلیمرها، به کمک یونهای آزاد، گذردهی جریان الکتریکی را در الکترولیت به عهده دارند. اگر یونها تحرک نداشته باشند، الکترولیز انجام نمیشود.
- منبع تغذیه برق مستقیم: این منبع تغذیه، انرژی مورد نیاز برای تولید یا شارژ یونها را تامین میکند. لازم به ذکر است که جریان الکتریکی در خارج از الکترولیت، از طریق یک مدار خارجی انجام میشود.
فرآیند الکترولیز
فرآیند اصلی در برقکافت، تبادل اتمها و یونها بوسیله حذف یا اضافه کردن الکترونها از طریق یک مدار خارجی است. حالت فیزیکی محصول نهایی در این فرآیند به طور معمول با الکترولیت متفاوت است و با استفاده از مراحل فیزیکی میتوان آن را از الکترولیت جدا کرد. به طور مثال، الکترولیز «آب شور» (Brine) به منظور تولید هیدروژن و کلر انجام میشود که هر دو در فاز گاز هستند. در این شرایط، حبابهای گاز در الکترولیت ایجاد و در نهایت جمعآوری میشوند:
$$2 \mathrm { NaCl } + 2 \mathrm { H } _ { 2 } \mathrm { O } \rightarrow 2 \mathrm { NaOH } + \mathrm { H } _ { 2 } + \mathrm { Cl } _ { 2 }$$
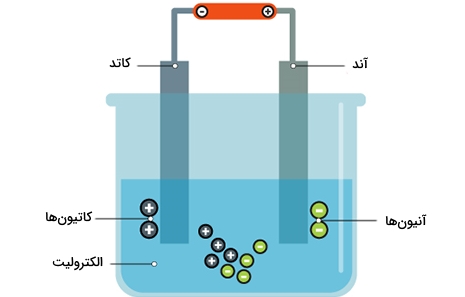
به کمک الکترودهایی که در الکترولیت قرارداده شدهاند، یک ولتاژ الکتریکی اعمال میشود. هر الکترود، یونهای با بار ناهمنام را به خود جذب میکند. یونهای با بار مثبت، به طرف کاتد و یونهای با بار منفی، به طرف آند حرکت میکنند. در این فرآیند، الکترونها ممکن است آزاد یا جذب شوند. اتمهای خنثی با گرفتن یا آزاد کردن الکترون باردار میشوند و در طول الکترولیت حرکت میکنند. تشکیل اتمهای خنثی از یونها را «تخلیه» (Discharging) مینامند. زمانی که یک یون به تعداد کافی الکترون بگیرد یا از دست بدهد تا خنثی شود، اتم جدیدی که ایجاد شده است از الکترولیت جدا خواهد شد. یونهای مثبت فلزی مانند $$Cu ^ { 2 + }$$ به شکل لایهای بر روی کاتد رسوب میکنند. به این فرآیند «آبکاری» (Electroplatin) میگویند. از واژههای «تصفیه الکتریکی» (Electrorefining) و «الکترووینینگ» (Electrowinning) نیز در توصیف برخی فرآیندهای برقکافت صنعتی استفاده میشود.
اکسایش و کاهش در الکترودها
اکسیداسیون یونها یا مولکولهای خنثی، در آند اتفاق میافتد. به طور مثال، اکسیداسیون «فرو» (Ferrous) و تبدیل آن به «فریک» (Ferric) در آند وقوع پیدا میکند.
$$\mathrm { Fe } ^ { 2 + } ( \mathrm { aq } ) \rightarrow \mathrm { Fe } ^ { 3 + } ( \mathrm { aq } ) + \mathrm { e } ^ { - }$$
کاهش مولکلولها یا یونها در کاتد اتقاق میافتد. کاهش «فری سیانید» (Ferrycinide) به «فرو سیانید» (Ferrocyanide) در کاتد به صورت زیر است:
$$\mathrm { Fe } ( \mathrm { CN } ) _ { 6 } ^ { 3 - } + \mathrm { e } ^ { - } \rightarrow \mathrm { Fe } ( \mathrm { CN } ) _ { 6 } ^ { 4 - }$$
مولکلولهای خنثی نیز میتوانند در هر دو الکترود واکنش دهند. به طور مثال در تصویر زیر «پی-بنزو کوئینون» (p-Benzoquinone) در کاتد به «هیدروکوئینون» (Hydroquinone) کاهش پیدا میکند:
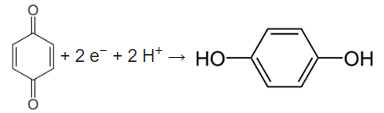
در مثال بالا، یون $$H ^ +$$ نیز در واکنش شرکت میکند که بوسیله اسید در محلول یا خود حلال تامین میشود. به طور مثال اگر حلال، آب یا متانول باشد، این یون بوسیله خود حلال در واکنش شرکت میکند. الکترولیز شامل یون $$H ^ +$$، به طور معمول در محلولهای اسیدی اتفاق میافتد و به همین شکل در محلولهای قلیایی، الکترولیز با «یون هیدروکسید» $$(O H ^ -)$$ همراه است.
در مورادی ـ مانند آب - خود حلال در الکترودها اکسایش یا کاهش مییابد. در برخی شرایط حتی ممکن است برقکافتی شامل گاز داشته باشیم. در این مواقع معمولا از «الکترودهای نفوذ گازی» (Gas Diffusion Electrode) استفاده میشود.
تغییرات انرژی در زمان برقکافت
انرژی الکتریکی که باید به سیستم داده شود عبارتست از تغییرات انرژی آزاد گیبس در واکنش به علاوه هدر رفت انرژی در سیستم:
هدررفت انرژی + تغییرات انرژی آزاد گیبس = انرژی الکتریکی مورد نیاز
در حالت تئوری، انرژی هدر رفته را میتوان صفر در نظر گرفت. بنابراین بیشترین بازده ترمودینامیکی با تقسیم تغییرات آنتالپی بر تغییرات انرژی بدست میآید. در بیشتر موارد، انرژی الکتریکی وارد شده به سیستم، از آنتالپی تغییر واکنش بیشتر است که موجب آزاد شدن انرژی به شکل گرما میشود. در برخی حالات، مثلا در الکترولیز بخار به هیدروژن و اکسیژن که در دمای بالا اتفاق میافتد، به عکس، گرما جذب میشود.
تغییرات ولتاژ
اعمال جریان الکتریکی متفاوت از برق مستقیم موسوم به «جریانهای پالسی» (Pulsating Current) که به جریانهای PDC نیز معروف هستند، سبب تولید فرآوردههایی متفاوت میشوند. به طور مثال، اعمال جریان پالسی در الکترولیز یک محلول اسیدی، نسبت ازن به اکسیژن تولیدی را در آند افزایش میدهد. همچنین الکترولیز اتانول با این روش، موجب تولید آلدهید به جای اسید میشود.
قوانین الکترولیز فارادی
میدانیم که جریان عبوری از یک باتری در مدار خارجی، به طور مستقیم با تعداد الکترونهایی که از الکترود منفی (کاتد) به یونهای فلزی یا کاتیونها منتقل میشوند متناسب است. اگر کاتیونها مانند $$C u ^ { 2 +}$$ دو ظرفیتی باشند، بنابراین برای هر کاتیون، دو الکترون از کاتد به کاتیون منتقل میشود. اگر هر بار الکتریکی شامل $$- 1.602 \times 10 ^ { - 19 }$$ کولن باشد و آن را $$- e$$ بنامیم، بنابراین برای اننقال هر اتم مس به بروی کاتد، میزان $$- 2 e$$ انتقال بار از کاتد به کاتیون مورد نیاز است.
حال برای تشکیل تعداد $$n$$ اتم مس روی کاتد، میزان بار انتقال یافته برابر با $$- 2 n e $$ کولن خواهد بود. جرم $$m$$ از مس تشکیل شده به طور مستقیم با میزان بار الکتریکی گذرنده از الکترولیت متناسب است:
$$m \propto Q$$

قاون اول فارادی
در سال ۱۸۳۲، مایکل فارادی اعلام کرد که مقدار عناصر جدا شده بوسیله عبور جریان الکتریکی از میان نمک ذوب یا حل شده با مقدار بار الکتریکی گذرنده از مدار متناسب است. این مطلب اساس قانون اول الکترولیز بود. جرم مادهای با وزن $$(m)$$ که در الکترود رسوب میکند به طور مستقیم با مقدار بار الکتریکی عبوری $$Q$$ متناسب است که رابطه آن را میتوان به صورت زیر نوشت:
$$m = k \cdot Q$$
در رابطه بالا $$k$$ یک ثابت الکترومکانیکی است. این رابطه را به شکل زیر نیز میتوان نشان داد:
$$m = Z \cdot Q$$
که در این رابطه $$Z$$ اکیوالان الکتروشیمیایی فلز رسوب شده یا گاز آزاد شده در الکترود است. این میزان برابر مقدار جرمی است که توسط یک کولون بار الکتریکی جابجا میشود.
اگر $$Q$$ را برابر با ۱ قرار دهیم خواهیم داشت:
$$m = Z$$
این عبارت بیان میکند که اکیوالان هر ماده برابر با مقدار رسوب شده همان ماده در عبور ۱ کولون بار الکتریکی است.
قانون دوم فارادی
فهمیدیم که جرم عنصر رسوب شده در الکترولیز با مقدار بار الکتریکی گذرنده از الکترولیت متناسب است. این جرم رسوبی با عوامل دیگری نیز تناسب دارد. هر ماده، وزن اتمی مخصوص به خود را دارد. بنابراین با تعداد اتم یکسان، مواد مختلف جرمهای متفاوتی خواهند داشت.
به عبارت دیگر تعداد اتمهایی که بر روی الکترود رسوب میکنند به تعداد ظرفیت آنها وابسته است. هرقدر تعداد ظرفیت بیشتر باشد، تعداد اتمهای تشکیل شده روی الکترودها کمتر خواهند بود و برعکس. بنابراین برای میزان مشخصی از جریان الکتریکی عبوری از الکترولیتهای مختلف، جرم رسوبی به طور مستقیم با عدد اتمی و به طور معکوس با ظرفیت آن اتمها متناسب است. قانون دوم الکترولیز فارادی بیان میکند زمانی که مقدار مشخصی جریان الکتریکی از چندین الکترولیت عبور کند، جرم رسوب شده با وزن اکیوالان (هم ارز) یا «اکیوالان شیمیایی» (Chemical Equivalent) آنها متناسب است.
اکی والان شیمیایی
اکیوالان شیمیایی یا وزن اکیوالان مواد به کمک قوانین الکترولیز فارادی بیان میشود. اکیوالان شیمیایی، وزنی از ماده است که وزن واحد هیدروژن را جابجا میکند یا با آن ترکیب میشود. اکیوالان شیمیایی هیدروژن به صورت واحد یعنی برابر با ۱ است. اکیوالان شیمیایی هر ماده به صورت نسبت وزن اتمی آن به ظرفیت آن ماده تعریف میشود:
ظرفیت / وزن اتمی = اکیوالان شیمیایی
کاربردهای صنعتی برقکافت
برقکافت در صنعت استفادههای متعددی دارد که نمونههایی از آن در زیر آورده شده است:
- کاربرد در الکترو متالورژی: «الکترومتالورژی» (Electrometallurgy) فرآیند کاهش فلزات از ترکیبات فلزی و بدست آوردن آنها به شکل خالص است که از طریق الکترولیز صورت میگیرد. برخی فلزات قلیایی و قلیایی خاکی مانند لیتیوم، سدیم، پتاسیم، منیزیم کلسیم به همراه برخی فلزات دیگر همچون مس و آلومینیوم از این روش بدست میآیند.
- تولید کلر و سدیم هیدروکسید
- تولید «سدیم کلرات» $$N a C l O _ 3 $$ و «پتاسیم کلرات» $$KC l O _ 3 $$
- تولید ترکیبات آلی پرفلوئوری مانند «تری فلوئورو استیک اسید» (Trifluoroacetic acid) با فرمول $$C F _ 3 C O _ 2 H $$
- تولید مس الکترولیتی (مس کاتدی) از مس تصفیه شده با کیفیت پایینتر
- تولید اکسیژن برای فضاپیماها و زیردریاییهای هستهای
- تولید سوخت هیدروژنی
از برقکافت همچنین در تمیز کردن و حفاظت از آثار هنری قدیمی نیز استفاده میشود. به دلیل اینکه این فرآیند موجب جداسازی اجزای غیر فلزی از فلز خواهد بود، از آن در تمیز کردن وسایل فلزی از سکه گرفته تا سرسیلندرهای زنگزده اتوموبیلها بهره میگیرند.
از بین بردن زنگ آهن به سادگی و با ابزارهای خانگی نیز امکانپذیر است. ابزارهای مورد نیاز آن عبارتند از: سطل پلاستیکی، آب، قطعاتی از میلگرد، جوش شیرین، سیم مفتول و شارژ.

رقابت نیمواکنشها در الکترولیز محلولها
در سلولهایی که الکترودهای خنثی از جنس پلاتین دارند، برقکافت محلول آبی برخی نمکها منجر به کاهش کاتیونها و اکسیداسیون آنیونها میشود. البته با نمکهای برخی فلزات مانند سدیم، هیدروژن در کاتد تشکیل میشود و برای نمکهای شامل آنیون مانند «سولفات» $$(S O _ 4 ^ { 2 - })$$، اکسیژن در آند تشکیل میشود. این امر در هر دو حالت به علت کاهش آب برای تشکیل هیدروژن یا اکسیداسیون آن برای تشکیل اکسیژن است.
در حقیقت، ولتاژ مورد نیاز برای برقکافت یک محلول نمکی از طریق «پتاسیل استاندارد الکترود» (Standard Electron Potential) برای واکنش در کاتد و آند بدست میآید. پتانسیل استاندارد الکترود به طور مستقیم با انرژی آزاد گیبس $$(\triangle G )$$ - برای هر واکنش در هر الکترود - متناسب است. پتانسیل استاندارد برای برخی از واکنشها در جدول زیر آورده شده است:
| $$E ^ \circ ( V )$$ | نیم واکنش |
| $$- 2 .71 $$ | $$\mathrm { Na } ^ { + } + \mathrm { e } ^ { - } \rightleftharpoons \mathrm { Na } ( \mathrm { s } )$$ |
| $$- 0 . 7 6 1 8 $$ | $$\mathrm { Zn } ^ { 2 + } + 2 \mathrm { e } ^ { - } \rightleftharpoons \mathrm { Zn } ( s )$$ |
| $$\equiv 0 $$ | $$2 \mathrm { H } ^ { + } + 2 \mathrm { e } ^ { - } \rightleftharpoons \mathrm { H } _ { 2 } ( g )$$ |
| $$+ 1. 0 8 7 3$$ | $$\mathrm { Br } _ { 2 } ( a q ) + 2 e ^ { - } \rightleftharpoons 2 \mathrm { Br } ^ { - }$$ |
| $$+ 1 . 2 3 $$ | $$\mathrm { O } _ { 2 } ( g ) + 4 \mathrm { H } ^ { + } + 4 \mathrm { e } ^ { - } \rightleftharpoons 2 \mathrm { H } _ { 2 } \mathrm { O }$$ |
| $$+ 1 . 3 6 $$ | $$\mathrm { Cl } _ { 2 } ( g ) + 2 e ^ { - } \rightleftharpoons 2 \mathrm { Cl } ^ { - }$$ |
| $$+ 2 . 0 7$$ | $$\mathrm { S } _ { 2 } \mathrm { O } _ { 8 } ^ { 2 - } + 2 \mathrm { e } ^ { - } \rightleftharpoons 2 \mathrm { SO } _ { 4 } ^ { 2 - }$$ |
برای تفسیر جدول بالا میتوان به شکل زیر عمل کرد:
ذراتی اکسید شده (معمولا کاتیونها) که پتانسیل منفیتری دارند، سخت تر کاهش مییابند. به طور مثال، کاهش یون سدیم به فلز سدیم، سختتر از کاهش یون روی به فلز روی است.
ذرات کاهش یافته (معمولا آنیونها) که پتانسیل مثبتتری دارند نسبت به ذرات کاهش یافتهای که پتانسیل کمتری دارند، سختتر اکسید میشوند. به طور مثال، اکسید کردن آنیون سولفات سختتر از اکسیدکردن آنیون برمید است.

عوامل تاثیرگذار بر واکنش برقکافت
عوامل موثر بر واکنش برقکافت را میتوان در موارد زیر دستهبندی کرد:
- ولتاژ زیاد: این امر به معنی اعمال ولتاژ بیش از حد انتظار است و در مواقعی استفاده میشود که به غلبه بر واکنشهایی نیاز داریم که در خود الکترود صورت میگیرد. این مورد بیشتر در گازها کاربرد دارد.
- نوع الکترود: یک الکترود خنثی، به عنوان محلی برای وقوع واکنش عمل میکند و خود در واکنش شرکت نمیکند اما یک الکترود فعال، بخشی از یک نیمواکنش خواهد بود.
- واکنشهای همزمان در الکترود: اگر دو نوع مختلف از نیمواکنشها همزمان اتفاق بیافتند، برخی از نیمواکنشها باید از بین بروند تا جفت نیمواکنش مناسب برای برقکافت مشخص شوند.
- حالت واکنشدهندهها: اگر واکنشدهندهها در حالت استاندارد خود قرار نداشته باشند، مقدار ولتاژ در هر نیم سلول با مقدار استاندارد متفاوت خواهد بود. در این حالت، محلول در بخش آند، pH بیشتر یا کمتر از استاندارد ۴ خواهد داشت که همین امر نیز علت وجود ولتاژ غیراستاندارد است.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی عمومی
- هیدرولیز و کاربردهای آن — به زبان ساده
- ثابت تعادل — از صفر تا صد
^^











سلام وقت بخیر. آیا امکان تهیه پروتئین وی هیدرولیز با کمک شیوه الکترولیز می باشد. در صورت امکان شیوه آن را لطفا راهنمایی بفرمائید
سلام
هیدروژن و اکسیژن پیوند مستحکمی دارند و اکسیژن به کمک برق قدرت خورندگی شدیدی دارد برای تجزیه به جای الکترود مقاوم اگر اهن استفاده کنیم کار در دو مرحله سبک میشه اول اکسید اهن به جدا شدن هیدروژن کمک میکنه و برق کمتری هم مصرف میشه دوم با گرما دادن به اکسید اهن پودر اهن به دست میاد که کاربرد متالوژی داره و هزینه استحلاک الکترود گرانقبمت هم نداریم در واقع الکترود به جای دوام زیاد تبدیل به خوراک میشه و اکسیژن از هیدروژن به اهن میچسبه.
سلام ؛ برای الکترولیز آب ، باید از یک سر اکسیژن و از طرف دیگه هیدروژن جدابشه ،درسته؟؟؟
در الکترولیز طلا از خاک طلا اند وکاتد باید از چه فلزی باشند .ولتاژ وامپر ان چقدر است الکترولیت باید از چه ماده رسانا باشد و ظرفی که این واکنش در ان انجام میشود باید از چه جنسی باشد متشکرم
سلام و روز بخیر و تشکر از مطالب
اگر میشه بفرمایید استفاده از ولتاژ بالا مثال ۲۲۰ ولت مستقیم برای الکترولیز آب تاثیری در محصولات خروجی داره یا نه؟
مثلاً با الکترولیت اسید یا باز
منظورم اینه که باعث تجزیه الکترولیت ها یا تولید اوزون میشه یا نه
سپاسگزار
سلام آقای کاظمی بنده یک ترکیب حاوی پلاتین دارم بنام PtCl6NH4 هگزا کلروپلاتینات آمونیوم که در آب محلول میشود ،میخواستم پلاتین خالص رو با روش الکترو لیز و کاتد و آند ارزان مثلا مس یا استیل یا نیکل انجام بدم،جنس آند و کاتد چه باید باشد .؟آیا عملی است؟
سلام از مطالبی ا نوشتین بسیار سپاس گذارم. ی سوال دارم من میخوام با روش الکترولیز از اهن ضایعات مس استخراج کنم چطور میتونید کمکم کنید. ایا منبعی میشناسید یا کسی رو ک بهم معرفی کنید
با سلام
برای تولید ثانویه مس میتوانید مطلب «عنصر مس و کاربردهای آن — از صفر تا صد» را مطالعه کنید. در میانه مطلب، عنوان «تولید ثانویه» ممکن است به شما کمک کند.
با تشکر از همراهی شما با مجله فرادرس
با حرکت انتخابی یون ها در سلول گالوانی اشنایی دارم و نحوه کار اون رو درک می کنم؛ قوانین فاراده گفته شده توسط شما در این مقاله فقط به رابطۀ بین جرم و بار الکتریکی سخن گفته و چیزی در مورد جریان الکتریکی در درون محلول نگفته.
از نظر شما نحوه جریان الکترون(که میگیم در محلول یونیست) در الکترولیز سدیم کلرید مذاب و در الکترولیز اب یکی است؟
سلام
یک سوال در مورد رساناهای یونی دارم؛ در واقع نحوه عملکرد رساناهای یونی رو دقیق متوجه نمیشم؛ ما در رساناهای الکترونی با یک چرخه حرکت الکترون ها در مدار الکتریکی روبرو هستیم(هرچند کنده)، اما وقتی مدار ما متشکل از یک رسانای یونی(محلول الکترولیت) و یک رسانای الکترونیه(مانند برقکافت آب، الکترولیز سدیم کرید مذاب و …که مداری به این شکل دارند) این چرخه درون محلول چگونه رخ میده؟
آیا درسته که همون ابتدا تمام یون ها به سمت الکترود متناسب با بارشون می روند و بار های مثبت و منفی در همون ابتدا درنزدیکی الکترودها تجمع می کنند و به مرور زمان از اندازۀ کل بارها در طرفین یک محلول الکترولیت کاسته میشه(به دلیل جریان الکترون ها در مدار بیرونی)؟
*****************************************************
و اینکه این درسته که در فرایند الکترولیز هیچ یونی بین دو الکترود جابجا نمیشه، چون جابجایی همون ابتدا که اختلاف پتانسیل اعمال شده اتفاق افتاده؟ اگه اینطوری باشه پس چگونه محلول الکترولیتی که حاوی مقداری یون هست برای الکترولیز اب استفاده میشه؟ چون فقط در این محلول ها درسطح الکترودها این اب است که وارد واکنش اکسایش یا کاهش میشه و اجازه اکسایش یا کاهش رو به یون های دیگه نمیده.(بخش دوم سوالم با توجه به متنی که نوشتید درست نیست، اما اوردم تا بهتر متوجه مشکل من بشید.)
سلام
شما نوشتید هر الکترود، یونهای با بار ناهمنام را به خود جذب میکند. یونهای با بار مثبت، به طرف کاتد و یونهای با بار منفی، به طرف آند حرکت میکنند مگه کاتد قطب مثبت و آند قطب منفی نیست پس بار مثبت به آند و بار منفی به کاتد میره درسته؟
با سلام؛
از شما بابت این سوال مهم سپاسگزاریم. برای پاسخ به این سوال پیشنهاد میکنیم مطلب زیر را مطالعه کنید.
کاتد و آند در شیمی — به زبان ساده
با تشکر از همراهی شما با مجله فرادرس
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. در رابطه با بخش اول سوال پیشنهاد میکنیم مطلب «پل نمکی چیست؟ — به زبان ساده» را مطالعه کنید تا با حرکت انتخابی یونها در محلول آشنا شوید. همچنین، در فرآیند الکترولیز، یونی بین دو الکترود جابجا نمیشود بلکه اعمال ولتاژ الکتریکی و حرکت الکترونها را داریم که البته برای درک نحوه این جابجایی، مطالعه دقیقتر قوانین الکترولیز فارادی پیشنهاد میشود.
با تشکر