واکنش خنثی شدن در شیمی — به زبان ساده
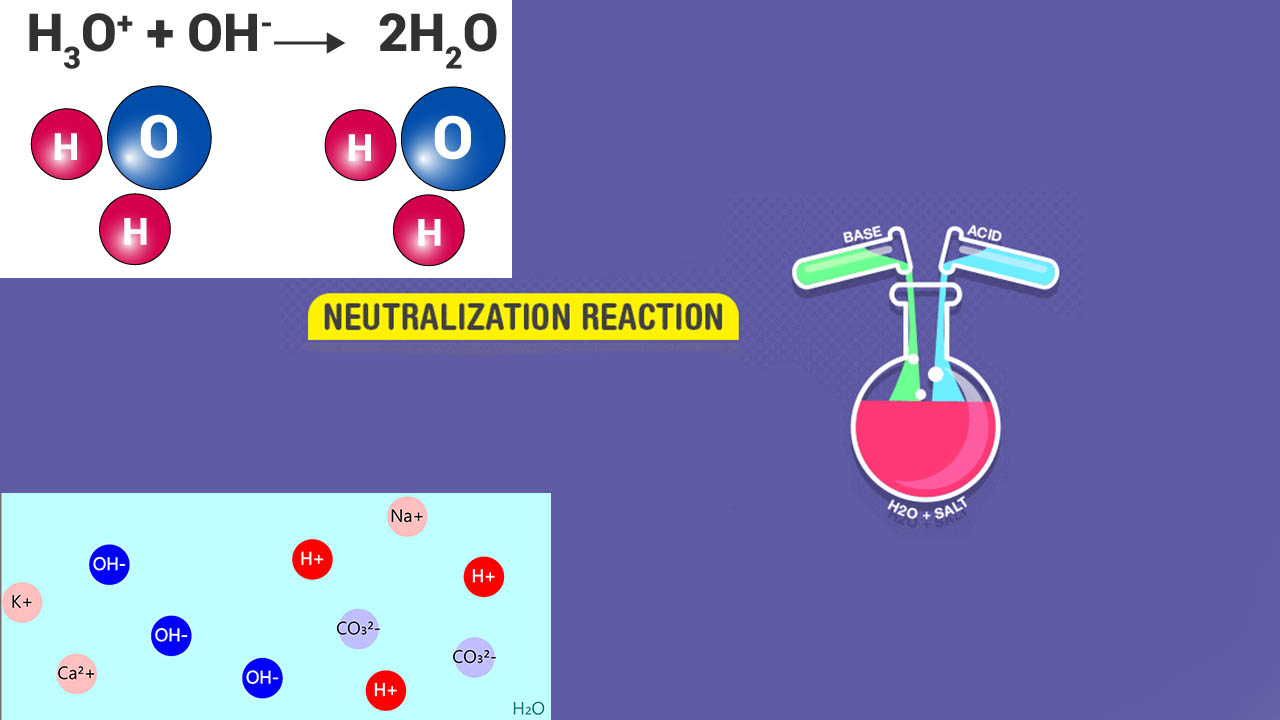
واکنش خنثی شدن یا واکنش خنثی سازی به واکنشی میگویند که در آن، یک اسید و باز با یکدیگر وارد واکنش شوند و آب و نمک به عنوان فرآورده تولید کنند. همچنین، واکنش خنثی شدن شامل ترکیب یونهای $$H ^ +$$ و $$OH ^ -$$ برای تشکیل آب است. واکنش خنثی شدن یک اسید و باز قوی، pH برابر با 7 دارد. اما واکنش خنثی شدن اسید قوی و باز ضعیف، pH کمتر از ۷ را نتیجه میدهد. به همین ترتیب، در واکنش خنثی شدن باز قوی با اسید ضعیف، pH بیش از 7 خواهیم داشت.
زمانی که یک محلول، خنثیسازی میشود به این معنی است که نمکهای تشکیل شده، حاصل وزنهای برابر از اسید و باز هستند. مقدار اسید مورد نیاز، مقداری است که یک مول پروتون $$(H ^ +)$$ بدست دهد. به همین ترتیب، مقدار باز مورد نیاز، یک مول $$OH^ -$$ تولید خواهد کرد. از آنجایی که نمکها، حاصل واکنش خنثی شدن با وزنهای برابر اسید و باز هستند، در نتیجه، N جزء از اسید همواره N جزء از باز را خنثی میکند.
توصیف دقیق واکنش خنثی شدن
همانطور که گفته شد، در شیمی و در واکنشهای شیمیایی، واژه «خنثی شدن» (Neutralization)، برای واکنش بین یک اسید و باز مورد استفاده قرار میگیرد. به طور معمول، واکنش خنثی شدن را به شکل زیر نشان میدهند:
نمک + آب $$\rightarrow$$ اسید + باز
به طور مثال، نمونهای از واکنش خنثی شدن به شکل زیر خواهد بود:
$$N a O H + H C l \rightarrow H _ 2 O + N a Cl $$
از فلش یکطرفه برای نشان دادن واکنش خنثی شدن بهره میگیرند زیرا این نوع از واکنشها به طور کامل انجام میشوند و در حقیقت، واکنش خنثی شدن نوعی واکنش کمی (مقداری) به شمار میآید. تعریف کلی واکنش خنثی شدن را میتوان بر اساس نظریه اسید و باز لوری-برونستد بیان کرد.
$$A H + B → A + B H$$
بارهای الکتریکی در تعریف بالا حذف شدهاند زیرا هرکدام از اجزای واکنش ممکن است بار الکتریکی نداشته باشند. واکنش خنثی شدن سولفوریک اسید نمونهای از این واکنش به شمار میآید. در این مثال، دو واکنش خنثی شدن جزئی انجام میشوند که در انتها، واکنش کلی نیز آورده شده است:
$$\begin{equation} \begin {array} { l }
\mathrm { H } _ { 2 } \mathrm { S O } _ { 4 } +mathrm { O H } ^ { - } \rightarrow \mathrm { H S O } _ { 4} ^ { - } + \mathrm { H } _ { 2 } \mathrm { O } \
\mathrm { H S O} _ { 4 } ^ { - } + \mathrm { O H } ^ { - } \rightarrow \mathrm { S O } _ { 4 } ^ { 2 - } + \mathrm { H } _ { 2 } \mathrm { O } \
\text { Overall\: } \mathrm { H } _ { 2 } \mathrm { S O } _ { 4 } + 2 \mathrm { O H } ^ { - } \rightarrow \mathrm { S O } _ { 4 } ^ { 2 + } + 2 \mathrm { H } _ { 2 } \mathrm { O }
\end {array} \end {equation}$$
بعد از خنثی شدن اسید AH، هیچ مولکولی از اسید (یا یون هیدروژن حاصل از تفکیک) در محلول باقی نخواهد ماند. برای انجام واکنش خنثی شدن، مقدار باز اضافه شده باید با مقدار اولیه اسید برابر باشد. به این مقدار، مقدار اکیوالان (معادل) گویند. در تیتراسیون اسید و باز، نقطه خنثی شدن موسوم به نقطه تعادل است.
طبیعت کمی (مقداری) واکنش خنثی شدن را به صورت غلظتهای اسید و باز بیان میکنند به طوریکه در نقطه تعادل، حاصلضرب حجم اسید در غلظت آن، برابر با حاصلضرب حجم باز در غلظت آن خواهد بود. به طور کلی، برای اسید $$A H _ n$$ با غلظت $$c_1$$ که با باز $$B (OH)_ m$$ در غلظت $$c_2$$ واکنش میدهد، رابطه زیر برقرار خواهد بود:
$$\begin {equation} n v _ { 1 } c _ { 1 } = m v _ { 2 } c _ { 2 } \end{equation}$$
نمونهای از واکنش خنثی شدن باز با اسید در زیر آورده شده است:
$$\begin {equation} \mathrm { B a } (\mathrm { O H } ) _ { 2 } + 2 \mathrm { H } ^ { + } \rightarrow \mathrm { B a } ^ { 2 + } + 2 \mathrm { H } _ { 2 } \mathrm { O } \end {equation}$$
مفهوم خنثی شدن تنها محدود به انجام واکنش به صورت محلول نیست. به طور مثال، واکنش سنگ آهک با اسیدی همچون سولفوریک اسید نیز یک واکنش خنثی شدن به شمار میآید.
$$\begin {equation} [\mathrm { C a } \, \mathrm { M g } ] \mathrm { C O } _ { 3 } (\mathrm{ s } ) + \mathrm { H } _ { 2 } \mathrm { S O } _ { 4 } (\mathrm { a q } ) \rightarrow \left ( \mathrm { C a } ^ { 2 + } \, \mathrm { M g } ^ { 2 + } \right ) ( \mathrm { a q } ) + \mathrm { S O } _ { 4 } ^ { 2 - } ( \mathrm { a q } ) + \mathrm { C O } _ { 2 } ( \mathrm { g } ) + \mathrm { H } _ { 2 } \mathrm { O } \end {equation}$$

واکنش خنثی شدن در اسید و بازهای قوی
یک اسید قوی، به اسیدی میگویند که به طور کامل در محلول آبی تفکیک شود. هیدروکلریک اسید، یک اسید قوی به شمار میآید.
$$\begin {equation} \mathrm { H C l } (\mathrm { a q } ) \rightarrow \mathrm { H } ^ { + } (\mathrm { a q } ) + \mathrm { C l } ^ { - } (\mathrm{ a q } ) \end{equation}$$
به طور مشابه، یک باز قوی به بازی میگویند که در محلول آبی به طور کامل تفکیک شود. به عنوان مثال، سدیم هیدروکسید، نوعی باز قوی است که واکنش تفکیک آنرا در زیر مشاهده میکنید:
$$\begin {equation} \mathrm { N a O H } (\mathrm { a q } ) \rightarrow \mathrm { N a } ^ { + } (\mathrm { a q } ) + \mathrm { O H } ^ { - } (\mathrm { a q } ) \end{equation}$$
بنابراین، زمانی که یک باز قوی با یک اسید قوی وارد واکنش شود، واکنش خنثی شدن را میتوان به شکل زیر نوشت:
$$H^ + + O H ^− → H _2 O$$
به طور مثال، در واکنش بین هیدروکلریک اسید و سدیم هیدروکسید، یونهای سدیم و کلرید، نقشی در واکنش نخواهند داشت. این واکنش با تعریف لوری-برونستد مطابقت میکند زیرا در واقعیت، یون هیدروژن به صورت یون هیدرونیوم $$H _ 3 O ^ +$$ وجود دارد. بنابراین، واکنش خنثی شدن را میتوان به شکل زیر نوشت:
$$\begin {equation} \mathrm { H } _ { 3 } \mathrm { O } ^ { + } + \mathrm { O H } ^ { - } \rightarrow \mathrm { H } _ { 2 } \mathrm { O } + \mathrm { H } _ { 2 } \mathrm { O } \rightarrow 2 \mathrm { H } _ { 2 } \mathrm { O } \end {equation}$$
زمانی که یک اسید قوی توسط یک باز قوی خنثی شود، هیچ یون هیدروژن اضافی در محلول باقی نخواهند ماند. چنین محلولی را خنثی میگویند زیرا خاصیت بازی یا اسیدی ندارد. pH این محلول، مقداری برابر یا نزدیک به 7 خواهد داشت. توجه داشته باشید که مقدار دقیق pH، وابسته به دمای محلول است. همچنین، واکنش خنثی شدن نوعی واکنش گرماگیر به شمار میآید.

واکنش خنثی شدن اسید ضعیف و باز قوی
اسید ضعیف به اسیدی میگویند که به طور کامل در آب تفکیک نشود. به همین دلیل، در اثر انحلال، یک مخلوط تعادلی خواهیم داشت.
$$\begin {equation} \mathrm { A H } + \mathrm { H } _ { 2 } \mathrm { O } \rightleftharpoons \mathrm { H } _ { 3 } \mathrm { O } ^ { + } + \mathrm { A } ^ { - } \end {equation}$$
از نمونههای اسیدهای ضعیف میتوان به استیک اسید اشاره کرد. مقدار pH محلول خنثی شده به عدد 7 نزدیک نیست و این مقدار البته به قدرت تفکیک اسید $$(pK_a)$$ بستگی دارد. مقدار pH را در نقطه پایانی یا نقطه تعادلی در یک تیتراسیون، به سادگی میتوان محاسبه کرد. در نقطه پایانی، اسید به طور کامل خنثی میشود. بنابراین، در این حالت، غلظت تحلیلی یون هیدروژن $$(T_ H)$$ صفر خواهد بود و غلظت باز مزدوج $$(A ^ -)$$، به طور موثری با غلظت تحلیلی اسید برابر خواهد بود. قدرت تفکیک اسید و $$pK_a$$ را به صورت زیر تعریف میکنیم:
$$\begin {equation} \left [\mathrm { A } ^ { - } \right] \left [ \mathrm { H } ^ { +} \right ] = K _ { \mathrm { a } } [\mathrm { H A } ] \; \quad \mathrm { p } K _ {\mathrm { a } } = - \log _ { 1 0 } K _ { \mathrm { a } } \end{equation}$$
به این ترتیب، ثابت خودیونش آب را میتوان به شکل زیر نوشت:
$$\begin {equation} K _ {\mathrm { w } } = \left[\mathrm { H } ^ { + } \right] \left [ \mathrm { O H } ^ { - } \right ] \; \quad \mathrm { p } K _ { \mathrm { w } } = -log _ { 1 0 } K _ {\mathrm { w } } \end{equation}$$
معادله موازنه جرم برای یون هیدروژن نیز به شکل زیر خواهد بود:
$$\begin {equation} T _ {\mathrm { H } } = \left[\mathrm { H } ^ { + } \right ] + K _ {\mathrm { a } } \left [ \mathrm { A } ^ { - } \right] \left [ \mathrm { H } ^ { + } \right ] - \frac { K _ {\mathrm { W } } } {\left [ \mathrm { H } ^ { + } \right] } \end {equation}$$
عبارت $$\frac {K _ w} {H ^ +}$$ برابر با غلظت یون هیدروکسید است. همانطور که گفته شد، در حالت خنثی، $$T_H$$ برابر با صفر خواهد بود. در نتیجه، روابط به شکل زیر تغییر پیدا میکنند:
$$\begin {equation} \begin {aligned}
&\; \left [ \mathrm { H } ^ { + } \right ] + K _ { \mathrm { a } }[ \mathrm { A } ] \left [ \mathrm { H } ^ { + } \right] - \frac { K _ {\mathrm { W } } } { \left [ \mathrm { H } ^ { + } \right] } = 0\
&\; \left [ \mathrm { H } ^ { + } \right ] ^ { 2 } + K _ { \mathrm { a } } T _ { \mathrm { A } } \left [ \mathrm { H } ^ { + } \right ] ^ { 2 } - \mathrm { K } _ {\mathrm { w } } = 0 \
&\; \left [ \mathrm { H } ^ { + } \right ] ^ { 2 } = \frac { K _ { w }} { 1 + K _ { a } T _ { A } } \
&\; \log \left [\mathrm { H } ^ { + } \right ] = \frac { 1 } { 2 } \log K _ {\mathrm{ w } } - \frac { 1 } { 2 } \log \left ( 1 + K _ {\mathrm { a} } T _{ \mathrm{ A } } \right)\
&\; \mathrm { p H } = \frac { 1 } { 2 } \mathrm { p } K _ {\mathrm { W} } - \frac { 1 } { 2} \log \left ( 1 + \frac {T _{ \mathrm { A } } } { K _ { \mathrm { a }}} \right )
\end {aligned} \end{equation}$$
در بسیاری از موارد، عبارت $$1 + \frac{T _ A} {K_a}$$، بسیار بزرگتر از 1 است و به همین دلیل میتوان عدد 1 را در رابطه در نظر نگرفت. در نتیجه، میزان pH با تقریب خوبی برابر با رابطه زیر خواهد بود:
$$\begin {equation} \mathrm { p H } \approx \frac { 1 } { 2 } \left (\mathrm { p } K _ {\mathrm { w } } + \mathrm { p } K _ {\mathrm { a } } - \log T _ {\mathrm { A } } \right ) \end {equation}$$
این رابطه به توضیح موارد زیر میپردازد:
- میزان pH در نقطه پایانی به طور عمده به $$pK_a$$ بستگی دارد.
- مقدار pH همچنی به غلظت اسید $$(T_A)$$ وابسته است.
- pH در نقطه پایانی، با افزایش غلظت اسید، با شیب تندی افزایش پیدا میکند.
زمانی که یک اسید ضعیف را با یک باز قوی تیتر کنیم، در pH بزرگتر از ۷ به نقطه پایانی میرسیم. به همین دلیل در چنین شرایطی، استفاده از معرفی همچون فنول فتالئین توصیه میشود زیرا در رنگ آن در مقادیر زیاد pH تغییر میکند.
واکنش خنثی شدن باز ضعیف و اسید قوی
این شرایط، همانند واکنش اسید ضعیف و باز قوی است.
$$\begin {equation} \mathrm { H } _ { 3 } \mathrm { O } ^ { + } + \mathrm { B } \rightleftharpoons \mathrm { H } _ { 2 } \mathrm { O } + \mathrm { B H } ^ { + } \end {equation}$$
میزان pH محلول خنثی به $$pK_b $$ و $$pK_a $$ مرتبط است. مناسبترین معرف نیز برای این نوع از تیتراسیون، متیل اورانژ ذکر میشود زیرا در مقادیر کم از pH تغییر رنگ میدهد.

واکنش خنثی شدن اسید و باز ضعیف
زمانی که یک اسید ضعیف با مقادیر برابر با یک باز ضعیف وارد واکنش شود، واکنش خنثی شدن به طور کامل انجام نخواهد شد.
$$\begin {equation} \mathrm { A H } + \mathrm { B } \rightleftharpoons \mathrm { A } ^ { - } + \mathrm { B H} ^ { + } \end{equation}$$
غلظت ذرات در واکنش تعادلی به ثابت تعادل بستگی دارند که به شکل زیر، قابل تعریف است:
$$\begin {equation} \left [ \mathrm { A } ^ { - } \right] \left [ \mathrm { B H } ^ { + } \right] = K [\mathrm { A H } ] [ \mathrm { B } ] \end{equation}$$
تعاریف مربوط به $$K_a$$ و $$K_b$$ به شکل زیر خواهند بود:
$$\begin {equation} \begin {array} {\ll}
\mathrm { A } ^ { - } + \mathrm { H } ^ { + } \rightleftharpoons \mathrm { A H } \; &\; [ \mathrm { A H } ] = K _ { \mathrm { a } } \left [ \mathrm { A } ^ { - } \right] \left [ \mathrm { H } ^ { + } \right] \
\mathrm { B } + \mathrm { H } ^ { + } \rightleftharpoons \mathrm { B H} ^ { + } \; &\; \left [ \mathrm { B H } ^ { + } \right ] = K _ {\mathrm { b } } [ \mathrm { B } ] \left [ \mathrm { H } ^ { + } \right ]
\end{array}\end{equation}$$
با بررسی این روابط در مییابیم که $$K = \frac{K _ a} {K _ b}$$ و بنابراین یک اسید یا باز ضعیف، هیچکدام نمیتوانند یکدیگر را به طور کامل خنثی کنند.
کاربردهای واکنش خنثی شدن
در ادامه، به کاربردهای واکنش خنثی شدن خواهیم پرداخت.
تیتراسیون
یکی از کاربردهای واکنش خنثی شدن، تیتراسیون است که بمنطور تعیین غلظتهای مجهول بکار میرود. برای درک بهتر این موضوع، مثالی را مطرح میکنیم.
مثال
غلظت 25 میلیلیتر نمونه HCl را حساب کنید اگر برای رسیدن به نقطه پایانی، 40 میلیلیتر از سدیم هیدروکسید با غلظت 0/450 مولار نیاز داشته باشیم. واکنش خنثی شدن در زیر آورده شده است:
$$\begin {equation} \mathrm { H C l }( \mathrm { a q } ) + \mathrm { N a O H } (\mathrm { a q } ) \rightarrow \mathrm { H } _ { 2 } \mathrm { O } (\mathrm { l } ) + \mathrm { N a C l } ( \mathrm { a q } ) \end {equation}$$
در مرحله اول، تعداد مول سدیم هیدروکسید اضافه شده را محاسبه کنید:
$$\begin {equation} 0 . 450 \frac {\text { moles }} { L } \mathrm { N a O H } \times 0.0400 \mathrm { L } = 0.018 \text { moles } \mathrm { N a O H } \end{equation}$$
از روابط استوکیومتری برای محاسبه تعداد مول $$HCl$$ در آنالیت استفاده میکنیم. در حقیقت، در واکنش موازنهشده بالا، نسبت تعداد مول $$H Cl$$ به $$Na O H $$ به صورت 1 به 1 است.
$$0.018 moles \mathrm { N a O H } \times \frac { 1 \text { mole } \mathrm { H C l } } { 1 \text { mole } \mathrm { N a O H} } = 0.018 moles H C l$$
در نهایت، غلظت مولار $$H Cl$$ در 25 میلیلیتر از نمونه را محاسبه کنید.
$$Molarity \of \mathrm { H C l } = \frac { 0.018 \text { moles } \mathrm { H C l } } { 0.025 \mathrm { L H C l } } = 0.72 Molar H C l$$
تصفیه فاضلاب
در تصفیه فاضلابها، از واکنشهای خنثی شدن استفاده میکنند تا قدرت تخریب فاضلابها به هنگام رهاسازی در طبیعت کاهش پیدا کند. برای کنترل pH از ترکیباتی همچون کلسیم کربنات، کلسیم اکسید، منیزیم هیدروکسید و سدیم بیکربنات با فرمول $$N a H C O _ 3$$ بهره میگیرند. ناگفته نماند که انتخاب ترکیب مورد نظر به نوع فرآیند بستگی دارد.
داروی معده
واکنشهای خنثی شدن اسید و باز کاربردهای بسیاری را شامل میشوند. یکی از معمولترین کاربردها، تولید داروهای ضد اسید است. این داروها بمنظور خنثی کردن شیره معده $$(H Cl )$$ تولید میشوند و در برخی موارد شامل سدیم بیکربنات هستند. واکنش خنثی شدن علاوه بر معده، به هنگام انتقال غذا از معده به روده نیز کاربرد دارد. برای اینکه مواد مغذی از طریق دیوارههای روده جذب شوند، به محیطی قلیایی نیاز داریم. به همین دلیل، پانکراس با تولید ضداسید بیکربنات، این محیط را بوجود میآورد.

کشاورزی
کاربرد دیگر واکنش خنثی شدن، در کودهای کشاورزی و کنترل pH خاک است. کلسیم هیدروکسید یا کلسیم کربنات را به خاک بسیار اسیدی اضافه میکنند تا موجب بهبود رشد گیاه شوند. کودهایی که بمنظور بهبود رشد گیاه تهیه میشوند به کمک خنثیسازی سولفوریک اسید یا نیتریک اسید با گاز آمونیاک به تولید میرسند که در اثر واکنش، آمونیوم سولفات یا آمونیوم نیترات بوجود میآید.
صنعت و محیط زیست
به صورت صنعتی، با سوزاندن زغالسنگ، گاز دیاکسید گوگرد تولید میشود که در ترکیب با بخار آب هوا در نهایت، سولفوریک اسید را تولید میکند. این سولفوریک اسید تولیدی نیز به شکل بارانهای اسیدی، به طور مجدد به خاک برخواهد گشت. برای اینکه از آزاد شدن دیاکسید گوگرد جلوگیری کنند، از برجهای شستشو و جمعآوری گاز، موسوم به «Scrubber» استفاده میکنند. این دستگاه در ابتدا کلسیم کربنات را به محفظه واکنش وارد میکند که در آنجا، کلسیم اکسید و کربندیاکسید تولید میشوند. کلسیم اکسید تولیدی در ادامه با دیاکسید گوگرد حاصل از سوختن زغالسنگ واکنش میدهد تا کلسیم سولفیت $$(Ca C O _ 3)$$ تشکیل و سپس، سوسپانسیونی از کلسیم اکسید را به این مخلوط وارد میکنند تا دوغاب تشکیل شود. این دوغاب، کلسیم سولفیت و هر دیاکسید گوگرد باقیمانده را حذف میکند.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی ۱ و ۲ (مرور و حل مساله)
- محلول بافر — از صفر تا صد
- دیالیز در شیمی — به زبان ساده
- جدول تناوبی — از صفر تا صد
^^











دوستان عزیز سلام
من تو خنثی کردن اسید نیتریک به مشکل برخوردم ساده ترین و کم هزینه ترین راه خنثی سازی رو لطفا بفرمایید
ممنون
سلام خدمت شما اقا سهیل واکنشش NAOH و NH3 چی میشه ؟؟ حالت واکنش چیه ؟؟ با توجه به اینکه دوتا باز هستند ؟؟ ایا ترکیب اونها رو میشه خنثی سازی کرد ؟؟
سلام و روز شما بهخیر؛
دو باز نمیتوانند با یکدیگر وارد واکنش شوند زیرا طبق تعریف لوییس، بازها دهنده الکترون هستند. واکنش زمانی اتفاق میافتد که در محیط یک اسید به عنوان گیرنده الکترون وجود داشته باشد. همچنین خنثیشدن به واکنشی گفته میشود که در آن یک اسید و یک باز حضور داشته باشند.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس
ممنون بسیار عالی بود ممنون میشم سوال بنده را هم بفرمایید .برای بازیافت مخلوط حلالی متشکل از متیلن کلراید و یک اسید و ناخالصی ها مواد را تقطیر میکنم و همچنان بعد از تقطیر حلال شدیدا اسیدی است با اینکه متیلن و حلال انحلال پذیر نیستند و چگالی یکسانی هم ندارند ولی باز از هم جدا نمیشوند کمک میخواستم برای خنثی سازی حلال بازیافت شده ممنون. حجم نیمه صنعتی هست سپاس فراوان
سلام
جهت خنثی سازی یک مخزن 260 متر مکعبی با PH تقریبی12 و رساندنPH آن به عددی بین 5 تا 8 ،چقدر سولفوریک اسید 98% نیازه . ممنونم
باسلام؛
دیکلرومتان یا متیلن کلراید نوعی اسید لوییس به شمار میآید.
با تشکر از همراهی شما با مجله فرادرس
سلام ممنون از مطالب مفیدتون. یه سوال داشتم اگه داخل سوال به ما غلظت و حجم اسید و باز رو بده بعد ph رو بخواد چجوری باید ph بدست بیاریم.
40 میلی لیتر naoh 0.09 مولار را تا 100 میلی لیتر رقیق کرده و سپس به ان 30 میلی لیتر hcl 0.1 مولار اضافه کرده. ph ا محاسبه کنید.
مثل مثال بالا یا بعضی وقتا غلظت رو میده اما حجم نمیده و باز ph رو میخواد.
با سلام؛
برای حل این مسائل باید با تعریف غلظت آشنایی بیشتری داشته باشید. به همین منظور، مطالعه مطالب زیر پیشنهاد میشود:
غلظت محلول ها و واحدهای آنها — به زبان ساده (+ دانلود فیلم آموزش رایگان)
مولاریته چیست؟ — به زبان ساده
نرمالیته چیست؟ — به زبان ساده
با تشکر از همراهی شما بامجله فرادرس
با عرض سلام خدمت شما یه سوال داشتم:
میزان حلالیت اسید ضعیف در باز قوی چگونه تعیین می شود با فرض اینکه مقدار زیادی از اسید ضعیف را به طور ناگهانی وارد باز قوی کنیم؟
با سلام؛
همانطور که در طول متن ذکر شده است، واکنش خنثی شدن به نوع تفکیک اسید ارتباط دارد و در حقیقت این دو ماده در یکدیگر حل نمیشوند بلکه با یکدیگر واکنش میدهند.
با تشکر از همراهی شما با مجله فرادرس
سلام خدمت شما تقدم و تاخر اضافه کردن اسید و باز چطوریه؟اول اسید بعد باز یا اول باز بعد اسید؟چرا؟
سلام خسته نباشید.
ببخشید یه سوال داشتم، برای حل مسائل خنثی شدن اسید و باز،آیا میتونیم تعداد مول یون هیدرونیم در اسید رو برابر با تعداد مول یون هیدروکسید در نظر بگیریم و مسئله رو حل کنیم؟
به نظر من این در مورد اسید و باز قوی درسته ولی در مور اسید ضعیف با باز قوی یا باز ضعیف با اسید قوی و یا اسید ضعیف و باز ضعیف اشتباهه.
ممنون میشم توضیح بفرمایید🙏
سلام و وقت شما بهخیر؛
نکتهای که باید در حل مسائل مربوط به خنثی شدن اسید و باز در نظر داشته باشیم، در نظر گرفتن ضرایب استوکیومتری اسید و باز در واکنش با یکدیگر است. بنابراین برای انجام محاسبات باید تعداد مولهای اسید را با تعداد مولهای باز در نقطه همارزی که خنثی شدن در آن صورت میگیرد با یکدیگر برابر در نظر بگیریم.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
با سلام؛
بسته به نوع واکنش ممکن است متفاوت باشد اما در هر صورت، در اثر واکنش اسید و باز، آب و نمک به تولید میرسند.
با تشکر از همراهی شما با مجله فرادرس
سلام خسته نباشید، ببخشید یه سوال داشتم اگه در یک واکنش در سمت واکنش دهنده منیزیم اکسید باشه که با هیدروکلریک اسید واکنش میده و در سمت فرآورده واکنش منیزیم سولفات و آب رو داشته باشیم، آیا این واکنش رو میتونیم جز واکنش های خنثی سازی اسید و باز به حساب بیاریم یا خیر؟ آیا همه مواد بازی واکنش دهنده باید الزاما تو ساختار خودشون یون ОН منفی داشته باشن به طور مستقیم تا در صورت واکنش با یک اسید اون واکنش رو واکنش خنثی شدن بنامیم یا اینکه اگر یک ماده ای مثل منیزیم اکسید که اگر حلش کنیم تو آب بهمون یون ОН منفی میده تو واکنش دهنده داشته باشیم به همراه یک ماده اسیدی مثل هیدروکلریک اسید، اون واکنش هم جز واکنش های خنثی سازی محسوب میشه؟
با سلام؛
در رابطه با سوال اول باید گفت که در صورت واکنش HCl و منیزیم اکسید، نمیتوان به منیزیم سولفات دست پیدا کرد. در رابطه با سوال دوم نیز پیشنهاد میکنیم مطلب «اسید و باز چیست — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام. متشکر
نوشته اید که وقتی سدیم هیدروکسید رو با هیدروکلریک اسید قاطی می کنیم نمک سدیم کلرید و آب بوجود میاد.
سوالم اینه که پس اون بوی خیلی تندی که هنگام مخلوط کردن هیدروکسید سدیم و کلریدریک اسید بوجود میاد مربوط به چیه؟ باید که این بوی تند مربوط به یک گاز تندی باشه!!
با سلام؛
به طور معمول چنین واکنشهایی باید زیر هود آزمایشگاهی انجام شوند چراکه بخارهای اسیدی بسیار خورنده و خطرناک هستند و این بوی تند نیز ناشی از همین اسید است.
با تشکر از همراهی شما با مجله فرادرس