کاتالیست و واکنش کاتالیستی — به زبان ساده

برای انجام یک واکنش شیمیایی، نیاز به یک مقدار حداقل انرژی به نام انرژی فعالسازی وجود دارد. اگر یک ماده بتواند این مقدار انرژی فعالسازی را کاهش دهد، بدون اینکه خودش در طول واکنش تغییر کند یا مصرف شود، آن ماده را یک «کاتالیست» (catalyst) یا عامل کاتالیستی مینامند. عملی که کاتالیست انجام میدهد، «فروکافت یا کاتالیز» (catalysis) نامیده میشود.
کاتالیست انرژی فعالسازی را از طریق جایگزین نمودن یک مسیر دیگر برای انجام واکنش کاهش میدهد. با انجام این کار، عامل کاتالیستی سرعت انجام واکنش را افزایش داده تا در دمایی کمتر از واکنش غیرکاتالیزی، مسیر واکنش جلو برود. علاوه بر این، اگر یک واکنش داده شده بتواند محصولات متنوعی تولید کند، کاتالیست ممکن است به واکنش نسبت به جهتدهی تولید یک زیر گروه خاص از محصولات کمک کند. به این معنی که اگر تولید یکی از محصولات ارجح باشد، میتوان تولید را برا اساس آن متمرکز کرد.
کاتالیستها نقشی اساسی در سیستمهای بیولوژیکی و فرآیندهای صنعتی ایفا میکنند. در موجودات زنده، «آنزیمها» (enzyme) واکنشهای بیولوژیکی بیشماری را کاتالیز میکنند که باعث زنده ماندن و عملیات تولید مثل و رشد میگردد. در صنعت، کاتالیستها برای یک آرایش گسترده از فرایندهای تولید از جمله تولید آمونیاک، سولفوریک اسید، پلیمرها و جایگزینهای محصولات نفتی مورد استفاده قرار میگیرند.

شاید در کشورهای صنعتی، آشناترین مثال از موارد استفادهی کاتالیستها، استفاده در مبدلهای کاتالیستی باشد. مبدل کاتالیستی دستگاهی است که مواد مضر را در خروجی اگزوز خودرو تجزیه میکند. تحقیقات روی کاتالیز و موارد استفادهی کاتالیستها همچنان کانون توجه بسیاری از محققان علوم تئوری و کاربردی است. در یک مضمون کلیتر، اصطلاح کاتالیست ممکن است برای هر عاملی (شامل یک شخص یا گروه) که سبب تغییرات سریع میگردد، به کار رود. به عنوان مثال، شخصی ممکن است کاتالیزور تغییر سیاسی نامیده شود.
تاریخ و ریشهشناسی
اصطلاح کاتالیز در سال 1835 توسط «یونس یاکوب برسلیوس» (Jöns Jakob Berzelius) شیمیدان سوئدی ابداع شد. او به این موضوع اشاره کرد که برخی از مواد شیمیایی سرعت یک واکنش را افزایش میدهند. این واژه از کلمهی یونانی «κατάλυσις»، برگرفته از فعل «καταλύειν» به معنای «انحلال» (to dissolve, annul, unite, pick up)، استنتاج شده است. تقریبا در همان زمان، شیمیدان «الکساندر میسچرلیچ» (Alexander Mitscherlich) به «contact processes» و «یوهان ولفگانگ دوبراینر» (Johann Wolfgang Döbereiner) به «contact action» اشاره کردند. دوبراینر روی موضوع استفاده از پلاتین به عنوان یک کاتالیست فعالیت نمود و فندکی را اختراع کرد که به وسیلهی حرکت هیدروژن روی یک اسفنج پلاتین روشن میشد. این فندک که چراغ دوبراینر نامیده شد، تبدیل به یک موفقیت تجاری بزرگ در سال 1820 گردید.

فرآیند کاتالیزوری عمومی
یک کاتالیست در یک یا چند مرحله از یک واکنش شرکت میکند؛ اما معمولا یک واکنشدهنده یا محصول در طول واکنش خود به عنوان کاتالیست فعالیت نمیکند. یک استثناء از این قانون، فرآیندی با عنوان «خودکاتالیزی» (autocatalysis) است که در آن محصول واکنش به عنوان یک کاتالیست برای واکنش فعالیت میکند. مادهای که فعالیت یک کاتالیست را مانع شود، «مهار کننده» (Inhibitor) مینامند. همچنین مادهای که سرعت عمل یک کاتالیست را افزایش دهد، «پیشبرنده» (promoter) نامیده میشود.
یک کاتالیست ممکن است با یک یا چند واکنشدهنده برای تشکیل یک ترکیب شیمیایی میانی واکنش دهد. این ترکیب میانی متعاقبا برای تشکیل محصول نهایی، وارد واکنش میگردد. در فرآیند کلی، کاتالیست بعد از انجام وظیفهی خود احیا میگردد. به طور متناوب، کاتالیست ممکن است سطحی را آماده کند که در آن واکنشدهندهها به هم متصل شوند تا راحتتر با یکدیگر تعامل نمایند؛ چراکه واکنش از طریق نزدیک ساختن واکنشدهندهها به هم آسانتر میشود. محصولات پس ا این که تشکیل شدند، از شاخکهای کاتالیست رها میگردند.

طرح واکنش زیر را در نظر بگیرید که در آن C نشاندهندهی کاتالیست، A و B واکنشدهنده و D محصول واکنش A و B است.
$$ A + C → AC (1) $$
$$ B + AC → ABC (2) $$
$$ ABC → CD (3) $$
$$ CD → C + D (4) $$
در واکنشهای ذکر شده، کاتالیست C از طریق واکنش در مرحلهی اول مصرف میگردد؛ اما در مرحلهی چهارم احیا و بازسازی میشود؛ بنابراین میتوان واکنش کلی را به صورت زیر نوشت:
$$ A + B + C → D + C $$
انواع کاتالیستها
کاتالیستها میتوانند «همگن» (homogeneous) یا «ناهمگن» (heterogeneous) باشند. «کاتالیستهای زیستی» (Biological catalysts or biocatalysts) غالبا یک گروه جداگانه در نظر گرفته میشوند. یک کاتالیست ناهمگن دارای فازی متفاوت از واکنشدهندهها است. به عنوان مثال یک کاتالیست جامد قادر است در یک مخلوط واکنش مایع استفاده شود. از طرفی دیگر، یک کاتالیست همگن باید دارای فاز یکسان با واکنشدهندهها باشد. به عنوان نمونه، کاتالیست میتواند در یک مخلوط واکنش مایع حل گردد.
کاتالیستهای ناهمگن
یک مدل ساده از کاتالیز ناهمگن کاتالیستی است که سطحی را مهیا میکند تا واکنشدهندهها (زیرلایهها) به طور موقت جذب شوند. پیوندهای شیمیایی در زیرلایهها به اندازهی کافی ضعیف شده تا پیوندهای جدید تشکیل شوند. همچنان که محصولات تولید میگردند، پیوندشان به کاتالیست نسبتا ضعیف شده و در نتیجه آزاد میگردند. مکانیسمهای ممکن مختلفی برای واکنشها روی سطوح بسته به چگونگی روش جذبش شناخته شدهاند.
برای مثال، «فرآیند هابر» (Haber process) برای تولید آمونیاک از نیتروژن و هیدروژن را در نظر بگیرید. در این حالت، «آهن ریز شده» (divided iron) به عنوان یک کاتالیست ناهمگن عمل میکند. مولکولهای واکنش دهنده (هیدروژن و نیتروژن) به کاتالیست متصل میشوند. این فرآیند اتصال دو اثر دارد:
- مولکولها از حالتی که در فاز گاز باشند، به هم نزدیکتر میگردند.
- پیوندهای درونی آنها ضعیف میشود.
به این ترتیب، کاتالیست این امکان را فراهم میکند که مولکولهای واکنشدهنده سریعتر از حالتی که در فاز گازی شکل باقی مانده بودند، عمل کنند.
کاتالیستهای همگن
در کاتالیز همگن، کاتالیست ممکن است خودش در مرحلهی اولیه از واکنش به محصول دیگری تبدیل شود و در انتهای واکنش احیا گردد. نمونهای از این مورد، تجزیهی ازن توسط رادیکالهای آزاد کلر (اتمهای آزاد کلر) است. رادیکالهای آزاد کلر با تابش اشعهی ماورابنفش روی «کلرو فلوئورو کربن» (chlorofluorocarbons, CFCs) تشکیل میشوند. این رادیکالهای آزاد با ازون واکنش داده و مولکولهای اکسیژن شکل میگیرند. در نهایت رادیکالهای آزاد کلر بازسازی میگردند. برخی از سادهترین واکنشهای این زنجیره در ادامه آورده شده است:
$$ Cl• + O3 → ClO• + O2 $$
$$ ClO• + O3 → Cl• + 2 O2 $$
کاتالیستهای زیستی
در طبیعت، آنزیمها کاتالیستهایی برای واکنشهای زیست شیمیایی هستند که در موجودات زنده رخ میدهند. اکثر آنزیمها پروتئینها هستند اما برخی از آنها که «ریبوزیم» (ribozymes) نامیده شدند، از «اسید ریبونوکلئیکاسید یا آرانآ» (Ribonucleic acid, RNA) ساخته میشوند. برخی از مولکولهای DNA که «deoxyribozymes» نام نهاده شدهاند نیز، فعالیت کاتالیزوری دارند. علاوه بر این، برخی از «پادتن یا آنتی بادیها» (antibody) که معمولا به صورت مصنوعی مهیا میگردند، دارای فعالیت کاتالیزوری هستند و «آبزیمها» (abzymes) خوانده میشوند.
بررسی انرژی واکنش
کاتالیستها از طریق ایجاد یک مکانیسم جایگزین برای پیش بردن یک واکنش شیمیایی عمل میکنند؛ مکانیسمی که انرژی فعالسازی را نسبت به واکنش کاتالیز نشده پایین میآورد. این موضوع بدان معنا است که کاتالیستها مقدار انرژی مورد نیاز برای شروع یک واکنش شیمیایی را کاهش میدهند. همچنین «حالت گذار» (transition state) یا «واسطهی گذار ناپایدار» (unstable transitional intermediate) که توسط واکنش دهندهها طی واکنش کاتالیز شده و واکنش کاتالیز نشده تشکیل میگردند، متفاوت هستند.
حالت گذار نوعی صورتبندی خاص در مسیر یک واکنش شیمیایی است که دارای بیشینه انرژی پتانسیل در آن مسیر واکنش باشد.
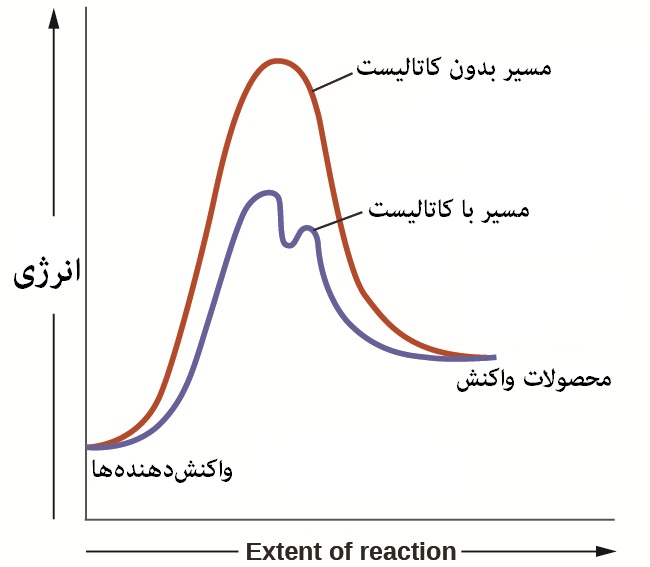
نمودار انرژی ارائه شده در زیر نشان میدهد که مسیر کاتالیز شده (مسیر آبی رنگ) سطح انرژی پایینتری نسبت به مسیر کاتالیز نشده (مسیر قرمز رنگ) دارد. علاوه بر این، از نمودار میتوان پی برد که تغییر خالص انرژی برای واکنش کلی در هر دو صورت (با کاتالیز و بدون کاتالیز) یکسان است؛ بنابراین کاتالیستها قادر به انجام واکنشها در سرعتهای بالا یا به روشهای خاص معین یا در دماهای پایین هستند. همچنین برخی از واکنشها فقط در حضور یک کاتالیست رخ میدهند. باید بدانید کاتالیستها نمیتوانند باعث انجام واکنشهایی شوند که از نظر سطح انرژی مطلوب نیست. این مواد هیچ اثری روی تعادل شیمیایی یک واکنش ندارند، زیرا سرعتهای واکنشهای رفت و برگشت به طور یکسان تحت تاثیر کاتالیست قرار میگیرد.
واحد اندازهگیری فعالیت کاتالیزوری یک کاتالیست در دستگاه SI، «کاتال» (katal) است. کاتال معادل تعداد مول بر ثانیه در نظر گرفته میشود. در بیوشیمی، فعالیت کاتالیزوری یک آنزیم بر حسب واحدهای آنزیم اندازهگیری میگردند. فعالیت یک کاتالیست همچنین میتواند توسط «آهنگ تبدیل کاتالیزگر» (turnover number, TON) تشریح شود.
در «آنزیمولوژی» (enzymology) آهنگ تبدیل کاتالیزگر بر اساس حداکثر تعداد مول از زیرلایه که یک آنزیم میتواند در هر محل کاتالیزوری (از آنزیم) در واحد زمان به محصول تبدیل کند، تعریف میگردد. در بیشتر زمینههای شیمیایی، آهنگ تبدیل کاتالیزگر بر اساس تعداد مولهای زیرلایه که یک مول کاتالیست میتواند قبل از غیر فعال شدن کاتالیست، تبدیل کند، توصیف میشود.
مسمومیت کاتالیست
کاتالیست ممکن است مسموم شود؛ اگر ترکیب دیگری (شبیه به یک بازدارنده) از لحاظ شیمیایی آن را تغییر دهد یا به آن پیوند داده شود یا از آن جدا نشود. چنین تعاملاتی به طور موثر مفید بودن کاتالیست را ضایع میکنند؛ زیرا از این به بعد نمیتوانند در واکنشی که قرار بود کاتالیز شود، شرکت کنند. سموم متداول کاتالیست عبارتند از قلع، سولفور، روی، منگنز و فسفر.
موارد کاربرد
طبق برخی برآوردها، 60 درصد از تمام محصولات شیمیایی تولید شده به صورت تجاری در بعضی از مراحل تولید نیاز به کاتالیست دارند. معمولا مؤثرترین کاتالیستها فلزات واسطه یا کمپلکسهای فلز واسطه هستند. مبدل کاتالیست یک خودرو یک مثال واضح از موارد استفادهی کاتالیستها است. در این دستگاه، «پلاتین» (platinum)، «پالادیوم» (palladium) یا «رودیم» (rhodium) ممکن است به عنوان کاتالیست استفاده شود؛ زیرا این مواد به تجزیهی برخی از محصولات جانبی مضر اگزوز خودرو کمک میکند. یک «مبدل کاتالیستی سه گانه» (three-way catalytic converter) سه وظیفه را انجام میدهد:
- کاهش اکسیدهای نیتروژن به اکسیژن و نیتروژن
$$ 2NOx → xO2 + N2 $$
- اکسیداسیون مونوکسید کربن به دیاکسید کربن
$$ CO + 0.5O2 → CO2 $$
- اکسیداسیون هیدروکربنهای نسوخته و تبدیل آنها به دیاکسید کربن و آب
$$ CxH2x+2 + [(3x+1)/2] O2 → xCO2 + (x+1) H2O $$
مثالهای دیگری از کاتالیستها و کاربرد آنها به شرح زیر است:
- آهن معمولی به عنوان کاتالیست در فرآیند هابر برای سنتز آمونیاک از نیتروژن و هیدروژن، همانگونه که در بالا به آن اشاره شد، استفاده میگردد.
- تولید انبوه یک پلیمر مانند پلیاتیلن یا پلیپروپیلن توسط یک عامل شناخته شده مانند کاتالیست «زیگلر- ناتا» (Ziegler- Natta) که اساس آن ترکیبات «تیتانیوم کلرید» (titanium chloride) و «آلکیل آلومینیوم» (alkyl aluminum) است، کاتالیز میشود.
- «وانادیوم اکسید» (Vanadium(V) oxide, V2O5) کاتالیستی است که برای تولید سولفوریک اسید در غلظتهای بالا با روش شناخته شدهی «فرآیند تماس» (contact process) مورد استفاده قرار میگیرد.
- برای تولید «مارگارین» (margarine) از نیکل استفاده میشود.
- در فرآیند معروف «کراکینگ» (cracking) که تجزیهی مولکولهای هیدروکربنی بزرگ به مولکولهای کوچکتر یا سادهتر است، از «آلومینا» (Alumina) و «سیلیکا» (Silica) به عنوان کاتالیست استفاده میگردد.
- تعدادی از آنزیمها برای تبدیل شیمیایی ترکیبات آلی استفاده میشوند. به این آنزیمها بیوکاتالیست و به عمل انجام شده توسط آنها بیوکاتالیز میگویند.
- الکترودهای یک سلول سوختی با یک کاتالیست مانند پلاتین، پالادیوم یا پودر آهن در مقیاس نانو پوششدهی میگردند.
- فرآیند «فیشر- تروپش» (Fischer-Tropsch) یک واکنش شیمیایی است که در آن کربن مونواکسید و هیدروژن در حضور کاتالیستهای آهن و کبالت به هیدروکربنهای مایع تبدیل میگردند. این فرآیند به طور عمده برای تولید یک جایگزین نفتی ترکیبی برای «روغن روانکار» (lubrication oil) یا سوخت استفاده میشود.
- فرآیند «هیدروژنه کردن» (Hydrogenation) که شامل افزودن هیدروژن به ترکیبات آلی مانند آلکنها (alkenes) یا «آلدئیدها» (aldehyds) است، نیاز به یک کاتالیست از قبیل پلاتین، پالادیوم، رودیوم و «روتنیوم» (ruthenium) دارد.
- تعدادی از واکنشهای شیمیایی توسط اسیدها یا بازها کاتالیز میشوند.
اگر این مطلب برایتان مفید بوده است، آموزشهای زیر را نیز به شما پیشنهاد میکنیم:
- آموزش شیمی عمومی
- مجموعه آموزشهای مهندسی شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- تعریف واکنش شیمیایی -- به زبان ساده
- واکنش اسید و باز -- از صفر تا صد
- باران اسیدی چیست و چگونه محیط زیست را ویران میکند؟
^^










سلام و خسته نباشید
آب و نمک در برخی اتو های کوچک خانگی که از هیچ المنتی استفاده نمیکنند چگونه است. چون بخار بسیار زیادی تولید میکند
با سلام؛
خواهشمندیم سؤال را با جزئیات بیشتری بپرسید تا بتوانیم در صورت اطلاع، پاسخ دهیم.
با تشکر
سلام
آیا می توان آب را هم یک کاتالیزور محسوب کرد که باعث تسریع در فرایند پخت و پز مواد غذایی میشود؟
آب که در انتهای پخت و پز غذا بدون تغییر باقی نمی مونه..
ایول تنها سایتی که کامل و درست توضیخ داده بود فرا درس بود . عالی دمتون گرم