پاتولوژی چیست و چگونه انجام می شود؟ – آسیب شناسی به زبان ساده

بدن انسان و سایر موجودات پرسلولی از مجموعه سلولهایی تشکیل شده است که برای انجام عملکرد مشخص کنار هم قرار میگیرند و بافت را تشکیل میدهند. بافتشناسی یا هیستولوژی علم بررسی ساختارهای بافتی و پاتولوژی یا آسیبشناسی علم بررسی تغییرات ساختاری و این بافتها است. پاتولوژی به پزشکان در تشخیص نوع بیماری کمک فراوانی میکند. در این مطلب از مجله فرادرس توضیح میدهیم پاتولوژی چیست و روشهایی بررسی آسیب بافت در پاتولوژی چیست.
پاتولوژی چیست ؟
واژه پاتولوژی یا آسیبشناسی از ریشه یونانی دو کلمه پاتو (pathos) به معنی تجربه یا درد و لوژی (-logia) به معنی مطالعه گرفته شده است. پاتولوژی شاخهای از علم پزشکی است به اثر بیماریها و آسیبهای فیزیکی بر بافت را بررسی میکند و پاتولوژیست فردی است که تغییرات مولکولی و ساختاری بافت را با استفاده از ابزارهای آزمایشگاهی و روشهای رنگآمیزی بافت زیر میکروسکوپ مشاهده میکند.
این روش کمک بسیاری به تشخیص خوشخیمی تودههای سلولی یا تعیین مرحله رشد آنها میکند. این شاخه از علوم پزشکی را میتوان بر اساس نوع نمونه، اندام درگیر و سیستم فیزیولوژیکی آسیب دیده به انواع مختلف تقسیم کرد. برای مثال سیتولوژی آسیبهای سلولی، هماتولوژی بیماریهای بافت خون، رنال پاتولوژی آسیبهای کلیه و اورال پاتولوژی آسیبهای سیستم دهان و حلق را بررسی میکند.
تفاوت پاتولوژی و هیستولوژی چیست ؟
با توضیح مفهوم پاتولوژی متوجه شدیم شباهت زیادی بین این رشته و هیستولوژی وجود دارد، پس دلیل جدا کردن هیستولوژی از پاتولوژی چیست؟ هیستولوژی یا بافتشناسی علمی که میکروساختارهای سلولی (غشای پلاسمایی، هسته، شبکه اندوپلاسمی، میتوکندری، دستگاه گلژی، پراکسیزوم، وزیکولها، لیزوزوم و سانتریول)، شیوه ارتباط سلولهای یک بافت و شیوه ارتباط بافتهای یک دستگاه (سیستم گردش خون، تنفس، تشکیل و تخلیه ادرار، تولید مثل مردان، تولید مثل زنان، گوارش، غدد اندوکرین، لنفاوی، ایمنی، پوست، حواس ویژه و عصبی) را بررسی میکند.
هیستولوژی و پاتولوژی از روشهای مشابهی برای مطالعه بافت بهره میبرند و تنها تفاوت آنها در نوع نمونه بافتی است. در هیستولوژی بافت سالم و در پاتولوژی تغییرات بافتی (بافت آسیبدیده) بررسی میشود. پیش از این در مطلب بافتشناسی چیست مجله فرادس هیستولوژی و منابع مفید مطالعه آن را کامل توضیح دادهایم.
انواع پاتولوژی چیست ؟
در بخشهای قبلی توضیح دادیم پاتوژی چیست و چه تفاوتی با هیستولوژی دارد. در این بخش انواع پاتولوژی را بررسی میکنیم. پاتولوژی را میتوان به انواع عمومی، آناتومی یا تشریحی، بالینی، مولکولی، خونشناسی و میکروبیولوژی تقسیم کرد. متخصصان تمام این رشتهها نمونههای بافتی آسیبدیده یا مشکوک به آسیب را با روشهای تقریبا مشابه بررسی میکنند.
تفاوت این بخشها در نوع نمونه بافتی، دامنه بررسی آسیب و مکانیسمهای بافتی بررسی شده است. برای مثال در پاتولوژی تشریحی نمونههای بافتی یا اندامهای جدا شده حین جراحی و در پاتولوژی بالینی مایعات بدن بررسی میشود.
پاتولوژی یا آسیب شناسی عمومی
پاتولوژی عمومی مکانیسمهای عمومی سلولها در پاسخ به آسیب و ترمیم بافت را بررسی میکند. نکروز، آپوپتوز، نئوپلازیا، ترمیم بافت، التهاب و مکانیسم سازگاری سلولها با آسیب در این بخش از پاتولوژی بررسی میشود. در ادامه توضیح میدهیم مکانیسم و تغییرات بافت در هر یک از این پاسخهای پاتولوژی چیست.
نکروز
نکروز یکی از انواع مرگ سلولهای یک بافت بر اثر آسیبهای فیزیکی یا فیزیولوژیک است. در این مکانیسم غشای سلول آسیبدیده تجزیه میشود و آنزیمهای آن بیرون میریزد. این آنزیمها خود سلول و سلولهای اطراف آن را از بین میبرند. این شرایط منجر به ایجاد التهاب در بافت آسیبدیده میشود. اگر جراحت یا آسیب شدید نباشد بافت ترمیم میشود. اما اگر جراحت شدید یا طولانیمدت باشد، بخشی از بافت یا کل اندام نکروزه شده و از بین میرود.
کمبود اکسیژن در بافت یا هایپوکسیا، افزایش دمای هوا، توکسینها، جراحت فیزیکی و چرخه لیتیک ویروسها منجر به نکروز بافت میشود. توقف جریان خون به بافتها (ایسکمی) یکی از دلایل اصلی نکروز بافت ماهیچه قلبی است. نکروز با تغییرات بافتی مختلفی همراه است.
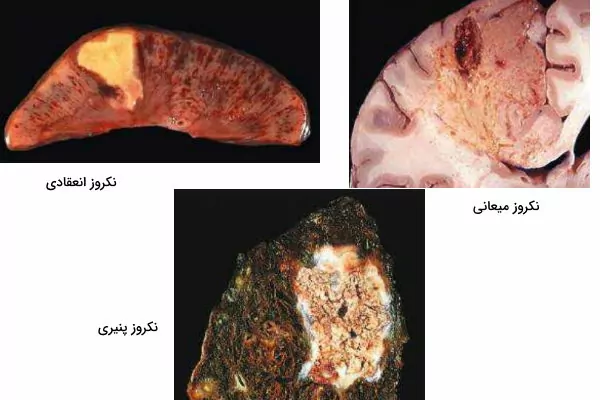
- «نکروز انعقادی» (Coagulative Necrosis): در نکروز انعقادی حداقل چند روز پس از مرگ سلولها ساختار اصلی بافت به هم نمیریزد. در این نکروز آسیب نه تنها پروتئینهای ساختاری بلکه پروتئازهای لیزکننده سلول هم از دناتوره میشوند. در نتیجه سلولهای بدون هسته برای هفتهها در بافت باقی میمانند و در نهایت با فعالیت نوتروفیلها و ماکروفاژهای بافتی از بین میروند. این نکروز بر اثر ایسکمی تمام بافتهای جامد به جز مغز ایجاد میشود.
- «نکروز میعانی» (Liquefactive Necrosis): این نوع نکروز در عفونتهای منطقهای باکتریایی، بعضی قارچها و به دلیل آنزیمهای آزاد شده از لوکوسیتها ایجاد میشود. در این شرایط بافت آسیبدیده کامل از بین رفته و به مایع ویسکوزی تبدیل میشود که بهوسیله فاگوسیتها از بافت خارج میشود.
- «نکروز گانگرن» (Gangrenous Necrosis): نکروز گانگرنی الگوی مجزای مرگ سلولی نیست، اما هنوز در معاینات بالینی از آن استفاده میشود. در این نکروز برای اندامهای حرکتی به ویژه اندامهای تحتانی کاربرد دارد که توقف جریان خون در آنها منجر به نکروز انعقادی چند لایه بافتی شده است. تغییر بافت در نکروز گانگرنی که با عفونت باکتریایی همراه باشد، شبیه نکروز میعانی است و به آن گانگرن خیس میگویند.
- «نکروز پنیری» (Caseous Necrosis): این نکروز معمولا بر اثر عفونت توبرکلوزیس ایجاد میشود و دلیل نامگذاری آن تشکیل بافت سست و زرد در محل مرگ سلولها است. در لامهای میکروسکوپی که با رنگآمیزی هماتوکسین-ائوزین آماده شده، ناحیه نکروز به شکل گرانول نامنظم صورتی دیده میشود. برخلاف نکروز انعقادی در این نکروز سازمانیافتگی سلولها کاملا به هم میریزد و مرز بین آنها قابل تشخیص نیست. به علاوه اطراف ناحیه نکروزی تعداد زیادی ماکروفاژ دیده میشود.
- «نکروز چربی» (Fat necrosis): نکروز چربی به دلیل تجزیه نقطهای بافت چربی ایجاد میشود. دلیل این نکروز معمولا آزاد شدن لیپاز فعال پانکراس (در اثر التهاب حاد پانکراس) در بخشهای مختلف این اندام یا حفره صفاقی (شکمی) است. در این شرایط آنزیمهای پانکراس غشای سلولهای چربی پرده صفاق را تجزیه کرده و لیپاز تریگلسیرید موجود در این سلولها را تجزیه میکند. اسیدهای چرب آزاد شده با یون کلسیم نواحی سفیدی در بافت ایجاد میکنند که در تشخیص آسیب بافت به پاتولوژیستها کمک میکند.
- «نکروز فیبرینوئید» (Fibrinoid necrosis): نکروز فیبرونوئيدی معمولا بر اثر رسوب کپلکسهای آنتیژن-آنتیبادی در دیواره رگها یا بیماری فشار خون بالا ایجاد میشود. این کمپلکسها در لامهایی که با رنگآمیزی هماتوکسین-ائوزین آماده شدهاند به شکل گرانولهای نامنظم صورتی کمرنگ دیده میشوند.
آپوپتوز
آپوپتوز یا مرگ برنامهریزی شده یکی دیگر از روشهای مرگ سلولی است که در شرایط فیزیولوژیک (طبیعی) و پاتولوژیک (آسیب بافتی) ایجاد میشود. اما نقش این نوع مرگ در شرایط پاتولوژی چیست؟
- آپوپتوز فیزیولوژیک: در طول تکامل جنین تعدادی از سلولها به وسیله آپوپتوز از بین میروند و با سلولهای جدید جایگزین میشوند. در فرد بالغ سلولهای پاسخدهنده به هورمون بهوسیله آپوپتوز از بین میروند. در سیستم ایمنی چرخه زندگی لوکوسیتها پس از پایان پاسخ ایمنی بهوسیله آپوپتوز تمام میشود و لوکوسیتهای شناساییکننده سلولهای خودی در مسیر تکامل بهوسیله این فرایند از بین میروند. در این مکانیسم سلولها بدون ایجاد فاکتورهای التهابی از بین میروند.
- آپوپتوز پاتولوژیک: آپوپتوز پاتولوژیک زمانی ایجاد میشود که آسیب سلولی قابل ترمیم نیست. آسیب غیرقابل تصحیح DNA، تغییر ساختار عملکردی پروتئینها و بعضی آلودگیهای ویروسی با القای آپوپتوز و از مرگ سلول همراه است.
آپوپتوز از دو مسیر داخلی و خارجی فعال میشود. مسیر داخلی بهوسیله مجموعهای واکنشها در میتوکندری و مسیر خارجی بهوسیله اتصال فاکتورهای تنظیمی به گیرندههای غشایی منجر به فعال شدن سیستئین پروتئازهای «کاسپاز» (Caspases) میشود. این آنزیم پیوند پپتیدی باقیمانده آسپارتیکاسید با آمینواسیدهای دیگر را هیدرولیز میکند. در نهایت باقیماندههای ایجاد شده از آپوپتوز سلول بهوسیله فاگوسیتها حذف میشود.
- مسیر میتوکندریایی آپوپتوز: بیشتر آپوپتوزهای فیزیولوژیک و پاتولوژیک از این مسیر ایجاد میشود. سیتوکروم C یکی از پروتئینهای غشای میتوکندری است که در زنجیره انتقال الکترون این اندامک شرکت میکند و فعالکننده آنزیم کاسپاز است. افزایش نفوذپذیری غشای میتوکندری با ورود این پروتئین به سیتوپلاسم و شروع واکنشهای آپوپتوزی همراه است. کاهش فاکتورهای رشد، آسیب DNA یا تجمع پروتئینهای غیرعملکردی در سلول منجر به فعال شدن پروتئینهای BH3 میشود. BH3 دیمری شدن پروتئینهای آپوپتوزی Bak و Bax را تحریک میکند. این دیمرها با تشکیل کانال در غشای میتوکندری سبب ورود سیتوکروم c و پروتئینهای دیگر به سیتوپلاسم میشوند. سیتوکروم c با فعال کردن کاسپاز ۹ مسیر آپوپتوزی را تحریک میکند. در نهایت آبشاری از واکنشها در سلول انجام خواهد شد که با قطعهقطعه شدن هسته و تشکیل اجسام آپوپتوزی همراه است.
- مسیر گیرنده آپوپتوزی: در غشای بسیاری از سلولهای بدن گیرندههای پروتئینی وجود دارد که فاکتورهای آپوپتوزی را شناسایی میکنند. این گیرندهها از انواع «گیرندههای فاکتور نکروز تومور» (TNF receptor) با یک توالی محافظتشده سیتوپلاسمی به نام دومین مرگ هستند. گیرنده TNF نوع I و پروتئین Fas یا CD95 یکی از گیرندههای آپوپتوزی است که در غشای لنفوسیتهای T فعال قرار دارد. اتصال Fas به لیگاند سطح سلولهای آلوده به ویروس یا توموری با فعال شدن دومین مرگ، پروتئینهای آداپتور و در نهایت کاسپاز ۸ همراه است. کاسپاز ۸ فعال مثل کاسپاز ۹ آبشاری از واکنشهای درونسلولی را فعال میکند که با قطعهقطعه شدن هسته و تشکیل اجسام آپوپتوزی همراه است.
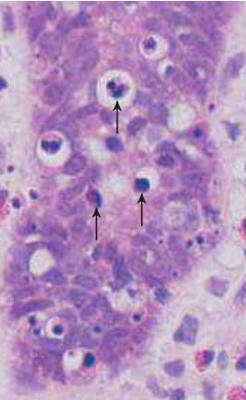
تفاوت نکروز و آپوپتوز
نکروز و آپوپتوز دو مکانیسم مرگ سلولی برای محافظت از بافتها هستند که در پاتولوژی عمومی بررسی میشوند و تفاوتهایی بین آنها وجود دارد.
- نکروز بیشتر در پاسخ به فاکتورهای آسیبزای خارجی (عفونت، سوم و تروما) و آپوپتوز در پاسخ به فاکتورهای آسیبهای داخلی (آسیب یا جهش DNA و تجمع پروتئینهای غیرعملکردی) ایجاد میشود.
- نکروز معمولا پس از التهاب یا همراه آن و کاهش جریان خون به بافت آسیبدیده ایجاد میشود، اما آپوپتوز در اکثر مواقع تغییرات سیستمی به همراه ندارد.
- نکروز نیاز به مداخله درمانی دارد اما آپوپتوز در موراد بسیار نادری نیاز به مداخله درمانی دارد.
التهاب
التهاب اولین پاسخ بدن به آسیب بافتی و یکی از مکانیسمهای ایمنی ذاتی بدن است که برای پیشگیری از آسیب بیشتر انجام میشود. احساس درد، گرم شدن، سرخ شدن، ورم و از دست رفتن عملکرد بافت آسیبدیده علائم ایجاد التهاب بافتهای سطحی است. این واکنش در دو نوع مزمن و حاد از بافتها در برابر آسیب بیشتر محافظت میکند. در ادامه توضیح میدهیم نقش این پاسخ ایمنی در ایجاد تغییرات پاتولوژی چیست.
التهاب حاد
التهاب حاد بین چند دقیقه تا چند ساعت پس از آسیب یا عفونت یکی از بافتها شروع میشود. نوتروفیلها سلولهای ایمنی هستند که نقش اصلی در ایجاد این پاسخ به مولکولهای شیمیایی آزاد شده از بافت آسیبدیده را بر عهده دارند. این پاسخ در سه مرحله انجام میشود. در مرحله اول افزایش قطر مویرگها سبب افزایش جریان خون بافت میشود. با افزایش نفوذپذیری مویرگها (افزایش فاصله بین سلولهای اندوتلیال) پروتئینهای پلاسما و لوکوسیتها از جریان خون خارج خواهند شد. در نهایت لوکوسیتهای تجمعیافته در بافت فعال میشوند و پاتوژنها یا سلولهای آسیبدیده را از بین میبرند.
در شرایط فیزیولوژیک بدن، سرعت جریان خون در مویرگها سبب میشود که گلبولهای قرمز کوچک در مرکز مویرگ و گلبولهای سفید در کنارهها حرکت کنند. اما جریان از اتصال یا رسوب گلبولهای سفید روی دیواره مویرگ جلوگیری میکند. در زمان التهاب که افزایش قطر مویرگ سرعت جریان خون را کاهش میدهد، گلبولهای سفید زمان بیشتری در تماس با دیواره هستند. در شرایط التهاب و در پاسخ به سیتوکینهای آزاد شده از سلولهای آسیبدیده یا سلولهای دندریتی و ماستسلهای مستقر در بافت، پروتئوگلایکان و پروتئینهای غشایی سلکتین (P- و E- سلکتین) و اینتگرین (ICAM-1) غشایی در سلولهای اندوتلیال مویرگ ترشح میشود که با پروتئینهای سطحی نوتروفیلها (اینتگرین و سیالیل) برهمکنش میدهند.
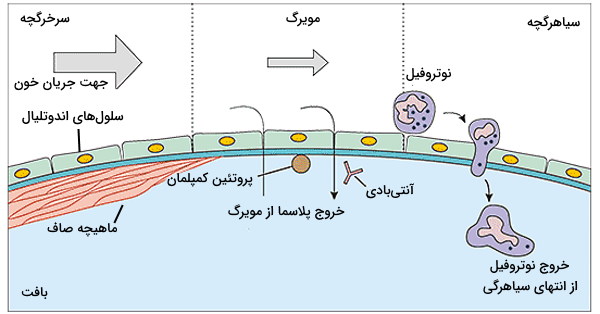
در غشای پلاسمایی نوتروفیلها و مونوسیتها گیرندههای شناساییکننده الگو یا آسیب وجود دارد که مولکولهای مشخصی در غشای پاتوژنها (Pathogen-Associated Molecular Patterns| PAMPs) و سلولهای آسیبدیده (Damage-Associated Molecular Patterns | DAMPs) را شناسایی میکنند. اتصال گیرنده-مولکول سطحی در این سلولها با تغییر غشای گلبول سفید، تشکیل پای کاذب و فاگوسیتوز پاتوژن یا سلول آسیبدیده همراه است. سلول فاگوسیتوز شده بهوسیله آنزیمهای هیدرولازی لیزوزوم یا رادیکالهای آزاد از بین میرود. این روش از گسترش عفونت و آسیب بافتی جلوگیری میکند. البته پیشتر در مجله فرادرس راجع به رادیکال آزاد صحبت کردهایم.
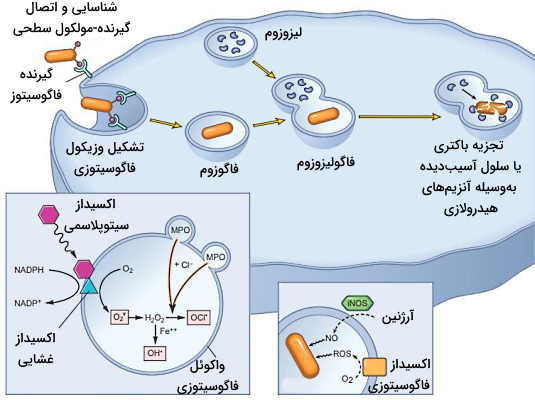
مولکولهای آزاد شده در التهاب حاد ممکن است به بافتهای سالم نیز آسیب برساند. به همین دلیل این مکانیسم دفاعی از بهوسیله چند روش تنظیم میشود. مولکولهای تحریککننده پاسخ التهابی نیمه عمر کوتاهی دارند و معمولا پس از حذف عامل ایجادکننده التهاب از بین میروند. به علاوه طول عمر نوتروفیلها در بافت کوتاه و بین چند ساعت تا حداکثر دو روز است و پس از آن با آپوپتوز از بین میروند.
با پیشرفت التهاب، متابولیت حاصل از تجزیه آراشیدونیک اسید (لیپید غشای پلاسمایی بافت آسیبدیده) از لوکوترین (فاکتور التهابی) به لیپوکسین (فاکتور ضدالتهابی) تغییر میکند. به علاوه تحریک نورونهای کولینرژیک (آزادکننده انتقالدهنده عصبی استیل کولین) با کاهش تولید فاکتور نکروز تومور (TNF) از ماکروفاژ، به پایان پاسخ التهابی کمک میکند.
تغییرات مورفولوژی بافت در التهاب مزمن
افزایش جریان خون در التهاب حاد با تجمع مایع در بافت (ادم)، قرمزی، افزایش دما و تورم بافت همراه است. مولکولهای شیمیایی و پروتئازهای آزاد شده در این فرایند ممکن است فعالیت بافت را به طور موقت متوقف کند. این مولکولها و فشار ایجاد شده به دلیل تجمع سلولهای ایمنی و مایع در بافت منجر به احساس درد میشود.
علاوه بر این تغییرات عمومی مشترک بین تمام بافتهای التهابی، بر اساس دلیل، محل و شدت التهاب تغییرات دیگری در بافت آسیبدیده ایجاد میشود. بر این اساس التهاب حاد را به انواع سروزی، فیبروزی، آبسه و «زخم غشای مخاطی» (Ulcer) تقسیم میکنند.
- التهاب سروزی: نشانه این التهاب مزمن تجمع مایع بدون سلول در شکافهای ایجاد شده بهوسیله جراحت یا حفرههای پوشیده شده با غشاهای سروزی (صفاق، پرده جنب و پریکاردیوم) است. این مایع به دلیل افزایش نفوذپذیری مویرگ و خروج پلاسما یا ترشحات سلولهای مزوتلیال ایجاد شده و به آن «افیوژن» (Effusion) گفته میشود. تاولهای پوستی ایجاد شده در اثر سوختگی پوست یا عفونتهای ویروسی نشانهای از التهاب حاد سروزی در اپیتلیال پوست یا بافتهای زیر آن است.
- التهاب فیبروزی: التهاب فیبروزی در اثر افزایش زیاد نفوذپذیری مویرگ و خروج پروتئینهای با وزن مولکولی زیاد ازجمله فیبرینوژن ایجاد میشود. فیبرینوژن پس از خروج از جریان خون با کمک فاکتورهای انعقادی به فیبرین تبدل شده و در مایع خارج سلولی رسوب میکند. التهاب حاد فیبروزی در لایههای پوششی حفرههای بدن ازجمله مننژ (بافت محافظ مغز)، پریکاردیوم (بافت محافظ قلب) و پرده جنب (اطراف ریهها) ایجاد میشود. اگر فیبرینهای رسوب کرده در مایع میان بافتی بهوسیله ماکروفاژها تجزیه نشود، به مرور زمان با تحریک تجمع فیبروبلاستها و تشکیل رگهای خونی منجر به ایجاد زخم در بافت میشوند.
- آبسه: تشکیل چرک (مجموعهای از نوتروفیلها، بقایای سلولی و مایع میانبافتی) مشخصه اصلی این نوع التهاب مزمن است. عفونت باکتریایی دلیل اصلی این نوع التهاب است و به باکتریهایی که این پاسخ را در بدن فعال میکنند، «پیوژنیک» (Pyogenic) گفته میشود. دیواره آبسهها به مرور زمان از بین میرود و با بافت پیوندی جایگزین میشوند. اما در اندامهای حساس ازجمله مغز یا مواردی که آبسه برای مدت بسیار طولانی در بافت باقیمانده باشد، ممکن است برای برداشت آن از جراحی استفاده شود.
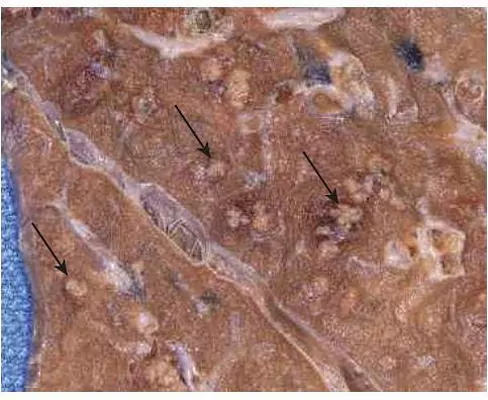
- زخم غشای مخاطی یا آلسر: زخم غشای مخاطی زخم یا تجمع مایع در در یک نقطه از سطح اندام یا بافت است که به دلیل جدا شدن سلولهای بافت نکروزی پس از التهاب ایجاد میشود. ایجاد این التهاب در غشای مخاطی دهان، معده، رودهها، اندامهای تناسلی، پوست و بافت زیرپوستی اندامهای تحتانی افراد سالمند با مشکلات گردش خون، متدوالتر است. زخم معده، روده و دیابتی از این نوع هستند.
التهاب مزمن
التهاب مزمن چند روز پس از آسیب بافتی شروع میشود. مونوسیتها، ماکروفاژها و لنفوسیتها سلولهای ایمنی هستند که نقش اصلی در این پاسخ را بر عهده دارند. در التهاب مزمن آسیب بافتی شدید و در بعضی موارد پیشرونده است. این مکانیسم در پاسخ به عفونتهای مقاوم ازجمله عفومنهای مایکوباکتریا، بعضی ویروسها، قارچها و انگلها، بیماریهای خودایمنی، تماس طولانیمدت با فاکتورهای سمی داخلی (رسوب کلسترول در رگ) یا خارجی (ذرات سیلیکا) یا بیماریهای مزمن دیگر ایجاد میشود و ممکن است تا چند ماه ادامه یابد.
ترمیم بافت
در بخشهای قبلی توضیح دادیم مکانیسمهای عمومی پاتولوژی چیست. اما بدن چگونه این تغییرات را اصلاح میکند. ترمیم بافت یکی از مکانیسمهای بدن برای جلوگیری از آسیب است که بهوسیله سلولهای ایمنی خون و مستقر در بافت انجام میشود. ترمیم بافت با تکثیر سلولهای باقیمانده و تشکیل بافت جدید یا جایگزینی بافت پیوندی به جای بافت از دست رفته انجام میشود.
- بازسازی بافت: توانایی تقسیم و تشکیل سلول های جدید در بعضی بافتهای بدن حفظ شده است. در نتیجه بافت آسیبدیده در این بخشها بهوسیله میتوز سلولها جایگزین میشود. سلولهای اپیتلیال پوست و رودهها، و سلولهای بعضی اندامهای پارانشیمی ازجمله کبد از این روش برای ترمیم بافت آسیبدیده استفاده میکنند. «سلولهای ناپایدار» (Labile Cells) و «پایدار» (Stable Cells) ازجمله سلولهایی هستند که با تقسیم آسیب بافتی را ترمیم میکنند.
- سلولهای ناپایدار: بافت پوششی سنگفرشی در پوست، دهان، واژن و سرویکس، بافت پوششی مکعبی مجاری غدد اگزوکرین بزاق، پانکراس و مجرای صفراوی، بافت پوششی استوانهای در لوله گوارش، مثانه و لولههای فالوپ، و بافت پوششی متغیر در مجاری ادراری از این نوع هستند.
- سلولهای پایدار: این سلولها در مرحله G0 قرار دارند و با تحریک فاکتورهای تنظیمی وارد میتوز میشوند. سلولهای کبدی، کلیه، پانکراس، اندوتلیال، فیبروبلاست و ماهیچههای صاف از این نوع هستند.
- جایگزینی بافت پیوندی: اگر توانایی تقسیم و تشکیل سلولهای جدید در بافت آسیبدیده وجود نداشته باشد یا آسیب بسیار شدید باشد، بافت ازبینرفته بهوسیله بافت پیوندی جایگزین میشود. به این سلولها که بیشترین تمایز در بدن را دارند، «سلولهای ثابت» (Permanent Tissues) گفته میشود. سلولهای ماهیچهای قلب و بیشتر نورونها در این گروه قرار میگیرند. به این فرایند تشکیل زخم یا بافت فیبروزی گفته میشود. بافت پیوندی ایجاد شده سبب پایداری بافت باقیمانده و حفظ فعالیت آن میشود. این فرایند در ریه، کلیه و کبد پس از التهاب مزمن و با رسوب کلاژن در بافت انجام میشود.
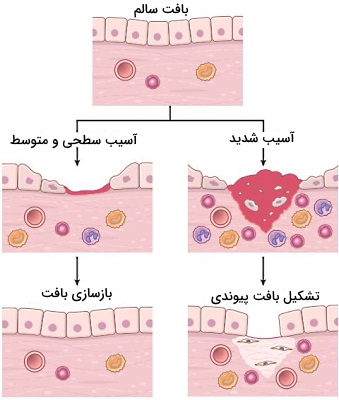
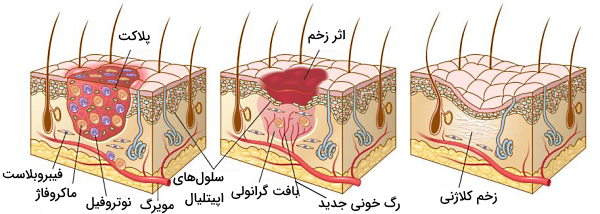
تشکیل زخم
بافت آسیبدیده ممکن است با تشکیل زخم (بافت پیوندی) یا ترکیب تشکیل زخم و تقسیم سلولهای باقیمانده ترمیم شود. زخم در چهار مرحله تشکیل لخته، التهاب، تکثیر سلولی و بازآرایی تشکیل میشود.
- تشکیل لخته: لخته ترکیبی از گلبولهای قرمز، پلاکتها، سلولهای ایمنی است که در داربستی از فیبرین کنار هم قرار دارند و دقایق اولیه پس از ایجاد جراحت تشکیل میشود.
- التهاب: کموکین و سیتوکینهای آزاد شده در التهاب حاد و مزمن، نوتروفیلها و ماکروفاژها را در ۶ تا ۴۸ ساعت پس از ایجاد آسیب به بافت فرا میخواند. ماکروفاژهای M1 با فاگوسیتوز باکتریها و باقیماندههای سلولی، و ماکروفاژ M2 با ترشح فاکتورهای رشد به پیشروی ترمیم بافت کمک میکنند.
- تکثیر سلولی: این مرحله از تشکیل زخم تا ۱۰ روز زمان میبرد. در این مرحله سلولهای اندوتلیال، اپیتلیال و فیبروبلاستها تکثیر میشوند و به اطراف زخم پاکسازی شده بهوسیله ماکروفاژ مهاجرت میکنند.
- سلولهای اپیتلیال در پاسخ به فاکتورهای رشد فعال شده و برای تشکیل پوشش زخم به محل آسیب مهاجرت میکنند.
- از تقسیم سلولهای اندوتلیال و دیگر سلولهای خونی رگهای جدید در فرایند رگزایی یا «آنژیوژنز» (Angiogenesis) تشکیل میشوند.
- مهاجرت، تکثیر و ترشح کلاژن از فیبروبلاستها داربست لازم برای تکثیر سلولها و ترمیم بافت را فراهم میکند.
- بازآرایی: کلاژنهای ترشح شده از فیبروبلاست در ۲ تا ۳ هفته پس از جراحت، زخم را ایجاد میکنند.
مکانیسم های سازگاری سلول با استرس
مکانیسمهای سازگاری مجموعهای از تغییرات برگشتپذیر در اندازه، شکل، عملکرد، تعداد یا متابولیسم سلولها در پاسخ به تغییرات محیطی است. سازگاری فیزیولوژیک معمولا در پاسخ به هورمونها و تغییرات پاتولوژیک در پاسخ به استرسهای محیطی ایجاد میشود. برای مثال بزرگ شدن رحم در دروان بارداری یکی از مکانیسمهای سازگاری فیزیولوژیک و تغییر نوع سلولهای پوششی در مسیرهای تنفسی افراد سیگاری از مکانیسمهای سازگاری پاتولوژیک است. «هایپرتروفی» (Hypertrophy)، «هایپرپلازیا» (Hyperplasia)، «آتروفی» (Atrophy) و «متاپلازیا» (Metaplasia) چهار مکانیسم سازگاری بافتی هستند و در ادامه توضیح میدهیم ویژگیهای بافت در این تغییرات پاتولوژی چیست.
هایپرتروفی
هایپرتروفی فرایند افزایش حجم سلول است که سبب افزایش اندازه اندام میشود. در این سلولها بیان پروتئینهای ساختاری و تعداد اندامکها افزایش مییابد. این مکانیسم به شکل طبیعی و در شرایط پاتولوژیک ایجاد میشود. برای مثال افزایش حجم رحم در بارداری به دلیل آتروفی فیزیولوژیک است که در پاسخ به هورمون استروژن در ماهیچه صاف این اندام ایجاد میشود. افزایش حجم ماهیچههای اسکلتی و ماهیچههای قلبی بر اثر فعالیت بیشتر، یکی دیگر از مثالهای هایپرتروفی فیزیولوژیک است.
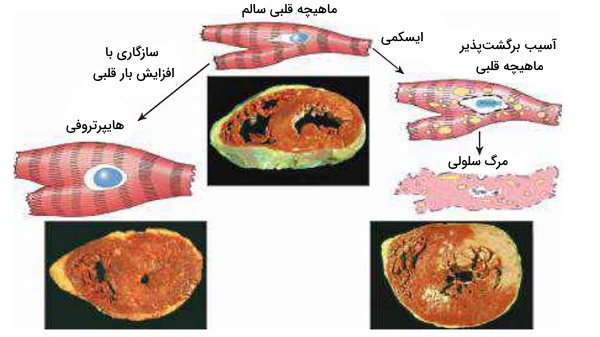
هایپرتروفی قلب بر اثر افزایش فشار خون یا تنگی دریچه آئورت یکی از مثالهای هایپرتوفی پاتولوژیک است. در این شرایط حجم سلولهای ماهیچه قلب برای تامین نیروی انقباضی بیشتر، افزایش مییابد. این سلولها در فرایند تمایز توانایی تقسیم خود را از دست دادهاند. اگر آسیب برای مدت طولانی ادامه پیدا کند، افزایش حجم ماهیچه نمیتواند نیروی انقباضی لازم برای خروج خون از قلب را تامین کند و فیبرهای ماهیچهای یا پروتئینهای انقباضی آن از بین میروند.
هایپرپلازیا
هایپرپلازیا افزایش تعداد سلولهای یک اندام به دلیل تقسیم سلولهای تمایزیافته و در برخی موارد سلولهای کمتر تمایزیافته اجدادی برای سازگاری با استرس ایجاد شده در بافت است. این مکانیسم ممکن است همزمان با آتروفی یا با محرکهای مشترک شروع شود. تقسیم سلولها در این مکانیسم به تحریک فاکتورهای رشد بستگی دارد. هاپرپلازیا در شرایط فیزیولوژیک و پاتولوژیک اندازه اندامها را تغییر میدهد.
- هایپرپلازیا فیزیولوژیک: در این شرایط سلولها در پاسخ به هورمون (رشد پستانها در زمان بلوغ) یا برای جبران بافت از دسترفته (میتوز سلولهای کبدی پس از برداشت قسمتی از آن) تقسیم میشوند.
- هایپرپلازیا پاتولوژیک: در این شرایط افزایش غیرطبیعی هورمونها و فاکتورهای رشد سبب افزایش تقسیم سلولی و هایپرپلازیا میشود. رشد تودههای خوشخیم در پروستات یکی از موارد هایپرپلازیای پاتولوژیک در اثر افزایش ترشح هورمون استروژن است.
آتروفی
آتروفی فرایند کاهش اندازه سلول به دلیل تجزیه ترکیبات سلولی است که منجر به کاهش اندازه اندام میشود. در این شرایط سلول زنده است اما عملکرد آن کاهش مییابد. این سازگاری به دلیل استفاده کمتر از اندام (ساق پاس گچ گرفته شده)، آسیب عصبهای اندام، کاهش جریان خون، اختلال سیستم اندوکرین و افزایش سن ایجاد میشود تا عملکرد حداقلی اندام را حفظ کند. آتروفی به دلیل کاهش سنتز پروتئینهای سلولی و افزایش تجزیه آنها ایجاد میشود.
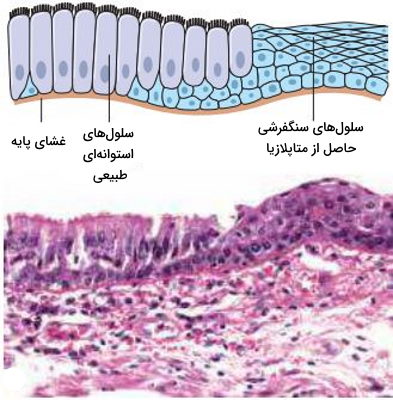
متاپلازیا
در متاپلازیا سلول بالغی که حساسیت بیشتری به استرس دارد با سلول بالغ دیگر جایگزین میشود. تغییر بافت پوششی نای و نایژهها در افراد سیگاری یکی از مثالهای متاپلازیا است. در این افراد سلولهای پوششی مژکدار استوانهای با سلولهای سنگفرشی جایگزین میشوند. مقاومت سلولهای سنگفرشی در برابر مواد سمی دود سیگار بیشتر است. طولانی شدن آسیب و تغییر سلولهای پوششی ممکن است منجر به تشکیل تودههای بدخیم در سیستم تنفسی شود.
پاتولوژی تشریحی چیست ؟
در بخشهای قبلی توضیح دادیم مکانیسمهای عمومی بدن در تغییرات پاتولوژی چیست. در ادامه این مطلب انواع پاتولوژی تشریحی را بررسی میکنیم. متخصصان این رشته نمونههای بافتی جدا شده حین جراحی (بیوپسی) و نمونههای سلولی را بررسی میکنند. پاتولوژیستهای تشریحی با رادیولوژیستها، جراحان و اونکولوژیستها همکاری میکنند. پاتولوژی کالبدشکافی (پزشکی قانونی) بخشی از پاتولوژی آناتومی است.
- پاتولوژی تشریحی بافت: هیستوپاتولوژی یا پاتولوژی تشریحی بافت بدن بررسی میشود. در این روش نمونه بافتی بهوسیله بیوپسی یا جراحی جدا شده و پس از آمادهسازی (تثبیت، قالبگیری، برش و رنگآمیزی) زیر میکروسکوپ مشاهده میشود. پاتولوژیستهای این رشته تغییرات ظاهری بافت و ارتباط بین سلولی را ثبت میکنند.
- پاتولوژی تشریحی سلول: سیتوپاتولوژی یا پاتولوژی تشریحی سلول شاخهای از پاتولوژی است که آسیبهای بدن را در سطح سلولی بررسی میکند. آزمایشهای این رشته به تشخیص سرطان، عفونت، اختلالهای التهابی، زخمهای تیروئید، بیماری حفرههای استریل بدن (صفاق شکم، جنب ریه و مغزی-نخاعی) کمک میکند. پاتولوژیستهای این رشته به جای بررسی بافت کامل (هیستوپاتولوژی) سلولها یا تکههایی از بافت را بررسی میکنند.
- کالبدشکافی: کالبدشکافی بخشی از پاتولوژی است که پس از بررسی جسد، علت مرگ فرد را تشخیص میدهد. کالبد شکاف ابتدا ظاهر جسد را برای پیدا کردن نشانههای آسیبهای فیزیکی (زخم، کبودی یا خفگی) بررسی میکند. سپس برای بررسی آسیب اندامهای داخلی از جراحی استفاده میکند.
پاتولوژی بالینی چیست ؟
پاتولوژی بالینی علاوه بر بافتهای سلولی، مایعات بدن (خون، لنف، مایع مغزی-نخاعی و ادرار) را بهوسیله ابزارها و روشهای شیمی، میکروبیولوژی پزشکی، میکروبیولوژی و مولکولی بررسی میکند. متخصصان این رشته تغییرات تعداد سلولهای خونی، فاکتورهای انعقادی و تغییر الکترولیتهای مایعات بدن را بررسی میکنند. پاتولوژیستهای بالینی در رشتههای میکروبیولوژی، هماتولوژی یا بانک خون آموزش میبینند. اما اطلاعات آنها به اندازه متخصصان هر یک از این رشتهها نیست.
لیست آزمایشات پاتولوژی چیست ؟
تا این بخش متوجه شدیم معنی و انواع پاتولوژی چیست. اما با چه روشهایی میتوان این تغییرات بافتی را بررسی کرد؟ آزمایشات پاتولوژی به دو بخش بررسی مایعات بدن و بافتها (نرم و سخت) تقسیم میشود که روش آمادهسازی نمونه و بررسی متفاوتی دارد. آنالیز خون، ادرار، مایع مغزی نخاعی و مایع آمونیتیک جنین ازجمله آزمایشهای پاتولوژی بالینی هستند. در ادامه این مطلب توضیح میدهیم آزمایشهای متداول پاتولوژی چیست.
آزمایش خون
خون بافت مایع بدن است که وظیفه حمل موادغذایی (گلوکز، کلسترول، اسیدهای چرب و آمینواسیدها)، فاکتورهای تنظیمی (هورمونها و پروتئینهای انعقادی) و گازهای تنفسی (اکسیژن و دیاکسید کربن) را بر عهده دارد. این بافت بستری برای انتقال سلولهای ایمنی به بافتهای آسیبدیده است و الکترولیتهای آن در تنظیم فشار اسمزی بدن نقش دارند. به همین دلیل بررسی غلظت تعداد سلولها، نسبت سلولها به مایع پلاسما، آنزیمها و مولکولهای متابولیک این بافت اطلاعات زیادی در مورد وضعیت سلامت من در اختیار پزشکان قرار میدهد. شمارش سلولهای خونی، آنالیز آنزیمی، هماتوکریت، تست مقاومت گلوکز، تست مقاومت اپینفرین، تستهای ایمونولوژی، تستهای سرولوژی، تست انسولین، تست کدورت تیمول آنالیزهای خونی هستند. این آزمایشها به پزشک در تشخیص اینکه دلیل تغییرات پاتولوژی چیست، کمک میکند.
شمارش سلولهای خونی
شمارش کامل سلولهای خونی یا CBC یکی از آزمایشهای استاندارد آزمایشگاههای آسیبشناسی است. در گزارش این آزمایش تعداد گلبولهای قرمز (RBC)، گلبولهای سفید (WBC)، پلاکتهای خونی (PLT)، درصد هموگلوبین و هماتوکریت (درصد گلبولهای قرمز در حجم کلی خون) و ویژگیهای ظاهری گلبول قرمز مشخص میشود. میانگین اندازه گلبول قرمز (MCV)، میانگین هموگلوبین هر گلبول قرمز (MCH)، تنوع اندازه گلبول قرمز (RDW) و غلظت هموگلوبین در هر گلبول قرمز (MCHC) ویژگیهایی است که بهوسیله این تست مشخص میشود.
افزایش تعداد این سلولها در خون نشانهای از عفونت، التهاب، لوکمیا (تومور سلولهای اجدادی لنفوسیتها)، بیماریهای خودایمنی و کاهش تعداد این سلولها نشانهای از کمخونی یا کاهش تقسیم سلولهای مغز استخوان است. علاوه بر بیماریها و شرایط فیزیولوژیک استفاده از داروهای مختلف ممکن است تعداد این سلولها را تغییر دهد.
آنالیز آنزیمی
آنزیمها مولکولهای کاتالیزی بدن انسان هستند که سرعت انجام واکنشهای بیوشیمایی (برای مثال تولید انرژی از چربی مواد غذایی) را افزایش میدهند. این درشتمولکولهای پروتئینی در سلولها فعالیت میکنند. اما بعضی بیماریها به خروج این پروتئینها از بافت آسیبدیده میشود. در نتیجه اندازهگیری غلظت آنها در خون به تشخیص بیماری کمک میکند. بیش از ۵۰ آنزیم در خون انسان وجود دارد اما آمیلاز، لیپاز، آلکالین فسفات، اسید فسفاتاز، پپتیداز و ترانسآمیناز آنزیمهایی هستند که غلظت آنها در آزمایشهای روتین خون اندازهگیری میشود.
- آمیلاز: آمیلاز تجزیهکننده نشاسته است که در بزاق و شیره پانکراس وجود دارد. افزایش فعالیت این آنزیم در خون نشانهای از مراحل اولیه التهاب حاد پانکراس است.
- لیپازها: لیپازها گروه دیگری از آنزیمهای پانکراس هستند که به گوارش لیپیدها در ل.له گوارش کمک میکنند. افزایش فعالیت سرمی این آنزیمها نشانهای از التهاب حاد پانکراس است.
- آلکالین فسفات: آلکالین فسفات (ALP) آنزیمی است که در بیشتر سلولهای انسان وجود دارد. اما فعالیت اصلی آن در استخوانها و کبد انجام میشود. فعالیت سرمی این آنزیم در التهاب استخوان و کبد، نرمی استخوان و یرقان افزایش مییابد.
- اسید فسفاتاز: محل اصلی فعالیت آنزیم بافت غدد پروستات در افراد بالغ است و فعالیت سرمی آن در متاستازهای پروتستات افزایش مییابد.
- پپتیدازها: پپیندازها آنزیمهای تجزیهکننده پروتئن هستند که فعالیت سرمی آنها به دلیل شوک، تب، آسیبهای فیزیکی بافت، کمخونی ناشی از شکنندگی گلبول قرمز و افزایش تجزیه گلبولهای قرمز افزایش مییابد.
- ترانس آمینازها: گلوتامیک آسپارتات ترانسآمیناز و گلوتامیک آلانین ترانسآمیناز دو ترانسآمیناز مهمی هستند که محل اصلی فعالیت آنها بافت قلب و کبد است. افزایش فعالیت سرمی این آنزیمها نشانه بیماریهای کبدی (هپاتیت) و قلبی (انفارکتوس ماهیچه قلبی) است.
زمان پروترومبین
تست زمان پروتومبین (PT) زمان انعقاد خون در آزمایشگاه را اندازه میگیرد. این تست در افرادی که خونریزی غیرطبیعی دارند یا برای بررسی وضعیت انعقادی خون قبل از انجام عمل جراحی انجام میشود. سرعت انعقاد خون ممکن است به دلیل مصرف داروهای رقیقکننده خون، کمبود ویتامین K، کاهش پروتئینهای انعقادی و مشکلات کبدی کاهش یابد.
تست های سرولوژی
سرم، پلاسمای فاقد فاکتورهای انعقادی است. آزمایشهای سرولوژی به مجموعهای تستهایی گفته میشود که فعالیت آنتیبادیهای تولید شده در پاسخ به بیماریهای مختلف را بررسی میکنند. فولیکولاسیون، خنثیسازی، آگلوتیناسیون، هموآگلوتیناسیون، الایزا (ELISAs) و «ارزیابی ایمنی با روشهای نوردهی شیمیایی» (Chemiluminescence Immunoassays) ازجمله روشهای سرولوژی در آزمایشگاههای پاتولوژی بالینی هستند. تمام این تستها بر اساس برهمکنش آنتیژن با آنتیبادی انجام میشود. برای مثال برای تشخیص ویروس کرونا، آنتیژن این ویروس در آزمایشگاه به نمونه سرم فرد مشکوک اضافه میشود.
پنل متابولیک ابتدایی و جامع
در پنل متابولیک ابتدایی غظت ترکیبات مختلف خون ازجمله سدیم، کلرید، بیکربنات، اوره، گلوکز، پتاسیم، کلسیم و نیتروژن خون اندازهگیری میشود. این آزمایش در تعیین وضعیت الکترولیتها بدن، غلظت گلوکز خون، پایداری مایعات بدن و عملکرد کلیه کمک میکند. در پنل متابولیک جامع (CMP) علاوه بر ترکیبات متابولیک ابتدایی غلظت آلبومین، آنزیمهای کبدی (آلکالین فسفات، آلانین ترانسآمیناز و آسپارتات آمینوترانسفراز)، بیلیروبین (ترکیب حاصل از تجزیه هموگلوبین در کبد)، اوره و کراتین خون اندازهگیری میشود.
پنل لیپیدها
در این آزمایش پاتولوژی غلظت تریگلیسرید و کلسترول (LDL و HDL) خون اندازهگیری میشود. گزارش پاتولوژی این آزمایش به تشخیص خطر ابتلا به بیماریهای قلبی-عروقی کمک میکند. افزایش غلظت LDL (کلسترول بد) و تریگلیسیرید بات رسوب این مولکولها در دیواره رگها، تصلب شریان و افزایش احتمال سکته قلبی همراه است. اما افزایش HDL (کلسترول خوب) به کاهش رسوب کلسترول در رگها کمک میکند.
تست فعالیت کبد
این آزمایش مشخص میکند دلیل تغییرات پاتولوژی کبد چیست و برای بررسی عملکرد آنزیمهای کبدی و احتمال وجود تومور انجام میشود. به کمک این آزمایش میتوان آسیب کبد بر اثر مصرف الکل، کبد چرب و انواع هپاتیت (C و B) را تشخیص داد. در این آزمایش معمولا غلظت آسپارتات آمینوترانسفراز، آلانین آمینوترانسفراز، آلکالین فسفاتاز، بیلیروبین و آلبومین (پروتئین تنظیم فشار اسمزی خون که در کبد سنتز میشود) خون اندازهگیری میشود. اما ممکن است وضعیت پاتولوژیک نیاز به اطلاعات بیشتری داشته باشد و غلظت گاما گلوتامیل ترانسفراز (GGT | آنزیم سنتز آمینواسید)، ۵ نوکلئوتیداز (5’-NT)، پروتئین سرم، زمان پروتروموبین و غلظت لاکتات دهیدروژناز (LDH | آنزیم تولید انرژی از کربوهیدرات) نیز در این آزمایش اندازهگیری شود.
تست فعالیت غده تیروئید
در این آزمایش غلظت هورمونهای تیروئیدی (TSH، T4 و T3) اندازهگیری میشود. افزایش غلظت این هورمونها نشانه پرکاری تیروئید و کاهش غلظت انها نشانه کمکاری غده تیروئید است.
آزمایش ادرار
ادرار ترکیبی از آب، الکترولیتها و متابولیتهای محلول است. بررسی ویژگیهای ظاهری این مایع (رنگ، بو و اسمولاریتی) و تغییر ترکیب آن به تشخیص بیماریهای کلیه، کبد، مثانه و مجاری ادراری کمک میکند.
- بررسی ویژگیهای ظاهری: میزان کدورت، رنگ، میزان کف و بوی ادارار ویژگیهای ظاهری است که پاتولوژیست بالینی بررسی میکند.
- رنگ: رنگ ادرار در شرایط معمول بین زرد کمرنگ تا زرد مایل به قهوهای متغیر است. ادرار ممکن است به دلیل کاهش آب بدن یا افزایش رنگدانههای صفراوی پررنگتر شود. دفع گلبولهای قرمز همراه ادرار رنگ این مایع را به صورتی تغییر میدهد.
- کدورت: دفع باکتری، قارچ، سلولهای خونی و بلورهای کلسیم منجر به افزایش کدورت ادرار میشود.
- بو: کاهش آب بدن، دفع سیستین، دیابت شیرین، عفونت مجاری ادراری، مصرف داروهای مختلف و تغییر رژیم غذایی بوی ادرار را تغییر میدهد.
- اسمولاریتی: اسمولاریتی ادرار ظرفیت کلیه برای تغییر غلظت این مایع را نشان میدهد. کاهش آب بدن، از کار افتادن کبد، کاهش جریان خون کلیه و افزایش تعریق با افزایش اسمولالیته ادرار و نکروز حاد بافت نفرون، افزایش کلسیم خون، کاهش پتاسیم خون، التهاب نفرون و دیابت بیمزه با کاهش اسمولاریتی ادرار همراه است.
- بررسی میکروسکوپی: در بررسی میکروسکوپی وجود باکتری، انگل یا قارچ، سلولهای خونی، ذرات اضافه، بلور و اسپرم در ادرار بررسی میشود.
- بررسی ترکیب شیمیایی: غلظت بیلیروبین، گلوکز، آنزیمها، کتون، نیترات، پروتئین و pH ادرار در این بخش از آزمایش ادرار اندازهگیری میشود. بیلیروبین و نیترات در ادرار فرد سالم وجود ندارد و وجود آن نشانه بیماری است.
آزمایش مایع مغزی نخاعی
مایع مغزی-نخاعی (CSF) مایعی شفاف است که در اطراف مغز و نخاع قرار دارد. وظیفه این مایع محافظت از مغز و نخاع، تامین مواد غذایی و انتقال گازهای تنفسی است. آزمایش مایع مغزی-نخاعی به تشخیص عفونتهای دستگاه عصبی (مننژیت)، تومورهای سیستم عصبی مرکزی یا متاستاز، بیماریهای خودایمنی سیستم عصبی مرکزی و بیماریهای تحلیل مغز (آلزایمر) کمک میکند.
آزمایش مایع آمونیتیک
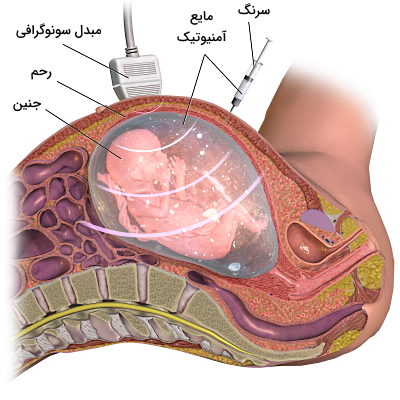
«آزمایش مایع آمونیتیک» (Amniocentesis) یکی از آزمایشهای زمان بارداری است که بهوسیله آن میتوان اختلالهای ژنتیکی و عفونت احتمالی جنین را تشخیص داد. به علاوه از این روش برای بررسی تکامل ریه قبل از تولد استفاده میشود. این آزمایش پاتولوژی در آزمایشگاههای ژنتیک و توسط متخصصان این رشته انجام میشود. در این آزمایش سوزن باریک و بلندی وارد ناحیه شکمی میشود و با عبور از غشای آمونیون بخشی از مایع اطراف جنین را خارج میکند. از سلولهای جنینی موجود در این مایع برای بررسی ژنهای جنین و تشکیل کاریوتیپ بهره برده میشود.
نمونه برداری پاتولوژی چیست ؟
در بخش قبلی آزمایشات پاتولوژی را بررسی کردیم و اما روش نمونهبرداری برای انجام این آزمایشات پاتولوژی چیست؟ روشهای نمونهبرداری اساس نوع آزمایشات متفاوت است. بیوپسی و اتوپسی دو روش نمونهبرداری است که در تهیه نمونههای پاتولوژی تشریحی کاربرد دارد. نمونههای پاتولوژی بالینی با استفاده از روش خونگیری و بیوپسی مایع تهیه میشود.
انواع بیوپسی پاتولوژی چیست ؟
بیوپسی یکی از روشهای متدوال برای تشخیص پاتولوژی سرطانها است. این روش نمونهبرداری به انواع بیوپسی سوزنی، بیوپسی اندوسکوپی، بیوپسی پوستی، بیوپسی مغز استخوان و بیوپسی جراحی تقسیم میشود.
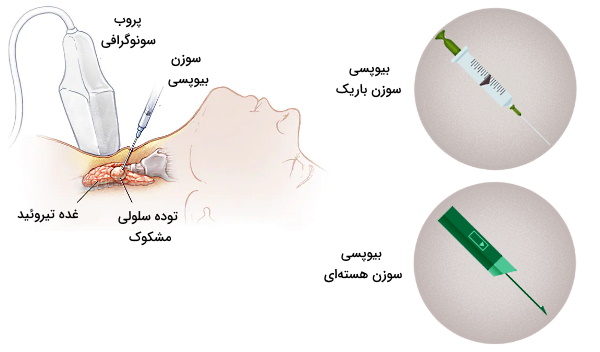
- بیوپسی سوزنی: در این روش از سرنگ و سوزنهای مختلف برای جدا کردن سلولهای بافت مشکوک به آسیب یا مایعات بدن استفاده میشود. برای کاهش درد بیمار در این روش از بیحسی موضعی بهره برده میشود. بیوپسی سوزن باریک، هستهای، همراه مکش و همراه تصویربرداری انواع بیوپسی سوزنی است.
- بیوپسی سوزن باریک: در این روش سوزن باریک و بلندی وارد بافت شده و سلولها و مایعات بدن به کمک سرنگ بیرون کشیده میشود.
- بیوپسی سوزنی هستهای: در این روش از سوزن بزرگی با سر برنده وارد بافت شده و چند لایه بافتی از بدن جدا میشود.
- بیوپسی همراه مکش: در این روش از کمک یک دستگاه ساکشن برای خارج کردن سلولها و مایعات بدن استفاده میشود. در نتیجه تعداد دفعات ورود سوزن به بدن کاهش مییابد.
- بیوپسی همراه تصویربرداری: در این روش از یک سیستم تصویربرداری ازجمله سیتی اسکن، MRI یا سونوگرافی برای بیوپسی سوزنی دقیقتر استفاده میشود. این روش برای نمونهبرداری از اندامهای داخلی (کبد، ریه، کلیه یا پروستات) کاربرد بیشتری دارد.
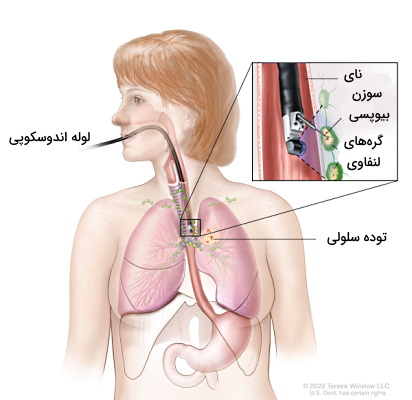
- بیوپسی اندوسکوپی: در این روش لوله باریک و انعطافپذیری از راه دهان، بینی، رکتوم، مجاری اداری یا برش کوچی روی پوست وارد اندامهای داخلی بدن میشود. از این روش میتوان برای تصویربرداری یا نمونهبرداری اندامها استفاده کرد. برای نمونهبرداری اندوسکوپی علاوه بر چراغ، قیچی یا سوزن کوچکی سر لوله باریک قرار دارد که بهوسیله آن میتوان بخشی از بافت مشکوک به آسیب در اندامهای داخلی را جدا کرد. نمونهبرداری اندوسکوپی از ریهها برونکوسکوپی، از مثانه سیستوسکوپی و از کولون کولونوسکوپی نام دراد.
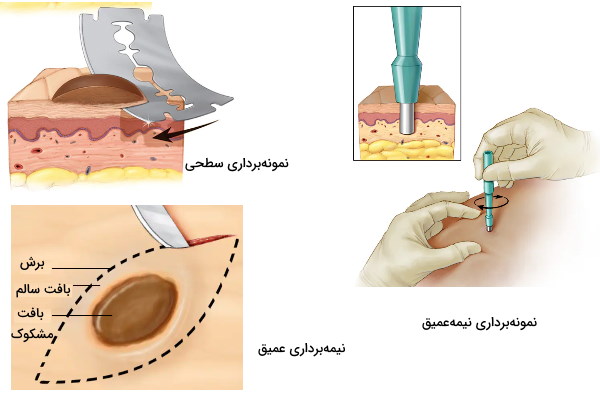
- بیوپسی پوستی: این روش نمونهبردایر برای جدا کردن بافت پوست در بخشهای مختلف بدن استفاده میشود. بر اساس نوع و عمق آسیب از بیوپسی سطحی، پانچ و برشی برای جدا کردن بافت بهره برده میشود.
- سطحی: در این روش از یک تیغ برای جدا کردن سلولهای خارجیترین لایه پپوست (اپیدرم و درم) استفاده میشود و پس از پایان نمونهبرداری به بخیه زدن پوست نیازی نیست.
- پانچ: در نمونهبرداری بهوسیله پانچ یا نمونهبرداری نیمهعمیق از ابزاری با تیغه برنده استوانهای برای جدا کردن لایههای عمیقتر پوست (اپیدرم، درم و بخشهای بالایی بافت چربی) استفاده میشود و معمولا پس از پایان نمونهبرداری نیازی به بخیه پوست نیست.
- برشی: در نمونهبرداری برشی یا عمیق از تیغ جراحی برای جدا کردن کامل توده سلولی یا بخشی از پوست استفاده میشود و پس از پایان نمونهبرداری برای بستن برش به جای مانده پوست به بخیه نیاز دارد.
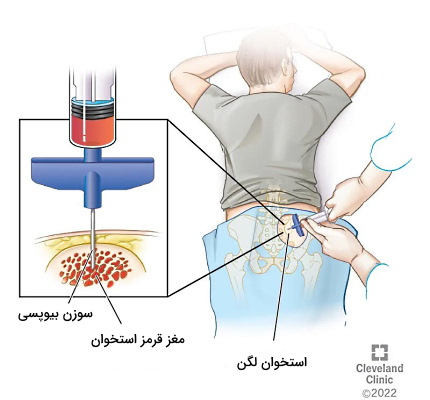
- بیوپسی مغز استخوان: این روش نمونهبرداری معمولا برای بررسی پاتولوژی بیماریهای خونی تغییردهنده تعداد یا شکل سلولهای خونی کاربرد دارد. در این روش از بیحسی موضعی و یک سوزن بلند برای خارج کردن سلولهای مغز استخوان از بدن (در بیشتر موارد استخوان لگن) استفاده میشود.
- جراحی: از این روش نمونهبرداری زمانی استفاده میشود که محل آسیب بافتی است که برای جدا کردن آن نمیتوان از روشهای قبلی استفاده کرد یا نمونه تهیه شده بهوسیله روشهای قبلی کیفیت تشخیصی لازم را ندارد. در جراحی ممکن است بخشی از بافت مشکوک یا تمام ان از بدن خارج شود. برای مثال خارج کردن تودههای پستانی برای بررسی خوشخیم یا بدخیم بودن آن بهوسیله جراحی انجام میشود.
بیوپسی مایع
بیوپسی مایع یکی از روشهای کمتر تهاجمی تهیه نمونه برای بررسی احتمال سرطان و تودههای بدخیم در بدن است. در این روش از خون، پلاسما یا سرم برای بررسی DNA آزاد گردش خون (cfDNA)، RNهای کوچک گردش خون، سلولهای توموری در گردش (CTCs) و وزیکولهای خارج سلولی حاوی RNA کوچک، mRNA و DNA (اگزوزومها) استفاده میشود.
اوتوپسی
اوتوپسی روش تهیه نمونه در کالبدشکافی است. در این روش علت و شیوه مرگ (طبیعی یا غیرطبیعی) در دو مرحله مشخص میشود. با این روش میتوان زمان و مرگ فرد را مشخص کرد.
- مرحله اول بررسی شواهد ظاهری جسد ازجمله جای کبودی، خراش و هر گونه آسیب خارجی است. در این مرحله ممکن است از اشعه UV برای بررسی جسد استفاده و نمونه پوست، مو یا ناخن برای آزمایش DNA یا تغییر مواد شیمیایی جدا شود. گزراش پاتولوژی یا کالبد شکافی در این بخش شامل تمام ویژگیهای ظاهری قابل تشخیص در جسد ازجمله رنگ مو و چشمها، اثر زخم، تاتو، خال و ماهگرفتگی میشود.
- در مرحله دوم با انجام جراحی آسیبهای اندامها و خونریزی داخلی بررسی میشود.
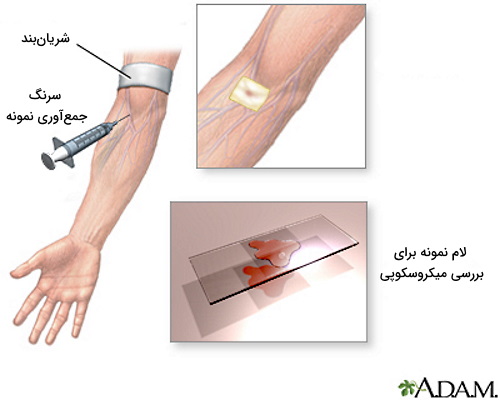
خونگیری
خونگیری یکی از روش تهیه نمونه پاتولوژی بالینی است که در آن از شریانبند، سرنگ و سوزنی باریک برای خارج کردن خون از سیاهرگها میانی زندی (داخل آرنج) یا روی دست استفاده میشود. خونگیری بر اساس سن بیمار، نوع آزمایش پاتولوژی و وسایل موجود با پروتکلهای متفاوتی انجام میشود. به علاوه بر اساس نوع آزمایش ترکیباتی به لولههای آزمایش نمونه خون اضافه میشود.
- در نمونهبرداریهای خون که به تمام اجزای خون برای انجام آزمایش نیاز است، از لوله آزمایش آغشته به ماده ضدانعقاد ETDA استفاده میشود. این ماده با یونهای کلسیم کمپلکس تشکیل داده و بدون ایجاد تغییر در مورفولوژی سلولهای خونی، واکنشهای انعقادی را مهار میکند.
- سدیم سیترات یکی دیگر از ترکیبات ضدانعقاد است که در خونگیری تستهای انعقادی استفاده میشود.
- لولههای حاوی سدیم هپارین یا لیتیوم هپارین برای تهیه نمونههای خونی که نیاز به انعقاد ندارد و بلافاصله پس از نمونهبرداری سانتریفیوژ میشود کاربرد دارند.
- از ترکیب سدیم فلوئورید و پتاسیم اگزالات برای تست گلوکز خون استفاده میشود. این ترکیبات انعقاد خون و گلیکولیز را مهار میکنند. در نتیجه غلظت گلوکز خون در زمان خونگیری ثابت باقیمیماند.
- برای آزمایش ترکیبات حساس به نور از لولههای غیرشفاف برای تهیه نمونه خون استفاده میشود. تعیین غلظت بیلیروبین در خون یکی از آزمایشهایی است که به این لوله نیاز دارد.
- برای انجام بسیاری از آزمایشهای ایمونولوژی و سرولوژی به تهیه نمونه سرم (پلاسمای فاقد سلولهای خونی) نیاز است. در تهیه این نمونهها از لولههای ساده (بدون ترکیب افزودنی) یا لولههای حاوی یک ماده انعقادی (برای جدا کردن سرم از سلولها) استفاده میشود.
پاتولوژی سرطان چیست ؟
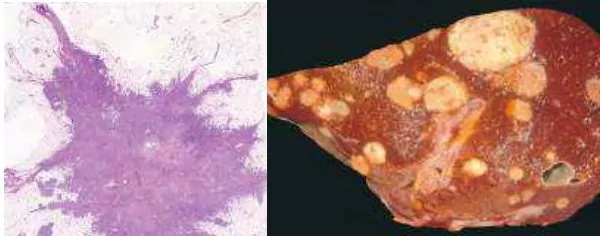
نئوپلازیا یا سرطان به معنی رشد کنترلنشده و غیرطبیعی سلولها یا بافتهای بدن است. به توده سلولی تشکیل شده در پایان این فرایند نئوپلاسم یا تومور گفته میشود. اما دلیل این تغییرات پاتولوژی چیست؟ این بیماری به دلیل جهش در ژنهای کنترل چرخه سلولی ایجاد شده و ممکن است به نسلهای بعدی منتقل میشود. این توده ممکن است «خوشخیم» (Benign Tumors) یا «بدخیم» (Malignant Tumors) باشد.
- تومورهای خوشخیم: تومورهای خوشخیم معمولا با اضافه شدن پسوند -oma به انتهای نام انگلیسی بافتی که در آن تشکیل میشوند، نام گذاری میشوند. برای مثال فیبروما به تودههای خوشخیم بافت فیبروزی و لیپوما به تودههای خوشخیم بافت چربی گفته میشود. این تودههای سلولی دبافت اولیه باقی میماند و عملکرد بخشهای دیگر بدن را مختل نمیکنند. تومورهای خوشخیم را میتوان با جراحی موضعی از بدن خارج کرد.
- تومورهای بدخیم: این تومورها به بافتهای اطراف آسیب میرسانند و با انتقال به اندامهای دیگر (متاستاز) عملکرد بخشهای مختلف بدن را مختل میکنند. به تومورهای بدخیمی که در بافتهای جامد بدن تشکیل میشوند سارکوما و به تورموهایی که در سلولهای مزانشیمی خون تشکیل میشوند، لوکمیا یا لیمفوما (لنفوم) گفته میشود. برای مثال توده بدخیمی که در سلولهای چربی تشکیل میشود لیپوسارکوما و توده بدخیمی که در بافت غضروفی تشکیل میشود کندروسارکوما نام دارد. به علاوه تومورهای بافت پوششی در تمام اندامهای بدن کارسینوما نام دارد. تومورهای کارسینوما به دو دسته آدنوکارسینوما (سلولهای شبیه غدد) و کارسینومای سلول سنگفرشی تقسیم میشوند.
آناپلازیا و تمایز، تهاجم به بافتهای اطراف و متاستاز سه ویژگی تمایزی بین تومورهای خوشخیم و بدخیم است. بروز یکی از این ویژگیها برای بدخیمی تومور کافی است.
- تمایز و آناپلازیا: تمایز نئوپلاسم به این معنی است که سلولهای توده ایجاد شده شکل و عملکرد یکسانی با بافت اولیه دارند. اما آناپلازیای نئوپلاسم به معنی تشکیل توده سلولی متفاوت از بافت اولیه است. به طور کلی تومورهای خوشخیم از سلولهایی تمایزیافته و مشابه بافت اولیه تشکیل شدهاند. اما تومورهای بدخیم را سلولهایی با مورفولوژی و عملکرد کاملا متفاوت تشکیل میدهند.
- تهاجم به بافت اطراف: رشد تومورهای بدخیم (سرطان) با تهاجم به بافت اطراف توده و از بین رفتن این بافتها همراه است. به همین دلیل تومروهای سرطانی حاشیه مشخصی با سلولهای اطراف ندارند و این وضعیت جراحی برداشت تومور را دشوار میکند. اما تومورهای خوشخیم معمولا تودههایی هستند که در بافت اولیه باقی میمانند و اطراف بسیاری از آنها کپسولی از بافت فیبروزی و ماتریکس خارج سلولی قرار دارد.
- متاستاز: در متاستاز سلولهای توموری از راه لنف، خون یا حفرههای بدن به بافتهای کاملا مجزا از بافت اولیه منتقل میشوند. لوکیما و لیموفوما از جمله سرطانهایی هستند که احتمال متاستاز آنها بسییار زیاد است.
آماده سازی نمونه های پاتولوژی چیست ؟
بیوپسی مهمترین روش نمونهبرداری پاتولوژی تشریحی است. اما روش آمداسازی نمونه در آزمایشگاه پاتولوژی چیست؟ در آزمایشگاههای پاتولوژی تشریحی ابتدا نمونه در فرمالین ۱۰٪ (محلول بیرنگ فرمالدهید در آب) تثبیت میشود. نسبت بهینه فرمالین به نمونه بافتی حداقل ۱۰ به ۱ (برای مثال ۱۰ میلیلیتر فرمالین برای هر ۱ سانتیمتر مکعب از بافت) است. این مرحله بین ۲۴ تا ۴۸ ساعت زمان میبرد. این مرحله به حفظ ساختار نمونه جدا شدن از بدن در مراحل مطالعه کمک و از تجزیه ساختارهای سلولی بهوسیله آنزیمهای خودی جلوگیری میکند. در مرحله بعد، ظاهر نمونه بررسی و سپس بخشی از بافت که شکلی متفاوت و غیرطبیعی دارد، برای بررسیهای میکروسکوپی جدا میشود.
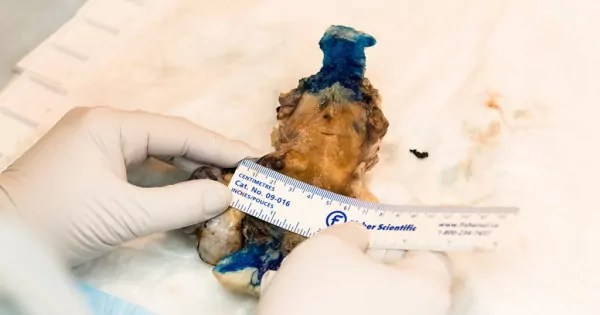
در ادامه برای بررسی تغییرات مورفولوژیکی بافت زیر میکروسکوپ فرایند پنجمرحلهای آبگیری، شفافسازی، قالبگیری، برش و رنگآمیزی انجام میشود. بافتهای سلولی ساختارهایی بدون تضاد رنگی هستند که برای بررسی میکروسکوپ نوری به رنگآمیزی نیاز دارند.
آبگیری نمونه پاتولوژی چیست ؟
این مراحله برای خارج کردن مولکولهای آب آزاد و محلول تثبیت بافت استفاده میشود. محلولهایی که برای آبگیری بافت استفاده میشود، ترکیبات آبدوستی هستند که با آب پبوند هیدروژنی برقرا میکنند (الکلها). نکته مهم در انجام این مرحله پیشرفت آهسته آن است. اگر در ابتدا از غلظت بالای محلول دهیدراته استفاده شود، فشار اسمزی و ساختار غشایی سلولها از بین رفته و مورفولوژی بافت تغییر میکند. اگر پروتکل مراحل بعدی، استفاده از پارافین برای ق۴البگیری باشد، آبگیری با غوطهور شدن نمونه بافتی در الکل ۶۰ تا ۷۰٪ شروع و با الکل مطلق (۱۰۰٪) تمام میشود.
شفافسازی نمونه پاتولوژی چیست ؟
در این مرحله ترکیب دهیدراتهکننده بافت خارج میشود. اگر آبگیری بهوسیله الکل انجام شده باشد، زایلن، تولوئن و کلروفرم سه ترکیبی است که در مرحله شفافسازی از آن استفاده میشود.
- زایلن: زایلن محلولی آلی، قابل امتزاج با پارافین و متداولترین ترکیب شفافسازی در مطالعات پاتولوژی و هیستولوژی است.
- تولوئن: تولوئن ترکیبی آلی با خصوصیات مشابه زایلن است که در با افزایش زمان آسیب کمتری در بافت ایجاد میکند.
- کلروفرم: کلروفرم یکی دیگر از ترکیبات آلی است که در شفافسازی بافتها از آن بهره برده میشود. عملکرد این ترکیب از تولوئن و زایلن آهستهتر است اما به کمک آنها میتوان برای نمونههای بافتی ضخیمتر (تا ۱ میلیمتر) استفاده کرد. نمونههایی که در کلروفرم قرار میگیرند، شفاف نمیشوند.
قالبگیری نمونه پاتولوژی چیست ؟
در این مرحله نمونه در ترکیبی مثل پارافین، ژلاتین، آگار یا رزین مایع قرار میگیرد تا بعد از انجماد، ساختار محکم تشکیل شده برش ورقههای نازک بافت را تسهیل کند. ترکیب ایدآل برای این مرحله باید ویژگیهای زیر را داشته باشد.
- در محلولهای قبلی آمادهساتزی حل شود.
- استحکام و انعطاف کافی برای برش بافت داشته باشد.
- نقطه ذوب آن بین ۳۰ تا ۶۰ درجه سانتیگراد باشد.
- شفاف یا بیرنگ باشد.
- پایدار، یکنواخت، غیرسمی، بیبو و ارزان باشد.
پارافین متدوالترین ترکیبی است که در آزمایشگاههای بافتشناسی و آسیبشناسی برای قالبگیری نمونههای تشریحی استفاده میشود. جدول زیر خلاصهای از فرایند چهار مرحله اولیه آمادهسازی بافت را نشان میدهد.
| ترکیب مصرفی | زمان (دقیقه) | دما (سانتیگراد) |
| فرمالین ۱۰٪ | ۶۰ | ۳۸ |
| فرمالین ۱۰٪ | ۶۰ | ۳۸ |
| الکل-فرمالین ۵۰٪ | ۶۰ | ۳۸ |
| الکل ۷۰٪ | ۶۰ | ۳۸ |
| الکل ۹۵٪ | ۶۰ | ۳۸ |
| الکل ۹۵٪ | ۴۰ | ۳۸ |
| الکل ۱۰۰٪ | ۶۰ | ۳۸ |
| الکل ۱۰۰٪ | ۴۰ | ۳۸ |
| زایلن | ۶۰ | ۳۸ |
| زایلن | ۳۰ | ۳۸ |
| پارافین | ۳۰ | ۳۸ |
| پارافین | ۳۰ | ۳۸ |
| پارافین | ۳۰ | ۳۸ |
| پارافین | ۳۰ | ۳۸ |
برش نمونه پاتولوژی چیست ؟
نمونه قالبگیری شده در پارافین ضخامت زیادی دارد که برای مشاهده زیر میکروسکوپ مناسب نیست. به همین دلیل از میکروتوم برای برش لایههای نازک (حدود ۵ میکرومتری) آن استفاده میشود.
رنگآمیزی نمونه پاتولوژی چیست ؟
نمونه برش خورده پس از خشک شدن آماده رنگآمیزی است. رنگآمیزی هماتوکسین-ائوزین یکی از متدوالترین روشها در آزمایشگاههای پاتولوژی تشریحی است. در این روش از رنگ بازی هماتوکسین و رنگ اسیدی ائوزین برای رنگآمیزی ساختارهای اسیدی (هسته) و بازی بافتها (ماتریکس خارج سلولی و سیتوپلاسم) استفاده میشود.
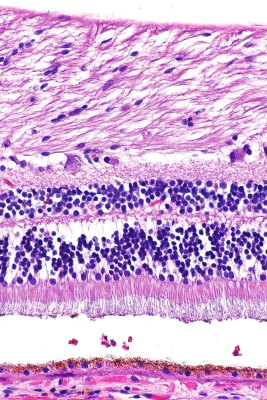
رنگآمیزی هماتوکسین ائوزین روشی سریع، کمهزینه و آسان است. اما اختلاف رنگ لازم برای بررسی بعضی ساختارهای بافتی و گرانولهای شیمیایی را فراهم نمیکندو به همین دلیل در این موارد از رنگآمیزیهای تخصصی استفاده میشود. ون گیسون، تولوئیدن بلو، آلشیان بلو، گیمسا، رتیکولین، نیسل، اورسین، سودان بلک، مازون، مالوری، آزان، کاسون، پریودیک اسید شیفت (PAS) و آلدهید فوشین روشهای رنگآمیزی تخصصی برای مشاهده ساختارهای بافتی هستند.
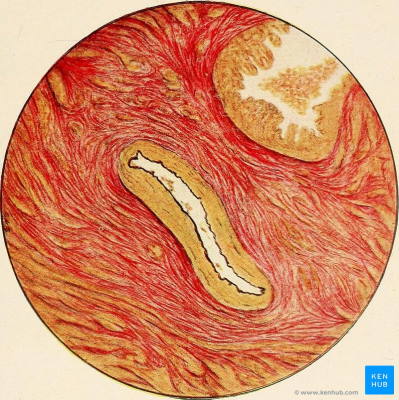
- ون گیسون: این روش رنگآمیزی بین رشتههای کلاژن و سایر رشتههای بافت پیوندی تمایز ایجاد میکند و معمولا برای بررسی آرایش رشتهها در تومورها از آن بهره برده میشود. این رنگ ترکیبی از اسید پیکریک و فوشین است. پس از رنگآمیزی رشتههای کلاژن به رنگ قرمز دیده میشوند.
- تولوئیدن بلو: تولوئیدن بلو یکی از رنگهای اسیدوفیل است که تمایل زیادی به اسید نوکلئوئیکها دارد. به همین دلیل برای رنگآمیزی سلولهایی با محتوای بالای RNA و DNA (بافت توموری) استفاده میشود. در پایان این رنگآمیزی اسید نوکلئوئیکها آبی دیده میشوند.
- آلشیان بلو: آلشیان بلو یکی از رنگهای بازی چندظرفیتی است که ۲ تا ۴ گروه ایزوتیواورانیوم با بار مثبت تشکیل شده است. این روش برای بررسی تحلیل بافت موکوزی و تشخیص موکوز اسیدی در تومورهای بافت پیوندی و اپیتلیال استفاده میشود. در پایان رنگآمیزی موسین اسیدی و ترکیبات مخاطی آب دیده میشود.
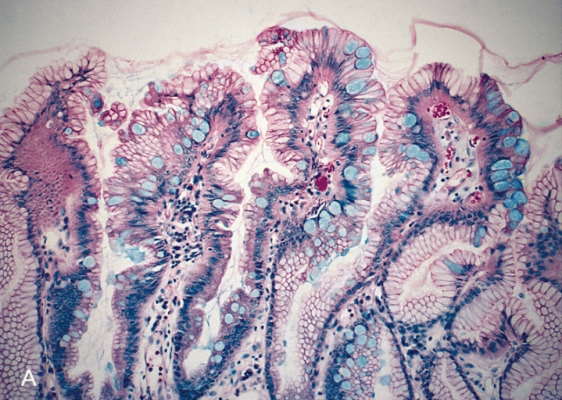
- گیمسا: از این روش برای رنگآمیزی نمونههای خونی و بافت جامد استفاده میشود. در پایان این رنگآمیزی سلولهای طبیعی بنفش و باکتریها را صورتی دیده میشوند.
- رتیکولین: از این روش برای تمایز رشتههای کلاژن نوع II (رتیکولین) و آسیبهای سلول کبدی، طحال، مغز استخوان و کلیه استفاده میشود. تغییر آرایش رشتههای رتیکولین در بافت کبدی ممکن است نشانه سیروز، نکروز یا تومور کبدی باشد. پس از پایان این رنگآمیزی رشتههای رتیکولین سیاه و زمینه بافت صورتی یا خاکستری دیده میشود.
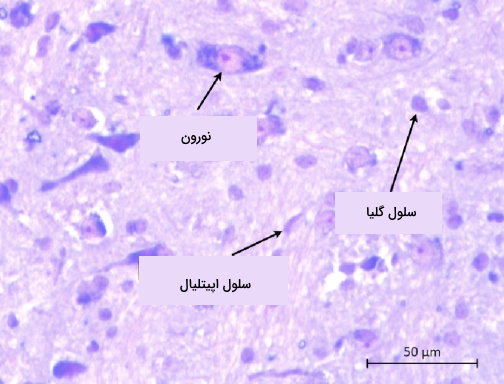
- نیسل: از این روش رنگآمیزی برای تمایز نورونها و سلولهای گلیای بافت عصبی استفاده میشود. اجسام نیسل تودههای شبکه اندوپلاسمی و ریبوزومهای آزاد سیتوپلاسم نورونی هستند که از بین رفتن آنها نشانه آسیب یا تحلیل نورونها است. در پایان رنگآمیزی اجسام نیسل آبی یا بنفش تیره دیده میشوند.
- اورسین: با این روش رنگآمیزی میتوان تجمع پروتئینهای تشکیل شده بهوسیله ویروس یا «اجسام انکلوژن» (Inclusion Bodies) را برخلاف خود ویروس زیر میکروسکوپ نوری مشاهده کرد. در آزمایشگاههای پاتولوژی از ین روش برای بررسی ویروس هپاتیت B در سلولهای کبدی استفاده میشود. در این روش از محلول اورسین در اتانول ۷۰٪ و هیدروکلریکاسید استفاده میشود و در پایان رنگآمیزی اجسام انکلوژن بنفش تیره-قهوهای دیده میشوند. این ترکیب با تمام پروتئینهای مسدار برهمکنش میدهد.
- سودان بلک: سودان بلک یکی از رنگهای هیدروفوب و غیریونی است که برای رنگآمیزی لیپیدها و گرانولهای چربی حاصل از افزایش سن استفاده میشود. پس از این رنگآمیزی گرانولهای چربی سیاه دیده میشوند. از این روش در رنگآمیزی گلبول قرمز نیز کاربرد دارد.
- مازون سهرنگ: در این روش از سه رنگ برای ایجاد تمایز بین فیبرهای ماهیچهای، کلاژنها، فیبرین و اریتروسیت در بافت پیوندی استفاده میشود. به کمک این روش میتوان سیروز و تومورهای کبدی را تشخیص داد. در این روش بافت ابتدا با یک رنگ اسیدی مثل ب«یبریچ اسکارلت» (Biebrich Scarlet) و سپس با فسفوتنگستیک یا فسفومولبیدیک اسید رنگآمیزی میشود. در نهایت از رنگ فیبر (مثل سبز روشن) استفاده خواهد شد. پس از پایان رنگآمیزی با این روش هسته سلولها آبی تیره یا سیاه، ماهیچهها و فیبرین قرمز و رشتههای کلاژن سبز دیده میشود.
- مالوری سهرنگ: مالوری یکی دیگر از روشهای رنگآمیزی رای ایجاد تمایز بین فیبرهای ماهیچهای و کلاژنها است که معمولا برای تشخیص بیماریهای کبدی و کلیه استفاده میشود. در پایان این روش هسته و سلولهای ماهیچهای قرمز، کلاژنها آبی و اریتروسیتها نارنجی دیده میشوند.
- آزان سهرنگ: آزان روش دیگری برای ایجاد تمایز بین فیبرهای ماهیچهای و کلاژنی است که برای تشخیص بیماریهای کبدی کاربرد دارد. در پایان این رنگآمیزی استخوان و غضروف دارای کلاژن آبی، و فیبرهای ماهیچهای قرمز دیده میشوند. در این روش از سه رنگ فسفومولبیدیکاسید، آنیلین بلو و آزوکارمین استفاده میشود.
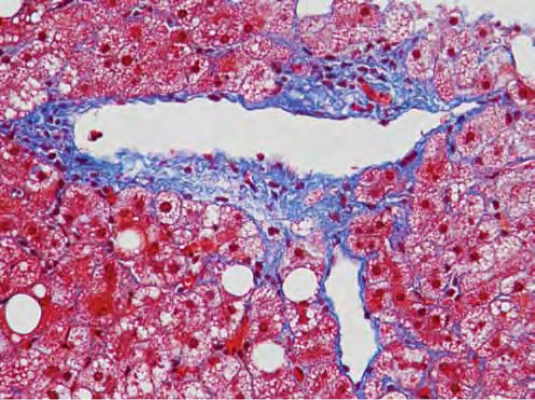
- پریودیک اسید شیفت: از این روش برای رنگآمیزی پلیمرهای گلیکوژن و تشخیص عفونتهای قارچی، انواع سارکوما و کارسینوما استفاده میشود. محلول رنگ ترکیبی از پریودیکاسید، هماتوکسیلین و معرف شیفت (ترکیب فوشین بازی و سدیم متابیسولفیت در آب مقطر و هیدروکلریکاسید) است. در پایان رنگآمیزی هسته سلولها آبی و گلیکوژن و قارچ قرمز یا صورتی دیده میشود.
- آلدهید فوشین: آلدهید فوشین یکی از رنگهای اختصاصی برای تمایز رشتههای الاستیک بافتهای پیوندی و گرانولهای سلولهای بتای پانکراس است. در پایان این رنگآمیزی رشتههای الاستیک و گرانولها بنفش-آبی دیده میشوند.
معنی اصطلاحات پاتولوژی چیست ؟
معنی ۲۳ اصطلاح متدوالی که در گزارش پاتولوژی کاربرد دارد، به ترتیب حروف الفبای انگلیسی در جدول زیر آمده است.
| توضیح فارسی | اصطلاح انگلیسی |
| آدنوما تومور خوشخیمی است به شکل سلولهای غددی بدن است و با تشخیص پزشک ممکن است نیاز به جراحی داشته باشد. | Adenoma |
| آبسه مجموعهای سلولهای ایمنی، میکروبها و مایع میانبافتی است که بر اثر عفونتهای داخلی یا سطحی ایجاد میشود. | Abscess |
| توده سلولی خوشخیم | Benign |
| کلسیفیکاسیون به رسوب یونهای کلسیم در بافتها گفته میشود که به دلیل جراحت یا عفونت، تومور، التهاب مزمن یا افزایش کلسیم خون ایجاد میشود. | Calcification |
| کلیر مارجین به شرایطی گفته میشود که بافت اطراف تومور جدا شده کاملا پاکسازی شده و سلول توموری در آن وجود ندارد. | Clear Margin |
| کلوز مارجین به شرایطی گفته میشود که سلولهای توموری پس از برداشت توده سلولی در بافت اطراف باقی مانده و به جراحی مجدد نیاز است. | Close Margin |
| کیست زوائد بافتی است که از یک لایه سلول اطراف حفرهای غیرطبیعیای تشکیل میشود. این حفره ممکن است خالی باشد یا از خون، چرک یا سلولهای پوستی پر شده باشد. | Cyst |
| در این بخش از گزارش پاتولوژی تشخیص پاتولوژیست در مورد نمونه بیوپسی نوشته میشود. | Diagnosis |
| فیبروز به زخم ایجاد شده پس از جراحت یا عفونت در بافتهای سطحی یا اندامهای داخلی گفته میشود. بافت فیبروزی عملکرد خود را از دست میدهد. | Fibrosis |
| آسیب فوکال در منطقه کوچک و محدودی از بافت ایجاد میشود. | Focal |
| شکل ظاهری نمونه (اندازه، رنگ، شکل هندسی و ارتباط با بافتهای کناری) در این بخش از گزارش پاتولوژی توصیف میشود. | Gross Description |
| التهاب پاسخ طبیعی بدن در شرایط عفونت یا آسیب بافتی است. | Inflammation |
| سرطان تهاجمی به وضعیتی گفته میشود که سلولهای توموری ایجاد شده در یک بافت عملکرد بافتهای اطراف ازجمله رگها و غدد لنفاوی را تحت تاثیر قرار میدهد. | Invasive Cancer |
| لیژن به تمام تغییرات بافتی گفته میشود که بر اثر تومورها، آسیبهای فیزیک یا عفونت ایجاد میشود. بعضی از لیژنها را میتوان بدون کمک میکروسکوپ مشاهده کرد. | Lesion |
| بدخیم | Malignant |
| توده سلولی یا تومور مجموعهای از سلولها است که بر اثر افزایش سرعت تکثیر سلولهای بافت ایچجاد میشود. این توده ممکن است خوشخیم یا بدخیم باشد. | Mass |
| مارجین مرز بین بافت توموری جدا شده و بافت سالم باقیمانده را مشخص میکند و نشاندهنده برداشت کامل بافت توموری است. | Margin |
| مول به زوائد پوستی همراه پیگمنت (رنگدانه) گفته میشود. | Mole |
| نودول توده سلولی کوچک (کمتر از ۵ میلیمتر) است که ممکن است بدخیم یا خوشخیم باشد. | Nodule |
| این اصطلاح نوع نمونه بافت جامد یا مایع (خون) را مشخص میکند. | Specimen |
| تومور گِرید تفاوتهای ظاهری تومورها با سلولهای سالم بدن را نشانمیدهد. اگر این این تفاوت کم باشد (low grade) تومور خوشخیم و اگر بیشتر زیاد (high grade) تومور بدخیم خواهد بود. | Tumor Grade |
| این اصطلاح در گزارش پاتولوژی پس از درمان، نشاندهنده کاهش اندازه تومور در بدن است. | Tumor Regression |
| مرحلهبندی تومور، اندازه توده سلولی، ورود سلولهای توموری به غدد لنفاوی بافت اولیه و متاستاز توده به اندامهای دیگر را مشخص میکند. | Tumor Stage |
| این اصلاح نشاندهنده التهاب رگ بر اثر آسیب یا عفونت بافتی است. | Vasculitis |
سوالات متدوال
در این بخش از مطلب مجله فرادرس به تعدادی از سوالات متداول پیرامون «پاتولوژی چیست» پاسخ میدهیم.
پاتولوژی رحم چیست ؟
پیش از این در مطلب رحم و سیستم تولید مثل زنان ساختار و آناتومی این اندام را در مجله فرادرس کامل توضیح دادهایم. رحم اندامی است که از دو لایه بافتی اندومتریوم (شامل غدد و بافت پیوندی) و میومتریوم (ماهیچههای صاف) تشکیل شده است. «اندومتریتیز» (Endometritis)، «آدنومیوزیس» (Adenomyosis)، «اندومتریوزیس» (Endometriosis)، خونریزی غیرطبیعی، هایپرپلازیا، پولیپ اندومتر، «لیومیوما» (Leiomyoma) و «لیومیوسارکوما» (Leiomyosarcoma) تغییرات پاتولوژیکی است که منجر به بیماریهای رحم میشود.
- اندومتریتیز: اندومتریتیز التهاب حاد یا مزمن بافت اندومتریوم رحم است که به دلیل عفونت باکتریایی «سی. تراکوماتیس» ( C. trachomatis) یا «نایسریا گونورهآ» (N. gonorrhoeae) و بیماریهای التهابی لگن ایجاد میشود. وجود سلولهای نوتروفیلی در نمونه پاتولوژی رحم، یکی از مشخصههای التهاب این اندام است. تب، درد ناحیه شکمی و عادت ماهیانه نامنظم از علائم بالینی این بیماری است.
- آدنومیوزیس: در این بیماری بخشی از بافت پیوندی یا غدد اندومتروم وارد لایه میومتریوم (بین فیبرهای ماهیچهای) میشود. این شرایط منجر به هایپرتروفی واکنشی لایه اندومتروم و تغییر شکل رحم (بزرگ شدن و افزایش ضخامت دیواره) میشود. درد مزمن لگن، عادت ماهیانه نامنظم و خونریزی شدید و درد انقباضی یا دفعهای در زمان عادت ماهیانه علائم بالینی این بیماری است.
- اندومتریوزیس: در اندومتریوزیس بخشی از بافت اندومتریوم رحم وارد قسمتهای خارج رحمی (لگن، رباطها، لولههای فالوپ و تخمدان) میشود. فاکتورهای التهاب به ویژه پروستوگلادین ۲ (E2) در بافت خارج شده از اندومتریوم افزایش مییابد.
- هایپرپلازیای اندومتر: افزایش نسبت ترشح استروژن به پروژسترون منجر به افزایش تقسیم سلولهای اندومتریوم شده و ممکن است در طولانیمدت به کارسینومکای اندومتریوم تبدیل شود. افزایش بافت چربی بدن، مشکلات تخمکگذاری، دریافت طولانیمدت استروژن، تخمدان پلیکیستیک و تومورهای تخمدان با افزایش استروژن بدن و هایپرپلازیای اندومتریوم همراه هستند.
- پولیپ اندومتر: پولیپهای اندومتریوم بیرونزدگیها (۵ تا ۳۰ میلیمتری) اندومتروم و رگهای خونی آن به فضای داخلی رحم هستند و معمولا در سنین یائسگی ایجاد میشوند. احتمال بذخیم شدن این تودههای سلولی بسیار کم است.
- لیومیوما: لیومیوما یا فیبروئید تودههای خوشخیم میودرم رحم است که اندازه آن پس از یائسگی کاهش مییابد. دستهجات فیبر ماهیچه صاف (شبیه بافت میومتریوم) مشخصه تومور در مطالعات پاتولوژی است. به علاوه فیبروز متمرکز، رسوب کلسیم و تحلیل بافت در نمونههای بافتی این بیماری دیده میشود. ساختارهای ژنی در سلولهای این تومور تغییر میکند.
- بازآرایی کروموزومهای ۶ و ۱۲ در این سلولها تغییر میکند.
- ژن MED12 (ژن کدکننده زیرواحدهای RNA پلیمراز) در ۷۰٪ تودههای لیومیوما جهش مییابد.
- لیومیوسارکوما: تومورهای لیومیوسارکما در بافت میومتریوم و معمولا پس از یائسگی ایجاد میشود. بازگشت توده پس از جراحی و متاستاز ریه در این تومورها بسیار متدوال است.
- اندمتریال سارکوما: سارکومای اندومتریوم در اثر افزایش استروژن و هایپرپلازیای این بافت ایجاد میشود. افزایش بافت چربی بدن، دیابت، فشار خون بالا، ناباروری و مصرف طولانیمدت استروژن از عواملی است که احتمال ابتلا به این سرطان را افزایش میدهد.
پاتولوژی چه تفاوتی با فیزیولوژی دارد ؟
در فیزیولوژی مکانیسمهای طبیعی اندامها و دستگاههای بدن، اما در پاتولوژی تغییرات بافتی بر اثر آسیبها یا بیماریها بررسی میشود. به علاوه پاتوفیزیولوژی شاخهای از علم زیستشناسی است که متخصصان آن تغییرات عملکردی اندامها بر اثر بیماری را بررسی میکنند.
جواب پاتولوژی چیست ؟
جواب پاتولوژی گزارشی است که پس از بررسی بافت، اندام یا نمونه خونی جدا شده از بدن و برای اطلاع پزشک از اینکه مشکل پاتوژی چیست، نوشته میشود. بر اساس نوع آنالیز نمونه آماده شدن جواب ممکن است بین چند روز تا چند هفته زمان نیاز داشته باشد.