اسمولالیته چیست؟ — به زبان ساده
در زیستشناسی از اسمول، اسمولاریته و اسمولالیته برای بیان غلظت مواد حلشونده استفاده میکنیم و میتوان گفت این مفاهیم متناظر مول، مولاریته و مولالیته در شیمی هستند. از آنجایی که اسمولاریتی و اسمولالیتی نقش مهمی در هومئوستازی بدن موجود زنده ایفا میکنند، در این مطلب به معنای هر واژه، نقش آن در پروکاریوتها، گیاهان و انسان و همچنین نحوه محاسبه غلظتها میپردازیم.
اسمول چیست ؟
اسمول یک واحد غیر SI و برابر با تعداد مول حلشونده دخیل در ایجاد فشار اسمزی است. سدیم کلرید در آب تبدیل به دو حل شونده، یعنی یون سدیم و کلر میشود، بنابراین هر مول از این ماده با حل شدن در آب، برابر با ۲ اسمول خواهد بود.
اسمولیت چیست؟
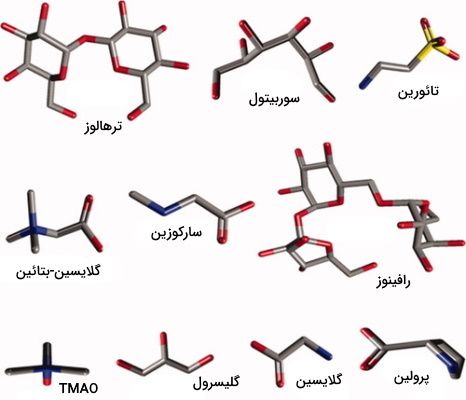
اسمولیتها مولکولهای طبیعی و آلی کوچکی هستند که بر خواص مایعات بدن موجود زنده اثر میگذارند. این مولکولها شامل گروههای شیمیایی مختلفی از جمله اسیدهای آمینه، متیلآمینها و پلیاُل (چندالکلی) میشوند. جانداران، از تجمع بالای اسمولیتها برای حفظ ساختارهای پروتئینی خود بهره میبرند. برهمکنش اسمولیت با ساختار اصلی پروتئین و برهمکنش حلال با زنجیره جانبی آن، نحوه تاخوردن پروتئین را مشخص میکند. به همین دلیل اختلال در غلظت اسمولیتها سبب آسیب ساختار و عملکرد پروتئین و در نهایت آسیب سلولی میشود.
در گیاهان، این مولکولها علاوه بر تنظیم اسمزی نقش محافظتی در برابر رادیکالهای آزد را نیز برعهده دارند. از جمله اسمولیتهای مهم در گیاهان میتوان به پرولین، گلایسین-بتائین، پلیآمینها و قندها اشاره کرد.
مکانسیم عمل اسمولیت
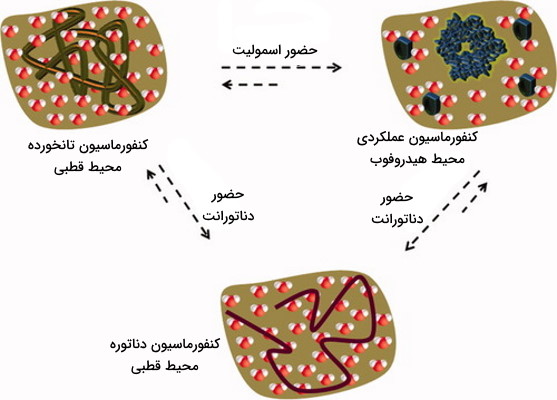
همانطور که گفته شد، اسمولیتها در تاخوردن درست پروتئین نقش دارند. در نبود این مولکولها، پروتئین توسط مولکولهای قطبی آب محصور میشود و در تعادل بین ۲ کنفورماسیون عملکردی و تانخورده است. حضور اسمولیت باعث پراکندهشدن مولکولهای آب میشود و اطراف پروتئین، محیطی آبگریز (هیدروفوب) حاصل خواهد شد.
این عمل، پروتئین را مجبور به تاخوردن میکند و تعادل را به نفع کنفورماسیون عملکردی تغییر میدهد. قطبی شدن محیط سبب تغییر شرایط به نفع دناتوراسیون پروتئین و حرکت تعادل به سمت کنفورماسیون دناتوره میشود.
نقش اسمولیت در بیماری ها
بسیاری از بیماریهای ارثی - مثل آلزایمر و هانتینگتون - به دلیل نقص عملکرد یا تجمع پروتئین در اثر تاخوردگی اشتباه بهوجود میآیند. در سالهای اخیر تمرکز بر استفاده از اسمولیتهای طبیعی برای جلوگیری از تاخوردگی اشتباه پروتئین و درمان بیماریهای ذکر شده، افزایش چشمگیری داشته اما هنوز در مرحله مطالعات حیوانی است.
تفاوت اسمولیت ها با مولکول های محافظ اسمزی
هردو، مولکول آلی با انحلالپذیری بسیار بالا هستند با این تفاوت که اسمولیت به کلیه مولکولهای دخیل در ایجاد فشار اسمزی گفته میشود اما مولکولهای محافظ اسمزی، در تنشها به تنظیم اسمزی و بقای سلول کمک میکنند.
تفاوت اسمولاریتی و اسمولالیتی چیست ؟
هردو، غلظت مربوط به ذرات حلشوندهی دخیل در فشار اسمزی هستند. اسمولاریتی بیانگر تعداد اسمول در حجم محلول است که با واحد اسمول بر لیتر (Osmol/L) نشان داده میشود. در حالیکه اسمولالیتی تعداد اسمول در جرم حلال است و با واحد اسمول بر کیلوگرم (Osm/kg) نمایش داده میشود. از آنجایی که حجم آب بر اثر حرارت تغییر میکند بسیاری از پژوهشگران ترجیح میدهند از اسمولالیتی برای بیان غلظت اسمزی استفاده کنند.
تفاوت اسمولاریته و مولاریته
در اسمولاریته تعداد اجزای حاصل از انحلال یک ماده در حلال مهم است. به طور مثال گلوکز در آب به ذرات دیگری تجزیه نمیشود، بنابراین محلول ۱ مولار این ماده برابر با ۱ اسمول بر لیتر است. اما ترکیبی مثل $$CaCl_{2}$$ در آب به سه جزء تفکیک میشود، بنابراین محلول یک مولار از این ماده، اسمولاریته ۳ اسمول بر لیتر دارد.
اسمولالیتی در پروکاریوت ها
محیط زندگی پروکاریوتها به نوعی است که موجود در معرض استرسهای اسمزی زیادی قرار میگیرد و برای متعادل نگهداشتن اسمولاریته سیتوپلاسم، از دو روش استفاده میکند. یکی از این روشها با کمک نمک داخل سیتوپلاسم و دیگری با کمک اسمولیتها تنش را برطرف میکند.
روش نمک سیتوپلاسم
این روش مخصوص هالوباکترها است. در این نوع پروکاریوت، ساختار پروتئینها تغییر میکند و غنی از اسیدآمینه آسپارتیل و گلوتامیل است. این اسیدآمینههای قطبی در مواقع لازم، امکان هیدراته شدن پروتئین (آبگیری) را فراهم میکنند.
روش اسمولیت ها
سایر پروکاریوتها از این روش بهره میگیرند. در این روش پاسخ اولیهای برای تنظیم اسمولاریتی وجود دارد که به کمک یون پتاسیم یا گلوتامات انجام میشود. پاسخ ثانویه، افزایش سنتز اسمولیتها در سلول است.
سنجش اسمولالیتی ترکیبات مهم بدن انسان
سنجش اسمولالیتی به معنی اندازهگیری تعداد ذرات فعال اسمزی در ترکیب است. این پارامتر نقش مهمی در هومئوزستازی مایعات بدن ایفا میکند. اگرچه اکثر سلولها میتوانند تغییرات حجم ناشی از تنشهای اسمزی را تنظیم کنند، اختلال اسمولالیته ترکیبات بدن ممکن است فرد را دچار بیماریهای مختلفی کند.
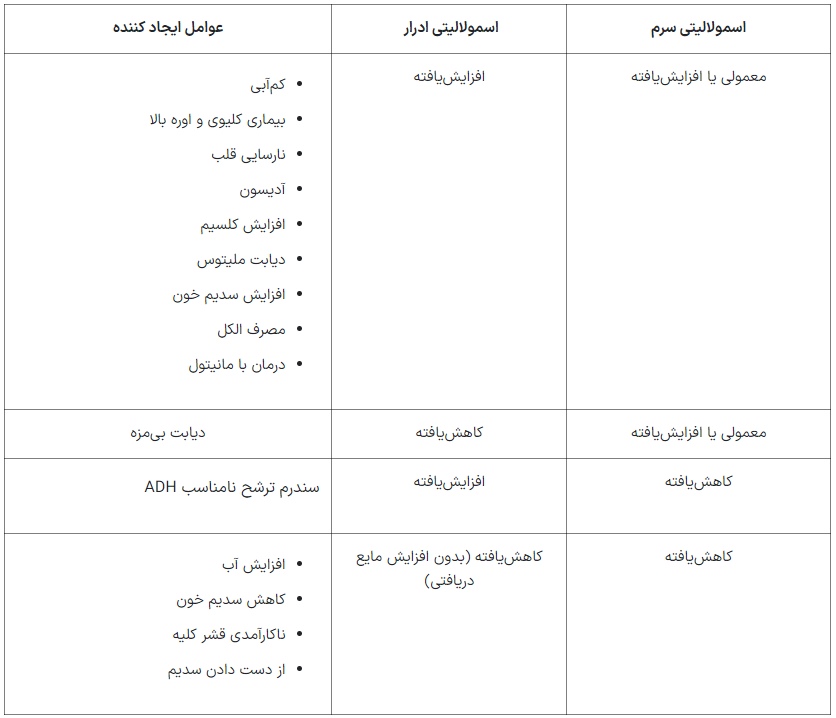
اسمولالیتی پلاسما و اسمولالیتی ادرار
در آزمایشهای بالینی معمولا سنجش این دو اسمولالیته همراه با هم انجام میشوند. در جدول ادامه میتوانید تغییر اسمولالیته پلاسما و ادرار در اختلالهای مختلف را مشاهده کنید.
اسمولالیتی خون
اسمولالیتی خون وابسته به مواد کلوئیدی موجود در آن، غلظت الکترولیتها و آب و در حالت طبیعی $$300 \ mOsmol/L$$ است. تعادل این ترکیبات در خون به تعادل هومئوستازی بدن کمک خواهد کرد. در مواقعی که اسمولالیتی بدن افزایش پیدا میکند (افزایش غلظت ترکیبات موجود در مایعات بدن) برای برقراری مجدد تعادل، هورمون ADH از سلولهای مغزی ترشح میشود. بافت هدف این هورمون قشر کلیه است که باعث حفظ آب بیشتر در این اندام و رقیق شدن خون و غلیظ شدن ادرار میشود.
فشار خون، وابسته به تغییرات اسمولاریتی آن است. اگر اسمولاریتی خون به دلیل کمبود آب یا مصرف زیاد نمک یا اختلالات دیگر افزایش پید اکند، فشار خون بالا میرود.
اسمولالیتی مدفوع
اسمولالیته مدفوع بهوسیله غلظت الکترولیتهای موجود در آن تعریف میشود و در آزمایشگاه، اسمولالیته مدفوع رقیق (اسهال) اندازهگیری میشود. میزان سدیم، پتاسیم و مواد دیگر رقت مدفوع را مشخص میکنند. اسهال حاد پس از چند روز بدون نیاز به درمان بهبود مییابد اما موارد مزمن که بیش از ۴ هفته طول میکشند، ممکن است نشاندهنده برخی اختلالات ازجمله موارد زیر باشد.
- عفونت انگلی، باکتریایی یا ویروسی
- بیماریهای روده
- سندروم روده تحریکپذیر
- بیماریهای سیستم اندوکرین مثل دیابت
- سیستم ایمنی تضعیف شده بر اثر سرطان یا بیماریهای دیگر
- جراحی قبلی یا رادیوتراپی ناحیه شکمی
- آلرژیها
- مصرف آنتیبیوتیک، داروهای شیمیدرمانی و ملینها
این تست همچنین مشخص میکند نوع اسهال اسمزی یا ترشحی است. اسهال اسمزی زمانی به وجود میآید که ماده مشخصی سبب ورود آب به روده باشد. اما اسهال ترشحی مربوط به زمانی است که بدن بهطور نامتعارف، داخل روده آب آزاد میکند.
اسمولاریته در گیاهان
اسمولاریته و اسمولیتها در گیاهان نقش مهمی برای حفظ تعادل بقای گیاه در تنش محیطی -شوری خاک، کمآبی، دمای بالا و اشعه فرابنفش خورشید- دارد.
در واقع تنش ایجاد شده سبب بیان ژنهای سنتز مولکولهای محافظ اسمزی و شروع چرخه تنظیمی میشود. این مولکولها بر اساس ترکیب شیمیایی از سه دسته کلی تشکیل شدهاند.
-
- اسیدهای آمینه
- ترکیبات چهارگانه آمونیوم
- پلیالها، قندها و قندهای الکلی
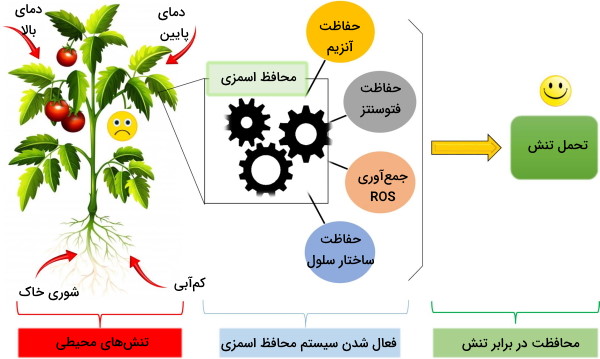
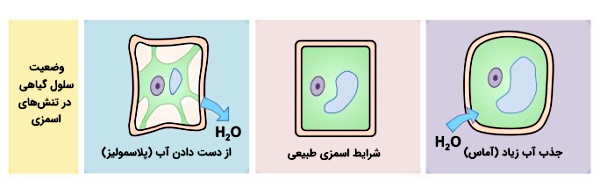
در سلولهای گیاهی برخلاف سلولهای جانوری، دیوارهسلولی وجود دارد که در شرایط تغییر تعادل اسمولاریته گیاه، اجازه نمیدهد سلول تغییر شکل زیادی پیدا کند و غشای پلاسمایی آن پاره شود.
فرمول محاسبه اسمولالیته مایعات بدن
محاسبه اسمولالیته مایعات بدن با توجه به غلظت چند ترکیب اصلی سازنده این مایعات انجام میشود. برای محاسبه نظری این غلظت از فرمول زیر استفاده میکنیم.
$$ 2 (Na^+) + 2 (K^+)$$ + گلوکز + اوره= اسمولالیته
توجه داشته باشید که در رابطه بالا، غلظت ترکیبات بر اساس mmol/L ذکر شده است.
به اختلاف بین غلظت محاسبه شده از این فرمول و غلظت بهدستآمده در آزمایشگاه شکاف اسمولالیتی (Osmolality gap) میگویند. این اختلاف وجود اسمولیتهای دیگر در مایعات یا مدفوع فرد را نشان میدهد که در فرمول لحاظ نشده است. شکاف اسمولی طبیعی، کمتر از $$10 \ mOsmol/Kg$$ محاسبه میشود. شکاف اسمولی غیرمعمول عموما به دلیل مصرف الکلها (اناتول، متانول، ایزوپروپانول، اتیلن گلایکول، دیاتیلن گلایکول و پروپیلن گلایکول) به وجود میآید.
مسائل اسمولاریته
در ادامه، به برخی از مثالها پیرامون اسمولالیته و اسمولاریته میپردازیم.
مثال اسمولاریته
فرض کنید ۴۰۰ میلیلیتر آب دارید که ۶۰ گرم $$MgCl_{2}$$ در آن حل شده است. جرم اتمی Mg برابر ۲۴/۳ گرم و جرم اتمی Cl برابر ۳۵/۵ گرم است. تعداد مول Mg موجود در محلول یاد شده را به طریق زیر محاسبه میکنیم.
$$60 gr\times\frac{1 mol}{95.3 gr}=0.63$$
برای محاسبه اسمول یک محلول باید به این نکته توجه داشته باشید که نمک حل شده در آن به چند ذره تفکیک میشود. در این مثال نمک ما $$MgCl_{2}$$ است که پس از انحلال به ۲ یون کلرید و ۱ یون منیزیوم تجزیه میشود. پس هر مول $$،MgCl_{2}$$ ۳ اسمول است. با توجه به موارد گفته شده، اسمول حل شونده در این محلول ۱/۸۹ است. در نتیجه اسمولاریتی محلول از طریق محاسبات زیر به دست میآید.
$$\frac{1.89Osm}{0.4L}=4.73 Osm/L$$
مثال اسمولالیته
با دانستن اسمولاریتی محلول در دو سمت غشای نیمهتراوا، میتوانید جهت فشار اسمزی و به دنبال آن جهت انتشار آب را پیشبینی کنید. آب از محلول رقیق به سمت محلول غلیظ حرکت میکند.
برای محاسبه اسمولالیته در این مثال، ابتدا نیاز به محاسبه جرم آب داریم. برای محاسبه جرم مایعات میتوانیم از چگالی استفاده کنیم. از آنجایی که چگالی آب در شرایط معمول 1 گرم بر سانتیمتر مکعب است، جرم آب در مثال بالا ۰/۴ گرم و اسمولالیته به قرار زیر است:
$$\frac{1.89Osm}{0.4Kgr}=4.73 Osm/kg$$










سلام. وقت یه خیر بسیار عالی بود. تقدیر و سپاس از سرکار خانم پیمان و سایت وزین فرادرس.
بسیار کامل و جامع توضیح داده بودین ممنون