متانول چیست؟ — به زبان ساده

متانول سادهترین عضو خانواده الکلها، با تنها یک اتم کربن است. الکلها گروهی از ترکیبهای آلی با گروه عاملی هیدروکسیل هستند. در این مطلب از مجله فرادرس میخواهیم بدانیم متانول چیست و چه کاربردهایی دارد. همچنین به ویژگیهای شیمیایی و فیزیکی آن که باعث به کارگیری آن بهعنوان سوخت میشود، نگاهی خواهیم داشت. در نهایت نیز با واکنشهای شیمیایی و روشهای تولید این ماده باارزش آشنا خواهیم شد.
متانول چیست ؟
«متانول» (Methanol) سادهترین «الکلی» (Alcohol) است که وجود دارد. فرمول شیمیایی این ماده را میتوان بهصورت $$CH_3OH$$ نشان داد. متانول، هیدروکربن نیست زیرا «گروه هیدروکسیل» (Hydroxyl Group) آن بهصورت شیمیایی به اتم کربن متصل شده است.
متانول از یک گروه «متیل» (Methyl) متصل به یک گروه هیدروکسیل تشکیل شده است. از متانول با نامهایی مانند «الکل چوب» (Wood Alcohol) و «متیل الکل» (Methyl Alcohol) نیز یاد میشود. بوی این الکل ملایمتر و شیرینتر از بوی اتانول است. این ماده بسیار فرار و بیرنگ است. متانول به شدت اشتعالپذیر و سمی نیز هست. مصرف این ماده باعث ایجاد مسمومیت میشود و میتواند منجر به نابینایی فرد شود.
متانول در فضای بینستارهای
متانول به میزان بسیار زیادی در فضاهای به وجود آمدن ستارهها یافت میشود و در علم نجوم از آن به عنوان نشانهای برای تشخیص این فضا استفاده میشود.
الکل چیست؟
برای اینکه بهتر بدانیم متانول چیست ابتدا سراغ الکلها میرویم تا با خانوادهای که متانول به آن تعلق دارد، بیشتر آشنا شویم. الکلها ترکیباتی هستند که یک یا تعدا بیشتری از اتمهای هیدروژن موجود در زنجیره کربنی آنها با گروه هیدروکسیل با فرمول شیمیایی $$OH$$ جایگزین شده باشد.
به این صورت میتوان ساختار سادهترین الکل، یعنی متانول را با جایگزین کردن یکی از هیدروژنهای موجود در ساختار متان که سادهترین عضو خانواده آلکانها است، با گروه هیدروکسیل به دست آورد.
نحوه نامگذاری الکلها
نام الکلها از همتای آلکانی آنها گرفته میشود. برای مثال برای سادهترین الکل که از متان ساخته میشود، کافیست پسوند «ال» (Ol) را در انتهای نام آن بیاوریم تا متانول به دست بیاید. فرمول کلی الکلها را میتوان بهصورت R_OH نشان داد که در آن R نشاندهنده بخش هیدروکربنی مولکول است و گروه آلکیلی نامیده میشود. در متانول این گروه برابر با $$CH_3$$ است. توجه داشته باشید که برای الکلهایی با سه اتم کربن و بیش از این، ساختارهای ایزومری وجود خواهند داشت و این باید در نام آنها نمود داشته باشد. به تصویر زیر که مربوط به الکلی با ۳ اتم کربن است توجه کنید.
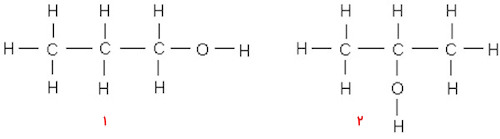
نام ساختار شماره ۱، ۱-پروپانول است که میتوان از ۱ صرفنظر کرد. ساختار ۲ نیز بهصورت ۲-پروپانول نامیده میشود. این جابهجایی گروه هیدروکسیل تغییراتی را در ویژگی و کاربردهای آنها به وجود میآورد.
انواع الکل
یک اتم کربن بهطور معمول ۴ پیوند شیمیایی را تشکیل میدهد. بنابراین در یک مولکول الکل، در صورتی که یکی از این پیوندها در اتصال با گروه هیدروکسیل باشد، ۳ ظرفیت دیگر میتوانند با کربنهای دیگر اشغال شوند. بر همین اساس میتوان الکلها را به انواع مختلفی دستهبندی کرد که در ادامه آنها را آوردهایم.
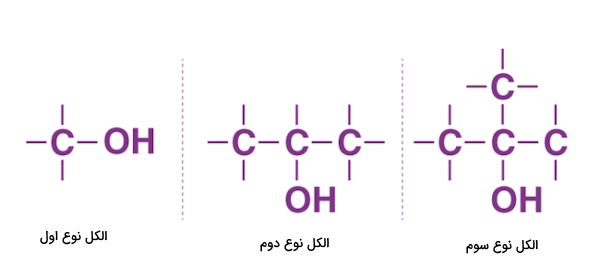
- الکل نوع اول: اگر به اتم کربن متصل به اتم اکسیژن گروه هیدروکسیل، تنها یک اتم کربن دیگر متصل باشد، الکل را نوع اول مینامیم.
- الکل نوع دوم: اگر به اتم کربن متصل به اتم اکسیژن گروه هیدروکسیل، دو اتم کربن دیگر متصل باشد، الکل را نوع دوم مینامیم.
- الکل نوع سوم: اگر به اتم کربن متصل به اتم اکسیژن گروه هیدروکسیل، سه اتم کربن دیگر متصل باشد، الکل را نوع سوم مینامیم. در تصویر بالا ساختار کلی این سه الکل را مشاهده میکنید.
خواص الکلها
تمامی الکلها با اکسیژن هوا وارد واکنش میشوند و دو محصول کربن دیاکسید و آب را به وجود میآورند. به همین دلیل نیز میتوان گفت که تمامی الکلها «اشتعالپذیر» (Combustible) هستند. «واکنش سوختن» (Combustion Reaction) در الکلها، مانند هیدروکربنها از اهمیت بالایی برخوردار است اما در صورتی که واکنش اکسایش آنها کنترل شده انجام شود، ارزش بیشتری خواهد داشت. اگر این اکسایش کنترل شده انجام شود، میتوان به محصولات باارزشی دست یافت. سهولت انجام این اکسایش به نوع الکل بستگی دارد.
برای الکلهای نوع اول این اکسایش بهصورت مرحلهای و کنترل شده پیش میرود. در ابتدا محصول «آلدهیدی» (Aldehyde) را به دست میآوریم. در این مرحله اگر از عامل اکسیدکننده در محیط باقی مانده باشد، آلدهید تولید شده تبدیل به کربوکسیلیک اسید همتای خود میشود.
$$RCH_2OH \xrightarrow {[O]} RCHO \xrightarrow{[O]} RCOOH $$
اکسایش ترکیبهای آلی را میتوان معمولا بهراحتی تشخیص داد زیرا در طی آن یا به مولکول، اتم اکسیژنی افزوده میشود یا از آن دو عدد اتم هیدروژن کم میشود. برای مثال میتوانیم به اکسایش اتانول اشاره کنیم. در این واکنش در ابتدا «استالدهید» (Axetaldehyde) و سپس کربوکسیلیک اسید همتای آن، یعنی «استیک اسید» (Acetic Acid) به وجود میآيد.
مولکولهایی با گروه عاملی آلدهیدی، دارای گروه $$CHO$$ هستند که در آن کربن با پیوند دوگانه به اتم اکسیژن متصل است. همچنین کربوکسیلیک اسید دارای گروه $$COOH$$ است که در آن اتم کربن با یک پیوند دوگانه به یک اتم اکسیژن و یک پیوند یگانه به اتم اکسیژن گروه هیدروکسیلی متصل است.
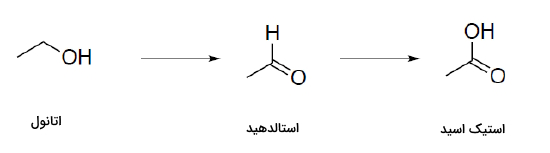
اتانول در اولین مرحله اکسایش به استالدهید و سپس استیک اسید تبدیل میشود. توجه داشته باشید که استالدهید یکی از اتمهای هیدروژن خود را از کربن و دیگری را که در اتصال با اکسیژن بود، از دست داده است. همچنین استیک اسید با استالدهید در یک اتم عنصر اکسیژن تفاوت دارد.
اکسایش تحت کنترل را میتوان به کمک محلول آبی پتاسیم پرمنگنات با فرمول شیمیایی $$KMnO_4$$ یا محلول آبی پتاسیم دیکرومات با فرمول شیمیایی $$K_2Cr_2O_7$$ در آزمایشگاههای شیمی انجام داد.
اکسایش الکل نوع دوم
وقتی یک الکل نوع دوم مانند ۲-پروپانول تحت همین شرایط قرار میگیرد، محصول متفاوتی به دست میآید. در این محصول یک گروه $$C=O$$ وجود دارد که به کربن آن دو اتم کربن دیگر متصل هستند. به این گروه در این شرایط «کتون» (Ketone) میگویند. سادهترین کتون طی واکنش زیر به دست میآید و استون نامیده میشود.
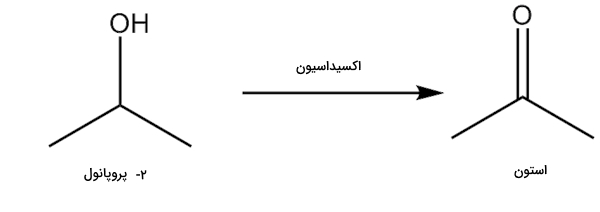
با توجه به این واکنش نیز متوجه میشویم که تعداد اتمهای هیدروژن محصول کتونی از واکنشدهنده الکلی ۲ عدد کمتر است و آن را در روند اکسایش از دست داده است. انجام اکسایش روی محصول کتونی دشوار است زیرا نمیتوان به کربن متصل به گروه $$C=O$$، اتم اکسیژن دیگری را پیوند داد. همچنین نمیتوان به طریقی اتمهای اکسیژن را از پیوند با اتم کربن و اتم اکسیژن جدا کرد.
اکسایش الکل نوع سوم
همانطور که پیشتر گفتیم به کربن متصل به گروه هیدروکسیلی، هیدروژنی متصل نیست، بنابراین اکسایش آنها دشوار است. در صورتی که الکل نوع اول، نوع دوم و نوع سوم در دسترس باشند و هر کدام را در بشری جداگانه حل کنیم و به آن پتاسیم پرمنگنات و پتاسیم دیکرومات اضافه کنیم، تنها بشر حاوی الکل نوع اول و نوع دوم وارد واکنش میشوند. انجام واکنش را میتوان بهسادگی استنباط کرد زیرا یونهای پتاسیم پرمنگنات و پتاسیم دیکرومات در آن از خود به ترتیب رنگی بنفش و نارنجی به جای میگذارند. به این صورت در بشر حاوی الکل نوع اول و نوع دوم، رنگ از بین میرود اما در بشر حاوی الکل نوع سوم هیچ تغییری ایجاد نمیشود.
ساختار متانول چیست ؟
همانطور که پیشتر اشاره کردیم، فرمول شیمیایی متانول را میتوان بهصورت $$CH_3OH$$ نشان داد. از آنجا که در این ساختار شیمیایی بین گروه متیل $$(CH_3)$$ و گروه هیدروکسیلی $$(OH)$$ اتصالی برقرار است، آن را بهصورت $$MeOH$$ نیز نشان میدهند. توجه داشته باشید که منظور از $$Me$$ همان گروه متیلی است.
ساختار متانول را میتوانید در تصویر زیر مشاهده کنید.
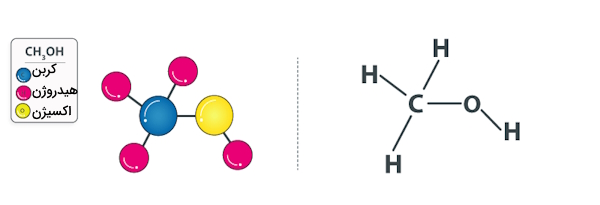
کربن موجود در ساختار متانول دارای هیبریداسیون $$sp^3$$ است. به دلیل حضور گروه هیدروکسیلی در این ماده، متانول توانایی تشکیل «پیوندهای هیدروژنی» (Hydrogen Bonds) بهصورت بینمولکولی را با «گیرندگان پیوند هیدروژنی» (Hydrogen Bond Acceptors) دارد. مخلوط آب و متانول یکی از مثالهای کلاسیک در مطالعه پیوند هیدروژنی است.
ویژگیهای شیمیایی و فیزیکی متانول چیست ؟
برای بررسی کاربردهای این ماده، بهتر است ابتدا بدانیم ویژگیهای شیمیایی و فیزیکی متانول چیست که باعث باارزش بودن آن شده است. در جدول زیر میتوانید بهصورت خلاصه برخی از ویژگیهای این ماده را مشاهده کنید.
| متانول | $$CH_3OH$$ |
| جرم مولکولی | ۳۲٫۰۴ گرم بر مول |
| چگالی | ۷۹۲ کیلوگرم بر مترمکعب |
| نقطه جوش | ۶۴٫۷ درجه سانتیگراد |
| نقطه ذوب | ۹۷٫۶- درجه سانتیگراد |
همچنین در فهرست زیر به برخی دیگر از ویژگیهای این ماده اشاره کردهایم.
- متانول در دمای اتاق بهصورت مایعی شفاف، بیرنگ و فرار حضور دارد.
- به دلیل داشتن بویی شبیه به اتانول، در بسیاری موارد با آن اشتباه گرفته و باعث به وجود آمدن مسمومیتهای الکلی میشود. استنشاق بخارهای این ماده باعث ایجاد سردرد و سرفه نیز میشود. همچنین در هنگام کار با این ماده باید از تماس مستقیم آن با پوست اجتناب کرد.
- این ماده به دلیل حضور گروه هیدروکسیل، از «قطبیت» (Polarity) بسیار بالایی برخوردار است. همین ویژگی باعث میشود که کاربرد وسیعی به عنوان حلال قطبی در واکنشهای شیمیایی داشته باشد.
- متانول با آب کاملا «قابل امتزاج» (Miscible) است. «انحلالپذیری» (Solubility) آن در دمای ۲۵ درجه سانتیگراد بیش از ۱۰۰ میلیگرم بر میلیلیتر است. متانول با مایعاتی مانند اتانول، «بنزن» (Benzene)، «اتر» (Ether)، «استون» (Acetone)، «کلروفرم» (Chloroform) مخلوط میشود.
- «نقطه اشتعال» (Flashpoint) متانول برابر با ۹٫۷ درجه سانتیگراد است.
- فشار بخار این مایع در دمای ۲۵ درجه سانتیگراد برابر با ۱۲۷ میلیمتر جیوه است.
- گرانروی متانول در دمای ۲۵ درجه سانتیگراد برابر با ۰٫۵۴۴ مگاپاسکال است.
- فشار سطحی این مایع در دمای ۲۵ درجه سانتیگراد برابر با مگانیوتون بر متر است.
- ثابت تفکیک $$(p_{Ka})$$ متانول برابر با ۱۵٫۳ است.
- «گرمای سوختن» (Heat Of Combustion) و «گرمای تبخیر» (Heat Of Vaporization) این ماده بهترتیب برابر با ۷۲۶٫۱ کیلوژول بر مول و ۳۷٫۳۴ کیلوژول بر مول است. این مقادیر برای دمای ۲۵ درجه سانتیگراد اندازهگیری شدهاند.
کاربرد متانول چیست ؟
تا اینجا دانستیم که متانول چیست و به کدام دسته از ترکیبهای آلی تعلق دارد. در این بخش میخواهیم بدانیم این ماده چه کاربردهایی دارد.
تولید فرمالدهید، استیک اسید و متیل ترشیوبوتیل اتر
همانطور که پیشتر گفتیم متانول طی یک واکنش اکسایش به فرمالدهید تبدیل میشود که کاربرد گستردهای در موارد مختلف بهخصوص در تولید پلیمرها دارد. این واکنش اکسایش را میتوان بهصورت زیر نمایش داد.
$$ 2 CH_3OH + O_2 \rightarrow 2 CH_2O + 2 H_2O $$
استیک اسید نیز بهصورت زیر طی یک چرخه واکنش کاتیوا از متانول به دست میآيد. در ادامه بهتفضیل به بررسی این چرخه و واکنشهای صورت گرفته در آن، پرداختهایم.
فرآیند کاتیوا
«فرآيند کاتیوا» (Cativa Process) روشی برای تولید استیک اسید توسط «کربونیلاسیون» (Carbonylation) متانول است. این روش از کاتالیزورهای حاوی عنصر ایریدیوم مانند کمپلکس $${Ir(CO)_2I_2}^-$$ استفاده میشود.
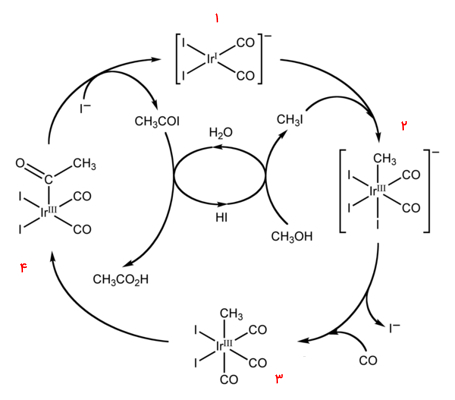
چرخه کاتیوا
در این بخش میخواهیم بدانیم متانول با طی کردن چه مراحلی تبدیل به استیک اسید میشود. این چرخه کاتالیزوری از واکنش متیل یدید با گونه کاتالیزوری ۱ آغاز میشود و طی آن گونههای ایریدیوم (III) هشتوجهی را به وجود میآورد. این محصول در چرخه با شماره ۲ مشخص شده است و بهصورت $$[Ir(CO)_2(CH_3)I_3]^-$$ نمایش داده شده است.
این «واکنش افزایش اکسایشی» (Oxidative Addition Reaction) شامل یک «واکنش جایگیری» (Insertion Reaction) ایریدیوم (I) در پیوند کربن-ید در مولکول متیل یدید است. بعد از تعویض لیگاند (یدید برای کربن مونوکسید)، واکنش جایگیری مهاجرتی کربن مونوکسید در پیوند ایریدیوم-کربن به تشکیل گونههایی «هرمی مربعی» (Square Pyramidal) با یک لیگاند متصل استیلی، ختم میشود که در این چرخه آن را از مرحله ۳ به ۴ نشان دادهایم.
گونههای کاتالیزوری فعال ۱ با «واکنش حذف کاهشی» (Reductive Elimination Reaction) استیل یدید، بازتولید میشوند. سپس استیل یدید در فرآیند تولید «هیدرویدیک اسید» (Hydroiodic ACid)، «آبکافت» (Hydrolyse) میشود تا محصول استیک اسید به دست بیاید.
تولید هیدروکربن، اولفین و بنزین
تراکم متانول برای تولید هیدروکربنهای معمولی و حتی هیدروکربنهای آروماتیک، پایه و اساس تکنولوژیهای بسیاری است که با فرآیند «گاز به مایع» (Gas To Liquids) در صنعت نفت و گاز، مرتبط هستند. در فهرست زیر تعدادی از این تبدیلهای تراکمی را مشاهده میکنید.
- متانول به هیدروکربن (MtH)
- متانول به بنزین (MtG)
- متانول به اولفین (MtO)
- متانول به پروپیلن (MtP)
این تبدیلها کاتالیزوری هستند و از «زئولیت» (Zeolite) به عنوان کاتالیزور ناهمگن آنها استفاده میشود.
افزودنی بنزین
طبق «دستورالعمل کیفیت سوخت اروپا» (European Fuel Quality Directive) استفاده از متانول در سوخت، تا ۳٪ و به همراه حلال کمکی، مجاز است. کشور چین در یک سال بیش از ۴٫۵ میلیادر لیتر از متانول را در صنعت سوخترسانی به مصرف میرساند. به این صورت که در وسایل نقلیه عمومی به نسبت کم در بنزین و برای وسایل نقلیه طراحی شده برای سوخت متانول، به مقدار بیشتری حضور دارد.
پیشساز مواد شیمیایی
از متانول بهعنوان «پیشساز» (Precursor) برای تولید بسیاری از ترکیبهای شیمیایی استفاده میشود. در زیر فهرستی از مهمترین این ترکیبات را مشاهده میکنید.
- متیل آمین
- متیل هالید
- متیل اتر
- متیل استر
علاوه بر موارد ذکر شده در بالا، متانول به عنوان سادهترین عضو خانواده الکلها در موارد بسیار دیگری نیز کاربرد دارد که در فهرست زیر به برخی از مهمترین آنها اشاره کردهایم.
- این الکل یکی از اصلیترین ترکیبات سازنده در محصولات روزمرهای مانند پلاستیک، لوازم ساختمانی و قطعات خودرو است.
- از آنجا که منبعی برای انرژی پاک است بهعنوان سوخت در ماشینها، کشتیها، دیگهای بخار و اجاقهای خوراکپزی به کار گرفته میشود. این کاربرد متانول از زمانهای باستانی متدوال بوده است.
- از متانول در آزمایشگاههای شیمی بهعنوان حلال استفاده میشود و میتوان واکنشهای بسیاری را به کمک آن به انجام رساند.
- متانول در صنعت برای تولید مواد شیمیایی دیگری مانند «فرمالدهید» (Formaldehyde)، «استیک اسید» (Acetic Acid) و برخی ترکیبات شیمیایی سنگین مانند «بوتیل اترها» (Butyl Ethers) و پلیمرهای دیگر به کار میرود.
- از این ماده در مناطقی از جمله کشورهای اروپایی بهعنوان یک ضدیخ استفاده میشود.
- از متانول برای تولید هیدروکربنهایی مانند «گازوئیل» (Gasoline)، «اولفین» (Olefins) و ترکیبات آروماتیکی پیچیدهتری استفاده میشود. این کار توسط «واکنش تراکمی» (Condensation Reaction) با کاتالیزوری همگن مانند «زئولیت» (Zeolites) انجام میشود.
- بسیاری از واکنشهای مورد نیاز در داروسازی را میتوان در محیطی با حلال متانول انجام داد.
- متانول در صنعت عطر و ادکلن کاربرد بسیار زیادی دارد.
خطرات استفاده از متانول چیست ؟
همانطور که مشاهده کردید از متانول در بسیاری از صنایع بهوفور استفاده میشود و افراد مشغول به کار در این محیطها، در معرض آن قرار دارند. در این بخش میخواهیم بدانیم خطرات استفاده از متانول چیست تا بتوان تا حد ممکن از آنها جلوگیری کرد که در فهرست زیر به آنها اشاره شده است.
- در صورتی که متانول چه بهصورت خوراکی چه از راه تنفس وارد بدن انسان شود، باعث ایجاد تاری دید، سردرد و حالت تهوع میشود. در آزمایشی تاثیر این ماده بر بچههای موشهای آزمایشگاهی مورد مطالعه قرار گرفته است که باعث ایجاد نقصهای مادرزادی میشود.
- آسیب ناشی از این ماده الکلی به دلیل تولید محصولات متابولیکی است که در همراهی با آنزیمهای بیولوژیکی مانند «الکل دهیدروژناز» (Alcohol Dehydrogenase) و «آلدهید دهیدروژناز» (Aldehyde Dehydrogenase) به وجود میآید.
- به دلیل اشتعالپذیری بالا نباید این ماده را در نزدیکی شعله نگهداری کرد. همچنین بهتر است در هنگام کار با آن از هر منبعی که باعث بالا رفتن دما میشود، دور بود. اشتعالپذیری بالای این ماده به دلیل پایین بودن مقدار نقطه جوش آن است که در بخشهای قبلی به آن پرداختهایم.
واکنشهای شیمیایی متانول چیست ؟
در این بخش میخواهیم به تعدادی از واکنشهای مهم شیمیایی که متانول در آنها حضور دارد، بهصورت مختصر اشارهای داشته باشیم.
واکنش اکسایش
از «واکنش اکسایش» (Oxidation Reaction) متانول برای تهیه صنعتی و تجاری ماده شیمیایی دیگری به نام فرمالدهید استفاده میشود. این واکنش را میتوانید در زیر مشاهده کنید. در این واکنش متانول با اکسیژن «نوپدید» (Nascent) و در حضور «پتاسیم دیکرومات» (Potassium Dichromate) بهعنوان کاتالیزور واکنش، در محیطی اسیدی رخ میدهد. طی این واکنش دو محصول فرمالدهید و آب تولید میشوند.
$$ CH_3OH + O → HCHO + H_2O $$
تشکیل استر
در واکنش الکل با کربوکسیلیک اسید، محصولی به دست میآید که در شیمی آلی با نام «استر» (Ester) شناخته میشود. مثالی از تشکیل استر (متیل اتانوات) حاصل از واکنش متانول و استیک اسید را میتوانید در زیر مشاهده کنید.
$$ CH_3OH + CH_3COOH \rightarrow CH_3COOCH_3 $$
این واکنش در محیط اسیدی اتفاق میافتد. (در حالت کلی استفاده از «اسید سولفوریک» (Sulfuric Acid) رقیق در این مورد ترجیح داده میشود.) از آنجا که متانول الکل سادهای است، بهسادگی با تمام اعضای خانواده کربوکسیلیک اسیدها وارد واکنش میشود و استرهایی را به وجود میآورد که بویی مشابه بوی میوه دارند. استرها کاربردهای صنعتی و تجاری فراوانی دارند و در صنایعی مانند صنایع غذایی و صنعت عطر و ادکلن به کار گرفته میشوند.
واکنش با هالو اسیدها
واکنش الکل با «هالوژن اسیدها» (Halogen Acids) یکی از بهترین روشهای موجود برای تولید «آلکیل کلریدها» (Alkyl Chlorides) است. یکی از از معروفترین آلکیل کلریدها، هیدروکلریک اسید است. هنگامی که متانول با یک هالوژن اسید وارد واکنش میشود، محصولی به نام متیل کلرید به وجود میآيد. در این واکنش آب نیز بهعنوان محصول جانبی تولید میشود. واکنش فوق را میتوان بهصورت زیر نمایش داد.
$$ CH_3OH + HCl \rightarrow CH_3Cl + H_2O $$
روشهای تولید متانول چیست ؟
متانول به دلیل کاربرد بسیار عمدهای که دارد در مقیاس صنعتی تولید میشود. برای تولید متانول از روشهای متعددی استفاده میشود که مهمترین آنها را در زیر آوردهایم.
هیدروژناسیون کاتالیزوری متانول چیست ؟
«هیدروژناسیون کاتالیزوری» (Catalytic Hydrogenation) یکی از قدیمیترین و سنتیترین روشهایی است که میتوان برای تولید متانول از آن استفاده کرد. در این واکنش کربن مونوکسید در حضور کاتالیزور روی اکسید و کروم اکسید $$(ZnO-Cr_2O_3)$$ تحت شرایط فشار و دمای بالا، هیدروژنه میشود.
$$ CO+ 2H^+_2 \rightarrow CH_3OH $$
در این روش از زغال، روغن و گاز طبیعی بهعنوان منبعی از مونوکسید استفاده میشد. این روش دوستدار طبیعت نیست و مخازن انرژیهای تجدیدناپذیر را کاهش میدهد. به همین دلیل این روش با روش دیگری که دوستدار طبیعت است، جایگزین شد. به این روش جدید تهیه متانول پاک گفته میشود و از زبالههای شهری، صنعتی و کشاورزی بهعنوان منبعی برای کربن مونوکسید استفاده میکند. روشی دیگر برای تهیه متانول، استفاده از کربن دیاکسید به دست آمده توسط همین زبالهها و ضایعات است.
راکتور زیستی تجاری
امروزه متانول در مقیاس صنعتی در راکتورهای بزرگی با «بستر پرشده» (Fixed Bed) تولید میشود که در دمای بالا، حدود ۵۵۰ تا ۵۷۵ درجه سانتیگراد و فشار بالا، حدود ۱۰۰ اتمسفر، عمل میکند. در این راکتور از اکسید مس و اکسید روی پوشش داده شده با آلومینا بهعنوان کاتالیزور استفاده میشود. با این حال فرآیندی که در این راکتور منجر به تولید متانول میشود، همچنان مشخص نیست و تنها حدسیات و فرضیاتی در مورد آن وجود دارد.
روش تولید بیوشیمیایی متانول چیست ؟
این روش یکی از ارزانترین و قدیمیترین روشهایی است که همچنان از آن برای تولید متانول استفاده میشود. آنزیمهای خاصی مانند «متان مونواکسیژناز» (Metahen Monooxygenases) میتوانند طی واکنشی کاتالیزوری، متان را به متانول تبدیل کنند. این آنزیمها اکسیژناز هستند و عملکرد پیچیدهای برای این کار دارند. تولید متانول توسط اکسیژناز همراه تشکیل محصولاتی جانبی مانند آب و $$NAD^+$$ است اما میتوان آن ها را به راحتی و در مراحل نهایی جدا کرد تا به متانول خالص دسترسی داشته باشیم. واکنش بیوشیمیایی تولید متانول از گاز متان به کمک کاتالیزور را میتوان بهصورت زیر نمایش داد.
$$ CH_4 + O_2 + NADPH + H^ + \rightarrow CH_3OH + H_2O + NAD^+ $$
«رابرت بویل» (Robert Boyle) اولین فردی بود که در سال ۱۶۶۱ توانست این ماده را جدا کند. او توانست با تقطیر «چوب شمشاد» (Boxwood) به متانول دست پیدا کند. گرچه امروزه این ماده بهصورت صنعتی و در آزمایشگاهها تولید میشود. در این فرآيند گاز کربن مونوکسید را در حضور یک کاتالیزور در مجاورت هیدروژن قرار میدهند.
تاریخچه متانول
تا اینجا دانستیم که متانول چیست و چگونه تولید میشود. در ادامه میخواهیم در مورد تاریخچه این ماده باارزش و پرکاربرد صحبت کنیم. مصریان باستان در فرآیند مومیایی کردن اجساد از ترکیبی از مواد استفاده میکردند که متانول نیز یکی از آنها بود. این متانول از «تجزیه حرارتی» (Pyrolysis) چوب به دست میآمد. همانطور که پیشتر گفتیم این ماده یهصورت خالص و برای اولین بار در سال ۱۶۶۱ توسط رابرت بویل به دست آمد.

سپس در سال ۱۹۰۵ میلادی شیمیدانی فرانسوی به نام «پل ساباتیه» (Paul Sabatier) اولین واکنش سنتزی برای به دست آوردن متانول را معرفی کرد. اون پیشنهاد داد که از واکنش بین کربن دیاکسید و هیدروژن میتوان به متانول دست پیدا کرد. سپس در سالهای بعدی نیز دانشمندان توانستد روشهای بهتر و جدیدتری را پیشنهاد دهند و با تغییر شرایط واکنشهای موجود به بهینهسازی آنها کمک کنند.
طی جنگ جهانی دوم، در موشکهای ارتش آلمان بهعنوان سوخت به همراه «هیدرازین» (Hydrazine) کاربرد داشت. همچنین در دوره بحران نفت در ۱۹۷۰ میلادی استفاده از متانول به عنوان سوخت خودرو رواج پیدا کرد. در سال ۱۹۹۰ میلادی بیش از ۲۰۰۰۰ «وسیله نقلیه منعطف در سوخت» (Flexible Fuel Vehicles) در ایالات متحده آمریکا به بازار عرضه شدند که توانایی حرکت با متانول و بنزین را داشتند. همچنین در این دوره در سوخت بنزین نیز مقدار اندکی از متانول وجود داشت. با این حال طی سالهای بعد به دلیل افزایش هزینه متانول، رفتهرفته علاقمندی به آن از بین رفت و خودروهای بیشتری با قابلیت استفاده از متانول بهعنوان سوخت تولید نشدند.
سپس در سال ۱۸۳۴ میلادی، دو شیمیدان فرانسوی به نامهای «ژان بتیست دوما» (Jean Baptiste Andre Dumas) و «یوجین پلیگوت» (Eugene MElchior Peligot) توانستند به عنصرهای سازنده این الکل پی ببرند. در سال ۱۸۹۲ میلادی نام متانول توسط «کنفرانس بینالمللی نامگذاری ترکیبات شیمی» (International Conference On CHemical Nomenclature) به این ماده نسبت داده شد
مثال و تمرین از متانول
حال که میدانیم متانول چیست و با روش تولید آن نیز آشنا شدیم، میخواهیم در ادامه تعدادی مثال و تمرین را مورد بررسی قرار دهیم.
مثال از متانول
در این بخش تعدادی مثال را به همراه پاسخ تشریحی آنها مرور خواهیم کرد. توجه به این سوالها باعث تثبیت و افزایش عمق آموخته ما خواهد شد.
مثال اول
اهمیت متانول در چیست؟
پاسخ
در بسیاری از سنتزهای شیمیایی وجود متانول خالص لازم است. همچنین این ماده به دلیل داشتن عدد اکتان بالا، میتواند باعث تمیز شدت سوخت در اتومبیل شود و از این نظر افزودنی بسیار مهمی به حساب میآيد. از متانول به دست آمده از چوب برای تهیه اتیل الکل سنتزی استفاده میشود.
مثال دوم
چرا متانول خطرناک است؟
پاسخ
این ماده بهشدت اشتعالپذیر و سمی است. اگر فردی بیش از ۱۰ میلیلیتر از متانول را قورت دهد، امکان نابینایی دائمی وی وجود دارد، زیرا متانول باعث آسیب به سیستم عصبی بینایی میشود. همچنین میتواند به «سیستم اعصاب مرکزی» (Central Nervous System) نیز آسیب وارد کند و باعث ایجاد کما و حتی مرگ شود. توجه داشته باشید که این خطرها در زمان استنشاق بخارهای متانول به میزان بالا نیز وجود دارد.
مثال سوم
متانول در چه محصولاتی وجود دارد؟
پاسخ
متانول در محصولاتی مانند ضدیخ، شیشه پاککن و «تینر» (Paint Thinner) وجود دارد.
مثال چهارم
متانول چه بویی دارد؟
پاسخ
متانول مادهای بیرنگ، اشتعالپذیر و فرار است. این ماده بویی نزدیک به اتانول (الکل قابل نوشیدن) دارد.
مثال پنجم
متانول اسید است یا باز؟
پاسخ
متانول هم اسید و هم باز است. طبق تعریف «لوری برونستد» (Bronsted Lowry)، اسید مادهای است که دهنده پروتون باشد. همچنین هر مادهای که پذیرنده الکترون باشد نیز در این تعریف به دسته بازها تعلق دارد. متانول دهنده پروتون است زیرا پروتون هیدروکسیل خود را به بازهای قوی مانند سدیم هیدروکسید میدهد.
حل تمرین از متانول
در این بخش به بررسی و مرور تعدادی تمرین چندگزینهای میپردازیم. در مواردی که نیاز باشد، پاسخ تشریحی آنها را نیز آوردهایم.
تمرین اول
جرم مولکولی متانول در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
۳۲ گرم بر مول
۳۱ گرم بر مول
۲۸ گرم بر مول
۳۴ گرم بر مول
تمرین دوم
کدام یک از گزینههای زیر در واکنش جانبی در تهیه متانول به وجود نمیآیند؟
متان
اکسیژن
کربن دیاکسید
آب
تمرین سوم
نسبت مولی هیدروژن به کربن دیاکسید در واکنش هیدروژناسیون کاتالیزوری کربن مونوکسید در کدام گزینه بهصورت صحیح آورده شده است؟
۱٫۲۵
۲٫۲۵
۳٫۲۵
۴٫۲۵
تمرین چهارم
واکنشدهندهای که برای حذف کتونها و آلدهیدها در متانول مایع استفاده میشود، چه نام دارد؟
منگنات
کرومات
دیکرومات
پرمنگنات
تمرین پنجم
متانول یک ... است.
مایع زرد رنگ
مایع قهوهای رنگ
مایع بیرنگ
مایع آبی رنگ
تمرین ششم
ویژگیهای متانول در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
بیرنگ، فرار، سمی و امتزاجپذیر
بیرنگ، فرار، غیر سمی و امتزاجپذیر
بیرنگ، فرار، سمی و غیر امتزاجپذیر
بیرنگ، غیرفرار، سمی و امتزاجپذیر
تمرین هفتم
به تصویر زیر نگاه کنید و بگویید چرا نقطه جوش متانول از متیل تیول بیشتر است؟
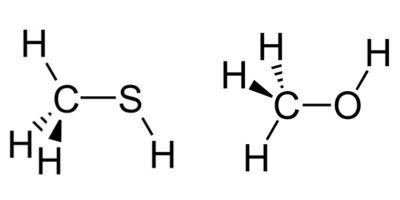
در متانول پیوند هیدروژنی درون مولکولی وجود دارد اما در متان تیول پیوند هیدروژنی از نوع بین مولکولی است.
در متانول پیوند هیدروژنی بین مولکولی وجود دارد اما متان تیول فاقد پیوند هیدروژنی است.
در متانول پیوند هیدروژنی درون مولکولی وجود دارد اما متان تیول پیوند فاقد هیدروژنی است.
متانول فاقد پیوند هیدروژنی در ساختار خود است اما متان تیول پیوند هیدروژنی درون مولکولی وجود دارد.
تمرین هشتم
دو نمونه داریم که آنها را با نمونه ۱ و نمونه ۲ مجزا کردهایم. نمونه ۱ شامل متانول و نمونه دو شامل اتانول است. هر دو این نمونهها را در ظرفی دربسته و با شرایط یکسان، تحت حرارت قرار میدهیم. در این صورت کدام یک از گزینههای زیر در مورد آنها صدق میکند؟
در دمای ۶۰ درجه سانتیگراد، محتویات نمونه ۱ و نمونه ۲، هر دو بهصورت مایع هستند.
در دمای ۸۰ درجه سانتیگراد، محتویات نمونه ۱ و نمونه ۲، شامل بخار هستند.
در دمای ۷۰ درجه سانتیگراد، محتویات نمونه ۱ بهصورت مایع است اما در نمونه ۲، بخار مشاهده میشود.
هر سه گزینه فوق صحیح هستند.
سوالات متدوال
حال که میدانیم متانول چیست و چه کاربردهایی دارد، میخواهیم به برخی از مهمترین و پرتکرارترین سوالهای موجود پیرامون آن بپردازیم.
سادهترین عضو خانواده الکلها چه نام دارد؟
متانول با ۲ اتم کربن، سادهترین الکل است.
الکلها چه گروه عاملی دارند؟
ویژگی مشترک الکلها داشتن گروه هیدروکسی در ساختار آنها است.
متانول، الکل نوع چند است؟
گروه هیدروکسیلی در متانول به کربنی متصل است که با تنها یک اتم کربن دیگر پیوند دارد. به همین دلیل متانول، الکل نوع اول به حساب میآید.
چرخه کاتیوا چیست؟
طی چرخه کاتالیزوری کاتیوا، استیک اسید از متانول به دست میآيد.
چرا متانول برای انسان خطرناک است؟
در صورتی که مقدار این ماده در بدن انسان از حدی بیشتر شود، با آسیب به سیستم عصبی بدن، ابتدا بر بینایی اثر میگذارد و میتواند در ادامه باعث ایجاد کما و حتی مرگ شود.
جمعبندی
هدف از این مطلب مجله فرادرس این بود که بدانیم متانول چیست و چه کاربردهایی دارد. همچنین در ادامه با روش نامگذاری این سادهترین عضو از خانواده الکلها، ویژگیهای شیمیایی و فیزیکی و کاربردهای آن آشنا شدیم. در نهایت نیز مروری بر واکنشهای شیمیایی متانول و کاربردهای آن داشتیم. سپس با بررسی تعدادی مثال چگونگی به درک خود، عمق بخشیدیم.











سلام.
دقیقا جمله اول مقدمه اشتباهی شده.
گفته متانول دو اتم کربن داره
درحالی که اشتباه هست و یک اتم کربن دارد.
با تشکر
سلام و روز شما بهخیر؛
ممنونیم از دقت نظر شما دوست عزیز. متن بازبینی و اصلاح شد.
خوشحالیم که با مجله فرادرس همراه هستید.