آلکان ها — از صفر تا صد
آلکانها ترکیبات آلی شامل اتمهای کربن با پیوند یگانه کربن-هیدروژن و بدون هیچ گروه عاملی هستند. فرمول آلکان ها به صورت $$C_nH_{2n+2}$$ نوشته میشود و به سه گروه آلکان با زنجیره خطی، شاخهدار و سیکلوآلکان (آلکان حلقوی) تقسیم میشوند. همچنین، این مواد آلی از جمله هیدروکربنهای سیرشده (اشباع) به شمار میآیند و کمترین واکنشپذیری را بین هیدروکربنها دارند و به لحاظ اقتصادی نیز اهمیت بسیاری دارند. علاوه بر این، از اجزای اصلی سوخت و روانکنندههای نفتی هستند و به وفور در شیمی آلی بکار گرفته میشوند. در نتیجه، از آلکان های خالص همچون هگزان، میتوان در نقش حلال بهره گرفت.
از جمله خصوصیاتی که یک آلکان را از سایر ترکیبات متمایز میکند، اشباع بودن آن است. در حقیقت، هیچ نوع پیوند دوگانه یا سهگانهای را در آنها نمیتوان پیدا کرد. به همین دلیل، این مواد واکنشپذیری بسیار پایینی دارند.
مقدمه
هیدروکربنهای اشباعی که شاخهدار نباشند، به «آلکانهای نرمال» (Normal Alkanes) موسوماند. نام و فرمول هیدروکربنی در آلکان نرمال در جدول زیر آورده شده است. پسوند «-ان»، نشاندهنده یک آلکان است.
| تعداد اتم کربن | نام آلکان | فرمول مولکولی |
| 1 | متان | $$\mathrm{CH}_{4}$$ |
| 2 | اتان | $$\mathrm{C}_{2} \mathrm{H}_{6}$$ |
| 3 | پروپان | $$\mathrm{C}_{3} \mathrm{H}_{8}$$ |
| 4 | بوتان | $$\mathrm{C}_{4} \mathrm{H}_{10}$$ |
| 5 | پنتان | $$\mathrm{C}_{5} \mathrm{H}_{12}$$ |
| 6 | هگزان | $$\mathrm{C}_{6} \mathrm{H}_{14}$$ |
| 7 | هپتان | $$\mathrm{C}_{7} \mathrm{H}_{16}$$ |
| 8 | اوکتان | $$\mathrm{C}_{8} \mathrm{H}_{18}$$ |
| 9 | نونان | $$\mathrm{C}_{9} \mathrm{H}_{20}$$ |
| 10 | دکان | $$\mathrm{C}_{10} \mathrm{H}_{22}$$ |
آلکان شاخهدار
هیدروکربنهای اشباعی که در آنها، یک گروه کربنی یا بیشتر به اتم کربن دیگری متصل شدهاند را آلکان شاخهدار مینامند. به اتم کربنی که به سه یا چهار اتم کربن دیگر متصل باشد، «نقطه انشعاب» (Branching Point) میگویند.
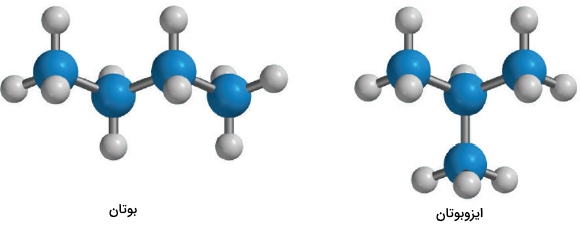
اتم کربنی که به زنجیره کربنی در نقطه انشعاب متصل باشد، بخشی از یک گروه آلکیل است. به طور مثال، ایزوبوتان، سادهترین نمونه از یک آلکان شاخهدار است که سه اتم کربن در زنجیر اصلی و یک شاخه با نام گروه $$-CH_3$$ دارد. در تصویر زیر، مدل گلوله و میله بوتان و ایزوبوتان را مشاهده میکنید.
ایزوپنتان و نئوپنتان، ایزومرهای پنتان هستند. ایزوپنتان نوعی آلکان شاخهدار با چهار اتم کربن در زنجیره اصلی و یک گروه متیل است. نئوپنتان، سه اتم کربن در زنجیر اصلی و دو گروه متیل متصل به اتم کربن مرکزی دارد.
دستهبندی اتمهای کربن
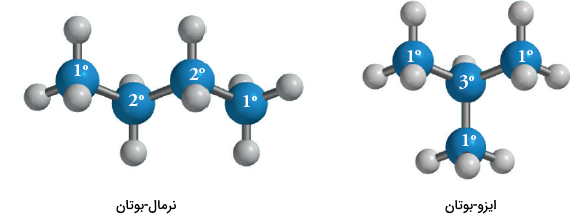
ساختار هیدروکربنها را بر اساس تعداد اتم کربن متصل به نوع خاصی از اتم کربن، دستهبندی میکنند. اتم کربنی که به تنها یک اتم کربن دیگر متصل باشد، «اتم کربن نوع اول» (Primary Carbon Atom) میگویند و آن را به صورت $$1^circ$$ نشان میدهند. اتمهای کربن در دو سر زنجیر کربنی از نوع اول هستند. به طور مثال، مولکول بوتان، دو اتم کربن نوع اول دارد. به همین ترتیب، اتم کربنی که به دو اتم کربن دیگر متصل باشد، کربن نوع دوم نام دارد. به طور مثال، اتم کربن میانی در بوتان از نوع دوم است.
به طور مشابه، به اتم کربنی که به ۳ اتم کربن دیگر متصل باشد، کربن نوع سوم میگویند و آن را به صورت $$3 ^ \circ$$ نشان میدهند. به طور مثال، زمانی که ساختار ایزو بوتان را بررسی میکنیم، میبینیم که یکی از اتمها از نوع سوم و سهاتم دیگر از نوع اول هستند. به همین شکل نیز میتوان اتم نوع چهارم را تعریف کرد و آن را به صورت $$4 ^ \circ$$ نشان داد.
ایزومرها
آلکانهایی که بیش از سه اتم کربن داشته باشند، آرایشهای مختلفی خواهند داشت و سبب بوجود آمدن «ایزومرهای ساختاری» (Structural Isomers) میشوند. سادهترین ایزومر یک آلکان، به گونهای است که در آن، اتم کربن در یک زنجیر و بدون شاخه حضور داشته باشد.
خواص فیزیکی آلکانها
تمامی آلکانها بیرنگ هستند. آلکانهایی با جرم مولکولی کم به صورت گاز هستند. بقیه آلکانها بسته به جرم مولکولی به صورت مایع و «موم» (Wax) وجود دارند. در جدول زیر، خواص فیزیکی آلکانها به طور خلاصه آورده شده است.
| نام آلکان | نقطه جوش (درجه سانتیگراد) | نقطه ذوب (درجه سانتیگراد) | چگالی $$(kg/ m^3)$$ |
| متان | $$-162$$ | $$-182$$ | $$0.656$$ |
| اتان | $$-89$$ | $$-183$$ | $$1.26$$ |
| پروپان | $$-42$$ | $$-188$$ | $$2.01$$ |
| بوتان | $$0$$ | $$-138$$ | $$2.48$$ |
| پنتان | $$36$$ | $$-130$$ | $$626$$ |
| هگزان | $$69$$ | $$-95$$ | $$659$$ |
| هپتان | $$98$$ | $$-91$$ | $$684$$ |
| اوکتان | $$126$$ | $$-57$$ | $$703$$ |
| نونان | $$151$$ | $$-54$$ | $$718$$ |
| دکان | $$174$$ | $$-30$$ | $$730$$ |
هدایت الکتریکی و انحلالپذیری
آلکانها رسانای الکتریکی نیستند و همچنین، در یک میدان الکتریکی، پولاریزه نمیشوند. به همین دلیل، پیوندهای هیدروژنی تشکیل نمیدهند و در حلالهای قطبی همچون آب، انحلالپذیر نیستند. از آنجایی که پیوند هیدروژنی در مولکولهای آب، خارج از مولکولهای یک آلکان اتفاق میافتد، در نتیجه، حضور همزمان یک آلکان و آب در کنار یکدیگر، کاهش آنتروپی را به همراه دارد. با توجه به اینکه پیوندی بین مولکولهای آب و آلکان روی نمیدهد، قانون اول ترمودینامیک پیشنهاد میکند که برای به حداقل رساندن کاهش آنتروپی، باید تماس آلکان و آب، محدود شود.
البته انحلالپذیری این مواد در حلالهای ناقطبی زیاد است که به این خاصیت «چربی دوستی» (Lipophilicity) میگویند. لازم به ذکر است که آلکانهای مختلف، به هر نسبتی با یکدیگر امتزاجپذیرند.
خواص شیمیایی آلکانها
آلکانها در بین ترکیبات شیمیایی، واکنشپذیری کمی دارند. مقادیر ثابت تفکیک اسید $$(pK_a)$$ برای آلکانها بین ۵۰-70 تخمین زده شده است. بنابراین، این مواد، اسیدهای ضعیفی هستند که در برابر بازها، حالتی خنثی دارند. رادیکالهای آزاد، نقش مهمی را در بیشتر واکنشهای آلکانها همچون «کراکینگ» (Cracking) و «ریفرمینگ» (Reforming) دارند. در این نوع از واکنشها، زنجیره طویل آلکانها به زنجیرههای کوتاهتر و آلکانهای راستزنجیر، به آلکانهای شاخهدار تبدیل میشوند.
واکنشهای آلکان
در ادامه قصد داریم تا در خصوص واکنشهای آلکانها بحث کنیم.
واکنش آلکان با اکسیژن (واکنش سوختن)
تمامی آلکانها در واکنشی تحت عنوان واکنش احتراق، با اکسیژن واکنش میدهند. با وجود اینکه با افزایش تعداد اتمهای کربن، سوزاندن این مواد نیز دشوارتر میشود، رابطه کلی برای واکنش کامل سوختن آلکان را میتوان به صورت یکی از دو واکنش زیر نشان داد:
$$\begin{aligned}
&\;mathrm{C}_{n} \mathrm{H}_{2 n+2}+left(\frac{3}{2} n+frac{1}{2}\right) \mathrm{O}_{2} \rightarrow(n+1) \mathrm{H}_{2} \mathrm{O}+n \mathrm{CO}_{2}\
&\;text { } \mathrm{C}_{n} \mathrm{H}_{2 n+2}+left(\frac{3 n+1}{2}\right) \mathrm{O}_{2} \rightarrow(n+1) \mathrm{H}_{2} \mathrm{O}+n \mathrm{CO}_{2}
\end{aligned}$$
در صورت عدم وجود اکسیژن کافی، مونواکسید کربن یا حتی دوده تولید خواهد شد و رابطه آن به شکل زیر است:
$$\begin{aligned}
&\;mathrm{C}_{n} \mathrm{H}_{2 n+2}+left(n+frac{1}{2}\right) \mathrm{O}_{2} \rightarrow(n+1) \mathrm{H}_{2} \mathrm{O}+n \mathrm{CO}\
&\;mathrm{C}_{n} \mathrm{H}_{2 n+2}+left(\frac{1}{2} n+frac{1}{2}\right) \mathrm{O}_{2} \rightarrow(n+1) \mathrm{H}_{2} \mathrm{O}+n \mathrm{C}
\end{aligned}$$
به طور مثال، در مورد متان خواهیم داشت:
$$\begin{aligned}
&\;2 \mathrm{CH}_{4}+3 \mathrm{O}_{2} \rightarrow 2 \mathrm{CO}+4 \mathrm{H}_{2} \mathrm{O}\
&\;mathrm{CH}_{4}+frac{3}{2} \mathrm{O}_{2} \rightarrow \mathrm{CO}+2 \mathrm{H}_{2} \mathrm{O}
\end{aligned}$$
واکنش آلکان با هالوژنها
آلکانها و هالوژنها در واکنشهایی تحت عنوان «واکنش هالوژناسیون رادیکال آزاد» (Free Radical Halogenation Reaction) شرکت میکنند. اتم هیدروژن در آلکانها به شدت با هالوژنها جایگزین میشود. این نوع از واکنشها به شدت گرماده هستند و به صورت انفجاری واکنش میدهند.
آزمایشها نشان داده است که فرآیند هالوژناسیون، مخلوطی از ایزومرها را بوجود میآورد که نشان میدهد در این نوع از واکنشها، تمامی اتمهای هیدروژن در معرض واکنش قرار دارند.
کراکینگ
همانطور که پیشتر نیز توضیح داده شد، فرآیند کراکینگ، مولکولهای درشت را به مولکولهای کوچکتر تقسیم میکند. کراکینگ را میتوان به صورت حرارتی یا کاتالیستی انجام داد.
ایزومریزاسیون و ریفرمینگ
ایزومریزاسیون (ایزومریشدن)، فرآیندی است که آلکانهای راستزنجیر، در حضور کاتالیزور پلاتین و حرارت، به آلکانهای شاخهدار تبدیل میشوند. در فرآیند ریفرمینگ، آلکانها به سیکلوآلکان یا هیدروکربنهای آروماتیک تبدیل خواهند شد. این واکنشها، هردو، عدد اکتان ماده مورد نظر را افزایش میدهند. بوتان از جمله آلکانهایی است که در فرآیند ایزومریزاسیون شرکت میکند چراکه آلکانهای شاخهدار زیادی با عدد اکتان بالا بوجود میآورد.
سایر واکنشها در آلکان
آلکان در حضور کاتالیزور نیکل، با بخار واکنش میدهند و هیدروژن تولید میکنند. همچنین، آلکانها با شرکت در فرآیندهای تخمیری، به کربوکسیلیک اسید تبدیل میشوند.
نامگذاری آلکانها
بسیاری از آلکانها به صورت ایزومر وجود دارند. برای بوتان با فرمول $$C _ 4 H _ {10}$$، دو ایزومر با نامهای بوتان و ایزو بوتان ذکر میشود. همچنین برای پنتان، سه ایزومر پنتان، ایزوپنتان و نئوپنتان وجود دارد. با افزایش تعداد اتمهای کربن در آلکانها، تعداد ایزومرهای آنها به صورت یک تصاعد هندسی افزایش مییابند. بسیاری از ایزومرهای محتمل حتی در نفت خام نیز دیده نشدهاند اما میتوان آنها را به صورت آزمایشگاهی تولید کرد. در نتیجه باید با یک روش مشخص، نامگذاری آلکانها را انجام داد.
قوانین آیوپاک برای نامگذاری آلکانها
با استفاده از قوانین نامگذاری آیوپاک، هر ترکیب شیمیایی، نامی منحصر به فرد خواهد داشت. نامگذاری آیوپاک شامل سه بخش پیشوند، والد و پسوند میشود.
والد، طولانیترین زنجیر کربنی در مولکول است که شامل گروه عاملی باشد. پسوند، در بیشتر ترکیبات آلی، نوع گروه عاملی را مشخص میکند. به طور مثال، یک والد آلکان، پسوند «-ان» دارد. برخی از گروههای عاملی همچون هالوژنها را با پیشوند نشان میدهند. به طور مثال، پیشوندهای کلرو و برومو بیانگر اتمهای کلر و برم هستند.
پیشوندها همچنین نوع و محل هرکدام از شاخههای گروههای آلکیل را نیز مشخص میکنند. به آلکانی که یک اتم هیدروژن از دست داده باشد، گروه آلکیل میگویند. برای نامیدن گروههای آلکیلی، کافی است تا پسوند «-ان» متناظر با آلکان را با «-یل» عوض کنید. به طور مثال، نام والد در $$CH_4$$، متان و $$CH_3$$ یک گروه آلکیل موسوم به متیل است. به همین ترتیب، نام والد $$C_2H_6$$ را اتان و $$CH_3CH_2$$ را گروه اتیل مینامند. به طور کلی، گروههای آلکیل را به صورت $$R-$$ نشان میدهند.
قوانین آیوپاک برای نامگذاری آلکانها به شرح زیر است:
مرحله اول: طولانیترین زنجیر پیوسته کربنی را به عنوان والد در نظر میگیرند. به طور مثال در شکل زیر، والد، زنجیر کربنی با پنج اتم کربن است.
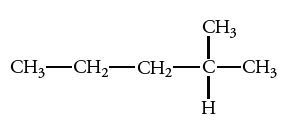
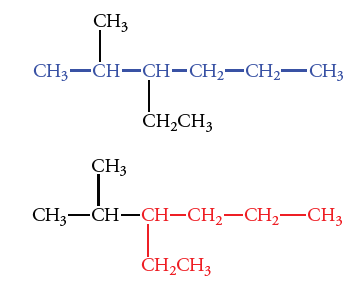
اگر دو زنجیر والد محتمل داشته باشیم که تعداد اتم کربن یکسانی داشته باشند، زنجیر والد، آن زنجیری است که نقطه انشعاب بیشتری داشته باشد. به طور مثال در تصویر زیر، زنجیر کربنی که با رنگ قرمز نشان داده میشود، ۶ اتم کربن و یک شاخه دارد اما در زنجیر کربن آبی، ۶ اتم کربن با دوشاخه متیل و اتیل داریم، در نتیجه، بخش آبیرنگ را به عنوان والد در نظر میگیریم.
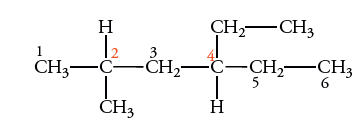
مرحله دوم: اتمهای کربن را شمارهگذاری میکنیم. شمارهگذاری را برای طولانیترین زنجیر پیوسته کربنی انجام میدهیم و آنرا از سمتی آغاز میکنیم که به اولین شاخه، نزدیکتر باشد. در تصویر زیر، زنجیر والد، شش اتم کربن دارد، در نتیجه، مولکول، یک هگزان با دو شاخه است: یک گروه متیل در C-2 و یک گروه اتیل در C-4
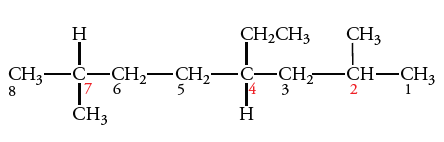
اگر شماره اتم کربنی که به اولین شاخه میرسد، از هر دو طرف یکسان بود، شمارهگذاری را از سمتی شروع میکنیم که به شاخه دوم نزدیکتر باشد. در تصویر زیر، زنجیر والد، هشت اتم کربن دارد. از هر دو طرف، عدد ۲ به شاخه اول میرسد. اما اگر شمارهگذاری را از سمت راست آغاز کنیم، به شاخه دوم، عدد ۴ اختصاص پیدا میکند. این مولکول، دوگروه متیل در C-2 و C-7 و یک گروه اتیل در C-4 دارد.
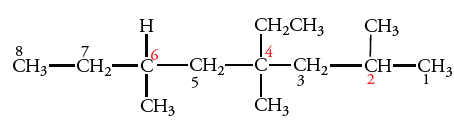
مرحله سوم: هر شاخه یا گروه جانشین (استخلافی)، شمارهای دارد که بیانگر محل آن در زنجیر والد است و این گروهها هرکدام، عدد مربوط به خود را خواهند داشت. به طور مثال در تصویر زیر، اکتان، ۳ گروه متیل در C-2، C-4 و C-6 و یگ گروه اتیل در C-4 دارد.
مرحله چهارم: بعد از اتمام شمارهگذاری، عددی که به هر گروه آلکیل اختصاص پیدا کرده است را بلافاصله قبل از نام گروه به همراه یک خط تیره ذکر میکنیم. گروههای آلکیل و هالوژن را به ترتیب حروف الفبا مینویسیم. در تصویر زیر، نام ترکیب، ۴-اتیل-۲-متیل هگزان است و نباید آنرا به صورت ۲-متیل-۴-اتیل هگزان بنویسیم.
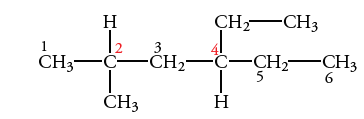
اگر در هر مولکول، دو گروه یا بیشتر به زنجیر اصلی کربن متصل باشند، آنها را با پسوندهای دی، تری، تترا و ... نشان میدهیم. اعدادی که محل شاخهها را نشان میدهند نیز با حرف «و» (در انگلیسی با «,») آنرا نشان می دهیم. تصویر زیر، مولکول ۲و۴-دیمتیل هگزان را نشان میدهد.
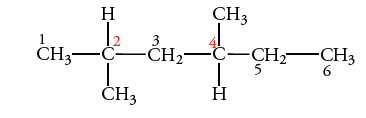
مرحله پنجم: توجه داشته باشید که پسوندهای دی، تری، تترا و ...، ترتیب الفبایی گروههای آلکیل را تغییر نمیدهند. نام مولکول تصویر زیر، ۵-اتیل-۲و۵-دیمتیل اوکتان است و نباید آن را به صورت ۳و۴-دیمتیل-۵اتیل اوکتان نوشت.
گروههای آلکیل
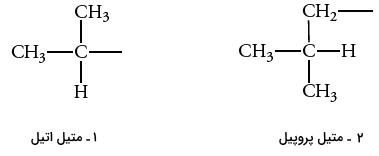
تنها یک گروه آلکیل وجود دارد که از متان و اتاق مشتق میشود. البته در زنجیرههای طولانیتر کربنی، چندین گروه ایزومری آلکیل تشکیل میشوند. بسیاری از این گروههای آلکیلی، نام معمول خود را دارند. به طور مثال، پروپان، دو اتم کربن نوع اول و یک اتم کربن نوع دوم دارد. اگر کربن نوع اول، اتم هیدروژن از دست بدهد، آلکیل نوع اول به نام پروپیل تولید میشود.
به پروپیل و آلکیلهای نوع اول دیگری که از آلکانهای نرمال بدست میآیند، گروههای آلکیل نرمال میگویند. عبارت «نرمال» (Normal) بیانگر این است که آلکان موردنظر، شاخهدار نیست. اگر کربن نوع دوم، یک هیدروژن از دست بدهد، گروه آلکیلی به نام گروه ایزوپروپیل تشکیل خواهد شد. پروپیل و ایزو پروپیل را به ترتیب با نمادهای n-Pr و i-Pr نشان میدهند.
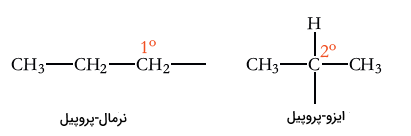
گروههای آلکیلی متعددی را میتوان از دو ایزومر بوتان بدست آورد. فرمول این گروههای آلکیل به صورت $$C_4H_9$$ است. دو گروه آلکیل از بوتان و دو گروه از ایزو-بوتان مشتق میشوند. اگر کربن نوع اول بوتان، هیدروژن از دست بدهد، یگ گروه «ان-بوتیل» (n-butyl) بدست میآید. اگر اتم کربن نوع دوم بوتان، هیدروژن از دست بدهد، گروه آلکیل «سک-بوتیل» (sec-butyl) تشکیل خواهد شد.
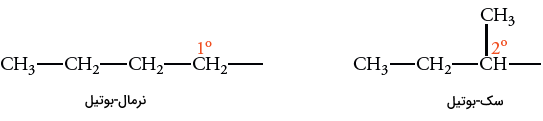
اگر کربن نوع اول ایزوبوتان، هیدروژن از دست بدهد، گروه آلکیل موسوم به ایزو-بوتیل تشکیل خواهد شد. اگر از کربن نوع سوم ایزوبوتان، هیدروژن کم کنیم، گروه آلکیل «ترت-بوتیل» (tert-butyl) تولید میشود. بنابراین، چهار گروه ایزومری آلکیل $$C_4H_9$$ به نامهای نرمال-بوتیل، سک-بوتیل، ایزو-بوتیل و ترت-بوتیل خواهیم داشت.
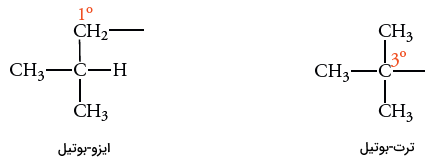
نامگذاری گروههای آلکیل
برای نامگذاری گروههای آلکیل، به همان ترتیب آیوپاک عمل و شمارهگذاری زنجیر پیوسته کربنی را از نقطه انشعاب آغاز میکنیم. به طور مثال، نام آیوپاک برای یک گروه ایزوپروپیل را به صورت ۱-متیلاتیل و برای یک گروه ایزوبوتیل به صورت ۲-متیلپروپیل نشان میدهند. توجه داشته باشید که محل اتصال گروه آلکیل را کربن ۱ مینامند.
گروههای آلکیل پیچیده را به هنگام نامگذاری هیدروکربنها در داخل پرانتز قرار میدهند. در نتیجه، ۴-ایزوپروپیل هپتان را به صورت ۴-(۱-متیلاتیل) هپتان نیز نشان میدهند.
مثال ۱
ترکیب زیر را نامگذاری کنید:
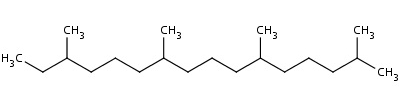
طولانیترین زنجیر پیوسته کربنی دارای ۱۶ اتم کربن است. شمارهگذاری را از سمت راست زنجیر آغاز میکنیم. در نهایت، ترکیب مورد نظر، ۲و۶و۱۰و۱۴-تترامتیل هگزادکان است.
مثال ۲
ترکیب زیر را نامگذاری کنید.
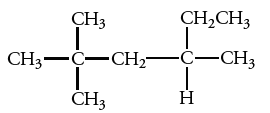
در ابتدا، طولانیترین زنجیر کربنی را پیدا میکنیم که در تصویر با رنگ قرمز نشان داده شده است. سه گروه متیل به والد متصل شدهاند. با شمارهگذاری از از چپ، دو گروه در C-3 و یک گروه در C-4 خواهیم داشت. بنابراین، ترکیب مورد نظر، ۳و۳و۴-تریمتیل هگزان است. توجه داشته باشید که اگر شمارهگذاری را از سمت راست انجام دهیم، نام ترکیب به صورت ۴و۴و۳تریمتیل هگزان خواهد بود که صحیح نیست زیرا مجموع $$3+3+4$$ کمتر از مجموع $$4+4+3$$ است.
کانفورماسیون آلکانها
از شیمی فضایی میدانیم که آرایش مختلف فضایی را که یک مولکول اختیار میکند، با نام «کانفورماسیون» (Conformation) یا صورتبندی میشناسند. به طور مثال، کانفورماسیون اتان از چرخش گروه $$CH_3$$ حول پیوند سیگما کربن-کربن پدید میآید. زمانی که گروه $$CH_3$$ حول پیوند کربن-کربن چرخش میکند. محل اتمهای هیدروژن نسبت به یکدیگر عوض میشود اما اتصال اتمها ثابت خواهد ماند. کانفورماسیونهای مختلف، شکلهای مختلفی دارند اما ایزومر ساختاری به شمار نمیآیند.
کانفورماسیون اتان
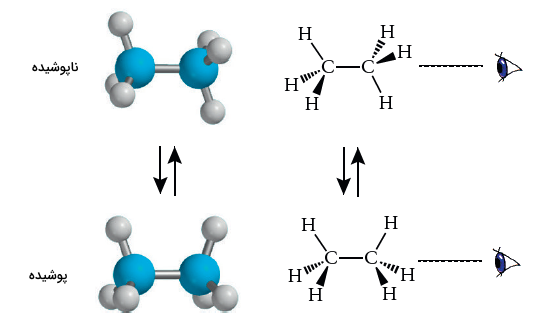
دَوران حول پیوند C-1 تا C-2، ایزومرهای کانفورماسیونی را بوجود میآورد که در تصویر زیر آورده شدهاند. در دو ساختار زیر، اتمهای هیدروژن، در حالت فضایی متفاوتی نسبت به دیگری قرار دارند. به این دو کانفورماسیون ایزومری، کانفورمر (همصورت) میگویند. از آنجایی که چنین ایزومرهای کانفورماسیونی از طریق دوران به یکدیگر تبدیل میشوند، به آنها «روتامر» (Rotamer) نیز میگویند.
اتان، در کانفورماسیونهای نامحدودی حضور دارد. کانفورماسیونی که در آن، اتم هیدروژن و الکترونهای پیوندی در دورترین فاصله از یکدیگر قرار داشته باشند، پایینترین انرژی را دارد. به این نوع از کانفورماسیون، «ناپوشیده» (Staggered) میگویند. کانفورماسیونی که در آن، اتمهای هیدروژن، در نزدیکی هم قرار گرفته باشند، بیشترین انرژی را دارند و موسوم به کانفورماسیون «پوشیده» (Eclipsed) هستند. در کانفورماسیون پوشیده، هر پیوند کربن-هیدروژن در یک اتم کربن، با پیوند اتم کربن دیگر، در یک راستا قرار دارد.
فرم نیومن
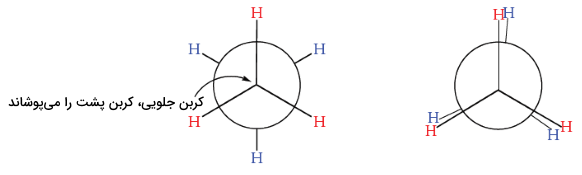
«فرم نیومن» (Newman Projection Formulas) در ساختارها بر دو اتم کربنی تمرکز دارد که چرخش، حول آن صورت میگیرد. اتم «روبرو» (Front)، از طریق نقطه با سه پیوند نشان داده میشود. اتم «پشتی» (Back)، به کمک یک دایره و خطوط متصل به محیط آن مشخص خواهد شد. باوجود اینکه پیوندی نیز بین دو اتم کربن برقرار است، اما این پیوند به توجه به اینکه در راستای چشم ناظر قرار دارد، دیده نمیشود و به نوعی مخفی شده است.
با توجه به اینکه در کانفورماسیون پوشیده، پیوندهای اتم پشتی دیده نمیشوند، با کمی تغییر در زاویه ناظر میتوان پیوندهای اتم پشتی را نیز مشاهده کرد. نحوه نمایش کانفورماسیون اتان را به فرم نیومن در زیر مشاهده میکنید.
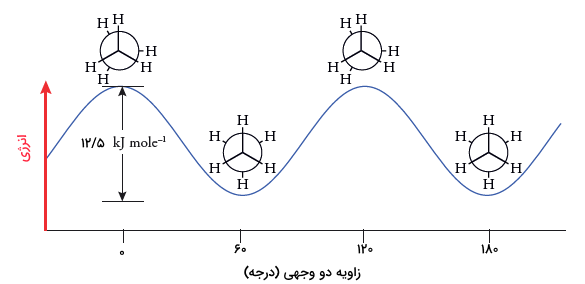
موانع چرخش در کانفورماسیون اتان
همانطور که گفته شد، کانفورماسیونها حول پیوند سیگما اتفاق میافتند. زمانی که کانفورماسیون پوشیده اتان به میزان ۶۰ درجه حول محور کربن-کربن دوران کند، کانفورماسیون ناپوشیده بوجود میآید. ادامه چرخش، به میزان ۶۰ درجه، کانفورماسیونی پوشیده، معادل با کانفورماسیون اول بدست میدهد. لازم به ذکر است که اختلاف انرژی بین کانفورماسیون پوشیده و ناپوشیده در حدود $$12.5 kJ mole^ {-1}$$ دارد.
به دلیلی وجود «فشار پیچشی» (Torsional Strain)، کانفورماسیون پوشیده انرژی بیشتری دارد. دلیل این امر، دافعه الکترونها در کانفورماسیون پوشیده است. بنابراین، مانع کوچکی در برابر چرخش وجود خواهد داشت.
اگر اختلاف انرژی کانفورماسیونهای پوشیده و ناپوشیده را بر ۳ تقسیم کنیم، به انرژی «برهمکنش پوشیده» (Eclipsing Interaction) هیدروژن-هیدروژن میرسیم که برابر با $$4.2 kJ mole^ {-1}$$ است. اختلاف انرژی بین این دو کانفورماسیون مقدار بسیار کمی دارد به گونهای که تبدیل کانفورماسیونها با سرعت زیاد در دمای اتاق انجام میشود. در نتیجه، چرخش حول محور $$C-C$$ در دمای اتاق به صورت آزاد و بدون محدودیت انجام خواهد شد.
کانفورماسیون پروپان
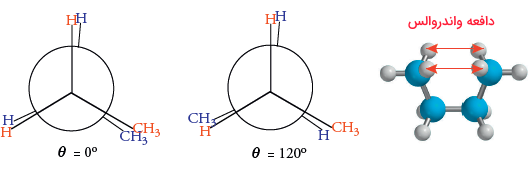
همانند اتان، کانفورماسیون پوشیده در بوتان نیز انرژی بیشتری دارد. این اختلاف انرژی برابر با $$13.8 kJ mole^ {-1}$$ است. کانفورماسیون پوشیده پروپان، دو برهمکنش پوشیده هیدروژن-هیدروژن و یک برهمکنش پوشیده هیدروژن-متیل دارد. از آنجایی که برهمکنش پوشیده هیدروژن-هیدروژن، $$4.2 kJ mole^ {-1}$$ است، نتیجه میگیریم که برهمکنش هیدروژن-متیل، مقداری برابر با $$5.4 kJ mole^ {-1}$$ دارد.
زمانی که دو یا چند اتم به یکدیگر فشرده شوند، همدیگر را دفع خواهند. در اثر این دفع، اتمها نیروی «دافعه واندروالس» (vander Waals Repulsion) را احساس میکنند. مقدار فاصلهای را که هر اتم یا گروه بدون دفع شدید، میتواند به دیگری نزدیک شود به «شعاع واندروالس» (van der Waals Radii) موسوم است. دافعه واندروالس را با نام «ممانعت فضایی» (Steric Hindrence) نیز میشناسند. در کانفورماسیون پروپان، اتمهای هیدروژن در C-1 و X-3 به اندازه کافی نزدیک نیستند تا دافعه واندروالس قابل توجهی داشته باشند.
کانفورماسیون بوتان
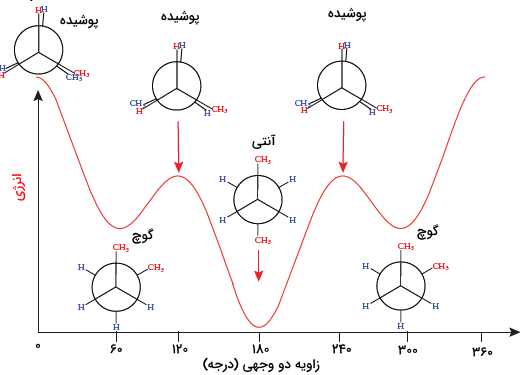
همانند اتان و پروپان، بوتان در هر دو کانفورماسیون پوشیده و ناپوشیده دیده میشود. این کانفورماسیون نتیجه چرخش حول پیوند C-1 به C-2 یا C-2 به C-3 است. به زاویه بین پیوند روبرو و پشت در فرم نیومن، «زاویه پیچشی» (Torsional Angle) یا «زاویه دوجهی» (Dihedral Angle) میگویند. در کانفورماسیون «گوچ» (Gauche) بوتان، گروه متیل در زاویه پیچشی ۶۰ درجه قرار دارد. این زاویه برای کانفورماسیون «آنتی» (Anti) برابر با ۱۸۰ درجه است.
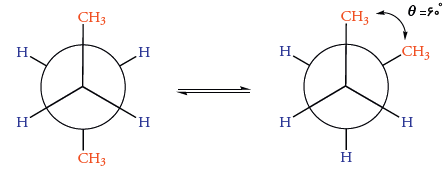
اختلاف انرژی بین کانفورماسیونهای ناپوشیده در بوتان، $$3.8 kJ mole^ {-1}$$ ذکر میشود. در این میان، کانفورماسیون آنتی، پایدارتر و در دمای 298 کلوین، نسبت کانفورماسیون آنتی به گوچ، ۲ به ۱ است. در هر ثانیه، $$10^8$$ بار این کانفورماسیونها در دمای اتاق به یکدیگر تبدیل میشوند.
با توجه به اینکه زاویه پیچشی بین دو کانفورماسیون ناپوشیده وجود ندارد و زاویه پیچشی بین آنها نیز ۶۰ درجه است، این سوال پیش میآید که چرا بین دو کانفورماسیون، اختلاف انرژی وجود دارد؟ در کانفورماسیون گوچ، دو گروه متیل، با زاویه ۶۰ درجه نسبت به هم قرار دارند و دافعه واندروالس و «کرنش فضایی» (Steric Strain) ایجاد میکنند. به طور مشابه، میتوان فرآیندی که در خصوص اتان توضیح داده شد را دنبال کرد تا بتوان علت دافعه واندروالس را در کانفورماسیون گوچ توضیح داد
آرایش دووجهی ۶ اتم را در نظر بگیرید که تمام زوایای پیوندی به صورت 109 درجه باشند. در این آرایش، اتمهای ۱ و ۶ باید یک فضا را اشغال کنند. با وجود اینکه اتمها در کانفورماسیون گوچ، در یک صفحه مشترک قرار ندارند، به اندازه کافی به یکدیگر نزدیک هستند تا مقدار قابل توجهی دافعه واندروالس را تجربه کنند. لازم به ذکر است که دو کانفورماسیون ناپوشیده بوتان، پایدارتر از کانفورماسیونهای پوشیده آن هستند.
حال، بیایید صورتبندی پوشیده، با زاویه پیچشی ۱۲۰ درجه را در نظر بگیریم. این صورتبندی، یک برهمکنش پوشیده هیدروژن-هیدروژن و دو برهمکنش پوشیده هیدروژن-متیل را شامل میشود. در نتیجه، انرژی این صورتبندی، به شکل $$4.2+2 \times 5.4=15 \mathrm{kJ} \text { mole }^{-1}$$، بیشتر از صورتبندی آنتی خواهد بود.
صورتبندی پوشیده با زاویه ۰ درجه، دو دسته برهمکنش هیدروژن-هیدروژن و یک برهم کنش متیل-متیل دارد. انرژی کلی این صورتبندی، $$21 kJ mole^ {-1}$$ و بیشتر از حالت آنتی ذکر شده است. با توجه به اینکه برهمکنش هیدروژن-هیدروژن، مقداری برابر با $$8.4 kJ mole^ {-1}$$ دارد، مقدار برهمکنش متیل-متیل، $$12.6 kJ mole^ {-1}$$ خواهد بود. این مقدار، بیشتر از مقادیر $$5.4 kJ mole^ {-1}$$ و $$4.2 kJ mole^ {-1}$$ در برهمکنشهای پوشیده هیدروژن-هیدروژن و هیدروژن-متیل است. زمانی که زاویه دو وجهی صفر درجه باشد، تمامی چهار اتم کربن در یک صفحه قرار میگیرند. بنابراین، دو اتم هیدروژن در دو سر گروه متیل، دافعه واندوالس شدیدی را حس میکنند.
در تصویر زیر، نمودار انرژی پتاسیل کانفورماسیونهای مختلف بوتان را برحسب زاویه دو وجهی ملاحظه میکنید. ماکزیمم نمودار، مربوط به کانفورماسیونهای پوشیده و مینیمم آن به کانفورماسیونهای ناپوشیده مربوط است.
سیکلوآلکانها
آلکانهای حلقوی یا «سیکلوآلکانها» (Cycloalkanes) با یک حلقه، فرمول عمومی $$C_nH_{2n}$$ دارند. این آلکانهای حلقوی، دو اتم هیدروژن نسبت به آلکان ها کمتر دارند چراکه برای تکمیل حلقه، یک پیوند کربن-کربن دیگر نیاز است. آلکانهای حلقوی را به صورت یک چندضلعی نشان میدهند که اضلاع، بیانگر پیوندها و رئوس، نماد اتمهای کربن هستند و این اتم ها هرکدام با هیدروژن پیوند دارند.
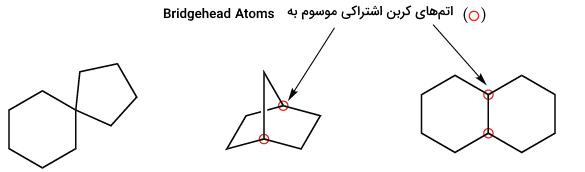
حلقههای چندگانه در یک مولکول میتواند در یک یا دو اتم، مشترک باشند. ترکیبات «اسپیروسیکلیک» (Spirocyclic Compounds)، اتم کربنی را بین دو حلقه به اشتراک میگذارند. این نوع از ترکیبات، کمتر در طبیعت یافت میشوند. ترکیبات «حلقههای جوش خورده» (Fused Rings)، دو اتم کربن و پیوندهای بین آنها و «حلقههای پلدار» (Bridged Ring)، دو کربن غیر مجاور را به اشتراک میگذارند. این نوع از ترکیبات نسبت به حلقههای جوشخورده، کمتر در طبیعت دیده میشوند. البته مقدار آنها نسبت به ترکیبات اسپیروسیکلیک بیشتر است. برخی از نمونههای این ترکیبات در تصویر زیر نشان داده شدهاند.
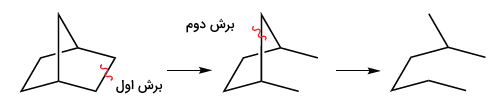
هرکدام از سیستمهای حلقوی که در بالا نشان داده شدهاند، دو حلقه دارند و به «ترکیبات باسیکلی» (Bicyclic Compounds) موسوماند. با تعیین تعداد برش موردنیاز برای تبدیل یک ترکیب حلقوی به غیر حلقوی، میتوان تعداد حلقههای یک سیستم را تعیین کرد. برای یک سیستم پلدار، دو نوع از این برشها نیاز است. برش اول، یک ترکیب تکحلقهای ایجاد میکند و برش دوم، ترکیب غیرحلقوی.
ایزومر هندسی
«ایزومرهای ساختاری» (Constitutional Isomers)، ترکیباتی با اسکلت کربنی، گروه عاملی و همچنین محل گروه عاملی متفاوت هستند. این نوع از ایزمرها در آرایشهای اتمی متفاوتی وجود دارند. اما در این بخش قصد داریم نوع دیگری از ایزومرها را مورد بررسی قرار دهیم. ترکیباتی که آرایش فضایی اتمها در آنها متفاوت است موسوم به «ایزومر فضایی» (Stereoisomer) هستند. به طور مثال، سیکلوآلکانهای که به صورت ایزومر فضایی وجود دارند را «ایزومر هندسی» (Geometric Isomers) میگویند.
کار خود را با سیکلوپروپان آغاز میکنیم که سه اتم کربن در آن، یک صفحه را تشکیل میدهد. هر گروهی که به این حلقه متصل شود، در بالا یا پایین صفحه قرار میگیرد. اگر دو گروه متیل را به اتمهای کربن مجاور در یک سمت صفحه متصل کنیم، ایزومر «سیس» (cis) خواهیم داشت و نام آن، سیس-۱و۲-دیمتیل سیکلوپروپان خواهد بود.
اگر دو گروه متیل را در خارج از صفحه و روبروی هم قرار دهیم، ترکیب مورد نظر، موسوم به ایزومر «ترانس» (trans) است. بنابراین، ۱و۲-دیمتیل سیکلوپروپان میتواند به هر دو شکل ایزومر سیس و ترانس وجود داشته باشد. ایزومرهای سیس و ترانس در اسیدهای چرب، خواص متفاوتی بدست میدهند.

نام گذاری آلکانهای حلقوی
سیکلوآلکانها را به کمک روش آیوپاک و اضافه کردن پیشوند «سیکلو-» نامگذاری میکنیم. زمانی که تنها یک محل شامل گروه عاملی یا آلکیل داریم، تنها یک ترکیب محتمل خواهیم داشت.
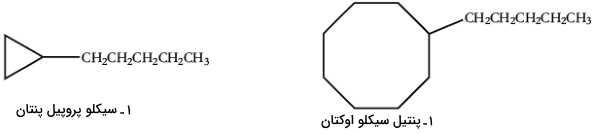
به عنوان نمونه، ترکیبات اتیلسیکلوپنتان و ایزوپروپیلسیکلو بوتان در زیر نمایش داده شدهاند.
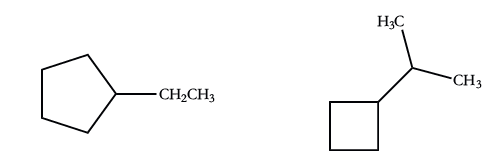
اگر زنجیر گروه آلکیل، تعداد اتم بیشتری نسبت به حلقه کربنی داشته باشد، ترکیب را باز هم به صورت یک سیکلوآلکان نامگذاری میکنیم اما در شرایطی متفاوت. به طور مثال، ترکیبی که یک گروه پنتیل متصل به حلقه سیکلوپروپان داشته باشد را به صورت «سیکلوآلکیلآلکان» (Cycloalkylalkane) نامگذاری میکنیم چراکه تعداد اتم کربن در گروه آلکیل، بیشتر از تعداد اتم کربن در حلقه کربنی است. در مقابل، ترکیبی که یک گروه پنتیل متصل به حلقه سیکلواکتان داشته باشد را به صورت «آلکیلسیکلوآلکان» نامگذاری خواهیم کرد زیرا در این حالت، تعداد اتم کربن در حلقه کربنی، بیشتر از گروه آلکیل است.
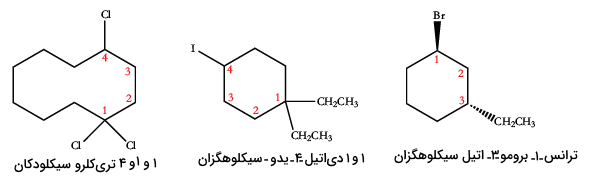
زمانی که دو گروه جانشین (استخلافی)، مانند گروه آلکیل یا هالوژن به حلقه کربنی متصل شوند، شمارهگذاری را از سمت گروه با اولویت بالاتر (الفبایی) آغاز میکنیم. به طور مثال، اتیل نسبت به متیل، اولویت بیشتری دارد. بنابراین، شمارهگذاری از اتیل آغاز میشود. ادامه روند به صورت ساعتگرد یا پادساعتگرد خواهد بود با این شرط که عدد کمتری به گروه با اولویت بعدی برسد. ترکیبات زیر را مشاهده کنید تا با نامگذاری آلکانهای حلقوی، بیشتر آشنا شوید.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- نیروهای بین مولکولی در شیمی — به زبان ساده
- اوربیتال مولکولی — به زبان ساده
^^











سلام. تو نموداری که پایداری و میزان انرژی هر مدل از فرم نیومن بوتان رو گذاشتین اشتباه نشده؟
فرم گوچ بیشترین پایداری رو بعد از آنتی داره چون فاصله ی ch3 ها زیاده
ولی تو نمودار سومین شکل پایداری رو داره. میشه توضیح بدین
سلام و وقت شما بهخیر؛
در نمودار مربوط به پایداری کانفورماسیونهای مختلف مولکول بوتان، کمترین انرژی به آنتی تعلق دارد. بعد از آن، فرم گوچ قرار میگیرد و در نهایت دو فرم متفاوت پوشیده این ساختار. توجه داشته باشید که انرژی فرم پوشیده در حالتی که دو استخلاف $$CH_3$$ نزدیک به یکدیگر قرار داشته باشند، به دلیل دافعه بالاتر، در بیشترین مقدار خود خواهد بود.
برای سنجش میزان انرژی هر فرم در این نموداری، میتوانید از نقطه منتسب به هر فرم، خطی افقی رسم کنید تا محور مربوط به انرژی را قطع کند. سپس با مقایسه این نقاط، ترتیب پایداری فرمهای مختلف را مورد بررسی قرار دهید.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
سلام علیکم خیلی خوب بود عالی است موفق باشید انشالله
سلام خسته نباشید
بالاترین درصد جرمی که کربن میتونه توی الکان ها داشته باشه چقدره؟ و چرا؟
سلام چرادمای کراکینگ پنتان بالاتراز پروپان است
سلام
ممنون بابت مقاله
خواستم بودنم تفاوت میان فشار پیچشی و فضایی چیست؟
با سلام؛
«فشار فضایی» (Steric Strain) یا «کرنش فضایی» زمانی ایجاد میشود که بیش از دو گروه (به شکل تودهای مولکولی) به یکدیگر نزدیک شوند. تفاوت اصلی بین فشار یا کرنش پیچشی و فضایی این است فشار فضایی را نمیتوان با چرخش مولکول به اطراف پیوند، کاهش داد اما این امر در فشار پیچشی امکانپذیر است.
با تشکر از همراهی شما با مجله فرادرس
سلام ببخشید هیبریداسیون الکیل ها spچند هست؟
سلام، اتم کربن در الکیل هیبریداسیون sp3 دارند.
بسیار عالی ولی کاش به جای سایت نسخه اپلیکیشن هم ساخته بشه
ممنون از مطالب کاربردیترین
فقط یک سوال داشتم
کنفرماسیون هرمی که ما در مولکول ها داریم که باعث میشه اتم ها در دورترین حالت قرار بگیرن آیا بخاطر موضوع ممانعت فضایی و اصل پائولی اکسکلوژن کرایتریا هستش و این ممانعت فضایی اگر ایجاد بشه چه اتفاقی میفته؟
سلا خسته نباشید یک اشتباهی داشتید متان با اکسیژن فراورده هایش میشود اب و کربن دی اکسید نه مونواکسید
اگر غلظت اکسیژن کافی باشه اون موقع سوختن کامل اتفاق می افته. زمانی که متان کامل بسوزه فراورده هاش بخار اب و کربن دی اکسید خواهد بود اما زمانی که غلظت اکسیژن کافی نباشه سوختن ناقص اتفاق می افته. وقتی که متان ناقص بسوزه کربن مونواکسید تولید می کنه.
با سلام؛
همانطور که در داخل متن ذکر شده است، زمانی که اکسیژن کافی نداشته باشیم، واکنش سوختن به طور کامل انجام نمیشود و دوده به تولید میرسد.
با تشکر از همراهی شما با مجله فرادرس
سلام، خسته نباشید
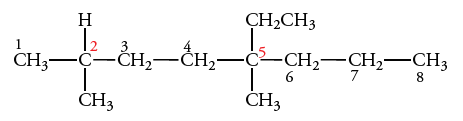
مثال ۱ نام گذاری گروه های آلکیل تعداد کربن های زنجیر والد ۱۷ عدد و به تبع آن ترکیب مورد نظر ۲و۶و۱۰و۱۵-تترا متیل هپتادکان است.
با تشکر بابت مطالب خوبتون
با سلام؛
از توجه شما بسیار سپاسگزاریم. تصویر اصلی در نمایش گروههای آلکیل کمی ایراد داشت و مثال تصویر عوض شد. اکنون با شمارش از راست به چپ به ترکیب مورد نظر میرسیم.
با تشکر از همراهی شما با مجله فرادرس
بسیار عالی سپاسگزارم
عالی بود
مواردی را که برای رسم زنجیر اصلی کربنی باید در نظر گرفته شود شرح دهید.
با عرض سلام و خسته نباشید
در جدول ابتدایی، فرمول شیمیایی دکان را اشتباه نوشتید.
عالی بود، مطالب دبیرستان، شیمی عمومی 1و2 دانشگاه همه رو یک جا داشت و کاملا یادگرفتم، منبع بسیار خوبی برای کسی هست که پایه ی ضعیفی داره و میخواد خودشو قوی کنه، خیلی ممنونم?
با سلام؛
از توجه شما سپاسگزاریم. فرمول بازبینی و اصلاح شد.
با تشکر