الکترون چیست؟ – به زبان ساده
الکترون یکی از سه ذره اصلی سازنده اتم است. دو ذره دیگر که در هسته اتم قرار دارند، پروتون و نوترون هستند. همچنین الکترون با اسپینی برابر با و به عنوان یک فرمیون، سبکترین ذره در اتم محسوب میشود. در این مطلب از مجله فرادرس توضیح میدهیم الکترون چیست و چه نقشی در پدیدههای فیزیکی و شیمیایی مختلف دارد.
- با ویژگیهای الکترون به عنوان یک ذره بنیادی کاملا آشنا میشوید.
- در مورد نحوه کشف الکترون، مدل کیک کشمشی و مدل رادرفورد خواهید آموخت.
- مفهوم پادذره را خواهید شناخت.
- یاد میگیرید مکان الکترون در اوبیتالها به چه صورت است.
- با سطوح انرژی مختلف آشنا میشوید.
- ارتباط الکترون را با مفاهیم کوانتومی مانند دوگانگی موج - ذره بهتر میشناسید.


الکترون چیست؟
الکترون یکی از ذرات بنیادی با بار منفی است که حول هسته اتم و در مدارهای مختلف حرکت میکند. جرم این ذره بسیار کوچکتر از جرم پروتون و نوترون است، بنابراین سبکترین ذره در ساختار اتم محسوب میشود. الکترونها نقش مهمی در پدیدههای مغناطیسی، پیوندهای شیمیایی و برقراری جریان الکتریکی در مدارها دارند. برخلاف پروتونها و نوترونها که از ذرات سادهتری تشکیل شدهاند، الکترونها جزء ذرات بنیادی هستند و شامل ذرات کوچکتری نمیشوند. در حقیقت الکترون نوعی ذره بنیادی به نام «لپتون» (Lepton) است. تمامی لپتونها بار الکتریکی از تا دارند. در یک جامد، ابزار اصلی انتقال جریان، الکترونها هستند که این مفهوم به کمک پیوند فلزی نیز بیان میشود.
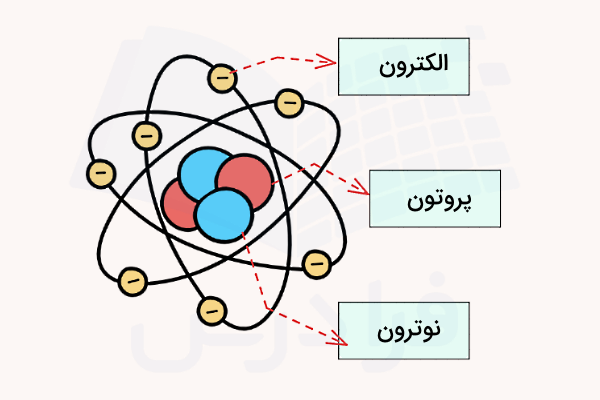
به طور کلی مهمترین ویژگیهای الکترون عبارتاند از:
- بار الکتریکی: منفی و برابر با .
- جرم: (چیزی حدود دو برابر جرم پروتون)
- نوع ذره: جزء ذرات بنیادی و از خانواده لپتونها
- اسپین: (فرمیون)
- رفتار: دوگانگی موج - ذره
- پایداری: بسیار پایدار و بدون فروپاشی طبیعی
کشف الکترون
در اواخر قرن نوزدهم، فیزیکدان انگلیسی به نام «سر جوزف جان تامسون» (Sir Joseph John Thomson)، آزمایشی را با لوله پرتو کاتدی انجام داد. لوله پرتو کاتدی، لولهای شیشهای است که بیشترِ هوای آن تخلیه شده است. با اعمال ولتاژ زیاد به الکترودهای یک سر لوله، باریکهای از ذرات، از کاتد به آند جریان پیدا کردند. این پرتوها را میتوان با استفاده از مادهای رنگی حاوی فسفر، مشاهده کرد.
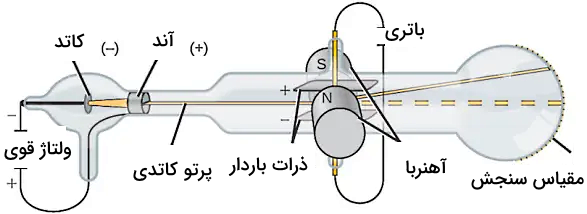
بمنظور بررسی خواص ذرات، تامسون، دو صفحه باردار الکتریکی با بار ناهمنام را در اطراف لوله پرتو کاتدی قرار داد. پرتو کاتدی به هنگام عبور، از صفحه با بار منفی دفع و به طرف صفحه با بار مثبت جذب شد. این آزمایش نشان داد که پرتو کاتدی از ذراتی با بار منفی تشکیل شده است. علاوه بر این، تامسون دو آهنربا را در اطراف لوله پرتو کاتدی قرار داد و مشاهده کرد که میدان مغناطیسی نیز موجب انحراف پرتو کاتدی میشود. در اثر این آزمایشات، تامسون موفق به اندازهگیری نسبت «جرم به بار» (Mass-to-charge) ذرات پرتو کاتدی شد. به کمک این آزمایش مشخص شد که جرم هر ذره، بسیار کمتر از هر نوع اتم شناخته شدهای است.
تامسون این آزمایش را با الکترودهای فلزی دیگری نیز انجام داد و متوجه شد که خواص پرتو کاتدی ثابت میمانند و در نتیجه، مستقل از جنس الکترود استفاده شده هستند. تامسون به کمک یافتههای آزمایش خود، نتایج زیر را ارائه کرد:
- پرتو کاتدی از ذراتی با بار منفی تشکیل شده است.
- این ذرات باید جزئی از یک اتم باشند چراکه جرم هر ذره، تنها جرم اتم هیدروژن است.
- این ذرات زیر اتمی، در تمامی اتمها وجود دارند.
نتایج تامسون در ابتدا، مخالفانی هم داشت اما به مرور مورد پذیرش دانشمندان قرار گرفت. در نهایت، به ذرات پرتو کاتدی آزمایش تامسون نامی اختصاص پیدا کرد که الکترون بود. کشف الکترون، بخشی از نظریه اتمی دالتون را نقض میکرد که میگفت اتمها به ذرات کوچکتری تقسیم نمیشوند. به منظور توصیف حضور الکترونها، مدل جدیدتر اتمی مورد نیاز بود.
مدل کیک کشمشی تامسون
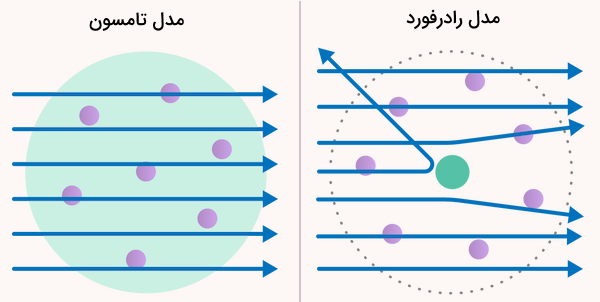
تامسون میدانست که اتمها، به لحاظ با الکتریکی خنثی هستند. در نتیجه، او اظهار داشت که باید منبعی با بار مثبت در اتمها وجود داشته باشد تا بار منفی الکترونها را خنثی کند. این امر موجب شد تا تامسون بیان کند که اتمها را میتوان به صورت ذراتی با بار منفی توصیف کرد که در میان بارهای مثبت در حرکت هستند. این مدل را به طور معمول با نام «مدل کیک کشمشی» (Plum Pudding Model) میشناسند.
با توجه به دانستههای امروزی ما در خصوص اتم، میدانیم که مدل کیک کشمشی تامسون، مدل صحیحی نیست. دانشمندان به بررسی ساختار اتمها ادامه دادند و حتی صحت مدل اتمی تامسون را نیز مورد ارزیابی قرار دادند.
ارنست رادرفورد و آزمایش ورقه طلا
آزمایش بعدی که در خصوص ساختار اتم انجام شد، آزمایشی بود که توسط دانشمند نیوزیلندی، ارنست رادرفورد انجام شد. در این آزمایش، رادرفورد، پرتو باریکی از ذرات آلفا را به ورقه نازکی از طلا تابید. برای اینکار، رادرفورد نمونهای از فلزی رادیواکتیو موسوم به رادیم را داخل جعبهای سربی قرار داد که روزنه کوچکی به بیرون داشت. بیشتر پرتوها توسط جعبه سربی جذب شدند اما باریکهای از ذرات آلفا با گذشتن از روزنه، به ورقه طلا برخورد کردند. ورقه طلا نیز با آشکارسازی احاطه شده بود که وجود پرتو آلفا را آشکار میکرد.
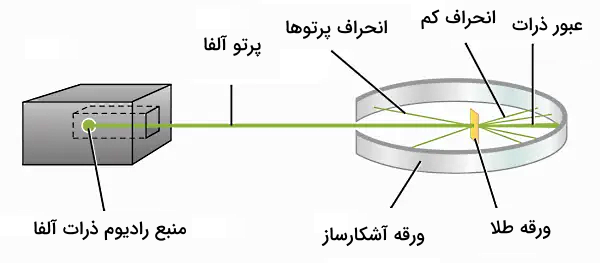
بر اساس مدل کیکی کشمشی تامسون، فرض بر این بود که بارهای مثبت، در حجم اتم پراکنده شدهاند و در نتیجه، بیشتر ذرات آلفا باید به راحتی از ورقه طلا عبور کنند چراکه قدرت میدان مغناطیسی حاصل از ذرات مثبت، بسیار ضعیف است و تاثیری بر مسیر ذرات سنگین و سریع آلفا نخواهد داشت. نتایج حاصل از آزمایش با نتایج مورد انتظار، متفاوت بود. درحالیکه تمامی ذرات آلفا به طور مستقیم از میان ورقه طلا عبور کردند، تعداد کمی ذرات، بیش از ۹۰ درجه انحراف داشتند.
رادرفودر نتایج آزمایش خود را اینگونه توصیف کرد: «این آزمایش، عجیبترین رویدادی بود که تاکنون در زندگی من رخ داده است. شگفتی آن به گونهای است که گویی یک توپ ۱۵ اینچی را شلیک کرده باشید و این توپ با برخود به ورقه نازک طلا و تغییر مسیر خود، به شما برخورد کند.»
مدل هسته ای اتم
رادرفورد بر اساس یافتههای آزمایش خود، نتایج زیر را برای ساختار یک اتم ارائه داد:
- بار مثبت باید در حجم بسیار کمی از اتم قرار داشته باشد که این حجم کم، بیشتر جرم اتم را تشکیل میدهد. این امر توضیح میدهد که چرا کسر کمی از ذرات آلفا، با اختلاف بسیار زیادی از مسیر خود منحرف شدند و این تغییر مسیر ممکن است در اثر برخورد با هسته طلا باشد.
- از آنجایی که بیشتر ذرات آلفا، به طور مستقیم از میان ورقه طلا عبور کردند، در نتیجه بیشتر فضای اتم را حجم خالی تشکیل میدهد.
تمامی این موارد سبب شد تا رادرفورد، مدل هستهای خود را ارائه دهد. در این مدل، اتم، شامل هسته مثبت بسیار کوچک و احاطه شده با الکترونهای منفی بود. بر اساس تعداد ذرات آلفا که در آزمایش رادرفورد از مسیر منحرف شدند، رادرفورد محاسبه کرد که هسته اتم، کسر کوچکی از حجم آن را تشکیل میدهد. مدل هستهای (مدل اتمی) رادرفورد، نتایج آزمایشگاهی او را توصیف میکرد، اما سوالات و ابهامات دیگری را به همراه داشت. به طور مثال، این سوال مطرح میشد که الکترونها در فضای خالی اتم چه وظیفهای بر عهده دارند. در ادامه، نیلز بور آزمایشات جدیدی را مطرح کرد که به کمک آنها در نهایت، مدل جدید مکانیک کوانتومی ارائه شد.
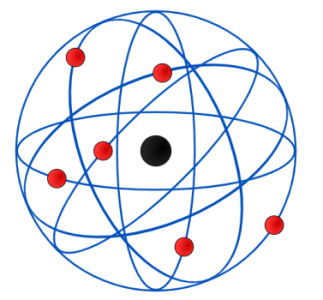
الکترون و پاد ذره
نماد را برای نمایش یک الکترون در نظر میگیرند. پاد ذره الکترون، که باری مثبت را حمل میکند، «پوزیترون» (Positron) یا پاد الکترون نام دارد و آن را با نشان میدهند. لازم به ذکر است که در اثر برخورد یک الکترون و پوزیترون، در فرآیندی انفجاری، اشعه گاما آزاد میشود. برهمکنش الکترون با سایر ذرات زیر اتمی، شاخهای از علم شیمی به نام شیمی هستهای را تشکیل میدهد.
خواص الکترون چیست؟
الکترونها ذرات بسیار کوچکی هستند. جرم یک الکترون در حدود جرم یک پروتون یا نوترون است. بنابراین، الکترونها سهمی در جرم یک اتم ندارند. الکترون بار الکتریکی برابر با دارد که برابر اما مخالف بار الکتریکی در پروتون است. اتمهای خنثی همگی تعدادی برابر از الکترون و پروتون دارند و در نتیجه، این بارهای مثبت و منفی یکدیگر را خنثی میکنند.
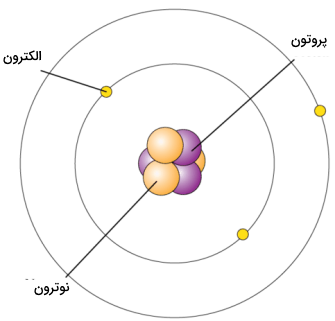
محل الکترون ها در اتم کجاست؟
برخلاف نوترونها و پروتونها که در داخل و مرکز هسته اتم قرار دارند، الکترونها را باید در خارج از هسته جستجو کرد. از آنجایی که بارهای مخالف، یکدیگر را جذب میکنند، الکترون منفی به هسته مثبت، جذب میشود. این جاذبه سبب خواهد شد تا الکترونها در فضای خالی اطراف هسته در حرکت باشند. از تصویر زیر به طور معمول برای نشان دادن ساختار یک اتم بهره میگیرند. این تصویر، الکترون را به صورت ذرهای نشان میدهد که در اطراف هسته در حال چرخش است. حرکت الکترونها در اطراف هسته، پیچیدگیهایی دارد که توسط مکانیک کوانتوم توضیح داده میشود.
اوربیتال ها
مدل اتمی در تصویر قبل، مدل مناسبی است اما کارایی لازم را به هنگام نمایش محل الکترون در اتم ندارد. درواقع، مسیر حرکت یک الکترون را نمیتوان تعیین کرد و تنها احتمال حضور الکترون در محدودهای خاص در اطراف هسته قابل تعیین است. محدودهای که در آن، بیشترین احتمال حضور الکترون وجود دارد را با نام «اوربیتال» (Orbital) میشناسند. هر اوربیتال در نهایت میتواند تا دو الکترون را در خود جای دهد. اوربیتالها دارای شکل نیز هستند. اوربیتالهای نوع s، شکلی کروی و اوربیتالهای نوع p، شکلی همچون یک دمبل دارند. در تصویر زیر، شکل این دو اوربیتال را ملاحظه میکنید. محلهایی با تراکم نقاط بیشتر، حاکی از احتمال بیشتر حضور الکترون در آن مناطق است.

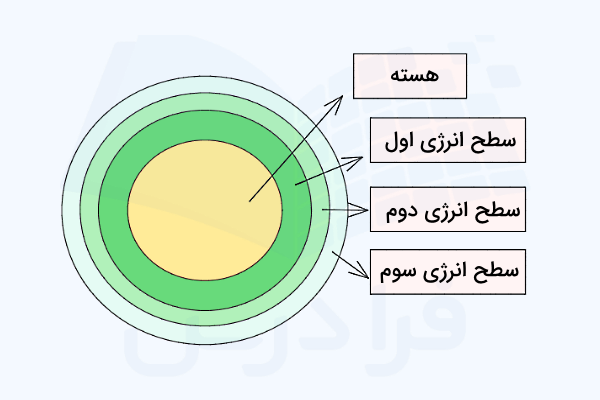
سطوح انرژی
الکترونها در فاصلهای ثابت از هسته قرار دارند که به این فواصل ثابت، سطوح انرژی میگویند. در تصویر بعدی میتوانید سه سطح اولیه انرژی را مشاهده کنید. این تصویر، بیشترین تعداد الکترون در هر سطح را نیز نشان میدهد. در ادامه قصد داریم تا نکات بیشتری در خصوص سطوح انرژی بیان کنیم.
- الکترونها در سطوح انرژی پایینتر، انرژی کمتری دارند و به هسته نیز نزدیکتر هستند. در پایینترین سطح انرژی، تنها یک اوربیتال وجود دارد، در نتیجه، این سطح از انرژی تنها دو الکترون خواهد داشت.
- تنها زمانی الکترونها به سطح انرژی بالاتر منتقل میشوند که سطح انرژی پایینتر، پر شده باشد. الکترونهایی که در سطوح انرژی بالاتری هستند، انرژی بیشتری نیز دارند. این سطوح همچنین، اوربیتالهای بیشتر و به دنبال آن تعداد الکترون بیشتری نیز خواهند داشت.
- الکترونی که در خارجیترین سطح انرژی یک اتم قرار دارد، الکترون والانس یا الکترون لایه ظرفیت نام دارد. این نوع از الکترونها، بسیاری از خواص یک عنصر را تعیین میکنند زیرا این الکترونها، در بسیاری از واکنشهای شیمیایی با سایر اتمها دخیل هستند. اتمها ممکن است الکترونهای والانس خود را به اشتراک بگذارند یا در پیوندهایی، آنها را مبادله کنند.
حقایقی در خصوص الکترون
در ادامه، موارد مختلفی را در خصوص یک الکترون مطرح خواهیم کرد.
شعاع الکترون
برای الکترونها، شعاع و در نتیجه حجمی در نظر نمیگیرند. در حقیقت، الکترونها نوعی «ذره نقطهای» (Point Particle) به شمار میآیند که رفتاری موجیشکل نیز دارند.
نقش الکترون در ترکیبات شیمیایی
همانطور که در بالا نیز به آن اشاره شد، سطوح انرژی در الکترونها و برهمکنشهایشان، رفتار شیمیایی و نوع پیوند مواد را تعیین میکنند. از جمله این موارد میتوان به نمونههای زیر اشاره کرد:
- اتمها در اثر یونش، ممکن است ترکیباتی را تولید کنند.
- اتمها با اشتراکگذاری الکترون در پیوندهای کووالانسی، ترکیبات جدیدی را بوجود میآوند.
نقش الکترون در مغناطیس و الکتریسیته
الکتریسته ساکن، ناشی از حرکت الکترونها از بخشی به بخش دیگر است. این نوع از جدایش بارها، این معنی را میدهد که بخشی دارای بار مثبت و بخشی دارای بار منفی خواهد بود. جریان الکتریکی نیز، جریان بارهای الکتریکی - به طور معمول الکترون - است که حرکت این الکترونها، مفهوم هدایت الکتریکی را بیان میکند.
نقش الکترون در فیزیک کوانتوم
در یک اتم، الکترونها از طریق جاذبه الکترواستاتیک، با هسته پیوند دارند. بر اساس فیزیک کلاسیک، الکترونها باید در اثر جاذبه، با از دست دادن انرژی، به هسته ملحق شوند. اگر این نگاه، صحیح بود، اتمها عمر کوتاهی داشتند. بنابراین، به کمک فیزیک کلاسیک نمیتوان وجود اتمها را توضیح داد. در فیزیک کوانتوم، الکترونها میتوانند سطوح معینی از انرژی را اختیار کنند و تحت شرایط معمول، نمیتوانند با پروتونهای هسته ترکیب شوند. در شرایط خاصی که در ستارگان بوقوع میپیوندد، این الکترونها با پروتونهای هسته ترکیب میشوند.
دوگانگی موج ذره
فیزیک کوانتوم، اساس «دوگانگی موج-ذره» (Wave-Particle Duality) را بیان کرد به این معنی که ذرات میتوانند رفتاری موجمانند داشته و دارای سرعت، طول موج، دامنه و فرکانس باشند و همچنین میتوانند دچار شکست، پراکندگی و انعکاس شوند. در این خصوص، معادلاتی مطرح میشوند که سعی میکنیم به طور خلاصه و با زبانی ساده به بیان آنها بپردازیم.
معادله دوبروی و امواج الکترون
طول موج یک ماده با رفتار موجی را میتوان به کمک «معادله دوبروی» ( de Broglie) محاسبه کرد که رابطه آن به صورت زیر است:
در رابطه بالا:
- : طول موج
- : ثابت پلانک
- : تکانه (مومنتوم)
معادله شرودینگر
با استفاده از معادله شرودینگر، تابع موج مکانیک کوانتومی الکترون را میتوان حل کرد. به کمک و ، سه عدد از چهار عدد کوانتومی را برای مشخصهسازی الکترونها در اتم یا مولکول و شکل و جهت اوربیتالهای الکترونی بدست میآوریم.

معادله دیراک و اسپین الکترون
معادله موج برای حرکت الکترونها با سرعتی نزدیک به سرعت نور، اسپین الکترون را توصیف میکند که به معادله دیراک موسوم است. الکترونها اسپینی به صورت دارند و این یعنی الکترونها به دستهای از ذرات زیر اتمی اختصاص دارند.
نقش الکترون در اعداد کوانتومی
هر الکترون در اتم با چهار عدد موسوم به اعداد کوانتومی توصیف میشود. این اعداد عبارتند از:
- : عدد اصلی کوانتومی
- : عدد کوانتومی تکانه زاویهای اوربیتال (عدد کوانتومی فرعی)
- : عدد کوانتومی مغناطیسی
- : عدد کوانتومی اسپین
در خصوص اعداد کوانتومی و الکترونها، «اصل طرد پائولی» (Pauli Exclusion Principle) بیان میکند که هیچ دو الکترونی در یک اتم نمیتوانند در هر چهار عدد کوانتومی برابر باشند. بنابراین، موقعیت هر الکترون در اتم، موقعیتی یکتا (منحصر به فرد) است.
تکانه زاویه ای
علاوه بر جرم و بار، الکترونها تکانه زاویهای هم دارند. این تکانه به دو صورت وجود دارد:
- تکانه زاویهای به هنگام چرخش الکترون به دور هسته
- تکانه زاویه اسپین
اگر این مطلب برای شما مفید بوده است، مطالعه مطلب «انواع فیزیک – آشنایی کامل با شاخه های فیزیک» از مجله فرادرس را به شما پیشنهاد میکنیم.












به نظر عکس مدل رادرفورد و تامسون رو در بالا جابه جا نوشتید، لطفا اصلاح کنید
با سلام؛
مورد ذکر شده در متن بازبینی و اصلاح شد.
با تشکر از همراهی شما با مجله فرادرس
عالی وقابل فهم البته باید تا حدودی از فیزیک و شیمی سر در بیارین .یا لا اقل دیپلم تجربی داشته باشین جوابه.
سلام بخوایم شیمی یا فیزیک رو از پایه بخونیم باید از پایه بخونیم از کجا باید شروع کنیم؟
با سلام،
برای آشنایی با فیزیک پایه بهتر است از خواندن کتابهایی که فیزیک را به صورت کلی و مفهومی بیان کردهاند شروع کنید. یادداشتهای فاینمن در زمینه فیزیک میتواند برای شروع بسیار جالب و مفید باشد،
با تشکر از همراهی شما با مجله فرادرس
ممنون از شما
خیلی خوب بود ممنون از شما
عالی بود
خیلی خوب جامع و کامل..
واقعاااا مفید بود.
برای من که هنوز به سطح قابل قبولی از فیزیک یا شیمی نرسیدم یکم سنگین بود.
ولی درک میکنم که حجم مطالب بالاست و باید پیش زمینه ای داشته باشم.
اگر بخوام مطالعه آزاد انجام بدم و از پایه شروع کنم باید سراغ چه چیز هایی برم ؟ ممنون میشم کمکم کنید