هیبریداسیون و اوربیتالهای هیبریدی — به زبان ساده

زمانی که نظریه پیوند والانس نتوانست به درستی، ساختار مولکولی را پیشبینی کند، هیبریداسیون برای توضیح آن معرفی شد. به طور آزمایشگاهی مشاهده شده است که زاویه پیوندها در ترکیبات آلی، نزدیک به مقادیر 109، 120 یا 180 درجه هستند. بر اساس نظریه وسپر (VSEPR)، جفتهای الکترونی یکدیگر را دفع میکنند و پیوندها و جفتالکترونهای ناپیوندی اطراف اتم مرکزی، در بیشترین زاویه ممکن از یکدیگر قرار خواهند گرفت.
مقدمه
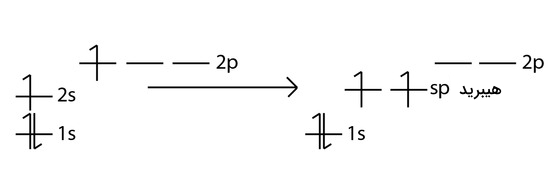
کربن، بهترین نمونه برای بیان هیبریداسیون است. آرایش الکترونی اتم کربن به صورت زیر است:
بر اساس نظریه پیوندهای والانس، کربن باید مولکولی همانند با دو پیوند کووالانسی تشکیل دهد زیرا در آرایش الکترونی خود، دو جفتالکترون ناپیوندی دارد. اما آزمایشات نشان دادهاند که به شدت واکنشپذیر است و به صورت پایدار وجود ندارد. در نتیجه، نمیتوان به کمک این نظریه، تشکیل مولکول را بیان کرد. برای تشکیل چهار پیوند، آرایش الکترونی کربن باید چهار جفتالکترون ناپیوندی داشته باشد.
تنها راهی که بتوان پیوند در را توضیح داد این است که بگوییم اوربیتال و سه اوربیتال با یکدیگر ترکیب میشوند تا ۳ اوربیتال هیبریدی را با انرژی برابر تولید کنند. در نتیجه، آرایش الکترونی زیر را خواهیم داشت:
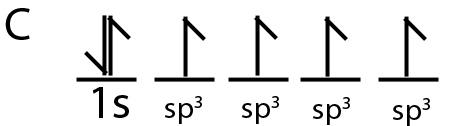
حال که اتم کربن، چهار الکترون جفتنشده دارد، میتواند چهار پیوند با انرژی یکسان تشکیل دهد. هیبریداسیون اوربیتالها از آن جهت مورد اهمیت است زیرا اوربیتالهای هیبرید، انرژی کمتری در مقایسه با شکل جدا (هیبرید نشده) دارند. در نتیجه، زمانی که هیبریداسیون داشته باشیم، ترکیبات پایدارتری حاصل میشوند. همچنین، بخشهایی اصلی در اوربیتالهای هیبریدی، همپوشانی بهتری از حالات هیبرید نشده دارند که نتیجه آن، پیوندهای بهتر است. در ادامه سعی داریم تا انواع مختلف هیبریداسیون را بررسی کنیم و به کمک آنها، ساختار برخی مولکولها را توضیح دهیم.
هیبریداسیون
هیبریداسیون ، ساختار چهاروجهی مولکول را توضیح میدهد. در این فرآیند، اوربیتال و هر سه اوربیتال ، در اثر هیبرید شدن، چهار اوربیتال را بوجود میآورند. هرکدام از اوربیتالهای حاصل، ۷۵ درصد خاصیت p و ۲۵ درصد خاصیت s دارند. بخشهای پیشانی اوربیتالها به گونهای در کنار یکدیگر قرار میگیرند که دافعه الکترونی به حداقل برسد.
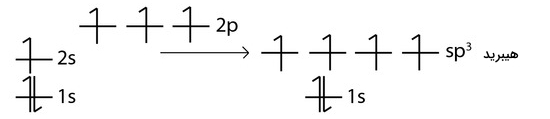
هیبریداسیون یک اوربیتال s و تمامی سه اوربیتال p ، سبب بوجود آمدن چهار اوربیتال هیبرید خواهد شد. این نوع از اوربیتالها، با زاویه پیوند 109/5 درجه در کنار یکدیگر قرار گرفتهاند. چنین آرایشی، هندسه چهاروجهی را بدست میدهد.
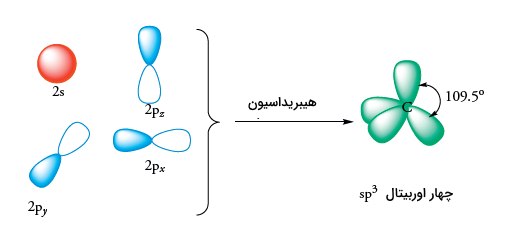
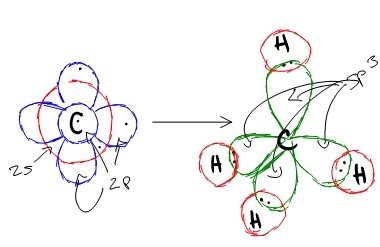
هیبریداسیون در متان
به دلیل اینکه کربن، نقشی بسیار اساسی در شیمی آلی دارد، از آن در مثال زیر استفاده میکنیم. چهار اوربیتال هیبرید حاصل، با چهار اتم متفاوت از اتم هیدروژن، تشکیل پیوند میدهند و متان را بوجود میآورند. شکل حاصل، با توجه به اهمیتِ کمینه کردن دافعه، به صورت چهاروجهی خواهد بود.
جفتالکترونهای ناپیوندی را فراموش نکنید. این جفتالکترونها نمیتوانند پیوند دوگانه تشکیل دهند و در نتیجه، در اوربیتال هیبرید خود قرار خواهند گرفت. به همین دلیل، مولکول آب به شکل چهار وجهی وجود دارد. اگر به زیرلایهها در اوربیتالهای s و p برویم، میتوانیم اوربیتالهای هیبرید و را تشکیل دهیم.
هیبریداسیون
هیبریداسیون در توضیح ساختار سهضلعی مسطح کاربرد دارد. در این هیبریداسیون، اوربیتال و دو اوربیتال ، در اثر هیبرید شدن، سه اوربیتال را تشکیل میدهند که هرکدام شامل 67 درصد خاصیت p و ۳۳ درصد خاصیت s هستند. قرارگیری این اوربیتالهای هیبرید به گونهای است که یک ساختار سهضلعی مسطح را تشکیل میدهند. در این میان، اوربیتال p بدون تغییر باقی میماند و بر صفحه سه اوربیتال، عمود خواهد بود.
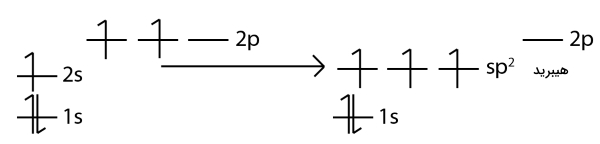
هیبرید شدن یک اوربیتال s با دو اوربیتال p ، سه اوربیتال هیبرید را بدست میدهد که با زاویه 120 درجه در کنار یکدیگر قرار گرفتهاند.
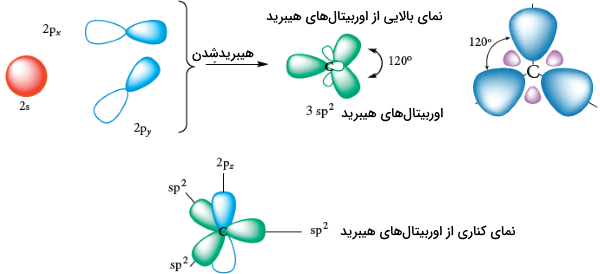
هیبریداسیون در آلومینیوم تریهیدرید
در آلومینیوم تریهیدرید، یک اوربیتال و دو اوربیتال ، در اثر هیبرید شدن، سه اوربیتال را تشکیل میدهند، که در ساختار سه ضلعی مسطح، در کنار یکدیگر قرار گرفتهاند. سه اوربیتال در آلومینیوم با اوربیتالهای از سه اتم هیدروژن، پیوند تشکیل میدهند که این پیوند در اثر همپوشانی اوربیتالهای تشکیل میشوند.
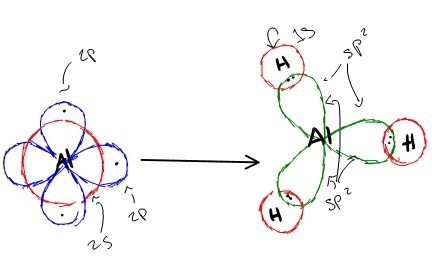
هیبریداسیون در اتن
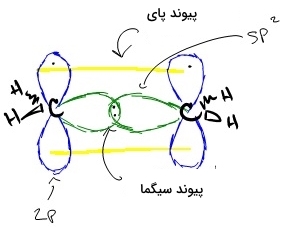
هیبریداسیون مشابه در هرکدام از اتمهای کربن در اتن نیز روی میدهد. برای هر اتم کربن، یک اوربیتال و دو اوربیتال ، هیبرید میشوند تا سه اوربیتال را بسازند. این اوربیتالهای هیبرید، خود را در ساختار یک سهضلعی مسطح قرار میدهند. برای هر اتم کربن، دو اوربیتال sp با دو اوربیتال در هیدروژن از طریق همپوشانی پیوند تشکیل میدهند. اوربیتالهای باقیمانده در هر کربن، با یکدیگر پیوند تشکیل میدهند. در اثر این فرآیند، از طریق همپوشانی ، پیوندی بین هر اتم کربن برقرار خواهد شد.
در این شرایط، دو اوربیتال p در هر اتم کربن باقی میمانند که هر کدام، یک الکترون در خود دارند. در نتیجه، پیوندی دوگانه و از نوع پای بین دو اتم کربن برقرار میکنند. از آنجایی که یک پیوند دوگانه تشکیل شده است، ساختار کلی ترکیب اتن، به صورت خطی است. البته، ساختار هر مولکول کربن، همچنان به صورت سهضلعی مسطح خواهد بود.
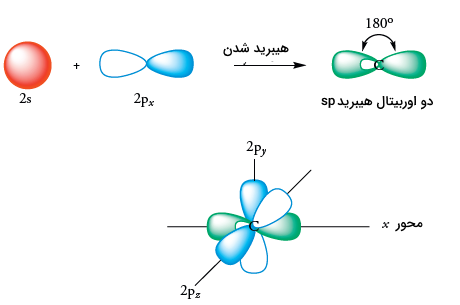
هیبریداسیون
هیبریداسیون ، وجود ساختار خطی در مولکول را توضیح میدهد. در این مدل، اوربیتال و یکی از اوربیتالهای ، برای تشکیل دو اوربیتال هیبرید میشوند که هرکدام، دارای 50 درصد خاصیت s و ۵۰ درصد خاصیت p هستند.
هر دو اوربیتال، به گونهای در کنار یکدیگر قرار میگیرند که ساختاری خطی با زاویه ۱۸۰ درجه بسازند. این نوع از آرایش، دافعه الکترونها را به حداقل میرساند.
با توجه به اینکه تنها از یک اوربیتال p استفاده شد، همچنان دو اوربیتال دستنخورده داریم که میتوانند مورد استفاده قرار بگیرند. این اوربیتالها نسبت به یکدیگر و نسبت به دو اوربیتال به صورت عمود قرار دارند.
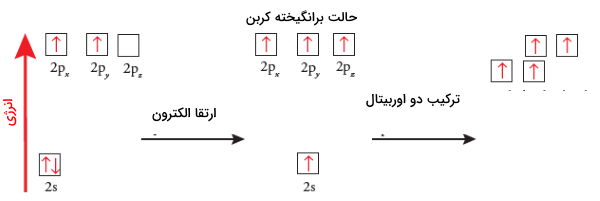
هیبریداسیون کربن در اتین
در ادامه، تشکیل پیوند در اتان را بررسی میکنیم. در این مولکول، اتم کربن به دو اتم با پیوند سیگما، متصل شده است. فرض میکنیم که این مولکول، از دو واحد مِتین تشکیل شده باشد. از آنجایی که هر اتم کربن استیلن، به دو اتم دیگر (هیدروژن و کربن) متصل میشود، هر واحد متین به دو پیوند پای نیاز دارد. این دو پیوند را به صورت زیر بدست میآوریم:
- یک الکترون را از اوربیتال پرشده به اوربیتال خالی ارتقا میدهیم.
- اوربیتال را با یک اوربیتال ، برای تشکیل دو اوربیتال هیبرید با انرژی برابر، ترکیب میکنیم. در نهایت، دو اوربیتال نیمهپرشده باقی خواهند ماند.
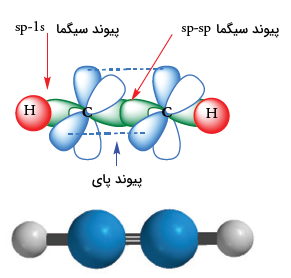
اوربیتالهای هیبرید تنها در موقعیت فضایی با یکدیگر تفاوت دارند. این اوربیتالها در زاویه ۱۸۰ درجهای به گونهای قرار میگیرند که بیشترین جدایش الکترونها و کمترین دافعه حاصل شود. این اوربیتالها، پیوندهای سیگما را بوجود میآورند. یک اوربیتال هیبرید در هر اتم کربن، یک پیوند سیگما با هیدروژن تشکیل میدهد. به همین شکل، اوربیتال هیبرید دیگر نیز، پیوند سیگما با دیگر اتم هیدروژن تشکیل خواهد داد. در نتیجه، تمامی چهار اتم استیلن، مطابق تصویر زیر، بر روی یک خط مستقیم قرار میگیرند.
تاثیر هیبریداسیون بر قدرت و طول پیوند
گرچه یک اوربیتال هیبرید ، دارای ۳۳ درصد خاصیت s در مقایسه با خاصیت ۲۵ درصدی s در اوربیتال هیبریدی است، اما یک اوربیتال هیبرید در کربن، شکلی تقریبا مشابه با اوربیتال هیبرید دارد. هر قدر درصد خاصیت s بیشتر شود، الکترونها در اوربیتالهای هیبریدی به هسته نزدیکتر خواهند بود. بنابراین، الکترونها در اوربیتال هیبرید ، نسبت به دیگر اوربیتال به هسته نزدیکترند. لازم به ذکر است که افزایش درصد خاصیت s در یک اوربیتال هیبرید، به طور موثری، الکترونگاتیوی اتم کربن را افزایش میدهد.
بحث در خصوص قدرت پیوند
هیبریداسیون اوربیتالها به شدت بر خواص فیزیکی همچون طول و انرژی پیوند تاثیرگذار است. طول پیوند سیگما بین کربن و اتم دیگر، در اوربیتالهای هیبرید کوتاهتر از ذکر میشود. به طور مثال، طول پیوند کربن-هیدروژن در اتن، برابر با است درحالیکه این طول برای اتان، مقداری برابر با دارد. همچنین، در اوربیتالهای هیبرید ، انرژی پیوند بیشتری در مقایسه با اوربیتالهای هیبرید داریم. به طور مثال، انرژی پیوند کربن-هیدروژن در اتن، برابر با است درحالیکه این مقدار برای پیوند کربن-هیدروژن در اتان، ذکر میشود. جدول زیر، متوسط انرژی پیوند را در اتان، اتن و اتین نشان میدهد.
| نوع پیوند | انرژی پیوند |
| 410 | |
| 422 | |
| 523 | |
| 347 | |
| 610 | |
| 837 |
بحث در خصوص طول پیوند
طول پیوند کربن-هیدروژن اتین، در حدود پیکومتر و انرژی پیوند آن برابر با است. طول پیوند کربن-کربن در اتان، اتن و اتین به ترتیب برابر با 154، 133 و 120 پیکومتر است. علت کاهش طول را میتوان اینطور بیان کرد که الکترونهایی که به منظور تشکیل پیوند سیگما در اوربیتالهای هیبرید استفاده شدهاند، به تدریج و با افزایش درصد خاصیت s، به هسته نزدیکتر میشوند. همچنین، کاهش طول پیوند کربن-کربن، ناشی از افزایش تعداد پیوندهای دخیل در اتم کربن نیز خواهد بود.
دو جفتالکترون اشتراکی (یک سیگما و یک پای)، هسته اتم کربن را در مقایسه با یک پیوند یگانه سیگما، بیشتر به خود جذب میکنند. به همین شکل، سه جفتالکترون (یک سیگما و دو پای) تاثیر بیشتری خواهند داشت. جدول زیر، متوسط طول پیوند را برای انواع پیوند در کربن نشان میدهد.
| نوع پیوند | متوسط طول پیوند |
| 109 | |
| 107 | |
| 105 | |
| 154 | |
| 133 | |
| 120 |
هیبریداسیون نیتروژن
تشکیل اوربیتالهای هیبرید در یک اتم نیتروژن، بسیار به اتم کربن شبیه است. تنها تفاوت آن این است که نیتروژن، یک الکترون بیشتر از کربن برای توزیع در اوربیتالهای هیبرید خود دارد.
چهار اوربیتال اطراف اتم نیتروژن، در گوشه یک چهاروجهی جای میگیرند. یک اوربیتال نیتروژن شامل یک جفتالکترون است. سه اوربیتال دیگر، هرکدام دارای یک الکترون هستند. همچون اتم هیدروژن در آمونیاک یا کربن در تریمتیل آمین، هر الکترون میتواند یک پیوند سیگما با اتم دیگر تشکیل دهد.
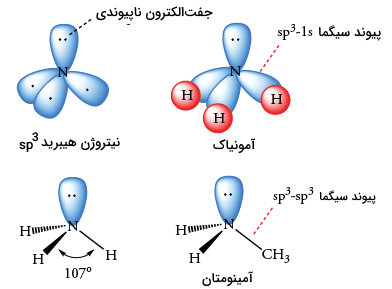
در تریمتیل آمین، سه گروه متیل ، به نیتروژن مرکزی متصل شدهاند تا یک مولکول هرمی مثلثی را با پیوندهای و زاویه پیوند 108 درجه تشکیل دهند. این زاویه پیوند، قدری با زاویه ۱۰۹/۵ درجه در یک چهاروجهی تفاوت دارد زیرا جفتالکترونهای ناپیوندی، حجم بیشتری را نسبت به الکترونهای پیوندی اشغال میکنند. مطابق تصویر زیر، الکترونهای ناپیوندی، الکترونهای پیوندی را دفع و زاویه پیوند را فشردهتر میکنند.
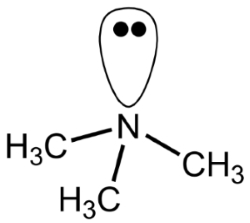
برخلاف اتم کربن، نیتروژن برای دستیابی به قاعده اکتت، بدون هیبرید کردن اوربیتالها، میتواند تا سه پیوند سیگما را با هیدروژن یا سایر اتمها تشکیل دهد. البته، اوربیتال هیبرید ، ۲۵ درصد خاصیت s دارد و همپوشانی این اوربیتال هیبرید با اوربیتال در اتم هیدروژن، موثرتر از همپوشانی یک اوربیتال از نیتروژن و یک اوربیتال از هیدروژن است. بار دیگر میبینیم که درصد بیشتر خاصیت s در اوربیتال هیبرید ، پیوند قویتر و مولکول پایدارتری را بدست میدهد.
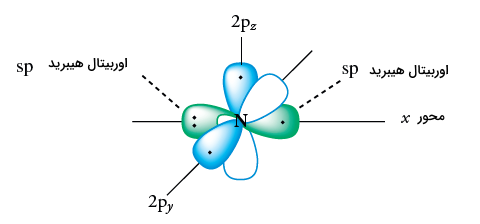
پنج الکترون والانس (ظرفیت) در نیتروژن همچنین میتوانند در سه اوربیتال هیبرید توزیع شوند. سه اوربیتال اطراف نیتروژن به صورت «همصفحه» (Coplanar) هستند. یک اوربیتال شامل یک جفت الکترون است. دو اوربیتال دیگر، هرکدام یک الکترون دارند. هر الکترون، یک پیوند سیگما با اتم دیگر، همچون هیدروژن یا کربن تشکیل میدهد. الکترون تنها در اوربیتال باقیمانده، یک پیوند پای با اوربیتال در اتم دیگر همچون کربن تشکیل میدهد.
هیبریداسیون اکسیژن
تشکیل اوربیتالهای هیبریدی در یک اتم اکسیژن نیز به همان شکل اتم کربن انجام میشود با این تفاوت که اکسیژن، دو الکترون بیشتر از اتم کربن برای توزیع در اوربیتالهای هیبریدی خود دارد. همانند تصویر زیر، اکسیژن، شش الکترون والانس (ظرفیت) برای توزیع در ۴ اوربیتال هیبریدی دارد. چهار اوربیتال اطراف اکسیژن، یک چهاروجهی را میسازند. دو اوربیتال هیبرید ، شامل جفتالکترون هستند. دو اوربیتال هیبرید دیگر، هر کدام یک الکترون دارند که میتوانند یک پیوند سیگما با یک اتم همچون هیدروژن یا کربن تشکیل دهند.
به طور مثال، اتم اکسیژن در آب، از طریق اوربیتالهای هیبرید ، با دو اتم هیدروژن پیوند دارد و مولکولی با شکلی خمیده و زاویه پیوندی 104/5 درجه را میسازد. این زاویه، قدری کمتر از زاویه 109/5 درجه یک چهاروجهی است زیرا همچون نیتروژن، جفتالکترونهای غیر پیوندی حجم بیشتری نسبت به الکترونهای پیوندی اشغال میکنند. در حقیقت، الکترونهای غیرپیوندی، الکترونهای پیوندی را دفع و زاویه پیوند را فشردهتر میکنند.
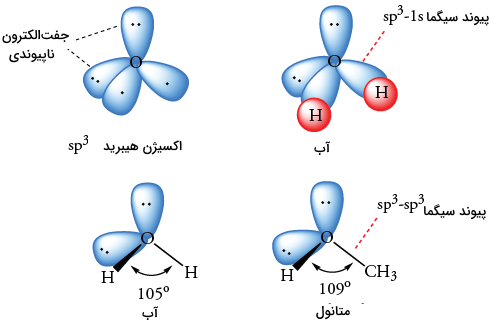
اکسیژن میتواند با تشکیل دو پیوند سیگما با هیدروژن، بدون هیبرید کردن اوربیتالهای خود، به قاعده اکتت دست پیدا کند. البته، همپوشانی اوربیتال از اکسیژن با اوربیتال از هیدروژن، پیوند قدرتمندی همچون همپوشانی یک اوربیتال با اوربیتال بدست نمیدهد. همانطور که در مولکول آمونیاک دیدیم، درصد خاصیت s در اوربیتال هیبرید ، پیوند قویتر و مولکول پایدارتری را ایجاد میکند.
تصویر زیر، گشتاور دوقطبی (ممان دوقطبی) آب و متانول را نشان میدهد. ۶ الکترون والانس در اکسیژن، میتوانند در سه اوربیتال هیبرید نیز توزیع شوند. این اوربیتالها نیز به صورت همصفحه قرار دارند و زاویه بین آنها در یک آرایش سهضلعی مسطح، ۱۲۰ درجه است.
دو اوربیتال ، دارای یک جفتالکترون هستند. دیگر اوربیتال ، یک الکترون تنها دارد که میتواند پیوندی از نوع سیگما با اتمی همچون کربن ایجاد کند. الکترون تنها در اوربیتال ، یک پیوند پای با دیگر اوربیتال در اتمی همچون کربن، ایجا میکند.
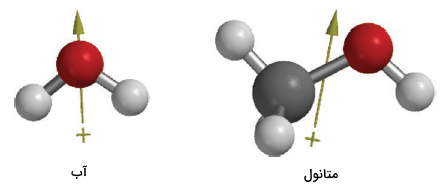
متانال ، اتمی به صورت هیبرید شده دارد. جفتالکترون ناپیوندی ، در صفحه اتمهای کربن و هیدروژن قرار میگیرد. متانال، ساختاری مشابه اتن دارد.

تا اینجا، اوربیتالهای هیبرید را برای کربن، نیتروژن و اکسیژن بررسی کردیم. در هر مورد، نظریه «وسپر» (VSEPR)، شکلی چهاروجهی را برای جفتهای الکترونی پیشبینی میکرد. البته، لازم به ذکر است که شکل مولکولی، به محل اتمها در یک مولکول بستگی دارد. بنابراین، مولکول متان، شکلی چهاروجهی دارد و آمونیاک، هرمی و شکل مولکولی آب، خمیده است.

جمعبندی
در این آموزش، اوربیتالهای هیبرید ، و را در کربن و نیتروژن، و را در اکسیژن و رابطه آنها با شکل پیشبینی شده نظریه وسپر را بررسی کردیم. دانستیم که اوربیتالهای هیبرید میتوانند پیوندهای سیگما با سایر اتمها تکشیل دهند. روش ترکیب خطی اوربیتالهای اتمی (LCAO)، روش ارزشمندی است چراکه دید مناسبی نسبت به هندسه مولکولی بدست میدهد. به طور مثال، طول و قدرت پیوندهای ، فارغ از گروههای هیدروکربنی متصل به آنها، تقریبا در تمامی الکلها یکسان است. جدول زیر، خلاصهای از روابط بین هیبریداسیون، هندسه جفتهای الکترونی و شکل مولکول بدست میدهد.
| نوع هیبریداسیون | هندسه جفتالکترون | شکل مولکول | الکترونهای ناپیوندی | پیوندهای سیگما | پیوندهای پای | مثال |
| خطی | خطی | ۲ | 2 | 2 | اتین | |
| سهضلعی مسطح | سهضلعی مسطح | 1 | 3 | 1 | اتن | |
| چهاروجهی | چهاروجهی | 0 | 4 | 0 | متان | |
| چهاروجهی | هرمی | 2 | 3 | 0 | آمونیاک | |
| چهاروجهی | خمیده | 4 | 2 | 0 | آب | |
| هیبریداسیون در «مواد واسط فعال» (Reaction Intermediates) | ||||||
| سهضلعی مسطح | سهضلعی مسطح | - | 3 | 0 | کربوکاتیون | |
| سهضلعی مسطح | سهضلعی مسطح | 1 | 3 | 0 | رادیکال کربن | |
| سهضلعی مسطح | هرمی | 2 | 3 | 0 | «کربانیون» (Carbanion) | |
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش آنالیز تابع موج (Wave Function) با نرم افزار Multiwfn
- اوربیتال مولکولی — به زبان ساده
- پیوند فلزی — به زبان ساده
^^












سلام و عرض ادب
آموزشتون عالی بود ممنون
فکر کنم تو الومینیوم تری هیدرید اشتباه تایپی وجود داره. اوربیتال های ۳s و ۳p باید بنویسید
با سلام؛
در فرآیند هیبریداسیون sp3، دو اوربیتال 2s و سه اوربیتال 2p با یکدیگر ترکیب میشوند تا چهار اوربیتال هیبرید تشکیل شود.
با تشکر از همراهی شما با مجله فرادرس
بسیار عالی بود???
فقط لطفا در مورد هیبریداسیون d2sp3 و dsp3 هم بنویسید
متشکرم