شناسایی ترکیبات آلی چطور انجام می شود؟ – به زبان ساده + معرفی کتاب

در این مطلب از مجله فرادرس میخواهیم با نحوه شناسایی ترکیبات آلی در گرایش شیمی آلی آشنا شویم. ابتدا به این موضوع میپردازیم که ترکیبات آلی چه ترکیباتی هستند و سپس روشهای موجود برای شناسایی آنها را مرور میکنیم. در نهایت نیز تعدادی کتاب کاربردی و مفید را معرفی خواهیم کرد.
ترکیبات آلی چیست؟
پیش از پرداختن به شناسی ترکیبات آلی میخواهیم بدانیم ترکیباتی که از آنها به عنوان ترکیبات آلی یاد میشود، کدام دسته از مواد شیمیایی هستند تا درک بهتری از روشهای شناسایی آنها داشته باشیم. به ترکیباتی که در ساختار خود دارای اتم کربن باشند، «ترکیبات آلی» (Organic Compunds) گفته میشود.
این دسته از ترکیبات میتوانند به هر سه حالت فیزیکی مایع، جامد و گاز حضور داشته باشند. در ادامه با این دسته از ترکیبات بیشتر آشنا میشویم.
ساختار ترکیبات آلی
اعضای این خانواده بسیار گسترده هستند و به همین دلیل نیاز به روشی سیستماتیک برای دستهبندی آنها احساس میشود. یک دستهبندی کلی از این ترکیبات سنجش آنها بر اساس زنجیرههاست که در آن به دو گروه «غیرحلقوی» (Acyclic) و «حلقوی» (Cyclic) دستهبندی میشوند. به گروه اول ترکیبات آلی «زنجیر باز» (Open Chain) و به گروه دوم ترکیبات آلی «زنجیر بسته» (Closed Chain) نیز گفته میشود.
در برخی موارد عنصرهای دیگر جدول تناوبی عناصر مانند گوگرد با نماد شیمیایی $$S$$، نیتروژن با نماد شیمیایی $$N$$ و اکسیژن با نماد شیمیایی $$O$$ نیز به کربنها متصل هستند و در ساختار ترکیبات آلی حضور دارند.
ترکیبات کربنی غیرآلی
توجه داشته باشید که تعداد اندکی از ترکیبات کربنی وجود دارند که به خانواده ترکیبات آلی تعلق ندارند. در جدول زیر تعدادی از این ترکیبات را به همراه فرمول شیمیایی آنها مشاهده میکنید. شناسایی این ترکیبات از این جهت مهم است که نباید با ترکیبات آلی اشتباه گرفته شوند.
| ترکیب کربنی غیر آلی | فرمول شیمیایی ترکیب |
| کربن دیاکسید | $$CO_2$$ |
| کربن مونواکسید | $$CO$$ |
| سیانات | $$OCN^-$$ |
| سیانید | $$CN^-$$ |
| ترکیبات یونی کربنی | - |
نحوه نمایش ترکیبات آلی
برای نمایش ساختار ترکیبات آلی از شیوههای متفاوتی مانند ساختار لوویس، مدل فضا پرکن و فرمولها ساختاری استفاده میشود. نشان دادن اتمهای هیدروژن در ساختار ترکیبات آلی بهصورت خط متدوال است و میتوان در فرمولهای شیمیایی بسته همه آنها را بهصورت یکجا آورد. حضور اتمهای هیدروژن در ساختار ترکیبات آلی بسیار حیاتی است و پیوندهای شیمیایی لازم برای هر اتم کربن را ایجاد میکند.
گروههای عاملی در ترکیبات آلی
ترکیبات آلی در صورتی که دارای مجموعهای از اتمها با ویژگیهای منحصربه فرد باشند که از آنها با عنوان «گروههای عاملی» (Functional Group) یاد میشود، به دستههای متنوعی تقسیم میشوند و نام خاص خود را پیدا میکند. گروههای عاملی مسئول وجود ویژگیهای شیمیایی هستند که هر دسته از ترکیبات آلی از خود نشان میدهد. برای مثال الکلها ترکیباتی هستند که در ساختار خود، گروه عاملی هیدروکسیل با فرمول شیمیایی $$OH$$ را دارند و از اعضای این خانواده میتوان به اتانول و متانول اشاره کرد.
مثالی دیگر «کربوکسیلیک اسیدها» (Carboxylic Acids) هستند که ویژگی منحصر به فرد آنها داشتن گروه عاملی بهصورت $$COOH$$ است. داروی آسپرین که یکی از قدیمیترین داروها با مصرف گسترده و تجاری است به این دسته از ترکیبات متعلق است.
تاریخچه ترکیبات آلی
در گذشته تصور بر این بود که مطالعه ترکیبات آلی محدود به محصولاتی است که از فرآيندهای طبیعی توسط موجودات زنده به دست می آیند اما شیمیدان آلمانی، «فردریش وهلر» (Friedrich Wohler) در سال ۱۸۰۰ میلادی به کشف جدیدی رسید و این فرضیه را زیر سوال برد. او عنوان کرد که ترکیبات آلی را میتوان از مواد معدنی و غیرآلی در آزمایشگاههای شیمی به دست آورد. در ادامه نیز شیمی مدرن و علم مواد روی ویژگیهای قابل توجه اتمهای عنصر کربن برای تولید مواد شیمیایی سنتزی، آفتکشها و ترکیبات دیگر تمرکز کرد. همانطور که پیشتر گفتیم در اغلب ترکیبات آلی یک اتم کربن به اتمی دیگر و تعدادی هیدروژن متصل است.

سریهای همولوگی
دستهای از ترکیبات آلی که در آن هر عضو دارای گروه عاملی مشابهی است و هر کدام با دیگری در یک واحد ثابت تفاوت دارد، به عنوان سریهای همولوگ شناخته میشود. اعضای سریهای همولوگی را میتوان با فرمولی کلی نشان داد و هر عضو با عضو قبل و بعد خود در یک واحد $$CH_2$$ تفاوت خواهد داشت. در شیمی ترکیبات آلی سریهای همولوگی متنوعی دیده میشود وکه میتوان از آنها به «آلکان» (Alkane)، «آلکن» (Alkene)، «آلکین» (Alkyne) و «هالو آلکان» (Haloalkane) اشاره کرد.
دسته بندی ترکیبات آلی
با وجود اینکه میلیونها ترکیب آلی سنتز و شناخته شده است، میتوان آنها را بهصورت سیستماتیک دستهبندی کرد و از روشی منسجم و قانونمند برای نامگذاری پیچیدهترین اعضای آنها بهره برد. در ادامه بهصورت بسیار خلاصه به معرفی دستهبندی این ترکیبات پرداختهایم.
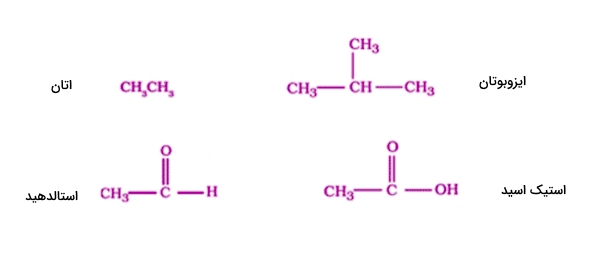
ترکیبات آلی زنجیر باز
به این دسته از ترکیبات آلی، «آلیفاتیک» (Aliphatic) نیز گفته میشود که راستزنجیر و شاخهای هستند. در زیر تعدادی از ساختارهای آلی متعلق به این دسته را مشاهده میکنید.
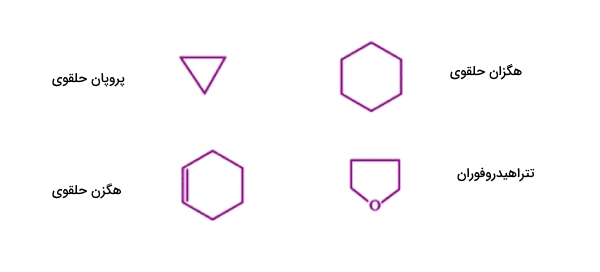
ترکیبات آلی حلقوی
این دسته از ترکیبات بهصورت حلقوی هستند و در واقع اتمهای کربنی هستند که در یک حلقه به یکدیگر متصل شدهاند. در این دسته از ترکیبات، در صورت وجود اتم عنصرهایی غیر از کربن و هیدرون، مانند نیتروژن و گوگرد، به آن «هتروسیکل» (Hetrocyclic) گفته میشود. این ترکیبات در بسیاری از ویژگیهای خود شبیه به ترکیبات آلیفاتیک هستند. در تصویر زیر تعدادی از ترکیبات متعلق به این دسته را مشاهده میکنید.
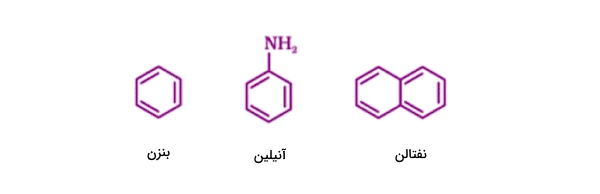
ترکیبات آلی اروماتیک
ترکیبات «آروماتیک» (Aromatic) دسته بهخصوصی از ترکیباتاند که حاوی «بنزن» (Benzen) و حلقههای مشابه دیگر هستند.
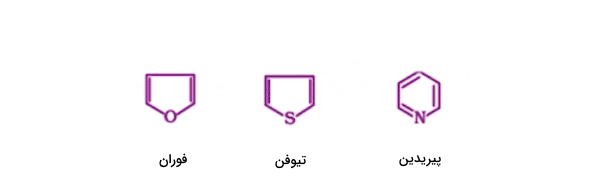
مانند ترکیبات حلقوی، این ترکیبات نیز میتوانند در ساختار خود اتمهای عناصری غیر از کربن و هیدروژن را جای دهند. به چنین ساختارهایی ترکیبات آروماتیک هتروسیکلی گفته میشود. ترکیبات آروماتیک خود زیرشاخههایی دارد که میتوانید آنها را در زیر مشاهده کنید.
روشهای شناسایی ترکیبات آلی
روشهای متنوع و متعددی برای شناسایی ترکیبات آلی وجود دارد که در هر مورد باید با توجه به تجهیزات موجود و نمونهای که در دست داریم، کارآمدترین روش را انتخاب کنیم. در ادامه میخواهیم به بررسی این روشها بپردازیم و نحوه انجام آنها را بهتفضیل مورد بررسی قرار دهیم.
شناسایی ترکیبات آلی با کروماتوگرافی
بسیاری از روشهای جداسازی و شناسایی ترکیبات آلی بر مبانی «کروماتوگرافی» (Chromatography) انجام میشوند که جداسازی اجزای سازنده یک ترکیب بر پایه تفاوتی است که در پخش آنها در دو فاز متفاوت مشاهده میشود. برای درک بهتر این مفهوم مثالی را مورد بررسی قرار میدهیم.
فرض کنید ترکیبی داریم متشکل از متان گازی و آمونیاک و این ترکیب را در معرض آب قرار میدهیم. آمونیاک انحلالپذیری بسیار بالایی در آب دارد، بهطوری که در فشار ۱ اتمسفر ۹۰ گرم آن در ۱۰۰ گرم آب حل میشود. بنابراین آمونیاک به آب وارد میشود. این در حالی است که متان تقریبا در آب نامحلول است و در هر ۱۰۰ گرم آب تنها ۰٫۰۰۳ گرم از آن حل میشود. در این صورت عمده متان در فاز گازی باقی میماند.
در این فرآیند آمونیاک و متان در جداسازی یک مرحلهای بین فاز آبی و گازی جدا شدهاند و این جداسازی را میتوان با تماس مکرر لایه گازی با آب کارآمدتر کرد. این فرآیند که باید بهصورت مکرر انجام شود، در صورتی که کارآیی داشته باشد، بسیار خستهکننده است و در صورتی که توزیع آنها در فازها مشابه باشد، کار دشوارتری خواهد بود. برای جلوگیری از انجام این فرآیند، افزایش کارآیی و کاهش زمان مورد نیاز میتوان این کار را به کمک روشهای کروماتوگرافی به انجام رساند.
کروماتوگرافی گاز-مایع
«ستون کروماتوگرافی» (Chromatographic Column) این امکان را در اختیار قرار میدهد که «فاز ساکن» (Stationary Phase) در تماس با «فاز متحرک» (Moving Phase) قرار بگیرد. کاربرد ستون کروماتوگرافی را برای مثالی که در بالا زدیم، مورد بررسی قرار میدهیم. فرض کنید نمونهای حاوی متان و آمونیاک گازی به ستونی بلند تزریق میشود. این ستون دارای «مهرههای شیشهای» (Glass Beads) است که با آب مرطوب شدهاند. در این ستون جریان آرامی از گازی بیاثر مانند نیتروژن یا هلیوم (در نقش حامل) عبور داده میشود تا نمونه گازی را به پیش براند.
زمانی که آمونیاک در آب حل و جریان گاز حاصل در حرکت در ستون با آب مواجه میشود، جداسازی چندمرحلهای رخ میدهد. در این صورت گاز حامل غنی از متانی است که در آب انحلالپذیری بسیار کمی دارد و پیش از جز دیگر ظهور پیدا میکند. سپس گاز پساب که حاوی آمونیاک است خارج میشود. این توضیحی بسیار ساده از فرآیندی است که با نام «کروماتوگرافی گاز-مایع» (Gas Liquid Chromatography) شناخته میشود. در بسیاری موارد این روش را بهصورت مخفف با GC نمایش میدهند.
استفاده از این روش بسیار کارآمد است و تحلیل و جداسازی بسیاری از ترکیبات آلی را متحول کرده است. این روش را میتوان روی ترکیباتی با مقادیر اندکی از «فراریت» (Volatility) در دمای معقول و قابل دستیابی به کار گرفت. امروزه و با پیشرفت تجهیزات، روشهای کروماتوگرافی گاز-مایع، تماما تحت کنترل کامپیوتر انجام میشود که در آن برنامهریزی دما صورت میگیرد. روشهای بسیار متنوعی برای اندازهگیری غلظت مواد در گاز حامل وجود دارد و برخی از آنها حساسیت بسیار بالایی دارند، بهصورتی که برای انجام کروماتوگرافی به مقادیر بسیار اندکی از نمونه، مثلا $$ 10^{-9} $$ گرم نیاز خواهد بود.
در فرآيندهای همیشگی کروماتوگرافی گاز-مایع چند میکرولیتر از ترکیب آلی مایع به «بخارساز» (Vaporizer) تزریق میشود تا برای آنالیز با جریان گاز همراه شود. سپس این ماده به همراه جریان گاز، ستون بلند و داغی را میپیماید که با جامدی متخلخل، مانند آجر نسوز، و آغشته به مایعی غیرفرار پر شده است.
در این مرحله جدایی گاز و مایع اتفاق میافتد و تفاوتهای موجود بین هر جداسازی را میتوان با تکرار این فرآيند در ستونهای طولانی مشخص کرد. بهطور معمول با اندازهگیری تفاوت موجود در «هدایت حرارتی» (Thermal Conductivity) گازهای خروجی، شناسایی صورت میگیرد. در تصویر زیر میتوانید الگوی یک شناسایی ترکیبات آلی به کمک کروماتوگرافی گاز-مایع را مشاهده کنید. این روش برای شناسایی مقادیر بسیار اندکی از ناخالصی در جهت افزایش خلوص مواد، بسیار مفید و کارآمد است زیرا میتوان در نمودار خروجی قله مربوط به هر ماده را تشخیص داد و مشاهده کرد. برای این کار نیاز است که مقدار نمونه افزایش پیدا کند.
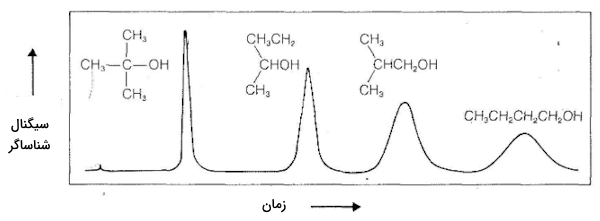
کروماتوگرافی مایع-جامد
«کروماتوگرافی مایع-جامد» (Liquid Solid Chromatography) یا «کروماتوگرافی ستونی» (Column Chromatography) در ابتدا برای جداسازی ترکیبات رنگی توسعه پیدا کرد. نام این روش نیز نشاندهنده این مسئله است زیرا در یونانی «کروما» (Chroma) به معنی رنگ است. در ادامه نمونهای از این جداسازی را که در شناسایی ترکیبات آلی بسیار کاربردی است، با جزئیات مورد بررسی قرار میدهیم. فرض کنید ترکیبی رنگی در دست داریم و به وجود ناخالص در آن مشکوک هستیم. این نمونه را در حلالی مناسب حل میکنیم و به آن زمان میدهیم تا از ستون عبور کند. این ستون با جاذبی جامد مانند «آلومینا» (Alumina) و «سیلیکا» (Silica) پر میشود. در تصویر زیر میتوانید نمونهای از این ستون را مشاهده کنید.
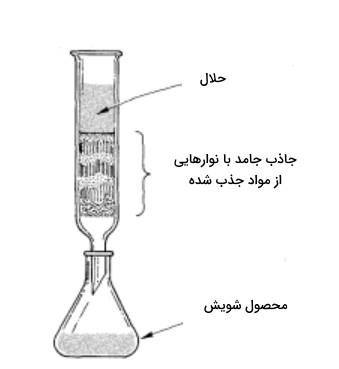
سپس با گذر حلالی مناسب که مواد جذب شده را میشوید و به پایین میآورد، «نمودار شویش» (Chromatogram) به دست میآيد. در صورتی این نمودار به دست آمده مطلوب است که جذب اجزای مختلف بر فاز جامد با یکدیگر متفاوت باشد تا بتوان مناطقی متفاوت با رنگهای مجزا مشاهده کرد. جذبی که در بالاترین نقطه ستون قرار بگیرد، بیشترین جذب را با بستر جامد دارد و به همین صورت جذبی که در انتهای ستون مشاهده شود، کمترین میزان جذب را در بین اجزای مخلوط دارد. این مناطق مجزا با جذبهای متفاوت را میتوان هم بهصورت مکانیکی از یکدیگر جدا کرد، هم از حلالی مناسب استفاده کرد که توانایی شویش آنها را داشته باشد. تنها در صورتی جداسازی بهخوبی صورت میگیرد که هر جزء با جذب متفاوت را بتوان جداگانه به دست آورد تا برای شناسایی و تحلیلهای بعدی آماده باشد.
کروماتوگرافی مایع-جامد بهصورتی که تا به اینجا توضیح دادیم، اولین بار در سال ۱۹۰۶ توسط بیوشیمیدان روس «میخاییل تسوت» (Mikhail Tsvet) ابداع شد. در سالهای پیش رو این روش ارتقا پیدا کرد و تسهیل شد. همچنین قدرت جداسازی و کارآیی آن نیز افزایش پیدا کرد.
کروماتوگرافی لایه نازک
در «کروماتوگرافی لایه نازک» (Thin Layer Chromatography) که بهطور ویژه برای تحلیلهای سریع به کار گرفته میشود، جاذبی با نگهدارندگی مناسب بهصورت یکنواخت روی پلیتی شیشهای پهن میشود. سپس قطرهای از محلول مورد آزمایش را در نزدیکی لبه پلیت میگذاریم. در مرحله بعد پلیت در ظرفی گذاشته میشود که در آن محلول شویشی قرار دارد. توجه داشته باشید که در این مرحله محلول شویشی باید حتما به میزانی باشد که قطره نمونه در آن باشد. با گذر زمان محلول از پلیت بالا میرود و مواد موجود در قطره نیز به همراه آن اما با سرعتهای متفاوت به سمت بالا حرکت میکنند.
این حرکت را میتوان مشابه آنچه در یک ستون کروماتوگرافی اتفاق میافتد دانست. برای شناسایی در این مرحله از روشهای متفاوتی استفاده میشود. در صورتی که لکهها رنگی باشند، میتوان آنها را بهسادگی با چشم تشخیص داد. همچنین میتوان از تابش نور فرابنفش برای مشخص شدن آنها استفاده کرد. در روشی دیگر محلولی که با لکههای موجود تشکیل مادهای رنگی میدهند را روی سطح آن اسپری میکنند. از مزیتهای این روش میتوان به این نکته اشاره کرد که نمونه بسیار کمی در حد کمتر از میکروگرم برای انجام آن نیاز است.
کروماتوگرافی جامد-مایع در فشار بالا
ارتقای روشهای انجام کروماتوگرافی به روشی بسیار کارآمد انجامید که «کروماتوگارفی جامد-مایع در فشار بالا» (High Pressure Solid Liquis Chromatography) نامیده میشود. افزایش فشار سیستم تا ۲۰ الی ۷۰ اتمسفر باعث افزایش سرعت جداسازی میشود و این امکان را به وجود میآورد که بتوان ترکیباتی با ذرههای بسیار کوچکتری را مورد آزمایش و مطالعه قرار داد. این ذرهها سطح تماس بیشتری دارند و برای ستونهای کروماتوگرافی با گرانش بالا کاربردی هستند. نظارت خودکار بر خروجی ستون توسط طیفسنجی فرابنفش یا با تغییر در ضریب شکست، روشی کارآمد برای تشخیص و انجام فرآيند جداسازی است. با انجام این روش میتوان به کروماتوگرام جداسازی دست پیدا کرد. کروماتوگرافی جامد-مایع با فشار بالا که از آن در بسیاری موارد با عنوان HPLC یاد میشود، مزیتهای بسیاری برای تحلیل و جداسازی مولکولها با وزن بالا دارد. از طرفی میتوان توسط این روش ترکیبات حساس به دما را مورد آزمایش قرار دارد. توجه داشته باشید که از این ترکیبات در روش GC نمیتوان استفاده کرد.
یکی دیگر از مزیتهای کروماتوگرافی جامد-مایع این است که میتوان در آن از یک تکیهگاه جامد برای برخی ترکیبات استفاده کرد. این ترکیبات در جداسازی، تمایل ویژهای به برخی از ترکیبات خاص دارند. از این روش به خصوص برای جداسازی آنزیمها استفاده میشود و فاز ساکن در این مورد میتواند ترکیبی باشد که با آنزیم واکنش میهد یا کمپلکسی را به وجود میآورد.
نتایج حاصل از کروماتوگرافی
در صورتی که در کروماتوگرام حاصل از یک کروماتوگرافی تنها یک قله به دست بیاید، میتوان اینطور نتیجهگیری کرد که نمونه مورد آزمایش خالص است. گرچه نمیتوان این را به قطعیت گفت و نیاز به بررسی آن در روشهای دیگر نیز وجود دارد. جداسازی آلایندههایی که باعث ایجاد ناخالصی میشوند، در صورتی که دارای ویژگیهای یکسان یا مشابه با ترکیب مورد نظر باشند، میتواند بسیار دشوار باشد. همچنین اگر دانستن درجه خلوص از اهمیت بالایی برخوردار باشد، میتوان کروماتوگرافی را به دفعات و با جاذبهای متفاوتی به انجام رساند و نتایج آنها را با یکدیگر مقایسه کرد. در صورت به دست آوردن نتایج مشابه، فرض ما بر خالص بودن ترکیب قوت بیشتری میگیرد. گرچه در هر مورد بهتر است از روشهای بیشتری برای اطمینان استفاده کرد.
شناسایی ترکیبات آلی با طیفسنجی
یکی از روشهایی که میتوان به کمک آن به شناسایی ترکیبات آلی پرداخت، استفاده از «طیفسنجی» (Spectroscopy) است. روشهای طیفسنجی از تنوع بسیار بالایی برخوردارند و اطلاعات سودمندی در مورد ساختار ترکیبات در اختیار ما قرار میدهند. در ادامه میخواهیم برخی از روشهای متدوال و کاربردی طیفسنجی را مورد بررسی قرار دهیم.
شناسایی ترکیبات آلی با طیف سنجی جرمی
در «طیفسنجی جرمی» (Mass Spectroscopy)، نمونه به وسیله پرتوی الکترونی با انرژی متوسط ( ۱۱۵۰ تا ۲۳۰۰ کیلو کالری بر مول) در خلاء بالا بمباران میشود. در مرحله بعد، ذرههای باردار شده مورد تحلیل قرار میگیرند. بسیاری از طیفسنجهای جرمی بهصورتی تنظیم شدهاند که ذره و قطعاتی با بار مثبت را تحلیل کنند. با این حال مطالعه روی ذرههایی با بار منفی نیز توسط طیفسنجی جرمی ممکن است. اجزای سازنده یک طیفسنج جرمی را در تصویر زیر مشاهده میکنید.
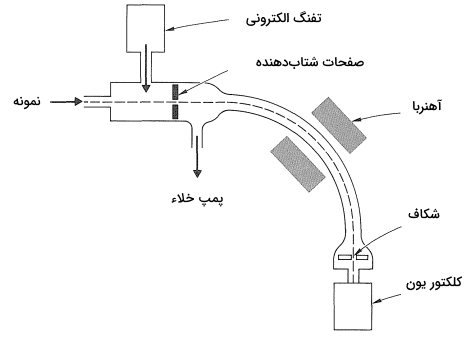
یونهای مثبتی که تحت تاثیر الکترون به وجود آمدهاند به وسیله صفحات شتابدهنده با بار منفی، شتاب میگیرند و از منحنی لوله آنالیزور پایین میروند. این یونها در این مسیر با توجه به نسبت جرم به بار خود (m/e) دستهبندی میشوند. این کار را یک آهنربا انجام میدهد. در این مرحله تنها یونهایی که دارای یک عدد جرمی هستند با وضوح بالا از شکاف رد میشوند و به «کلکتور» (Collector) برخورد میکنند. یونهایی با عدد جرمی نزدیک به چند هزار نیز قابلیت انجام این کار را دارند. میزان حضور طیف وسیعی از اعداد جرمی مورد نظر را میتوان با رسم سرعت جمعآوری یونها به عنوان تابعی از میدان مغناطیسی، به دست آورد.
مثالی از طیفسنجی جرمی
در این بخش میخواهیم به بررسی مثالی از کاربرد طیفسنجی جرمی بپردازیم. در تصویر زیر «طیف جرمی» (Mass Spectra) سه ترکیب آلی ۲-پروپانون، ۲-بوتانون و پروپانال را مشاهده میکنید. هر قله در این طیف نشاندهنده یونی با جرم مشخص است که در فرآیند قطعهقطعه شدن مولکول توسط بمباران الکترونی ایجاد شده است. برخی از این قطعهها را در فهرست زیر مشاهده میکنید.
- $$CH_3^+$$
- $$CH_3CH_2^+$$
- $$ CH_3CO^+ $$
الگوهای شکست در طیفسنجی جرمی به انرژی بمباران الکترونی بستگی دارد و مانند اثرانگشتی بسیار محنصربهفرد برای هر مولکول عمل میکند. برای مثال به این نکته توجه داشته باشید که ۲-پروپانون و پروپانال با یکدیگر ایزومر هستند اما الگوی شکست آنها با یکدیگر بهطرز چشمگیری تفاوت دارد.
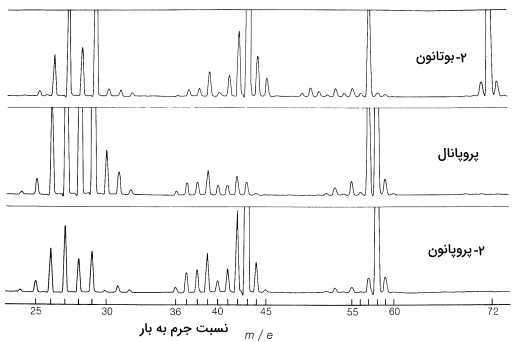
قلهای که عدد جرمی بالاتری از بقیه دارد، اهمیت بالایی دارد زیرا نشاندهنده مولکول والد بهصورتی است که از آن تنها یک الکترون کم شده باشد. این قله را با $$M^+$$ نشان میدهند. استفاده از جرم به دست آمده در این روش، برای به دست آوردن جرم مولکولی ترکیبات ناشناخته مفید است، زیرا این کار را با دقت بسیار بالایی انجام میدهد. توجه داشته باشید که در صورتی که یون $$M^+$$ پیش از رسیدن به کلکتور به قطعههای کوچکتر تبدیل شود، جرمی که به دست میآيد صحیح نخواهد بود.
موردی دیگر که میتواند باعث ایجاد خطا شود، حالتی است که دو قطعه با یکدیگر ترکیب میشوند و قطعهای را به وجود میآورند که از یون $$ M^+ $$ سنگینتر است. در شناسایی ترکیبات آلی این نکته را به یاد داشته باشید که قله مربوط به یون $$M^+$$ در الکلها و هیدروکربنهای شاخهای، ضعیف است و شکسته میشود. این معنا که یک مولکول آب یا گروههای موجود در زنجیرههای جانبی خود را از دست میدهند. در چنین ترکیباتی پیک مربوط به $$M^+$$ ممکن است ۰٫۱٪ یا کمتر از بلندترین قله باشد که به نام «قله پایه» (Base Peak) شناخته میشود و به آن شدت دلخواه ۱۰۰ نسبت داده میشود.
فشار نمونه در منبع یون طیفسنج جرمی بهطور معمولی در حد $$10^{-5}$$ میلیمتر جیوه است و تحت این شرایط، تشکیل قطعاتی که قلههایی قابل توجه با نسبت جرم به بار بیشتر از یون $$M^+$$ به دست بدهند، تقریبا نادر است. در این مورد استثنایی وجود دارد که مربوط به قله گونه $$(M+1)^+$$ است. این قطعه از انتقال یک هیدروژن از $$M$$ به $$M^+$$ به وجود میآيد. شدت نسبی قله این قطعه، بهطور معمول به فشار حساس است و میتوان به این صورت آن را شناسایی کرد.
محاسبه ترکیب عنصری
با در دست داشتن وزن مولکولی از طریق قله یون $$M^+$$ با اطمینان قابل قبول، مرحله بعد تعیین فرمول مولکولی است. در صورتی که وضوح طیفسنج بالا باشد میتوان ترکیب عنصری هر یون را به کمک مقدار جرم به بار دقیق آن به دست آورد. بسیاری از طیفسنجها قادر به تفکیک یونهایی که تفاوت نسبت جرم به بار آنها کمتر از یک واحد جرمی است را ندارند. در این موارد میتوان از فراوانی ایزوتوپ برای انجام محاسبات بهره برد. در ادامه میخواهیم با بررسی یک مثال ساده، این مورد را بررسی کنیم.
مثال محاسبات به کمک فراوانی ایزوتوپ
بلندترین قلهها در یک طیف جرمی دارای مقادیر جرم به بار برابر با ۶۴ و ۶۶ هستند که به یون $$M^+$$ نسبت داده میشوند. شدت نسبی این دو قله بهصورت ۳:۱ است. ترکیب عنصری را در این مورد پیدا کنید.
پاسخ
توجه داشته باشید که نسبت فراوانی ۳:۱ مشخصه بارز ایزوتوپهای کلر است که بهصورت زیر نمایش داده میشوند.
$$ ^{35}Cl:^{37}Cl=3:1 $$
بنابراین قلههای ۶۴ و ۶۶، هر دو یونهای مولکولی هستند. قله ۶۴ مربوط به یونی است که حاوی $$^{35}Cl$$ باشد و قله ۶۶ نیز مربوط به یونی است که حاوی $$^{37}Cl$$ باشد. در این مولکولها عنصرهای دیگری نیز وجود دارد که جرم آنها را میتوان بهصورت زیر به دست آورد.
$$64-35=29$$
$$66-37=29$$
ترکیبهای متفاوتی از عنصرها را میتوان متصور شد که جمع وزن مولکولی آنها برابر با عدد ۲۹ شود. به تعدادی از آنها در فهرست زیر که ترکیبی از هیدروژن، نیتروژن، اکسیژن و کربن است، در زیر اشاره کردهایم.
- $$N_2H$$
- $$CHO$$
- $$CH_3N$$
- $$C_2H_5$$
از این بین ترکیبی که در همراهی با کلر از نظر شیمیایی منطقی است، $$C_2H_5$$ است. بنابراین فرمول مولکولی این نمونه بهصورت $$C_2H_5Cl$$ است که کلرواتان نامیده میشود. در این مثال، به شناسایی ترکیبات آلی به کمک طیفسنجی جرمی پرداختیم.
شناسایی ترکیبات آلی با طیف سنجی رزونانس مغناطیسی هستهای
«طیفسنجی رزونانس مغناطیسی هستهای» (Nuclear Magnetic Resonance Spectroscopy) که بهصورت مخفف با NMR نمایش داده میشود، یکی از بهترین روشهایی است که برای شناسایی ترکیبات آلی وجود دارد. قوانین پایهای این روش طیفسنجی ساده است که در ادامه به آن خواهیم پرداخت.
هسته اتمهای بسیاری در میدان مغناطیسی مانند آهنرباهای بسیار کوچکی عمل میکنند و با یکدیگر همراستا میشوند. در NMR، انرژی مورد نیاز برای همراستایی آهنرباهای هستهای در میدان مغناطیسی را اندازهگیری میکنیم. برای درک بهتر این موضوع، رفتار پروتون $$^1H$$ را در میدان مغناطیسی در نظر بگیرید. با توجه به جهت میدان اعمالی، دو امکان برای این همراستایی وجود دارد. این را میتوانید در تصویر زیر مشاهده کنید.
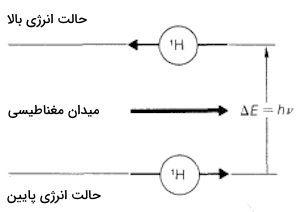
آهنرباهای هستهای میتوانند در راستای میدان مغناطیسی یا خلاف آن قرار بگیرند. توجه داشته باشید که این دو جهتگیری با یکدیگر برابر نیستند و برای تبدیل همراستایی پایدارتر به همراستایی دیگر به انرژی نیاز است.
در تصویر زیر اجزای یک دستگاه NMR را مشاهده میکنید. زمانی که مادهای مانند اتانول در «سیمپیچ فرستنده» (Transmiter Coil) قرار میگیرد، میدان مغناطیسی بهصورت تدریجی افزایش مییابد و در مقدار خاصی از قدرت میدان، انرژی فرکانس رادیویی توسط نمونه جذب میشود و آمپرمتر افزایشی را در جریان سیمپیچ نشان میدهد. توجه داشته باشید که اتانول را میتوان بهصورت $$CH_3-CH_2-OH$$ نمایش داد و هیدروژنهای آن مغناطیسی هستند. طیف به دست آمده توسط NMR برای نمونه اتانول، مانند اثرانگشتی عمل میکند و معرف آن خواهد بود.
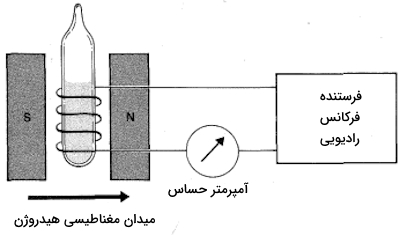
در ادامه میخواهیم بدانیم از رزونانس مغناطیسی هستهای برای چه روشهایی میتوان استفاده کرد. ویژگیها مغناطیسی همیشه در هستههایی با جرم فرد مشاهده میشود. در فهرست زیر تعدادی از این هستههای را آوردهایم.
- $$^1H$$
- $$^{13}C$$
- $$^{15}N$$
- $$^{17}O$$
- $$^{19}F$$
- $$^{31}P$$
همچنین دسته دیگری از ترکیبات نیز در رزونانس مغناطیس هستهای کاربرد دارند. این دسته از ترکیبات دارای عدد جرمی زوج اما عدد اتمی فرد هستند و در فهرست زیر به تعدادی از آنها اشاره کردهایم.
- $$^2H$$
- $$^{10}B$$
- $$^{14}N$$
هستههایی مانند $$^{12}C$$ و$$^{16}O$$ و $$^{32}S$$ که دارای عدد اتمی و عدد جرمی زوج هستند، فاقد ویژگیهای مغناطیسی هستند و از خود هیچ سیگنالی در روزنانس مغناطیسی هستهای نشان نمیدهند. به دلایل متعددی تنها استفاده از طیف NMR چند هسته متدوال است و در این بخش میخواهیم تنها به بررسی طیف هستههای هیدروژن-۱ و کربن-۱۳ بپردازیم.
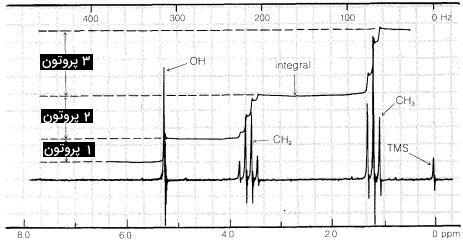
در این بخش میخواهیم نوعی از طیفسنجی NMR را مورد بررسی قرار دهیم که تنها در حالت مایع یا محلول قابلیت انجام دارد. خوشبختانه طیف گستردهای از حلالها را میتوان در این روش به کار برد که میتوان از این بین به انواع هیدروکربنها و اسید سولفوریک غلیظ اشاره کرد و برای بسیاری از ترکیبات میتوان با کمی جستجو، حلالی مناسب پیدا کرد.
طیف رزونانس مغناطیس هستهای میتواند خیلی ساده باشد، بهصورتی که تنها از یک قله تشکیل شده باشد. اما در این روش شاهد طیفهایی هستیم که از تصویر بالا بسیار پیچیدهتر هستند. با این وجود باید بدانیم که هر طیف با هر میزان از پیچیدگی، شامل سه مولفه است که از اهمیت بهسزایی برخوردار است. در ادامه آنها را آوردهایم.
- «جابهجایی شیمیایی» (Chemical Shift)
- «شکافت اسپین اسپین» (Spin Spin Splitting)
- «فرآيندهای سینتیکی» (Kinetic Process)
جابهجایی شیمیایی
در طیف مربوطه به اتانول که در بخش قبلی مشاهده کردید، ۳ گروه اصلی از خطوط مشاهده میشود که نشاندهنده حضور ۳ نوع هیدروژن متفاوت در مولکول است. این هیدروژنها را میتوان بهصورت زیر دستهبندی کرد.
- ۳ عدد هیدروژن موجود در متیل: $$CH_3$$
- ۲ عدد هیدروژن موجود در متیلن: $$CH_2$$
- ۱ عدد هیدروژن موجود در هیدروکسیل: $$OH$$
روش سیستماتیک شناسایی ترکیبات آلی
تا اینجا در مورد روشهایی که برای جداسازی و شناسایی ترکیبات آلی به کار میروند، بهتفضیل صحبت کردیم. در این بخش میخواهیم شناسایی ترکیبات آلی را بهصورت سیستماتیک مورد بررسی قرار دهیم.
در فهرست زیر مراحل طی شده در این روش را مشاهده میکنید. سپس در مورد هر کدام از آنها جزئیات مورد نیاز را خواهیم آورد.
- آزمون مقدماتی
- آزمون انحلالپذیری
- شناسایی عنصرهای اضافی
- تشخیص گروه عاملی
- تعیین ثابتهای فیزیکی و شناسایی ترکیبات
- آزمون تایید
در ادامه میخواهیم بدانیم در هر کدام از این مراحل چه فعالیتهایی انجام میشود.
آزمون مقدماتی
در این آزمون ویژگیهای متفاوت فیزیکی ترکیبات را در چند مرحله مورد بررسی قرار میدهیم. توجه داشته باشید که میتوانید اطلاعات به دست آمده را در هر مورد تطبیق دهید و استنباط مورد نیاز را از آن داشته باشید.
آزمون ماهیت فیزیکی
ترکیبات مورد آزمایش میتوانند به دو حالت فیزیکی جامد و مایع حضور داشته باشند و در هر حالت فیزیکی دستههای خاصی از ترکیبات حضور دارند که در زیر مشاهده میکنید. تنها از حالت فیزیکی ماده میتوان به اطلاعات مفیدی در مورد آن دست یافت و به شناسایی ترکیبات آلی پرداخت.
- ماهیت فیزیکی جامد: در صورتی که ترکیب جامد باشد به خانواده کربوهیدرات، اسید، فنول، آمین و هیدروکربنهای سنگینتر تعلق دارد.
- ماهیت فیزیکی مایع: در صورتی که ترکیب مایع باشد به خانواده الکل، کتون، آلدهید، استر، فنول و آمین تعلق دارد.
توجه داشته باشید که برخی از ترکیبات میتوانند به هر دو حالت فیزیکی حضور داشته باشند و در هر دو دسته آورده شدهاند. برای داشتن اطلاعات بیشتر به آزمونهای بعدی اتکا میکنیم.
آزمون رنگ
با توجه به رنگ هر ترکیب میتوان در مورد آنها حدسهایی زد که در فهرست زیر تعدادی از آنها را مشاهده میکنید.
- جامد زردرنگ: «متا دینیترو بنزن» (m- Dinitrobenzene)، «پارا نیترو تولوئن» (p- Nitro toluene)، «نیترو فنول» (Nitro Phenol)، «نیترو آنیلین» (Nitro Aniline)
- مایع زردرنگ: «نیترو بنزن» (Nitrobenzene)
- قهوهایرنگ: «پارا تولوئیدین» (p- Toluidine)، «رزورسینول» (Resorcinol)
- مشکیرنگ: «آلفا نفتول» (α- Naphtol)، «بتا نفتول» (ß- Naphtol)
- صورتیرنگ: «آلفا نفتول» (α- Naphtol)، «بتا نفتول» (ß- Naphtol)
- رنگ بژ و مایل به قرمز: «آنیلین» (Aniline)، «فنول» (Phenol)، «آمین آروماتیک» (Aromatic Amine)
- بیرنگ: اسید ساده، «الکل» (Alcohol)، «استر» (Ester)، «کتون» (Ketone)، «هیدروکربن آروماتیک» (Aromatic Hydrocarbon)
آزمون بو
با توجه به بویی که هر ماده شیمیایی میدهد میتوان در مورد آنها اطلاعاتی به دست آورد. در فهرست زیر تعدادی از آنها را آوردهایم.
- بوی کربولیکی: «فنول» (Phenol)، «کرسول» (Cresol)
- بوی شبیه ماهی: «آمین» (Amine)
- بوی شیرین دلپذیر: «استر» (Ester)، «الکل» (Alcohol)، «مشتقهای هالوژنی» (Halogen Derivatives)
- بوی بادام تلخ: «نیتروبنزن» (Nitrobenzene)، «بنزآلدهید» (Benzaldehyde)
- بوی قرص ضدبید یا نفتالن: «نفتالن» (Naphthalene)
- بدون بویی خاص: «اسیدهای آروماتیک» (Aromatic Acid)، «آمید» (Amide)، «کربوهیدرات» (Carbohydrate)
آزمون شعله
با توجه به نوع سوختن ماده در شعله نیز میتوان در مورد آن ترکیب به نتایجی رسید. در این مورد به فهرست زیر توجه کنید.
- سوختن همراه با دوده: ترکیبات آروماتیک یا ترکیبات آلیفاتیک دارای مقادیری از هیدروژن هستند. برای مثالی میتوان به $$CHCl_3$$، $$CCl_4$$ اشاره کرد.
- سوختن بدون شعله: ترکیبات آلیفاتیک
- سوختن و تبدیل شدن به زغال: کربوهیدارتها و «سولفانیلیک اسید» (Sulfanilic Acid)
آزمونهای اشباع
از آزمون اشباع میتوان اطلاعاتی در مورد ترکیبات آلی به دست آورد. این آزمون به دو صورت انجام میشود که در ادامه هر دوی آنها را بررسی خواهیم کرد.
آزمون پتاسیم پرمنگنات
برای انجام این آزمون ابتدا ترکیب مورد نظر را با ۲ میلیلیتر آب مخلوط میکنیم و بهخوبی هم میزنیم. سپس به این مخلوط ۲ قطره از محلول پتاسیم پرمنگنات رقیق با فرمول شیمیایی $$KMnO_4$$ اضافه میکنیم. در ادامه ۲ حالت ممکن است به وجود بیاید که به شرح زیر هستند.
- از بین رفتن رنگ پتاسیم پرمنگنات: ترکیباتی که باعث از بین رفتن رنگ پتاسیم پرمنگنات میشوند، یا غیراشباع هستند یا به سادگی اکسید میشوند.
- باقی ماندن رنگ پتاسیم پرمنگنات: ترکیباتی که اشباع باشند، تاثیری روی رنگ پتاسیم پرمنگنات ندارند.
آزمون آب برم
برای انجام این آزمون ابتدا ترکیب مورد نظر را با ۲ میلیلیتر آب مخلوط میکنیم و بهخوبی هم میزنیم. سپس به این مخلوط ۲ قطره از «آب برم» (Bromine Water) اضافه میکنیم. در ادامه ۳ حالت ممکن است به وجود بیاید که به شرح زیر هستند.
- از بین رفتن رنگ آب برم: در صورتی که با اضافه کردن آب برم رنگ محلول از بین برود، «ترکیب غیراشباع» (Unsaturated Compound) است.
- از بین رفتن رنگ به همراه تشکیل رسوب: در این حالت ترکیب میتواند به راحتی جایگزین شود.
- باقی ماندن رنگ: اگر رنگ ترکیب در این آزمون از بین نرود، «ترکیب اشباع» (Saturated Compound) است.
آزمون انحلالپذیری
آزمون انحلالپذیری به دو صورت انجام میشود که هر کدام روشهای متنوعی دارند. اطلاع از شرایط انحلالپذیری یک ماده کمک فروانی به شناسایی ترکیبات آلی میکند. در ادامه آنها را به تفکیک آوردهایم.
آزمون انحلالپذیری برای ترکیبهای محلول و امتزاج پذیر با آب
در مورد اول برای نمونههایی است که ترکیب در آب حل شود یا با آن امتزاجپذیر باشد. آزمون انحلالپذیری برای ترکیبات محلول و امتزاجپذیر به سه روش کلی انجام میدهد که در ادامه به بررسی آنها میپردازیم.
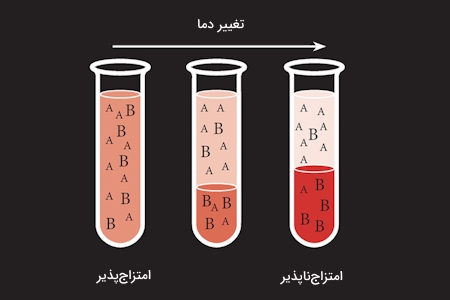
آزمون اول انحلالپذیری
ابتدا ۰٫۱ گرم از نمونه را جدا و به آن ۳ میلیلیتر آب اضافه کنید و بهخوبی تکان دهید. محلول را با کاغذ لیتموس مورد آزمایش قرار میدهیم. در ادامه ۴ حالت امکان بروز دارد که آنها را در زیر مشاهده میکنید.
- ترکیب حل میشود: اعضای سبک خانواده الکل، استر، کتون و کربوهیدرات
- کاغذ آبی لیتموس، قرمز میشود: در نمونه ترکیبهای اسیدی و فنولی محلول در آب وجود دارند.
- کاغذ قرمز لیتموس، آبی میشود: در نمونه باز محلول در آب وجود دارد.
- تغییری در کاغذ لیتموس ایجاد نمیشود: در نمونه ترکیبات خنثی محلول در آب وجود دارد.
آزمون دوم انحلالپذیری
ابتدا ۰٫۱ گرم از نمونه را جدا و به آن محلول سدیم هیدروژن کربنات اشباع با فرمول شیمیایی $$NaHCO_3$$ اضافه کنید. جوشش شدیدی ایجاد میشود و ترکیب در آن حل میشود. سپس به این محلول شفاف، هیدروکلریک اسید غلیظ با فرمول شیمیایی $$HCl$$ اضافه کنید. در ادامه اگر جامدی در محلول، تشکیل رسوب ندهد، میتوان اینطور جمعبندی کرد که در نمونه اسیدهای محلول در آب حضور دارند.
آزمون سوم انحلالپذیری
ابتدا ۰٫۱ گرم از نمونه را جدا و به آن ۳ میلیلیتر آب اضافه کنید و بهخوبی تکان دهید تا نمونه در آن حل شود. سپس به این محلول شفاف محلول الکلی آهن (III) کلرید اضافه کنید. در صورتی که با این کار رنگ محلول از آبی به بنفش تغییر کند، متوجه میشویم که در آن فنول محلول در آب وجود دارد.
آزمون انحلالپذیری برای ترکیبهای غیرمحلول و امتزاج ناپذیر با آب
آزمون انحلالپذیری برای ترکیبهایی که در آب حل نمیشوند و با آن امتزاج ناپذیر هستند به چهار روش انجام میشود که در ادامه آنها را مشاهده میکنید.
آزمون اول انحلالپذیری
ابتدا ۰٫۱ گرم از نمونه را با ۳ میلیلیتر از محلول سدیم هیدروژن کربنات اشباع با فرمول شیمیایی $$NaHCO_3$$ حل کنید. محلول را بهخوبی هم بزنید تا تمام ترکیبات در آن حل شود. سپس به این محلول شفاف، قطرهقطره از محلول هیدروکلریک اسید غلیظ اضافه کنید. پس از این در صورتی که جوشش شدیدی در محلول صورت بگیرد حدس میزنیم که در نمونه کربوکسیلیک اسید حضور داشته باشد و با ظهور جامدی که تشکیل رسوب میدهد از حدس خود اطمینان حاصل میکنیم.
آزمون دوم انحلالپذیری
ابتدا ۰٫۱ گرم از نمونه را با ۳ میلیلیتر از محلول سدیم هیدروکسید رقیق با فرمول شیمیایی $$NaOH$$ حل کنید. محلول را بهخوبی هم بزنید تا تمام ترکیبات در آن حل شود. سپس به این محلول شفاف، قطرهقطره از محلول هیدروکلریک اسید غلیظ اضافه کنید. پس از این با مشاهده جامد یا امولسیون متوجه میشویم که در آن ترکیباتی فنولی حضور دارند.
آزمون سوم انحلالپذیری
ابتدا ۰٫۱ گرم از نمونه را با ۳ میلیلیتر از محلول هیدروکلریک اسید ۱:۱ حل کنید. محلول را بهخوبی هم بزنید تا تمام ترکیبات در آن حل شود. سپس به این محلول شفاف، قطرهقطره از محلول سدیم هیدروکسید ۲۰٪ اضافه کنید. در صورتی که در این مرحله جامدی تشکیل شود، متوجه حضور باز در نمونه اولیه میشویم.
آزمون چهارم انحلالپذیری
اگر نمونه در محلولهای سدیم هیدروژن کربنات، سدیم هیدروکسید و هیدروکلریک اسید نامحلول باشد، نشاندهنده این است که در آن ترکیباتی خنثی حضور دارند.
شناسایی عنصرهای اضافی
برای انجام این آزمون بهصورت زیر عمل میکنیم که «آزمون لاسانی» (Lassaigne's test) یا « آزمون گداخت سدیم» (Sodium Fusion Test) نام دارد. این مرحله یکی از مراحل مهم در شناسایی ترکیبات آلی است.
- یک قطعه کوچک از فلز عنصر سدیم خشک را در «لوله فیوژن» (Fusion Tube) قرار دهید تا زمانی که فلز ذوب شود.
- همان مقدار از نمونه را نیز به این لوله اضافه کنید. در صورتی که نمونه به شکل مایع است، دو قطره از آن کافی است.
- ابتدا به ملایمت به آن گرما دهید و سپس گرما را تا جایی افزایش دهید که رنگ آن قرمز شود.
- لوله قرمز داغ را در یک لوله آزمایش با ۱۰ میلیلیتر آب مقطر مستقر در یک ظرف چینی فرو کنید. سپس بلافاصله آن را با یک ورق آزبست بپوشانید و لوله فیوژن را کاملا خرد کنید.
- این همجوشی را به دفعات تکرار کنید. سپس عصاره حاصل را به مدت ۵ دقیقه بجوشانید تا حجم آن به ۵ میلیلیتر کاهش پیدا کند و آن را صاف کنید. در ادامه میتوانید آزمونهای زیر را روی این نمونه به انجام برسانید و حضور یا عدم حضور عنصرهای مختلف را در آن بررسی کنید.
آزمون نیتروژن
۱ میلیلیتر از نمونه به دست آمده در مرحله بالا را با ۲ تا ۳ قطره محلول سدیم هیدروکسید مخلوط کنید تا محیط بازی شود. سپس چند قطره از محلول آهن(II) سولفات تازه را به آن اضافه کنید و برای چند دقیقه نمونه را بجوشانید. نمونه را سرد کنید و به آن چند قطره از هیدروکلریک اسید رقیق یا سولفوریک اسید رقیق اضافه کنید تا اسیدی شود. پس از این مرحله، در صورت مشاهده رنگ آبی نیلی یا سبز، میتوان اینطور استنباط کرد که در نمونه، عنصر نیتروژن وجود دارد.
آزمون گوگرد
آزمون تشخیص عنصر گوگرد را میتوان به ۳ روش مختلف به انجام رساند که در ادامه آنها را مشاهده میکنید.
آزمون اول
۱ میلیلیتر از عصاره به دست آمده را با ۱ میلیلیتر از استیک اسید ۲ نرمال و ۱ میلیلیتر محلول سرب استات مخلوط کنید. در صورتی که پس از آن شاهد تشکیل رسوبی به رنگ مشکی بودید، به این معناست که در نمونه گوگرد وجود دارد.
آزمون دوم
۱ میلیلیتر از عصاره به دست آمده را با ۱ قطره از محلول سدیم نیتروپروسید با فرمول شیمیایی $$ Na_2[Fe(CN)_5NO]$$ مخلوط کنید. در صورت مشاهده رنگ بنفش، متوجه میشویم که در نمونه گوگرد وجود دارد.
آزمون سوم
۱ میلیلیتر از عصاره به دست آمده در بالا را با محلول آلی آهن(III) کلرید مخلوط کنید. در صورتی که رنگی قرمز به دست بیاید متوجه میشویم که در نمونه هم نیتروژن، هم گوگرد حضور دارند.
آزمون هالوژن
برای آزمون هالوژن نیز از عصاره به دست آمده در بالا استفاده میشود. برای پی بردن به حضور یا عدم حضور هالوژن میتوان یکی از دو آزمون زیر را انجام داد.
آزمون اول
در این آزمون ابتدا ۱ میلیلیتر از عصاره را با ۱ میلیلیتر نیتریک اسید مخلوط میکنیم. اگر در مراحل قبل به این جمعبندی رسیده باشیم که نمونه حاوی دو عنصر نیتروژن و گوگرد است، در این مرحله باید آن را بهخوبی بجوشانیم. سپس به آن محلول نقره نیترات ۵٪ با فرمول شیمیایی $$AgNO_3$$ اضافه میکنیم. در صورتی که پس از این مرحله شاهد تشکیل رسوبی سفید باشیم، متوجه میشویم که در نمونه هالوژن وجود دارد.
آزمون دوم
در صورتی که در مرحله قبل به این نتیجهگیری برسیم که در نمونه، هالوژن وجود دارد، آزمون دوم را انجام میدهیم تا به کمک آن متوجه شویم چه عنصر هالوژنی حضور دارد.
ابتدا ۱ میلیلیتر از عصاره را با ۱ میلیلیتر از سولفوریک اسید رقیق و ۰٫۵ میلیلیتر از کلروفرم با فرمول شیمیایی $$CH_3Cl_3$$ و ۰٫۵ میلیلیتر از آب کلر مخلوط میکنیم. این مخلوط را بهخوبی هم میزنیم و رنگ لایه کلروفرم را مد نظر قرار میدهیم.
- رنگ بنفش: در صورت مشاهده رنگ بنفش، هالوژن موجود، عنصر ید است.
- رنگ زرد و قهوهای: اگر شاهد این رنگ باشیم، هالوژن موجود، عنصر برم است.
- بیرنگ: اگر در این مرحله رنگی مشاهده نشود، هالوژن موجود، عنصر کلر است.
دستهبندی ترکیبات بر اساس عنصرهای موجود
در مرحله پیش مشاهده کردید که میتوان در مورد حضور یا عدم حضور برخی از عنصرها در ترکیبات آلی آزمونهایی را به انجام رساند. با توجه به اطلاعات به دست آمده در مرحله قبل، میتوان یک تقسیمبندی کلی داشت. توجه داشته باشید که هر کدام از این گروهها، با توجه به اطلاعات تکمیلی در مراحل بعد، به زیرشاخههایی تقسیم میشوند و برای شناسایی ترکیبات آلی بسیار کمککننده هستند.
گروه ۱
در صورتی که ترکیبی حاوی ۳ عنصرهای کربن، هیدروژن و اکسیژن باشد، در یکی از دستههای زیر میگنجد.
- کربوکسیلیک اسید
- فنول
- خنثی
گروه ۲
در صورتی که ترکیبی آلی حاوی عنصرهای کربن، هیدروژن، اکسیژن، نیتروژن و گوگرد باشد، بهصورت زیر قابل دستهبندی است.
- اسید
- خنثی
گروه ۳
در صورتی که ترکیبی آلی حاوی عنصرهای کربن، هیدروژن، اکسیژن و نیتروژن باشد، بهصورت زیر قابل دستهبندی است.
- کربوکسیلیک اسید
- فنول
- باز
- خنثی
گروه ۴
در صورتی که ترکیبی آلی حاوی عنصرهای کربن، هیدروژن، اکسیژن و هالوژن باشد، بهصورت زیر قابل دستهبندی است.
- خنثی
تشخیص گروه عاملی در گروه ۱
در این بخش میخواهیم بدانیم با توجه به اطلاعاتی که در مراحل قبل به دست آوردهایم، چطور میتواند در مورد گروه(های) عاملی موجود در هر ترکیب اظهار نظر کنیم. اطلاع از گروههای عاملی موجود در هر ساختار، کمک فراوانی به شناسایی ترکیبات آلی میکند. در ادامه نحوه تشخیص گروههای عاملی، در ترکیبات متعلق به گروه ۱ که پیش از این به آن پرداختهایم را مورد بررسی قرار میدهیم.
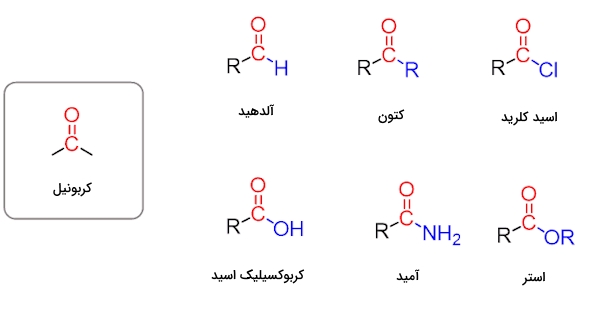
گروه عاملی کربوکسیلیک اسید
برای تشخیص حضور یا عدم حضور گروه عاملی کربوکسیلیک اسید، میتوان از آزمونهای زیر بهره برد.
آزمون اول
۰٫۱ گرم از نمونه را با ۳ میلیلیتر از محلول سدیم هیدروژن کربنات مخلوط میکنیم. مخلوط را بهخوبی هم میزنیم تا نمونه در آن حل شود. سپس یه این محلول رقیق به صورت قطرهای از هیدروکلریک اسید غلیظ اضافه میکنیم. در صورت ایجاد جوشش شدید متوجه میشویم که در نمونه کربوکسیلک اسید وجود دارد. با مشاهده رسوب این برداشت تایید میشود.
آزمون دوم
در این آزمون ۰٫۵ گرم از نمونه را با ۱ میلیلیتر آب مخلوط میکنیم و به خوبی هم میزنیم. سپس به آن ۱ تا ۲ قطره از محلول آهن(III) کلرید الکلی اضافه میکنیم. در ادامه با توجه به شرایط متفاوتی که به وجود میآید، میتوان در مورد گروه عاملی موجود در ترکیب اظهار نظر کرد.
- تشکیل رسوب به رنگ زرد نخودی: در صورت مشاهده رسوبی به رنگ زرد نخودی نتیجه میگیریم که در نمونه «بنزوئیک اسید» (Benzoic Acid) یا «فتالیک اسید» (Phthalic Acid) وجود دارد.
- تشکیل رسوب به رنگ بنفش: در صورتی که در نمونه شاهد تشکیل رسوب بنفش باشیم، بر وجود «سالیسیلیک اسید» (Salicylic Acid) در نمونه دلالت دارد.
- تشکیل رسوب به رنگ بنفش با دادن حرارت: در صورتی که رسوب بنفش تنها پس از دادن حرارت در نمونه مشاهده شود به این معناست که در آن «استیل سالیسیلیک اسید» (Acetyl Salicylic Acid) حضور دارد.
- تشکیل رسوب زرد: در صورتی که شاهد تشکیل رسوب در نمونه به رنگ زرد باشیم، اینطور جمعبندی میکنیم که در آن «سینامیک اسید» (Cinnamic Acid) وجود دارد.
- تشکیل رسوب قرمز ملایم: با مشاهده رسوبی به رنگ قرمز ملایم متوجه میشویم که در نمونه «سوکسینیک اسید» (Succinic Acid) وجود دارد.
- تشکیل رسوب خردلی: زمانی که در این شرایط در نمونه رسوبی به رنگ خردلی تشکیل میشود، به این معناست که در آن «سیتریک اسید» (Citric Acid) وجود دارد.
- عدم مشاهده تغییر: در صورتی که در محلول آهن(III) کلرید هیچ تغییری مشاهده نشود، در نمونه «اگزالیک اسید» (Oxalic Acid) وجود دارد.
گروه عاملی فنول
برای تشخیص حضور یا عدم حضور گروه فنول، میتوان از آزمونهای زیر بهره برد.
آزمون اول
در این آزمون ۰٫۱ گرم از نمونه را با ۳ میلیلیتر از محلول سدیم هیدروکسید رقیق مخلوط میکنیم و به خوبی آنها را هم میزنیم. سپس به این محلول شفاف قطرهقطره از هیدروکلریک اسید غلیظ اضافه میکنیم. در این صورت نمونه بهطور کامل حل میشود و در صورت مشاهده رسوب یا امولسیون میتوانیم نتیجه بگیریم که در نمونه فنول حضور دارد.
آزمون دوم
برای انجام این آزمون ۰٫۱ گرم از نمونه را با ۳ میلیلیتر آب یا الکل مخلوط میکنیم و آنها را هم میزنیم. سپس یک قطره از محلول آهن(III) کلرید الکلی یا خنثی به نمونه اضافه میکنیم. در این مرحله احتمالهای گوناگونی وجود دارد که آنها را در فهرست زیر مشاهده میکنید.
- مشاهده رنگ بنفش: در این صورت در نمونه فنول حضور دارد.
- مشاهده رنگ آبی بنفش: با مشاهده این رنگ نتیجه میگیریم که در نمونه «رزورسینول» (Resorcinol) وجود دارد.
- تشکیل رسوب سفید که در گذر زمان به رنگ صورتی، آبی یا بنفش متمایل میشود: در این صورت در نمونه «آلفا نفتول» (α- naphthol) وجود دارد.
- مشاهده رنگ سبز: با مشاهده رنگ سبز متوجه میشویم که در نمونه «بتا نفتول» (ß- naphthol) وجود دارد.
آزمون سوم
از این آزمون با عنوان «آزمون فتالئین» (Phthalein Test) نام برده میشود که مراحل انجام آن را در ادامه مشاهده میکنید. مقدار ۰٫۰۱ گرم از نمونه را با ۰٫۰۱ گرم از «فتالیک انیدرید» (Phthalic Anhydride) و ۲ قطره از سولفوریک اسید غلیظ مخلوط میکنیم. این مخلوط را حرارت میدهیم تا زمانی که ذوب شود. سپس آن را سرد میکنیم و در بشری حاوی ۲۰ میلیلیتر از محلول سدیم هیدروکسید رقیق سرریز میکنیم. در ادامه با توجه به مشاهدات خود میتوانیم در مورد آن اظهار نظر کنیم.
- رنگ صورتی: در صورت مشاهده رنگ صورتی متوجه میشویم که در نمونه فنول حضور دارد.
- رنگ سبز یا آبی: با مشاهده رنگ سبز یا آبی یکی از دو ترکیب آلفا نفتول و بتا نفتول در نمونه حضور دارند.
- رنگ فلورسانس زرد متمایل به سبز: مشاهده این رنگ بر وجود رزورسینول دلالت دارد.
آزمون چهارم
این روش به نام «آزمون لیبرمن» (Liebermann Test) مشهور است و بهصورت زیر انجام میشود. ۰٫۰۱ گرم از نمونه را با ۱ میلیلیتر از سولفوریک اسید غلیظ و دو تکه از بلور سدیم نیتریت با فرمول شیمیایی $$NaNO_2$$ مخلوط میکنیم. به این مخلوط حرارت ملایمی میدهیم و سپس آن را با آب رقیق میکنیم و از محلول سدیم هیدروکسید ۲۰٪ به آن اضافه میکنیم. در صورت مشاهده رنگ قرمز یا آبی متمایل به سبز متوجه میشویم که نمونه فنولی است.
آزمون تشخیص کربوهیدراتها
برای تشخیص حضور کربوهیدرات در یک ترکیب از «آزمون مولیش» (Molish Test) استفاده میشود که در ادامه مراحل آن را بررسی خواهیم کرد. توجه داشته باشید که این آزمون تنها در صورتی باید انجام شود که ترکیب بیرنگ باشد و در آب نیز حل شود. برای انجام این آزمون ۰٫۵ گرم از نمونه را در ۱ میلیلیتر آب حل میکنیم و ۲ تا ۳ قطره از آلفا نفتول ۱۰٪ حل شده در اتیل الکل را به آن اضافه میکنیم. همچنین نیاز به افزودن ۱ میلیلیتر از سولفوریک اسید غلیظ به این مخلوط داریم. در صورتی که در سطح مقطع دو فاز ترکیب، شاهد رنگ بنفش باشیم، متوجه میشویم که در آن کربوهیدرات وجود دارد.
آزمون تشخیص آلدهیدها و کتونها
در این آزمون ۰٫۰۵ گرم از نمونه را با ۳ میلیلیتر از ۲و۴- دی نیترو فنیل هیدرازین مخلوط میکنیم و آنها را بهخوبی هم میزنیم. در صورت مشاهده رسوبهای بلوری به رنگ زرد یا نارنجی متمایل به قرمز اینطور نتیجهگیری میکنیم که در نمونه آلدهید یا کتون حضور دارد.
در صورتی که پاسخ این مرحله مثبت باشد و بخواهیم از حضور آلدهید یا کتون در نمونه اطمینان حاصل کنیم، آزمونهای بعدی را انجام میدهیم.
آزمون تشخیص آلدهید
برای تشخیص حضور آلدهید در نمونه میتوان از ۴ روش زیر بهره برد.
آزمون اول
این روش به نام «آزمون شیف» (Schiff's Test) شناخته میشود و به شرح زیر است. ابتدا ۰٫۰۵ گرم از نمونه را با ۲ تا ۳ میلیلیتر از واکنشدهنده شیف مخلوط میکنیم و بهخوبی آنها را به هم میزنیم. در ادامه شاهد وضعیتهای متفاوتی خواهیم بود.
- پیدایش سریع رنگ بنفش: در صورت مشاهده رنگ بنفش به این نتیجه میرسیم که در نمونه آلدهید آلیفاتیک حضور دارد.
- پیدایش آهسته رنگ صورتی: اگر محلول به آهستگی به رنگ صورتی در بیاید، دلالت بر وجود آلدهید آروماتیک دارد.
آزمون دوم
نام این روش «آزمون تولنز» (Tollen's Test) یا «آزمون آینه نقرهای» (Silver Miror Test) است که در ادامه جزئیات انجام آن را مشاهده میکنید. برای انجام این آزمون ۰٫۱ گرم از نمونه را با ۲ تا ۳ میلیلیتر از واکنشدهنده تولنز (برای مثال محلول نقره نیترات آمونیاکی) مخلوط میکنیم. این نمونه را در حمام آب جوش قرار میدهیم تا گرم شود. پس از این مرحله اگر شاهد تشکیل آینه نقرهای در بخش داخلی لوله آزمایش باشیم، نتیجه میگیریم که در نمونه آلدهید حضور دارد.
آزمون سوم
این روش را به نام «آزمون فهلینگ» (Fehling Solution Test) میشناسیم و بهصورت زیر آن را انجام میدهیم. توجه داشته باشید که در این روش منظور از محلول فهلینگ $$A$$، محلول آبی رنگ سولفات مس و منظور از محلول فهلینگ $$B$$، محلول بیرنگ پتاسیم سدیم تارتارات است. مقدار ۰٫۱ گرم از نمونه را با ۱ میلیلیتر از محلول فهلینگ $$A$$ و ۱ میلیلیتر از محلول فهلینگ $$B$$ مخلوط میکنیم و به آرامی به آن حرارت میدهیم. در صورتی که شاهد تشکیل رسوب قرمزرنگ اکسید مس باشیم، در نمونه آلدهید حضور دارد.
آزمون چهارم
آخرین روشی که میتوان برای تشخیص آلدهید از آن بهره برد، «آزمون بندیکت» (Benedict's Test) نامیده میشود که در آن ۰٫۱ گرم از نمونه را با محلول بندیکت مخلوط میکنیم و به آرامی به آنها گرما میدهیم. در صورتی که طی اعمال حرارت شاهد رنگ قرمز رسوب اکسید مس باشیم، به این نتیجه میرسیم که در نمونه آلدهید حضور دارد.
آزمون تشخیص کتون
در صورتی که در دو مرحله قبل، وجود آلدهید یا کتون تایید شده باشد، این آزمون را روی نمونه انجام میدهیم. در این آزمایش مقدار ۰٫۱ گرم از نمونه را با ۱ میلیلیتر از محلول سدیم نیترو پروسید و ۲ قطره از سدیم هیدروکسید مخلوط میکنیم. در صورتی که شاهد رنگ قرمز یا نارنجی متمایل به قرمز باشیم، میتوان نتیجهگیری کرد که در نمونه گروه عاملی کتون حضور دارد.
آزمون تشخیص استر
برای انجام این آزمون ۰٫۱ گرم یا ۰٫۵ میلیلیتر از نمونه را در ۱ میلیلیتر اتیل الکل حل میکنیم و سپس به آن ۱ قطره فنول فتالئین و ۲ قطره از محلول بسیار رقیق سدیم هیدروکسید اضافه میکنیم. این مخلوط را در حمام آب گرم در حال جوش قرار میدهیم. ظهور رنگ صورتی در این محلول دلالت بر حضور گروه عاملی استر در نمونه دارد.
آزمون تشخیص الکل
برای اینکه بتوان به وجود الکل در نمونهای پی برد، از آزمونهای زیر استفاده میکنیم.
آزمون اول
در این آزمون تکهای بسیار کوچک از فلز سدیم خشک را در لوله فیوژن میاندازیم و چند قطره از نمونه را به آن اضافه میکنیم. در صورتی که گاز هیدروژن با سرعت بالایی از آن خارج شود، در نمونه الکل حضور دارد.
آزمون دوم
در این آزمون ۱ میلیلیتر از استیل کلرید را در لوله آزمایشی خشک میریزیم و به آن چند قطره از نمونه را اضافه میکنیم. در صورت مشاهده جوشش شدید، میتوان اینطور نتیجهگیری کرد که در نمونه گروه عاملی الکل حضور دارد.
آزمون تشخیص اتر
در این آزمون ۰٫۱ گرم از نمونه را با ۱ میلیلیتر از ید در کربن دیسولفید ترکیب میکنیم و بهخوبی هم میزنیم. در صورتی که لایههای بنفشرنگ $$CS_2$$ به قهوهای تغییر رنگ بدهند، متوجه میشویم که در نمونه، گروه عاملی اتر حضور دارد.
آزمون تشخیص هیدروکربن
برای انجام این آزمون ابتدا ۰٫۱ گرم از نمونه را با ۱ تا ۲ میلیلیتر آب مخوط میکنیم و آنها را بهخوبی هم میزنیم. سپس به آن ۱ تا ۲ قطره از محلول پتاسیم پرمنگنات بسیار رقیق اضافه میکنیم و دوباره آنها را با یکدیگر مخلوط میکنیم. با توجه به مشاهدات خود در این مرحله میتوان در مورد حضور یا عدم حضور هیدروکربن در نمونه اظهار نظر کرد.
- در صورتی که تمام آزمونهایی که در بالا به آنها پرداختهایم، رد شوند، میتوان بهسادگی به این نتیجه رسید که نمونه حاوی هیدروکربن است.
- در صورتی که رنگ محلول از بین برود، به این معناست که در آن «هیدروکربنهای غیراشباع» (Unsaturated Hydrocarbon) حضور دارد.
- در صورتی که رنگ محلول از بین نرود و باقی بماند، به این نتیجه میرسیم که در نمونه «هیدروکربن اشباع» (Saturated Hydrocarbon) وجود دارد.
تشخیص گروه عاملی در گروه ۲
در این مرحله میخواهیم بدانیم چطور میتوان گروههای عاملی را در ترکیبات متعلق به گروه ۲ تشخیص داد. مانند قبل برای هر گروه عاملی آزمونهای متفاوتی وجود دارد که آنها را مرحله به مرحله مورد بررسی قرار میدهیم.
آزمون تشخیص کربوکسیلیک اسید
برای پی بردن به حضور یا عدم حضور گروه عاملی کربوکسیلیک اسید در این ترکیبات، میتوان از آزمونهای زیر استفاده کرد.
آزمون اول
در این آزمون مقدار ۰٫۱ گرم از نمونه را با ۲ تا ۳ میلیلیتر از محلول سدیم هیدروژن کربنات اشباع مخلوط میکنیم و بهخوبی هم میزنیم. سپس به این محلول شفاف از هیدروکلریک اسید غلیظ قطرهقطره اضافه میکنیم. با توجه به مشاهدات میتوان در مورد آن اظهار نظر کرد.
- مشاهده جوشش شدید و حل شدن ترکیب: در این صورت میتوان اینطور جمعبندی کرد که در نمونه نیترو کربوکسیلیک اسید یا آمینو کربوکسیلیک اسید حضور دارد.
- تشکیل رسوب: با مشاهده تشکیل رسوب متوجه میشویم که در نمونه نیترو کربوکسیلیک اسید وجود دارد.
- عدم تشکیل رسوب: در صورت عدم تشکیل رسوب، در نمونه آمینو کربوکسیلیک اسید وجود دارد.
آزمون دوم
در صورتی که در آزمون قبل به این نتیجه برسیم که در نمونه نیترو کربوکسیلیک اسید وجود دارد، برای تایید آزمون دوم را نیز انجام میدهیم. در این آزمون ۰٫۲ گرم از نمونه را با ۲ میلیلیتر از اتیل الکل و ۰٫۱ گرم از سدیم کلرید جامد و ۰٫۱ گرم از پودر روی مخلوط میکنیم. این مخلوط را به مدت ۵ دقیقه میجوشانیم و پس از ۵ دقیقه جوشاندن، آن را صاف میکنیم و به آن از واکنشدهنده تولنز اضافه میکنیم. در صورت مشاهده رسوب خاکستری یا مشکی میتوان با اطمینان گفت که گروههای نیترو در نمونه حضور دارند.
آزمون سوم
در صورتی که در آزمون اول به این نتیجه برسیم که در نمونه آمینو کربوکسیلیک اسید وجود دارد، برای تایید آزمون سوم را نیز انجام میدهیم. در این آزمون ۰٫۵ گرم از نمونه را با ۳ تا ۴ میلیلیتر از هیدروکلریک اسید با نسبت ۱:۱ مخلوط میکنیم و بهخوبی هم میزنیم. پس از سرد شدن به آن چند قطره از محلول سدیم نیتریت ۲٪ اضافه میکنیم. در این مرحله محلول شفافی به دست میآید که آن را به محلول بتا نفتول بازی اضافه میکنیم. در این مرحله اگر شاهد رنگدانههای نارنجی باشیم به این معناست که گروه آمین نوع اول آرماتیک در نمونه حضور دارد.
آزمون تشخیص فنول
برای تشخیص گروه عاملی فنول در ترکیبات گروه ۲، از آزمونهای زیر بهره میبریم.
آزمون اول
مقدار ۰٫۱ گرم از نمونه را با محلول سدیم هیدروکسید رقیق مخلوط میکنیم. سپس به آن بهصورت قطرهای از هیدروکلریک اسید میافزاییم.در این مرحله سه حالت مختلف امکان بروز دارد که به شرح زیر هستند.
- حل شدن نمون و تشکیل رنگ زرد تند یا نارنجی: در صورت مشاهده این رنگ، اینطور نتیجهگیری میکنیم که در نمونه نیترو فنول و آمینو فنول حضور دارد.
- تشکیل مجدد رسوب: با مشاهده تشکیل مجدد رسوب متوجه میشویم که نمونه دارای نیترو فنول است.
- عدم تشکیل مجدد رسوب: در صورتی که مجددا شاهد تشکیل رسوب نباشیم، نمونه حاوی آمینو فنول است.
آزمون دوم
در صورتی که در آزمون قبل به این جمعبندی برسیم که در نمونه نیترو فنول حضور دارد، برای تایید آن آزمون دوم را انجام میدهیم. در این آزمون ۰٫۲ گرم از نمونه را با ۲ میلیلیتر از اتیل الکل و ۰٫۱ گرم از سدیم کلرید جامد و ۰٫۱ گرم از پودر روی مخلوط میکنیم. این مخلوط را به مدت ۵ دقیقه میجوشانیم و پس از ۵ دقیقه جوشاندن، آن را صاف میکنیم و به آن از واکنشدهنده تولنز اضافه میکنیم. در صورت مشاهده رسوب خاکستری یا مشکی میتوان با اطمینان گفت که گروههای نیترو در نمونه حضور دارند.
آزمون سوم
در صورتی که در آزمون اول به این نتیجه برسیم که در نمونه آمینو فنول وجود دارد، برای تایید آزمون سوم را نیز انجام میدهیم. در این آزمون ۰٫۵ گرم از نمونه را با ۳ تا ۴ میلیلیتر از هیدروکلریک اسید با نسبت ۱:۱ مخلوط میکنیم و بهخوبی هم میزنیم. پس از سرد شدن به آن چند قطره از محلول سدیم نیتریت ۲٪ اضافه میکنیم. در این مرحله محلول شفافی به دست میآید که آن را به محلول بتا نفتول بازی اضافه میکنیم. در این مرحله اگر شاهد رنگدانههای نارنجی باشیم به این معناست که گروه آمین نوع اول آرماتیک در نمونه حضور دارد.
آزمون تشخیص بازهای نیتروژنی
برای تشخیص حضور یا عدم حضور بازهای نیتروژنی و همچنین نوع آنها، آزمونهایی را انجام میدهیم که در ادامه به آنها اشاره کردهایم.
آزمون اول
برای انجام این آزمون ابتدا ۰٫۵ گرم از نمونه را با ۳ تا ۴ میلیلیتر از هیدروکلریک اسید با نسبت ۱:۱ مخلوط میکنیم. سپس آنها را بهخوبی هم میزنیم و صاف میکنیم.بعد از صاف کردن قطرهقطره از سدیم هیدروکسید ۲۰٪ به آن میافزاییم. در ادامه با توجه مشاهدات میتوان به جمعبندیهایی رسید.
- حل شدن نمونه: در صورتی که نمونه در این شرایط حل شود، متوجه میشویم که در آن آمین حضور دارد.
- تشکیل دوباره جامد یا امولسیون: با مشاهده تشکیل دوباره جامد، حضور آمین تایید میشود.
آزمون دوم
در این آزمون مقدار ۰٫۵ گرم از نمونه را با ۳ تا ۴ میلیلیتر از هیدروکلریک اسید ۱:۱ مخلوط میکنیم و بهخوبی هم میزنیم. پس از خشک شدن به آن چند قطره از محلول سدیم نیتریت ۲٪ اضافه میکنیم. در ادامه شرایط مختلفی که امکان بروز دارد را مشاهده میکنید.
- مشاهده رنگ زرد تند، قرمز و سبز: در صورتی که در محلول این رنگها را مشاهده کنیم، متوجه میشویم که در آن گروه آمین نوع سوم آروماتیک حضور دارد.
- مشاهده امولسیون سفید و زرد: اگر این رنگها را در محلول مشاهده کنیم، اینطور نتیجهگیری میکنیم که در آن گروه آمین نوع دوم آروماتیک وجود دارد.
- مشاهده رنگدانه نارنجی: در این مورد محلول شفافی به دست میآید که آن را به محلول بتا نفتول بازی اضافه میکنیم. در صورتی که شاهد به وجود آمدن رنگدانههای نارنجی باشیم، در نمونه آمین نوع اول آروماتیک حضور دارد.
آزمون تشخیص ترکیبات خنثی حاوی اتم نیتروژن
در این بخش میخواهیم روشهایی را ارائه دهیم که برای تشخیص ترکیبات متعلق به گروه ۲ که خنثی و حاوی اتم عنصر نیتروژن هستند، مفید و کاربردی است. این آزمونها توانایی شناسایی گروههای مختلفی را در ترکیبات دارد که در ادامه آنها را مشاهده میکنید.
آزمون تشخیص دیفنیل آلانین
در این آزمون ۱ تا ۲ بلور از نمونه را با ۱ میلیلیتر از اسید سولفوریک غلیظ و نیتریک اسید غلیظ یا ۱ قطره از محلول سدیم نیتریت رقیق مخلوط میکنیم. در صورتی که در این مرحله شاهد رنگ آبی تندی باشیم، متوجه میشویم که در نمونه دیفنیل آلانین حضور دارد.
آزمون تشخیص آمیدها
آمیدها ترکیباتی شیمیایی هستند که در آنها گروه عاملی آمید وجود دارد که کربن آنها از یک طرف با پیوند دوگانه به اکسیژن و از طرف دیگر به $$NH_2$$ متصل است. در ادامه میخواهیم به بررسی روشهایی بپردازیم که برای شناسایی آنها کاربردی هستند.
آزمون اول
۰٫۲ گرم از نمونه را با ۳ میلیلیتر از محلول سدیم هیدروکسید ۲۰٪ مخلوط کنید و آن را به مدت ۲ دقیقه بجوشانید. در این مرحله با توجه به گازی که متصاعد میشود، میتوانیم در مورد ترکیب اظهار نظر کنیم. در صورتی که گاز آزاد شده آمونیاک باشد که میتوان آن را از بویی که آزاد میکند تشخیص داد، جمعبندی این است که در نمونه گروههای آمیدی حضور دارند.
آزمون دوم
در این آزمون ۰٫۲ گرم از نمونه را با ۳ میلیلیتر از محلول سدیم هیدروکسید ۲۰٪ مخلوط کنید و آن را به مدت ۲ دقیقه بجوشانید. سپس از یک کاغذ لیتموس مرطوب برای شناسایی استفاده میکنیم و آن را در لبه لوله آزمایش قرار میدهیم. در صورتی که کاغذ لیتموس از قرمز به آبی تغییر رنگ دهد، حضور ترکیبهای آمیدی در نمونه تایید میشود.
آزمون سوم
در این آزمون نیز در ابتدا به روش آزمونهای قبلی عمل میکنیم. به این صورت که ۰٫۲ گرم از نمونه را با ۳ میلیلیتر از محلول سدیم هیدروکسید ۲۰٪ مخلوط میکنیم و آن را به مدت ۲ دقیقه میجوشانیم. سپس یک همزان شیشهای را در هیدروکلریک اسید غلیظ فرو میکنیم و آن را در نزدیکی دهانه لوله آزمایش قرار میدهیم. در صورتی که بخارهای سفیدی بهصورت متراکم اطراف همزن شیشهای را بپوشاند، به حضور آمید در نمونه پی میبریم.
آزمون تشخیص آنیلید
در این آزمون ابتدا ۰٫۱ گرم از نمونه را با ۱ میلیلیتر از هیدروکلریک اسید غلیظ مخلوط میکنیم و آن را به مدت ۱ دقیقه میجوشانیم. پس از سرد شدن به آن ۵ میلیلیتر آب و چند قطره از محلول سدیم نیتریت سرد اضافه میکنیم. در این مرحله باید ترکیب را بهخوبی هم بزنیم. سپس به آن محلول بازی بتا نفتول را اضافه میکنیم. در صورتی که شاهد ظهور رنگدانههایی به زنگ نارنجی باشیم، متوجه میشویم که در نمونه گروههای آنیلیدی حضور دارند.
آزمون گروههای نیترو
برای تشخیص حضور یا عدم حضور گروههای نیترو در یک نمونه از روشهای متفاوتی میتوان بهره برد که در ادامه آنها را مشاهده میکنید.
آزمون اول
این آزمون را به نام «آزمون مولیکن» (Muliken's Test) میشناسیم و روش انجام آن به این صورت است که ابتدا ۰٫۲ گرم از نمونه را با ۲ میلیلیتر اتیل الکل و ۰٫۱ گرم آمونیوم کلرید جامد و ۰٫۱ گرم از پودر روی مخلوط میکنیم. سپس این ترکیب را به مدت ۵ دقیقه میجوشانیم و پس از صاف کردن به آن از واکنشدهنده تولنز اضافه میکنیم. در صورتی که در این مرحله شاهد تشکیل رسوبی به رنگ خاکستری یا مشکی باشیم به حضور گروههای نیترو در آن پی میبریم.
آزمون دوم
نام این روش «آزمون رنگدانه آزو» (Azo Dye Test) است و در صورتی که گروه آمین نوع اول در نمونه حضور نداشته باشد، تنها این آزمون را روی آن انجام میدهیم. در این آزمون ۰٫۵ گرم از نمونه را با ۰٫۵ گرم از فلز قلع و ۲ میلیلیتر هیدروکلریک اسید غلیظ مخلوط میکنیم. سپس این مخلوط را به مدت ۳ دقیقه میجوشانیم و آن را صاف میکنیم. پس از سرد شدن آن را با ۵ میلیلیتر آب رقیق میکنیم و چند قطره سدیم نیتریت نیز به آن اضافه میکنیم. این ترکیب را به محلول بازی بتا نفتول میافزاییم. در این مرحله اگر شاهد ظهور رنگدانههای نارنجی باشیم، نتیجه میگیریم که در نمونه گروههای نیترو حضور دارند.
آزمون سوم
از این آزمون میتوان به حضور یا عدم حضور ترکیبهای دینیترو استفاده کرد. مقدار ۰٫۵ گرم از نمونه را با ۱ تا ۲ میلیلیتر از استون مخلوط میکنیم و آن را بهخوبی هم میزنیم تا نمونه کاملا حل شود. سپس به آن ۱ تا ۲ قطره از محلول سدیم هیدروکسید رقیق میافزاییم. در صورتی که در این مرحله شاهد ظهور رنگ بنفش تیره باشیم، حضور ترکیبهای دینیترو در نمونه تایید میشود.
در ادامه میخواهیم به بررسی آزمونهایی بپردازیم که برای تشخیص حضور گروههای عاملی در ترکیبات متعلق به گروه ۳ از آنها استفاده میشود.
آزمون تشخیص اسید
برای تشخیص حضور اسیدها در ترکیبات متعلق به گروه ۳، از آزمونهای زیر استفاده میشود.
آزمون آمینو سولفونیک اسید
برای تشخیص حضور آمینو سولفوینیک اسیدها دو روش وجود دارد که آنها را در ادامه آوردهایم.
آزمون اول
در این آزمون مقدار ۰٫۲ گرم از نمونه را با ۳ تا ۴ میلیلیتر از محلول سدیم هیدروژن کربنات اشباع مخلوط میکنیم. در صورتی که شاهد ایجاد جوشش و حل شدن ترکیب باشیم، نتیجه میگیریم که در نمونه آمینو سولفونیک اسید حضور دارد.
آزمون دوم
در این آزمون مقدار ۰٫۵ گرم از نمونه را با ۳ تا ۴ میلیلیتر از هیدروکلریک اسید ۱:۱ مخلوط میکنیم و بهخوبی هم میزنیم. پس از خشک شدن به آن چند قطره از محلول سدیم نیتریت ۲٪ اضافه میکنیم و محلول شفافی به دست میآید که آن را به محلول بتا نفتول بازی اضافه میکنیم. در صورتی که شاهد به وجود آمدن رنگدانههای نارنجی باشیم، در نمونه آمین نوع اول آروماتیک حضور دارد.
آزمون تشخیص گروههای خنثی
در نهایت نیز میتوان برای تشخیص برخی گروههای خنثی به روش زیر عمل کرد.
آزمون تشخیص تیواوره
تیواوره در آب محلول است و تغییری در کاغذ لیتموس ایجاد نمیکند. برای شناسایی آن ۰٫۱ گرم از نمونه را با ۲ میلیلیتر محلول سدیم هیدروکسید ۲۰٪ مخلوط میکنیم و آن را میجوشانیم. پس از سرد شدن به آن چند قطره از محلول سرب استات اضافه میکنیم. در صورتی که در این مرحله رسوب مشکی رنگی به دست بیاید، حضور تیواوره تایید میشود.
در ادامه میخواهیم بدانیم برای تشخیص حضور هالوژن در ترکیبات خنثی متعلق به گروه ۴ از چه روشی میتوان استفاده کرد.
آزمون تشخیص هالوژن در ترکیب خنثی
در این آزمون ۰٫۲ گرم از نمونه را با ۲ تا ۳ میلیلیتر از محلول سدیم هیدروکسید رقیق مخلوط میکنیم و برای چند دقیقه آنها را میجوشانیم. پس از سرد شدن به آن نیتریک اسید میافزاییم تا اسیدی شود و سپس ۱ میلیلیتر از محلول نقره نیترات نیز به آن اضافه میکنیم. در ادامه شرایط گوناگونی به وجود میآيد که به بررسی آنها خواهیم پرداخت.
- تشکیل رسوب سفید یا زرد: در صورتی که شاهد تشکیل رسوب سفید یا زرد باشم، در نمونه ترکیبهای هالید آلیفاتیک مانند $$CHCl_3$$ و $$CCl_4$$ حضور دارند.
- عدم تشکیل رسوب: در صورتی که در انتهای این آزمون رسوبی تشکیل نشود، متوجه میشویم که در نمونه کلروبنزن یا برموبنزن حضور دارد.
تعیین ثابتهای فیزیکی و شناسایی ترکیبات
برای به دست آوردن نقطه ذوب و نقطه جوش ترکیبات آلی میتوان آنها را لوله مویرگی با انتهای بسته ریخت و از روشهای موجود بهره برد.
با توجه به آزمونهایی که مورد بررسی قرار دادیم، میتوان بهصورت سیستماتیک و مرحلهای به اطلاعات بسیاری در مورد یک ترکیب آلی رسید و فرآیند شناسایی ترکیبات آلی را به انجام رساند.
معرفی کتاب شناسایی ترکیبات آلی
تا اینجا متوجه شدیم که روشهای بسیار متنوعی برای شناسایی ترکیبات آلی وجود دارد و هر کدام از این روشها خود به چندین زیرشاخه طبقهبندی میشوند. به دلیل اهمیت این روشها، دانشجویان و افراد مشغول در حوزههای مرتبط، نیاز به منبعی دارند که بتوانند این روشها را بهصورت منسجم و دقیق مطالعه کنند. به همین دلیل میخواهیم در ادامه به معرفی تعدادی کتاب بپردازیم که برای آموزش مفهوم شناسایی ترکیبات آلی مفید و کاربردی هستند.
کتاب The Systematic Identification Of Oraganic Compounds
این کتاب اولین بار در سال ۱۹۳۵ منتشر شد و به دلیل جامع بودن، همچنان مرجعی کلاسیک در این موضوع به حساب میآید و به خوانندگان اطلاعات مفیدی ارائه میدهد. در این کتاب بسیاری از روشهای نو معرفی شدند و اطلاعات موجود پیرامون این موضوع را متحول کردند. از این کتاب میتوان در آزمایشگاههای پیشرفته عالی و همچنین برای واحدهای طیفسنجی بهره برد.

آخرین ویرایش این کتاب قطور در سال ۲۰۰۴ میلادی و در ۷۳۶ صفحه در اختیار خوانندگان قرار گرفت. نویسنده این کتاب «رالف ال شراینر» (Ralph L Shriner) است.
کتاب مسائل The Systematic Identification of Organic Compounds
این کتاب برای تمامی دانشجویانی که به مطالعه جلد اول آن میپردازند، کاربردی و مفید است. توجه داشته باشید که منظور از جلد اول کتابی است که پیش از این، به معرفی آن پرداختیم. این کتاب پاسخ تمام مسائل مطرح شده در کتاب اول را آورده است، بهصورتی که دانشجو میتواند بعد از پاسخگویی به آنها، به این کتاب مراجعه کند و دانش خود را محک بزند و به ضعفهای خود پی ببرد. از مزیتهای این کتاب میتوان به این نکته اشاره کرد که در هر مورد ساختارها، فرمولها و مکانیسمهای مورد نیاز را برای درک عمیقتر آورده است.

هشتمین ویرایش این کتاب در سال ۲۰۰۳ میلادی و در ۴۱۶ صفحه توسط«رالف ال شراینر» (Ralph L Shriner) به چاپ رسیده است.
کتاب Spectrometric Identification Of Organic Compounds
اولین انتشار این کتاب به بیش از ۴۰ سال پیش برمیگردد و از جمله اولین منابعی است که به روشهای طیفسنجی به عنوان راهحلی برای شناسایی ترکیبات آلی پرداخته است. این کتاب روشی ویژه در تعیین ساختار ترکیبات آلی به دست میدهد که شامل استفاده از طیفسنجی جرمی، طیف سنجی مادون قرمز و طیفسنجی رزونانس مغناطیسی هستهای است. از مزیتهای این کتاب میتوان به این نکته اشاره کرد که روشهای بیان شده را با مثالهای خوب و واقعی مورد آزمون قرار داده است. این کتاب چنان جامع است که شیمیدانهای متخصص و حرفهای نیز از آن به عنوان منبع استفاده میکنند. خواندن این کتاب به دانشجویان و شاغلان حوزه شیمی بهخصوص شیمی آلی پیشنهاد میشود.

هشتمین ویرایش این کتاب در سال ۲۰۱۴ میلاد، به زبان انگلیسی و در ۴۶۴ صفحه منتشر شد. این کتاب چندین نویسنده دارد و یکی از آنها «رابرت ام سیلواستاین» (Robert M Silverstein) است. او دارای مدرک دکتری شیمی از دانشگاه نیویورک است.
کتاب Structure Determination of Organic Compounds
در این کتاب اطلاعات پایهای و مرجع برای روشهای $$NMR$$، $$UV$$ و $$IR$$ گردآوری و تفسیر شده است. از این اطلاعات میتوان برای شناسایی ترکیبات آلی و حدس ساختار آنها استفاده کرد.

پنجمین ویرایش این کتاب در سال ۲۰۲۰ میلادی و در ۴۹۳ صفحه به چاپ رسیده است. این کتاب سه نویسنده دارد که هر سه فارغالتحصیل «موسسه فناوری فدرال زوریخ» (Swiss Federal Institute of Technology in Zurich) هستند که در آن شیمی اهمیت بالایی دارد و این افراد تجربههای فراوانی در موضوعات مورد مبحث در این کتاب دارند.
کتاب Spectrometric Identification of Organic Compounds
این کتاب نخستین بار در سال ۱۹۶۲ میلادی به چاپ رسید و یکی از اصلیترین و قدیمیترین منابعی است که برای شناسایی ترکیبات آلی از طریق طیفسنجی وجود دارد. در این کتاب روشهای متفاوتی که در طیفسنجی وجود دارد مورد بررسی قرار گرفته است. رویکرد این کتاب آموزش مفاهیم به همراه مثالهای مرتبط برای درک بهتر است.

آخرین ویرایش این کتاب در سال ۲۰۲۱ میلادی و به زبان انگلیسی در اختیار علاقمندان قرار گرفته است. نویسنده این «رابرت ام سیلواستاین» (Robert M Silverstein) است که پیش از این به معرفی یکی دیگر از کتابهای او در همین حوزه پرداختهایم.
کتاب The Identification of Organic Compounds
این کتاب در بسیاری از موارد از توضیحات مختصری استفاده کرده است و در آن فرض بر این است که دانشجو با پیش زمینهای از این موضوعات به سراغ این کتاب برای مطالعه بیشتر میآید. بنابراین در صورتی که واحدهای مورد نیاز مانند طیفسنجی را گذراندهاید، مطالعه این کتاب را به شما پیشنهاد میدهیم.

آخرین ویرایش این کتاب در سال ۲۰۲۲ میلادی و به زبان انگلیسی به چاپ رسیده است. این کتاب به نسبت مختصر است و تنها از ۱۵۴ صفحه تشکیل شده است.
کتاب Guide To Spectroscopic Identification Of Organic Compounds
رویکرد این کتاب به این صورت است که نحوه شناسایی و تشخیص ساختارهای شیمیایی نامعلوم را در فرآیند حل یک مسئله آموزش میدهد. در این کتاب برای حل مسائل از طیفهای موجود استفاده میشود. از مزیتهای این کتاب میتوان به این نکته اشاره کرد که مثالها در آن گلچین شدهاند و از ساده تا پیچیده را مورد پوشش قرار میدهند. همچنین ساختار پیشبینی شده برای ترکیبات آلی نیز در انتهای هر مثال آورده شده است. با توجه به حجم مناسبی که این کتاب دارد، مطالعه آن به افراد بسیار پیشنهاد میشود.

این کتاب مختصر از ۱۳۶ صفحه تشکیل شده است و اولین چاپ آن به سال ۲۰۱۷ میلادی برمیگردد. نویسنده این کتاب «کارن فنستاین» (Karen Feinstein) نام دارد.
سوالات متدوال
حال که میدانیم شناسایی ترکیبات آلی به چه روشهایی صورت میگیرد، میخواهیم در این بخش به تعدادی از مهمترین و پرتکرارترین سوالهای پیرامون این موضوع پاسخ دهیم.
منظور از ترکیبات آلی چیست؟
ترکیبات آلی دستهای از ترکیبات شیمیایی هستند که در آنها یک یا تعداد بیشتری از اتم عنصر کربن بهصورت کووالانسی به اتمهای عنصرهای دیگری مانند هیدروژن، اکسیژن و نیتروژن متصل است.
کروماتوگرافی چیست؟
کروماتوگرافی روشی است که در آن جداسازی اجزای سازنده یک ترکیب بر پایه تفاوت آنها در پخش شدن در دو فاز متفاوت صورت میگیرد.
چطور میتوان به آلی بودن ترکیبی پی برد؟
اگر در ترکیبی اتم عنصر کربن از طریق کووالانسی به اتمهای دیگر متصل باشد، به دسته ترکیبات آلی تعلق دارد.
طیف سنجی جرمی چیست؟
در طیفسنجی جرمی، نمونه به وسیله پرتوی الکترونی با انرژی متوسط ( ۱۱۵۰ تا ۲۳۰۰ کیلو کالری بر مول) در خلاء بالا بمباران میشود.
از چه روشهایی برای شناسایی ترکیبات آلی استفاده میشود؟
این روشها شامل طیفسنجی، کروماتوگرافی و آزمونهای شناسایی سیستماتیک ترکیبات آلی میشوند.
جمعبندی
هدف از این مطلب مجله فرادرس این بود که بدانیم ترکیبات آلی به کدام دسته از مواد شیمیایی اطلاق میشود و با انواع آنها آشنا شویم. همچنین در ادامه به روشهای شناسایی ترکیبات آلی پرداختیم. در این مطلب روشهای متفاوتی را برای انجام این کار مورد بررسی قرار دادیم و به شناسایی سیستماتیک این دسته از ترکیبات اقدام کردیم. در پایان نیز به معرفی تعدادی از کتابهای مفید پیرامون آن پرداختیم.










