آلکیل هالید – از صفر تا صد
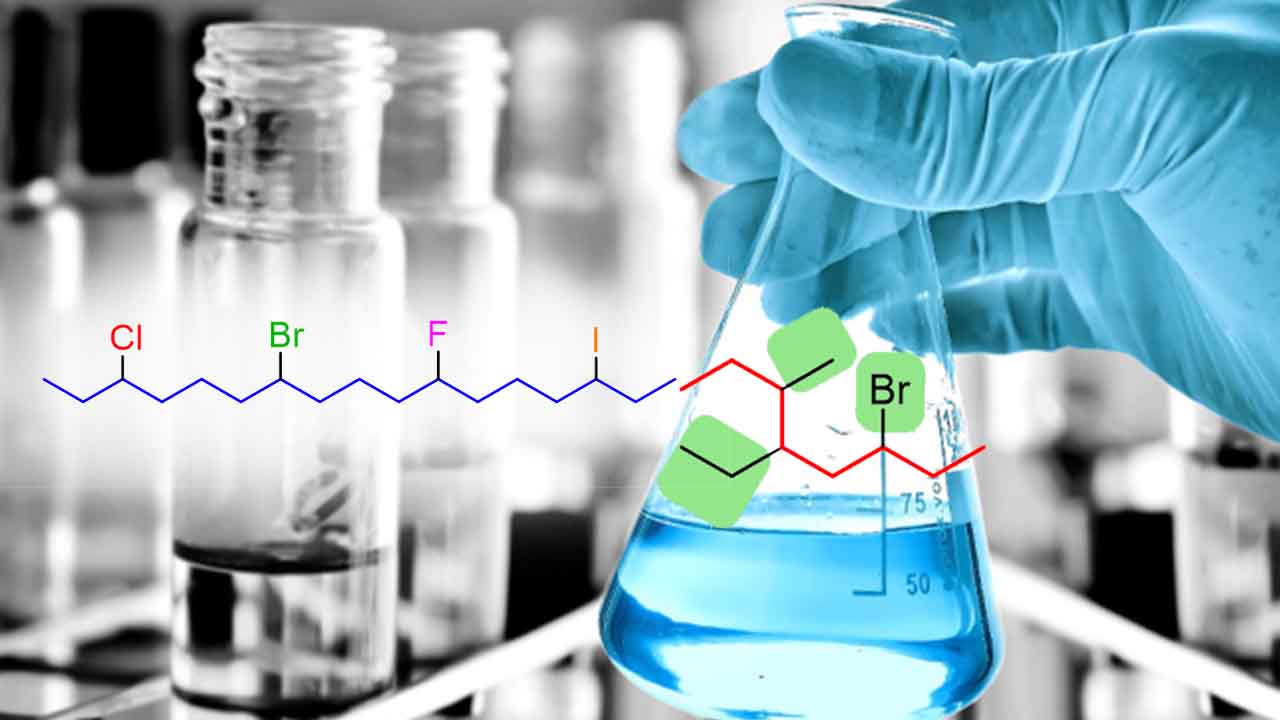

آلکیل هالید ها که آنها را با نام هالوآلکانها یا آلکانهای هالوژنه میشناسیم، ترکیبات شیمیایی هستند که به طور معمول از آلکانهای حاوی یک یا دو هالوژن مشتق میشوند. میتوان گفت آلکیل هالید ها زیرمجموعهای از «هالوکربنها» (Halocarbons) هستند. آلکیل هالیدها از طریق جایگزینی اتم هیدروژن با اتمهای هالوژن در هیدروکربنهای آلیفاتیک، به تولید میرسند. همچنین، برای تولید این ماده میتوان از پریکرسرهایی (پیشماده) همچون آلکانها، آلکنها، الکلها و کربوکسیلیک اسیدها استفاده کرد.
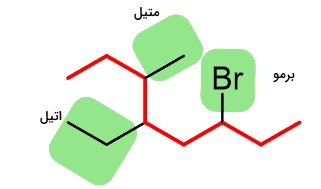
به طور کلی، آلکیل هالیدها شامل اتم هیدروژن متصل به کربن هیبرید شده در گروه آلکیل هستند. برخی از نمونههای آلکیل هالید را در تصویر زیر مشاهده میکنید:
مقدمه
آلکیل هالیدها بسته به مکان هالوژن در زنجیره اتمهای کربن، به دستههای مختلفی تقسیم میشوند. آلکیل هالیدها را در دستههای آلکیل هالید نوع اول، دوم و سوم دستهبندی میکنند. برای درک بهتر روندها و الگوهای مختلف در واکنشپذیری این ترکیبات، میتوان آنها را با این تقسیمبندیها تعریف کرد.
از آنجایی که الگوی خنثی پیوندی برای هالوژنها به صورت یک پیوند به همراه سه جفتالکترون ناپیوندی است، کربن و هالوژن همواره با یکدیگر، پیوند یگانه تشکیل میدهند. تقسیمبندی آلکیل هالید به کمک الگوی پیوندی اتم کربن متصل به هالوژن تعیین میشود.
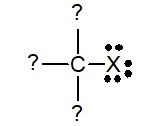
آلکیل هالید نوع اول
در هالوآلکان نوع اول، کربن متصل به اتم هالوژن، تنها به یک گروه آلکیل وصل شده است. در تصویر زیر، برخی از مثالهای آلکیل هالیدهای نوع اول را مشاهده میکنید.
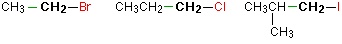
توجه داشته باشید که در این حالت، پیچیدگی آلکیلهالید متصل شده، تفاوتی ایجاد نمیکند. در هر حالت، تنها یک اتصال از طریق گروه متصل به هالوژن وجود دارد. البته یک استثنا هم در این قانون وجود خواهد داشت و آن، و سایر هالیدهای متیل هستند. این ترکیبات را به عنوان آلکیل هالید نوع اول میشناسند حتی اگر هیچ گروه آلکیلی به اتم کربن شامل هالوژن، متصل نباشد.
آلکیل هالید نوع دوم
در آلکیل هالیدهای نوع دوم، کربن متصل به اتم هالوژن به طور مستقیم به دو گروه آلکیل دیگر متصل میشود. این دو گروه میتوانند یکسان یا متفاوت باشند. برخی از نمونههای آلکیل هالید نوع دوم در تصویر زیر دیده میشوند.
آلکیل هالید نوع سوم
در هالوآلکان نوع سوم، اتم کربن نگهدارنده هالوژن، به طور مستقیم به سه گروه آلکیل متصل شده است. این سه گروه نیز میتوانند یکسان یا متفاوت باشند. برخی از آلکیلهالیدهای نوع سوم را در تصویر زیر مشاهده میکنید.

نامگذاری آلکیل هالیدها
نامگذاری آلکیل هالیدها از همان قوانینی پیروی میکند که در خصوص نامگذاری آلکانها مطرح کردیم. تنها تفاوتی که در اینجا باید در نظر بگیریم این است که در این ترکیبات، یک گروه استخلافی (جانشین) یا بیشتر، به صورت هالوژن وجود دارد که در اینصورت باید نام آنرا کمی تغییر دهیم.
هالوژنهای موجود در آلکیل هالیدها را همانند گروههای جانشین آلکیل در نظر میگیریم به این معنی که اولویتی نسبت به اتمهای کربن ندارند. زنجیر والد را نیز به گونهای شمارهگذاری میکنیم که کمترین عدد به گروههای جانشین برسد. تنها تفاوتی که وجود دارد، این است که باید به انتهای نام هالوژن، حرف «و» اضافه کنیم. به طور مثال باید بنویسم: ۲-برمو، ۴-کلرو یا ۵-فلوئورو.
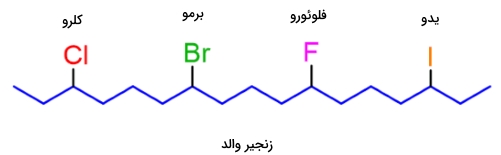
حال، میخواهیم آلکیل هالید زیر را نامگذاری کنیم:
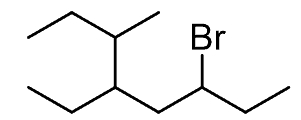
گام اول: زنجیر والد را مشخص کنید. طولانیترین زنجیر ممکن، شامل هشت اتم کربن است، بنابراین، زنجیر والد، یک اکتان خواهد بود.
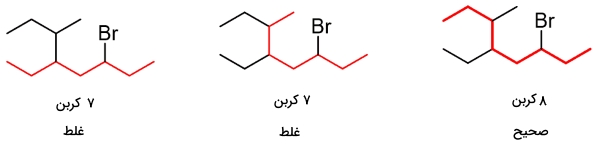
گام دوم: گروههای استخلافی را تعیین کنید. در اینجا، سه گروه جانشین شامل دو آلکیل و یک هالید (هالوژن) داریم.
گام سوم: شمارهگذاری را از سمتی آغاز کنید که کمترین شماره به گروههای جانشین برسد. اگر شمارهگذاری به گونهای بود که گروه جانشین، از هر دو جهت، شماره یکسانی دریافت میکرد، شمارههای بعدی را برای عدد کمتر در نظر بگیرید. به طور مثال، در ترکیب زیر، با شمارهگذاری از چپ یا راست، عدد ۳ به برم میرسد. اگر شمارهگذاری را از سمت چپ شروع کنیم، اعداد کمتری به سایر گروهها اختصاص مییابند و در نتیجه، ترکیب سمت چپ، نامگذاری صحیحی را بدست میدهد.
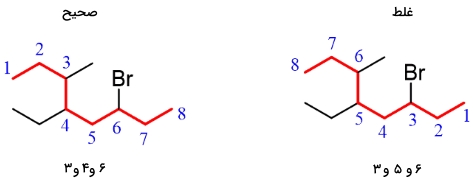
گام چهارم: در نهایت، نام زنجیر والد و گروههای استخلافی را با رعایت ترتیب الفبایی، ذکر کنید. به طور مثال، نام ترکیب زیر، ۶-برمو-۴-اتیل-۳-متیل اکتان خواهد بود. توجه داشته باشید که در این ترکیب، گروهها را به ترتیب الفبایی مرتب کردهایم. با وجود اینکه Br در موقعیت ۶ قرار دارد، اما قبل از سایر گروههای جانشین جای گرفته است.

نامگذاری آلکیل هالیدها با مرکز کایرال
زمانیکه یک مرکز استریوژنیک در ترکیبی داشته باشیم، چرخش مولکول را باید با استفاده از کنفیگراسیونهای R و S مشخص کنیم. به طور مثال، نام آیوپاک آلکیل هالید زیر را مشخص کنید.
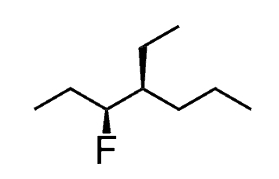
مرکز کایرال مولکول بالا، هیچکدام از قوانین توضیح داده شده را تغییر نمیدهد. بنابراین، در ابتدا باید زنجیر والد را مشخص کنیم و به نامگذاری مولکول بپردازیم. در نهایت، بعد از طی کردن مراحل بالا، به مولکول زیر میرسیم.
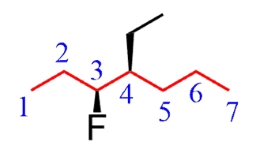
تنها تفاوتی که وجود دارد این است که باید کنفیگراسیون R و S را مشخص و بسته به محل آن در مولکول، آنرا نامگذاری کنیم. نام مولکول بالا، -۴-اتیل-۳-فلوئوروهپتان است.
نامگذاری آلکیل هالیدهای غیراشباع
در نامگذاری آلکیل هالیدهای سیرنشده (غیراشباع)، پیوندهای چندگانه در شمارهگذاری نسبت به گروههای جانشین اولویت دارند. به همین دلیل در شمارهگذاری این ترکیبات باید دقت بیشتری داشته باشیم.

نام معمول آلکیل هالیدها
بعد از آنکه با نحوه نامگذاری سیستماتیک برای آلکیل هالیدها آشنا شدیم، باید به نامهای معمول این ترکیبات نیز اشاره کنیم. در حقیقت، این ترکیبات، شباهتهای بسیاری به آلکانها دارند و تنها به جای یک یا چند اتم هیدروژن، هالوژن جایگزین آن شده است.
نام معمول در این ترکیبات شامل دو بخش است: نام گروه آلکیل بعلاوه نام هالوژن با پسوند «-ید»

مثال نام گذاری آلکیل هالید
برای هریک از ترکیبات زیر، نام آیوپاک و نام معمول هرکدام را ذکر کنید.
- برای هریک از تصاویر زیر، نام آیوپاک تعیین کنید.

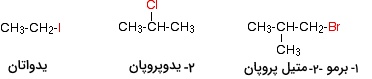
حل ۱: گروه آلکیل یک گروه پروپیل و هالوژن آن، برم است. بنابراین، نام معمول آن، پروپیل برمید خواهد بود. برای نامگذاری آیوپاک، از پیشوند برمو با همراه آلکان سه کربنه (پروپان) با شمارهگذاری مناسب استفاده میکنیم. در نهایت، نام ترکیب، ۱-برموپروپان خواهد بود.
حل۲: در این مثال، گروه آلکیل شامل ۳ اتم کربن به همراه یک اتم کلر متصل به کلر مرکزی است. بنابراین، گروه آلکیل، یک ایزوپروپیل و نام معمول این ترکیب، ایزوپروپیل کلرید خواهد بود.
حل۳: در تصویر اول، آلکان والد شامل ۵ اتم کربن و بنابراین، یک پنتان خواهیم داشت. یک گروه برمو به اتم کربن دوم زنجیر متصل شده است. نام آیوپاک ترکیب،۲-برمو-پروپان خواهد بود.
در تصویر دوم، آلکان والد، یک هگزان است. گروههای متیل و برمو به ترتیب به اتمهای کربن دوم و چهارم متصل شدهاند. با مرتب کردن گروههای جانشین به صورت الفبایی، به نام ۴-برمو-۲-متیل هگزان میرسیم.
خواص آلکیل هالیدها
شکل خالص آلکیل هالیدها بیرنگ است اما برمیدها و یدیدها زمانی که در معرض نور قرار بگیرند، به رنگهای مختلفی تبدیل میشوند. همچنین، بسیاری از ترکیبات فرار هالوژن، بویی شیرین دارند.
نقطه ذوب و جوش آلکیل هالید
متیل کلرید، متیل برمید، اتیل کلرید و برخی کلروفلوئورو متانها، در دمای اتاق به شکل گاز هستند و سایر ترکیبات به صورت مایع یا جامد وجود دارند. همانطور که میدانید، مولکولهای هالوژنهای آلی در طبیعت به صورت قطبی هستند. به دلیل قطبیت و جرم مولی بیشتر در مقایسه با هیدروکربنهای متناظر خود، در مشتقات هالوژن، نیروهای جاذبه بین مولکولی قویتری داریم. بنابراین، نقطه جوش کلریدها، برمیدها و یدیدها به طور مشخصی بیشتر از هیدروکربنها با جرم مولکولی مشابه خواهد بود. نقطه جوش آلکیل هالیدها نیز به روند زیر تغییر میکند.
چگالی
مشتقات برم، ید و پلیکلر، سنگینتر از آب هستند. هرقدر تعداد اتمهای کربن و هالوژن افزایش پیدا کند، چگالی نیز افزایش خواهد یافت.
انحلال پذیری
هالوآلکانها انحلالپذیری کمی در آب دارند. برای انحلال این ترکیبات در آب و مقابله با جاذبه بین مولکولهای آلکیلهالیدها و شکستن پیوندهای هیدروژنی بین مولکولهای آب، به انرژی نیاز داریم. به هنگام تشکیل نیروهای جاذبه بین هالوآلکانها و مولکولهای آب، انرژی بسیار کمی آزاد میشود. این جاذبه تشکیل شده، از جاذبه پیوندهای هیدروژنی بین مولکولهای آب، ضعیفتر است. در نتیجه، انحلالپذیری این ترکیبات در آب نیز کم خواهد بود. اما آلکیل هالیدها در حلالهای آلی به خوبی حل میشوند.
واکنشهای آلکیل هالیدها
واکنش شیمیایی هالوآلکانها را میتوان به سه بخش کلی تقسیمبندی کرد:
- واکنش جانشینی نوکلئوفیلی (هستهدوستی)
- واکنش حذفی
- واکنش با فلزات
واکنش جانشینی نوکلئوفیلی
در این نوع از واکنش شیمیایی، یک نوکلئوفیل (هستهدوست) با آلکیل هالیدی واکنش میدهد که بار جزئی مثبتی بر روی اتم کربن متصل به هالوژن داشته باشد. یک واکنش جانشینی رخ میدهد و اتم هالوژن (گروه ترککننده) به صورت یون هالید، مولکول را ترک میکند.
از آنجایی که واکنش جانشینی به کمک یک نوکلئوفیل آغاز شده، موسوم به واکنش جانشینی نوکلئوفیلی است. نمونهای از این واکنش را در تصویر زیر میبینید که در آن، «Nu» بیانگر هستهدوست خواهد بود.
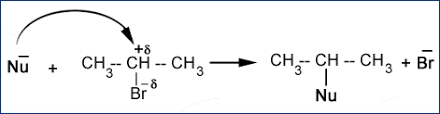
این واکنش، یکی از کاربردیترین واکنشها در شیمی آلی و آلکلیل هالیدها به شمار میآید که در آن، هالوژن، به کربن هیبرید متصل شده است.
واکنش حذفی
زمانیکه یک هالوآلکان به کمک محلول الکلی از پتاسیم هیدروکسید، حرارت ببیند، واکنش حذفی خواهیم داشت. در نتیجه این اتفاق، یک آلکن به تولید میرسد. از آنجایی که در این واکنش، اتم هیدروژن در موقعیت بتا قرار دارد، به طور معمول به آن، واکنش حذفی بتا میگویند.

درصورتیکه بیش از یک هیدروژن بتا داشته باشیم، امکان تشکیل بیش از یک آلکن وجود دارد که به طور معمول، یکی از فرآوردهها، فراوانی بیشتری خواهد داشت.
واکنش با فلزات
بیشتر کلریدها، برمیدها و یدیدهای آلی با برخی از فلزات مشخص، واکنش میدهند تا ترکیباتی شامل پیوندهای کربن-فلز ایجاد شوند. چنین ترکیباتی را با نام «ترکیبات آلیفلزی» (Orgonaometallic Compounds) میشناسند. این فرآوردهها به طور معمول از طریق واکنش هالوآلکانها با فلز منیزیم در اتر خشک تولید میشوند.
در این میان، «واکنشگر گرینیارد» (Grignard Reagent) به طور فعال با هر نوع منبعی از پروتون واکنش میدهد و هیدروکربن تولید میکند. بنابراین، باید از واکنشگرهای گرینیارد اجتناب کرد.
تهیه آلکیل هالیدها
هالوآلکانها را تقریبا میتوان به کمک تمامی پریکرسرهای آلی تولید کرد اما به لحاظ صنعتی، این ترکیبات به کمک آلکانها و آلکنها به تولید میرسند. در ادامه قصد داریم تا به بررسی سنتز آلکیل هالید با روشهای مختلف بپردازیم.
سنتز آلکیل هالید به کمک الکلها
آلکیل هالیدها را به طور معمول به کمک جایگزینی گروه در الکل با یک اتم هالوژن تولید میکنند. در ادامه متن، تولید هالوآلکانها از الکلها را از طریق هیدروژن هالیدها و فسفر هالیدها بررسی میکنیم.
تولید آلکیل هالید از الکل به کمک هیدروژن هالید
واکنش کلی به صورت زیر است:
تولید کلروآلکان
به کمک هیدروکلریک اسید غلیظ، میتوان کلروآلکانهای نوع سوم را از الکلهای متناظر آنها تولید کرد. درصورتیکه نیاز به تولید کلروآلکانهای نوع اول یا دوم باشد باید از روش دیگری بهره گرفت. در دمای اتاق، با تکان دادن ظرف شامل هیدروکلریک اسید غلیظ و الکل، کلروآلکان نوع سوم متناظر با الکل تولید میشود. این واکنش را در تصویر زیر مشاهده میکنید:

تولید برموآلکان
به جای استفاده از هیدروبرمیک اسید، الکل را با مخلوط سدیم یا پتاسیم برمید و سولفوریک اسید رقیق، فرآوری میکنند. در اثر این اتفاق، هیدروژن برمید تولید میشود که با الکل واکنش میدهد. با حرارت دادن و تقطیر مخلوط، برموآلکان به تولید میرسد.
تولید یدوآلکان
در این حالت، الکل با مخلوط سدیم یا پتاسیم یدید به همراه غلیظ واکنش میدهد و در نهایت، یدوآلکان تقطیر میشود.
میتوان از فسفریک اسید به جای سولفوریک اسید غلیظ استفاده کرد چراکه سولفوریک اسید، یونهای ید را اکسید میکند و هیدروژن یدید تولید نمیکند. موردی مشابه نیز برای یونهای برم در تولید برمو آلکانها اتفاق میافتد اما مقدار آن به قدری نیست که در واکنش اصلی تاثیرگذار باشد.
تولید آلکیل هالید از الکل به کمک فسفر هالیدها
در ادامه، به بررسی تولید کلروآلکان، برمو و یدو آلکان به کمک فسفر هالیدها خواهیم پرداخت.
تولید کلروآلکان
کلروآلکانها را به کمک واکنش الکل با فسفر (III) کلرید تولید میکنند.
این مواد را همچنین میتوان با اضافه کردن فسفر (V) کلرید جامد به یک الکل تولید کرد. چنین واکنشی در دمای اتاق بسیار خطرناک است و ابری از گاز سمی هیدروژن کلرید تولید میکند. به همین دلیل، راه مناسبی برای هالوآلکانها به شمار نمیآید. البته از این روش به عنوان آزمونی برای گروه عاملی در شیمی آلی استفاده میشود.
در این واکنش، همچنین واکنشهای جانبی شامل واکنش الکل با انجام میشود.
تولید برموآلکان و یدوآلکان
این دو ترکیب را به یک روش کلی میتوان سنتز کرد. به جای استفاده از فسفر (III) برمید یا یدید، الکل را تحت ریفلاکس به کمک مخلوطی از فسفر قرمز و کلر (یا برم) حرارت میدهند. فسفر در ابتدا با برم (یا ید) واکنش میدهد و فسفر (III) هالید تولید میکند.
در ادامه، این مواد با الکل واکنش میدهند و هالوآلکانهای متناظر با الکل را تولید میکنند. که از طریق تقطیر، جداسازی میشوند.

تولید برمواتان در آزمایشگاه
سولفوریک اسید غلیظ را به آرامی و با تکان دادن و سرد کردن به اتانول در ظرف آزمایش اضافه میکنند. در ادامه، پتاسیم جامد را به آن اضافه میکنند. سپس، ظرف آزمایش را به یک کندانسور متصل میکنند و به کمک تقطیر، برمومتان ایجاد شده را استخراج میکنند.
برمواتان نقطه جوش پایین دارد اما چگالتر از آب و در آن انحلال ناپذیر است. برای جلوگیری از تبخیر آن، معمولا این ماده را در زیر آب نگهداری میکنند که اطراف ظرف با یخ احاطه شده است. در برخی موارد نیز برمواتان در لوله آزمایش و بدون آب، درون یخ نگهداری میشود. ظرف واکنش را به آرامی تا زمانی گرم میکنند که تمامی برمواتان موجود، جمع آوری شود. در طول این واکنش، ناخالصیهایی نیز به تولید میرسند که شامل موارد زیر هستند:
- هیدروژن برمید: با جمعآوری برمواتان در زیر آب، بیشتر آن در آب حل خواهد شد.
- برم: با اکسایش یونهای برمید توسط سولفوریک اسید تولید میشوند.
- دیاکسید سوفلور: زمانیکه سولفوریک اسید غلیظ، یونهای برمید را اکسید میکند، این ناخالصی به تولید میرسد.
- اتانول: در واکنش شرکت نکرده است.
- اتوکسیاتان (دی اتیل اتر): از طریق واکنش جانبی بین اتانول و سولفوریک اسید غلیظ تولید میشود.
سنتز آلکیل هالیدها از آلکانها
آلکانها در واکنشهایی موسوم به «هالوژنه کردن رادیکال آزاد» (Free Radical Halogenation) شرکت میکنند. در این نوع از واکنشها، اتم هیدروژن از یک آلکان جدا و در ادامه، یک هالوژن جایگزین آن میشود. این جایگزینی توسط واکنش با یک مولکول دواتمی هالوژن صورت میگیرد. ماده واسط فعال در این واکنش، یک رادیکال آزاد است و به چنین واکنشی، واکنش زنجیرهای رادیکال آزاد میگویند.
هالوژناسیون رادیکال آزاد، مخلوطی از ترکیبات یک یا چندهالوژنه تولید میکند. بر اساس انرژی تفکیک پیوند میتوان نتایج واکنش هالوژناسیون و پایداری نسبی رادیکالهای آزاد واسط را پیشبینی کرد. عامل دیگری که در این خصوص مدنظر قرار میگیرد، احتمال انجام واکنش در هر اتم کربن، با نگاه آماری است.
لازم به ذکر است با توجه به تفاوت در گشتاورهای دوقطبی مخلوط حاصل، این مخلوط را به کمک تقطیر، خالصسازی میکنند.
سنتز آلکیل هالیدها از آلکن و آلکین
در فرآیند «هیدروهالوژناسیون» (Hydrohalogenation)، یک آلکن با هیدروژن هالید بیآب همچون هیدروژن کلرید یا هیدروژن برمید واکنش میدهد تا یک مونو-هالوآلکان تولید شود. پیوند دوگانه آلکن، با دو پیوند جدید، جایگزین میشود. یک پیوند با هالوژن و دیگری با اتم هیدروژن در هیدروهالیک اسید خواهد بود. «قانون مارکونیکوف» (Markonikov's Rule) بیان میکند که در این واکنش، هالوژن تمایل دارد که به کربن با «استخلاف بیشتر» (More Substituted) - یعنی کربنی که گروههای آلکیل بیشتری به آن متصل میشود - پیوند برقرار کند. به این واکنش، واکنش افزایشی الکتروندوست میگویند.
در این نوع از واکنشها نباید آب وجود داشته باشد چراکه در غیر اینصورت، ترکیب واسط هالوهیدرین تولید خواهد شد. بنابراین، واکنش را باید در حلالی بیآب همچون یا به طور مستقیم در فاز گاز انجام داد. واکنش در آلکینها نیز به همین صورت خواهد بود و قانون مارکونیکوف نیز در آنها صدق میکند.
آلکنها همچنین در واکنشی موسوم به واکنش افزایش هالوژن، آلکیل هالیدی با دو اتم هالوژن مجاور تولید میکنند. آلکینها نیز به طور مشابه، ترکیباتی تولید میکنند.
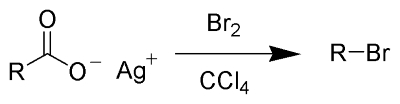
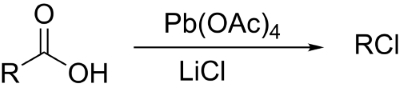
سنتز آلکیل هالید از کربوکسیلیک اسیدها
سنتز آلکیل هالیدها از کربوکسیلیک اسیدها به دو روش با نامهای «واکنش هونسدیکر» (Hunsdiecker Reaction) و «واکنش کچی» (Kochi Reaction) به تولید میرسد که تصاویر این واکنشها را در زیر مشاهده میکنید.
بیوسنتز آلکیل هالید
بسیاری از ترکیبات برموآلکان و کلروآلکان، به صورت طبیعی تولید میشوند. مسیر اصلی واکنش، شامل آنزیمهای «کلروپروکسیداز» (Chloroperoxidase) و «برموپروکسیداز» (Bromoperoxidase) خواهد بود.
کاربرد آلکیل هالید
در ادامه، به بررسی کاربرد هالوآلکانها خواهیم پرداخت.
کلروفلوئورو کربن و مواد جایگزین
«کلروفلوئورکربنها» (CFCs)، ترکیباتی شامل اتمهای کلر و فلوئور متصل به کربن هستند و دو مورد معمول در آنها، «CFC-11» و «CFC-12»، به ترتیب با فرمولهای شیمیایی و ذکر میشوند. این نوع از آلکیل هالیدها اشتعالپذیر و سمی نیستند. در نتیجه، کاربردهای بسیاری را برای آنها در نظر گرفتند. با این وجود، این ترکیبات، عامل اصلی در تخریب لایه اوزون به شمار میروند.
در اتمسفر بالا، پیوند کربن-کلر شکسته و رادیکال آزاد کلر به تولید میرسد و این رادیکالها، لایه اوزون را تخریب میکنند. البته امروزه، ترکیبات دیگری جایگزین کلروفلوئورو کربنها شدهاند.
مواد جایگزین CFC
جایگزین این مواد همچنان هالوآلکانها هستند اما برخی از آلکانهای ساده همچون بوتان نیز در مواردی مورد استفاده قرار میگیرد.
هیدروکلرو فلوئور کربن (HCFC)
این ترکیبات کربن جایگزین، شامل اتمهای هیدروژن و هالوژن هستند که از آنجمله میتوان به «HCFC-22» با فرمول اشاره کرد. این ترکیبات نسبت به CFCها عمر کمتری در اتمسفر دارند و بیشتر آنها در اتمسفر پایین تخریب میشوند و بنابراین، به لایه اوزون نمیرسند و تاثیر آنها بر لایه اوزون بسیار کمتر است.
هیدروفلوئورو کربن (HFC)
این ترکیبات، تنها شامل اتمهای هیدروژن و فلوئور متصل به کربن هستند که به عنوان نمونه میتوان از «» با فرمول نام برد. از آنجایی که این ترکیبات، هیچ اتم کلری ندارند، بر لایه اوزون تاثیرگذار نیستند. امروزه از این ماده در یخچالها و پلاستیکهای فومی استفاده میکنند.
سایر کاربردهای آلکیل هالیدها
از ترکیبات سیرنشده (شامل پیوند دوگانه) در آلکیل هالیدها به شکل زیر استفاده میشود:
- کلرواتن برای تولید پلیکلرواتان (PVC) کاربرد دارد.
- تترافلوئورواتن را در ساخت پلیتترا فلوئورواتن (PTFE) بکار میگیرند.











سلام من شاید به اشتباه این ترکیب رو نام گذاری میکنم اما این نامگذاری صحیح هست؟۲_برومو۴_کلرو۴_متیل پنتان….
CH3CH(Br)CH2CCl(CH3)2نامگذاریش چی میشه؟
۴ برمو ۲ کلرو ۲ متیل پنتان