ترکیبات هتروسیکل در شیمی – به زبان ساده
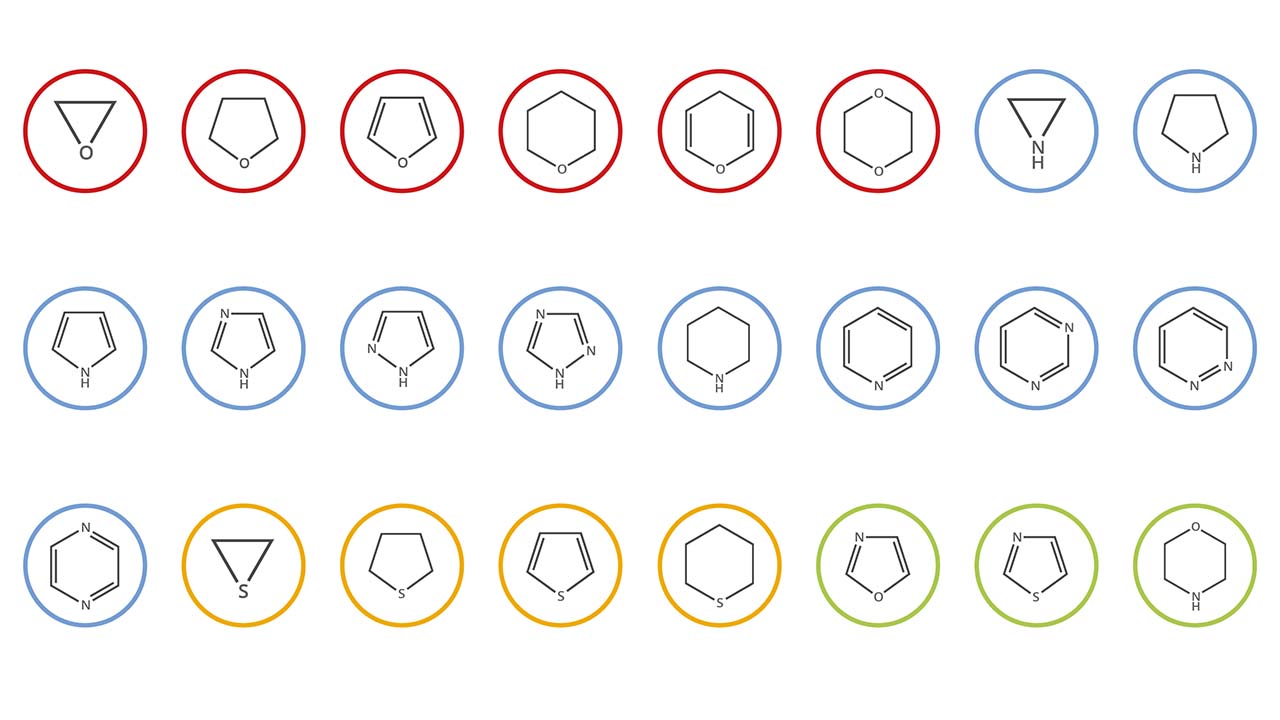
یک ترکیب هتروسیکل یا ساختار حلقوی به ترکیب حلقوی میگویند که در آنها حداقل دو عنصر مختلف به عنوان عضوی از حلقه وجود داشته باشند. شیمی ترکیبات هتروسیکل شاخهای از شیمی آلی است که به سنتز، خواص و کاربردهای این نوع از ترکیبات میپردازد. از نمونههای ترکیبات هتروسیکیلیک میتوان به نوکلئیک اسیدها، بسیاری از داروها، بیومس و بسیاری از رنگهای طبیعی و مصنوعی اشاره کرد.
ساختار ترکیبات هتروسیکل
با وجود اینکه ترکیبات هتروسیکل یا ناجورحلقه در شیمی میتوانند به صورت آلی یا معدنی وجود داشته باشند، بیشتر آنها حداقل دارای یک اتم کربن هستند. دستهبندی ترکیبات شیمیایی به نوع ساختار مولکولهای این ترکیبات وابسته است که این نوع ساختار را به کمک نوع و تعداد اتمها و همچنین پیوند کووالانسی بین آنها بیان میکنند. دو نوع ساختار کلی در ترکیبات وجود دارد:
- اتمهایی که یک زنجیر را تشکیل میدهند (ترکیبات آلیفاتیک).
- اتمهایی که یک حلقه را تشکیل میدهند (ترکیبات حلقوی).
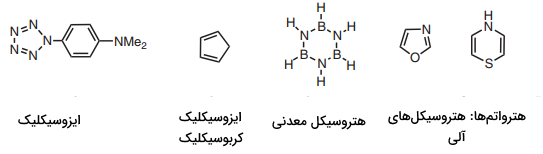
ترکیبات حلقوی که در آنها تنها یک اتم، حلقه را تشکیل میدهد موسوم به ترکیبات «ایزو سیکلیک» (Isocyclic) هستند. اگر حلقهای، تنها از اتم کربن تشکیل شده باشد، آنرا ترکیب کربوسیکلیک مینامیم. ترکیبات حلقوی که حداقل دو اتم متفاوت در ساختار خود داشته باشند، به عنوان ترکیبات هتروسیکل یا هتروسیکلیک شناخته میشوند. در این خصوص باید گفت که خود حلقه این ترکیبات را هتروسیکل مینامند. اگر در این حلقه، هیچ اتم کربنی وجود نداشته باشد، یک هتروسیکل معدنی داریم. درصورتیکه حداقل یک اتم در حلقه، کربن باشد، مولکول را ترکیب آلی هتروسیکلیک نامگذاری میکنیم. تحت این شرایط، تمام اتمهای حلقه که کربن نباشند، موسوم به «هترواتم» (Heteroatom) هستند.
در کنار نوع اتمهای حلقه، تعداد کلی آنها نیز مهم است زیرا اندازه حلقه را تعیین میکنند. کوچکترین حلقه محتمل، دارای ۳ عضو خواهد بود. معمولترین حلقهها، هتروسیکلهای پنج و شش عضوی هستند. البته در این خصوص محدودیتی وجود ندارد و حلقههایی تا حتی 9 عضو یا بیشتر نیز وجود دارند. به طور کلی، تمامی عنصرها به غیر از فلزات قلیایی میتواند نقش اتمهای حلقه را داشته باشند. در این میان، اتم نیتروژن، معمولترین هترواتم در ترکیبات هتروسیکل است. اتمهای بعدی عبارتند از اکسیژن و گوگرد.
پایداری ترکیبات هتروسیکل
برای تعیین پایداری و واکنشپذیری ترکیبات هتروسیکل، به طور معمول آنها را با ترکیبات مشابه کربوکسیلیک آنها مقایسه میکنند. برای این کار کافی است تا گروههای $$C H $$ و $$C H _ 2$$ را با هترواتمها جایگزین کنیم. با بررسی یک سیستم تکحلقهای (مونوسیکلیک)، طبق تصاویر زیر، ۴ نوع هتروسیکل را میتوان شناسایی کرد:
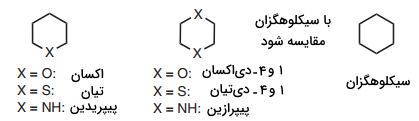
هیتروسیکلهای اشباع (هتروسیکلو آلکانها)
در این نوع از ترکیبات، هیچ پیوند چندگانهای بین اتمهای حلقه دیده نمیشود. واکنشپذیری این ترکیبات، همچون ترکیبات آلیفاتیک متناظر با آنها است. به طور مثال، اوکسان (تتراهیدروپیران) و دیاکسان، رفتاری مشابه دیآلکیل اترها دارند. تیان و 1و۴ دیتیان هم مانند دیآلکیل سولفیدها هستند. همچنین پیپریدین و پیپرازین نیز مانند آمینهای نوع دوم آلیفاتیک رفتار میکنند.
سیستمهای غیراشباع به صورت جزئی (هتروسیکلو آلکنها)
اگر پیوندهای چندگانه بین دو اتم کربن در حلقه وجود داشته باشند، به طور مثال، در ترکیب با شماره 6 تصویر زیر، این نوع از ترکیبات به طور کلی همچون آلکنها و آلکینها و سایر ترکیبات با پیوند چندگانه رفتار میکنند. در این ترکیبات، هترواتمها میتوانند بخشی از پیوندهای دوگانه باشند.

سیستمهایی با بیشترین تعداد پیوند دوگانه (هتروآنیولنها)
آنیولنها ترکیبات تکحلقهای هستند که به طور یک در میان، پیوند دوگانه دارند. این ترکیبات میتوانند دو نوع هتروسیکل تشکیل دهند:
- در صورتیکه $$CH$$ با $$X$$ جابجا شود، سیستمهایی با اندازه حلقه یکسان بوجود میآیند.
- درصورتیکه $$HC = CH$$ با $$X$$ جابجا شود، سیستمهای با اندازه حلقه کوچکتر ایجاد خواهند شد.

سیستمهای هترواتمی
مهمترین گروه این نوع از ترکیبات که از «قانون هوکل» (Hückel's Rule) تبعیت میکنند حلقههای بنزنی هستند که با نام هتروآرنها شناخته میشوند.
نام گذاری ترکیبات هتروسیکل
بسیاری از ترکیبات آلی از جمله ترکیبات هتروسیکل نیز دارای نامهای معمول هستند. این نامها ممکن است به دلایل مختلفی همچون نحوه آمادهسازی و خواص ویژه آنها بوجود آمده باشند.
البته نیاز به روشی سیستماتیک برای نامگذاری این نوع از ترکیبات نیز دیده میشود. در تصویر زیر، نام عمومی و نام سیستماتیک (آیوپاک) برخی از ترکیبات هیتروسیکل را مشاهده میکنید.
| ساختار | نام معمول | نام آیوپاک |
| اتیلن اکسید | اکسیران | |
 | پیروموسیک اسید | فوران-2-کربوکسیلیک اسید |
 | پیریدین | پیریدین |
 | نیکوتینیک اسید | پیریدین-3-کربوکسیلیک اسید |
 | کومارین | ۲ H-کرومن-۲-اون |
نامگذاری سیستماتیک ترکیبات هتروسیکل بر اساس ساختار آنها و به کمک حلقه والد آن صورت میگیرد. قوانینی که آیوپاک برای نامگذاری ترکیبات هتروسیکل در نظر گرفته است شامل دو نوع نامگذاری میشود: روش «هانتش-ویدمن» (Hantzch-Widman) برای هتروسیکلهای ۳-10 عضوی و روش «جایگزینی» (Replacement) برای حلقههای بزرگتر که در این آموزش به روش هانتش-ویدمن خواهیم پرداخت.
روش نامگذاری هانتش ویدمن
در ادامه، مراحل نامگذاری به کمک روش هانتش-ویدمن را بررسی خواهیم کرد.
1. نوع هترواتم
نوع هترواتم را به کمک پیشوند جدول زیر مشخص میکنیم. این جدول همچنین، ترتیب پیشنهادی پیشوندها را نیز نشان میدهد.
| نماد عنصر | پیشوند | نماد عنصر | پیشوند |
| $$O$$ | اکسا | $$Bi$$ | بیسما |
| $$S$$ | تیا | $$S i$$ | سیلا |
| $$S e$$ | سلنا | $$G e$$ | ژرما |
| $$Te$$ | تلورا | $$S n$$ | استانا |
| $$N$$ | آزا | $$P b$$ | پلومبا |
| $$P$$ | فسفا | $$B$$ | بور |
| $$A s$$ | آرسا | $$H g$$ | مرکورا |
| $$S b$$ | استیبا |
2. اندازه حلقه
اندازه حلقه نیز به کمک پسوندهای جدول زیر مشخص میشوند. با توجه به تغییراتی که در برخی نامگذاریهای فارسی دیده میشود، معادل انگلیسی آنها نیز در این جدول ذکر شده است.
| اندازه حلقه | پسوند غیراشباع | پسوند اشباع |
| $$3$$ | «-یرن» (irene) | «-یران» (irane) |
| $$4$$ | «-ت» (ete) | «-تان» (etane) |
| $$5$$ | «-ول» (ole) | «-ولان» (olane) |
| $$6 A$$ | «-ین» (ine) | «-ان» (ane) |
| $$6 B$$ | «-نین» (inine) | «-ینان» (inane) |
| $$6 C$$ | «-ینین» (epine) | «-ینان» (inane) |
| $$7$$ | «-پین» (ocine) | «-پان» (epane) |
| $$8$$ | «-سین» (ocine) | «-وکان» (ocane) |
| $$9$$ | «-نین» (onine) | «-نان» (onane) |
| $$10$$ | «-سین» (ecine) | «-اکان» (ecane) |
3. سیستمهای تکحلقهای
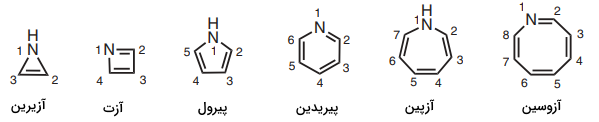
ترکیباتی با بیشترین تعداد پیوند دوگانه را به عنوان ترکیب والد در یک سیستم تکحلقهای با اندازه حلقه مشخص در نظر میگیرند. نامگذاری به کمک ترکیب پسوندها و پیشوندها از جداول بالا انجام میشود. برخی از این سیستمها در تصویر زیر نشان داده شدهاند.
4. سیستمهای دوحلقهای (باسیکلی) با یک حلقه بنزنی
سیستمهایی که دو اتم همسایه مشترک دارند یا مانند تصاویر زیر، بیش از یک حلقه داشته باشند، به عنوان «سیستمهای جوشخورده» (Fused Systems) شناخته میشوند. برخی از این سیستمها دارای نام معمول هستند که در زیر آورده شدهاند:

در صورتی که ترکیباتی همچون ترکیبات بالا را نداشته باشیم و تنها یک هتروسیکل دارای نام معمول باشد، برای نامگذاری از پیشوند بنزو و نام معمول هتروسیکل کمک میگیریم. به طور مثال، بنزو فوران، ترکیبی مشابه زیر خواهد داشت:

این نوع از سیستمها به اجزای خود تقسیم میشود. بخش هتروسیکل را به عنوان جزء اصلی در نظر میگیرند. پیوند بین اتمها در حلقه را با حروف a، b، c و d نشان میدهند. به طور مثال، در ترکیب بنزو [b] فوران، حرف b در کروشه نشاندهنده اشتراک اتم جزء اصلی با حلقه دیگر است. این حرف باید نزدیکترین حرف الفبا را شامل شود و به همین دلیل، نوشتن آن به صورت بنزو [d] فوران صحیح نیست. به طور کلی، نامگذاری سیستمهای دو و چندحلقهای باید جدا از نامگذاری اجزای اصلی صورت بگیرد. نحوه انجام این کار در ادامه توضیح داده شده است.
سیستم حلقوی را به شکل زیر در یک صفحه مختصات قائم قرار میدهیم:
- تعداد حلقههای ممکن، در محور افقی قرار بگیرند.
- بیشترین تعداد حلقه، در گوشه سمت راست حضور داشته باشند.
در ادامه، سیستم را به صورت ساعتگرد شمارهگذاری میکنیم. شروع شمارهگذاری از دورترین اتم در سمت راست آغاز میشود و این اتم، در حلقه جوش خورده شرکت ندارد. در چنین شرایطی، اتم یا باید بالاترین اتم در حلقه یا دورترین اتم در سمت راست باشد. در این حالت، اتمهای کربنی که به بیش از یک حلقه اختصاص دارند را در نظر نمیگیریم. در شمارهگذاری این سیستمها باید توجه شود که کمترین عدد به هترواتمها برسد.
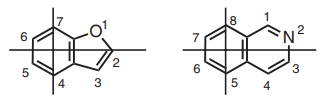
اگر جزء اصلی، نام معمول نداشته باشد، کل سیستم را به ترتیبی که گفته شد، شمارهگذاری میکنیم و مکان هترواتمها را قبل از پیشوند «بنزو» ذکر خواهیم کرد:

5. سیستمهای دو و چندحلقهای به همراه بیش از یک هتروسیکل
برای نامگذاری این نوع از ترکیبات، ابتدا جزء اصلی (پایه) را بر مبنای روش زیر مشخص میکنیم. به همین منظور، جزء اصلی عبارتست از:
- جزء شامل نیتروژن
- جزء شامل هترواتمی به غیر از نیتروژن که بالاترین جایگاه را در جدول پیشوندها داشته باشد.
- جزء با بیشترین تعداد حلقه ممکن
- جزء با بزرگترین حلقه
- جزء با بیشترین هترواتم
- جزء با بیشترین تعداد هترواتم مختلف
- جزء با بیشترین تعداد هترواتم و بالاترین جایگاه در جدول پیشوندها
6. هیدروژن
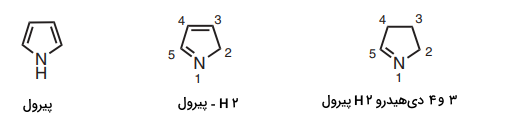
در برخی موارد، سیستمهای هتروسیکل به صورت ایزومرهای ساختاری وجود دارند که تفاوت آنها تنها در محل اتم هیدروژن است. برای نامگذاری این ترکیبات باید شماره محل اتم هیدروژن را در ابتدای نام آن ذکر کرد. برخی از این ترکیبات را در زیر مشاهده میکنید. در این ترکیبات، نام «پیرول» (Pyrole) نشاندهنده محل شماره 1 برای اتم هیدروژن است.
هتروسیکلهای سه عضوی
در ادامه این آموزش قصد داریم تا در خصوص هتروسیکلهای سه عضوی صحبت کنیم. همانطور که در ابتدای متن نیز به آن اشاره شد، هتروسیکلهایی تا بیش از هشت عضو نیز وجود دارند اما در این آموزش به هتروسیکلهای سه، چهار و پنجعضوی خواهیم پرداخت. خواص هتروسیلکل سه عضوی، به طور عمده حاصل کرنش زاویه پیوند موسوم به «کرنش بیر» (Beyer Strain) است. این کرنش در حلقه، سبب واکنشپذیری بالا در این ترکیبات میشود.
اکسیرانها (اپوکسیدها) معمولترین هتروسیکلهای سهعضوی به شمار میآیند. اپوکسیدها به سادگی از طریق واکنش آلکنها با پروکسیاسیدها به تولید میرسند که دارای «فضاویژگی» (Stereospecificity) مناسبی نیز هستند. از آنجایی که این هتروسیکلهای سهعضوی، کرنش زاویهای بالایی دارند، واکنشپذیرتر از اترهای بدون کرنش هستند. بیشتر واکنشها در این دسته از ترکیبات، شامل واکنشهای افزایشی هستهدوست یا الکتروندوست است.
هتروسیکل چهار عضوی
برای آمادهسازی هتروسیکلهای چهارعضوی روشهای مختلفی وجود دارد که برخی از آنها در تصویر زیر آورده شدهاند. واکنشهای حذفی و دیمر شدن، از جمله واکنشهای جانبی در این دسته از واکنشها هستند. در مثال ۱، تشکیل حلقه از طریق ایجاد یک «تیاتان» (Thietane) انجام میشود که در این واکنش، عامل حاکم، هستهدوستی گوگرد است به خصوص زمانی که از یک باز کمک بگیریم.
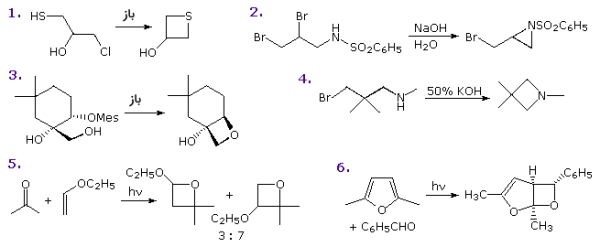
واکنشها در هتروسیکل چهار عضوی
در واکنشهای هتروسیکلهای چهارعضوی نیز، تاثیر کرنش حلقه مشهود است. برخی از این واکنشها در تصویر زیر آورده شدهاند. در واکنشهایی که سبب گشایش حلقه میشوند، کاتالیزورهای اسیدی، نقش بسیاری دارند که نمونههای آن در مثالهای ۱ تا ۳ آمده است.

هتروسیکل پنج عضوی
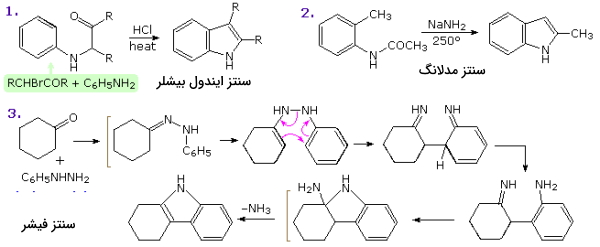
برخی از واکنشهای آمادهسازی هتروسیکلهای پنجعضوی در تصویر زیر آورده شده است. مهمترین هیتروسیکل با حلقه جوش خورده را میتوان به «ایندول» (Indole) اختصاص داد. که برخی از روشهای سنتز آنرا در این تصویر میبینید.
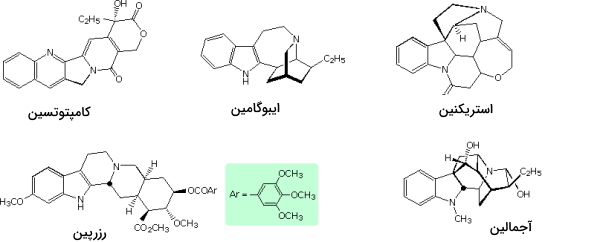
برخی از هتروسیکلهای چند حلقهای
ساختارهای هتروسیکل بسیاری را میتوان در فرآوردههای شیمیایی پیدا کرد. برخی از این ساختارها در تصویر زیر نشان داده شدهاند. از جمله این ترکیبات میتوان به «رزرپین» (Reserpine) اشاره کرد که در کنترل فشار خون مورد استفاده قرار میگیرد. آجمالین و استریکنین به ترتیب به عنوان داروی قلب و آفتکش کاربرد دارند.
فیلم آموزش شیمی هتروسیکل
با توجه به اهمیتی که ترکیبات هتروسیکل در شیمی دارویی و سنتز ترکیبات دارویی و شیمیایی دارند، «فرادرس» اقدام به انتشار یک دوره آموزشی تحت عنوان «آموزش شیمی هتروسیکل» کرده که از این لینک قابل دریافت است.
این آموزش در قالب شش درس و با مدت زمانی ۳/5 ساعت در دسترس شما قرار دارد. مباحثی که در این آموزش مطرح شد، به طور کامل در درس یکم و دوم این آموزش و با ارائه مثالهای بیشتری تدریس شدهاند. درس سوم به هتروسیکلهای ششعضوی همچون پیریدین اختصاص دارد. در این درس، سنتز پیریدین و خواص بازی آن مورد بررسی قرار میگیرند. علاوه بر این، مشتقات پیریدین و سایر هتروسیکلهای ششعضوی بررسی خواهند شد.
در درس پنجم، هتروسیکلهای پنجعضوی با یک هترواتم بررسی میشوند. در این درس، ساختار و آروماتیسیته در فوران، تیوفن و پیرول آموزش داده خواهد شد و سنتز و واکنشهای این دسته از ترکیبات به طور کامل مورد بررسی قرار خواهند گرفت. همچنین، در درس ششم با هتروسیکلهای پنجعضوی با دو یا چند هترواتم آشنا میشوید که از آنجمله میتوان به آزولها و سنتز آنها اشاره کرد. درس ششم این آموزش به هتروسیکل های اشباع اختصاص دارد. اکسیران و اکسهاتان، آزیریدین و آزهتیدین و همچنین تایران (تایایران) و تیاتان از جلمه مباحث تدریس شده در این درس به شمار میآیند. در انتهای این فصل نیز برخی هتروسیکلهای چهارعضوی جزئی غیراشباع نیز مورد بررسی قرار خواهند گرفت.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی آلی 3
- واکنش شیمیایی در گازها — به زبان ساده
- آلکن ها — از صفر تا صد
- جدول تناوبی — از صفر تا صد
^^












باسلام،من اگر بخوام به این مطلب رفرنس بدم چطور باید این کارو بکنم؟ فقط نام سایت درج بشه کافی هست؟
با سلام؛
نحوه استفاده از نوشتههای مجله فرادرس، در انتهای صفحه و در بخش «شرایط استفاده» آورده شده است.
با تشکر از همراهی شما با مجله فرادرس