انواع تیتراسیون در شیمی – به زبان ساده + مثال و نمودار

تیتراسیون روشی در علم شیمی است که به کمک آن غلظت ترکیب یا ترکیبات مجهول موجود در یک نمونه را به دست میآورند. این روش میتواند بهصورتهای مختلفی انجام شود و به چندین دسته تقسیمبندی میشود. از انواع تیتراسیون میتوان به تیتراسیون رسوبی، تیتراسیون اسید و باز، تیتراسیون اکسایشی کاهشی و تیتراسیون منگانومتری اشاره کرد. در این مطلب مجله فرادرس میخواهیم در مورد انواع تیتراسیون و نحوه انجام آنها صحبت کنیم. همچنین در ادامه با بررسی تعدادی مثال، محاسبات مورد نیاز در این فرآيند را نیز مورد بررسی قرار خواهیم داد.
تیتراسیون چیست ؟
از انواع تیتراسیون برای تعیین غلظت گونههای مجهول استفاده میشود. در این روش عموما از یک گونه با غلظت مشخص برای انجام واکنش با گونه مجهول استفاده میشود و به اصلاح گونه مجهول تیتر میشود. تیتراسیون به روشهای متعددی صورت میگیرد که در ادامه به آنها خواهیم پرداخت.
نحوه انجام تیتراسیون
تیتراسیون تکنیکی است که طی آن محلولی با غلظت مشخص (تیترانت) برای اندازهگیری غلظت، به محلولی با غلظت نامشخص (آنالیت) افزوده میشود. در این بخش میخواهیم در مورد نحوه انجام این فرایند کمی بیشتر بدانیم. در تیتراسیون تیترانت در بورت و آنالیت در ارلن مایر قرار دارند. با افزودن قطرهقطره تیترانت به آنالیت، واکنشی بین آن دو صورت میگیرد که پایان آن معمولا به کمک یک شناساگر به دست میآيد. برای انجام محاسبات مورد نیاز برای یافتن غلظت مجهول، از حجم اضافه شده تیترانت کمک گرفته میشود.
اجزای تیتراسیون
در انواع تیتراسیون مجموعهای از اجزای شرکتکننده و اصطلاحات وجود دارد که برای درک چگونگی انجام یک تیتراسیون باید نسبت به آنها آگاه باشیم. در ادامه به بررسی این موارد پرداختهایم. توجه داشته باشید که با توجه به واکنش صورت گرفته در هر تیتراسیون، ترکیباتی که در هر مرحله به کار گرفته میشوند، متفاوت از روشی دیگر خواهند بود.
تیتراند
«تیتراند» (Titrand) که از آن با نام «آنالیت» (Analyte) نیز یاد میشود، محلولی است که در تیتراسیون مورد بررسی قرار میگیرد. غلظت این گونه مجهول است و هدف از انجام تیتراسیون، به دست آوردن همین مقدار است. در تیتراسیون، آنالیت در ارلن مایری ریخته میشود و برای افزودن تیترانت در زیر شیر بورت قرار میگیرد. در بخش بعدی در مورد تیترانت صحبت خواهیم کرد.
تیترانت
«تیترانت» (TItrant) محلولی است که طی تیتراسیون به تیتراند افزوده میشود. غلظت این جزء مشخص است و با داشتن حجم مورد استفاده آن تا نقطه همارزی، میتوانیم غلظت مجهول تیتراند را محاسبه کنیم. برای مثال در تیتراسیون اسید و باز، تیترانت یک اسید یا باز است که از آن برای واکنش خنثیشدن با تیتراند، بهره میبریم.
تیترانت را باید بهآهستگی و قطرهقطره به ارلن حاوی تیتراند اضافه کنیم تا تغییرات حاصل با دقت مورد ارزیابی قرار گیرد و از نقطه پایان تیتراسیون عبور نکنیم. اضافه کردن حجم زیاد تیترانت به یک باره، باعث ایجاد خطا در محاسبات نهایی انواع تیتراسیون خواهد شد.
شناساگر
«شناساگر» (indicator) مادهای است که در محیطهایی با ویژگی متفاوت، گونههای متنوعی دارد. مثلا در تیتراسیونهای اسید و بازی، از فنول فتالیین استفاده میشود. این شناساگر در حضور اسید و باز رنگهای متفاوتی خواهد داشت و میتوان از آن برای پی بردن به نقطه پایان تیتراسیون کمک گرفت.
شناساگری مناسب است که در نزدیک نقطه همارزی، تغییر رنگ واضحی از خود به نمایش بگذارد.

نقطه همارزی
«نقطه همارزی» (Equivalence Point) نقطهای است که در آن واکنش بین تیترانت و تیتراند از نظر تئوری تکمیل شده است. در این نقطه تعداد مولهای تیترانت با تعداد مولهای تیتراند برابر خواهد بود. در بسیاری موارد مفهوم نقطه همارزی با مفهوم نقطه پایانی اشتباه گرفته میشود، اما توجه داشته باشید که گرچه این دو نقطه به هم نزدیک، دارای تفاوتهایی هستند.
نقطه پایانی
نقطه پایانی، در واقع همان نقطهای است که در محاسبات در نظر گرفته میشود. در عمل در بسیاری از تیتراسیونها، رسیدن نقطه پایانی را با توجه به تغییر رنگ شناساگر تشخیص میدهند. در مواردی نیز به جای شناساگر، از پتاسیومتر استفاده میشود و به این صورت تیتراسیون به خانواده تیتراسیونهای پتانسیومتری متعلق خواهد بود.
تفاوت نقطه همارزی و نقطه پایانی تیتراسیون
همانطور که گفتیم در بسیاری از موارد، نقطه پایانی و نقطه همارزی انواع تیتراسیون معادل با یکدیگر در نظر گرفته میشوند با این حال نیاز است که به تفاوتهای بین آنها آگاهی داشته باشیم. در ادامه به برخی از این تفاوتها اشاره کردهایم.
- نقطه پایانی تیتراسیون پس از نقطه همارزی تیتراسیون اتفاق میافتد و به همین شکل نقطه همارزی تیتراسیون پیش از نقطه پایانی تیتراسیون خواهد بود.
- در نقطه پایانی تیتراسیون تغییر رنگ حاصل از شناساگر مشاهده میشود در حالیکه در نقطه همارزی مقدار تیترانت و آنالیت در ظرف واکنش با یکدیگر برابر خواهد بود.
- اسیدهای ضعیف تنها یک نقطه پایانی تیتراسیون دارند اما چندین نقطه همارزی خواهند داشت.
انواع تیتراسیون چیست ؟
پیش از این گفتیم که با توجه به واکنشی که در هر تیتراسیون صورت میگیرد، این روش به دستههای متنوعی تقسیمبندی میشود که هر کدام با دیگری شباهتها و تفاوتهایی دارد. در این بخش میخواهیم برخی از مهمترین و پرکاربردترین انواع تیتراسیون مورد استفاده در آزمایشگاههای شیمی و صنعت را مورد بررسی قرار دهیم.
تیتراسیون اسید و باز
تیتراسیون اسید و باز روشی است که توسط آن به غلظت یک اسید یا باز مجهول از طریق انجام واکنش خنثی شدن بین آنها پی میبریم. در این روش برای یافتن نقطه همارزی تیتراسیون معمولا از یک شناساگر اسید و باز کمک گرفته میشود.
مثالی از تیتراسیون اسید و باز، حضور استیک اسید به عنوان تیترانت و سدیم هیدروکسید به عنوان آنالیت است. این تیتراسیون نمونهای از تیتراسیون باز قوی با اسید ضعیف است و واکنش صورت گرفته در آن را میتوان بهصورت زیر نشان داد.
$$ HC_2H_4O_{2(aq)}+OH^-_{(aq)} → C_2H_4O_{2(aq)}+H_2O_{(l)}$$
اسیدیمتری و آلکالیمتری
تیتراسیون اسید و باز، بسته به گونهای که مورد تیتراسیون قرار میگیرد به دو دسته تقسیمبندی میشود. در اسیدیمتری برای یافتن غلظت مجهول یک باز از اسیدی با غلظت مشخص بهره میبرند و به همین صورت در آلکالیمتری، آنالیت یک اسید با غلظت مجهول و از یک باز برای انجام تیتراسیون استفاده میشود.
شناساگر تیتراسیون اسید و باز
انتخاب شناساگر تیتراسیون اسید و باز از اهمیت بالایی برخوردار است زیرا در صورت مناسب نبودن، میتواند باعث ایجاد خطا در انجام محاسبات شود. مشاهده تغییر رنگ ناشی از پایان انواع تیتراسیون باید در نزدیکی نقطه همارزی باشد تا بیشترین دقت ممکن به دست بیاید.
با توجه به ماهیت اجزای شرکتکننده در یک تیتراسیون اسید و باز، میتوان به موارد زیر اشاره کرد.
- اسید قوی و باز قوی: نقطه پایان تیتراسیون خنثی و مقدار $$pH$$ برابر با ۷ است.
- اسید قوی و باز ضعیف: نقطه پایان تیتراسیون اسیدی و مقدار $$pH$$ کمتر از ۷ است.
- اسید ضعیف و باز قوی: نقطه پایان تیتراسیون بازی و مقدار $$pH$$ بیشتر از ۷ است.
بنابراین میتوان اینطور بیان کرد که در تیتراسیون اسید و باز، در صورتی که باز قویتر باشد، نقطه پایان تیتراسیون بازی و در صورتی که اسید قویتر باشد، نقطه پایان تیتراسیون اسیدی خواهد بود. با این حال توجه داشته باشید که معمولا تیتراسیونی با اسید ضعیف و باز ضعیف انجام نمیشود، زیرا تشخیص نقطه پایانی تیتراسیون به کمک شناساگر بسیار مشکل خواهد بود.
در جدول زیر تعدادی از متدوالترین شناساگرهایی که در تیتراسیون اسید و باز مورد استفاده قرار میگیرند را مشاهده میکنید.
| نام شناساگر | بازه $$pH$$ تغییر رنگ | رنگ در محیط اسیدی- در محیط بازی |
| متیل بنفش | ۱٫۶ تا ۰٫۰ | زرد / بنفش |
| برمو فنل آبی | ۴٫۶ تا ۳٫۰ | زرد / آبی |
| متیل نارنجی | ۴٫۴ تا ۳٫۱ | قرمز / زرد |
| متیل قرمز | ۶٫۳ تا ۴٫۴ | قرمز / زرد |
| لیتموس | ۸٫۰ تا ۵٫۰ | قرمز / آبی |
| برموتیمول آبی | ۷٫۶ تا ۶٫۰ | زرد / آبی |
| فنل فتالیین | ۱۰٫۰ تا ۸٫۳ | بیرنگ / صورتی |
در بسیاری از آزمایشگاههای مجهز از یک «پیاچ سنج» (pH Meter) برای بررسی تغییرات موجود در تیتراسیون اسید و باز بهره برده میشود.
نحوه انجام تیتراسیون اسید و باز
در تیتراسیون اسید و بازی، به دلیل تشکیل $$CO_2$$ حین واکنش اسید و باز نیاز به وجود منبع گرما است. کربن دی اکسید تشکیل شده میتواند در آب حل شود و کربونیک اسید با فرمول شیمیایی $$H_2SO_3$$ را به وجود بیاورد که به عنوان بافر عمل میکند و دقت تیتراسیون را کاهش میدهد. با جوشاندن، مقدار عمده این کربونیک اسید از محلول خارج میشود و دقت تیتراسیون بالا میرود.
توجه داشته باشید که در انواع تیتراسیون مقادیر اندکی از شناساگر باید توانایی تغییر رنگ مناسبی داشته باشید، زیرا با افزایش مقدار شناساگر، مقدار $$pH$$ نقطه پایانی تیتراسیون تحت تاثیر قرار میگیرد. همچنین بهتر است تغییر رنگ در نقطه پایانی شدید باشد. شناساگر تیتراسیون اسید و باز باید دارای مقدار ثابت تفکیک اسید $$(pK_a)$$ نزدیک به مقدار $$pH$$ نقطه پایانی تیتراسیون باشد. هرچه این تفاوت کمتر باشد، دقت تیتراسیون و محاسبات آن بالا خواهد رفت.
مثال تیتراسیون اسید و باز
برای تیتراسیون هیدروکلریک اسیدی با غلظت مجهول، ۵۰ میلیلیتر از آن را به یک ارلن مایر تمیز منتقل میکنیم. تیترانت این تیتراسیون، سدیم هیدروکسید ۰٫۱ مولار است و تا رسیدن به نقطه پایانی تیتراسیون و مشاهده تغییر رنگ، ۱۰ میلیلیتر از آن مصرف میشود. بازه تغییر رنگ این تیتراسیون در $$pH$$ برابر با ۷ است، بنابراین از لیتموس با $$pK_a$$ برابر با ۶٫۵ استفاده میشود. غلظت اسید مجهول را محاسبه کنید.
پاسخ
واکنش خنثیشدن این تیتراسیون را میتوان بهصورت زیر نوشت:
$$HCl_{(aq)} + NaOH_{(aq)} \rightarrow H_2O_{(l)} + Na^+ + Cl^-$$
همچنین میتوان برای سادگی از معادله خالص یونی آن نیز استفاده کرد.
$$H^+ + OH^- \rightarrow H_2O_{(l)}$$
بنابراین میتوان برای محاسبه غلظت هیدروکلریک اسید بهصورت زیر عمل کرد.
$$X= (0.1\; M \;\; NaOH) (10\;mL) \left(\dfrac{1\;L}{1000\; mL} \right) \left( \dfrac{1\;mol\; NaOH}{1\; mol \; OH^-} \right)$$
$$H^+ = X \;\; HCl$$
$$X = 0.0010 \;mol \;of\; HCl$$
$$\dfrac{0.0010\; mol\; HCl}{0.050\; L} = 0.020\;M \;HCl$$
تیتراسیون اکسایش کاهش
کمی پس از گسترش تیتراسیون اسید و باز، استفاده از تیتراسیونهایی که بر مبنای یک واکنش اکسایش و کاهش بودند نیز معرفی شدند. در تیتراسیونهای اکسایش و کاهش ابتدایی، از قدرت اکسندگی کلر بهره گرفته میشد. در اواسط قرن نوزدهم، استفاده از این روش با به کارگیری تیترانتهای اکسندهای مانند $$ MnO_4^–$$، $$Cr_2O_7^{2–}$$ و $$I_2$$ و تیترانتهایی کاهنده مانند $$Fe^{2+}$$ و $$S_2O_3^{2–}$$ رواج بیشتری پیدا کرد با این حال عدم وجود شناساگر مناسب مانعی سر راه این روش بود.
با اینحال تیترانتی که دارای گونه اکسایشی و گونه کاهشی با دو رنگ متفاوت باشد، میتواند در تیتراسیون بدون استفاده از شناساگر به کار گرفته شود. برای مثال، یون $$ MnO_4^–$$ رنگ بنفش تیرهای دارد و میتواند شناساگر تیتراسیون خود باشد. این تیترانت در حالت کاهشی خود، $$Mn^{2+}$$، تقریبا بیرنگ است. در گذر زمان، شناساگرهای مناسبی برای انواع تیتراسیون اکایش کاهش نیز معرفی شد.
نحوه انجام تیتراسیون اکسایشی و کاهشی
برای بررسی انواع تیتراسیون اکسایشی و کاهشی باید شکل منحنی تیتراسیون آن را بدانیم. این منحنی تغییرات پتانسیل واکنش را نسبت به حجم تیترانت اضافهشده، نمایش میدهد. در ادامه مثالی را مورد بررسی قرار میدهیم. تیتراسیونی را در نظر بگیرید که در آن آنالیتی در فرم کاهش یافته $$A_{red}$$ خود، با تیترانتی به فرم اکسایش یافته خود $$B_{ox}$$، وارد واکنش میشود.
$$A_\textrm{red}+B_\textrm{ox} \rightleftharpoons B_\textrm{red}+A_\textrm{ox}$$
در صورتی که $$A_{OX}$$ نشاندهنده گونه اکسایش یافته آنالیت باشد، $$B_{Red}$$ گونه کاهش یافته آن را نمایش میدهد. همچنین بهصورت زیر، پتانسیل واکنش $$E_{rxn}$$، تفاوت پتانسیل دو نیمواکنش خواهد بود.
$$E_\textrm{rxn}=E_{B_\mathrm{\Large ox}/B_\mathrm{\Large red}}-E_{A_\mathrm{\Large ox}/A_\mathrm{\Large red}}$$
بعد از هر افزودن تیترانت، واکنش آن با آنالیت به تعادل خواهد رسید و از آنجا که پتانسیل در نقطه همارزی برابر با ۰ است، پتانسیل کاهشی تیترانت و آنالیت مشابه یکدیگر خواهد بود.
$$E_{B_\mathrm{\Large ox}/B_\mathrm{\Large red}}=E_{A_\mathrm{\Large ox}/A_\mathrm{\Large red}}$$
این نکته بسیار مهم و کاربردی است زیرا با دانستن آن میتوان از هر کدام از نیمواکنشها برای پیگیری تیتراسیون استفاده کنیم. پیش از نقطه همارزی، مخلوط تیتراسیون حاوی مقادیر قابل ملاحظهای از گونه اکسایش یافته و کاهش یافته آنالیت است اما مقدار تیترانت واکنشنداده، بسیار کم است. بنابراین برای به دست آوردن مقدار پتانسیل، از رابطه نرنست برای نیمواکنش آنالیت بهره میبریم و آن را بهصورت زیر مینویسیم.
$$E_\textrm{rxn}= E^o_{A_\mathrm{\Large ox}/A_\mathrm{\Large red}}-\dfrac{RT}{nF}\ln\dfrac{[A_\textrm{red}]}{[A_\textrm{ox}]}$$
همچنین پس از نقطه همارزی، محاسبه پتانسیل از رابطه نرنست برای نیمواکنش تیترانت، سادهتر است و آن را به شکل زیر نمایش میدهیم.
$$E_\textrm{rxn}= E^o_{B_\mathrm{\Large ox}/B_\mathrm{\Large red}}-\dfrac{RT}{nF}\ln\dfrac{[B_\textrm{red}]}{[B_\textrm{ox}]}$$
محاسبات تیتراسیون اکسایشی و کاهشی
نحوه انجام محاسبات لازم در انواع تیتراسیون اکسایشی و کاهشی را در این بخش با یک مثال مورد بررسی قرار میدهیم. در این تیتراسیون ۵۰ میلیلیتر از $$Fe^{2+}$$ با مولاریته ۰٫۱ با $$Ce^{4+}$$ با مولاریته ۰٫۱ تیتر میشود. هر دو این اجزا در ماتریس $$HClO_4$$ ۱ با مولاریته ۱ قرار دارند. واکنش این تیتراسیون را میتوان بهصورت زیر نمایش داد.
$$\textrm{Fe}^{2+}(aq)+\textrm{Ce}^{4+}(aq)\rightleftharpoons \textrm{Ce}^{3+}(aq)+\textrm{Fe}^{3+}(aq)\tag{9.15}$$
در $$HClO_4$$ با مولاریته ۱، پتانسیل فرمال برای کاهش $$Fe^{3+}$$ به $$Fe^{2+}$$ برابر با ۰٫۷۶۷ ولت و پتانسیل فرمال برای کاهش $$Ce^{4+}$$ به $$Ce^{3+}$$ نیز برابر با ۱٫۷ ولت است. از آنجا که ثابت تعادل برای واکنش بالا بسیار بزرگ و در حد $$ 6 × 10^{15}$$ است، فرض بر این خواهد بود که واکنش بین آنالیت و تیترانت تکمیل میشود. برای انجام محاسبات مورد نیاز این تیتراسیون مراحل زیر را طی میکنیم.
مرحله اول: محاسبه حجم مورد نیاز تیترانت برای رسیدن به نقطه همارزی
نخستین کاری که در هر محاسبات تیتراسیونی باید صورت گیرد، محاسبه حجم تیترانت تا رسیدن به لحظه همارزی است. این محاسبات را با توجه به استوکیومتری واکنش بهصورت زیر انجام میدهیم.
$$\textrm{moles Fe}^{2+}=\textrm{moles Ce}^{4+}$$
$$M_\textrm{Fe}\times V_\textrm{Fe} = M_\textrm{Ce}\times V_\textrm{Ce}$$
با جایگذاری مقادیر در دست، حجم $$Ce^{4+}$$ محاسبه میشود.
$$V_\textrm{eq} = V_\textrm{Ce} = \dfrac{M_\textrm{Fe}V_\textrm{Fe}}{M_\textrm{Ce}}=\dfrac{\textrm{(0.100 M)(50.0 mL)}}{\textrm{(0.100 M)}}=\textrm{50.0 mL}$$
مرحله دوم: محاسبه پتانسیل پیش از نقطه همارزی
این کار را با محاسبه غلظت گونههای اکسیدشده و کاهش یافته آنالیت انجام میدهیم. سپس از رابطه نرنست برای نیمواکنش کاهشی استفاده میکنیم. توجه داشته باشید که پیش از نقطه همارزی، محاسبه غلظت $$Fe^{2+}$$ و $$Fe^{3+}$$ ساده است. پتانسیل را نیز از رابطه نرنست برای نیمواکنش $$Fe^{3+}/Fe^{2+}$$ به دست میآوریم.
$$E = E^o_\mathrm{\large Fe^{3+}/Fe^{2+}} - \dfrac{RT}{nF}\log\dfrac{[\mathrm{Fe^{2+}}]}{[\mathrm{Fe^{3+}}]}=+0.767\textrm V - 0.05916\log\dfrac{[\mathrm{Fe^{2+}}]}{[\mathrm{Fe^{3+}}]}\tag{9.16}$$
برای مثال غلظت $$Fe^{3+}$$$ و $$Fe^{2+}$$ بعد از افزودن ۱۰ میلیلیتر از تیترانت بهصورت زیر قابل محاسبه است.
$$ \begin{align}
[ \textrm {Fe}^{2+ } ] &=\dfrac{\textrm {initial moles Fe} ^{2+} - \textrm {moles Ce} ^{4+} \textrm{ added}}{\textrm {total volume}}=\dfrac {M_\textrm{Fe}V_\textrm{Fe} - M_\textrm{Ce}V_\textrm{ Ce } } {V_\textrm{Fe}+V_\textrm{Ce}}\\
&\mathrm{= \dfrac{ ( 0.100\;M ) (50.0\;mL)-(0.100\;M)(10.0\;mL) } { 50.0\;mL+10.0\;mL } = 6.67\times10^{-2}\;M}
\end {align} $$
$$ \begin {align}
[\mathrm{Fe^ {3+ } }]&=\mathrm{\dfrac{moles\;Ce^{4+}\;added} {total\;volume} }=\dfrac {M_\textrm{Ce}V_\textrm{Ce } } {V_\textrm{Fe} + V_\textrm {Ce} } \\
&=\dfrac {\textrm{(0.100 M)(10.0 mL)}}{\textrm{50.0 mL + 10.0 mL} } =1.67\times10^ {-2} \textrm{ M}
\end{align} $$
با جایگذاری این مقادیر در رابطه پتانسیل، آن را به دست میآوریم.
$$ E = +0.767\textrm { V} - 0.05916 \log\dfrac{6.67\times10^{-2 }\textrm{ M}}{ 1.67\times10^{-2}\textrm { M}}=+0.731\textrm { V} $$
مرحله سوم: محاسبه پتانسیل پس از نقطه همارزی
این کار را با محاسبه غلظت گونههای اکسیدشده و کاهش یافته تیترانت انجام میدهیم. سپس از رابطه نرنست برای نیمواکنش کاهشی آن استفاده میکنیم. توجه داشته باشید که پس از نقطه همارزی، محاسبه غلظت $$Ce^{4+}$$ و $$Ce^{3+}$$ ساده است. پتانسیل را نیز از رابطه نرسنت برای نیمواکنش $$Ce^{4+}/Ce^{3+} $$ به دست میآوریم.
$$ E=E^o_\mathrm{\large {Ce^{4+}/Ce^{3+}}}-\dfrac { RT }{nF}\log\mathrm{\dfrac {[Ce^{3+}]}{[Ce^{4+}] } } =+ 1.70\textrm{ V} - 0.05916 \log\mathrm{\dfrac {[Ce^{3+}]}{ [Ce^{4+}]}}\tag {9.17 } $$
برای مثال بعد از افزودن ۶۰ میلیلیتر از تیترانت، غلظت $$Ce^{3+}$$ و $$Ce^{4+}$$ بهصورت زیر به دست میآید.
$$ \begin{align}
[\textrm {Ce}^{3+}]&={\dfrac{\textrm{initial moles Fe}^{2+}}{\textrm {total volume } } } =\dfrac{M_\textrm{Fe}V_\textrm{Fe}}{V_\textrm {Fe} +V_\textrm{Ce}} \\
&=\dfrac{\textrm{(0.100 M)(50.0 mL)}}{\textrm{50.0 mL + 60.0 mL}}= 4.55\times10^{-3}\textrm{ M}
\end{align} $$
$$ \begin{align}
[\textrm {Ce}^ {4+}]&=\dfrac{\textrm{moles Ce}^{4+}\textrm{ added} - \textrm{initial moles Fe}^{2+ } } {\textrm{total volume}}=\dfrac{M_\textrm{Ce}V_\textrm{Ce}-M_\textrm{Fe}V_\textrm{Fe}}{V_\textrm{Fe}+V_\textrm{Ce}}\\
&=\dfrac {\textrm {(0.100 M)(60.0 mL)} -\textrm{(0.100 M)(50.0 mL)}} { \textrm{50.0 mL + 60.0 mL}}=9.09\times10^{-3}\textrm{ M}
\end{align} $$
با جایگذاری این مقادیر در رابطه پتانسیل، آن را به دست میآوریم.
$$ E=+1.70\textrm{ V}-0.05916\log\dfrac {4.55\times10^ {-2}\textrm{ M} } {9.09 \times10^{-3}\textrm { M} } =+1.66\textrm { V}$$
مرحله چهارم: محاسبه پتانسیل در نقطه همارزی
در نقطه همارزی، پتانسیل دو نیمواکنش با یکدیگر برابر خواهد بود و میتوان آنها را به شکل زیر نوشت.
$$ 2E_\textrm{eq}= E^o_\mathrm{\large Fe^{3+}/Fe^{2+}}+E^o_\mathrm{\large Ce^{4+}/Ce^{3+}}-0.05916\log\dfrac{\mathrm{[{Fe}^{2+}][Ce^{3+}]}}{\mathrm{[Fe^{3+}][Ce^{4+}]}}$$
از آنجا که در این نقطه غلظتهای دو گونه $$ [Fe^{2+}] = [Ce^{4+}] $$ و $$ [Ce^{3+}] = [Fe^{3+}] $$ با یکدیگر برابر هستند، مقدار عددی لگاریتم برابر با ۰ خواهد بود و پتانسیل در نقطه همارزی بهصورت زیر به دست میآید.
$$ E_\textrm{eq}=\dfrac{E^o_\mathrm{\large Fe^{3+}/Fe^{2+}} + E^o_\mathrm{\large Ce^{4+}/Ce^{3+}}}{2}=\dfrac{\textrm{0.767 V + 1.70 V}}{2}=1.23\textrm{ V} $$
میتوان با محاسباتی مشابه محاسبات بالا، تعداد بیشتری نقاط را به دست آورد و از آنها برای رسم منحنی تیتراسیون بهره برد. این نقاط را در حجمهای مختلف در جدول زیر آوردهایم.
| حجم $$Ce^{4+}$$ بر حسب میلیلیتر | پتانسیل بر حسب ولت |
| ۱۰ | ۰٫۷۳۱ |
| ۲۰ | ۰٫۷۵۷ |
| ۳۰ | ۰٫۷۷۷ |
| ۴۰ | ۰٫۸۰۳ |
| ۵۰ | ۱٫۲۳ |
| ۶۰ | ۱٫۶۶ |
| ۷۰ | ۱٫۶۸ |
| ۸۰ | ۱٫۶۹ |
| ۹۰ | ۱٫۶۹ |
| ۱۰۰ | ۱٫۷ |
منحنی این تیتراسیون در زیر آورده شده است. همانطور که مشاهده میکنید در نزدیکی نقطه همارزی، زمانی که ۵۰ میلیلیتر از تیترانت افزوده شده است، تغییرات پتانسیل بسیار شدید است.
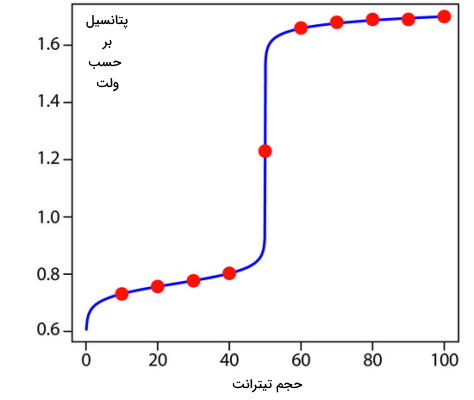
نقطه همارزی در تیتراسیون اکسایشی و کاهشی
نقطه همارزی در انواع تیتراسیون اکسایشی و کاهشی زمانی مشاهده میشود که مقدار تیترانت و آنالیت از نظر استوکیومتری با یکدیگر برابر باشند. در این روش نیز نقاط همارزی واکنش توسط یک شناساگر بهصورت نقطه پایانی تیتراسیون به دست میآید.
این نقطه را در منحنی تیتراسیون اکسایشی و کاهشی در قسمت شیبدار میتوان مشاهده کرد. توجه داشته باشید که اگر استوکیومتری تیترانت و آنالیت متقارن باشد، یعنی هر ۱ مول از تیترانت با ۱ مول از آنالیت وارد واکنش شود، به آن «نقطه همارزی متقارن» (Symmetric Equivalence Pint) گفته میشود. در حالتی که استوکیومتری واکنش ۱:۱ نباشد، نقطه همارزی به بالا یا پایین منحنی نزدیکتر خواهد بود و آن را با نام «نقطه همارزی نامتقارن» (Asymmetric Equivalence Point) میشناسیم.
مثال از تیتراسیون اکسایشی و کاهشی
محاسبات مربوط به تیتراسیون $$Fe^{2+}$$ توسط تیترانت $$MnO_4^-$$ را با توجه به واکنش زیر انجام دهید.
$$ 5\textrm{Fe}^{2+}(aq)+\textrm{MnO}_4^-(aq)+8\textrm H^+(aq)\rightarrow 5\textrm{Fe}^{3+}(aq)+\textrm{Mn}^{2+}(aq)+\mathrm{4H_2O} $$
پاسخ
نیمواکنشهای $$Fe^{2+}$$ و $$MnO_4^-$$ را میتوان بهصورت زیر نوشت:
$$ \textrm{Fe}^{2+}(aq)\rightarrow\textrm{Fe}^{3+}(aq)+e^- $$
$$ \textrm{MnO}_4^-(aq)+8\textrm H^+(aq)+5e^-\rightarrow \textrm{Mn}^{2+}(aq)+4\mathrm{H_2O}(l)- $$
و رابطه نرنست را برای آنها خواهیم نوشت:
$$ E=E^o_\mathrm{\large Fe^{3+}/Fe^{2+}}-0.05916\log\dfrac{[\textrm{Fe}^{2+}]}{[\textrm{Fe}^{3+}]} $$
$$ E=E^o_\mathrm{\large MnO_4^-/Mn^{2+}}-\dfrac{0.05916}{5}\log\dfrac{[\textrm{Mn}^{2+}]}{{[MnO_4^- ][H^+]^8}} $$
پیش از جمع بستن این دو عبارت، باید عبارت دوم را در عدد ۵ ضرب کنیم تا بتوانیم لگاریتمها را به یکدیگر اضافه کنیم.
$$ 6E=E^o_\mathrm{\large Fe^{3+}/Fe^{2+}}+5E^o_\mathrm{\large MnO_4^-/Mn^{2+}}-0.05916\log\mathrm{\dfrac{[Fe^{2+}][Mn^{2+}]}{[Fe^{3+}][{MnO_4^-}][H^+]^8}} $$
میدانیم که در نقطه همارزی دو عبارت زیر صادق هستند.
$$ [\textrm{Fe}^{2+}]=5\times[\textrm{MnO}_4^-] $$
$$ [\textrm{Fe}^{3+}]=5\times[\textrm{Mn}^{2+}] $$
با جایگذاری این دو عبارت در رابطههای پیشین و بازآرایی آنها، معادلهای کلی برای محاسبه پتانسیل در نقطه همارزی خواهیم داشت.
$$ 6E_\textrm{eq}=E^o_\mathrm{\large Fe^{3+}/Fe^{2+}}+5E^o_\mathrm{\large MnO_4^-/Mn^{2+}}-0.05916\log\mathrm{\dfrac{5[{MnO_4^-}][Mn^{2+}]}{5[Mn^{2+}][{MnO_4^-}][H^+]^8}} $$
$$ E_\textrm{eq}=\dfrac{E^o_\mathrm{\large Fe^{3+}/Fe^{2+}} + 5E^o_\mathrm{\large MnO_4^-/Mn^{2+}}}{6}-\dfrac{0.05916}{6}\log\dfrac{1}{[\textrm H^+]^8} $$
$$ E_\textrm{eq}=\dfrac{E^o_\mathrm{\large Fe^{3+}/Fe^{2+}}+5E^o_\mathrm{\large MnO_4^-/Mn^{2+}}}{6}+\dfrac{0.05916\times8}{6}\log[\textrm H^+] $$
$$ E_\textrm{eq}=\dfrac{E^o_\mathrm{\large Fe^{3+}/Fe^{2+}}+5E^o_\mathrm{\large MnO_4^-/Mn^{2+}}}{6}-0.07888\textrm{pH} $$
معادله ما برای نقطه همارزی از دو عبارت تشکیل شده است. عبارت اول میانگین وزنی پتانسیل استاندارد تیترانت و آنالیت را نشان میدهد که در آن تعداد الکترونها بیانگر این وزن هستند.
همچنین از عبارت دوم متوجه میشویم که این تیتراسیون به مقدار $$pH$$ بستگی دارد. برای مثال در سولفوریک اسید و در مقدار $$pH$$ برابر با ۱، پتانسیل نقطه همارزی برابر است با:
$$ E_\textrm{eq}=\dfrac{0.768+5\times1.51}{6}-0.07888\times1=1.31\textrm{ V} $$
در تصویر زیر، منحنی نامتقارن این تیتراسیون را مشاهده میکنید.
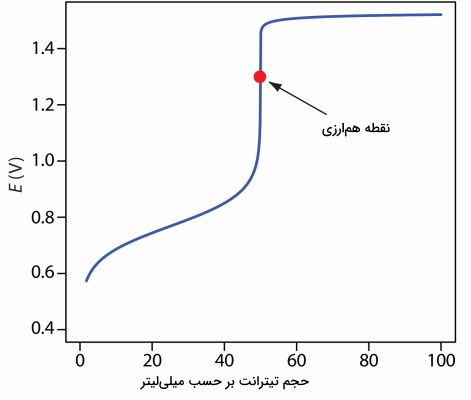
شناساگر تیتراسیون اکسایشی و کاهشی
در تیتراسیون اکسایشی و کاهشی از ۳ نوع از انواع تیتراسیون استفاده میشود. در ادامه میخواهیم این شناساگرها را به تفصیل مورد بررسی قرار دهیم.
- برخی از تیترانتهای مورد استفاده در انواع تیتراسیون اکسایشی و کاهشی در فرم اکسایش یافته و کاهش یافته خود دارای دو رنگ متفاوت هستند. از این مورد میتوان به تیترانت پتاسیم پرمنگنات اشاره کرد. به تیتراسیونی که در آن از پتاسیم پرمنگنات به عنوان تیترانت استفاده شود، «منگانومتری» (Manganometry) گفته میشود. در این تیتراسیون پرمنگنات دارای رنگ بنفش تیره است و وقتی به فرم $$Mn^{2+}$$ کاهش پیدا میکند، بیرنگ میشود. در این صورت با مشاهده اولین رنگ بنفش که نشاندهنده مقدار مازاد موجود از پرمنگنات است، به نقطه پایانی تیتراسیون پی خواهیم برد.
شناساگر رنگی
شناساگرهای دیگری وجود دارند که با گونه اکسایش یافته یا کاهش یافته تیترانت یا آنالیت، ترکیبی به وجود میآورند که رنگی هستند. برای درک بهتر مثالی را مورد بررسی قرار میدهیم. شناساگر نشاسته با $$I_3^-$$ کمپلکسی به رنگ آبی تیره تولید میکند. میتوان با مشاهده این رنگ به وجود مقدار مازاد تیترانت $$I_3^-$$ پی برد. همچنین اگر $$I_3^-$$ آنالیت باشد، در حضور شناساگر با مصرف شدن، رنگ آبی محلول به بیرنگ تغییر پیدا میکند. همچنین شناساگر تیوسیانات، $$SCN^-$$، با یون $$Fe^{3+}$$ تشکیل کمپلکس قرمز رنگ $$Fe(SCN)^{2+}$$ را میدهد.
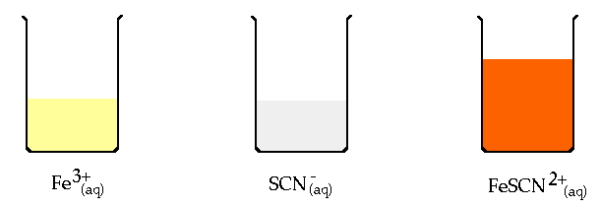
دسته سوم که مهمترین شناساگرها نیز هستند، موادی هستند در تیتراسیون، تشکیل رسوب نمیدهند اما گونه اکسایشی و کاهشی آنها با یکدیگر تفاوت رنگ دارد. وقتی شناساگر اکسایشی و کاهشی را به محلول آنالیت اضافه میکنیم، از خود رنگی نشان میدهد که بستگی به مقدار پتانسیل محیط دارد. به همین دلیل با تغییر مقدار پتانسیل محلول در افزودن تیترانت، درجه اکسیداسیون شناساگر نیز تغییر میکند و شاهد تغییر رنگ خواهیم بود. این تغییر رنگ نشانهای از فرا رسیدن نقطه پایانی تیتراسیون اکسایشی و کاهشی است. برای درک بهتر رابطه بین پتانسیل و رنگ شناساگر، نیمواکنش کاهشی زیر را در نظر بگیرید.
$$ \mathrm{In_{ox}}+ne^-\rightleftharpoons \mathrm{In_{red}} $$
- $$In_{ox}$$: گونه اکسایش یافته شناساگر
- $$ {In_{red}} $$: گونه کاهش یافته شناساگر
رابطه نرنست برای این نیمواکنش را می توان بهصورت زیر نوشت.
$$ E=E^o_\mathrm{In_{\large ox}/In_{\large red}}-\dfrac{0.05916}{n}\log\mathrm{\dfrac{[In_{red}]}{[In_{ox}]}} $$
همانطور که در تصویر زیر مشاهده میکنید، اگر تغییر رنگ شناساگر از $$In_{OX}$$ به $$In_{red}$$ زمانی اتفاق بیفتد که نسبت $$ [In_{red}]/[In_{ox}] $$ از ۰٫۱ به ۱ تغییر کند، نقطه پایانی زمانی مشاهده میشود که پتانسیل در بازه رابطه زیر باشد.
$$ E=E^o_\mathrm{In_{\large ox}/In_{\large red}}\pm\dfrac{0.05916}{n} $$
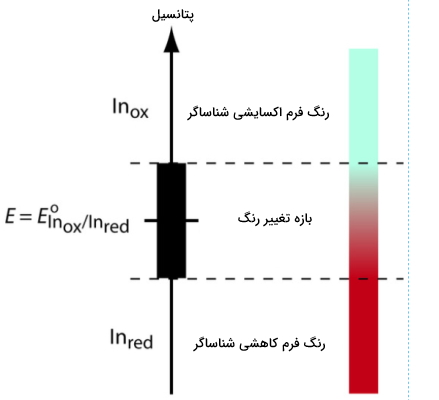
در جدول زیر تعدادی از شناساگرهای متعلق به این دسته را به همراه تغییر رنگشان مشاهده میکنید.
| شناساگر | رنگ فرم اکسایشی- رنگ فرم کاهشی | $$E^o_\mathrm{In_{\large ox}/In_{\large red}}$$ |
| متیلن آبی | آبی- بیرنگ | ۰٫۳۶ |
| فرورین | آبی روشن- قرمز | ۱٫۱۴۷ |
| دیفنیل آمین | بنفش- بیرنگ | ۰٫۷۵ |
| ایندیگو تتراسولفات | آبی- بیرنگ | ۰٫۳۶ |
| دیفنیل آمین سولفونیک اسید | قرمز- بیرنگ | ۰٫۸۵ |
تیتراسیون کمپلکسومتری
در «تیتراسیون کمپلکسومتری» (Compexometric Titration) تعیین غلظت مجهول یک یون فلزی به کمک «لیگاندی» (Ligand) صورت میگیرد که با آن یک کمپلکس با نسبت مشخص، تشکیل بدهد. در این تیتراسیون، آنالیت یونهای فلزی و تیترانت یک لیگاند است.
تیتراسیون کمپلکسومتری اولین بار در سال ۱۸۵۰ صورت گرفت با اینحال گسترش این روش سالها به طول انجامید زیرا بسیاری از یونهای فلزی با لیگاندها بیش از یک کمپلکس را تشکیل میدهند و این کار را بسیار دشوار میکند.
پرکاربردترین لیگاندی که در انواع تیتراسیون کمپلکسومتری به کار گرفته میشود، «اتیلن دیآمین تترا استیک اسید است که آن را با EDTA نشان میدهند. این لیگاند با بسیاری از یونهای فلزی، کمپلکسی با نسبت ۱:۱ تشکیل میدهد. در ادامه به بررسی این لیگاند بسیار مهم خواهیم پرداخت.
EDTA چیست؟
اتیلن دی آمین تترا استیک اسید به خانواده آمینو کربوکسیلیک اسیدها تعلق دارد. میتوانید ساختار این مولکول را در تصویر زیر مشاهده کنید که تمامی پروتونهای خود را از دست داده است.
این مولکول یک اسید لوییس است و ۶ محل اتصال در آن وجود دارد. ۴ محل اتصال بهصورت گروه کربوکسیلیک اسید با بار منفی و ۲ محل، گروههای آمینی نوع سوم هستند.
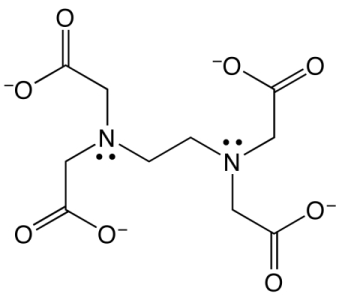
این محلها میتوانند به یونهای فلزی زوج الکترون بدهند که منتهی به تولید کمپلکس فلز-EDTA میشود. در این کمپلکس EDTA مانند قفسی، یون فلزی را احاطه میکند و به اصطلاح یک ترکیب کوئوردیناسیونی را به وجود میآورد. این را میتوانید در تصویر زیر مشاهده کنید که در آن $$M^{2+}$$ یون فلزی است.
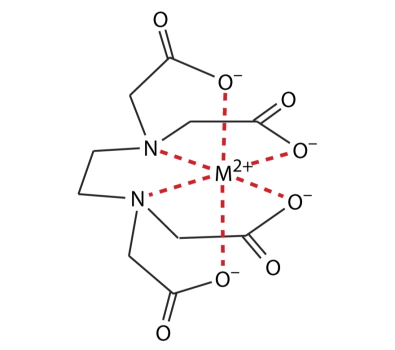
ثابت تشکیل فلز و EDTA
برای نمایش سادهتر تشکیل کمپلکس فلز با EDTA، ابتدا واکنشی را مورد بررسی قرار میدهیم. در این مورد واکنش بین یون فلزی کادمیوم و EDTA در زیر آورده شده است.
$$\mathrm{Cd^{2+}}(aq)+\mathrm{Y^{4-}}(aq)\rightleftharpoons \mathrm{CdY^{2-}}(aq)\tag{9.9}$$
در این واکنش فرم پروتونزدایی شده EDTA را بهصورت $$Y^{4-}$$ نمایش میدهیم. از آنجا که مقدار ثابت این واکنش بزرگ است، تعادل آن به سمت راست پیشروی خواهد کرد.
$$K_\textrm f=\dfrac{[\textrm{CdY}^{2-}]}{[\textrm{Cd}^{2+}][\textrm{Y}^{4-}]}=2.9\times10^{16}\tag{9.10}$$
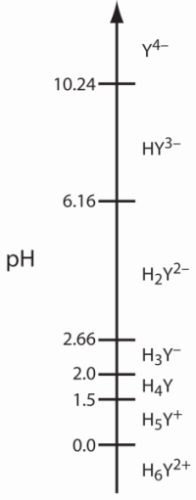
توجه داشته باشید که EDTA اسید ضعیفی است و با توجه به تعداد پروتونهای موجود در ساختار خود میتوان آن را با نمادهای متفاوتی نشان داد. این را میتوانید در تصویر زیر مشاهده کنید. همچنین مقدار $$pK_a$$ در هر فرم نیز آورده شده است.
ثابت تشکیل مشروط فلز با EDTA
در ثابت تشکیل $$CdY^{2-}$$، فرم $$Y^{4-}$$ از EDTA موجود است. با آمادهسازی محلولی از آن غلظت کل آن را در دست خواهیم داشت و آن را با نماد $$C_{EDTA}$$ نمایش میدهیم. بنابراین نمیتوان غلظت یک گونه خاص که در واکنش تیتراسیون دخیل است را بهصورت جداگانه بیاوریم. در این موارد نیاز داریم که رابطه ثابت تشکیل را با در نظر گرفتن این مورد بازنویسی کنیم. توجه داشته باشید که فارغ از محدوده $$pH$$، غلظت کل EDTA برابر با جمع غلظت فرمهای مختلف آن است و میتوان آن را بهصورت زیر نشان داد.
$$C_\textrm{EDTA}=[\mathrm{H_6Y^{2+}}]+[\mathrm{H_5Y^+}]+[\mathrm{H_4Y}]+[\mathrm{H_3Y^-}]+[\mathrm{H_2Y^{2-}}]+[\mathrm{HY^{3-}}]+[\mathrm{Y^{4-}}]$$
برای تصحیح ثابت تشکیل اسید و باز EDTA نیاز داریم که کسری از EDTA را که بهصورت $$Y^{4-}$$ وجود دارد، به شکل زیر مورد محاسبه قرار دهیم.
$$\alpha_{\textrm Y^{4-}} \dfrac{[\textrm Y^{4-}]}{C_\textrm{EDTA}}\tag{9.11}$$
در جدول زیر میتوانید مقادیر به دست آمده را در $$pH$$ مختلف مشاهده کنید. از این اعداد برای محاسبات بعدی کمک خواهیم گرفت.
| مقدار $$pH$$ | $$α_{Y^{4–}}$$ |
| ۱ | $$1.9×10^{–18}$$ |
| ۲ | $$3.4×10^{–14}$$ |
| ۳ | $$2.6×10^{–11}$$ |
| ۴ | $$3.8×10^{–9}$$ |
| ۵ | $$3.7×10^{–7}$$ |
| ۶ | $$2.4×10^{–5}$$ |
| ۷ | $$5.0×10^{–4}$$ |
| ۸ | $$5.6×10^{–3}$$ |
| ۹ | $$5.4×10^{–2}$$ |
| ۱۰ | $$0.37$$ |
| ۱۱ | $$0.85$$ |
| ۱۲ | $$0.98$$ |
| ۱۳ | $$1.00$$ |
| ۱۴ | $$1.00$$ |
در این صورت میتوانیم رابطه ثابت تشکیل کمپلکس فلز-EDTA را بهصورت زیر بازآرایی کنیم.
$$K_\textrm f =\dfrac{[\textrm{CdY}^{2-}]}{[\textrm{Cd}^{2+}]\alpha_{\textrm Y^{4-}}C_\textrm{EDTA}}$$
در نهایت به رابطه زیر خواهیم رسید که «ثابت تشکیل مشروط» (Conditional Formation Constant) نامیده میشود. این ثابت به مقدار $$pH$$ وابسته است. مقادیر این ثابت تشکیل مشروط در $$pH$$ مختلف در جدول زیر آورده شده است. با توجه به آن متوجه میشویم که در مقادیر $$pH$$ اسیدی، کمپلکس از پایداری کمتری برخوردار است.
| مقدار $$pH$$ | $$K_{f}´$$ |
| ۱ | $$5.5 × 10^{–2}$$ |
| ۲ | $$1.0 × 10^{–3}$$ |
| ۳ | $$7.7 × 10^{5}$$ |
| ۴ | $$1.1 × 10^{8}$$ |
| ۵ | $$1.1 × 10^{10}$$ |
| ۶ | $$6.8 × 10^{11}$$ |
| ۷ | $$1.5 × 10^{13}$$ |
| ۸ | $$1.6 × 10^{14}$$ |
| ۹ | $$1.6 × 10^{15}$$ |
| ۱۰ | $$1.1 × 10^{16}$$ |
| ۱۱ | $$2.5 × 10^{16}$$ |
| ۱۲ | $$2.9× 10^{16}$$ |
| ۱۳ | $$2.9× 10^{16}$$ |
| ۱۴ | $$2.9× 10^{16}$$ |
رقابت EDTA با لیگاندهای دیگر
برای ثابت نگهداشتن مقدار $$pH$$ در طول انجام انواع تیتراسیون کمپلکسومتری، معمولا به محیط یک بافر افزوده میشود. در صورتی که یکی از اجزای بافری، لیگاندی باشد که بتواند با کادمیوم تشکیل کمپلکس بدهد، EDTA باید با لیگاند دیگر برای تصاحب $$cD^{2+}$$ رقابت کند. در این مورد مثالی را مورد بررسی قرار میدهیم.
اگر بافر افزوده شده، آمونیوم و آمونیاک حاوی $$NH_3$$ باشد، کمپلکسهای متعددی از $$Cd^{2+}-NH_3$$ وجود خواهد داشت اما از آنجایی که کمپلکس EDTA با کادمیوم قویتر است، جایگزین میشود. با اینحال مقداری از پایداری کمپلکس کادمیوم-EDTA کاسته میشود.
به این حالت، تاثیر «عامل کمپلکسکننده فرعی» (Auxiliary Complexing Agent) گفته میشود. تاثیر این مورد را نیز باید دقیقا مانند تاثیر $$pH$$ در بخش قبلی در محاسبات در نظر گرفت. پیش از افزودن EDTA، تعادل جرم یون کادمیوم را میتوان بهصورت زیر نمایش داد.
$$C_\textrm{Cd}=[\mathrm{Cd^{2+}}]+[\mathrm{Cd(NH_3)^{2+}}]+[\mathrm{Cd(NH_3)_2^{2+}}]+[\mathrm{Cd(NH_3)_3^{2+}}]+[\mathrm{Cd(NH_3)_4^{2+}}]$$
همچنین کسری از $$Cd^{2+}$$ واکنشنداده را نیز میتوان بهصورت زیر نشان داد:
$$\alpha_{\textrm{Cd}^{2+}}=\dfrac{[\mathrm{Cd^{2+}}]}{C_\textrm{Cd}}\tag{9.13}$$
در این حالت ثابت تشکیل مشروط را میتوان به روش زیر مورد محاسبه قرار داد.
$$K_\textrm f' =K_\textrm f \times \alpha_{\textrm Y^{4-}} = \dfrac{[\mathrm{CdY^{2-}}]}{\alpha_\mathrm{Cd^{2+}}C_\textrm{Cd}C_\textrm{EDTA}}$$
از آنجا که غلظت آمونیاک در بافر مقداری ثابت است، میتوان با بازآرایی رابطه بالا، آن را بهصورت زیر نوشت.
$$K_\textrm f''=K_\textrm f\times\alpha_\mathrm{Y^{4-}}\times\alpha_\mathrm{Cd^{2+}}=\dfrac{[\mathrm{CdY^{2-}}]}{C_\textrm{Cd}C_\textrm{EDTA}}\tag{9.14}$$
بنابراین میتوان به این صورت رابطهای داشت که هم تاثیر $$pH$$ و هم تاثیر عامل کمپلکسکننده فرعی را در نظر بگیرد. در جدول زیر میتوانید مقادیر عددی $$α_{Cd^{2+}}$$ را در چند غلظت متفاوت آمونیاک مشاهده کنید.
| غلظت $$NH_3$$ بر حسب مولار | $$α_{Cd^{2+}}$$ |
| ۱ | $$6.09×10^{–8}$$ |
| ۰٫۵ | $$1.05×10^{–6}$$ |
| ۰٫۱ | $$3.51×10^{–4}$$ |
| ۰٫۰۵ | $$2.72×10^{–3}$$ |
| ۰٫۰۱ | $$8.81×10^{–2}$$ |
| ۰٫۰۰۵ | $$2.27×10^{–1}$$ |
| ۰٫۰۰۱ | $$6.09×10^{–1}$$ |
محاسبات تیتراسیون کمپلکسومتری
حال که با مفهوم تیتراسیون کمپلکسومتری تا اینجای این مطلب از مجله فرادرس آشنا شدیم، میخواهیم یکی از انواع تیتراسیون کمپلکسومتری را مورد بررسی قرار دهیم و محاسبات مورد نیاز آن را مرحله به مرحله انجام دهیم. هدف از این محاسبات در نهایت یافتن نقطه همارزی و غلظت مجهول آنالیت است.
در این تیتراسیون ۵۰ میلیلیتر از $$Cd^{2+}$$ با مولاریته $$5.00×10^{–3}$$ را به کمک EDTA با مولاریته ۰٫۰۱ تیتر میکنیم. $$pH$$ محیط این تیتراسیون به کمک بافر آمونیاک ۰٫۰۱ مولار روی مقدار ۱۰ ثابت میشود. مراحل انجام شده در این مورد باید بهصورت زیر باشد.
مرحله اول: محاسبه ثابت تشکیل مشروط کمپلکس فلز با EDTA
از آنجا که مقدار $$pH$$ برابر با ۱۰ است، مقداری از EDTA به فرم $$Y^{4-}$$ حضور خواهد داشت. به علاوه در این تیتراسیون EDTA باید برای تشکیل کمپلکس با یون کادمیوم، با آمونیاک نیز وارد رقابت شود. بنابراین پیش از هرکاری باید مقدار ثابت تشکیل مشروط را برای این شرایط به دست آوریم. با توجه به جداول پیشین، میدانیم که مقدار $$α_{Y^{4–}}$$ در $$pH$$ برابر با ۱۰، ۰٫۳۵ و مقدار $$α_{Cd^{2+}}$$ نیز در حضور آمونیاک ۰٫۰۱ مولار، برابر با ۰٫۰۸۸۱ است. با استفاده از این مقادیر میتوان مقدار ثابت تشکیل مشروط را بهصورت زیر محاسبه کرد.
$$K_\textrm f''=K_\textrm f \times \alpha_\mathrm{Y^{4-}}\times\alpha_\mathrm{Cd^{2+}}=(2.9\times10^{16})(0.37)(0.0881)=9.5\times10^{14}$$
و از آنجا که مقدار به دست آمده بزرگ است، میتوان اینطور نتیجهگیری کرد که این واکنش بهصورت کامل انجام میشود.
$$\textrm{Cd}^{2+}(aq)+\textrm Y^{4-}(aq)\rightarrow \textrm{CdY}^{2-}(aq)$$
مرحله دوم: محاسبه حجم مورد نیاز EDTA برای رسیدن به نقطه همارزی
میدانیم که در نقطه همارزی مولهای تیترانت و آنالیت با یکدیگر برابر است. این مورد را میتوان بهصورت زیر نمایش داد.
$$\textrm{moles EDTA = moles Cd}^{2+}$$
$$M_\textrm{EDTA}\times V_\textrm{EDTA}=M_\textrm{Cd}\times V_\textrm{Cd}$$
با جایگذاری مقادیر داده شده، حجم مورد نیاز EDTA را بهصورت زیر خواهیم داشت.
$$V_\textrm{eq}=V_\textrm{EDTA}=\dfrac{M_\textrm{Cd}V_\textrm{Cd}}{M_\textrm{EDTA}}=\dfrac{(5.00\times10^{-3}\;\textrm M)(\textrm{50.0 mL})}{\textrm{0.0100 M}}=\textrm{25.0 mL}$$
مرحله سوم: محاسبه مقدار $$pM$$ پیش از نقطه همارزی با محاسبه غلظت یونهای فلزی واکنشنداده
پیش از نقطه همارزی، مقدار $$Cd^{2+}$$ مازاد است و میتوان مقدار $$pCd$$ را از غلظت کادمیوم واکنشنداده به دست آورد. از آنجا که تمام کادمیوم آزاد نیست و برخی با آمونیاک تشکیل کمپلکس داده است، باید حضور آمونیاک را نیز در نظر داشت. برا مثال بعد از افزودن ۵ میلیلیتر EDTA، غلظت $$Cd^{2+}$$ را میتوان به روش زیر به دست آورد.
\begin{align}
C_\textrm{Cd}&=\dfrac{\textrm{initial moles Cd}^{2+} - \textrm{moles EDTA added}}{\textrm{total volume}}=\dfrac{M_\textrm{Cd}V_\textrm{Cd}-M_\textrm{EDTA}V_\textrm{EDTA}}{V_\textrm{Cd}+V_\textrm{EDTA}}\\
&=\dfrac{(5.00\times10^{-3}\textrm{ M})(\textrm{50.0 mL}) - (\textrm{0.0100 M})(\textrm{5.0 mL})}{\textrm{50.0 mL + 5.0 mL}}=3.64\times10^{-3}\textrm{ M}
\end{align}M}
برای محاسبه غلظت $$Cd^{2+}$$ آزاد نیز به روش زیر عمل میکنیم.
$$[\mathrm{Cd^{2+}}] = \alpha_\mathrm{Cd^{2+}} \times C_\textrm{Cd} = (0.0881)(3.64\times10^{-4}\textrm{ M})=3.21\times10^{-4}\textrm{ M}$$
$$\textrm{pCd}=-\log[\mathrm{Cd^{2+}}]=-\log(3.21\times10^{-4}) = 3.49$$
مرحله چهارم: محاسبه مقدار $$pM$$ در نقطه همارزی به کمک ثابت تشکیل مشروط
در نقطه همارزی، تمامی کادمیوم موجود بهصورت $$CdY^{2-}$$ حضور خواهند داشت. بنابراین میتوان غظت کادمیوم را از تفکیک این کمپلکس به دست آورد. ابتدا غلظت کمپلکس را محاسبه میکنیم.
$$\begin{align}
[\mathrm{CdY^{2-}}]&=\dfrac{\textrm{initial moles Cd}^{2+}}{\textrm{total volume}}=\dfrac{M_\textrm{Cd}V_\textrm{Cd}}{V_\textrm{Cd}+V_\textrm{EDTA}}\\
&=\dfrac{(5.00\times10^{-3}\textrm{ M})(\textrm{50.0 mL})}{\textrm{50.0 mL + 25.0 mL}}=3.33\times10^{-3}\textrm{ M}
\end{align}$$
$$K_\textrm f''=\dfrac{[\mathrm{CdY^{2-}}]}{C_\textrm{Cd}C_\textrm{EDTA}}=\dfrac{3.33\times10^{-3}-x}{(x)(x)}= 9.5\times10^{14}$$
$$x=C_\textrm{Cd}=1.9\times10^{-9}\textrm{ M}$$
توجه داشته باشید که در نقطه همارزی، تعداد مولهای $$Cd^{2+}$$ و EDTA با یکدیگر برابر هستند و غلظت کلی آنها نیز با یکدیگر برابر خواهد بود.
برای در نظر داشتن حضور آمونیاک بهصورت زیر عمل میکنیم.
$$[\mathrm{Cd^{2+}}]=\alpha_\mathrm{Cd^{2+}}\times C_\textrm{Cd}=(0.0881)(1.9\times10^{-9}\textrm{ M}) = 1.70\times10^{-10}\textrm{ M}$$
بنابراین مقدار $$pCd$$ در نقطه همارزی برابر با ۹٫۷۷ خواهد بود.
مرحله پنجم: محاسبه مقدار $$pM$$ بعد از نقطه همارزی به کمک ثابت تشکیل مشروط
بعد از نقط همارزی، مقدار EDTA مازاد است و میتوان غلظت کادمیوم را از تفکیک کمپلکس به دست آورد. برای این کار ابتدا غلظت کمپلکس و EDTA واکنشنداده را محاسبه میکنیم. برای مثال بعد از افزودن ۳۰ میلیلیتر از تیترانت خواهیم داشت.
$$\begin{align}
[\mathrm{CdY^{2-}}]&=\dfrac{\textrm{initial moles Cd}^{2+}}{\textrm{total volume}}=\dfrac{M_\textrm{Cd}V_\textrm{Cd}}{V_\textrm{Cd}+V_\textrm{EDTA}}\\
&=\dfrac{(5.00\times10^{-3}\textrm{ M})(\textrm{50.0 mL})}{\textrm{50.0 mL + 30.0 mL}}=3.13\times10^{-3}\textrm{ M}
\end{align}$$
$$\begin{align}
C_\textrm{EDTA}&=\dfrac{M_\textrm{EDTA}V_\textrm{EDTA}-M_\textrm{Cd}V_\textrm{Cd}}{V_\textrm{Cd}+V_\textrm{EDTA}}\\
&=\dfrac{\textrm{(0.0100 M)(30.0 mL)} - (5.00\times10^{-3}\textrm{ M})(\textrm{50.0 mL})}{\textrm{50.0 mL + 30.0 mL}}\\
&=6.25\times10^{-4}\textrm{ M}
\end{align}$$
$$\dfrac{[\mathrm{CdY^{2-}}]}{C_\textrm{Cd}C_\textrm{EDTA}} = \dfrac{3.13\times10^{-3}\textrm{ M}}{C_\textrm{Cd}(6.25\times10^{-4}\textrm{ M})} = 9.5\times10^{14}$$
$$C_\textrm{Cd}=5.4\times10^{-15}\textrm{ M}$$
$$[\mathrm{Cd^{2+}}] = \alpha_\mathrm{Cd^{2+}} \times C_\textrm{Cd} = (0.0881)(5.4\times10^{-15}\textrm{ M}) = 4.8\times10^{-16}\textrm{ M}$$
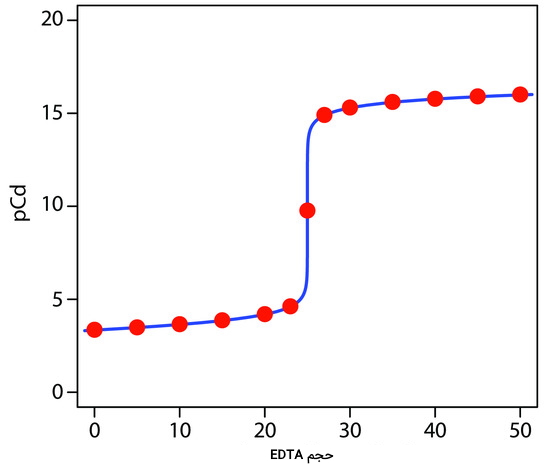
بنابراین مقدار $$pCd$$ برابر با ۱۵٫۳۲ خواهد بود. به کمک همین محاسبات تعدادی نقاط دیگر را نیز به دست آوردهایم که میتوان از آنها برای رسم منحنی تیتراسیون بهره گرفت.
| حجم EDTA بر حسب میلیلیتر | مقدار $$pCd$$ |
| ۰ | ۳٫۳۶ |
| ۵ | ۳٫۴۹ |
| ۱۰ | ۳٫۶۶ |
| ۱۵ | ۳٫۸۷ |
| ۲۰ | ۴٬۲ |
| ۲۳ | ۴٫۶۲ |
| ۲۷ | ۱۴٫۹۵ |
| ۳۰ | ۱۵٫۳۳ |
| ۳۵ | ۱۵٫۶۱ |
| ۴۰ | ۱۵٫۷۶ |
| ۴۵ | ۱۵٫۸۶ |
| ۵۰ | ۱۵٫۹۴ |
با توجه به نقاط محاسبه شده در جدول بالا، میتوان منحنی این تیتراسیون را بهصورت زیر رسم کرد. همانطور که مشاهده میکنید در نزدیکی نقطه همارزی شاهد جهش بزرگی هستیم.
مثال از انواع تیتراسیون کمپلکسومتری
نمونهای ۱۰۰ میلیلیتری از آب سخت را برای سنجش میزان سختی آن، به کمک ۲۳٫۶۳ میلیلیتر از EDTA با مولاریته ۰٫۰۱۰۹ تیتر میکنیم. میزان سختی این نمونه را برحسب میلیگرم بر لیتر کلسیم کربنات $$(CaCO_3)$$ گزارش دهید.
پاسخ
در آنالیز نمونههای آب برای سنجش میزان سختی، فرض میگیریم که نمونه تنها حاوی یون کلسیم است. یعنی تنها کمپلکسی که با EDTA تشکیل میشود، کمپلکس کلسیم-EDTA است. بنابراین میتوان برای یافتن جرم کلسیم در نمونه بهصورت زیر عمل کرد.
$$ \mathrm{\dfrac{0.0109\;mol\;EDTA}{L}\times0.02363\;L\times\dfrac{1\;mol\;Ca^{2+}}{mol\;EDTA}=2.58\times10^{-4}\;mol\;Ca^{2+}} $$
نسبت مولی کلسیم و کلسیم کربنات ۱:۱ است و میتوان جرم آن را به شکل زیر مورد محاسبه قرار داد.
$$ \mathrm{2.58\times10^{-4}\;mol\;Ca^{2+}\times\dfrac{1\;mol\;CaCO_3}{mol\;Ca^{2+}}\times\dfrac{100.09\;g\;CaCO_3}{mol\;CaCO_3}=0.0258\;g\;CaCO_3} $$
و به این طریق، سختی نمونه را از رابطه زیر به دست میآوریم.
$$ \mathrm{\dfrac{0.0258\;g\;CaCO_3}{0.1000\;L}\times\dfrac{1000\;mg}{g}=258\;mg\;CaCO_3/L} $$
تعیین نقطه پایانی تیتراسیون کمپلکسومتری
نقطه همارزی انواع تیتراسیون کمپلکسومتری زمانی اتفاق میافتد که مقادیر استوکیومتری برابری از آنالیت و تیترانت با یکدیگر وارد واکنش میشوند. مانند باقی تیتراسیونها برای به دست آوردن این نقطه از روشهای تجربی استفاده میکنیم. به طور عمده از دو روش زیر برای به دست آوردن این نقطه استفاده میشود.
- استفاده از شناساگر
- کنترل میزان جذب
در ادامه هر کدام از این روشها را مورد بررسی قرار خواهیم داد.
استفاده از شناساگر برای تعیین نقطه پایانی انواع تیتراسیون کمپلکسومتری
بسیاری از شناساگرهایی که در انواع تیتراسیون کمپلکسومتری به کار گرفته میشوند، با یونهای فلزی کمپلکسهای پایداری را تشکیل میدهند. این شناساگرها را با نام «شناساگر متالوکرومی» (Metallochromic Indicator) میشناسیم. این شناساگر، $$In^{m–}$$، به محلول آنالیت افزوده میشود و کمپلکسی پایدار را بهصورت $$MIn^{n–}$$ به وجود میآورد. با افزودن EDTA، ابتدا با یونهای فلزی آزاد وارد واکنش میشود و کمپلکس یون با EDTA را به وجود میآورد. سپس به سراغ کمپلکس یون فلزی-شناساگر میرود و با تخریب آن،خود جایگزین شناساگر میشود. این واکنش را میتوان بهصورت زیر نمایش داد.
$$\textrm{MIn}^{n-}+\textrm Y^{4-}\rightarrow\textrm{MY}^{2-}+\textrm{In}^{m-}$$
در این صورت اگر $$MIn^{n–}$$ و $$In^{m–}$$ دارای دو رنگ متفاوت باشند، تغییر رنگ اتفاق میافتد و اتمام واکنش تیتراسیون را نشان میدهد. در این صورت دقت نقطه پایانی شناساگر به استحکام کمپلکس یون با شناساگر بستگی دارد. اگر این کمپلکس بسیار مستحکم باشد، تغییر رنگ پس از نقطه همارزی اتفاق میافتد اما اگر کمپلکس بسیار ضعیف باشد، نقطه پایانی پیش از رسیدن به نقطه همارزی مشاهده میشود.
شناساگر تیتراسیون کمپلکسومتری
بیشتر شناساگرهای متالوکرومی اسیدهایی ضعیف هستند. در نتیجه ثابت تشکیل مشروط کمپلکس یون با شناساگر به مقدار $$pH$$ آنالیت بستگی دارد. از این مورد میتوان استفاده مطلوبی کرد زیرا با تنظیم مقدار $$pH$$، میزان استحکام این کمپلکس قابل کنترل است. از آنجایی که شناساگر خود اسیدی ضعیف است، رنگ شناساگر آزاد، با تغییر مقدار $$pH$$، تغییر خواهد کرد.
در تصویر زیر نموداری را مشاهده میکنید که مربوط به شناساگر «کالماژيت» (Calmagite) است و تغییرات $$pH$$ را در برابر $$pMg$$ نشان میدهد. گونههای مختلف آزاد این شناساگر بهصورتهای $$H_2In^–$$، $$HIn^{2–}$$ و $$In^{3–}$$ مشخص شدهاند. همچنین $$MgIn^–$$ نشاندهنده کمپلکس منیزیم با شناساگر کالماژیت است. از آنجا که رنگ کمپلکس یون-شناساگر قرمز است، استفاده از آن در بازه $$pH$$ بین ۸٫۵ تا ۱۱ ممکن خواهد بود زیرا در این بازه شناساگر واکنش نداده رنگی آبی خواهد داشت.
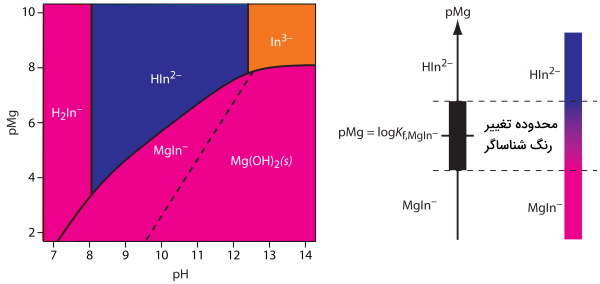
انواع شناساگر تیتراسیون کمپلکسومتری
در جدول زیر تعدادی از مهمترین و پرکاربردترین شناساگرهای مورد استفاده در انواع تیتراسیون کمپلکسومتری آورده شدهاند.
| شناساگر | محدود $$pH$$ | یونهای فلزی |
| کالماژيت | ۸٫۵ تا ۱۱ | کلسیم، منیزیم، باریم و روی |
| پن | ۲ تا ۱۱ | مس، کادمیوم و روی |
| اریوکروم بلک تی | ۷٫۵ تا ۱۰٫۵ | روی، باریم، منیزیم و کلسیم |
| اریوکروم بلک آر | ۸ تا ۱۲ | مس، روی، منیزیم و کلسیم |
| سالیسیلیک اسید | ۲ تا ۳ | آهن |
| مورکسید | ۶ تا ۱۳ | نیکل، مس و کلسیم |
در صورتی که برای تیتراسیونی، شناساگر مناسبی وجود نداشته باشد، در بسیاری موارد میتوان با افزودن مقدار کمی از کمپلکس EDTA با یونی دیگر، تیتراسیون را به انجام رساند. این کار را در صورتی میتوان انجام داد که کمپلکس یون دوم با شناساگر قویتر از کمپلکس یون اول با شناساگر و همچنین کمپلکس یون دوم با EDTA ضعیفتر از کمپلکس یون اول با EDTA باشد. برای درک بهتر این مورد، مثالی را مورد بررسی قرار میدهیم.
اگر در تیتراسیون کمپلکسومتری یون کلسیم با EDTA از شناساگر کالماژيت استفاده کنیم، نتیجه چندان رضایتبخش نخواهد بود. با افزودن مقداری از کمپلکس منیزیم-EDTA به آنالیت، نقطه پایانی با وضوح بیشتری به دست میآید. از آنجا که یون کلسیم کمپلکسی قویتر با EDTA تشکیل میدهد، جایگزین منیزیم میشود. در این صورت شاهد رنگ قرمز ناشی از تشکیل کمپلکس منیزیم-کالماژیت خواهیم بود. در نقطه پایانی تیتراسیون، EDTA جایگزین کالماژیت در کمپلکس آن با منیزیم میشود و رنگی آبی نشاندهنده آن است.
تعیین نقطه پایان تیتراسیون به کمک میزان جذب
در صورتی که اجزای تیتراسیون خود از پیش دارای رنگ باشند، استفاده از شناساگر برای تشخیص نقطه پایانی تیتراسیون بسیار مشکل خواهد بود. برای مثال برای تیتراسیون مس با EDTA، از آمونیاک برای تنظیم مقدار $$pH$$ محیط استفاده میشود. کمپلکس رنگی $$Cu(NH_3)_4^{2+}$$، رنگ شناساگر را مختل میکند و در این صورت تشخیص نقطه پایانی مشکل و همراه با خطا خواهد بود.
همچنین در مواردی که نمونه رنگی باشد، مانند خون، نیز نمیتوان از این روش استفاده کرد. در اینصورت اگر تنها یکی از اجرای تیتراسیون جاذب تابش الکترومغناطیسی باشد، میتوان برای پیبردن به نقطه همارزی از به تغییرات جذب در طول موجی مشخص دقت کرد. برای درک بهتر مثالی را از این مورد مورد بررسی قرار میدهیم.
برای تشخیص نقطه پایانی تیتراسیون $$Cu^{2+}$$ با EDTA در حضور آمونیاک، جذب آنالیت را در طول موج ۷۴۵ نانومتر مورد بررسی قرار میدهند. در این مثال، $$Cu(NH_3)_4^{2+}$$ جذب بالایی دارد. در ابتدای تیتراسیون میزان جذب در بیشترین مقدار خود است، با این حال با افزودن EDTA، واکنش زیر صورت میگیرد و باعث کاهش غلظت این کمپلکس میشود و به همین صورت میزان جذب نیز تا رسیدن به نقطه همارزی کاهش مییابد.
$$\mathrm{Cu(NH_3)_4^{2+}}(aq)+\textrm Y^{4-}(aq)\rightarrow\textrm{CuY}^{2-}(aq)+4\mathrm{NH_3}(aq)$$
بعد از نقطه همارزی، تغییرات جذب ۰ خواهد بود. به منحنی این تیتراسیون «منحنی تیتراسیون طیف نورسنجی» (Spectrophotometric Titration Curve) گفته میشود. توجه داشته باشید که در این نمودار، محور عمودی نشاندهنده میزان جذب تصحیح شده است که میتوان آن را بهصورت زیر به دست آورد.
$$A_\textrm{corr}=A\times\dfrac{V_\textrm{EDTA}+V_\textrm{Cu}}{V_\textrm{Cu}}$$
منحنی تیتراسیون کمپلکسومتری به کمک جذب، دارای خطوطی است که یکدیگر را قطع میکنند و میتوان از آنها برای یافتن نقطه پایانی انواع تیتراسیون استفاده کرد. در تصویر زیر ۶ حالت متفاوت از این تیتراسیونها را مشاهده میکنید.
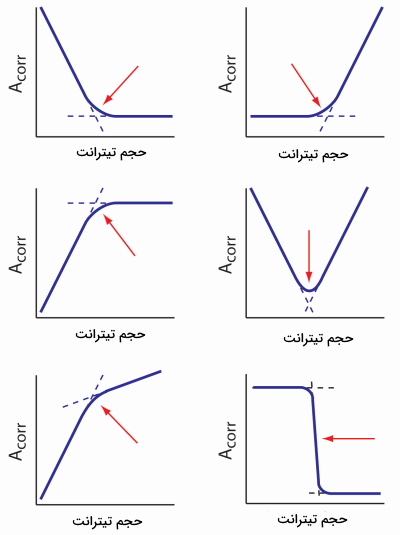
تیتراسیون کمپلکسومتری و سختی آب
آب سخت، دارای کاتیونهای محلول در آب است بهصورتی که میتوانند با صابون، تشکیل کمپلکسهای نامحلولی بدهند. گرچه تعداد زیادی از کاتیونها امکان حضور در آب را دارند، کلسیم و منیزیم از اهمیت بالاتری برخوردارند و اغلب منظور از سختی آب، وجود همین دو کاتیون است.
یکی از روشهایی که برای سنجش میزان سختی آب به کار میرود، استفاده از تیتراسیون کمپلکسومتری است. در این روش از EDTA به عنوان تیترانت استفاده و محیط به کمک بافر در مقدار $$pH$$ برابر با ۱۰ تنظیم میشود. همچنین از کالماژيت به عنوان شناساگر بهره میبرند و مقدار سختی با واحد میلیگرم کلسیم کربنات بر لیتر گزارش میشود.
نحوه انجام تیترسیون کمپلکسومتری برای تعیین سختی آب
برای انجام این تیتراسیون از مقدار کمی تیترانت، در حدود ۱۵ میلیلیتر استفاده میشود تا زمان مورد نیاز برای تکمیل آن کمتر از ۵ دقیقه باشد. در صورت نیاز میتوان نمونه را با آب مقطر به حجم ۵۰ میلیلیتر رساند. سپس مقدار $$pH$$ محیط را با افزودن ۱ یا ۲ میلیلیتر از بافری حاوی مقادیر اندکی $$Mg^{2+}-EDTA$$ روی ۱۰ تنظیم میکنیم. با افزودن شناساگر مناسب، تیتراسیون را تا تغییر رنگ از قرمز به آبی ادامه میدهیم. در ادامه برای درک بهتر روند این تیتراسیون چند نکته را بهصورت پرسش و پاسخ بیان خواهیم کرد.
سوال اول
دلیل تنظیم $$pH$$ روی مقدار ۱۰ چیست و در صورتی که مقدار آن بیشتر و کمتر باشد، با چه مشکلی مواجه میشویم؟
پاسخ
کاتیون منیزیم نسبت به باقی کاتیونهای دخیل در ایجاد سختی، ضعیفترین کمپلکس را با EDTA تشکیل میدهد و آخرین کاتیونی است که در تیتراسیون شرکت میکند. کالماژیت برای این تیتراسیون بسیار مفید است زیرا نقطه پایانی تیتراسیون منیزیم را به خوبی نشان میدهد. همچنین بازه $$pMg$$ که در آن شناساگر تغییر رنگ میدهد به خاطر ویژگیهای کالماژیت به مقدار $$pH$$ محیط بستگی دارد. در تصویر زیر منحنی تیتراسیون ۵۰ میلیلیتر محلول $$Mg^{2+}$$ با مولاریته $$10^{-3}$$ با EDTA در مقدار $$pH$$ برابر با ۹، ۱۰ و ۱۱ آورده شده است.
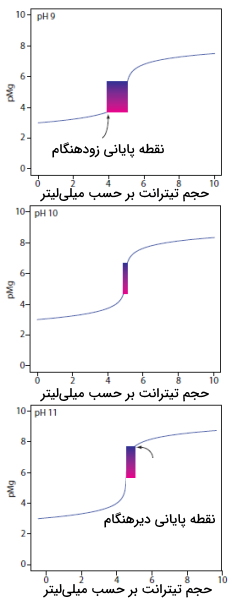
در مقدار $$pH$$ برابر با ۹، «نقطه پایانی زودهنگام» (Early End Point) خواهیم داشت و در محاسبات شاهد خطای منفی هستیم. همچنین در مقدار $$pH$$ برابر با ۱۱ نیز، «نقطه پایانی دیرهنگام» (Late End Point) و بنابراین خطای مثبت در انجام محاسبات خواهیم داشت.
سوال دوم
چرا مقدار اندکی از کمپلکس $$Mg^{2+}-EDTA$$ به بافر افزوده میشود؟
پاسخ
همانطور که میدانید، نقطه پایانی تیتراسیون به کمک شناساگر کالماژیت قابل پیگیری است. تغییر رنگ این شناساگر در تیتراسیون با منیزیم بسیار مناسب است اما در تیتراسیون با کلسیم نقطه پایانی مناسبی ندارد. در این صورت اگر نمونه اولیه دارای منیزم نباشد، تشخیص نقطه پایانی تیتراسیون بسیار مشکل خواهد بود و منجر به انجام محاسبات نادرست میشود.
افزودن مقدار کمی از کمپلکس منیزیم با EDTA ما را مطمئن میسازد که هر چند مقدار اندکی از این کاتیون در محیط واکنش حضور دارد. از آنجا که کمپکس کلسیم با EDTA نسبت به کمپلکس منیزیم با EDTA قویتر است، کلسیم جایگزین منیزیم میشود و منیزیم آزاد میشود و به شناساگر متصل میشود. این جایگزینی استوکیومتری مشخصی دارد و از این جهت غلظت کل یونهای دخیل در سختی آب، دستنخورده باقی میماند.
سوال سوم
تاکید برای انجام تیتراسیون در زمانی کمتر از ۵ دقیقه برای چیست؟
پاسخ
وقتی برای انجام واکنشی محدودیت زمانی در نظر گرفته میشود، واکنشی جانبی وجود دارد که میتواند به وقوع بپیوندد و ایجاد تداخل کند. در اینجا واکنش تشکیل کلسیم کربنات در مقدار $$pH$$ برابر با ۱۰ امکان وقوع دارد. در تصویر زیر چند حالت متفاوت در طول این تیتراسیون آورده شده است.

در ارلن شماره ۱ شاهد رنگی مایل به قرمز هستیم که ناشی از حضور کمپلکس منیزیم با شناساگر است. در ارلن شماره ۲، نقطه پایانی تیتراسیون را به رنگ بنفش مشاهده میکنیم. در نهایت نیز ارلن شماره ۲ با رنگ آبی، به دلیل حضور شناساگر واکنشنداده و آزاد به چشم میخورد.
تیتراسیون پتانسیومتری
تیتراسیون پتانسیومتری روشی مشابه با انواع تیتراسیون مستقیم دارد، با این تفاوت که در آن برای مشخص کردن نقطه همارزی تیتراسیون از شناساگر شیمیایی استفاده نمیشود. در این نوع از انواع تیتراسیون از یک الکترود به عنوان شناساگر استفاده میشود.
اجزای انواع تیتراسیون پتانسیومتری شامل یک سلول با «الکترود شاهد» (Refrence Electrode)، یک «پل نمکی» (Salt Bridge)، آنالیت و یک الکترود شناساگر میشوند. همچنین از الکترود نقره کلرید، کالومل و هیدروژن به عنوان الکترود مرجع استفاده میشود. الکترود شناساگر نیز شامل الکترود شیشه و یون فلز هستند.
نحوه انجام تیتراسیون پتانسیومتری
در این تیتراسیون با قرار گرفتن زوج الکتروها در محلول نمونه و آنالیت، اختلاف پتانسیلی مشاهده میشود و با افزودن قطرهقطره تیترانت به آنالیت، این اختلاف پتانسیل نیز تغییر میکند. توجه داشته باشید که الکترود مرجع الکترودی است که با غوطهور شدن در محلول نمونه، مقدار پتانسیل خود را حفظ میکند. همچنین الکترود شناساگر الکترودی است که به تغییر پتانسیل محلول آنالیت در گذر زمان حساس است. از پل نمکی نیز برای جلوگیری از تاثیر آنالیت روی الکترود مرجع استفاده میشود. بزرگترین مزیت انواع تیتراسیون پتانسیومتری این است که برای انجام آن به مقدار بسیار کمتری از مواد نیاز داریم و روشی مقرون بهصرفه به حساب میآید.
انواع تیتراسیون پتانسیومتری
انواع تیتراسیون پتانسیومتری بیشتر از اینکه روشی برای انجام تیتراسیون باشند، روشی برای شناسایی نقطه همارزی در تیتراسیون هستند. به این معنا که میتوان تیتراسیونهای کمپلکسومتری، اکسایشی و کاهش، رسوبی و ... را انجام داد و از این روش برای مشخص کردن نقطه پایانی بهره برد. در مواردی که استفاده از شناساگر شیمیایی رایج که فرا رسیدن نقطه پایانی را به کمک تغییر رنگ نشان میدهند، ناممکن باشد، میتوان از پتانسیومتری بهره برد.
محاسبات تیتراسیون پتانسیومتری
پتانسیل سلول تیتراسیون پتانسیومتری که متشکل از دو نیم سلول است را میتوان بهصورت زیر به دست آورد.
$$E_{cell} = E_{ind} – E_{ref} + E_j$$
- $$E_{cell}$$: پتانسیل سلول
- $$E_{ind}$$: پتانسیل الکترود شناساگر
- $$E_{ref}$$: پتانسیل الکترود مرجع
- $$E_j$$: افت پتانسیل در پل نمکی
در واقع پتانسیل سلول به غلظت یونهایی که در تماس با الکترود شناساگر هستند، بستگی دارد. در واقع بهصورت عملی پتانسیل سلول با افزودن هر مقدار از تیترانت محاسبه میشود و روند این تغییرات پتانسیل مورد بررسی قرار میگیرد.
کاربرد انواع تیتراسیون پتانسیومتری
از انواع تیتراسیون پتانسیومتری به دلیل شریط ویژهای که دارد در بسیاری موارد میتوان استفاده بهسزایی کرد. در این بخش میخواهیم به بررسی تعدادی از کاربردهای این روش تیتراسیونی بپردازیم.
- در شیمی بالینی برای آنالیز فلزها به کار میرود.
- از تیتراسیون پتانسیومتری برای آنالیز سیانید و آمونیاک موجود در آب و فاضلاب استفاده میشود.
- در صنعت کشاورزی از این روش برای شناسایی عناصر در خاک و کود بهره میبرند.
- در صنعت تولید شویندهها روش پرکاربردی است.
در ادامه برخی مواردی که در تیتراسیون پتانسیومتری در هر روش مورد سنجش قرار میگیرند را مشاهده میکنید.
شیمی بالینی
استفاده از انواع تیتراسیون پتانسیومتری در شیمی بالینی گستردگی فراوانی دارد و برای اندازهگیری موراد زیر به کار میرود.
شیمی محیط زیست
در این علم برای اندازهگیری موارد زیر در آب و فاضلاب از روش تیتراسیون پتانسیومتری بهره برده میشود.
- $$CN^-$$
- $$NO_3$$
- $$F_3$$
- $$NH_3$$
کشاورزی
در علم کشاورزی برای اندازهگیری ترکیبات موجود در خاک و کود از تیتراسیون پتانسیومتری استفاده میشود.
- $$NO_3$$
- $$NH_4$$
- $$I$$
- $$Ca$$
- $$K$$
- $$CN$$
تیتراسیون غیر مستقیم یا برگشتی چیست ؟
در تیتراسیون غیرمستقیم، به دلایلی امکان اندازهگیری مستقیم آنالیت توسط تیترانت وجود ندارد. در این صورت تیتراسیون در دو مرحله صورت میگیرد، در مرحله اول مقدار مازادی از تیترانت به محتویات آنالیت افزوده میشود، بهصورتی که واکنش بین تیترانت و آنالیت کامل میشود و همچنان مقداری از آنالیت در محیط آزاد است.
سپس این مقدار مازاد را خود به عنوان یک آنالیت در نظر میگیرند و آن را به کمک تیترانتی مناسب تا رسیدن به نقطه هم ارزی تیتر میکنند. برای انجام محاسبات نیز مقدار مازاد تیترانت را از مقدار اولیه کم میکنند.
در لیست زیر تعدادی از دلایلی که باعث میشود از تیتراسیون غیر مستقیم به جای تیتراسیونهای معمول مستقیم استفاده شود، را آوردهایم.
- فرار بودن یکی از اجزای واکنش
- در تیتراسیون اسید و باز، ممکن است نمک اسید و بازی نامحلول باشد. از این مورد میتوان به کلسیم کربنات اشاره کرد.
- واکنشی در تیتراسیون وجود دارد که کند است.
- در تیتراسیون اسید ضعیف با باز ضعیف، مشاهده نقطه پایانی تیتراسیون به سختی ممکن خواهد بود و استفاده از روش تیتراسیون غیرمستقیم کاربردی است.
مثال تیتراسیون برگشتی
مقدار آسکوربیک اسید $$(C_6H_8O_6)$$ موجود در آب پرتقال را با اکسید کردن آن به کمک $$I_3^-$$ و تبدیل آن به دهیدرو آسکوربیک اسید با فرمول شیمیایی $$C_6H_6O_6$$ اندازهگیری میکنند. در این تیتراسیون برگشتی، مقدار مازاد $$I_3^-$$ را به کمک $$Na_2S_2O_3$$ تیتر میکنند. ابتدا به نمونهای ۵ میلیلیتری از آب پرتقال، ۵۰ میلیلیتر از $$I_3^-$$ با مولاریته ۰٫۰۱۰۲۳ افزوده میشود. بعد از اتمام فرآیند اکسیداسیون، ۱۳٫۸۲ میلیلیتر از $$Na_2S_2O_3$$ با مولاریته ۰٫۰۷۲۰۳ برای رسیدن به نقطه همارزی تیتراسیون برگشتی در حضور شناساگر نشاسته مورد نیاز است. غلظت آسکوربیک اسید را به دست آورید.
پاسخ
برای انجام محاسبات مربوط به نواع تیتراسیون برگشتی، نیاز داریم که استوکیومتری بین $$I_3^-$$ و آنالیت $$C_6H_8O_6$$ و بین $$I_3^-$$ و تیترانت $$Na_2S_2O_3$$ را در دست داشته باشیم. واکنش موازنه شده اجزا را میتوان بهصورت زیر نوشت.
$$\mathrm{C_6H_8O_6}(aq)+{I_3^-}(aq)\rightarrow \mathrm{3I^-}(aq)+\mathrm{C_6H_6O_6}(aq)+\mathrm{2H^+}(aq) $$
$${I_3^-}(aq)+\mathrm{2S_2O_3^{2-}}(aq)\rightarrow \mathrm{S_4O_6^{2-}}(aq)+\mathrm{3I^-}(aq) $$
با توجه به واکنشهای بالا، کاهش $$I_3^-$$ نیازمند ۲ الکترون است بنابراین هر ۱ مول از آسکوربیک اسید، ۱ مول از $$I_3^-$$ را مصرف میکند.
میتوان تعداد مولهای مورد استفاده در واکنش با $$C_6H_8O_6$$ و $$Na_2S_2O_3$$ را بهصورت زیر محاسبه کرد.
مقدار مول مورد استفاده در تیتراسیون برگشتی را نیز میتوان به این روش به دست آورد.
$$\mathrm{0.01382\;L\;Na_2S_2O_3\times\dfrac{0.07203\;mol\;Na_2S_2O_3}{L\;Na_2S_2O_3}\times\dfrac{1\;mol\;{I_3^-}}{2\;mol\;Na_2S_2O_3}=4.977\times10^{-4}\;mol\;{I_3^-}} $$
دو مقدار به دست آمده در بالا را از یکدیگر کم میکنیم تا مقدار مولهای وارد واکنش شده با آسکوربیک اسید را داشته باشیم.
$$\mathrm{5.115\times10^{-4}\;mol\;{I_3^-} - 4.977\times10^{-4}\;mol\;{I_3^-}=1.38\times10^{-5}\;mol\;{I_3^-}} $$
بنابراین مقدار آسکوربیک اسید موجود در یک نمونه ۵ میلیلیتری برابر است با:
$$\mathrm{1.38\times10^{-5}\;mol\;{I_3^-}\times\dfrac{1\;mol\;C_6H_8O_6}{mol\;{I_3^-}}\times\dfrac{176.13\;g\;C_6H_8O_6}{mol\;C_6H_8O_6}=2.43\times10^{-3}\;g\;C_6H_8O_6}$$
در این صورت مقدار آسکوربیک اسید موجود در یک نمونه ۱۰۰ میلیلیتری برابر با ۴۸٫۶ میلیگرم است.
تفاوت تیتراسیون مستقیم و غیرمستقیم
در بخش پیشین، در مورد انواع تیتراسیون غیرمستقیم صحبت کردیم. حال در این بخش از این مطلب مجله فرادرس میخواهیم به تفاوتهای این روش با روش تیتراسیون مستقیم، بپردازیم. در لیست زیر میتوانید این تفاوتها را بهصورت کوتاه و خلاصه مشاهده کنید.
- تیتراسیون مستقیم واکنشی بین تیترانت با غلظت معلوم و آنالیت با غلظت مجهول است اما در تیتراسیون غیرمستقیم، با تیتر کردن مقدار مازاد تیترانت که به محیط وارد شده است، به غلظت آنالیت پی برده میشود.
- در تیتراسیون مستقیم تنها یک واکنش شیمیایی صورت میگیرد اما در هر تیتراسیون غیرمستقیم، پای دو واکنش شیمیایی در میان است.
- در تیتراسیون مستقیم تنها یک ترکیب با غلظت معلوم حضور دارد اما در تیتراسیون غیرمستقیم دو ترکیب با غلظت معلوم حضور دارند.
- از تیتراسیون مستقیم زمانی استفاده میشود که بتوان به نقطه پایانی آن به راحتی دست پیدا کرد. همچنین از تیتراسیون غیرمستقیم در مواردی استفاده میشود که در نقطه پایانی واکنش شاهد تغییر رنگی بسیار واضح باشیم.
تیتراسیون رسوبی
«تیتراسیون رسوبی» (Precipitation Titration) روشی است که در آن واکنش بین آنالیت و تیترانت منجر به تولید رسوبی نامحلول میشود. یکی از اولین تیتراسیونهای رسوبی انجام شده در طول تاریخ، تیتراسیون $$K_2CO_3$$ و $$K_2SO_4$$ به کمک «پتاس» (Potash) است.
در این تیتراسیون از کلسیم نیترات با فرمول شیمیایی $$Ca(NO_3)_2$$ به عنوان تیترانت استفاده میشود و رسوب حاصل بهصورت $$CaCO_3$$ و $$CaSO_4$$ خواهد بود. در نقطه پایانی این تیتراسیون با افزودن تیترانت بیشتر، مقدار رسوب حاصل تغییری نخواهد کرد. با این حال اهمیت این روش تیتراسیونی در قرن ۱۹ام، در اندازهگیری $$Ag^+$$ و یونهای هالید درک شد.
محاسبات تیتراسیون رسوبی
در این بخش میخواهیم با بررسی یک مثال، محاسبات مربوط به یک تیتراسیون رسوبی را انجام دهیم. در این تیتراسیون ۵۰ میلیلیتر از سدیم کلرید ۰٫۰۵ مولار با $$AgNO_3$$ با مولاریته ۰٫۱ تیتر شده است، واکنش این تیتراسیون را میتوان بهصورت زیر یادداشت کرد.
$$\mathrm{Ag}^+(aq)+\mathrm{Cl}^-(aq)\rightleftharpoons \mathrm{AgCl}(s)$$
از آنجا که مقدار ثابت تعادل واکنش بسیار بزرگ است، فرض میگیریم که واکنش بین یون نقره و کلرید کامل خواهد شد.
$$K=(K_\textrm{sp})^{-1}=(1.8\times10^{-10})^{-1}=5.6\times10^9$$
برای انجام محاسبات لازم در این تیتراسیون، باید مراحل زیر را طی کنیم.
مرحله اول: محاسبه حجم $$AgNO_3$$ مورد نیاز برای رسیدن به نقطه همارزی
در ابتدا نیاز داریم بدانیم چه مقدار از $$Ag^+$$ برای رسیدن به نقطه همارزی مورد نیاز است. با توجه به استوکیومتری واکنش میتوانیم اینطور بنویسیم:
$$\mathrm{moles\;Ag^+=moles\;Cl^-}$$
$$M_\textrm{Ag}\times V_\textrm{Ag}=M_\textrm{Cl}\times V_\textrm{Cl}$$
با حل این رابطه، حجم را بهصورت زیر به دست میآوریم.
$$ V_\textrm{eq}=V_\textrm{Ag}=\dfrac{M_\textrm{Cl}V_\textrm{Cl}}{M_\textrm{Ag}}=\dfrac{\textrm{(0.0500 M)(50.0 mL)}}{\textrm{(0.100 M)}}=\textrm{25.0 mL} $$
بنابراین تا رسیدن به نقطه همارزی به ۲۵ میلیلیتر از $$Ag^+$$ نیاز داریم.
مرحله دوم: محاسبه مقدار $$pCl$$ پیش از نقطه همارزی با یافتن غلظت سدیم کلرید واکنشنداده
پیش از نقطه همارزی، مقدار آنالیت $$Cl^-$$ مازاد است. غلظت آنالیت واکنشنداده بعد از افزودن ۱۰ میلیلیتر از $$Ag^+$$ به روش زیر به دست میآید.
$$\begin{align}
[\textrm{Cl}^-]&=\dfrac{\textrm{initial moles Cl}^- - \textrm{moles Ag}^+\textrm{ added}}{\textrm{total volume}}=\dfrac{M_\textrm{Cl}V_\textrm{Cl}-M_\textrm{Ag}V_\textrm{Ag}}{V_\textrm{Cl}+V_\textrm{Ag}}\\
&=\mathrm{\dfrac{(0.0500\;M)(50.0\;mL)-(0.100\;M)(10.0\;mL)}{50.0\;mL+10.0\;mL}=2.50\times10^{-2}\;M}
\end{align} $$
بنابراین مقدار $$pCl$$ برابر با ۱٫۶ خواهد بود.
مرحله سوم: محاسبه مقدار $$pCl$$ در نقطه همارزی به کمک $$K_{sp}$$ رسوب نقره کلرید
میدانیم که در نقطه همارزی تیتراسیون، غلظت $$Ag^+$$ و $$Cl^-$$ با یکدیگر برابر است. برای محاسبه غلظت $$Cl^-$$ از رابطه «ثابت حاصلضرب انحلالپذیری» (Solubility Equilibrium) استفاده میکنیم.
$$K_\textrm{sp}=\mathrm{[Ag^+][Cl^-]}=(x)(x)=1.8\times10^{-10}$$
با حل این معادله، غلظت $$Cl^-$$ برابر با $$۱٫۳\times۱۰^{-۵}$$ و همچنین مقدار $$pCl$$ برابر با ۴٫۸۹ خواهد بود.
مرحله چهارم: محاسبه مقدار $$pCl$$ بعد از نقطه همارزی
برای این کار ابتدا غلظت مقدار مازاد نقره نیترات را محاسبه میکنیم و سپس به کمک $$K_{sp}$$ غلظت $$Cl^-$$ را به دست میآوریم.
$$ \begin{align}
[\textrm{Ag}^+]&=\dfrac{\textrm{moles Ag}^+\textrm{ added}-\textrm{initial moles Cl}^-}{\textrm{total volume}}=\dfrac{M_\textrm{Ag}V_\textrm{Ag}-M_\textrm{Cl}V_\textrm{Cl}}{V_\textrm{Cl}+V_\textrm{Ag}}\\
&=\dfrac{\textrm{(0.100 M)(35.0 mL)}-\textrm{(0.0500 M)(50.0 mL)}}{\textrm{50.0 mL + 35.0 mL}}=1.18\times10^{-2}\textrm{ M}
\end{align} $$
$$ [\textrm{Cl}^-]=\dfrac{K_\textrm{sp}}{[\textrm{Ag}^+]}=\dfrac{1.8\times10^{-10}}{1.18\times10^{-2}}=1.5\times10^{-8}\textrm{ M} $$
در این صورت مقدار $$pCl$$ برابر با ۷٫۸۱ است. در جدول زیر تعداد نقاط بیشتری را به روش محاسبات بالا به دست آوردهایم و میخواهیم به کمک آنها منحنی تیتراسیون را رسم کنیم.
| حجم $$AgNO_3$$ بر حسب میلیلیتر | مقدار $$pCl$$ |
| ۰ | ۱٫۳ |
| ۵ | ۱٫۴۴ |
| ۱۰ | ۱٫۶ |
| ۱۵ | ۱٫۸۱ |
| ۲۰ | ۲٫۱۵ |
| ۲۵ | ۴٫۸۹ |
| ۳۰ | ۷٫۵۴ |
| ۳۵ | ۷٫۸۲ |
| ۴۰ | ۷٫۹۷ |
| ۴۵ | ۸٫۰۷ |
| ۵۰ | ۸٫۱۴ |
با استفاده از نقاط به دست آمده، منحنی این تیتراسیون رسوبی را میتوان بهصورت زیر رسم کرد. هر نقطه با یک دایره قرمز مشخص شده است.
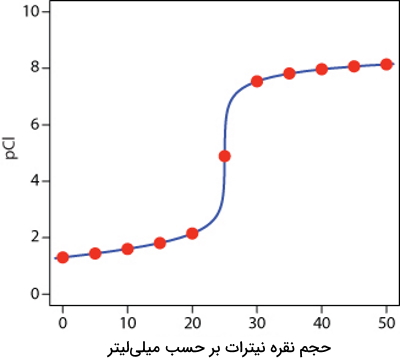
توجه داشته باشید که برای انجام محاسبات میتوان تغییر در غلظت آنالیت یا تیترانت را مد نظر قرار داد.
رسم منحنی تیتراسیون رسوبی
برای سنجش رابطه بین نقطه همارزی انواع تیتراسیون با نقطه پایانی آن، باید منحنی تیتراسیون آن را رسم کنیم. در این بخش میخواهیم رسم این منحنی را بررسی کنیم. برای مثال، تیتراسیون ۵۰ میلیلیتر سدیم کلرید ۰٫۰۵ مولار را با نقره نیترات ۰٫۱ مولار، مورد مطالعه قرار میدهیم. توجه داشته باشید که نحوه محاسبات همین تیتراسیون در بخش قبلی بررسی شده است و در اینجا تکرار نخواهد شد.
در ابتدا باید حجم تیترانت مورد استفاده تا نقطه همارزی را پیدا کنیم که در بخش قبلی برابر با ۲۵ میلیلیتر به دست آمده است. سپس دو محور افقی و عمودی را بهصورتی رسم میکنیم که یکدیگر را قطع کنند. محور عمودی نشاندهنده مقدار $$pCl$$ و محور افقی نشاندهنده حجم افزوده شده از تیترانت است. برای به دست آوردن نقطه همارزی، تنها کافیست از حجم ۲۵ میلیلیتر در محور افقی، خطی عمودی به بالا رسم کنیم. این مورد را میتوانیم در نمودار شماره ۱ آورده شده در زیر، مشاهده کنید.
پیش از نقطه همارزی مقدار $$Cl^-$$ مازاد است و میتوان $$pCl$$ را از غلظت $$Cl^-$$ واکنش نداده به دست آورد. با مراجعه به جدول بالا به این مقادیر دسترسی خواهید داشت. در نمودار ۲، دو نقطه مربوط به حجم ۱۰ و ۲۰ میلیلیتر از تیترانت با دایرههای قرمز نشان داده شدهاند.
بعد از نقطه همارزی، مقدار $$Ag^+$$ مازاد است و غلظت $$Cl^-$$ را از ثابت خاصلضرب انحلالپذیری نقره کلرید به دست میآوریم. در نمودار ۳، دو نقطه مربوط به حجم ۳۰ و ۴۰ میلیلیتر از تیترانت با دایرههای قرمز نشان داده شدهاند. در مرحله بعد باید دو نقطه مربوط به پیش از همارزی و دو نقطه مربوط به پس از همارزی را با یک خط راست به یکدیگر متصل کنیم. این را میتوانید در نمودار ۴ مشاهده کنید.
در دو مرحله بعد، خطوط رسم شده را با یک منحنی به یکدیگر وصل میکنیم. در این صورت توانستهایم محاسبات لازم را انجام دهیم و منحنی تیتراسیون را بهدرستی رسم کنیم.
مثال از تیتراسیون رسوبی
در یک تیتراسیون ۵۰ میلیلیتر از نقره نیترات ۰٫۰۵ مولار و سدیم کلرید ۰٫۱ مولار حضور دارند. محاسبات را با مد نظر قرار دادن آنالیت و تیترانت انجام دهید. یعنی نقاطی را در نمودار $$pAg$$ و $$pCl_4$$ در برابر $$V_{NaCl}$$ بیابید.
پاسخ
در ابتدا باید حجم سدیم کلرید مورد نیاز برای رسیدن به نقطه همارزی را بیابیم. این کار را بهصورت زیر انجام میدهیم.
$$ V_\textrm{eq}=V_\textrm{NaCl}=\dfrac{M_\textrm{Ag}V_\textrm{Ag}}{M_\textrm{NaCl}}=\mathrm{\dfrac{(0.0500\;M)(50.0\;mL)}{(0.100\;M)}=25.0\;mL} $$
پیش از نقطه همارزی مقدار آنالیت $$Ag^+$$ مازاد است. غلظت $$Ag^+$$ واکنشنداده را بعد از افزودن ۱۰ میلیلیتر از سدیم کلرید بهصورت زیر به دست میآوریم.
$$ \mathrm{[Ag^+]=\dfrac{(0.0500\;M)(50.0\;mL)-(0.100\;M)(10.0\;mL)}{50.0\;mL+10.0\;mL}=2.50\times10^{-2}\;M} $$
بنابراین مقدار $$pAg$$ برابر با ۱٫۶ خواهد بود. همچنین برای محاسبه غلظت $$Cl^-$$ از ثابت حاصلضرب نقره کلرید استفاده میکنیم.
$$ [\mathrm{Cl^-}]=\dfrac{K_\textrm{sp}}{[\mathrm{Ag^+}]}=\dfrac{1.8\times10^{-10}}{2.50\times10^{-2}}=7.2\times10^{-9}\textrm{ M} $$
بنابراین مقدار $$pCl$$ برابر با ۸٫۱۴ است.
میدانیم که در نقطه همارزی تیتراسیون غلظت گونه $$Ag^+$$ و $$Cl^-$$ با یکدیگر برابر است. برای انجام محاسبات لازم از رابطه زیر کمک میگیریم.
$$ K_\textrm{sp}=\mathrm{[Ag^+][Cl^-]}=(x)(x)=1.8\times10^{-10} $$
با حل این رابطه غلظت $$Ag^+$$ و $$Cl^-$$ برابر با $$ ۱٫۳\times۱۰^{-۵} $$ و مقدار $$pAg$$ و $$pCl$$ نیز ۴٫۸۹ به دست میآید.
بعد از نقطه همارزی، این بار تیترانت بهصورت مازاد حضور دارد. بعد از افزودن ۳۵ میلیلیتر از آن خواهیم داشت:
$$\mathrm{[Cl^-]=\dfrac{(0.100\;M)(35.0\;mL)-(0.0500\;M)(50.0\;mL)}{50.0\;mL+35.0\;mL}=1.18\times10^{-2}\;M}$$
در این صورت مقدار $$pCl$$ برابر با ۱٫۹۳ میشود. برای یافتن غلظت $$Ag^+$$ از ثابت حاصلضرب انحلالپذیری نقره کلرید استفاده میکنیم.
$$ [\mathrm{Ag^+}]=\dfrac{K_\textrm{sp}}{[\mathrm{Cl^-}]}=\dfrac{1.8\times10^{-10}}{1.18\times10^{-2}}=1.5\times10^{-8}\textrm{ M} $$
همچنین مقدار $$pAg$$ برابر با ۷٫۸۲ میشود. به کمک همین روش میتوانیم نقاط بیشتری را پیدا کنیم و از آنها برای رسم نمودار تیتراسیون کمک بگیریم. در جدول زیر تعدادی از این نقاط محاسبه و آورده شدهاند.
| حجم سدیم کلرید بر حسب میلیلیتر | مقدار $$pAg$$ | مقدار $$pCl$$ |
| ۰ | ۱٫۳ | - |
| ۵ | ۱٫۴۴ | ۸٫۳۱ |
| ۱۰ | ۱٫۶ | ۸٫۱۴ |
| ۱۵ | ۱٫۸۱ | ۷٫۹۳ |
| ۲۰ | ۲٫۱۵ | ۷٫۶ |
| ۲۵ | ۴٫۸۹ | ۴٫۸۹ |
| ۳۰ | ۷٫۵۴ | ۲٫۲ |
| ۳۵ | ۷٫۸۲ | ۱٫۹۳ |
| ۴۰ | ۷٫۹۷ | ۱٫۷۸ |
| ۴۵ | ۸٫۰۷ | ۱٫۶۸ |
| ۵۰ | ۸٫۱۴ | ۱٫۶ |
همانطور که مشاهده میکنید با پیشروی تیتراسیون از غلظت $$Ag^+$$ کم و به غلظت $$Cl^-$$ افزوده میشود و این تغییر در نزدیکی نقطه همارزی بسیار شدیدتر و واضحتر است.
شناساگر تیتراسیون رسوبی
برای تیتراسیونهای رسوبی ۳ نوع شناساگر موجود است که همه در نزدیکی نقطه همارزی از خود تغییر رنگی را بروز میدهند. در ادامه این بخش میخواهیم به این سه، اشارهای داشته باشیم.
روش مور
این روش در سال ۱۸۵۵ توسط «کارل فردریش مور» (Karl Friedrich Mohr) معرفی شد. در این روش آنالیت $$Cl^-$$ توسط نقره نیترات، تیتر میشود. همچنین مقدار کمی از پتاسیم دیکرومات نیز به محلول آنالیت افزوده میشود. نقطه پایانی تیتراسیون با مشاهده تشکیل رسوب قرمز مایل به قهوهای $$Ag_2CrO_4$$ استناد میشود. از آنجایی که $$CrO_4^{2-}$$ به محلول رنگی زرد میدهد، باعث کدر شدن نقطه پایانی میشود و به همین دلیل به مقدار بسیار کمی افزوده میشود. در نتیجه نقطه پایانی تیتراسیون همیشه دیرتر از نقطه همارزی اتفاق میافتد.
برای جبران این مقدار خطا، همیشه محلولی شاهد که عاری از آنالیت است، جداگانه مورد تیتراسیون قرار میگیرد و مقدار به دست آمده از آن، در محاسبات در نظر گرفته میشود.از آنجا که $$CrO_4^{2-}$$ بازی ضعیف است، محیط تیتراسیون اندکی قلیایی میشود. اگر مقدار $$pH$$ خیلی اسیدی باشد، کرومات به فرم $$HCrO_4^-$$ در میآید و نقطه پایانی تیتراسیون به تاخیر میافتد. همچنین باید دقت داشته باشیم که مقدار $$pH$$ کمتر از ۱۰ باشد تا از تشکیل رسوب نقره هیدروکسید جلوگیری شود.
روش ولهارد
روش ولهار اولین بار در سال ۱۸۷۴ توسط «جیکوب ولهارد» (Jacob Volhard) معرفی شد. در این روش آنالیت $$Ag^+$$ با استفاده از $$KSCN$$ تیتر میشود. همچنین مقدار اندکی از $$Fe^{3+}$$ نیز به آنالیت افزوده میشود. نقطه پایانی تیتراسیون زمانی است که کمپلکس قهوهای رنگ $$Fe(SCN)^{2+}$$ تشکیل میشود. این تیتراسیون باید در محیطی اسیدی انجام شود تا از تشکیل رسوب $$Fe(OH)_3$$ پیشگیری شود.
روش فاجانس
این روش نخستین بار در سال ۱۹۲۰ توسط «کازیمیر فاجانس» (Kasimir Fajans) معرفی شد. در این روش آنالیت $$Cl^-$$ توسط نقره مورد تیتراسیون قرار میگیرد و به محلول آنالیت، رنگدانه آنیونی «دی کلرو فلورسین» (Dichlorofluoroscein) افزوده میشود. پیش از نقطه همارزی، رسوب نقره کلرید به دلیل جذب $$Cl^-$$ مازاد، بار سطحی منفی دارد. از آنجا که دی کلرو فلورسین نیز دارای بار منفی است، توسط رسوب دفع میشود و در محلول به رنگ سبز-زرد باقی میماند. بعد از نقطه همارزی، سطح رسوب دارای بار سطحی مثبت است زیرا مقدار $$Ag^+$$ مازاد است. در این مرحله دی کلرو فلورسین جذب سطح رسوب میشود و رنگ صورتی دارد. این تغییر رنگ شناساگر نشانهای از رسیدن به نقطه پایانی واکنش است.
مثال و حل تمرین از انواع تیتراسیون
حال که در این مطلب از مجله فرادرس با انواع تیتراسیون و روشهای متدوال آن آشنا شدیم، در ادامه میخواهیم به بررسی تعدادی مثال و تمرین بپردازیم و از این طریق درک خود را عمق ببخشیم.
مثال از انواع تیتراسیون
در این بخش مثالهای متعددی را به همراه پاسخ تشریحی، مورد مطالعه قرار میدهیم. با دقت به پاسخهای تشریحی میتوانید به سوالهای مشابه در مورد انواع تیتراسیون، پاسخگو باشید.
مثال اول
مخلوطی از $$KCl$$ و $$NaBr$$ به روش مور، آنالیز میشوند. نمونهای حاوی ۰٫۳۱۷۲ گرم از آن را در ۵۰ میلیلیتر آب حل میکنیم و با $$Ag_2CrO)4$$ تا رسیدن به نقطه همارزی، تیتر میکنیم. تا رسیدن به این نقطه ۳۶٫۸۵ میلیلیتر از $$AgNO_3$$ با مولاریته ۰٫۱۱۲ مصرف میشود. تیتراسیون محلول «شاهد» (Blank)، نیازمند ۰٫۷۱ میلیلیتر از تیترانت برای رسیدن به نقطه همارزی است. مقدار درصد جرمی $$KCl$$ را در نمونه حساب کنید.
پاسخ
برای یافتن مولهای تیترانتی که با آنالیت وارد واکنش میشوند، ابتدا تصحیح زیر را به کمک محلول شاهد انجام میدهیم.
$$ V_\textrm{Ag}=\textrm{36.85 mL}-\textrm{0.71 mL = 36.14 mL} $$
$$ (\textrm{0.1120 M AgNO}_3)\times(\textrm{0.03614 L AgNO}_3) = 4.048\times10^{-3}\textrm{ mol AgNO}_3 $$
انجام تیتراسیون با نقره نیترات منجر به تولید دو رسوب نقره کلرید و نقره برمید میشود. در تولید این رسوبها، هر ۱ مول پتاسیم کلرید و هر ۱ مول سدیم برمید، ۱ مول از نقره نیترات را مصرف میکنند و در نتیجه رابطه زیر صادق خواهد بود.
$$ \textrm{moles KCl + moles NaBr}=4.048\times10^{-3} $$
میخواهیم در مرحله بعد جرم پتاسیم کلرید را محاسبه کنیم. بنابراین رابطه را بر مبنای جرم مینویسیم.
$$ \textrm{moles KCl}=\dfrac{\textrm{g KCl}}{\textrm{74.551 g KCl/mol KCl}} $$
$$ \textrm{moles NaBr}=\dfrac{\textrm{g NaBr}}{\textrm{102.89 g NaBr/mol NaBr}} $$
در این مرحله باید آنها را در معادله بالایی جایگزین کنیم و نتیجه بهصورت زیر خواهد بود.
$$ \dfrac{\textrm{g KCl}}{\textrm{74.551 g KCl/mol KCl}}+\dfrac{\textrm{g NaBr}}{\textrm{102.89 g NaBr/mol NaBr}}=4.048\times10^{-3} $$
از آنجا که در این معادله دو مجهول وجود دارد، گرم پتاسیم کلرید و گرم سدیم برمید، به معادله دیگری نیز نیاز داریم. این معادله را میتوانیم با توجه به این نکته که نمونه اولیه، تنها شامل پتاسیم کلرید و سدیم برمید است، بهصورت زیر یادداشت کنیم.
$$ \textrm{g NaBr = 0.3172 g} - \textrm{g KCl} $$
$$ \dfrac{\textrm{g KCl}}{\textrm{74.551 g KCl/mol KCl}}+\dfrac{\textrm{0.3172 g}-\textrm{g KCl}}{\textrm{102.89 g NaBr/mol NaBr}}=4.048\times10^{-3} $$
$$ 1.341\times10^{-2}(\textrm{g KCl})+3.083\times10^{-3}-9.719\times10^{-3}(\textrm{g KCl}) = 4.048\times10^{-3} $$
$$ 3.69\times10^{-3}(\textrm{g KCl})=9.65\times10^{-4} $$
در نهایت نیز میتوانیم درصد جرمی پتاسیم کلرید را بهصورت زیر محاسبه کنیم.
$$ \dfrac{\textrm{0.262 g KCl}}{\textrm{0.3172 g sample}}\times100=\textrm{82.6% w/w KCl} $$
مثال دوم
درصد جرمی $$I^-$$در نمونهای ۰٫۶۷۱۲ گرمی به روش تیتراسیون ولهارد مورد محاسبه قرار گرفته است. بعد از افزودن ۵۰ میلیلیتر از نقره نیترات ۰٫۰۵۶۱۹ مولار و تشکیل رسوب، نقره باقیمانده توسط $$KSCN$$ با مولاریته ۰٫۰۵۳۲۲ مورد تیتراسیون برگشتی قرار میگیرد و تا رسیدن به نقطه همارزی ۳۵٫۱۴ میلیلیتر از تیترانت مورد استفاده قرار میگیرد. مقدار درصد جرمی $$I^-$$ را گزارش کنید.
پاسخ
در این تیتراسیون دو رسوب به وجود میآید. رسوب نقره یدید حاصل از $$I^-$$ و نقره نیترات و رسوب $$AgSCN$$ حاصل از نقره نیترات و $$KSCN$$. هر مول $$I^-$$ و هر مول $$KSCN$$ یک مول از $$AgNO_3$$ را مصرف میکنند. بنابراین میتوانیم معادله زیر را بنویسیم.
$$ \textrm{moles AgNO}_3=\textrm{moles I}^-\textrm{ + moles KSCN} $$
و میتوانیم برای یافتن تعداد مولهای $$I^-$$ به روش زیر عمل کنیم.
$$ \textrm{moles I}^-=\textrm{moles AgNO}_3-\textrm{moles KSCN} $$
$$ \textrm{moles I}^- = M_\textrm{Ag}\times V_\textrm{Ag}-M_\textrm{KSCN}\times V_\textrm{KSCN} $$
$$ \textrm{moles I}^-=(\textrm{0.05619 M AgNO}_3)\times(\textrm{0.05000 L AgNO}_3)-(\textrm{0.05322 M KSCN})\times(\textrm{0.03514 L KSCN}) $$
مقدار مولهای $$I^_$$ برابر با $$۹٫۳۹۱\times۱۰^{-۴}$$ است و درصد جرمی آن را بهصورت زیر محاسبه میکنیم.
$$\dfrac{(9.393\times10^{-4}\textrm{ mol I}^-)\times 126.9\textrm{ g I}^- /\textrm{mol I}^-}{\textrm{0.6712 g sample}}\times100=17.76\%\textrm{ w/w I}^-$$
مثال سوم
غلظت $$Cl^-$$ موجود در یک نمونه آب ۱۰۰ میلیلیتری مورد سنجش قرار گرفته است. در این تیتراسیون از $$Hg(NO_3)_2$$ با مولاریته ۰٫۰۵۱۶ به عنوان تیترانت، استفاده شده است. برای انجام تیتراسیون نمونه را اسیدی میکنیم و تیتراسیون را تا رسیدن به نقطه پایانی دیفنیل کاربازون ادامه میدهیم که ۶٫۱۸ میلیلیتر از آنالیت نیاز دارد. میزان غلظت $$Cl^-$$ را بر حسب میلیگرم بر لیتر بیان کنید.
پاسخ
واکنش بین $$Cl^-$$ و $$Hg^{2+}$$ منجر به تولید کمپلکس $$HgCl_2$$ میشود. هر ۱ مول از $Hg^{2+}$$ با ۲ مول از $$Cl^-$$ وارد واکنش میشود. بنابراین میتوانیم جرم کلر موجود در نمونه را به روش زیر محاسبه کنیم.
$$ \mathrm{\dfrac{0.0516\;mol\;Hg(NO_3)_2}{L}\times0.00618\;L\;Hg(NO_3)_2\times\dfrac{2\;mol\;Cl^-}{mol\;Hg(NO_3)_2}\times\dfrac{35.453\;g\;Cl^-}{mol\;Cl^-}=0.0226\;g\;Cl^-} $$
در نتیجه غلظت $$Cl^-$$ بهصورت زیر خواهد بود.
$$ \dfrac{0.0226\textrm{ g Cl}^-}{0.1000\textrm{ L}}\times\dfrac{\textrm{1000 mg}}{\textrm g}=226\textrm{ mg/L} $$
مثال چهارم
محاسبات لازم برای تیتراسیون ۵۰ میلیلیتر از $$Sn^{2+}$$ با مولاریته ۰٫۰۵ را با $$Ti^{3+}$$ با مولاریته ۰٫۱ انجام دهید. در این تیتراسیون هم تیترانت و هم آنالیت در هیدروکلریک اسید ۱ مولار هستند و واکنش بین آنها بهصورت زیر خواهد بود.
$$\textrm{Sn}^{2+}(aq)+\textrm{Tl}^{3+}(aq)\rightarrow \textrm{Sn}^{4+}(aq)+\textrm{Tl}^+(aq)$$
پاسخ
حجم مورد نیاز از $$Ti^{3+}$$ برای رسیدن به نقطه همارزی را میتوان بهصورت زیر به دست آورد.
$$ V_\textrm{eq}=V_\textrm{Tl}=\dfrac{M_\textrm{Sn}V_\textrm{Sn}}{M_\textrm{Tl}}=\mathrm{\dfrac{(0.050\;M)(50.0\;mL)}{0.100\;M}=25.0\;mL } $$
پیش از نقطه همارزی، محاسبه غلظت $$Sn^{2+}$$ واکنشنداده و $$Sn^{4+}$$ را میتوان به آسانی به دست آورد. به همین دلیل پتانسیل نیم واکنش $$ Sn^{4+}/Sn^{2+} $$ را به کمک رابطه نرنست محاسبه میکنیم. برای مثال غلظت $$Sn^{2+}$$ و $$Sn^{4+}$$ پس از افزودن ۱۰ میلیلیتر از تیترانت بهصورت زیر خواهد بود.
$$\mathrm{[Sn^{2+}]=\dfrac{(0.050\;M)(50.0\;mL)-(0.100\;M)(10.0\;mL)}{50.0\;mL+10.0\;mL}=0.0250\;M} $$
$$ \mathrm{[Sn^{4+}]=\dfrac{(0.100\;M)(10.0\;mL)}{50.0\;mL+10.0\;mL}=0.0167\;M} $$
بنابراین پتانسیل نیز بهصورت زیر خواهد بود.
$$ E=\mathrm{+0.139\;V-\dfrac{0.05916}{2}\log\dfrac{0.0250\;M}{0.0167\;M}=+0.134\;V} $$
پس از نقطه همارزی نیز به دست آوردن غلظت $$Ti^+$$ و غلظت مازاد $$Ti^{3+}$$ به سادگی صورت میپذیرد و برای این کار از پتانسیل نیمواکنش $$ Tl^{3+}/Tl^+ $$ بهره میبریم. برای مثال پس از افزودن ۴۰ میلیلیتر از تیترانت، غلظتها بهصورت زیر قابل محاسبه هستند.
$$\mathrm{[Tl^+]=\dfrac{(0.0500\;M)(50.0\;mL)}{50.0\;mL+40.0\;mL}=0.0278\;M}$$
$$\mathrm{[Tl^{3+}]=\dfrac{(0.100\;M)(40.0\;mL)-(0.0500\;M)(50.0\;mL)}{50.0\;mL+40.0\;mL}=0.0167\;M}$$
همچنین برای به دست آوردن مقدار پتانسیل از رابطه نرنست به شکل زیر استفاده میکنیم.
$$ E=\mathrm{+0.77\;V-\dfrac{0.05916}{2}\log\dfrac{0.0278\;M}{0.0167\;M}=+0.76\;V}$$
در نقطه همارزی تیتراسیون، پتانسیل همارزی را به دست میآوریم.
$$ E_\textrm{eq}=\mathrm{\dfrac{0.139\;V+0.77\;V}{2}=0.45\;V}$$
با به کارگیری محاسباتی مشابه، میتوان نقاط بیشتری را در طول تیتراسیون به دست آورد و از آنها برای رسم منحنی استفاده کرد. در جدول زیر تعدادی از این نقاط را مشاهده میکنید.
| حجم تیترانت بر حسب میلیلیتر | پتانسیل بر حسب ولت |
| ۵ | ۰٫۱۲۱ |
| ۱۰ | ۰٫۱۳۴ |
| ۱۵ | ۰٫۱۴۴ |
| ۲۰ | ۰٫۱۵۷ |
| ۲۵ | ۰٫۴۵ |
| ۳۰ | ۰٫۷۵ |
| ۳۵ | ۰٫۷۵ |
| ۴۰ | ۰٫۷۶ |
| ۴۵ | ۰٫۷۶ |
| ۵۰ | ۰٫۷۶ |
همانطور که مشاهده میکنید در نزدیکی نقطه همارزی، تغییر مقدار پتانسیل بسیار زیاد است.
مثال پنجم
خلوص نمونهای از سدیم اگزالات با فرمول شیمیایی $$Na_2C_2O_4$$ به کمک تیتراسیون با محلول پتاسیم پرمنگنات با فرمول شیمیایی $$KMnO_4$$ مورد محاسبه قرار میگیرد. اگر نمونهای ۰٫۵۱۱۶ گرمی تا رسیدن به نقطه همارزی نیازمند ۳۵٫۶۲ میلیلیتر از پتاسیم پرمنگنات ۰٫۰۴ مولار باشد، درصد جرمی سدیم اگزالات در نمونه چقدر خواهد بود؟
پاسخ
از آنجا که برای این مثال، واکنش موازنهشدهای در دست نداریم، تبادل بار را برای پی بردن به استوکیومتری بین اجزای واکنش، مورد بررسی قرار میدهیم. اکسیداسیون $$C_2O_4^{-2}$$ به $$CO_2$$ نیازمند تغییر عدد اکسایش از ۳ به ۴ و ۱ الکترون به ازای هر کربن است. بنابراین برای هر مول از $$C_2O_4^{-2}$$ برابر با دو الکترون خواهد بود. همچنین کاهش $$MnO_4^-$$ که در آن منگنز دارای عدد اکسیداسیون ۷ است، به $$Mn^{2+}$$ نیازمند ۵ الکترون است. بنابراین میتوان اینطور جمعبندی کرد که برای انجام واکنش تیتراسیون، ۲ مول از $$KMnO_4$$ با ۵ مول از $$Na_2C_2O_4$$ وارد واکنش میشود.
تعداد مولهای پتاسیم پرمنگنات برای رسیدن به نقطه پایانی تیتراسیون از روش زیر محاسبه میشود.
$$ \mathrm{(0.0400\;M\;KMnO_4)\times(0.03562\;L\;KMnO_4)=1.42\times10^{-3}\;mol\;KMnO_4} $$
به این صورت میتوان محاسبات زیر را در مورد نمونه حاوی سدیم اگزالات نوشت.
$$ \mathrm{1.42\times10^{-3}\;mol\;KMnO_4\times\dfrac{5\;mol\;Na_2C_2O_4}{2\;mol\;KMnO_4}=3.55\times10^{-3}\;mol\;Na_2C_2O_4} $$
بنابراین مقدار سدیم اگزالات در نمونه نیز به روش زیر در دست خواهد بود.
$$ \mathrm{3.55\times10^{-3}\;mol\;Na_2C_2O_4\times\dfrac{134.00\;g\;Na_2C_2O_4}{mol\;Na_2C_2O_4}=0.476\;g\;Na_2C_2O_4} $$
در نهایت نیز درصد جرمی سدیم اگزالات در نمونه را محاسبه میکنیم.
$$ \mathrm{\dfrac{0.476\;g\;Na_2C_2O_4}{0.5116\;g\;sample}\times100=93.0\%\;w/w\;Na_2C_2O_4} $$
تمرین از انواع تیتراسیون
در این بخش تعدادی تمرین چند گزینهای را در مورد انواع تیتراسیون مورد بررسی قرار میدهیم.
تمرین اول
از کدام یک از ترکیبات زیر میتوان به عنوان شناساگر در تیتراسیون اسید قوی با باز ضعیف استفاده کرد؟
متیل نارنجی
متیل قرمز
سدیم هیدروکسید
فنول فتالیین
تمرین دوم
از کدام یک از ترکیبات زیر میتوان در تیتراسیون اسید ضعیف با باز قوی به عنوان شناساگر استفاده کرد؟
متیل نارنجی
میتل قرمز
سدیم هیدروکسید
فنول فتالیین
تمرین سوم
نقش شناساگر در واکنشهای تیتراسیونی چیست؟
شناسایی نقطه پایانی تیتراسیون
کمک به واکنشدهنده برای انجام سریعتر واکنش
فراهم آوردن بستری مناسب برای انجام واکنش
افزایش سرعت واکنش
تمرین چهارم
هدف اولیه برای انجام یک تیتراسیون اسید و باز چیست؟
یافتن غلظت یک اسید یا باز مجهول
یافتن حجم اسید یا باز مجهول
یافتن مقدار $$pH$$ اسید یا باز مجهول
یافتن فشار اسید یا باز مجهول
تمرین پنجم
در یک تیتراسیون، نقطه همارزی به چه معنایی است؟
نقطهای است که در آن فشار تیترانت با فشار آنالیت برابر میشود.
نقطهای است که در آن مقدار $$pH$$ تیترانت با مقدار $$pH$$ آنالیت برابر میشود.
نقطهای است که در آن حجم تیترانت با حجم آنالیت برابر میشود.
نقطهای است که در آن مقدار تیترانت با مقدار آنالیت برابر میشود.
تمرین ششم
در زیر مشخصات ۴ نوع از انواع تیتراسیون مختلف آوره شده است، با توجه به آنها بگویید در کدام گزینه ترتیب شناساگر مناسب برای آنها، بهصورت صحیح آورده شده است؟
- تیتراسیون سدیم هیدروکسید $$(NaOH)$$ با استیک اسید $$(CH_3COOH)$$
- تیتراسیون پتاسیم پرمنگنات $$(KMnO_4)$$ با اگزالیک اسید $$( H_2C_2O_4)$$
- تیتراسیون ید $$(I_2)$$ با سدیم تیوسولفات $$(Na_2S_2O_3)$$
- تیتراسیون پتاسیم دیکرومات $$(K_2Cr_2O_7)$$ با آهن(II) سولفات $$(FeSO_4)$$
فنول فتالیین، پتاسیم پرمنگنات $$(KMnO_4)$$، نشاسته، پتاسیم فروسیانات $$(K_3 [Fe(CN)_6])$$
پتاسیم پرمنگنات $$(KMnO_4)$$، نشاسته، پتاسیم فروسیانات $$(K_3 [Fe(CN)_6])$$، فنول فتالیین
پتاسیم فروسیانات $$(K_3 [Fe(CN)_6])$$، پتاسیم پرمنگنات $$(KMnO_4)$$، نشاسته، فنول فتالیین
نشاسته، پتاسیم فروسیانات $$(K_3 [Fe(CN)_6])$$، فنول فتالیین، پتاسیم پرمنگنات $$(KMnO_4)$$
تمرین هفتم
نمونهای ۱٫۹۶۳ گرمی آلیاژی در $$HNO_3$$ حل و سپس تا حجم ۱۰۰ میلیلیتر رقیق میشود. تیتراسیون ۲۵ میلیلیتر از نمونه، نیازمند ۲۷٫۱۹ میلیلیتر از $$KSCN$$ با مولاریته ۰٫۱۰۷۸ است. درصد جرمی نقره در این نمونه در کدام گزینه بهصورت صحیح آمده است؟
۵۶٫۸۷ ٪
۶۴٫۴۴ ٪
۶۰٫۴۵ ٪
۷۵٫۰۲ ٪
ابتدا تعداد مولهای مصرفی $$KSCN$$ را بهصورت زیر محاسبه میکنیم.
$$\mathrm{\dfrac{0.1078\;M\;KSCN}{L}\times0.02719\;L=2.931\times10^{-3}\;mol\;KSCN}$$
نسبت استوکیومتری $$SCN^-$$ و $$Ag^+$$ بهصورت ۱:۱ است، بنابراین میتوان بهراحتی، جرم نقره را به دست آورد. توجه داشته باشید که این مقدار برای نمونهای ۲۵ میلیلیتری است.
$$\mathrm{2.931\times10^{-3}\;mol\;Ag^+\times\dfrac{107.87\;g\;Ag}{mol\;Ag}=0.3162\;g\;Ag}$$
برای داشتن جرم نمونه اولیه، مقدار به دست آمده را در عدد ۴ ضرب میکنیم و متوجه میشویم که جرم نقره در نمونه ۱٫۲۶۵ گرم از آن موجود است. برای به دست آوردن درصد جرمی، باید این مقدار را بر نمونه اولیه تقسیم کنیم.
$$ \mathrm{\dfrac{1.265\;g\;Ag}{1.963\;g\;sample}\times100=64.44\%\;w/w\;Ag} $$
منحنی زیر مربوط به تیتراسیون نمونهای ۵۰ میلیلیتری حاوی $$Cl^_$$ و $$I^-$$ است که در آن نقره نیترات به عنوان تیترانت حضور دارد. با توجه به نقاطی پایانی تیتراسیون این دو آنالیت، گزینه صحیح را انتخاب کنید.
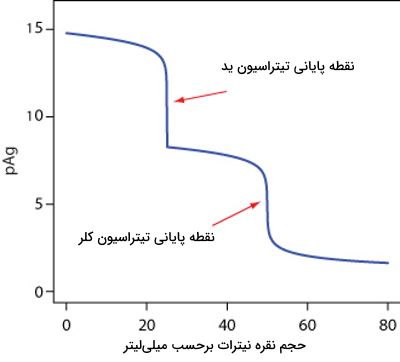
انحلالپذیری $$AgI$$ از $$AgCl$$ بیشتر است زیرا نقطه پایانی تیتراسیون آن دیرتر است.
انحلالپذیری $$AgI$$ از $$AgCl$$ بیشتر است زیرا نقطه پایانی تیتراسیون آن زودتر است.
انحلالپذیری $$AgCl$$ از $$AgI$$ بیشتر است زیرا نقطه پایانی تیتراسیون آن زودتر است.
انحلالپذیری $$AgCl$$ از $$AgI$$ بیشتر است زیرا نقطه پایانی تیتراسیون آن دیرتر است.
تمرین نهم
نمونه ناخالص $$NaCN$$ با جرم ۰٫۴۴۸۲ گرم توسط نقره نیترات ۰٫۱۰۱۸ مولار تیتر و تا رسیدن به نقطه پایان تیتراسیون ۳۹٫۶۸ میلیلیتر از تیترانت مصرف میشود. خلوص این نمونه بر حسب درصد جرمی $$NaCN$$ در کدام گزینه بهصورت صحیح آورده شده است؟
۸۸٫۳۳ ٪
۷۶٫۷۵ ٪
۶۵٫۴۳ ٪
۵۵٫۰۹ ٪
تیتراسیون $$CN^-$$ با $$Ag^+$$ باعث به وجود آمدن کمپلکس $$Ag(CN)_2^{2-}$$ میشود. در این تیتراسیون هر ۱ مول از $$AgNO_3$$ با ۲ مول از $$NaCN$$ واکنش میدهد. جرم $$NaCN$$ در نمونه را بهصورت زیر مورد محاسبه قرار میدهیم.
$$ \mathrm{\dfrac{0.1018\;mol\;AgNO_3}{L}\times0.03968\;L\times\dfrac{2\;mol\;NaCN}{mol\;AgNO_3}\times\dfrac{49.01\;g\;NaCN}{mol\;NaCN}=0.3959\;g\;NaCN} $$
و برای به دست آوردن خلوص نمونه به روش زیر عمل میکنیم.
$$ \mathrm{\dfrac{0.3959\;g\;NaCN}{0.4482\;g\;sample}\times100=88.33\%\;w/w\;NaCN} $$
در یک تیتراسیون $$U^{4+}$$ توسط $$Ce^{4+}$$ تا رسیدن به نقطه همارزی تیتر میشود. واکنش موازنه نشده آن را در زیر مشاهده میکنید. با توجه به اطلاعات داده شده، پتانسیل نقطه همارزی را در محیطی با مقدار $$pH$$ برابر با ۱ به دست آورید.
۰٫۷۱۲ ولت
۱٫۳۴ ولت
۲٫۴۳ ولت
۰٫۹۸ ولت
دو نیمواکنش این تیتراسیون را میتوان بهصورت زیر نشان داد.
$$ \textrm{Ce}^{4+}(aq)+e^-\rightarrow \textrm{Ce}^{3+}(aq) $$
$$ \mathrm{U^{4+}}(aq)+\mathrm{2H_2O}\rightarrow \mathrm{UO_2^{2+}}(aq)+\mathrm{4H^+}(aq)+2e^- $$
همچنین رابطه نرنست آنها را مینویسیم.
$$ E=E^{\circ}\mathrm{_{Ce^{4+}/Ce^{3+}}-\dfrac{0.05916}{1}\log\dfrac{[Ce^{3+}]}{[Ce^{4+}]}} $$
$$ E=E^{\circ}\mathrm{_{UO_2^{2+}/U^{4+}}-\dfrac{0.05916}{2}\log\dfrac{[U^{4+}]}{[UO_2^{2+}][H^+]^4}} $$
پیش از افزودن این دو رابطه به هم، باید رابطه دوم را در ۲ ضرب کنیم تا بتوانیم لگاریتمهای آنها را با یکدیگر جمع ببندیم.
$$ 3E=E^{\circ}\mathrm{_{Ce^{4+}/Ce^{3+}}}+2E^{\circ}\mathrm{_{UO_2^{2+}/U^{4+}}-0.05916\log\dfrac{[Ce^{3+}][U^{4+}]}{[Ce^{4+}][UO_2^{2+}][H^+]^4}} $$
همچنین میدانیم که در نقطه همارزی، دو عبارت زیر صدق میکند.
$$ \mathrm{[Ce^{3+}]=2\times[UO_2^{2+}]} $$
$$ \mathrm{[Ce^{4+}]=2\times[U^{4+}]} $$
با جایگذاری این عبارتها در رابطه پتانسیل و بازارایی آن، معادله کلی پتانسیل در نقطه همارزی را میتوان بهصورت زیر به دست آورد.
$$ 3E=E^{\circ}\mathrm{_{Ce^{4+}/Ce^{3+}}}+2E^{\circ}\mathrm{_{UO_2^{2+}/U^{4+}}-0.05916\log\dfrac{2[UO_2^{2+}][U^{4+}]}{2[U^{4+}][UO_2^{2+}][H^+]^4}} $$
$$ E=\dfrac{E^{\circ}_\mathrm{Ce^{4+}/Ce^{3+}}+2E^{\circ}_\mathrm{UO_2^{2+}/U^{4+}}}{3}-\dfrac{0.05916}{3}\log\dfrac{1}{[\textrm H^+]^4} $$
$$ E=\dfrac{E^{\circ}_\mathrm{Ce^{4+}/Ce^{3+}}+2E^{\circ}_\mathrm{UO_2^{2+}/U^{4+}}}{3}+\dfrac{0.05916\times4}{3}\log[\textrm H^+]$$
$$ E=\dfrac{E^{\circ}_\mathrm{Ce^{4+}/Ce^{3+}}+2E^{\circ}_\mathrm{UO_2^{2+}/U^{4+}}}{3}-0.07888\textrm{ pH} $$
در مقدار $$pH$$ برابر با ۱، پتانسیل بهصورت زیر به دست میآيد.
$$ E_\textrm{eq}=\dfrac{1.72 + 2\times0.327}{3}-0.07888\times1=0.712\textrm{ V} $$
در تیتراسیونی، ۳۰ میلیلیتر از نیترو اسید با مولاریته ۰٫۲ به عنوان آنالیت وجود دارد. در انجام تیتراسیون از آمونیاک ۰٫۰۵ مولار استفاده میشود. محدوده $$pH$$ در نقطه همارزی واکنش در کدام یک از گزینههای زیر بهصورت صحیح آمده است؟
بیشتر از ۷
برابر با ۷
کمتر از ۷
نمیتوان با این اطلاعات در مورد آن اظهار نظر کرد.
تمرین دوازدهم
تیتراسیون غیرمستقیم برای اندازهگیری کدام یک از ترکیبهای زیر به کار گرفته میشود؟
کلسیم
منیزیم
روی
برای تمام گزینههای بالا به کار میرود.
تمرین سیزدهم
تیتراسیون بین سولفوریک اسید و سدیم کربنات، نمونهای از واکنش بین ... است.
دو محلولی که از هر دو میتوان به راحتی استاندارهای اولیه را تهیه کرد.
اسید قوی و باز ضعیف
اسید ضعیف و باز قوی
اسید تک پروتونی و باز ضعیف
تمرین چهاردهم
برای اندازهگیری کدام یک از گزینههای زیر نمیتوان از تیتراسیون یدومتری استفاده کرد؟
$$Fe^{3+}$$
$$Cu^{2+}$$
$$Pb^{2+}$$
$$Ag^{+}$$
تمرین پانزدهم
آلیاژی از کرومل شامل نیکل، آهن و کروم، در تیتراسیون به کمک EDTA مورد اندازهگیری قرار میگیرد. در ابتدا ۰٫۷۱۶۷ گرم از نمونه این آلیاژ در نیتریک اسید حل میشود و بعد از منتقل شدن به یک ارلن، تا حجم ۲۵۰ میلیلیتری رقیق میشود. ۵۰ میلیلیتر از این نمونه را به کمک پیروفسفات برای بلوکه کردن آهن و کروم شستشو میدهیم. برای رسیدن به نقطه پایانی تیتراسیون مورکسید به ۲۶٫۱۴ میلیلیتر از EDTA با مولاریته ۰٫۵۸۳۱ نیاز داریم. ۵۰ میلیلیتر دیگر از نمونه را به وسیله هگزامتیلن تترا آمین شستشو میدهیم تا کروم بلوکه شود. در این تیتراسیون برای رسیدن به نقطه پایان تیتراسیون مورکسید به ۳۵٫۴۳ میلیلیتر از EDTA با همان مولاریته پیشین نیاز داریم. در نهایت نیز یک نمونه دیگر ۵۰ میلیلیتری را به کمک ۵۰ میلیلیتر از همان EDTA شستشو میدهیم و تیتراسیون برگشتی را به وسیله مورکسید روی آن اجرا میکنیم. در این تیتراسیون نیز برای رسیدن به نقطه پایانی به ۶٫۲۱ میلیلیتر از $$Cu^{2+}$$ با مولاریته ۶٫۲۱ نیاز داریم. درصد وزنی نیکل، آهن و کروم را در آلیاژ پیدا کنید.
۱۶٫۶ درصد جرمی آهن
۲۰ درصد جرمی آهن
۳۲ درصد جرمی آهن
۱۵٫۰۹ درصد جرمی آهن
استوکیومتری بین EDTA و یونهای فلزی بهصورت ۱ به ۱ است. در نتیجه میتوان رابطه بین مولهای EDTA و یونهای فلزی را به شکل زیر نوشت.
- تیتراسیون اول: مولهای نیکل= مولهای EDTA
- تیتراسیون دوم: مول نیکل+ مول آهن= مول EDTA
- تیتراسیون سوم: مول نیکل+ مول آهن+ مول کروم= مول EDTA
با توجه به رابطههای بالا، میتوان تعداد مولهای نیکل را در ۵۰ میلیلیتر از آلیاژ محلول به دست آورد. این را بهصورت زیر نشان میدهیم.
$$ \mathrm{\dfrac{0.05831\;mol\;EDTA}{L}\times 0.02614\;L\;EDTA=1.524\times10^{-3}\;mol\;EDTA} $$
بنابراین مقدار مول موجود از نیکل در نمونه را میدانیم.
با در دست داشتن مولهای EDTA که با نیکل واکنش میدهند، میتوان با کمک رابطه دوم، مقدار آهن موجود در نمونه را نیز به دست آورد. این محاسبات بهصورت زیر قابل انجام است.
$$ \mathrm{\dfrac{0.05831\;mol\;EDTA}{L}\times0.03543\;L\;EDTA=2.066\times10^{-3}\;mol\;EDTA} $$
از این مقدار، $$ 1.524×10^{–3} $$ مول از تیترانت، صرف تیتراسیون با نیکل شده است، بنابراین مقدار مول مورد استفاده در تیتراسیون با آهن برابر با $$ 5.42×10^{–4} $$ است و در نمونه همین مقدار مول از آهن وجود دارد.
در نهایت نیز میتوان از تیتراسیون سوم برای به دست آوردن مقدار کروم موجود در آلیاژ استفاده کرد. این محاسبات بهصورت زیر خواهد بود.
$$ \mathrm{\dfrac{0.05831\;mol\;EDTA}{L}\times0.05000\;L\;EDTA=2.916\times10^{-3}\;mol\;EDTA} $$
با توجه به محاسبات قبل، از این مقدار $$ 1.524×10^{–3} $$ صرف تیتراسیون نیکل و $$ 5.42×10^–4 $$ صرف تیتراسیون آهن شده است. بنابراین $$ 8.50×10^{–4} $$ مول از EDTA در تیتراسیون با کروم و مس مورد استفاده قرار گرفته است. مقدار EDTA مورد مصرف برای تیتراسیون مس را نیز میتوانیم بهصورت زیر محاسبه کنیم.
$$ \mathrm{\dfrac{0.06316\;mol\;Cu^{2+}}{L}\times0.00621\;L\;Cu^{2+}\times\dfrac{1\;mol\;EDTA}{mol\;Cu^{2+}}=3.92\times10^{-4}\;mol\;EDTA}$$
بنابراین $$ 4.58×10^{–4}$$ مول از EDTA در تیتراسیون با کروم استفاده شده است. از همین رو متوجه میشویم که نمونه شامل همین مقدار مول از کروم است.
در این مرحله مقدار مول هر کدام از محتویات را در نمونهای ۵۰ میلیلیتری در دست داریم. برای محاسبه درصد جرمی هر آنالیت در آلیاژ نیز مراحل زیر را طی میکنیم.
$$\mathrm{\dfrac{1.524\times10^{-3}\;mol\;Ni}{50.00\;mL}\times250.0\;mL\times\dfrac{58.69\;g\;Ni}{mol\;Ni}=0.4472\;g\;Ni}$$
$$\mathrm{\dfrac{0.4472\;g\;Ni}{0.7176\;g\;sample}\times100=62.32\%\;w/w\;Ni}$$
$$\mathrm{\dfrac{5.42\times10^{-4}\;mol\;Fe}{50.00\;mL}\times250.0\;mL\times\dfrac{55.847\;g\;Fe}{mol\;Fe}=0.151\;g\;Fe}$$
$$\mathrm{\dfrac{0.151\;g\;Fe}{0.7176\;g\;sample}\times100=21.0\%\;w/w\;Fe}$$
$$\mathrm{\dfrac{4.58\times10^{-4}\;mol\;Cr}{50.00\;mL}\times250.0\;mL\times\dfrac{51.996\;g\;Cr}{mol\;Cr}=0.119\;g\;Cr}$$
$$\mathrm{\dfrac{0.119\;g\;Cr}{0.7176\;g\;sample}\times100=16.6\%\;w/w\;Fe}$$
تمرین شانزدهم
مقدار $$pH$$ نقطه همارزی در تیتراسیون استیک اسید ۱٫۰ مولار با سدیم هیدروکسید ۱٫۰ مولار، در کدام گزینه بهصورت صحیح آورده شده است؟
۹٫۵۶
۹٫۲۲
۸٫۴۳
۱۰٫۰۴
تمرین هفدهم
از تیتراسیون برگشتی با EDTA برای اندازهگیری غلظت سولفات $$(SO_4^{2-}$$ در یک نمونه استفاده میشود. نمونهای ۰٫۱۵۵۷ گرمی را در آب حل میکنیم. سپس با افزودن $$Ba(NO_3)$$، تمام سولفات موجود در آن بهصورت رسوب $$BaSO_4$$ در میآید. بعد از صاف کردن و شستشوی رسوب، آن را در ۲۵ میلیلیتر از EDTA با مولاریته ۰٫۲۰۱۱ حل میکنیم. سپس مقدار مازاد EDTA با $$Mg^{2+}$$ با مولاریته ۰٫۰۱۱۱۳ تیتر میشود. تا رسیدن به نقطه پایانی تیتراسیون ۴٫۲۳ میلیلیتر از EDTA مصرف میشود. درصد جرمی $$Ba_2SO_4$$ در نمونه، در کدام گزینه بهصورت صحیح آورده شده است؟
۴۰٫۴۳ ٪
۴۱٫۲۳ ٪
۶۵٫۴۲ ٪
۳۹٫۰۴ ٪
تعداد کل مولهای EDTA مصرفشده در این تیتراسیون برابر است با:
$$\mathrm{\dfrac{0.02011\;mol\;EDTA}{L}\times0.02500\;L = 5.028\times10^{-4}\;mol\;EDTA}$$
همچنین میتوان مولهای به کار رفته در تیتراسیون برگشتی با $$Mg^{2+}$$ را نیز بهصورت زیر به دست آورد.
$$ \mathrm{\dfrac{0.01113\;mol\;Mg^{2+}}{L}\times0.00423\;L\times\dfrac{1\;mol\;EDTA}{mol\;Mg^{2+}}=4.708\times10^{-5}\;mol\;EDTA} $$
با کم کردن این دو مقدار از یکدیگر، مقدار EDTA درگیر با رسوب باریم سولفات نیز محاسبه میشود.
$$ \mathrm{5.028\times10^{-4}\;mol\;EDTA-4.708\times10^{-5}\;mol\;EDTA=4.557\times10^{-4}\;mol\;EDTA} $$
هر ۱ مول از باریم سولفات با ۱ مول از EDTA واکنش میدهد. بر همین اساس میتوان معادله زیر را نوشت:
$$\mathrm{4.557\times10^{-4}\;mol\;EDTA\times\dfrac{1\;mol\;BaSO_4}{mol\;EDTA}\times\dfrac{1\;mol\;Na_2SO_4}{mol\;BaSO_4}\times\dfrac{142.04\;g\;Na_2SO_4}{mol\;Na_2SO_4}=0.06473\;g\;Na_2SO_4} $$
در نهایت نیز میتوان درصد جرمی سدیم سولفات در نمونه را بهصورت زیر به دست آورد.
$$\mathrm{\dfrac{0.06473\;g\;Na_2SO_4}{0.1557\;g\;sample}\times100=41.23\%\;w/w\;Na_2SO_4} $$
تمرین هجدهم
در تیتراسیون اسید و باز، نقطه همارزی نقطهای است که در آن تعداد مولهای اسید ... تعداد مولهای باز است.
بیشتر از
کمتر از
هیچ کدام
برابر با
تمرین نوزدهم
نقطهای که در آن شناساگر تغییر رنگ میدهد، نقطه ... نامیده میشود.
نقطه پایان تیتراسیون
نقطه همارزی تیتراسیون
گزینه اول و دوم
هیچ کدام
تمرین بیستم
در انواع تیتراسیون به طور معمول، تیترانت در ... و آنالیت در ... نگهداری میشود.
ارلن، بورت
بورت، بشر
بورت، ارلن
بشر، بالون ژوژه
تمرین بیست و یکم
در یک تیتراسیون اسید و باز، باز در بورت، قطرهقطره به ارلن حاوی اسید افزوده میشود. در این تیتراسیون از شناساگر فنیل آلانین استفاده میشود. با رسیدن به نقطه پایانی تیتراسیون، انتظار مشاهده چه تغییر رنگی را خواهیم داشت؟
بیرنگ به صورتی
صورتی به بیرنگ
قرمز به آبی
آبی به قرمز
تمرین بیست و دوم
در تمام انواع تیتراسیونهای موجود، حداقل یک واکنش اسید و باز صورت میگیرد.
صحیح
غلط
سوالات متدوال
حال که با مفهوم تیتراسیون و انجام روشهای انجام آن آشنا شدیم، میخواهیم به برخی از مهمترین و پرتکرارترین سوالهای پیرامون آن، پاسخ دهیم.
تیتراسیون چیست ؟
تیتراسیونی روشی آنالیزی است که در وهله اول برای یافتن غلظت مجهول محلول آنالیت به کمک محلولی استاندارد با غلظت معلوم، به کار گرفته میشود.
محلول استاندارد چیست ؟
به محلولی که غلظت آن مشخص باشد، محلول استاندارد میگوییم. در تیتراسیون محلول استاندارد همان محلول تیترانت است.
چرا نباید ارلن حاوی آنالیت را پیش از افزودن آن، کر داد؟
با این کار مقداری از مایع به دیوارههای میچسبد و باعث افزایش حجم میشود. در این حالت شاهد بروز خطا در تعیین نقطه همارزی و متعاقبا مقدار غلظت به دست آمده، خواهیم بود.
اسیدیمتری چیست ؟
«اسیدیمتری» (Acidimetry) روش تیتراسیونی است که در آن، غلظت مجهول یک باز به کمک یک محلول استاندارد اسید با غلظت معلوم، به دست میآید.
قلیایی سنجی چیست ؟
«قلیاییسنجی» (Alkalimetry) روش تیتراسیونی است که در آن، غلظت مجهول یک اسید به کمک یک محلول استاندارد باز با غلظت معلوم، به دست میآید.
در نقطه همارزی تیتراسیون منگانومتری چه اتفاقی میافتد؟
در نقطه پایانی این تیتراسیون، محلول بیرنگ به رنگ صورتی در میآید.
چه الکترود هایی به عنوان مرجع در تیتراسیون پتانسیومتری استفاده می شوند ؟
الکترود هیدروژن، الکترود نقره کلرید و الکترود کالومل در این تیتراسیون به عنوان الکترود مرجع به کار گرفته میشوند.
انواع تیتراسیون چیستند ؟
روشهای تیتراسیونی بسیار متعدد هستند. برای مثال میتوان به تیتراسیون اسید و باز، تیتراسیون اکسایش و کاهش، تیتراسیون کمپلکسومتری و تیتراسیون رسوبی اشاره کرد.
تفاوت نقطه همارزی و نقطه پایانی در انواع تیتراسیون چیست ؟
در نقطه همارزی مقدار تیترانت از نظر شیمیایی با مقدار آنالیت برابر است اما نقطه پایانی، نقطهای است که در آن شاهد تغییر رنگ از جانب شناساگر هستیم.
بزرگترین مزیت استفاده از تیتراسیون پتانسیومتری چیست؟
تیتراسیون پتانسیومتری روش مقرون بهصرفهای است زیرا در آن به مقدار بسیار اندکی از تیترانت و آنالیت نیاز داریم.
جمع بندی
هدف از این مطلب مجله فرادرس بررسی انواع تیتراسیون به عنوان یکی از مهمترین روشهای اندازهگیری کمی در علم شیمی بود. همچنین با انواع روشهای موجود برای انجام تیتراسیون با توجه به تیترانت و آنالیت و شناساگر آشنا شدیم. در ادامه نیز با بررسی تعدادی مثال و حل تمرینهای متعدد تلاش کردیم تا توانایی خود را در انجام محاسبات مورد نیاز برای یافتن غلظت مجهول تیترانت در این روش، تقویت کنیم.









توی تمرین ۱۰ در بخش پاسخ احتمالا Ag(CN)2 بارش یک منفی باشه که نوشته شده دو منفی
حالا ولی سوال اصلی من اینه چرا نسبت مولی یک به دو میشه؟ برای اینکه غلظت CN یک منفی آزاد رو بفهمیم
AgNO3 +NaCN —-> AgCN + NaNO3 چرا واکنش مون اینجوری نمیشه؟
سلام و روز شما بهخیر؛
ممنونیم از دقت نظر شما دوست عزیز. بار کمپلکس $$[Ag(CN)_2]^-$$ تصحیح شد. این کمپکس دارای یک عدد $$Ag^+$$ و دو عدد $$CN^-$$ است، بنابرین بار نهایی روی آن ۱ بار منفی است.
با این حال توجه داشته باشید که واکنش تشکیل این کمپلکس بهصورت زیر صحیح است که در آن یونهای ناظر حذف شدهاند:
$$ Ag^+ + 2CN^-\rightarrow[Ag(CN)_2]^- $$
در واکنشی که شما نوشتید، گرچه موازنه جرم و بار وجود دارد اما محصول نهایی مورد نظر مشابه محصول کمپلکسی این مثال نیست. بنابراین همانطور که مشاهده میکنید، نسبت استوکیومتری دو گونه درگیر در واکنش بهصورت ۱:۲ است، یعنی هر ۱ مول $$Ag^+$$ با دو مول از $$CN^-$$ وارد واکنش میشود تا محصول به دست آید.
خوشحالیم که با مجله فرادرس همراه هستید.