گرما چیست؟ – واحد و نحوه اندازه گیری – به زبان ساده

فنجان قهوه داغی را با دمای ۸۰ درجه سلسیوس در نظر بگیرید که روی میز آشپزخانه قرار دارد. فرض کنید دمای محیط نیز برابر ۲۶ درجه سلسیوس باشد. چه اتفاقی رخ میدهد؟ همانطور که بارها مشاهده کردهاید فنجان قهوه به تدریج سرد میشود و پس از مدت زمان مشخصی با محیط اطراف به تعادل گرمایی میرسد. در مقیاس ماکروسکوپی میگوییم گرما از فنجان قهوه به محیط اطراف منتقل میشود. حقیقت آن است که گرما از قهوه به محیط اطراف منتقل میشود و دمای قهوه و انرژی آن کاهش مییابد. به انتقال انرژی از جسم داغ به جسم سرد، گرما میگوییم. در این مطلب، پس از پاسخ به پرسش گرما چیست به سایر سوالات مرتبط با این حوزه پاسخ میدهیم، ازجمله اینکه یاد میگیریم که فرمول و راههای انتقال گرما چیست و با چه وسایلی آنها را اندازهگیری کنیم.
گرما چیست ؟
گرما مفهومی بسیار مهم در علم فیزیک است. اگر علاقهمند به فیزیک باشید یا مبحث ترمودینامیک را در دوره دبیرستان یا دانشگاه گذرانده باشید، به طور حتم با این کلمه بسیار روبرو شدهاید. آیا میدانید گرما چیست؟ در زندگی روزمره، بارها با این کلمه روبرو شدهاید و آن را احساس کردهاید. به عنوان مثال، هنگامی که لیوانی چای داغ را در دست میگیرید، گرمای آن را احساس خواهید کرد یا در یکی از روزهای گرم مرداد ماه با خود میگویید، چه هوای گرمی. گرما مفهومی است که در بسیار از مبحثهای فیزیک، مانند فیزیک گرما و ترمودینامیک، استفاده میشود.
قبل از آنکه بدانیم گرما چیست، به این نکته توجه داشته باشید که گرما نهتنها در فیزیک بلکه در بسیاری از شاخههای دیگر مانند علم مواد، شیمی و زیستشناسی نیز استفاده میشود. قبل از توضیح در مورد گرما باید بدانیم دما چیست.
دما چیست ؟
خودکاری را در نظر بگیرید و با استفاده از میکروسکوپ روی آن زوم کنید. هرچه قدرت بزرگنمایی میکروسکوپ بیشتر باشد به این نکته پی خواهید برد که خودکار از مولکولها و ذرات بسیار ریز با تعداد زیاد ساخته شده است. ذرات تشکیلدهنده خودکار یا هر جسم دیگر، ساکن نیستند و حرکت میکنند. شاید با خود فکر کنید ذرات تشکیلدهنده اجسام جامد، مانند خودکار، حرکت نمیکنند، اما اینطور نیست. حتی ذرات تشکیلدهنده جسم جامد نیز حرکت میکنند.
دو ذره مجاور یکدیگر داخل جسمی جامد را در نظر بگیرید. این دو ذره با یکدیگر پیوند دارند. پیوند بین دو ذره مجاور در جسم جامد را با دقت خوبی میتوان مشابه فنر کوچکی دانست. اکنون سیستمی دو ذرهای به صورت نشان داده شده در تصویر زیر داریم که با یکدیگر پیوند دارند و پیوند آنها همانند فنری کوچک است.
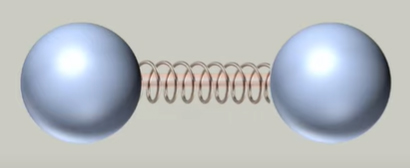
اگر این سیستم دو ذرهای انرژی داشته باشد، دو ذره به صورت طبیعی حول نقطه تعادل خود نوسان میکنند. هرچه انرژی سیستم دو ذرهای بیشتر باشد، ذرات با شدت بیشتری نوسان میکنند و در نتیجه، انرژی جنبشی بیشتری خواهند داشت. ذرات تشکیلدهنده جسم داغ، انرژی جنبشی زیادی دارند. اما، ذرات تشکیلدهنده جسم سرد انرژی جنبشی کمی دارند.
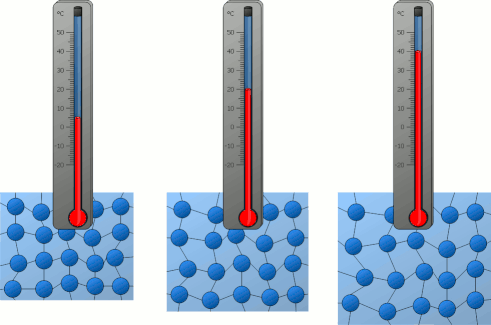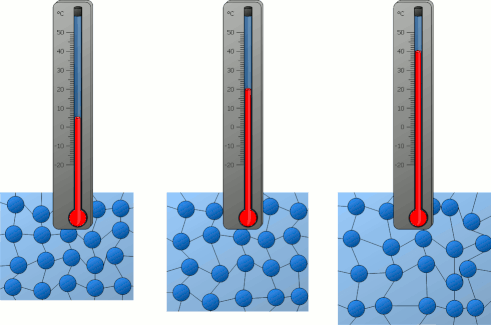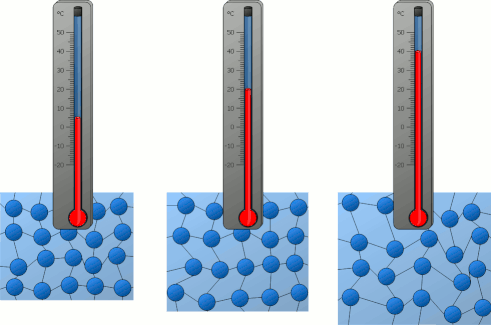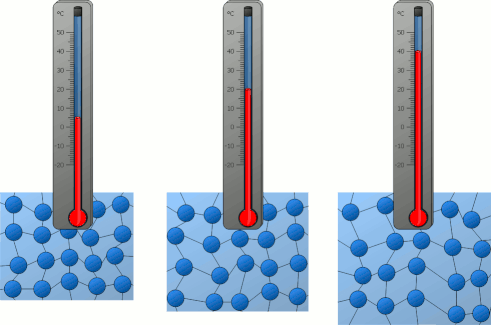
دما به صورت متوسط انرژی جنبشی ذراتِ تشکیلدهنده سیستم تعریف میشود. شاید از خود بپرسید دما چه چیزی را اندازه میگیرد. دما، مقدار گرمای موجود برای انجام کار در سیستم را اندازه میگیرد. بنابراین، انرژی گرمایی به متوسط انرژی جنبشی اتمها یا ذرات داخل سیستم مربوط میشود. انرژی جنبشی ذرهای به جرم m با استفاده از رابطه زیر بهدست میآید:
همانطور که در رابطه بالا دیده میشود، انرژی جنبشی هر ذره با مربع سرعت حرکت آن ذره به طور مستقیم متناسب است. بنابراین، هرچه انرژی جنبشی ذرهای بیشتر باشد، آن ذره با سرعت بیشتری حرکت خواهد کرد. به بیان دیگر، هرچه اتمهای داخل جسم با سرعت بیشتری حرکت کنند، انرژی جنبشی آنها بیشتر است. در نتیجه، هرچه دمای جسمی بیشتر باشد، ذرات تشکیلدهنده آن با سرعت بیشتری حرکت میکنند.
انرژی جنبشی متوسط سیستم با استفاده از معادله زیر به دمای سیستم مربوط میشود:
همانطور که در معادله بالا دیده میشود، انرژی جنبشی متوسط سیستم با دمای سیستم متناسب است. تا اینجا با مفهوم دما آشنا شدیم. در ادامه، به پرسش گرما چیست پاسخ میدهیم.
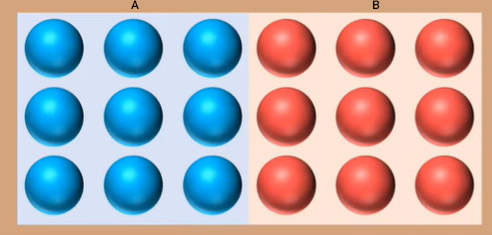
دو جسم A و B را در دو دمای متفاوت در نظر بگیرید. دمای جسم A را ۲۰ درجه سلسیوس و دمای جسم B را ۸۰ درجه سلسیوس در نظر بگیرید. این دو جسم همگن هستند و از ماده یکسانی ساخته و از بقیه جهان جدا شدهاند. از آنجا که دمای جسم A کمتر از دمای جسم B است، ذرات جسم B سریعتر از ذرات جسم A حرکت میکنند. زیرا انرژی جنبشی ذرات در جسم A کمتر از انرژی جنبشی ذرات در جسم B است. بنابراین، جسم A نسبت به جسم B سردتر است. برای نشان دادن مقدار انرژی جنبشی ذرات در سیستم از دو رنگ استفاده میکنیم.
ذرات قرمزرنگ انرژی جنبشی بیشتری در مقایسه با ذرات آبیرنگ دارند. از اینرو، ذرات A آبیرنگ و ذرات B قرمزرنگ هستند. در ادامه، دو جسم A و B را در تماس با یکدیگر قرار میدهیم و مرز بین آنها را بررسی میکنیم.
سه ذره از جسم A را در نظر میگیریم و آنها را ذرههای شماره یک، دو و سه مینامیم. به طور مشابه، سه ذره از جسم B انتخاب میکنیم و شمارههای چهار، پنج و شش را به هر ذره میدهیم.
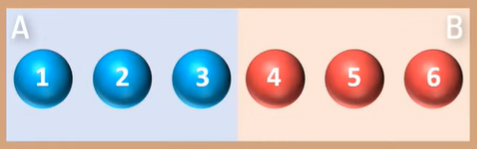
ذرات یک تا سه در جسم A با دمای کمتر قرار دارند، بنابراین انرژی جنبشی کمتری در مقایسه با ذرات چهار تا شش در جسم B دارند. به بیان دیگر، ذرات یک تا ۳ با سرعت بیشتر در مقایسه با ذرات چهار تا شش حرکت میکنند. به این نکته توجه داشته باشید که ذرات در جسم جامد در مکان خود، حول نقطه تعادل نوسان میکنند. بنابراین، هر ذره با ذره مجاور خود برخورد میکند. به هنگام برخورد دو ذره با انرژی جنبشیهای متفاوت، ذرهای که انرژی جنبشی بیشتری دارد، مقداری از انرژی خود را به ذره با انرژی جنبشی کمتر منتقل میکند.
دو ذره سه و چهار در محل تماس دو جسم A و B با یکدیگر قرار دارند. این دو ذره با یکدیگر برخورد میکنند. از آنجا که انرژی جنبشی ذره چهار بیشتر از انرژی جنبشی ذره سه است، این ذره مقداری از انرژی جنبشی خود را به ذره سه میدهد. به بیان دیگر، ذره چهار روی ذره سه کار انجام میدهد. در این حالت، انرژی جنبشی ذره سه افزایش مییابد و بیشتر از انرژی جنبشی ذره دو میشود. هنگامی که ذرههای دو و سه با یکدیگر برخورد میکنند، مقداری از انرژی جنبشی ذره سه به ذره دو منتقل خواهد شد.

اتفاق مشابهی در جسم B رخ میدهد. انرژی جنبشی ذره چهار کمتر از انرژی جنبشی ذره پنج است. زیرا ذره چهار مقداری از انرژی جنبشی خود را در برخورد با ذره سه از دست داده است. اکنون، ذره چهار با ذره پنج برخورد میکند و مقدار از انرژی جنبشی ذره پنج به ذره چهار منتقل میشود. به بیان دیگر، ذره پنج مقداری از انرژی جنبشی خود را به هنگام برخورد با ذره چهار از دست میدهد. اتفاق مشابهی بین ذرات یک و دو و پنج و شش رخ میدهد.
همانطور که دیده میشود مبادله انرژی جنبشی به تدریج گسترش مییابد. اینگونه به نظر میرسد که ذرات در سیستم B با دمای بالاتر، مقداری از انرژی جنبشی خود را به ذرات در سیستم A با انرژی جنبشی کمتر منتقل میکنند. در پایان، انرژی جنبشی ذرات در هر دو جسم با یکدیگر برابر میشوند. از دید ناظر خارجی در اتاق، دمای دو جسم A و B با یکدیگر برابر میشود یا دو جسم با یکدیگر به تعادل گرمایی میرسند.
اگر یک گام به عقبتر برویم و گستردهتر نگاه کنیم، به این نکته پی میبریم که ذرات جسم داغ روی ذرات جسم سرد کار انجام دادهاند. به بیان دیگر، انرژی از جسم داغ به جسم سرد منتقل شده است. به این انتقال انرژی، گرما میگوییم. واحد اندازهگیری انرژی گرمایی، ژول است. به بیان دیگر گرما، کار حاصل از طرف ذرات جسم داغ روی ذرات جسم سرد است:
$$Q = \sum W _ { Particles\ \of \ hotter \ system }$$
در مطالب بالا دیدیم که ذرات جسم داغ روی ذرات جسم سرد کار انجام میدهند و به این کار انجام شده، گرما گفته میشود. در واقع، گرما از جسم با دمای بالاتر به جسم با دمای پایینتر منتقل میشود. انتقال گرما تا جایی ادامه مییابد که دو جسم به دمای یکسانی برسند. در ترمودینامیک چند راه برای توصیف انرژی جنبشی سیستم وجود دارند. در مطالب بالا در مورد یکی از این راهها، یعنی دما، صحبت کردیم. انرژی درونی (U) سیستم راه دیگری برای اندازهگیری انرژی جنبشی سیستم است. به انرژی درونی، انرژی گرمایی نیز گفته میشود.
انرژی گرمایی، جمع انرژی جنبشی تمام مولکولهای داخل سیستم است. به این نکته توجه داشته باشید که دما به صورت انرژی جنبشی متوسط تمام مولکولهای داخل سیستم تعریف میشود. به مقدار انرژی گرمایی که به سیستم اضافه یا از آن گرفته میشود، گرما میگوییم. توصیف گرما برای فردی که هیچ دیدگاهی در مورد آن ندارد بسیار سخت است. دانشمندان برای مدت زمان زیادی گرما را به شکل نوعی سیال معرفی کردند. دلیل این موضوع آن است که گرما همانند سیال میتواند از سیستمی به سیستم دیگر منتقل شود. اما امروزه میدانیم گرما، سیال نیست.
در مطالب بالا فهمیدیم دما و گرما چیستا. همانطور که در بالا اشاره شد، گرما انرژی است که بین سیستمهای مختلف با دماهای متفاوت منتقل و با حرف Q نشان داده میشود. واحد اندازهگیری گرما در زندگی روزمره کالری یا کیلوکالری است. واحد اندازهگیری گرما در سیستم SI با ژول بیان میشود. در بخشهای بعد در مورد واحد اندازه گیری گرما با جرییات بیشتری صحبت خواهیم کرد.
فرمول گرما چیست ؟
گرما، دمای سیستم را تغییر میدهد. مقدار تغییر دما به دو عامل بستگی دارد:
- جرم سیستم: هرچه جرم سیستم بیشتر باشد، به گرمای بیشتری برای تغییر دما نیاز دارد. در واقع، سیستم سنگینتر از ماده بیشتری تشکیل شده است. بنابراین، تغییر انرژی جنبشی متوسط آن به انرژی بیشتری نیاز دارد.
- ظرفیت گرمایی ویژه: گرمای ویژه معیاری از مقدار گرمای ذخیره شده در ماده است. هر مادهای گرمای ویژه خود را دارد. هرچه گرمای ویژه بیشتر باشد، انرژی بیشتری به شکل گرما باید منتقل شود تا دمای ماده تغییر کند. به عنوان مثال، ظرفیت گرمایی ویژه آب بسیار بزرگتر از ظرفیت گرمایی ویژه آلومینیوم است. این بدان معنا است که مقدار گرمای لازم برای تغییر دمای آب بسیار بیشتر از مقدار گرمای لازم برای تغییر دمای آلومینیوم به همان مقدار است.
بنابراین، مقدار گرمای وارد شده یا خارج شده از ماده برابر است با:
در رابطه بالا:
- Q مقدار گرمای وارد شده یا خارج شده از ماده است.
- m جرم ماده است.
- c ظرفیت گرمایی ویژه است.
- میزان تغییر دمای ماده پس از انتقال گرما است.
اگر علامت Q مثبت باشد، گرما به سیستم وارد شده است. در مقابل، علامت منفی برای Q به معنای خروج گرما از سیستم است. تغییر حالت، عامل مهم دیگری است که بر گرما تاثیر میگذارد و به دما مربوط میشود. فرض کنید ده کیلوگرم یخ در دمای منفی ده درجه سانتیگراد در فشار اتمسفر دارید. قالب یخ را داخل ظرفی میگذارید و روی شعله اجاق قرار میدهید، چه اتفاقی رخ میدهد؟ دمای یخ افزایش مییابد.

افزایش دما تا صفر درجه سلسیوس ادامه مییابد، اما با رسیدن دما به این نقطه اتفاق خاصی رخ میدهد. دما پس از رسیدن به صفر درجه سلسیوس افزایش نمییابد. در این حالت، یخ شروع به ذوب شدن میکند. بنابراین، در این دما گرمای اضافه شده به یخ به جای آنکه دمای آن را افزایش دهد، سبب ذوب شدن یخ و تغیر حالت آن از جامد به مایع میشود. پس از آنکه تمام یخ ذوب شد، گرمای اضافه شده سبب افزایش دوباره دما و رسیدن آن به دمای ۱۰۰ درجه سلسیوس میشود. در دمای ۱۰۰ درجه سلسیوس نیز اتفاق مشابهی رخ میدهد.
در این دما نیز، همانند دمای صفر درجه، افزایش دما متوقف و افزودن دما سبب تغییر حالت آب از مایع به بخار (گاز) میشود. تا تبدیل تمام آب به بخار، افزایش دمایی رخ نخواهد داد. بنابراین، به هنگام تغییر فاز یا تغییر حالت ماده نمیتوان از رابطه برای توصیف انتقال گرما استفاده کرد. مقدار انتقال گرما به هنگام تغییر فاز برابر حاصلضرب جرم در گرمای نهان است و به صورت زیر نوشته میشود:
در رابطه فوق:
- Q مقدار گرمای مبادله شده است.
- m جرم ماده است.
- L گرمای نهان است.
به مقدار گرمای لازم برای تغییر حالت ماده، گرمای نهان میگوییم و مقدار آن به ماده موردنظر و تغییر فاز بستگی دارد. به عنوان مثال، به گرمای نهان، به هنگام تغییر حالت از جامد به مایع، گرمای نهان ذوب یا به هنگام تغییر حالت از مایع به گاز، گرمای نهان تبخیر گفته میشود. تا اینجا میدانیم گرما چیست و با استفاده از چه فرمولهایی محاسبه میشود. سوال مهمی که ممکن است مطرح شود آن است که گرما چگونه پخش میشود. پاسخ به این سوال به ما کمک میکند که بفهمیم چرا پوشیدن لباس بسیار مهم و حیاتی است.
راه های انتقال گرما چیست ؟
گرما از سه طریق پخش میشود:
- هدایت یا رسانندگی
- همرفت
- تابش یا تشعشع
در ادامه، در مورد هر یک از راههای انتقال گرما توضیح میدهیم.
هدایت یا رسانندگی در انتقال گرما چیست ؟
هرگاه جسمی گرم میشود، انرژی گرمایی به جسم منتقل میشود و دمای آن افزایش مییابد. همانطور که در مطالب بالا گفتیم، فرایند انتقال گرما میتواند از سه طریق رخ دهد. انتخاب هر یک از این سه راه به محیط انتقال گرما بستگی دارد. گرما در جامدات با استفاده از فرایندی به نام رسانندگی انتقال مییابد. انتقال گرما در مایعات با استفاده از فرایند همرفت رخ میدهد. همچنین، گرما برای آنکه بتواند در فضای خالی از نقطهای به نقطه دیگر منتقل شود باید به شکل تشعشع این کار را انجام دهد. در این بخش در مورد رسانندگی یا انتقال گرما با استفاده از فرایند هدایت صحبت میکنیم.
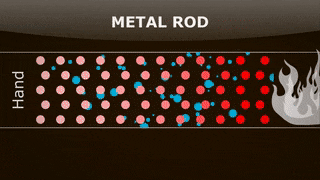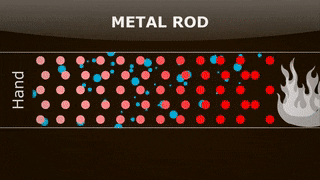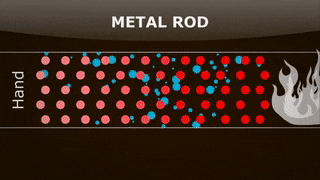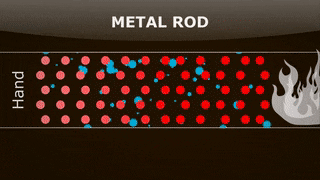
نکته کلیدی و مهم در مورد فرایند همرفت آن است که ذرات ارتعاشی، انرژی را به ذرات مجاور منتقل میکنند. برای درک بهتر این موضوع فرض کنید قطعهای فلزی دارید و انتهای آن را با استفاده از چراغ بنزن یا هر وسیله گرمایشی دیگری گرم میکنید. قطعه فلز را میتوانیم به صورت دستهای از ذرات در نظر بگیریم که به صورت سری و متوالی کنار یکدیگر قرار گرفتهاند. هنگامی که انتهای فلز گرم میشود، انرژی به فلز منتقل میشود یا به بیان علمیتر، انرژی جنبشی ذرات قرار گرفته در انتهای فلز افزایش مییابد.
از اینرو، این ذرات سریعتر حرکت میکنند و با سرعت و انرژی جنبشی بیشتری به ذرات مجاور خود برخورد خواهند کرد. هنگامی که ذره A با انرژی جنبشی زیاد به ذره B با انرژی جنبشی کمتر برخورد میکند، انرژی جنبشی از ذره A به ذره B منتقل میشود. بنابراین، انرژی جنبشی ذره B افزایش مییابد و با سرعت بیشتری حرکت میکند. به طور مشابه، مقداری انرژی جنبشی از ذرات گرم شده انتهای فلز به ذرات مجاور منتقل میشود و این ذرات نیز با سرعت بیشتری به ارتعاش درمیآیند. برخورد ذرات به یکدیگر و انتقال انرژی جنبشی ادامه مییابد. در نتیجه، انرژی به انتهای دیگر فلز منتقل میشود. در پایان، گرما در سراسر فلز به صورت بکنواخت پخش و دما کموبیش در همه جای فلز یکسان خواهد شد.
مثال دیگری را در نظر بگیرید. دمای دو قطعه فلز گرم و سرد به ترتیب برابر ۱۰۰ و ۱۰ درجه سلسیوس است. اگر دو فلز را در تماس با یکدیگر قرار دهیم، چه اتفاقی رخ خواهد داد؟ پس از تماس دو فلز با یکدیگر، گرما از ناحیه گرم به ناحیه سرد منتقل میشود. انتقال گرما تا رسیدن دو فلز به دمای یکسان ادامه مییابد. به بیان دیگر، هنگامی که دو فلز به دمای یکسانی میرسند، تعادل گرمایی رخ میدهد. آیا انتقال گرما در تعادل گرمایی رخ میدهد؟ در تعادل گرمایی، گرما بین دو جسم منتقل میشود، اما انتقال گرما به گونهای رخ میهد که انتقال کل گرما برابر صفر باشد.

انتقال گرما در برخی مواد بهتر از مواد دیگر رخ میدهد. فلزات رسانای خوب گرما هستند و آن را به خوبی منتقل میکنند. الماس انرژی گرمایی را به خوبی منتقل میکند. به موادی که گرما را از خود عبور نمیدهند، عایق گفته میشود. به عنوان مثال، چوب عایق گرما است. آیا تاکنون به ماهیتابهای که به هنگام پخت غذا استفاده میکنید دقت کردهاید؟ جنس ماهیتابه از فلز و جنس دسته آن از مادهای عایق مانند چوب است. بنابراین، گرمای شعله از طریق فلز به خوبی به مواد غذایی منتقل میشود. همچنین، شما به راحتی با گرفتن دسته ماهیتابه میتوانید آن را از روی شعله بردارید.

مفهومی به نام رسانندگی گرمایی وجود دارد و واحد اندازهگیری آن است. رسانندگی گرمایی میزان انتقال گرما توسط رسانش را نشان میدهد. از آنجا که فلزات رسانای خوبی برای انتقال گرما هستند، مقدار رسانندگی گرمایی بالایی دارند. به عنوان مثال، رسانندگی گرمایی مس برابر است. آب به خوبی مس گرما را از خود عبور نمیدهد. بنابراین، رسانندگی گرمایی آن از مس بسیار کمتر و برابر است. در مطالب بالا گفتیم چوب عایق گرما است، بنابراین مقدار رسانندگی گرمایی آن از بسیار کوچک و برابر خواهد بود. پشم شیشه یکی از بهترین عایقهای حرارتی و مقدار رسانندگی گرمایی آن از مس بسیار کمتر و برابر است.
هوا، عایق حرارتی بهتری نسبت پشم شیشه و مقدار رسانندگی گرمایی آن برابر است. به این نکته توجه داشته باشید که عدد برای هوای ساکن صحیح خواهد بود. اگر هوا حرکت کند، انتقال گرما میتواند رخ دهد. به عنوان مثال، فرض کنید زمستان است و شما در بیرون از خانه بازی و وزیدن نسیمی ملایم را احساس میکنید. اگر نسیم به صورت شما برخورد کند، سرمای شدیدی را احساس خواهید کرد. در واقع، نسیم گرما را از بدن شما میگیرد و آن را با خود به نقطه دیگری منتقل میکند. بنابراین، دمای بدن کاهش مییابد. به این نکته توجه داشته باشید که اگر نسیم به شما برخورد نکند، سرمای زیادی را احساس نخواهید کرد.

شاید از خود بپرسید چرا گرما در برخی مواد جامد مانند مس به خوبی منتقل میشود. دلیل این موضوع آن است که ذرات در ماده جامد در فاصله بسیار نزدیکی از یکدیگر قرار دارند. این بدان معنا است که برخوردهای زیادی بین ذرات رخ میدهد و انرژی به خوبی بین آنها منتقل میشود. ذرات در مواد مایع یا گاز در فاصله دورتری نسبت به یکدیگر قرار گرفتهاند. بنابراین، تعداد برخودهای رخ داده بین آنها بسیار کمتر است.
همرفت در انتقال گرما چیست ؟
در بخش قبل فهمیدیم نقش رسانندگی در انتقال گرما چیست. گرما توسط روش دیگری به نام همرفت نیز میتواند منتقل شود. همانطور که دیدیم انتقال گرما در ماده جامدی مانند مس بسیار متفاوت از انتقال گرما در سیالی مانند هوا است. انتقال گرما در سیال از طریق روشی به نام همرفتی انجام میشود. به این نکته توجه داشته باشید که به هر چیزی که بتواند جریان داشته باشد، سیال میگوییم. بنابراین، گاز و مایع را میتوانیم به عنوان سیال یا شاره در نظر بگیریم.
هوا نوعی سیال است. در مطالب بالا اشاره شد که هوای ساکن رسانای خوبی برای انتقال گرما نیست. هوا در صورت حرکت میتواند گرما را از نقطهای به نقطه دیگر منتقل کند. به همین دلیل، در صورت وزش نسیمی هرچند اندک در روز گرم تابستان و برخورد آن با صورت خود، احساس سرمای مطبوعی به شما دست میدهد. زیرا هوا پس از برخورد با بدن شما، مقداری گرما را دریافت و به نقطه دیگری منتقل میکند. همرفت هنگامی رخ میدهد که گرما توسط حرکت سیال، مایع یا گاز، منتقل شود.
بِشِری را در بردارید و داخل آن مقداری آب بریزید. سپس، آن را روی شعله قرار دهید. مولکولهای آب در نزدیکی شعله و کف بِشِر، گرم میشوند. این مولکولها پس از گرم شدن به قسمت بالای ظرف حرکت میکنند و سرد میشوند. در نتیجه، مولکولهای آبِ گرم به سمت بالا و مولکولهای سرد به سمت پایین حرکت میکنند. اتفاق مشابهی برای مولکولهای هوا نیز رخ میدهد. زمین در روزهای داغ تابستان بسیار داغ است. هوای داغ نزدیک به زمین به سمت بالا حرکت میکند و پس از دور شدن از سطح زمین، سرد میشود.
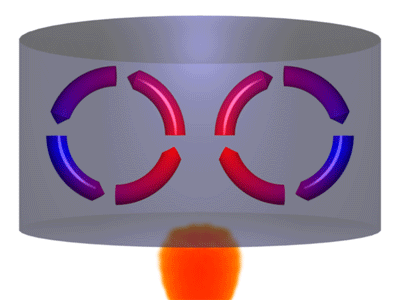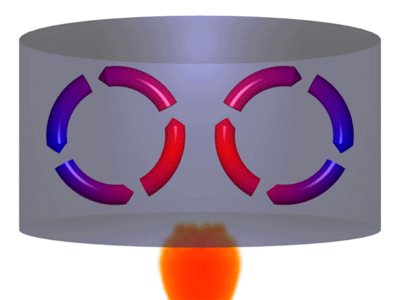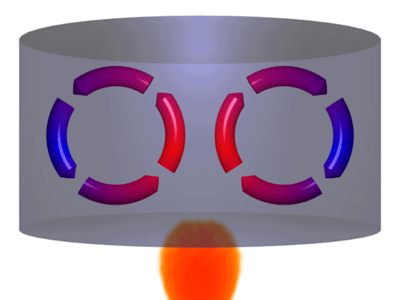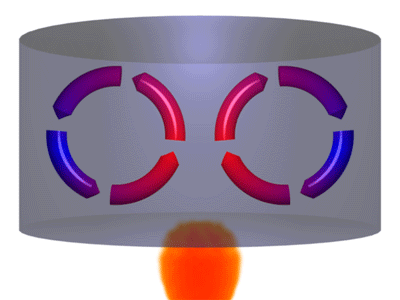
مولکولهای هوای سرد به سمت پایین حرکت میکنند. چرا هوای گرم به سمت بالا حرکت میکند؟ زیرا چگالی هوای گرم، کمتر از چگالی هوای سرد است. هر زمان گاز یا هوا را گرم کنید، مولکولها منبسط میشوند. در نتیجه، مقدار جرم در واحد حجم، یا چگالی، کاهش مییابد. بنابراین، از آنجا که هوای گرم سبکتر از هوای سرد است، هوای گرم به سمت بالا و هوای سرد به سمت پایین حرکت میکند. برای درک بهتر مفهوم همرفتی به مثال زیر توجه کنید. اگر فلزی را داخل آب بیاندازید، فلز به دلیل داشتن چگالی بیشتر نسبت به آب، داخل آن فرو میرود. اما چوب روی آب شناور میماند، زیرا چگالی آن کمتر از آب است.

ذرات در سیال در مکان ثابتی قرار ندارند. بنابراین، این ذرات پس از گرم شدن و کسب انرژی، با سرعت بیشتری حرکت خواهند کرد. ذرات گرمتر به دلیل فرایند نفوذ تصادفی از ناحیه گرمتر دور میشوند و به سمت نواحی با دمای پایینتر حرکت میکنند. این بدان معنا است که پراکندگی ذرات پرانرژی در نواحی گرمتر بیشتر از پراکندگی آنها در نواحی سردتر است. بنابراین، سیال در ناحیه گرمتر با گرم شدن منبسط میشود و چگالی آن کاهش مییابد. برای درک بهتر پدیده همرفت در انتقال گرما، دو آزمایش ساده را در ادامه با یکدیگر انجام میدهیم.
آزمایش شماره یک همرفتی
پدیده همرفتی دیده نمیشود، اما با استفاده از روشهای ساده میتوان آن را مشاهده کرد. وسایل موردنیاز برای انجام این آزمایش عبارت هستند از:
- ظرفی به شکل مستطیل که تا نیمه از آب سرد پر شده است.
- رنگ غذا در دو رنگ آبی و قرمز. از رنگ قرمز برای نشان دادن نواحی گرم و از رنگ آبی برای نشان دادن نواحی سرد استفاده میشود.
- پایه برای قرار دادن ظرف آب روی آنها
ظرفی مستطیلی را تا نیمه از آب سرد پر میکنیم و آن را به شکل نشان داده شده در تصویر زیر روی چهار پایه قرار میدهیم.

سه قطره رنگ غذا، دو قطره آبی و یک قطره قرمز، به شکل نشان داده شده در تصویر زیر در آب سرد میریزیم. رنگ قرمز را در وسط ظرف و دو قطره رنگ آبی را در طرفین رنگ قرمز میچکانیم. همانطور که گفتیم رنگ قرمز نشاندهنده ناحیه گرم و رنگ آبی نشاندهنده ناحیه سرد است.

در ادامه، لیوانی را از آب داغ پر میکنیم و آن را به صورت نشان داده شده در تصویر، زیر ظرف آبِ سرد (ناحیه قرمزرنگ) قرار میدهیم. اگر از نزدیک به ناحیه قرمزرنگ نگاه کنیم به این نکته پی میبریم که پس از مدت زمان کوتاهی ناحیه قرمزرنگ به سمت بالا حرکت میکند.

در مطالب بالا گفتیم گرما از ناحیه با دمای بالاتر به ناحیهای با دمای کمتر منتقل میشود. بنابراین، گرما از لیوان حاوی آب داغ به ظرف حاوی آب سرد منتقل خواهد شد. پس از گذشت مدت زمان کوتاهی میبینیم رنگ قرمز به سمت بالا حرکت میکند، زیرا آب در این ناحیه گرمتر و چگالی آن نسبت به آب سردِ اطراف کمتر میشود. رنگ قرمز به سمت بالا حرکت و رنگ آبی با دمای کمتر و چگالی بیشتر جای آن را پر میکند.

آزمایش شماره دو همرفتی
وسایل موردنیاز برای انجام این آزمایش عبارت هستند از:
- مقوا
- شمع
- لیوان کاغذی که با برنج پر شده است.
- مقوای نازک
- مداد
- خطکش
- قیچی
- کبریت
با استفاده از خطکش روی مقوای ضخیم مستطیلی به عرض ۱۰ سانتیمتر و طول ۴۰ سانتیمتر رسم میکنیم. سپس مستطیل را به سه قسمت تقسیم میکنیم:
- دو مربع
- یک مستطیل
سپس مقوا را به شکل نشان داده شده در تصویر زیر میبریم و آن را از طرفین تا میزنیم. به این نکته توجه داشته باشید که دو مربع در دو انتها و مستطیل در وسط قرار گرفتهاند.

در ادامه، مقوای نازکتر را برمیداریم و دایرهای به قطر ۱۵ سانتیمتر روی آن رسم میکنیم. سپس سه خط داخل دایره به گونهای رسم میکنیم که آن را به ۶ قسمت مساوی تقسیم کنند. سپس دایرهای کوچکتر را در مرکز دایره بزرگتر رسم و دایره بزرگ را به شکل نشان داده شده در تصویر زیر قیچی میکنیم.

هر یک از قسمتهای بریده شده در تصویر بالا را کمی تا میزنیم به گونهای که دایره به شکل چتر در بیاید. سپس دایره بریده شده را از قسمت مرکز را باید روی مداد به گونهای قرار دهیم که تعادل آن حفظ شود. در ادامه، لیوان حاوی برنج را برمیداریم و مداد را از قسمت انتها داخل آن و سپس، دایره بریده شده را از قسمت مرکز روی نوک مداد قرار میدهیم.

شمعها را به صورت نشان داده شده در تصویر، زیر مقوای دایرهای قرار میدهیم و آنها را با استفاده از کبریت روشن میکنیم. شاید از خود پرسیده باشید مقوای ضخیمی که بریدیم، کجا به درد میخورد. این مقوا را میتوانیم در اطراف شمعها قرار دهیم. بدینصورت، نتیجه آزمایش را بهتر مشاهده میکنیم.

پس از روشن کردن شمعهای چه اتفاقی رخ میدهد؟ مقوای نازک شروع به حرکت و چرخیدن میکند. چرا مقوا میچرخد؟ زیرا هوای نزدیک شمعها گرم و منبسط و در نتیجه چگالی آن در مقایسه با هوای سرد کمتر میشود. بنابراین، به سمت بالا حرکت میکند و بر دایره مقوایی نیرو وارد میکند.
تا اینجا میدانیم گرما چیست و چگونه با استفاده از دو روش هدایت و همرفت از نقطهای به نقطه دیگر منتقل میشود. در ادامه، در مورد سومین روش برای انتقال گرما، یعنی تابش یا تشعشع، از نقطهای به نقطه دیگر صحبت میکنیم.
تا اینجا میدانیم دو روش مهم در انتقال گرما چیست. در این دو روش برای انتقال گرما به محیط مادی نیاز است. در ادامه، با روش سومِ انتقال گرما آشنا میشویم.
تشعشع در انتقال گرما چیست؟
تا اینجا فهمیدیم نقش همرفتی و رسانندگی در انتقال گرما چیست. تشعشع یکی دیگر از راههای انتقال گرما است. تشعشع هنگامی رخ میدهد که گرما در محیط تهی با استفاده از امواج الکترومعاطیسی منتقل میشود. خورشید، بهترین مثال برای توضیح در این مورد است. انرژی گرمایی خورشید در فضای تهی منتقل میشود. دمای زمین پس از دریافت انرژی گرمایی از خورشید، افزایش مییابد. هنگام شب، زمین امواج فروسرخ تابش میکند. بنابراین دمای زمین به هنگام شب کاهش مییابد. در حقیقت، خورشید، تنها جسمی نیست که تابش میکند. هر جسمی با دمای بالاتر از صفر کلوین، نوعی تشعشع از خود تابش میکند.

حتی ما نیز شکلی از تشعشع را از خود ساطع میکنیم. این تشعشع به شکل امواج فروسرخ است. اگر دمای جسمی افزایش یابد، میزان تشعشع آن نیز افزایش خواهد یافت. فرض کنید قطعهای فلز آهن داریم. اگر دمای آن را با گرما دادن تا ۹۰۰ درجه سلسیوس افزایش دهیم، رنگ آن قرمز میشود. بنابراین، امواج فروسرخ و حتی نور قرمز تابش میکند. اگر دمای قطعه آهن را بیشتر و تا ۳۰۰۰ درجه سلسیوس افزایش دهیم، نور مریی و حتی نور سفید تابش خواهد کرد. بنابراین، میزان تشعشع جسم با دمای آن رابطه مستقیم دارد. هرچه دما بالاتر باشد، میزان تشعشع نیز زیادتر خواهد بود.

دمای سطح خورشید در حدود ده هزار کلوین است. به طور حتم، خورشید با این دمای بسیار بالا، مقدار زیادی نور تابش میکند. دمای مرکز خورشید حتی از این دمای بسیار بالاتر و در حدود چند میلیون کلوین است. در مطالب بالا گفتیم هر جسمی با دمای بالاتر از صفر مطلق، صفر کلوین، به طور پیوسته امواج الکترومغناطیسی تابش میکند. این امواج میتوانند در فضا با سرعت نور حرکت کنند. امواج الکترومغناطیسی، تابش گرمایی (تابش حرارتی) تولید میکنند. تابش گرمایی نیز همانند همرفت و رسانندگی یکی از راههای انتقال گرما بین اجسام مختلف است.
دانشمندان باید بتوانند تابش گرمایی را شبیهسازی کنند. بهترین راه برای شروع این کار آن است که به امواج الکترومغناطیسی و رفتار آنها دقت کنیم.
- نخستین نکته در مورد امواج الکترومغناطیسی آن است که پس از تابش از منبع تشعشع روی خط مستقیم حرکت میکنند.
- این امواج میتوانند در خلأ منتشر شوند.
- تابش گرمایی، برخلاف همرفت و رسانندگی، میتواند در غیاب محیط مادی نیز رخ دهد.
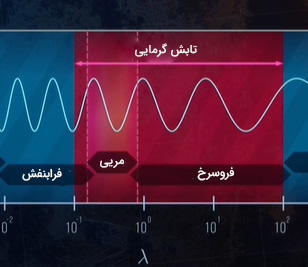
امواج الکترومغناطیسی توسط طول موجشان، ، شناسایی میشوند. به عنوان مثال، امواج رادیویی امواج الکترومغناطیسی با طول موج بسیار بلند یا اشعه گاما و اشعه ایکس، امواج الکترومغناطیسی با طول موج بسیار کوتاه هستند. طول موج نور مریی بین ۰/۴ تا ۰/۷ میکرومتر است.
طول موج تابش گرمایی تابیده شده از جسمی دلخواه بین ۰/۱ تا ۱۰۰ میکرومتر متغیر است. از اینرو، این تابش با امواج فروسرخ، نور مریی و بخشی از امواج فرابنفش همپوشانی دارد.
به مقدار انرژی تابیده شده توسط هر جسم در هر ثانیه بر واحد سطح، قدرت نشر، E، گفته میشود. واحد اندازهگیری این کمیت، وات بر مترمربع است. برای مطالعه تابش گرمایی، تابنده یا ساطعکننده ایدهالی را تعریف میکنیم. این ساطعکننده در دمای مشخص T بیشینه تابش گرمایی را از خود تابش میکند. به این جسم فرضی ایدهال، جسم سیاه میگوییم. میزان تابش هیچ جسم واقعی نمیتواند از میزان تابش جسم سیاه بیشتر باشد.
قدرت نشر جسم سیاه را میتوانیم با استفاده از قانونی بسیار ساده، به نام قانون استفان-بولتزمن، بهدست آوریم:
در رابطه بالا:
- T دمای سطح جسم برحسب کلوین است.
- ثابتی به نام ثابت استفان-بولتزمن و مقدار آن برابر است.
حاصلضرب قدرت نشر در مساحت سطح جسم به ما نرخ انتقال گرما را میدهد.
به عنوان مثال، جسم سیاه کروی به شعاع ۳۰ سانتیمتر و در دمای ۳۰۰ کلوین، گرما را با نرخ ۵۲۰ وات یا ۵۲۰ ژول بر ثانیه تابش میکند. همانطور که در رابطه استفان-بولتزمن دیده میشود دما با توان ۴ تغییر میکند. این بدان معنا است که جسمی با دمای بالا مقدار قابلتوجهی گرما در مقایسه با جسمی با دمای پایین ساطع میکند. به عنوان مثال، اگر دمای کره را از ۳۰۰ کلوین به ۶۰۰ کلوین افزایش دهیم، نرخ تابش در هر ثانیه به مقدار ۸۳۱۰ وات افزایش مییابد.
الکترومغناطیس تابیده شده به دلیل تابش گرمایی، طول موج یکسانی ندارد. انرژی تابیده شده از جسم سیاهی با دمای ۳۰۰ کلوین به شکل امواج الکترومغناطیس با طول موج متغیری بین ۲ تا ۵۰ میکرومتر است. تغییرات انرژی تابیده شده از جسم سیاهی با دمای ۳۰۰ کلوین برحسب طولموج در تصویر زیر نشان داده شده است.
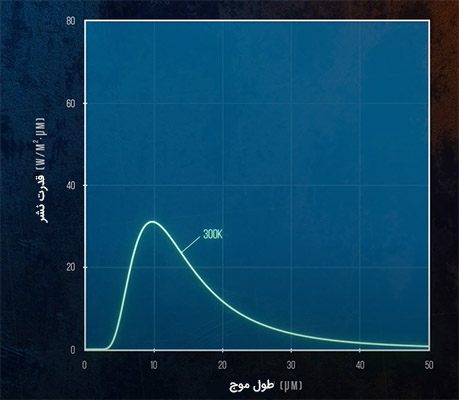
در مطالب بالا گفتیم قدرت نشر با استفاده از قانونی با نام قانون استفان-بولتزمن بهدست میآید. این رابطه همچنین میتواند با استفاده از نمودار بالا و جمع تمام طول موجها یا محاسبه مساحت زیر نمودار بهدست آید. در دمای ۳۰۰ کلوین، هیچ انرژی تابیده شدهای در قسمت مریی طیف امواج الکترومغناطیسی قرار نگرفته است. با افزایش دما، کل انرژی تابیده شده از جسم سیاه به سرعت افزایش مییابد. بنابراین، برای آنکه بتوانیم نمودارهای مختلف را در دماهای مختلف با یکدیگر مقایسه کنیم، باید نمودارها را در مقیاس لگاریتمی رسم کنیم.
با افزایش دما، نمودار نشان داده شده در تصویر بالا به سمت چپ حرکت میکند. این بدان معنا است که هرچه دما زیادتر شود، قدرت نشر جسم سیاه به سمت طولموجهای کوتاهتر حرکت میکند. به بیان دیگر، سهم طول موجهای کوتاهتر در انرژی تابیده شده از جسم سیاه بیشتر میشود. در دمایی در محدوده ۷۰۰ کلوین به قسمت مریی طیف امواج الکترومغناطیس میرسیم. به همین دلیل، اجسام با افزایش دما میدرخشند.
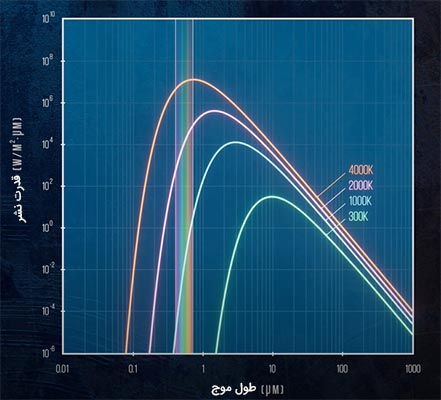
سطح خورشید را میتوان به جسم سیاهی با دمای ۵۸۰۰ کلوین شبیهسازی کرد. قسمت بیشتر تابش گرمایی خورشید در محدوده مریی است. اما قسمتی از انرژی تابیده شده از خورشید نیز در محدود امواج فرابنفش و فروسرخ قرار میگیرد. طول موجی که در آن بیشترین تابش گرمایی رخ میدهد بسیار جالبتوجه است. این طول موج با تغییرات دما، تغییر و از قانونی به نام قانون جابجایی وین تبعیت میکند. از این قانون اغلب در نجوم استفاده میشود. توزیع انرژی نشان داده شده در تصویر بالا برحسب طول موج، تنها برای جسم سیاه به کار برده میشود.
توجه به این نکته مهم است که جسم سیاه، حالت ایدهال است. گرچه برخی اجسام واقعی نیز رفتاری مشابه رفتار جسم سیاه از خود نشان میدهند، نمودار تابش گرمایی این اجسام برحسب طول موج با نمودار جسم سیاه متفاوت است. همانطور که در تصویر زیر دیده میشود تابش کل تابیده شده از جسم واقعی کمتر از جسم سیاه است، زیرا فاکتورهای بسیاری در جسم سیاه در نظر گرفته نشدهاند.
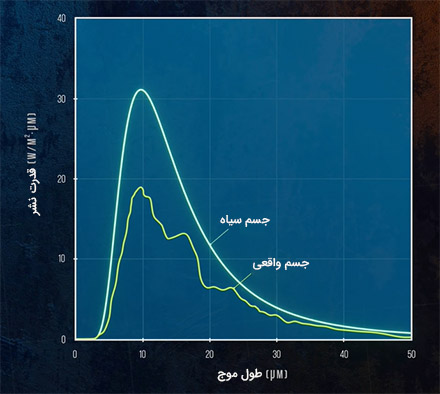
تا اینجا میدانیم سه روش مهم برای انتقال گرما چیست. برای انتقال گرما در دو روش رسانندگی و همرفت به ذرات یا محیط مادی نیاز داریم. اما در روش تشعشع، گرما بدون نیاز به محیط مادی از نقطهای به نقطه دیگر منتقل میشود.
مهم ترین روش های انتقال گرما چیست ؟
رسانندگی، همرفت و تشعشع سه روش مهم در انتقال گرما از نقطهای به نقطه دیگر هستند.
واحد اندازه گیری گرما چیست ؟
تا اینجا میدانیم گرما چیست و به چه روشهایی منتقل میشود. بیشتر ما با عبارت گرما آشنا هستیم و اثر آن را در زندگی روزمره تجربه کردهایم. از دیدگاه علمی، گرما شکلی از انرژی است که دمای ماده را تغییر میدهد. گرما را با نماد Q نشان میدهیم و همانطور که در مطالب بالا نشان دادیم با استفاده از رابطه زیر بهدست میآید:
واحد اندازهگیری گرما در سیستم SI، ژول است. از آنجا که گرما نیز شکلی از انرژی است، واحد اندازهگیری آن در SI، ژول خواهد بود. به مقدار انرژی لازم برای افزایش دمای جرم داده شده به اندازه یک درجه، ژول میگوییم. مقدار گرمای لازم برای افزایش یک واحد وزنی آب (معمولا یک گرم) برابر ۴/۱۸۴ ژول است. دیگر واحدهای اندازهگیری گرما عبارت هستند از:
- BTU: از این واحد در سیستم انگلیسی برای اندازهگیری دما استفاده میشود. BTU مقدار انرژی لازم برای افزایش دمای یک پوند آب به اندازه یک درجه فارنهایت در سطح دریا است.
- کالری: کالری مقدار انرژی لازم برای افزایش دمای یک گرم آب به اندازه یک درجه سانتیگراد است.
جدول زیر تبدیل واحدهای اندازهگیری گرما به یکدیگر را نشان میدهد.
| کالری | ||
| ژول | ||
| BTU |
مثال اول تبدیل واحد گرما
سارا با استفاده از تکنیک کالری شماری مقدار کالری روزانه موردنیاز خود را در حدود ۱۸۴۲ کیلوکالری بهدست آورده است. این مقدار برابر چند ژول است؟
پاسخ
یک کیلو کالری برابر ۴۱۸۶/۶ ژول است. در نتیجه، ۱۸۴۲ کیلوکالری برابر ژول یا ژول است.
مثال دوم تبدیل واحد گرما
سارا با استفاده از تکنیک کالری شماری مقدار کالری روزانه موردنیاز خود را در حدود بهدست آورده است. این مقدار برابر چند کالری است؟
پاسخ
یک کیلوکالری برابر ۴۱۸۶/۶ ژول است. در نتیجه، ژول برابر کالری یا ۱۵۰۹ کیلوکالری است.
تبدیل واحد دما
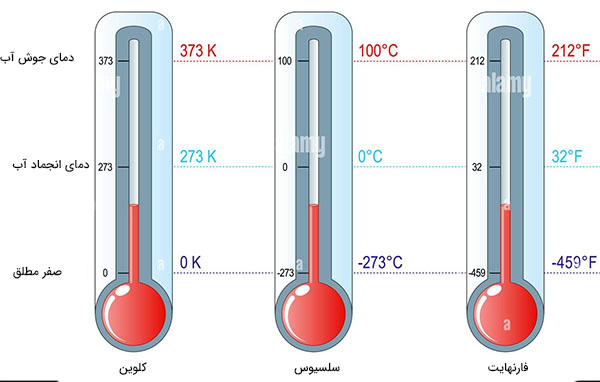
دما را به صورت انرژی جنبشی متوسط مولکولهای تشکیلدهنده جسم تعریف کردیم. گرما شکلی از انرژی است که به صورت خودبهخودی به دلیل تفاوت دمای دو جسم، بین آنها منتقل میشود و از جسمی با دمای بالاتر به جسمی با دمای پایینتر میرود. در مطالب بالا در مورد واحدهای اندازهگیری گرما و چگونگی تبدیل آنها به یکدیگر صحبت کردیم. آشنایی با واحدهای اندازهگیری دما و چگونگی تبدیل آنها به یکدیگر نیز خالی از لطف نیست. رایجترین واحدهای اندازهگیری دما عبارت هستند از:
- سلسیوس
- کلوین
- فارنهایت
تبدیل واحد از سلسیوس به کلوین
برای تبدیل واحد از سلسیوس به کلوین از رابطه زیر استفاده میکنیم:
در رابطه فوق:
- K دمای داده شده برحسب کلوین است.
- C دمای داده شده برحسب سلسیوس است.
مثال تبدیل واحد از سلسیوس به کلوین
آب در دمای ۱۰۰ درجه سلسیوس به جوش میآید و در دمای صفر درجه سلسیوس یخ میزند. این دو دما را برحسب درجه کلوین بهدست آورید.
پاسخ
برای تبدیل واحد از سلسیوس به کلوین از رابطه زیر استفاده میکنیم:
۱۰۰ درجه سلسیوس برحسب کلوین برابر است با:
صفر درجه سلسیوس برحسب کلوین نیز برابر است با:
تبدیل واحد از کلوین به سلسیوس
برای تبدیل واحد از کلوین به سلسیوس از رابطه زیر استفاده میکنیم:
مثال تبدیل واحد از کلوین به سلسیوس
آب در دمای ۳۷۳ درجه سلسیوس به جوش میآید و در دمای ۲۷۳ درجه سلسیوس یخ میزند. این دو دما را برحسب درجه سلسیوس بهدست آورید.
پاسخ
برای تبدیل واحد اندازهگیری دما از کلوین به سلسیوس از رابطه زیر استفاده میکنیم:
۱۰۰ درجه سلسیوس برحسب کلوین برابر است با:
صفر درجه سلسیوس برحسب کلوین نیز برابر است با:
تبدیل واحد از سلسیوس به فارنهایت
برای تبدیل واحد از سلسیوس به فارنهایت از رابطه زیر استفاده میکنیم:
در رابطه فوق:
- F دمای داده شده برحسب فارنهایت است.
- C دمای داده شده برحسب سلسیوس است.
مثال تبدیل واحد از سلسیوس به فارنهایت
آب در دمای ۱۰۰ درجه سلسیوس به جوش میآید و در دمای صفر درجه سلسیوس یخ میزند. این دو دما را برحسب درجه فارنهایت بهدست آورید.
پاسخ
برای تبدیل واحد از سلسیوس به فارنهایت از رابطه زیر استفاده میکنیم:
۱۰۰ درجه سلسیوس برحسب فارنهایت برابر است با:
صفر درجه سلسیوس برحسب فارنهایت برابر است با:
تبدیل واحد از فارنهایت به سلسیوس
برای تبدیل واحد از فارنهایت به سلسیوس از رابطه زیر استفاده میکنیم:
مثال تبدیل واحد از فارنهایت به سلسیوس
آب در دمای ۲۱۲ درجه فارنهایت به جوش میآید و در دمای ۳۲ درجه فارنهایت یخ میزند. این دو دما را برحسب درجه فارنهایت بهدست آورید.
پاسخ
برای تبدیل واحد از فارنهایت به سلسیوس از رابطه زیر استفاده میکنیم:
۲۱۲ درجه فارنهایت برحسب سلسیوس برابر است با:
۳۲ درجه فارنهایت برحسب سلسیوس برابر است با:
تبدیل واحد از کلوین به فارنهایت
برای تبدیل واحد از کلوین به فارنهایت از رابطه زیر استفاده میکنیم:
مثال تبدیل واحد از کلوین به فارنهایت
آب در دمای ۳۷۳ درجه کلوین به جوش میآید و در دمای ۲۷۳ درجه کلوین یخ میزند. این دو دما را برحسب درجه فارنهایت بهدست آورید.
پاسخ
برای تبدیل واحد از کلوین به فارنهایت از رابطه زیر استفاده میکنیم:
۳۷۳ درجه کلوین برحسب فارنهایت برابر است با:
۲۷۳ درجه کلوین برحسب فارنهایت برابر است با:
تبدیل واحد از فارنهایت به کلوین
برای تبدیل واحد از فارنهایت به کلوین از رابطه زیر استفاده میکنیم:
مثال تبدیل واحد از فارنهایت به کلوین
آب در دمای ۲۱۲ درجه فارنهایت به جوش میآید و در دمای۳۲ درجه فارنهایت یخ میزند. این دو دما را برحسب کلوین بهدست آورید.
پاسخ
برای تبدیل واحد از فارنهایت به کلوین از رابطه زیر استفاده میکنیم:
۲۱۲ درجه فارنهایت برحسب کلوین برابر است با:
۳۲ درجه فارنهایت برحسب کلوین برابر است با:
اندازه گیری گرمای واکنش های شیمیایی
تا اینجا با مفهوم گرما آشنا شدیم و در مورد راههای انتقال گرما صحبت کردیم. در این قسمت، در مورد گرمای واکنشهای شیمیایی و چگونگی محاسبه آن صحبت میکنیم. ابتدا باید بدانیم گرمای واکنش شیمیایی چیست. به کل انرژی آزاد شده یا جذب شده به هنگام انجام واکنش شیمیایی، گرمای واکنش گفته میشود.
گرمای واکنش برابر تفاضل جمع انرژی آزاد شده یا جذب شده توسط محصولات واکنش و جمع انرژی آزاد شده یا جذب شده توسط واکنشدهندهها است.
$$\triangle H _ {heat \of reaction } = \sum _ { \triangle H } [products] - \sum _ { \triangle H } [reactants] $$
در رابطه فوق:
- $$\triangle H _ {heat \ \of \ reaction } $$
- : انرژی گرمایی محصولات واکنش و برابر مقدار انرژی کل آزاد شده یا جذب شده توسط محصولات به هنگام انجام واکنش شیمیایی است.
- : انرژی گرمایی واکنشدهندهها و برابر مقدار انرژی کل آزاد شده یا جذب شده توسط واکنشدهندهها به هنگام انجام واکنش شیمیایی است.
مقدار انرژی گرمایی کل واکنش (برحسب کیلوژول بر مول) که به هنگام تشکیل یک مول ترکیب شیمیایی تک، جذب یا آزاد میشود، در جدولی به نام جدول تشکیل گرما نشان داده میشود. مقدار گرمای تشکیل تمام عناصر برابر صفر است. گرمای تشکیل برخی ترکیبهای شیمیایی در دمای ۲۵ درجه سلسیوس و فشار یک اتمسفر در جدول زیر نشان داده شده است.
| ترکیب شیمیایی | گرمای تشکیل برحسب کیلوژول بر مول |
| (s) | |
به عنوان مثال، ترکیب جامد را در جدول بالا در نظر بگیرید. عدد نوشته شده جلوی این ترکیب برابر ۱۶۶۹/۸- کیلوژول بر مول است. این عدد چه چیزی را نشان میدهد؟ ابتدا به این نکته توجه داشته باشید که علامت منفی به معنای از دست دادن گرما و علامت مثبت به معنای گرفتن گرما است. در نتیجه، به ازای تشکیل هر مول ، مقدار ۱۶۶۹/۸- کیلوژول گرما آزاد میشود.
پرسش: عدد نوشته شده جلوی ترکیب گازی برابر ۲۵/۹ کیلوژول بر مول است. این عدد چه چیزی را نشان میدهد؟
پاسخ: به ازای تشکیل هر مول ، مقدار ۲۵/۹ کیلوژول گرما جذب میشود. علامت مثبت به معنای گرفتن گرما است.
جدول بالا بسیار گسترده است و ترکیبهای شیمیایی بسیاری را میتوانیم به آن اضافه کنیم. با استفاده از این جدول میتوانیم مقدار انرژی گرمایی کل جذب شده یا آزاد شده به هنگام انجام واکنشهای شیمیایی مختلف را بهدست آوریم. این نکته را در خاطر داشته باشید که انرژی گرمای تشکیل عناصر همواره برابر صفر است. به عنوان مثال، انرژی گرمای تشکیل اکسیژن، ید یا هیدروژن برابر صفر است. تا اینجا میدانیم:
- گرما چیست.
- واحد اندازهگیری گرما چیست.
- راههای انتقال گرما چیست.
- گرمای واکنش شیمیایی چیست و چگونه محاسبه میشود.
در ادامه، برای آشنایی با چگونگی محاسبه گرمای واکنشهای شیمیایی، چند مثال را با یکدیگر حل میکنیم.
مثال اول محاسبه گرمای واکنش
گرمای واکنش شیمیایی زیر را بهدست آورید:
پاسخ
در این واکنش، یک مول گاز پروپان با ۵ مول گاز اکسیژن واکنش میدهد و ۳ مول گاز کربندیاکسید و ۴ مول بخار آب تولید میشود. در این مثال میخواهیم مقدار انرژی گرمایی کل آزاد شده یا جذب شده به هنگام انجام این واکنش را بهدست آوریم. برای انجام این کار باید از جدول گرمای تشکیل ترکیبهای شیمیایی مختلف استفاده کنیم. اطلاعات لازم را با استفاده از اینترنت یا کتابهای درسی مختلف میتوانیم به راحتی بهدست آوریم. گرمای واکنش با استفاده از رابطه زیر بهدست میآید:
$$\triangle H _ {heat \of reaction } = \sum _ { \triangle H } [products] - \sum _ { \triangle H } [reactants] $$
ابتدا به محصولات واکنش دقت میکنیم. محصولات این واکنش عبارت هستند از:
- سه مول
- چهار مول بخار آب
تعداد مولهای هر یک از محصولات بالا را در گرمای تشکیل آنها ضرب میکنیم. گرمای تشکیل برابر ۳۹۳/۵- کیلوژول بر مول و گرمای تشکیل بخار آب برابر ۲۴۲/۸- کیلوژول بر مول است.
رابطه (۱)
در ادامه، به واکنشدهندهها دقت میکنیم. واکنشدهندههای این واکنش عبارت هستند از:
- یک مول
- پنج مول گاز اکسیژن
تعداد مولهای هر یک از واکنشدهندهها را در گرمای تشکیل آنها ضرب میکنیم. گرمای تشکیل برابر ۱۰۳/۸- کیلوژول بر مول و گرمای تشکیل گاز اکسیژن برابر صفر کیلوژول بر مول است.
رابطه (۲)
رابطه (۲) را از رابطه (۱) کم میکنیم:
$$\triangle H _ {heat \of reaction } = [ ( 3 mol CO_ 2) \times ( - 393.5 \frac { kJ } { mol} ) + ( 4 mol H_ 2 O) \times ( - 241.8 \frac { kJ } { mol} )] - [ ( 1 mol C_ 3 H _ 8) \times ( - 103.8 \frac { kJ } { mol} ) + ( 5 mol O_2) \times ( 0 \frac { kJ } { mol} )] $$
پس از انجام محاسبات، گرمای کل واکنش برابر ۲۰۴۳/۹- کیلوژول بهدست میآید. علامت منفی بدان معنا است که به هنگام انجام این واکنش شیمیایی و تشکیل و بخار آب، گرما آزاد میشود. به بیان دیگر، واکنش واکنشی گرماده است.
مثال دوم محاسبه گرمای واکنش
اگر در واکنش شیمیایی زیر ۱۰/۰ گرم مصرف شود، گرمای آزاد شده یا جذب شده آن را بهدست آورید.
پاسخ
در این واکنش، یک مول کلریک اسید با یک مول کلسیم هیدروکسید واکنش میدهد و یک مول کلسیم کلرید و ۴ مول آب مایع تولید میشود. در این مثال، ابتدا مقدار گرمای آزاد شده یا جذب شده واکنش داده شده را بهدست میآوریم. سپس، مقدار گرمای آزاد شده یا جذب شده برای ۱۰/۰ گرم را بهدست میآوریم. برای محاسبه گرمای واکنش از جدول گرمای تشکیل ترکیبهای شیمیایی مختلف استفاده میکنیم. گرمای واکنش با استفاده از رابطه زیر بهدست میآید:
$$\triangle H _ {heat \of reaction } = \sum _ { \triangle H } [products] - \sum _ { \triangle H } [reactants] $$
ابتدا به محصولات واکنش دقت میکنیم. محصولات این واکنش عبارت هستند از:
- یک مول
- دو مول آب مایع
تعداد مولهای هر یک از محصولات بالا را در گرمای تشکیل آنها ضرب میکنیم. گرمای تشکیل برابر ۷۴۵/۰- کیلوژول بر مول و گرمای تشکیل آب مایع برابر ۲۸۵/۸- کیلوژول بر مول است.
رابطه (۱)
در ادامه، به واکنشدهندهها دقت میکنیم. واکنشدهندههای این واکنش عبارت هستند از:
- یک مول
- دو مول کلریک اسید
تعداد مولهای هر یک از واکنشدهندهها را در گرمای تشکیل آنها ضرب میکنیم. گرمای تشکیل Ca( OH ) _2 برابر ۹۸۶/۶- کیلوژول بر مول و گرمای تشکیل کلریک اسید برابر ۹۲۳- کیلوژول بر مول است.
رابطه (۲)
رابطه (۲) را از رابطه (۱) کم میکنیم. مقدار گرمای واکنش پس از انجام محاسبات برابر مقدار ۱۹۵/۴- کیلوژول بهدست میآید. علامت منفی بدان معنا است که به هنگام انجام این واکنش شیمیایی و تشکیل و آب مایع، گرما آزاد میشود. به بیان دیگر، واکنش داده شده در این مثال، واکنشی گرماده است. تا اینجا، گرمای واکنش داده شده را بهدست آوردیم. در ادامه باید بدانیم با داشتن ده گرم چه مقدار انرژی آزاد میشود. ابتدا باید مقدار داده شده برحسب گرم را به مول تبدیل کنیم.
یک مول برابر ۷۴/۱۰ گرم است. همچنین، یک مول در واکنش شیمیایی داده شده انرژی گرمایی برابر ۱۹۵/۴- کیلوژول آزاد میکند.
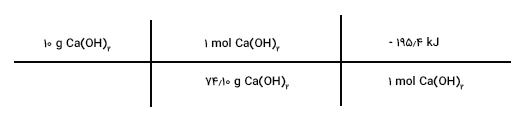
پس از انجام محاسبات به عدد ۲۶/۴- کیلوژول میرسیم. بنابراین، مقدار گرمای آزاد شده به هنگام واکنش ده گرم Ca( OH ) _2 برابر ۲۶/۴- کیلوژول خواهد بود.
اندازه گیری گرمای واکنش های یونی
تشکیل ترکیبهای یونی، گرماده هستند. چرا؟ زیرا ترکیب یونی تشکیل شده پایدارتر از یونهای تشکیلدهنده آن است. به هنگام تشکیل پیوند یونی، انرژی اضافی به شکل گرما از یونها آزاد میشود. هنگامی که گرمای آزاد شده به هنگام انجام واکنش شیمیایی بیشتر از گرمای موردنیاز برای انجام واکنش باشد، واکنش شیمیایی گرماده است. پیوندهای یونی بین دو اتم با تفاوت الکترونگاتیوی زیاد تشکیل میشوند. به طور کلی، واکنشهای یونی بین فلزات و نافلزات رخ میدهند.
به طور معمول، فلزات به تعدادی الکترون برای پر کردن لایه بیرونی خود نیاز دارند. در مقابل، نافلزات برای رسیدن به حالت پایدار باید تعدادی الکترون از دست بدهند. بنابراین، در واکنش بین فلز و نافلز، الکترون از نافلز جدا و به آخرین لایه فلز اضافه میشود. برای آنکه بدانیم واقعا چه اتفاقی به هنگام تشکیل پیوند یونی رخ میدهد، تشکیل کلرید سدیم یا نمکطعام را در نظر میگیریم. اگر فلز سدیم را در تماس با گاز کلر قرار دهیم، نمکطعام در واکنشی گرماده تشکیل میشود.
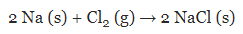
به شکل شبکه کریستالی متشکل از یونهای کلر و سدیم وجود دارد به گونهای که الکترون اضافی سدیم، لایه بیرونی کلر را پر کرده است. در این حالت، لایه بیرونی سدیم و کلر هشت الکترون دارند و کامل شدهاند. این ترکیب از نقطه نظر انرژی ترکیب کاملا پایداری است.

پس از پاسخ به پرسش گرما چیست، در مورد راههای انتقال گرما صحبت کردیم و چگونگی اندازهگیری گرمای واکنشهای شیمیایی را توضیح دادیم. شاید از خود پرسیده باشید گرما با استفاده از چه وسیلهای اندازه گرفته میشود. در ادامه، به این پرسش پاسخ میدهیم.
وسیله اندازه گیری گرما چیست ؟
تا اینجا فهمیدیم واحد اندازهگیری گرما چیست. گرما با استفاده از وسایل مختلفی اندازه گرفته میشود. در این بخش، در مورد راههای اندازهگیری گرما صحبت میکنیم. دماسنج یکی از قدیمیترین وسیلههای اندازهگیری گرما است. امروزه، دمای هر چیزی مانند دمای بیرون یا دمای گوشت پخته را میتوان با دماسنجهای متفاوت اندازهگیری کرد. ابزارهای دیگر نیز میتوانند گرمای کل ساختمانها یا حتی میزان انرژی موجود در غذا را با تولید واکنشهای گرمایی، اندازهگیری کنند.
اندازه گیری گرما با استفاده از ترموگراف
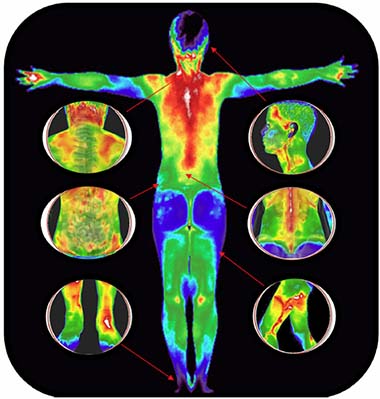
کار با ترموگراف به سادگی کار با دماسنج نیست. دماسنج با نشان دادن عددی مشخص، مقدار گرما موجود را به ما نشان میدهد. اما ترموگرافها با استفاده از دوربینهای فروسرخ داخلی، تصویرهای گرمایی تولید میکنند. از آنجا که نور فروسرخ تولید شده توسط هر جسم یا موجودی زنده با دمای جسم یا موجود زنده رابطهای مستقیم دارد، رنگهای ظاهر شده در تصویر فروسرخ با دقت خوبی میتوانند توزیع دمایی کاملی از جسم موردنظر را نشان دهند.

تصویرهای تولید شده توسط ترموگرافها با رنگهای دقیق یا به صورت سیاه و سفید نمایش داده میشوند. در تصویر گرفته شده، قسمتهای روشنتر، دماهای بالاتر و قسمتهای تاریکتر، دماهای کمتر را نشان میدهند. ترموگرافها با توجه به کاری که انجام میدهند، اندازه و شکلهای متنوعی دارند. از ترموگرافها در پزشکی برای دیدن توزیع دمای بدن بیمارها استفاده میشود.
اندازه گیری گرما با استفاده از دماسنج
چند قرن قبل برای اندازهگیری دمای هوا از دماسنجهای الکلی استفاده میکردند. سالها بعد جیوه جایگزین الکل شد، زیرا جیوه در برابر تغییر دما سریعتر منقبض یا منبسط میشود. امروزه از دماسنجهای دیجیتالی برای اندازهگیری دمای اجسام مختلف استفاده میکنیم. از دماسنجهای پزشکی برای اندازهگیری حرارت بدن استفاده میشود.
اندازه گیری گرما با استفاده از کالری سنج
امروزه افراد زیادی به میزان کالری مصرف شده به صورت روزانه توجه میکنند. بنابراین، مقدار کالری موجود در مواد غذایی روی بستهبندی آنها نوشته شده است. همانطور که در مطالب بالا اشاره شد، کالری یکی از واحدهای اندازهگیری گرما است. یک کیلوکالری برابر مقدار گرمای لازم برای بالا بردن دمای یک لیتر آب به اندازه یک درجه سلسیوس است. برای تعیین مقدار کالری در مواد غذایی از وسیلهای به نام کالریسنج استفاده میشود.

ابتدا، یک گرم از ماده غذایی موردنظر را داخل محفظه فلزی مهروموم شده قرار میدهیم. این محفظه فلزی داخل کالریسنج قرار دارد. بقیه کالریسنج را با آب پر میکنیم و درِ آن را محکم میبندیم. غذای داخل محفظه فلزی توسط نخ پنبهای مشتعل میشود. غذای شعلهور شده داخل محفظه فلزی آب اطراف خود را گرم میکند. کالریسنج تغییر دمای آب را اندازه میگیرد. میزان افزایش دمای آب به ما مقدار کالری موجود در ماده غذایی را نشان میدهد.

شاید از خود بپرسید چرا از محفظه فلزی برای قرار دادن غذا استفاده میشود. همانطور که در مطالب بالا اشاره شد، رسانندگی یا هدایت یکی از راههای انتقال گرما از نقطهای به نقطه دیگر است. از آنجا که فلز رسانایی خوبی برای انتقال گرما است، محفظه داخلی کالریسنج از فلز ساخته میشود.
جمعبندی
در این مطلب، ابتدا به پرسش «گرما چیست» به زبان ساده پاسخ دادیم، سپس دو فرمول محاسبه گرما را نوشتیم. اگر جسم پس از دریافت یا از دست دادن گرما تغییر حالت دهد، مقدار گرمای دریافت شده یا آزاد شده با استفاده از رابطه زیر بهدست میآید:
در صورتی که انتقال گرما با تغییر حالت همراه نباشد، مقدار آن با استفاده از رابطه زیر محاسبه میشود:
در ادامه فهمیدیم روشهای انتقال گرما چیست. گرما از سه روس رسانندگی، همرفت و تابش منتقل میشود. در دو روش رسانندگی و همرفت برای انتقال گرما به محیط مادی نیاز است، در حالیکه انتقال گرما در تابش، بدون نیاز به محیط مادی انجام میشود. در پایان فهمیدیم واحد اندازهگیری گرما چیست و با چه روشهایی اندازه گرفته میشود.













ممنون از سایت همیشه درخشانتون امیدوارم این مقاله خیلی خوب از نظر علمی ویرایش بشه و اشتباهات کوچیکش رفع بشن و مثل همیشه عالی باشین
با سلام،
مطلب بررسی و برخی فرمولها اصلاح شدند،
با تشکر از همراهی شما با مجله فراردس