آب سخت چیست؟ — به زبان ساده
آب سخت (Hard Water) شامل مقادیر زیادی مواد معدنی از جمله کلسیم و منیزیم است و به دلیل طعم فلز مانندی که دارد در بیشتر موارد، از آب معمولی قابل تشخیص است. همچنین سر و کار داشتن با این آب باعث خشکی پوست بدن انسان نیز میشود. در این مطلب ابتدا میخواهیم بدانیم آب سخت چیست و چه مزایا و معایبی دارد، سپس به توضیح روشهایی میپردازیم که در نرم کردن آن مورد استفاده قرار میگیرند.
آب سخت چیست ؟
آب سخت به آبی گفته میشود که شامل مقادیر بالایی از مواد معدنی به صورت یون باشد. این مواد معدنی بیشتر به صورت دو عنصر کلسیم و منیزیم حضور دارند و با توجه به طعم آن قابل تشخیص هستند.
وجود آن به سیستم آبرسانی شهری با تشکیل رسوب در لولههای انتقال آسیب میزند. آب سخت علت لکههای سفید مایل به زرد رسوب در اطراف شیرهای آب و داخل کتری آبجوش است. زمانی که صابون با آب بهخوبی کف نمیکند نیز میتوان به وجود آب سخت پیبرد.

در طبیعت آب به هر دو نوع سخت و نرم موجود است و بستگی به منشا جاری شدن و موقعیت جغرافیایی آن دارد. آنهایی که در مسیر خود در تماس با سنگهای متخلخل باشند همیشه مقداری از مواد معدنی آنها را با خود حمل میکنند. این آبها میتوانند حاوی سنگ آهک و دولومیت باشند که آنها را بسیار سخت میکند. در مقابل، منابع حاصل از آب شدن یخهای یخچالی و آنهایی که با سنگهایی از نوع آتشفشانی در تماس قرار میگیرند، بسیار نرمتر هستند.

یونهای موجود در آب
میدانیم که آب مولکولی دو اتمی متشکل از دو اتم هیدروژن و یک اتم اکسیژن با فرمول است و در موارد بسیار کمی به صورت خالص وجود دارد و همواره شامل یونهایی به صورت محلول است. نوع این یونها به مکان، عمق و دما بستگی دارد. این یونها شامل کاتیونهای کلسیم ، منیزیم ، سدیم ، پتاسیم و آمونیوم و آنیونهای بیکربنات ، سولفات ، نیتریت ، کلر و نیترات هستند. این کاتیونها و آنیونها از آنجا که در مجاورت هم هستند، همدیگر را از نظر بار الکتریکی خنثی میکنند.
انواع آب سخت
در این بخش میخواهیم بدانیم چند نوع آب سخت وجود دارد و مبنای این طبقهبندی چیست. گفتیم که آب سخت شامل مقادیر زیادی از مواد معدنی هست که در این بین دو عنصر کلسیم به فرم کاتیون فلزی و منیزیم از همه بیشتر دیده میشوند. با این حال ممکن است عنصرهای آهن، آلومینیوم و منگنز نیز در برخی مناطق وجود داشته باشند. این فلزها در آب محلول هستند و تشکیل رسوب نمیدهند.
یکی از مقیاسهایی که از آن برای سنجش میزان نرمی و سختی آب استفاده میشود، واحد grains per gallon است. در این مقیاس که با نشان داده میشود، هر grain معادل ۶۴٫۸ میلیگرم است. با توجه به این مقیاس سختی و نرمی را در سه بازه متفاوت در نظر میگیرند.
- اگر کمتر از ۳-۰ باشد، نرم (Soft Water) است.
- اگر بین ۷-۳٫۵ باشد، کمی سخت و ایدهال است.
- اگر بالای ۷٫۵ باشد، سخت و بهتر است با روشهای موجود سختی آن را از بین ببرند یا کاهش دهند.
حضور غلظت بالای این یونها، باعث اشباع شدن میشود و متعاقبا واکنش تعادلی را به سمت مواد اولیه میبرد. در این حالت رسوبهای این عنصرها در آب قابل مشاهده خواهند بود. این جابهجایی مواد معدنی از محلول باعث به وجود آمدن رسوب کلسیم کربنات و منیزم کربنات در آب آشامیدنی شیر میشود.
به طور کلی دو نوع آب سخت وجود دارد.
- آب سخت موقت (Temporary Hardness)
- آب سخت دائم (Permanent Hardness)
در ادامه هر دوی این موارد را به تفضیل بررسی خواهیم کرد.
سختی کل آب
آب سخت خود به دو دسته آب سخت موقت و آب سخت دائم طبقهبندی میشود. اما معنای هر کدام چیست؟
- سختی موقت: به آبی که یونهای آن در اثر جوشاندن، از آب حذف میشوند سختی موقت میگوییم.
- سختی دائم: سختی دائم وجود یونهایی در آب است که با جوشاندن، اتفاقی برایشان نمیافتد و در آب باقی میمانند.
به مجموع سختی موقت و سختی دائم، سختی کل گفته میشود، یعنی سختی کل شامل تمام یونهای داخل آن است، چه آنهایی که با جوشیدن از بین میروند چه آنها که باقی میمانند.
آب سخت موقت چیست ؟
آب سخت موقت به آبی گفته میشود که بهطور عمده از کاتیون کلسیم و آنیون بیکربنات تشکیل شده باشد. با گرما دادن به آب سخت موقت آنیونهای بیکربنات تخریب و تبدیل به آنیون کربنات ، کربن دیاکسید و آب میشوند. سپس آنیون کربنات بهدست آمده میتواند با یونهای دیگر داخل آب وارد واکنش شود و ترکیبهایی نامحلول مانند کلسیم کربنات و منیزنم کربنات را به وجود بیاورد.
واکنشهای کربناتهای دیگر در محلول باعث به وجود آمدن رسوبهایی میشود که در کتریها بعد از جوشیدن آب باقی میماند. ایجاد لایهای ضخیم از این رسوبها به دلیل عدم هدایت گرمایی باعث اتلاف انرژی شده و جوشیدن درون کتری را به تاخیر میاندازد.
در زیر تعادل شیمیایی بین یونهای بیکربنات و کلسیم را مشاهده میکنید. افزایش دما باعث میشود تعادل به سمت چپ برود و رسوبهای نامبرده را از خود بهجا بگذارد.
همین جابهجایی به وجود آمده در تعادل، عامل دیده شدن رسوب سفید مایل به زرد در کتری است. همین رسوبها در لولههای انتقال نیز وجود دارند و مسیر حرکت را مختل میکنند. همچنین این رسوبها در صورت وجود گرمای بیش از حد باعث به وقوع پیوستن انفجار خواهند شد. همانطور که از ثابت انحلالپذیری پیداست، رسوبها بعد از سرد شدن دوباره حل نمیشوند. دلیل نامگذاری این نوع آب سخت به عنوان موقت این است که میتوان سختی آن را تنها با جوشاندن و خارج کردن یونهای مواد معدنی از بین برد.
آب سخت دائم چیست ؟
آب سخت دائم از غلظتهای بالای آنیونهایی مانند سولفات تشکیل شده است. از آنجا که این آب سخت، برخلاف آب سخت موقت تنها با فزایش دما و تشکیل رسوب مواد معدنی قابل سختیزدایی نیست، به آن آب سخت دائم میگوییم. با این حال سختی آن را میتوان از روشهای دیگری از بین برد، به همین دلیل نام آب سخت دائم ممکن است کمی گمراهکننده باشد.

رسوبهای حاصل از آب سخت دائم مانند نوع موقت آن میتواند باعث ایجاد انسداد در لولههای انتقال آب شود. همانطور که پیشتر اشاره کردیم آب سخت حاوی کاتیون کلسیم و منیزیم است. این کاتیونها با صابون وارد واکنش شده و ترکیبات نامحلولی را به وجود میآورند که به صورت لکه و رسوب در سینک باقی میماند. به علاوه واکنش این کاتیونها با صابون باعث میشود که صابون کف خوبی تولید نکند. در واقع کارایی آن را به شدت کاهش میدهد. در واکنش زیر نمونهای از این مورد را میبینید که در آن منیزیم موجود در آب سخت با یکی از اجزای صابون، در این مورد استئارات ، وارد واکنش شده است. تشکیل منیزیم استئارات نامحلول ، مسئول ناکارمد بودن صابون است. این واکنش به صورت زیر نشان داده میشود.
نحوه نرم کردن آب سخت
نرم کردن آب فرایندی است که به روشهای متنوع و با هدفهای وسیعی صورت میگیرد. در زیر به برخی از مهمترین این اهداف در کاربردهای صنعتی و خانگی اشاره میکنیم.
- عدم کف کردن صابون: همانطور که گفتیم صابون در آب سخت بهخوبی کف نمیکند و نه تنها باعث اتلاف وقت و انرژی میشود بلکه ممکن است باعث ضربه به اقتصاد برخی صنایع شود. مثلا کارواشها و آرایشگاهها برای جلوگیری از اصراف شوینده میخواهند که سختی آب خود را از بین ببرند.
- عدم تخریب لولهها: ایجاد رسوب حاصل از آب سخت علاوه بر ناخوشایند بودن، میتواند باعث مسدود شدن لولههای انتقال شود. برای رفع این مشکل ممکن است بخواهیم سختی را از بین ببریم.
- عدم تشکیل رسوب: تشکیل رسوبهای سفید مایل به زرد روی سینک و شیرآلات منظره نامطلوبی را در خانه به وجود میآورد.
- حس ناخوشایند آب سخت بر پوست: گفتیم که آب سخت بیشتر و سریعتر ازآب نرم باعث خشک شدن پوست میشود. برخی افراد به همین دلیل ترجیح میدهند از آب سخت استفاده نکنند.
با توجه به دلیلهای ذکر شده، توسعه روشهایی برای از بین بردن سختی آب ضروری است. این روشها را در بخش بعد مورد مطالعه قرار میدهیم.
تبادل یون
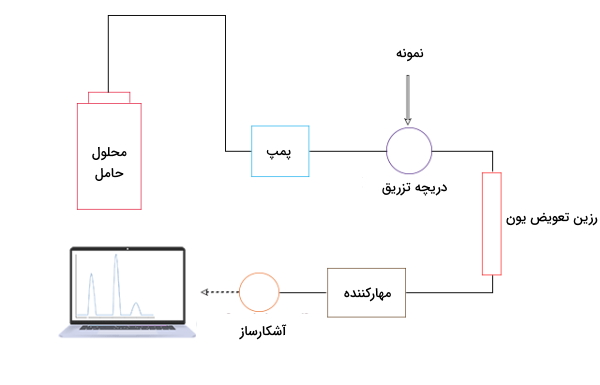
یکی از روشهای از بین بردن سختی آب تبادل یون (Ion Exchange) است که طی آن یونهای موجود نامطلوب را با یونهای دلخواه جایگزین میکنند. در بسیاری موارد دو کاتیون مسئول ایجاد سختی، یعنی کلسیم و منیزیم را با یونهای سازگارتری مانند سدیم تعویض میکنند. در نتیجه آب نرم حاصل از این روش مقادیر زیادی از سدیم با خود به همراه دارد. استفاده از آب نرم حاصل از این روش برای برخی افراد که در رژیم غذایی خود منع مصرف سدیم دارند، مناسب نیست.
برای انجام این کار آب را از ستون حاوی رزین یا زئولیت عبور میدهند. در این فرایند یونهای نامطلوب به رزین متصل میشوند و جای خود را به کاتیونهای دیگری میدهند. یونهای آب سخت به دلیل اتصال به رزین تبدیل به یون ثابت میشوند. به یونهای جایگزین شده از ستون، یون مخالف میگویند. تصویر زیر نحوه انجام این فرایند را بهخوبی نشان میدهد.
استفاده از آهک در فرایند کلارک
در این روش به آب سخت، کلسیم هیدروکسید اضافه میکنند. با این کار محیط افزایش پیدا میکند و کلسیم و منیزیم موجود در آن به صورت کلسیم کربنات و منیزیم هیدروکسید تشکیل رسوب میدهند. با توجه به تعادل زیر میدانیم که انحلالپذیری منیزیم هیدروکسید در آب بسیار پایین است و میتوان آن را به کمک روش صافی از آب جدا کرد. این گفته در مورد کلسیم کربنات نیز صدق میکند که تعادل آن را پیشتر در این مطلب مورد بررسی قرار دادهایم.
واکنشهای استفاده از آهک برای گرفتن سختی آب را میتوان به صورت زیر نمایش داد.
ابتدا با افزودن کلسیم هیدروکسید یونهای کلسیم به صورت کلسیم کربنات در میآیند.
افزودن مقادیر بیشتری از کلسیم هیدروکسید، باعث افزایش آن میشود و یونهای منیزیم نیز به این صورت حذف خواهند شد.
در ادامه با افزودن مقداری سدیم کربنات، یونهای کلسیم بیشتری از محیط خارج میشوند.
بعد از جدا کردن رسوب از آب سخت به دلیل قلیایی شدن محیط، باید برای بازگرداندن به حالت معمولی به آن اسید اضافه کنیم.
روش تیتراسیون تشکیل کیلیت
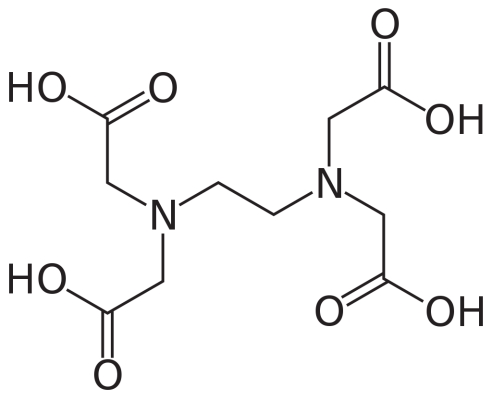
روشی دیگر برای گرفتن سختی استفاده از عوامل کیلیتساز (Chelate) است. کیلیتهای چند دندانه (Polydentate)، مانند کیلیت پنج دندانه اتیلن دیآمین تترااستیک اسید به یونهای ناخواسته متصل میشوند. بنابراین با افزودن این ماده به آب سخت میتوان دو یون منیزیم و کلسیم را از آن جدا کرد.
این عوامل کیلیتساز حلقه بسیار پایداری با این کاتیونهای فلزی تشکیل میدهد، بهطوری که دیگر با هیچ ماده افزودنی دیگری، مثلا صابون، وارد واکنش نمیشوند. به این صورت عوامل کیلیتساز تاثیرات منفی این یونها را کاهش میدهند. ساختار شیمیایی اتیلن دیآمین تترااستیک اسید را در زیر مشاهده میکنید.
در پایین واکنش بین عامل کیلیتساز اتیلن دیآمین تترااستیک اسید با کاتیون کلسیم نشان داده شده است. مقدار ثابت تشکیل این واکنش نشاندهنده تمایل بالای واکنش برای پیشروی در مسیر خود است.
سوالی که اینجا به ذهن میآید این است که عامل کیلیتساز اتیلن دیامین تترااستیک اسید با کدام فلزها تشکیل پیچیده (Complex) پایدار میدهد. همانطور که در بالا گفتیم این عامل با کاتیونهای دو عنصر فلزی منیزیم و کلسیم به خوبی همراه میشود. در برخی موارد با کاتیون آلومینیوم و آهن نیز میتواند همراه شود.
نکتهای که در تشکیل کیلیت اهمیت دارد، بدون پروتون بودن گروههای کربوکسیلیک اسیدی در ساختار است تا بتواند بهخوبی اتمهای فلزی را کنار خود نگه دارد. در واقع این عوامل باید قبل از ورود به واکنش متحمل واکنش پروتونزدایی شوند. برای این کار باید محیط بالای مقدار آن باشد. کیلیت تشکیل شده به صورت زیر خواهد بود. در این تصویر نشاندهنده یونهای فلزی است.
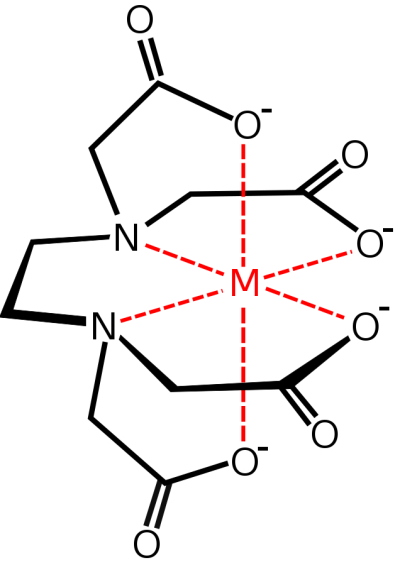
برای سنجش نقطه پایان این تیتراسیون از شناساگرهای مختلفی استفاده میشود. میخواهیم بدانیم شناساگر مناسب برای این مورد باید دارای چه ویژگیهایی باشد. این شناساگر باید ساختاری داشته باشد که در حضور یا عدم حضور یونهای فلزی از خود رنگ متفاوتی نشان بدهد تا بتوان با مشاهده تغییر رنگ نقطه پایان را تشخیص داد. برای این تیتراسیون از شناساگر اریوکروم بلک تی که به صورت پودر قهوهای است استفاده میشود. در ابتدای فرایند زمانی که آن را به آب سخت اضافه میکنیم در حضور یونهای فلزی آزاد به رنگ شرابی در میآید. با پیشروی تیتراسیون و تشکیل کمپلکس با اتیلن دیآمین تترااستیک اسید و خالی شدن محیط از یونهای فلزی، شناساگر اریوکروم بلک تی محیط را به رنگ آبی در میآورد.

گاهی پیش از انجام تیتراسیون با کمک اتیلن دیآمین تترااستیک اسید، از افزایش محیط برای رسوب دادن یونهای فلزی در آب استفاده میشود زیرا به جز فلزهای گروه ۱، باقی میتوانند با افزایش کافی رسوب خوبی تشکیل بدهند. در زیر ثابت انحلالپذیری ۵ یون فلزی را با یکدیگر مقایسه میکنیم و میخواهیم بدانیم رسوب هیدروکسیدی کدام یک زودتر تشکیل میشود.
- ثابت انحلالپذیری آلومینیوم
$${Al(OH)_{3 \:(s)} ↔ Al^{3+ }\:_{(aq) }+ 3 OH^-\:_{ (aq)}}$$
- ثابت انحلالپذیری کلسیم
$${Ca(OH)_{2 \:(s)} ↔ Ca^{2+ }\:_{(aq) }+ 2 OH^-\:_{ (aq)}}$$
- ثابت انحلالپذیری آهن(II)
$${Fe(OH)_{2 \:(s)} ↔ Fe^{2+ }\:_{(aq) }+ 2 OH^-\:_{ (aq)}}$$
- ثابت انحلالپذیری آهن(III)
$${Fe(OH)_{3 \:(s)} ↔ Fe^{3+ }\:_{(aq) }+ 3 OH^-\:_{ (aq)}}$$
- ثابت انحلالپذیری منیزیم
$${Mg(OH)_{2 \:(s)} ↔ Mg^{2+ }\:_{(aq) }+2 OH^-\:_{ (aq)}}$$
افزایش محیط باعث میشود تمامی یونهای بالا به جز تشکیل رسوب دهند و مزاحمتشان حذف شود. شناساگری که در این فرایند استفاده میشود هیدروکسی نفتول آبی است که به شکل پودر سیاه موجود است. یعنی در مرحله بعد که تیتراسیون با اتیلن دیآمین تترااستیک اسید است تنها یون محلول، کلسیم خواهد بود. پس با انجام آن فقط کمپلکس با کلسیم تشکیل میشود.

نکته جالبی که وجود دارد این است که با انجام این دو تیتراسیون پشت هم میتوان غلظت یون منیزیم موجود را به دست آورد. از آنجا که در بیشتر موارد غلظت دو یون آهن و آلومینیوم بسیار ناچیز و قابل صرف نظر است، میتوان با محاسبه اختلاف بین تیتراسیون با اریوکروم بلک تی و تیتراسیون با هیدروکسی نفتول آبی به غلظت یون منیزم پی برد.
محاسبه میزان سختی آب
برای انجام تیتراسیونی که در بخش قبل توضیح دادیم به مواد زیر نیاز است.
- محلول اتیلن دیآمین تترااستیک اسید: ۰٫۰۰۲۵ مولار
- محلول شناساگر اریوکروم بلک تی: (۰٫۱ گرم در ۲۵ میلیلیتر متانول)
- بافر آمونیوم : مقدار ۶۷٫۶ گرم از را در ۵۲۷ میلیلیتر حل و با ۱ لیتر آب مقطر رقیق کنید.
- سدیم هیدروکسید 50%
مقدار نمونه مورد نیاز از آب سخت بسته به میزان سختی آن دارد اما بهطور کلی ۵۰ میلیلیتر از آن کافی خواهد بود. ابتدا ۳ میلیلیتر بافر آمونیوم و سپس ۶ قطره از شناساگر اریوکروم بلک تی اضافه کنید. تیتراسیون را با محلول اتیلن دیآمین تترااستیک اسید شروع کنید و حواستان به تغییر رنگ از شرابی به آبی باشد. گاهی به دلیل سختی بیش از حد ممکن است نیاز داشته باشید از محلول تیتراسیون با غلظت بیشتری استفاده کنید یا مقدار نمونه کمتری را به کار بگیرید.
برای اندازهگیری میزان سختی میتوان از فرمولی ساده استفاده کرد که سختی را با مقیاس حضور کلسیم کربنات نشان میدهد. با کمک این فرمول میزان سختی را با واحد اندازه میگیرند. این فرمول به صورت زیر است.
در ادامه به بررسی هر پارامتر میپردازیم.
- : حجم مورد نیاز اتیلن دیآمین تترااستیک اسید (در واحد لیتر)
- : غلظت اتیلن دیآمین تترااستیک اسید مورد استفاده در تیتراسیون (در واحد میلی مولار)
- : حجم آب نمونه (در واحد لیتر)
اسمز معکوس (Reverse Osmosis)
آخرین روشی که به آن اشاره میکنیم اسمز معکوس است که طی آن آب سخت با کمک فشار بالا از غشایی نیمهتراوا عبور داده میشود. این غشا بهطور معمول نسبت به هر چیزی به جز آب نیمهتراوا است و مانند فیلتری عمل میکند و مانع از عبور یونهای بزرگ میشود.
به این صورت یونهای مسئول سختی جدا میشوند و در طرف دیگر غشا آب نرم باقی میماند. در این فرایند آب از سمتی با غلظت بالای یونها به سمتی با غلظت پایین یونها منتقل میشود. به عبارتی آب سخت یونهای عامل سختی خود را پشت غشای نیمهتراوا بهجا گذاشته و نرم میشود. عیبی که این روش نسبت به باقی روشهای پیشین دارد این است که میزان پساب زیادی از خود بهجا میگذارد. در تصویر زیر روند انجام این فرایند نشان داده شده است.
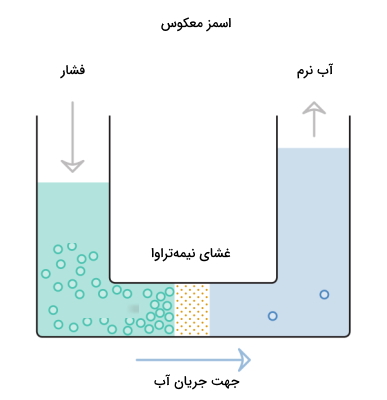
اندازهگیری و تشخیص آب سخت
سختی را به روشهای مختلفی میتوان اندازهگیری کرد و امروزه، کیتهای مختلفی برای اندازهگیری و تشخیص آب سخت وجود دارند اما در ادامه، نحوه اندازه گیری سختی را به کمک تیتراسیون یاد میگیریم. به عبارت دیگر، مقدار کلسیم موجود در نمونه را به کمک روش تیتراسیون، اندازهگیری میکنیم.
در این روش، به کمک لوازم آزمایشگاهی، نمونه را مورد بررسی قرار میدهیم و مقدار کلسیم موجود در آن را اندازهگیری میکنیم. اگر با نحوه کار تیتراسیون آشنا نیستید، میتوانید انواع مطالب مربوط به تیتراسیون را در «مجله فرادرس» مطالعه کنید که از میان آنها میتوان به تیتراسیون رسوبی، اکسایش کاهش و تیتراسیون اسید باز اشاره کرد.
در اینجا، محلول EDTA به عنوان تیترانت شناخته میشود که در واکنش با یونهای کلسیم موجود در آب، کلاتسازی انجام میشود. واکنش EDTA با یون کلسیم در تصویر زیر نشان داده شده است.
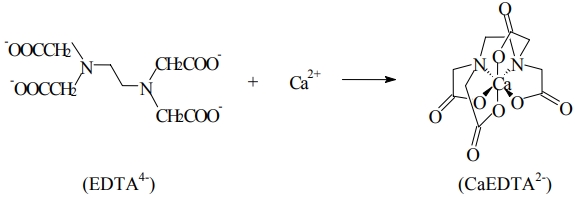
واکنش بالا تنها در مقادیر بالای pH رخ میدهد، بنابراین، محلول بافر با pH برابر با ۱۰، به نمونه اضافه میشود. همچون واکنشهای اسید و باز، از یک معرف برای تعیین نقطه پایانی استفاده میکنیم. معرف مورد استفاده در این آزمایش، «اریوکروم بلکتی» (Erichrome Black T) نام دارد.

معرف یون فلزی
«معرف یون فلزی» (Metal Ion Indicator) به ترکیبی میگویند که رنگ آن به هنگام تشکیل پیوند با یون فلزی، تغییر کند. برای اینکه چنین معرفی در تیتراسیون با EDTA مفید باشد، باید یون فلزی خود را به EDTA بدهد. معرف در حالت آزاد (بدون پیوند) به رنگ آبی است. مقادیر کمی از معرف به محلول حاوی یون کلسیم اضافه میشود و کمپلکسی قرمزرنگ تشکیل میشود. اگر معرف را با «» نشان دهیم، واکنش آن، به صورت زیر خواهد بود:
در طرف چپ واکنش، رنگ به رنگ آبی و ترکیب سمت راست، به رنگ قرمز است. در این آزمایش، زمانیکه محلول قرمزرنگ به آبی تبدیل شود، به نقطه پایانی میرسیم که نشان میدهد EDTA به طور کامل با تمامی یونهای کلسیم در نمونه آب، واکنش داده است.
در پایان نیز باید مقدار یونهای کلسیم موجود را محاسبه کنیم. برای بیان غلظت نیز از «ppm» استفاده میشود. در این آزمایش نیز غلظت کلسیم کربنات را بر اساس ppm محاسبه میکنیم. با داشتن حجم نمونه و حجم EDTA مصرفی، میتوان میزان سختی را محاسبه کرد.
1000 × حجم EDTA مصرفی در تیتراسیون (میلیلیتر) / حجم نمونه آب = غلظت کلسیم کربنات (بر حسب ppm)
بعد از انجام محاسبات، به کمک جدول زیر، میزان سختی را تعیین کنید.
| غلظت (ppm) | سختی |
| کمتر از ۶۱ | سختی کم (آب نرم) |
| ۱۲۰-۶۱ | متوسط |
| ۱۸۰-۱۲۱ | سخت |
| بیشتر از ۱۸۰ | بسیار سخت |
شاخص های آب سخت
برای توصیف رفتار کلسیم کربنات در آب سخت از چند شاخص استفاده میشود که در ادامه به آنها خواهیم پرداخت. علاوه بر موارد زیر از شاخصهایی مانند شاخص لارسون-اسکولد (Larson-Skold index)، شاخص پوکوریوس (Pokorioua index)، شاخص اودو-تامسون (Oddo-Tomaon index) و شاخص استیف-دیویس (Stiff-Davis index) نیز برای پیشبینی رفتار کلسیم کربنات بهره میبرند.
شاخص اشباع لانژلیه (Langelier Saturation Index(
شاخص اشباع لانژلیه به صورت عددی محاسبه میشود که پایداری کلسیم کربنات را نشان میدهد. در واقع این شاخص به ما میگوید که آیا کلسیم کربنات حل میشود، رسوب میدهد و در تعادل باقی میماند یا خیر. این شاخص در سال ۱۹۳۶ توسط ویلفرد لانژلیه برای تخمین ی که در آن کلسیم کربنات به حد اشباع میرسد، ابداع شد. شاخص اشباع لانژلیه اختلاف بین واقعی سیستم و آن در حالت اشباع است و فرمول آن را میتوان به صورت زیر نمایش داد.
در جدول زیر مقادیر متفاوت این شاخص و معنای هر کدام مورد بررسی قرار گرفته است. اگر واقعی پایینتر از اشباع باشد، شاخص اشباع لانژلیه منفی است و اگر بالاتر از اشباع باشد، شاخص اشباع لانژلیه آن مثبت است و رسوب وجود خواهد داشت. هر چه این اختلاف بیشتر باشد و عدد مثبت بزرگتری داشته باشیم رسوب بیشتری تشکیل میشود.
| شاخص اشباع لانژلیه | وضعیت |
| برابر با ۰ | اشباع و در تعادل با کلسیم کربنات است. |
| کوچکتر از ۰ | زیر حد اشباع خود است و کلسیم کربنات به صورت محلول حضور دارد. |
| بزرگتر از ۰ | فوق اشباع است و لایهای از رسوب کلسیم کربنات وجود دارد. |
شاخص اشباع لانژلیه به دما وابسته است بهصورتی که با افزایش دما، بیشتر میشود. این مورد به خصوص در مورد آب چاه و دمای پایینتر آن قبل از خروج به چشم میآید.
شاخص پایداری رایزنر (Ryznar Stability Index)
از این شاخص برای پیشبینی احتمال رسوب دادن کلسیم کربنات در نمونه استفاده میشود. این شاخص در سال ۱۹۴۰ توسط جان رایزنر (John Ryznar) توسعه پیدا کرد. این شاخص را با نشان میدهیم و فرمول آن بهصورت زیر خواهد بود.
در جدول زیر به تفسیر موقعیتهای مختلف در اندازهگیری این شاخص میپردازیم.
| شاخص پایداری رایزنر | وضعیت |
| بین ۶٫۵ تا ۷ | تقریبا اشباع و در تعادل با کلسیم کربنات است |
| کوچکتر از ۶٫۵ | غیر اشباع است و کلسیم کربنات حل میشود |
| بزرگتر از ۸ | فوق اشباع است و رسوب وجود دارد |
آب سخت در خانه
ما انسانها در زندگی روزمره برای بسیاری از فعالیتها نیاز به آب داریم. در این بخش میخواهیم بدانیم اگر آب مورد استفاده ما آب باشد چه تاثیراتی خواهد داشت.
- حمام: حمام کردن با آب سخت هیچ آسیبی به بدن نمیرساند اما ممکن است به خاطر ماهیت آن، بعد از شستشوی بدن، آن تمیزی که از شستشو با آب نرم به دست میآید، حاصل نشود.
- ماشین ظرفشویی و لباسشویی: شستشوی لباس و ظرف با این آب هیچ مشکلی ندارد اما در طولانی مدت باعث آسیب به ماشین میشود و عمر آن را کاهش میدهد.
- پختوپز: فارغ از طعم فلزمانند و ظاهر تیره و ناخوشایندی که دارد، نوشیدن و استفاده از آن در آشپزی منبع خوبی برای تامین منیزیم و کلسیم مورد نیاز بدن است. برای مثال سبزیجات بهطور معمول در پخته شدن مقداری از مواد معدنی مفید خود را از دست میدهند اما زمانی که با آب سخت پخته شوند حتی مقدار مواد معدنی آنها افزایش نیز پیدا میکند.
- شیرآلات و سینک: پیشتر اشاره کردیم که آب سخت با تشکیل رسوب، باعث تخریب ظاهر وسایل میشود. وجود لکههای سفید مایل به زرد در اطراف سینک و روی شیرآلات در این مورد اجتنابناپذیر است.

مشکلات آب سخت
گفتیم که آب سخت تاثیر مستقیم خطرناکی روی بدن انسان ندارد اما وجود آن در لولهکشی خانه و استفاده از آن میتواند مشکلات جانبی به بار بیاورد.
- آب سخت با ایجاد رسوب در مسیر لوله انتقال، باعث کاهش فشار آب میشود.
- رسوب باقیمانده از آن، عمر تجهیزات را کاهش میدهد.
- برای نگهداری و رسیدگی به تجهیزات در جهت افزایش عمر هزینه بیشتری نیاز خواهد بود.
- کارایی رادیاتورها به دلیل نداشتن هدایت گرمایی رسوبهای حاصل از آب سخت کاهش پیدا میکند. (وجود هر ۱ میلیمتر از این رسوب مصرف انرژي را به میزان ۷٪ افزایش میدهد.)
- با کاهش کارایی سیستم گرمارسانی، مدت زمان استفاده و درجه دمای تنظیم شده آن افزایش پیدا میکند و باعث افزایش مصرف انرژی و بالا رفتن مبلغ قبض پرداختی میشود.

سوالات متدوال
در این بخش به تعدادی از سوالهای رایج در مورد آب سخت جواب خواهیم داد.
عامل سختی چیست ؟
سخت شدن آب به وجود یا عدم وجود برخی مواد معدنی که عموما به فرم کاتیون فلزی هستند، بستگی دارد.
چند نوع آب سخت وجود دارد ؟
آب سخت با توجه به اینکه مواد معدنی آن از چه نوعی باشند، به دو دسته آب سخت دائم و آب سخت موقت طبقهبندی میشود.
چطور سختی را از بین ببریم ؟
برای از بین بردن سختی روشهای متنوعی وجود دارد. از این بین میتوان به روش تبادل یون، استفاده از عامل کیلیتساز، استفاده از آهک و اسمز معکوس اشاره کرد.
مشکل استفاده از روش تبادل یون چیست ؟
در این روش یونهای عامل سختی با سدیم جایگزین میشوند. افزایش این ماده برای افرادی که در رژیم غذایی خود پرهیز سدیم دارند، خطرناک است.
جمع بندی
در این مطلب یاد گرفتیم که آب سخت چیست و چه کاربردهایی دارد. آب سختی به آبی گفته میشود که حاوی مقادیر زیادی از یونهای نامطلبوب باشد و با توجه به نوع این یونها به دو دسته سخت و نرم طبقهبندی میشود. روشهای متنوع و کارامدی برای از بین بردن سختی تعبیه شده است و مورد استفاده قرار میگیرند.