شناساگر اسید و باز چیست؟ | به زبان ساده

در علم شیمی، بسیاری از مواد با حل شدن در آب، آنرا به اسید یا باز تبدیل میکنند. یک محلول بازی دارای pH بزرگتر از 7 است در حالیکه این مقدار برای محلولی اسیدی، کمتر از ۷ ذکر میشود. برای اینکه بدانیم یک محلول، اسیدی، بازی یا خنثی است باید از شناساگر اسید و باز یا معرف استفاده کنیم. یک شناساگر اسید و باز به ترکیبی میگویند که در محدوده مشخصی از pH، رنگ آن تغییر میکند. برای ایجاد تغییر رنگ، مقادیر بسیاری کمی از شناساگر مورد نیاز است. آنچه که در این مطلب به آن می پردازیم، شناساگرهای اسید و باز و نحوه عملکرد آنها خواهد بود.
تعریف شناساگر اسید و باز
شناساگر اسید و باز یک اسید یا باز ضعیف است که به هنگام تغییر غلظت یون هیدروژن $$H ^ +$$ یا هیدروکسید $$(OH^-)$$ در یک محلول آبی، تغییر رنگ میدهد. از شناساگرهای اسید و باز به طور معمول در فرآیند تیتراسیون استفاده میشود تا به کمک آنها بتوان نقطه پایانی یک واکنش اسید و باز را مشخص کرد.
در حقیقت، معمولترین روش برای درک محدوده pH یک محلول، بهرهگیری از شناساگرهای اسید و باز است. این معرفها، مولکولهای آلی بزرگی هستند که همچون یک جوهر رنگی عمل میکنند. با وجود اینکه بیشتر جوهرها در حضور مقادیر مختلف اسید و باز، تغییر رنگ نمیدهند اما مولکولهای این مواد، در حضور اسید و باز، دچار تغییر رنگ میشوند. کاغذ لیتموس معروفترین شناساگر اسید و باز به شمار میآید که در مقادیر pH کمتر از ۴/۵، قرمز و در pH بالای ۸/۲، آبیرنگ است.
نحوه عملکرد شناساگر اسید و باز
همانطور که گفته شد، برخی از مواد آلی در محلولهای رقیق، زمانیکه غلظت یون هیدرونیوم به مقدار مشخصی برسد، دچار تغییر رنگ میشوند. به طور مثال، فنول فتالئین در تمامی محلولهای آبی با pH کمتر از 8/3، مادهای بیرنگ است. در محلولهای بازی که مقدار pH، بیشتر از ۸/۳ باشد، این ماده به رنگ صورتی یا قرمز دیده میشود. موادی همچون فنول فتالئین که از آنها میتوان برای تعیین pH محلولها استفاده کرد موسوم به شناساگر اسید و باز یا معرف اسید و باز هستند.
تعادل در یک محلول متیل اورانژ که اسیدی ضعیف به شمار میرود را میتوان با معادله شیمیایی زیر نشان داد که در آن برای نمایش مولکول پیچیده متیل اورانژ از $$HIn$$ کمک گرفتیم.
$$\underbrace{{HIn}_{(aq)}}_{{red}}+{H2O}_{(l)}⇌{H3O+}_{(aq)}+underbrace{{In-}_{(aq)}}_{{yellow}}$$
مقدار ثابت تفکیک اسید برای معادله بالا نیز به صورت زیر محاسبه میشود:
$$K_{a}={\dfrac{[H3O+][In- ]}{[HIn]}}=4.0×10^{−4}$$
آنیون متیل اورانژ $$(In^-)$$ به رنگ زرد و شکل یونیزه نشده آن یعنی $$HIn$$، قرمزرنگ است. زمانیکه اسیدی به محلول متیل اورانژ اضافه کنیم، افزایش غلظت یون هیدرونیوم، سبب میشود تا طبق اصل لوشاتلیه، تعادل به طرف چپ جابجا شود. همچنین اگر یک باز اضافه کنیم، تعادل به طرف راست جابجا خواهد شد. چنین رفتاری بسیار شبیه به عملکرد محلولهای بافر است.
به عبارت دیگر، رنگ این شناساگر، بیانگر نسبت غلظتهای دو ذره $$HIn$$ و $$In^-$$ است. اگر در حدود ۶۰ تا ۹۰ درصد در محلول، $$In^-$$ داشته باشیم، محلول به رنگ این یون یعنی زرد تبدیل میشود. مقدار ثابت تفکیک اسید را میتوان به کمک بازآرایی به شکل زیر نوشت:
$$\frac{[In ^-]}{HIn} = \frac{[K_a]}{[H_3O^+]}$$
در حقیقت، در صورت کسر رابطه بالا، غلظت ماده با رنگ زرد و در مخرج کسر، غلظت ماده با رنگ قرمز قرار دارد. این رابطه چگونگی تغییر نسبت $${\dfrac{[In- ]}{[HIn]}}$$ را با غلظت یون هیدرونیوم نشان میدهد. در نهایت، به کمک روابط لگاریتمی، از رابطه بالا میتوان استفاده کرد تا به رابطه «هندرسون-هاسلباخ» (Henderson-Hasselbalch) دست پیدا کرد که از آن میتوان برای توصیف تعادل در شناساگرها استفاده کرد.
$$\begin{equation}
\begin{array}{c}
\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{K_{\mathrm{a}}}=\frac{[\mathrm{HIn}]}{\left[\mathrm{In}^{-}\right]} \
\log \left(\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{K_{\mathrm{a}}}\right)=\log \left(\frac{[\mathrm{HIn}]}{\left[\mathrm{In}^{-}\right]}\right) \
\log \left(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\right)-log \left(K_{\mathrm{a}}\right)=-log \left(\frac{\left[\mathrm{In}^{-}\right]}{[\mathrm{HIn}]}\right) \
-mathrm{pH}+mathrm{p} K_{\mathrm{a}}=-log \left(\frac{\left[\mathrm{In}^{-}\right]}{[\mathrm{HIn}]}\right) \
\mathrm{pH}=\mathrm{p} K_{\mathrm{a}}+log \left(\frac{\left[\mathrm{In}^{-}\right]}{[\mathrm{HIn}]}\right) \text { or } \mathrm{pH}=\mathrm{p} K_{\mathrm{a}}+log \left(\frac{[\mathrm{base}]}{[\mathrm{acid}]}\right)
\end{array}
\end{equation}$$
زمانیکه مقدار عددی $$[H_3O^ +]$$ برابر با $$K_a$$ باشد، نسبت $$[In^-]$$ به $$[HIn]$$ برابر با ۱ خواهد بود یعنی ۵۰ درصد $$[HIn]$$ و ۵۰ درصد $$[In^-]$$ داریم و نیمی قرمز و نیمی زرد خواهیم داشت و به همین دلیل، محلول نیز به رنگ نارنجی دیده میشود. زمانی که غلظت یون هیدرونیوم به مقدار $$8 \times 10^{-4}$$ مولار (pH = 3/1) میرسد، رنگ محلول به قرمز تغییر میکند. از این به بعد، هر قدر غلظت یون هیدرونیوم افزایش پیدا کند، تغییر رنگی نخواهیم داشت.
زمانی که غلظت یون هیدرونیوم به مقدار $$4 \times 10^{-5}$$ مولار (pH = 4/4) برسد، غلظت رنگ زرد در معرف، بیشتر خواهد بود و کاهش یون هیدرونیوم بیش از این مقدار (افزایش pH)، تغییر رنگی را به همراه ندارد. بنابراین محدوده پیاچ بین ۳/۱ تا ۴/۴ را به عنوان بازه تغییر رنگ متیل اورانژ در نظر میگیرند.
مواد مختلف دیگری را بسته به نوع آزمایش هدف میتوان به عنوان شناساگر اسید و باز مورد استفاده قرار دارد. به طور مثال، آب کلم قرمز شامل مخلوطی از مواد رنگی است که pH پایین رنگ قرمز تیره و در pH متوسط به رنگ آبی کمرنگ و در pH بالا به رنگ زرد دیده میشود.

شناساگر چه خصوصیاتی باید داشته باشد
در همه موارد، یک شناساگر اسید و باز خوب باید شامل خواص زیر باشد:
- تغییر رنگ باید به خوبی تشخیص داده شود.
- تغییر رنگ باید سریع باشد.
- مولکولهای معرف نباید با ماده تحت تیتراسیون واکنش دهند.
- برای کاهش خطا، مقدار دامنه pK شناساگر باید در بازه ۱ واحدی از مقدار pH مورد انتظار نقطه تعادل (همارزی) قرار داشته باشد.

معرفهایی سنتزی ساخته شدهاند که تمامی شرایط بالا را شامل میشوند و به کمک آنها میتوان دامنه کاملی از pH را پوشش داد. در تصویر زیر، برخی از شناساگرهای معروف اسید و باز به همراه تغییر رنگ در محدوده pH آورده شدهاند. علاوه بر این، برخی از معرفها همچون تیمول بلو (تیمول آبی)، اسیدهایی چند پروتونه هستند که رنگ آن دو بار در دو محدوده مختلف تغییر میکند.

نحوه انتخاب صحیح شناساگر تیتراسیون اسید باز
نکته مهم در خصوص شناساگر اسید و باز این است که این مواد در مقدار مشخصی از pH، تغییر رنگ ناگهانی ندارند. زمانی که $$[HIn]$$ کاهش و $$[In^-]$$ افزایش پیدا میکند، رنگ محلول به آرامی از رنگ مشخصه $$HIn$$ به رنگ $$In^-$$ تغییر پیدا میکند.
برای تیتراسیون اسید و باز قوی، انتخاب نوع معرف به دلیل تغییرات زیاد pH در محدوده نقطه تعادل (نقطه همارزی یا اکیوالان)، حساسیت بالایی نیاز ندارد. در مقابل، انتخاب اشتباه معرف در تیتراسیون اسید یا باز ضعیف، خطای بسیار زیادی ایجاد میکند. برای درک بهتر این موضوع، تصویر زیر را در نظر بگیرید.
این تصویر، نمودار pH در برابر حجم بازِ اضافه شده برای تیتراسیون ۵۰ میلیلیتر از محلول 0/1 مولار اسید قوی HCl و محلول استیک اسید (اسید ضعیف) را به کمک محلول 0/1 مولار سدیم هیدروکسید نشان میدهد. دامنه تغییر رنگ pH برای متیل قرمز و فنول فتالئین، مشخص است.
خطوط افقی، محدوده pH را برای تغییر رنگ هریک در برابر نمودارِ تقریبا عمودی تیتراسیون HCl نشان میدهد. زمانی که حجمی برابر از سدیم هیدروکسید (حدود ۵۰ میلیلیتر) اضافه میشود، هر دو شناساگر اسید و باز تغییر رنگ میدهند.
در مقابل، تیتراسیون استیک اسید بسته به نوع استفاده از معرف (فنول فتالئین یا متیل قرمز) رفتار متفاوتی را نشان میدهد. با وجود اینکه دامنه pH برای تغییر رنگ فنول فتالئین، قدری بیشتر از نقطه تعادل تیتراسیون اسید قوی است، از خطای ایجاد شده به دلیل شیب نمودار تیتراسیون در این نقطه میتوان صرف نظر کرد.
همانند تیتراسیون HCl، زمانیکه ۵۰ میلیلیتر از سدیم هیدروکسید به محلول استیک اسید اضافه شود هم رنگ معرف به صورتی تبدیل میشود. اما در محدوده pH برابر با ۵، متیل قرمز از قرمز به زرد تغییر رنگ میدهد که این تغییر رنگ، نقطه تعادل تیتراسیون نیست بلکه «نقطه میانی» (Midpont) آن به شمار میآید. نمودار به خوبی نشان میدهد که اضافه کردن حدود ۲۵ تا ۳۰ میلیلیتر سدیم هیدروکسید سبب تغییر رنگ متیل قرمز و بروز خطایی بسیار زیاد در محاسبه نقطه تعادل (همارزی) میشود.
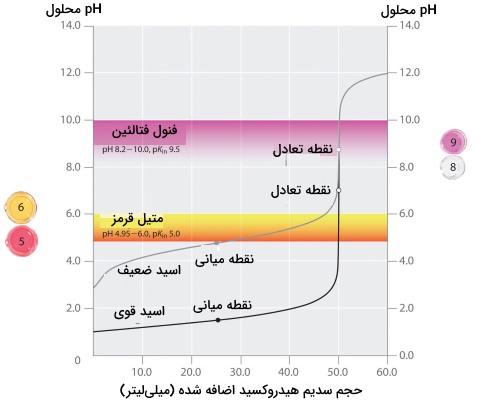
به دلیل شیب نمودار تیتراسیون اسید قوی در اطراف نقطه تعادل، هر کدام از شناساگرهای مورد استفاده، در این نقطه به سرعت تغییر رنگ میدهند. در مقابل، pK معرف (مقدار ۵) برای متیل قرمز، بسیار به مقدار pka استیک اسید (4/76) نزدیک است و نقطه میانی تغییر رنگ برای متیل قرمز، به جای قرارگیری در نقطه تعادل، در نزدیکی نقطه میانی تیتراسیون قرار میگیرد. به طور کلی، برای تیتراسیون اسید قوی با باز قوی و برعکس، هر نوع معرف با pK بین ۴ تا ۱۰ مناسب خواهد بود.
شناساگرهای طبیعی
شناساگر اسید و باز را میتوان در روشهای مختلفی از جمله اندازهگیری pH خاک، شامپو، آبمیوهها و ... بکار برد. علاوه بر این، شناساگرهای طبیعی را نیز میتوان به همین منظور مورد استفاده قرار داد که در ادامه به برخی از این شناساگرهای طبیعی اشاره میکنیم.
بخشهای مختلفی از گیاهان دارای مواد شیمیایی از خانواده ترکیبات رنگی «آنتوسیانین» (Anthocyanin) هستند. این مواد در محلوهای اسیدی به رنگ آبی و در محلولهای بازی به رنگ آبی دیده میشوند. آنتوسیانین را میتوان به کمک آب یا سایر حلالها از گیاهان استخراج کرد. کلم قرمز، گل شمعدانی، شقایق و بسیاری از گلها و میوههای دیگر را میتوان از جمله شناساگرهای طبیعی دانست.

از جمله دیگر شناساگرهای طبیعی باید به لیتموس اشاره کرد که در گذشته و حتی امروز نیز به عنوان شناساگر اسید و باز مورد استفاده قرار میگیرد. رنگ لیتموس در محلولهای اسیدی به رنگ قرمز و در محلولهای بازی به رنگ آبی است.
گلبرگ برخی از گلها همچون گل رز و ادریسی و برخی میوهها همچون گیلاس و توتفرنگی در صورت تغییر pH خاک، تغییر رنگ میدهند. در خاکهای اسیدی، واکنشهای شیمیایی انجام میگیرند که سبب تشکیل آلومینیوم در این گیاهان میشوند و رنگ آنها را به آبی تبدیل میکنند. در خاکهای قلیایی (بازی)، چنین واکنشهایی انجام نمیگیرند و در نتیجه آلومینیومی توسط گیاه جذب نمیشود و تغییر رنگی نخواهیم داشت.

شناساگر اسید و باز طبیعی دیگری که باید به آن اشاره کنیم، زردچوبه است. این ادویه در محیطهای اسیدی به رنگ زرد و در محیطهای بازی، رنگ قرمز قهوهای دارد. در جدول زیر، رنگ برخی از شناساگرهای طبیعی در محیط اسیدی و بازی آورده شده است.
| شناساگر | pH پایین (اسیدی) | pH بالا (بازی) |
| گل ادریسی | آبی | صورتی تا بنفش |
| آنتوسیانین | قرمز | آبی |
| لیتموس | قرمز | آبی |
| زردچوبه | زرد | قرمز قهوهای |
معرفی فیلم آموزش علوم تجربی پایه هشتم - بخش شیمی
آنچه که در این آموزش مطرح شد، آشنایی با انواع معرفها و شناساگر اسید و باز در شیمی بود که از جمله مباحث مربوط به علوم پایه هشتم به شمار میآید و به دلیل اهمیت یادگیری آن، «فرادرس» اقدام به انتشار فیلم آموزش علوم تجربی پایه هشتم - بخش شیمی در قالب آموزشی ۵ ساعته کرده که توضیحات مربوط به دروس آن در ادامه آمده است.
این آموزش در ۶ درس به ببرسی بخش شیمی در علوم تجربی هشتم میپردازد و درس یکم تا سوم به بررسی مخلوطها، کلوئیدها، سوسپانسیون و امولسیون، روشهای جداسازی مواد و تغییرات فیزیکی و شیمیایی اختصاص دارد. درس چهارم تا ششم نیز، اتم و ساختار آن به همراه مدلهای اتمی، ایزوتوپ، آلوتروپ، یون و مفهوم کاتیون و آنیون تدریس خواهد شد.












سلام و عرض ادب،،،من نیاز به یک شناساگر دارم که محدود پنج و هشت دهم تا شش و دو دهم را مشخص کند آیا چنین شناساگری وجود دارد؟ با سپاس از شما
سلام.اگه گفته شده باشه که برای یک شناساگر(HIn)رنگ غالب فرمول مولکولی آن در نسبت ۲۰به ۱در پی هاچ ۶ظاهر میشود.اینجا منظور از رنگ غالب چیه؟
با سلام؛
منظور رنگی است که در آن pH مشاهده میشود. برای اطلاعات بیشتر به جدول داخل مطلب مراجعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام وقت بخیر در تیتراسیون اسید_باز به جز فنل فتالئین از چه شناساگر های دیگری می توان استفاده کرد؟
با سلام؛
برای این مورد به جدول موجود در مطلب «تیتراسیون اسید باز — از صفر تا صد» مراجعه کنید.
با تشکر از همراهی شما با مجله فرادرس
با تشکر از همراهی شما با مجله فرادرس