فیزیولوژی قلب و دستگاه گردش خون — به زبان ساده
تامین خون تمام اندامهای بدن وظیفه اصلی قلب است. این فعالیت با انقباض ماهیچههای تمایزیافته و مستقل از دستگاه عصبی انجام میشود. فیزیولوژی قلب بخشی از علم زیستشناسی است که مکانیسم خودتحریکی این اندام، انقباض، تغییرات جریان الکتریکی و نقش بافتهای قلبی در فعالیت این اندام را بررسی میکند. در این مطلب از مجله فرادرس فیزیولوژی قلب را همراه ارتباط آن با سیستم گردش خون توضیح میدهیم.
فیزیولوژی قلب چیست ؟
به طور کلی فیزیولوژی بدن انسان بخشی از زیستشناسی است که فعالیتهای اندامها در شرایط فیزیولوژیک و طبیعی بدن را بررسی میکند. فعالیت قلب به ساختار بافتها و شیوه ارتباط این بافتها با هم بستگی دارد. در نتیجه برای بررسی فیزیولوژی قلب به اطلاعات در مورد آناتومی، بافتها، فرایند انقباض ماهیچههای قلبی، جریان الکتریکی قلب، انتقال خون به رگها و بافتهای قلب نیاز داریم.
آناتومی و بافت قلب
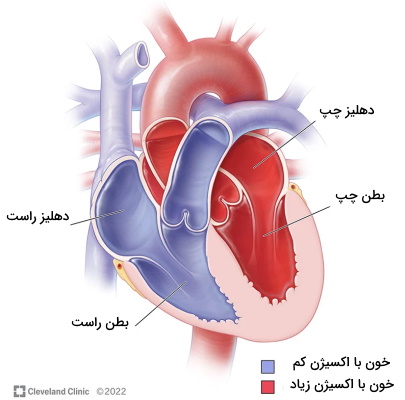
قلب اندام ماهیچهای و مخروطی است که از چهار حفره اصلی تشکیل میشود. این اندام وسط قفسه سینه (دو-سوم سمت چپ و یک-سوم سمت راست) قرار دارد و پوشش محافظی از جنس بافت پیوندی اطراف آن را میپوشاند. ساختار بافتی و حفرههای این اندام نقش مهمی در فیزیولوژی قلب دارد. دیواره جلویی قلب با استخوان جناغ، غضروف دندهای مشترک، ریه چپ و پرده جنب در ارتباط است. نای، آئورت پایینرونده سینهای، سیاهرگ جفت (آزیگوز| Azygos)، «سیاهرگ نیمهجفت» (Hemiazygos) و مجرای سینهای پشت قلب قرار دارند. پایین قلب دیافراگم و دو طرف قلب ریهها قرار دارند.
حفره های قلب
قلب بهوسیله دیوارههای ماهیچهای به چهار حفره مجرا (دو حفره در هر سمت بدن) تقسیم شده است. «دهلیزهای» (Atrium) چپ و راست در بخش بالایی قلب (نزدیک سر) و «بطنهای» (Ventricle) چپ و راست در بخش پایینی قلب (نزدیک شکم) قرار دارند. خون از دهلیزها وارد قلب شده و بهوسیله بطنها از قلب خارج میشود. سپتوم بین دهلیزی و سپتوم بینبطنی دو تیغهای است که حفرههای سمت راست و چپ قلب را از هم جدا میکنند. به همین دلیل در قلب سالم هیچ وقت خون دو طرف قلب با هم مخلوط نمیشود. سپتوم بیندهلیزی از بافت ماهیچه قلبی با قطری زیاد تشکیل شده است. اما بخش بالایی سپتوم بینبطنی (نزدیک دهلیز) از جنس بافت پیوندی رشتهای و بخش پایینی آن (نزدیک نوک قلب) از جنس ماهیچههای ضخیم قلبی است.
اسکلت فیبروزی قلب
اسکلت قلب از چهار حلقه فیبروزی، غشای «تریگون» (Trigones) و غشای پیوندی سپتومهای قلب (بین دهلیزی، بین بطنی و دهلیزی-بطنی) تشکیل شده است. این اسکلت بین دهلیز و بطن قرار دارد و حلقههای آن از بافت پیوندی متراکم تشکیل شده است. حلقههای پیوندی اطراف دهانه دریچهها قرار دارد. تریگون چپ و راست قلب، بافت پیوندی بسیار متراکمی است که حلقههای اطراف دریچه آئورت با دریچه میترال و دریچه ششی با دریچه سهلختی را به هم متصل میکند.
این بافت محکم علاوه بر حفظ ساختار و افزایش استحکام بافتهای قلب، با ایجاد عایق الکتریکی نقش مهمی در فیزیولوژی قلب دارند. این عایق انتقال جریان الکتریکی از دهلیز به بطن را مهار میکند. در نتیجه پتانسیل عمل فقط از رشتههای تمایزیافته هدایت جریان الکتریکی به بطنهای منتقل میوند.
دریچه های قلب
چهار دریچه قلب بین دهلیز و بطن هر سمت و بطن و سرخرگهای خروجی از قلب قرار دارد. این ساختارها از برگشت خون خروجی به قلب و مخلوط شدن خون دهلیز و بطن هر سمت این اندام جلوگیری میکنند. دریچه سهلختی بین دهلیز و بطن راست، دریچه میترال یا دولختی بین دهلیز و بطن چپ، دریچه آئورت بین بطن چپ و سرخرگ آئورت و دریچه ششی بین بطن راست و سرخرگ ششی قرار دارد. دریچههای قلب از بافت پیوندی رشتهای با کلاژن، الاستین و پروتئوگلایکان فراوان تشکیل شده است که بهوسیله طناب وتری به ماهیچههای پاپیلری دیواره بطن متصل میشود.
بافت دیواره قلب
دیواره بطن از چندین لایه بافت پیوندی و ماهیچهای تشکیل شده است. پریکاردیوم، اپیکاردیوم، میوکاردیوم و اندروکاردیوم بافت قلب از خارج به داخل را تشکیل میدهند.
پریکاریدیوم و اپیکاردیوم
پریکاردیوم یا آبشامه کیسهای از بافت پیوندی دولایه است که قلب را از اندامهای اطراف جدا میکند. بخش خارجی (پریکاردیوم فیبروزی) این کیسه از بافت پیوندی متراکمی تشکیل شده است که انعطافپذیری زیادی ندارد. به همین دلیل از قلب در برابر فشار ناگهانی قفسه سینه محافظت میکند. بافت بخش داخلی (پریکاردیوم سروزی) از بافت پیوندی سست با رشتههای الاستین فراوان تشکیل شده است. بین دو لایه پریکاردیوم سروزی فضای بسیاری باریکی وجود دارد که بهوسیله ۱۵ تا ۵۰ میلیلیتر مایع سروزی پر شده است. رشتههای عصبی برای رسیدن به بافت ماهیچهای قلب از این لایه عبور میکنند.
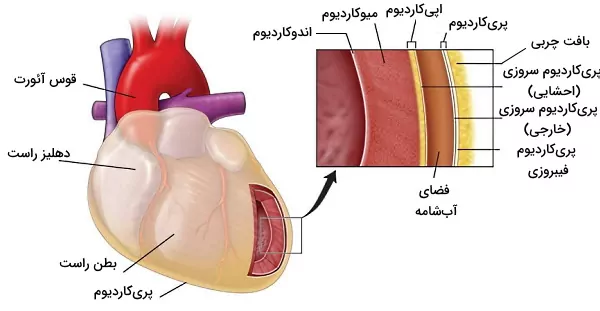
اپیکاریدیوم خارجیترین لایه دیواره قلب و مجموعهای از سلولهای مزوتلیال (اپیتلیال بافتهای احشایی)، بافت چربی و پیوندی است.
میوکاردیوم
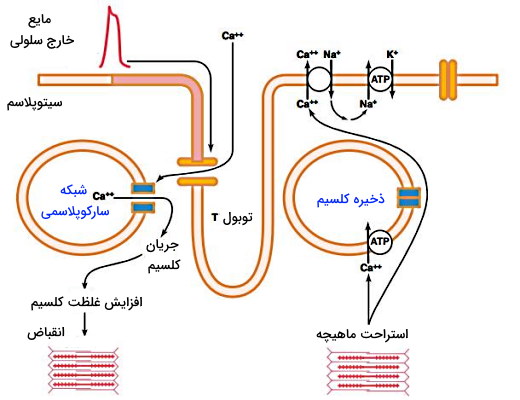
میوکاردیوم لایه عملکردی اصلی در فیزیولوژی قلب است. این بافت ماهیچهای است که فقط در قلب وجود دارد و به شکل غیرارادی منقبض میشود. سلولهای این بافت ماهیچهای مخطط برخلاف ماهیچه اسکلتی از یک هسته مرکزی تشکیل میشود. میتوکندری و شبکه سارکوپلاسمی دو اندامک فراوان در سیتوپلاسم سلولهای ماهیچه قلبی است که انرژی و یون کلسیم لازم برای انجام فعالیت فیزیولوژی قلب را فراهم میکند. گرانولهای گلیکوژن یکی دیگر از ساختارهای سیتوپلاسمی و انبار ذخیره انرژی این سلولها است. پروتئینهای انقباضی، توبولهای T و دیسک بین لایهای سه ساختار مهم فیزیولوژی قلب در میوکارد هستند.
- پروتئینهای انقباضی: اکتین، میوزین، تیتین، نبولین و پروتئینهای خط z پروتئینهای انقباضی سلولهای ماهیچه قلبی هستند که آرایش سیتوپلاسمی آنها شبیه ماهیچههای اسکلتی است. میکروفیلامنتهای اکتین از زیرواحدهای G اکتین تشکیل شده است و بهوسیله نبولین به پروتئینهای خط Z متصل میشود. مولکولهای میوزین II از دو زنجیره سنگین و دو زنجیره سبک مشابه تشکیل شده است. سر میوزین بخشی است که به میکروفیلامنتهای اکتین متصل میشود و با هیدرولیز ATP انرژی لازم برای حرکت این دو رشته را فراهم میکند. این مولکولها بهوسیله تیتین به پروتئینهای خط Z منتصل میشوند.
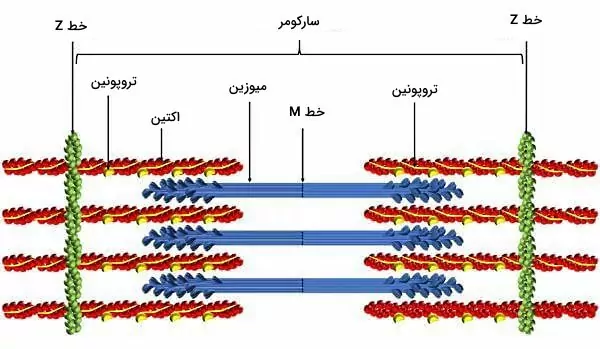
- توبول T: توبولهای T فرورفتگیهای غشای پلاسمایی در کاردیومیوسیتها هستند. تعداد این توبولها در ماهیچههای قلبی از اسکلتی کمتر، اما عرض آنها بیشتر است. بخش سیتوپلاسمی توبولهای T نزدیک سیسترنای شبکه سارکوپلاسمی قرار دارد و سرعت انتقال پتانسیل الکتریکی ایجاد شده در غشا به این منبع ذخیره کلسیم را افزایش میدهد.
- دیسک بین لایهای: دیسک بین لایهای یا صفحات اینترکاله یکی دیگر از ساختارهای غشایی است که به تنظیم فیزیولوژی قلب کمک میکند. اتصالات این ساختار بین سیتوپلاسم دو کاردیومیوسیت مجاور در محل خط Z ارتباط برقرار میکند. دیسک بینلایهای از اتصالات دسموزومی، شکافدار و فاسیا ادهرنس تشکیل شده است.
- اتصالات دسموزومی: این اتصالات از تعداد زیادی پروتئین غشایی تشکیل شده است و غشا را به فیلامنتهای حدواسط اسکلت سلولی متصل میکند. ساختار محکم این اتصال از جدا شدن سلولهای ماهیچهای بر اثر فشار انقباض جلوگیری میکند.
- اتصالات فاسیا ادهرنس: پروتئینهای این اتصال به میکروفیلامنتهای اکتین متصل میشوند و به حرکت غشا در انقباضهای ماهیچه قلب کمک میکنند.
- اتصالات شکافدار: اتصالات شکافدار از پروتئینهای غشایی تشکیل شده است که با ایجاد کانال بین غشای پلاسمایی دو سلول کنار هم ارتباط برقرار میکنند. هر یک از این کانالها از ۶ پروتئین کانکسین تشکیل میشود. این اتصالات با انتقال یون کلسیم بین سیتوپلاسم سلولهای قلب به انقباض همزمان ماهیچهها کمک میکند.
اندوکاردیوم
اندوکاردیوم از دو لایه بافت تشکیل شده است که سطح حفرهها و دریچههای قلب را میپوشاند. بخش خارجی این لایه (در تماس با حفرهها) از یک لایه سلول اندوتلیال تشکیل شده است و لایهای از بافت پیوندی زیر آن قرار دارد. بافت پیوندی اندوکاردیوم با بافت پیوندی میوکاردیوم در ارتباط است و رشتههای سیستم هدایت قلب از آن منشعب میشود.
بافت محرک قلب
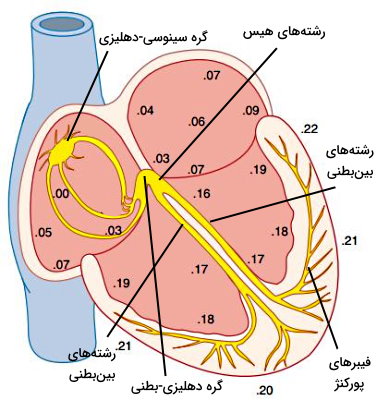
فعالیت تمام اندامها و دستگاههای بدن به دریافت مواد غذایی (گلوکز و آمینواسید) و اکسیژن از خون و جریان خون در بافتها به قدرت انقباضی قلب بستگی دارد. به همین دلیل سیستمی مستقل از دستگاه عصبی شروع پتانسیل الکتریکی و هدایت جریان به میوکارد را کنترل میکند. از کنار هم قرار گرفتن سلولهای ماهیچه قلبی تمایزیافته این سیستم، گرهها و رشتههای سیستم هدایت جریان الکتریکی تشکیل میشود. گرهها ساختارهای جریانساز (باتری) و رشتهها ساختارهای انتقال جریان الکتریکی (سیم) هستند. بافت محرک قلب از گره سینوسی-دهلیزی (Sinuatrial Nodes | SA)، رشتههای بین گرهای، گره دهلیزی-بطنی (Atrioventricular Nodes | AV)، رشتههای بین بطنی، رشتههای دیواره بطنی و فیبرهای پورکنژ تشکیل شده است.
- گره سینوسی-دهلیزی: این گره با قطری حدود ۲۵ میلیمتر در دیواره بالایی-پشتی (نزدیک سر و ستون مهرهها) دهلیز راست و نزدیک محل خروج «ورید اجوف فوقانی» (Superior Vena Cava) قرار دارد. این گره مرکز اصلی ایجاد جریان الکتریکی قلب است.
- رشتههای بین گرهای: این رشتهها بین گره سینوسی-دهلیزی و گره دهلیزی-بطنی قرار دارند و جریان الکتریکی را به میوکارد دهلیز راست و گره دهلیزی-بطنی منتقل میکنند.
- رشتههای درون دهلیزی: رشتههای درون دهلیزی یا «رشتههای بکمن» (Bachmann’s bundle) جریان الکتریکی ایجاد شده در گره سینوسی-دهلیزی را به میوکارد دهلیز راست و چپ منتقل میکند. جریان الکتریکی این رشته در نهایت به گره دهلیزی-بطنی منتقل میشود.
- گره دهلیزی-بطنی: گره دهلیزی-بطنی دومین منبع جریانساز قلب است. کاردیومیوسیتهای تمایزیافته این گره تنها مسیر انتقال پتانسیل جریان الکتریکی از میوکارد دهلیز به بطن است. این گره بخش پایینی و دیواره پشتی سپتوم بین دهلیزی قرار دارد. اندازه کوچکتر این گره نسبت به گره سینوسی-دهلیزی و تعداد کمتر اتصالات شکافدار، سرعت انتقال جریان الکتری بین سلولهای این بخش از سیستم هدایت جریان الکتریکی را کاهش میدهد.
- رشتههای بین بطنی: رشتههای هیس (Hiss) بخش ابتدایی رشتههایی را تشکیل میدهند که جریان الکتریکی را از گره دهلیزی-بطنی خارج میکند. هدایت جریان در این رشتهها یکطرفه است و پتانسیل الکتریکی از بطنها به دهلیز برنمیگردد. این رشتهها از بافت پیوندی سپتوم بین بطنی عبور کرده و در میوکارد به دو دسته چپ و راست تقسیم میشوند. شاخه سمت چپ هدایت جریان الکتریکی به بطن سمت چپ و شاخه راست هدایت جریان الکتریکی به بطن راست را بر عهده دارد. این رشتهها جریان الکتریکی لازم برای انقباض ماهیچههای پاپیلری را تامین میکنند.
- فیبرهای پورکنژ: رشتههای پورکنژ سیستم انتقال جریان الکتریکی در بافت زیراندوکاردیوم هستند و پتانسیل عمل را در کل حفره بطنی منتقل میکنند. این رشتهها از نوک قلب شروع شده و دیوراههای کناری حرکت میکنند. تعداد اتصالات شکافدار بین سلولی و در نتیجه سرعت انتقال پیام در این رشتهها از سلولهای گره دهلیزی بطنی بیشتر است.
فیزیولوژی سیستم خودتحریکی قلب
جریان یون کلسیم و سدیم در سلولهای گره سینوسی-دهلیزی نقش مهمی در فیزیولوژی قلب دارد. کانالهای نشتی زیادی در غشای سلولهای سینوسی قرار دارد که با به عبور بسیار آهسته یونهای سدیم از غشای این سلولها کمک میکند. میانگین پتانسیل الکتریکی غشای این سلولها معمولا ۶۰- میلیولت است. اگر ورود یون سدیم از این کانالها پتانسیل الکتریکی غشا را به ۴۵- میلیولت تغییر دهد، کانالهای کلسیمی نوع T (حساس به ولتاژ) باز خواهد شد. عبور یونهای کلسیم از این کانالها با افزایش پتانسیل پتانسیل غشا (۴۰- میلیولت) و باز شدن کانالهای کلسیمی نوع L همراه است. در نتیجه یون کلسیم در سیتوپلاسم بسیار افزایش مییابد و بخشی از آن از اتصالات شکافدار وارد سلول کنای میشود (انتقال جریان الکتریکی).
انتقال کلسیم از اتصالات بینسلولی به سیتوپلاسم سلولهای ماهیچه قلبی به مرور پتانسیل الکتریکی غشا را از حدود ۹۰- به ۷۰- افزایش میدهد. در این شرایط کانالهای ولتاژی سدیم باز شده و سدیم با سرعت (تعداد یون عبوری از کانال در ثانیه) بسیار زیاد وارد سلول میشود. همزمان کانالهای ولتاژی کلسیم باز شده و تعداد کمی یون وارد سیتوپلاسم میشود. ورود کاتیونها به سیتوپلاسم، پتانسیل الکتریکی سلول را به ۱۰+ میلیولت افزایش داده و کانالهای ولتاژی سدیم بسته میشود.
مثبت شدن پتانسیل الکتریکی سلول با تغییر کنفورماسیون دریچه کانالهای ولتاژی پتاسیم، باز شدن این کانالها و خروج پتاسیم از سلول همراه است. کاهش غلظت کاتیونها پتانسیل الکتریکی سلول را به صفر میلیولت کاهش میدهد. کنفورماسیون دریچه کانالهای کلسیم نوع L در غشای سلولهای ماهیچه قلبی و توبولهای T به این پتانسیل بسیار حساس هست. به همین دلیل باز شدن دریچهها با ورود جریانی از یون کلسیم به سیتوپلاسم همراه است. اما خروج همزمان یون پتاسیم از تغییر پتانسیل غشا جلوگیری میکند.
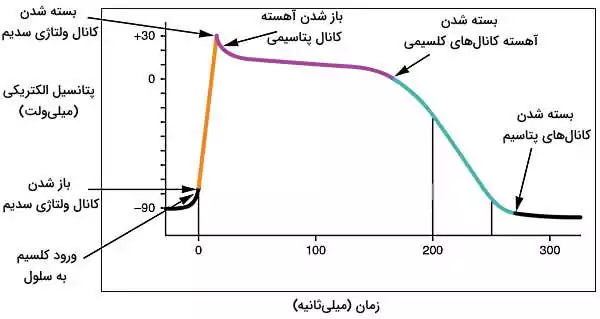
در سلولهای هدایت جریان الکتریکی دریچه کانالهای پتاسیم با تغییر پتانسیل به ۴۰+ میلیولت باز شده و پتاسیم به سرعت از سلول خارج میشود. در نتیجه غشا ریپلاریزه شدن و پتانسیل آن به پتانسیل استراحت برمیگردد. در این سلولها مرحله مقاوم به جریان نشده و سلول میتواند بلافاصله دپلاریزه شود.
خروج پتاسیم و کاهش پتانسیل الکتریکی در سلولهای ماهیچه قلبی ریپلاریزه شدن سلول همراه است. در این شرایط کانالهای نوع L غشایی بسته شده و جریان یون کلسیم متوقف میشود. به علاوه پمپ پروتون-کلسیم و سیمپورتر کلسیم-سدیم غشای شبکه سارکوپلاسمی و غشای پلاسمایی کلسیم را از سیتوپلاسم خارج میکند. در نتیجه پتانسیل غشا منفیتر از حالت استراحت میشود.
اثر سیستم عصبی بر فیزیولوژی قلب
سیستم عصبی سمپاتیک و پاراسمپاتیک اعصاب خودمختار سیستم عصبی محیطی هستند که با اثر بر سلولهای خودتحریکی گرهههای بطنی و ماهیچهها فیزیولوژی قلب را تغییر میدهند. گیرنده بتا آدرنرژیک در غشای سلولهای گره به اپینفرین و نوراپینفرین آزاد شده از پایانه آکسون این اعصاب متصل میشود. اتصال انتقال دهنده عصبی-گیرنده در این سلولها با فعال شدن پروتئین Gs، تبادل GDP با GTP، فعال شدن آنزیم آرنیلات سیکلاز غشا و افزایش ناقل ثانویه cAMP در سیتوپلاسم همراه است. cAMP با اتصال به جایگاه تنظیمی، آنزیم پروتئین کیناز A را فعال میکند. این آنزیم با فسفوریلاسیون برگشتپذیر کانالهای نوع L کلسیم و تغییر کنفورماسیون دریچه، تعداد دفعات باز شدن کانال را افزایش میدهد. در نتیجه فاصله بین دو پتانسیل عمل کاهش یافته و ضربان قلب افزایش مییابد.
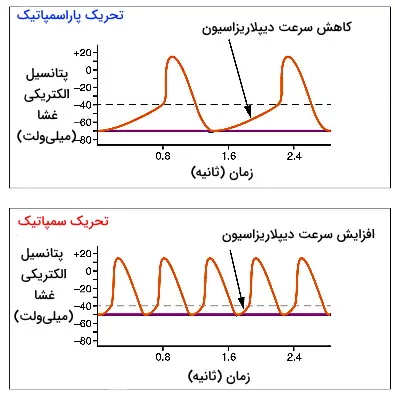
اتصال انتقال دهنده عصبی استیل کولین اعصاب پاراسمپاتیک (عصب واگ) به گیرندههای M2 در غشای سلولهای گرههای قلب با فعال شدن پروتئین Gi و تبادل GDP با GTP همراه است. در این شرایط زیرواحدهای گاما و بتا از این پروتئین جدا شده و به کانالهای لیگاندی پتاسیم متصل میشود. این اتصال با تغییر کنفورماسیون دریچه و خروج یونهای پتاسیم غشای سارکوپلاسمی را هایپرریپلاریزه کرده و فاصله ایجاد شده بین دو پتانسیل عمل را کاهش میدهد. در نتیجه ضربان قلب کاهش مییابد. به علاوه زیرواحد آلفای این Gi با اتصال به آنزیم آدنیلات سیکلاز و مهار این آنزیم، غلظت cAMP و ورود کلسیم به سلول، ضربان قلب را کاهش میدهد.
اثر سیستم سمپاتیک بر انقباض ماهیچه قلب
اتصال اپینفرین به گیرندههای بتای غشای سلولهای ماهیچهها با فعال شدن پروتئین Gs، پروتئین کیناز A را فعال میکند. پروتئین کیناز A پروتئین فسفولامبان در غشای شبکه سارکوپلاسمی را فعال میکند. این پروتئین باز شدن کانالهای کلسیمی را تحریک و ذخیره این یون در اندامک را افزایش میدهد. به علاوه کیناز A با فسفوریلاسیون برگشتپذیر دریچه کانالهای ولتاژی کلسیم در غشای سارکوپلاسم، ورود این یون به سیتوپلاسم را افزایش میدهد. کلسیم ورودی به کانالهای رایمودین-۲ متصل و جریان یون کلسیم از شبکه سارکوپلاسمی به سیتوپلاسم را تحریک میکند. در نتیجه کلسیم بیشتری برای اتصال به پروتئینهای انقباضی و افزایش سرعت انقباضی قلب در سیتوپلاسم وجود دارد. افزایش سرعت انقباض ماهیچهها منجر به افزایش بیرونده قلب و فشار خون میشود.
فیزیولوژی انقباض ماهیچه قلب
اتصال کلسیم به کانالهای لیگاندی رایمودین-۲ در غشای شبکه سارکوپلاسمی با تغییر کنفورماسیون دریچه این کانال سبب ورود کلسیم ذخیره شده در این اندامک به سارکوپلاسم سلول ماهیچهای میشود. این کلسیم به پروتئینهای تروپونین متصل شده و کنفورماسیون آن را تغییر میدهد تغییر کنفورماسیون با آزاد شدن جایگاه اتصال به میوزین در میکروفیلامنتهای اکتین همراه است. در نتیجه سر میوزین به اکتین متصل شده و با هیدرولیز هر مولکول ATP روی فیلامنتهای اکتین و به سمت خط M حرکت میکند. میکروفیلامنتهای اکتین به خط Z و پروتئینهای این خط به غشای پلاسمایی متصل است. در نتیجه غشا به داخل کشیده شده و سلول منقبض میشود.
فیزیولوژی تحریک ناپذیری ماهیچه قلب
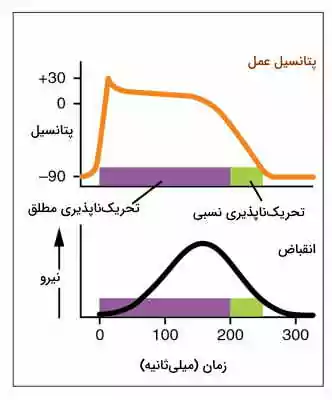
در تمام سلولهای تحریکپذیر دورهای وجود دارد که سلول به ایجاد تحریک مجدد پاسخ نمیدهد. تحریکناپذیری نسبی به شرایطی گفته میشود که اگر شدت یا تعداد دفعات تحریک افزایش یابد، در سلول اختلاف پتانسیل ایجاد میشود. اما در تحریکناپذیری مطلق افزایش شدن یا تعداد دفعات تحریک اثری بر تغییر پتانسیل ندارد و سلول در چرخه قبلی باقی میماند.
- تحریکناپذیری مطلق ماهیچه قلب: دوره تحریکناپذیری بطن بین ۰٫۲۵ تا ۰٫۳۰ ثانیه است. در این زمان کانالهای دریچهدار کلسیمی باز و غشای میوکارد بطن دپلاریزه است. بخش صاف منحنی پتانسیل به زمان تحریکناپذیری مطلق قلب را نشان میدهد. تحریکناپذیری دهلیزها بسیار کمتر و حدود ۰٫۱۵ ثانیه است.
- تحریکناپذیری نسبی ماهیچه قلب: دوره تحریکناپذیری نسبی قلب ۰٫۰۵ ثانیه است. در این شرایط اگر شدت پیام تحریکی بسیار زیاد باشد، قلب قبل از دیاستول کاملا دوباره وارد سیستول میشود. بخش نزولی نمودار پتانسیل به زمان تحریکناپذیری نسبی قلب را نشان میدهد. در این دوره کانالهای پتاسیمی باز و غشای میوکارد بطنها ریپلاریزه است.
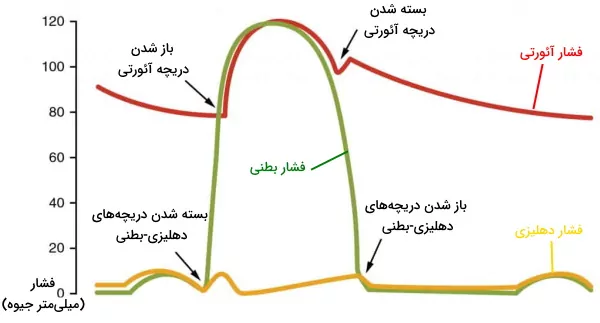
فیزیولوژی چرخه قلب
چرخه قلب مجموعهای از اتفاقاتی است که با پر شدن قلب از خون، انقباض حفرهها و خروج قلب از خون همراه است. تغییر فشار حفرهها، انتقال جریان الکتریکی و انقباض ماهیچهها اتفاقات مهمی هستند که بر اساس آن چرخه قلب را مراحل دیاستول کامل قلب، سیستول دهلیزها، سیستول بطن و دیاستول بطن تقسیم میکنند. مراحل دیاستول استراحت و سیستول انقباض ماهیچهها را نشان میدهد. در ادامه هر یک از این مراحل را توضیح میدهیم. لازم به ذکر است اگر به اطلاعات بیشتر در مورد فیزیولوژی قلب و دشتگاههای دیگر بدن نیاز دارید، مجموعه آموزش فیزیولوژی مقدماتی تا پیشرفته فرادرس به شما پیشنهاد میشود.
- دیاستول کامل: چرخه قلب با مرحله دیاستول شروع میشود. در این مرحله سلولهای میوکارد دهلیز و بطن در حالت استراحت هستند. خون با فشار پایین اکسیژن از وریدهای اجوف فوقانی و تحتانی وارد دهلیز راست میشود. خون با فشار اکسیژن بالا بهوسیله چهار سیاهرگ ششی وارد دهلیز چپ میشود. دریچههای بینبطنی در دیاستول کامل قلب باز هستند و خون از دهلیز به بطن منتقل میشود. اما دریچههای آئورتی و ششی بسته هستند تا بازگشت خون به بطنها جلوگیری شود.
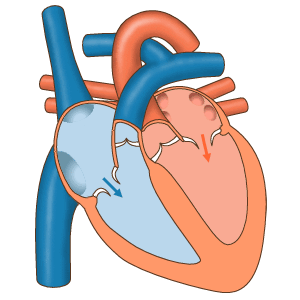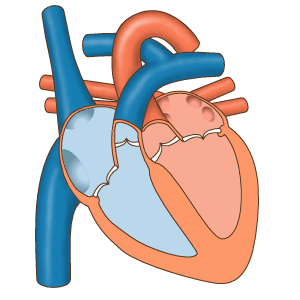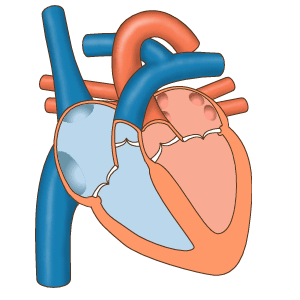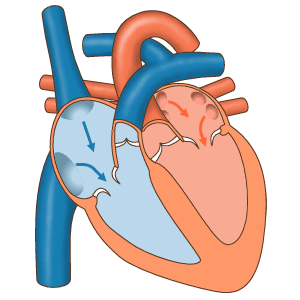
- سیستول دهلیز: در این مرحله جریان الکتریکی در تمام دهلیز پخش شده و میوکارد این حفرهها منقبض میشود. دریچههای بینبطنی باز و دریچههای سرخرگی باز هستند. با انقباض دهلیز خون باقی مانده به بطن منتقل میشود. این بخش از چرخه قلب در ۱۰۰ ثانیه انجام شده و قبل از شروع دیاستول دهلیز تمام میشود.
- سیستول بطن: سیتول بطن با دپلاریزه شدن ماهیچههای قلبی شروع میشود. در ابتدای این مرحله از چرخه قلب انقباض بطنها فشار این حفره را نسبت به دهلیز افزایش میدهد. در نتیجه دریچههای میترال و سهلختی بشته میشوند. اما فشار سرخرگی هنوز از بطنها بیشتر است. در نتیجه دریچههای ششی و آئورت بسته هستند و خونی از قلب خارج نمیشود. در نتیجه این مرحله از سیستول قلب انقباض «حجم ثابت» (Isovolumic Contraction) نام دارد. در مرحله دوم انقباض ماهیچهها، فشار خون در محیط بسته قلب را افزایش داده، فشار بطنها از سرخرگ بیشتر شده و دریچههای سرخرگی باز میشود.
- دیاستول بطن: با شروع ریپلاریزه شدن سلولهای ماهیچهای، بطن وارد دیاستول یا استراحت دومرحلهای میشود. پایان انقباض با کاهش فشار بطنها نسبت به سرخرگها همراه است. در نتیجه خون به عقب حرکت کرده و دریچههای آئورت و ششی را میبندد. در این مرحله دریچههای دهلیزی-بطنی بسته است. در مرحله دوم استراحت کامل ماهیچههای بطن منجر به کاهش بیشتر فشار میشود. زمانی که فشار بطن کمتر از فشار دهلیزها شود، جریان خون دریچههای میترال و سهلختی را باز کرده و وارد بطن خواهد شد.
حجم های قلب
برونده قلب حجم خونی است که در هر دقیقه از بطنها خارج میشود. این مقدار را میتوان از حاصلضرب «ضربان قلب» (Heart Rate | HR) در «حجم ضربهای» (Stroke Volume | SV) محاسبه کرد. ضربان تعداد دفعات انقباض قلب در دقیقه و حجم ضربهای حجم خونی است که در هر انقباض از قلب خارج میشود.
حجم ضربهای از اختلاف بین حجم انتهای دیاستولی (End-Diastolic Volume | EDV) و حجم انتهای سیستولی (End-Systolic Volume | ESV) محاسبه میشود. حجم انتهای دیاستولی، حجم خونی است که در پایان دیاستول کامل قلب بدون انقباض دهلیزها (غیرفعال) وارد بطن میشود. حجم سیستولی، حجم خونی است که در پایان هر سیستول در بطن باقیمیماند. در نتیجه حجم ضربهای را میتوان از فرمول زیر محاسبه کرد.
$$SV=EDV-ESV= 120-50=70 ml$$
میانگین ضربان قلب افراد بالغ و سالم حدود ۷۰ ضربه در دقیقه و حجم خون ضربهای حدود ۷۰ میلیلیتر است. در نتیجه برونده قلب برای این فرد حدودد ۵ لیتر در دقیقه است. عواملی تغییردهنده ضربان و حجم ضربهای، حجم برونده قلب را کاهش یا افزایش میدهند.
عوامل تغییردهنده ضربان قلب
سیستم عصبی عصبی خودمختار، هورمونها، غلظت یونها (کلسیم و پتاسیم)، افزایش سن و تحریک گیرندههای شیمیایی عواملی است که ضربان قلب و به دنبال آن برونده قلب را تغییر میدهد.
- سیستم عصبی: تحریک گره سینوسی-دهلیزی بهوسیله اعصاب سمپاتیک ضربان قلب را افزایش و بهوسیله اعصاب پاراسمپاتیک ضربان قلب را افزایش میدهد. گیرندههای شیمیایی سلولهای تحریکپذیر در دیواره سرخرگهای آئورت و ششی هستند. کاهش فشار جزئی اکسیژن، افزایش فشار جزئی دیاکسید کربن و کاهش pH خون (اسیدوز) منجر به تحریک این گیرندهها و انتقال پیام عصبی به مرکز کنترل قلب در سیستم عصبی مرکزی میشود. عصب سمپاتیک پیام عصبی این مرکز را به قلب منتقل میکند.
- هورمون: اتصال هورمونهای تیروئیدی (T4 و T3) به گیرندههای سلولهای گره سینوسی-دهلیزی ضربان را افزایش میدهد.
- غلظت یونها: افزایش غلظت کلسیم (هایپرکلسمیا) در خون منجر به افزایش انتقال این یون به سارکوپلاسم، افزایش انقباض ماهیچههای بطن، افزایش ضربان و برونده قلب میشود. افزایش سون پتاسیم در خون (هایپرکالمیا) یکی از خطرناکترین فاکتورهایی است که فیزیولوژی قلب را تغییر میدهد. افزایش این یون در خون با انتقال آن در جهت شیب غلظت به سارکوپلاسم و افزایش زمان انقباض همراه است. این شرایط ممکن است به ایست قلبی (Cardiac Arrest) منجر شود.
- افزایش سن: ضربان قلب در جنین و نوزاد (۱۲۰ تا ۱۴۰ ضربه در دقیقه) بیشتر از فرد بالغ است. به علاوه ضربان قلب در افراد مسن بیشتر از جوانان است.
عوامل تغییر دهنده حجم ضربهای قلب
«پریلود» (Preload) یا خاصیت کشسانی میوکارد، قدرت انقباضی میوکارد و «افترلود» (Afterload) یا مقاومت در برابر خروج خون از قلب، سه پارامتر اصلی هستند که حجم ضربهای را تغییر میدهند.
- تغییر پریلود: پریلود به حجم پایان دیاستولی، زمان پر شدن قلب و فیبروز میوکارد بستگی دراد. کاهش فشار قفسه سینه نسبت به ناحیه شکمی، انقباض ماهیچههای صاف دیواره سیاهرگها و انقباض ماهیچههای صاف اطراف سیاهرگهای پا عواملی تغییر حجم پایان دیاستولی را تنظیم میکند. با تغییر این عاومل، حجم پایان دیاستولی و در نتجیه پریلود قلب تغییر خواهد کرد. کاهش زمان پر شدن قلب و فیبروز میوکارد عوامل دیگری هستند که پریلود را کاهش میدهد.
- تغییر قدرت انقباضی: افزایش انقباض میوکارد ار تباط مستقیم با افزایش حجم ضربهای دارد. قدرت انقباضی میوکارد بهوسیله اعصاب سمپاتیک، هورمونهای تیروئیدی، غلظت یونها و داروهای بتا بلاکر تغییر میکند. تحریک سمپاتیک، افزایش کلسیم خون و هورمونهای تیروئیدی انقباض میوکارد را افزایش میدهد. اما افزایش یونهای پتاسیم، سدیم و پروتون در خون انقباض را کاهش میدهد.
- تغییر افترلود: افزایش افترلود، حجم ضربهای قلب را کاهش میدهد. عوامل تغییردهنده فشار خون در سرخرگها و حفرههای قلب، افترلود را افزایش میدهد. رسوب مولکولهای چربی در دیواره سرخرگ، بیماریهای دریچه آئورت و افزایش انقباض ماهیچههای صاف رگها با افزایش فشار خون نیروی لازم برای خارج شدن خون از بطن و افترلود را افزایش میدهد.
عوامل محیطی تغییر برون ده قلب
حجم برونده قلب در شرایط فیزیولوژيک برابر با حجم خونی است که در دقیقه بهوسیله سیاهرگ وارد دهلیز راست میشود و بازگشت وردیدی نام دارد. در نتیجه تغییرات سیستم گردش خون محیطی ازجمله افزایش مقاومت دیواره رگها بازگشت وریدی و برونده قلب را تغییر میدهد. تغییر مقاومت محیطی رگها در طولانیمدت یکی از عواملی است که برونده و فیزیولوژی قلب را تغییر میدهد. مقاومت محیطی با برونقلب رابطه معکوس دارد. افزایش مقاومت محیطی منجر به کاهش برونده و کاهش مقاومت محیطی منجر به افزایش برونده میشود. بریبری، فیستول وریدی-سرخرگی، پرکاری تیروئید و کمخونی بیماریهایی هستند که با کاهش مقاومت محیطی برونده قلب را افزایش میدهند.
- بریبری: این بیماری به دلیل کمبود ویتامین B ایجاد میشود. در این شرایط جذب بعضی از مواد موردنیاز و توانایی سلول برای استفاده از آنها کاهش مییابد. به همین دلیل مکانیسمهای تنظیم بافتی با افزایش نفوذپذیری رگها، فشار خون منطقهای را کاهش میدهد تا فرصت کافی برای انتقال مولکولهای مورد نیاز اط غشای سلولی فراهم شود. درنتیجه مقاومت محیطی در این بیماری به نصف شرایط طبیعی کاهش یافته و برونده قلب دو برابر میشود.
- فیستول وریدی-سرخرگی: فیستول یا شانت زمانی ایجاد میشود که منفذی بین دیواره دو رگ ایجاد شده و حجم زیادی از خون سرخرگی وارد سیاهرگ میشود. در این شرایط کاهش حجم خون سرخرگی مقاومت محیطی را کاهش میدهد و همزمان برگشت وریدی و برونده قلب افزایش مییابد.
- پرکاری تیروئید: در پرکاری تیروسید افزایش تذشح هورمون متابولیسم بافتها و نیاز به اکسیژن را افزایش میدهد. در نتیجه بافت برای افزایش جریان خون و فراهم کردن فرصت کافی انتشار اکسیژن، قطر رگ را افزایش و جریان خون بافت را کاهش میدهد. در نتیجه برگشت وریدی و برونده قلب (۴۰ تا ۸۰ درصد بیشتر از حالت طبیعی) افزایش مییابد.
- کمخونی: کاهش ویسکوزیتی خون و اکسیژنرسانی به بافتها در کمخونی مقاومت محیطی را کاهش و برونده قلب را افزایش میدهد.

کاهش حجم خون سیستمی، افزایش قطر رگها، انسداد سیاهرگهای بزرگ، کاهش حجم بافت و کاهش متابولیسم عوامل محیطی هستند که برونده قلب را کاهش و فیزولوژی قلب را تغییر میدهند.
- کاهش حجم خون: کاهش حجم خون که مهمترین دلیل آن خونریزی است برونده قلب را کاهش می دهد.
- افزایش قطر رگ: افزایش ناگهانی قطر رگ معمولا در شرایطی ایجاد میشود که عملکرد سیستم سمپاتیک متوقف شده است. در این شرایط فشار خون کاهش و خون به قلب برنمیگردد. درنتیجه برونده قلب کاهش مییابد.
- انسداد سیاهرگهای بزرگ: انسداد سیاهرگهای بزرگ جریان خون برگشتی و برونده قلب را کاهش میدهد.
- کاهش حجم بافت: افزایش سن و کاهش فعالیت بدنی در طولانیمدت منجر به کاهش توده عضله اسکلتی میشود. به همین دلیل مصرف اکسیژن و جریان خون این بافت کاهش یافته و برونده قلب را کاهش میدهد.
- کاهش متابولیسم: کاهش متابولیسم بدن در شرایط استراحت یا بیماریهای متابولیکی ازجمله کمکاری تیروئید با کاهش جریان خون همراه است. در نتیجه برونده قلب در این شرایط کاهش مییابد.
الکتروکاردیوگرام
«الکتروکاردیوگرام» (Electrocardiogram | ECG or EKG) منحنی است که فعالیت الکتریکی قلب را نشان میدهد. بهوسیله این منحنی عوامل تغییردهنده فیزیولوژی قلب را تشخیص داد. برای انجام این آزمایش الکترودهای دستگاه الکتروکاردیوگرام روی پوست قفسه سینه، پا و دست فرد قرار داده میشود. در این منحنی اگر جهت جریان الکتریکی قلب از الکترود منفی به الکترود مثبت باشد، نمودار صعودی و اگر جهت این جریان از الکترود مثبت به الکترود منفی باشد، نمودار نزولی تشکیل میشود. توقف انتقال جریان یا انتقال بسیار کند جریان به شکل خط صاف در این نمودار ثبت میشود.
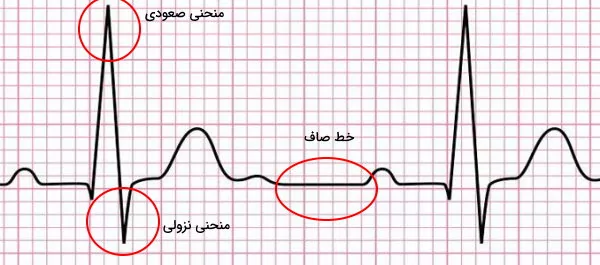
این منحنی را میتوان با قرار دادن ۱۰ الکترود در قفسه سینه، اندامهای فوقانی و اندامهای تحتانی انجام داد. این الکترودها پتانسیل الکتریکی قلبی را در ۱۲ جهت (لید یا اشتقاق) ثبت میکنند. به همین دلیل به این روش الکتروکاردیوگرافی ۱۲-لیدی (12-lead ECG) گفته میشود.
الکترودهای اندامهای حرکتی
این الکترودها روی بازو راست (RA)، بازوی چپ (LA)، ساق پای راست (RL) و ساق پای چپ (LL) قرار میگیرد. این الکترودها جریان الکتریکی ایجاد شده در سطح مقطع افقی قلب را ثبت میکنند. این الکترودها در ۶ لید دوقطبی (I، II و III) و تقویتشده اندام حرکتی (aVR، aVL و aVF) قرار میگیرند.
در مدل دوقطبی دو الکترود منفی روی بازو چپ، یک الکترود منفی و یک الکترود مثبت روی بازوی راست و دو الکترود مثبت روی پای چپ قرار میگیرد. اختلاف پتانسیل بین الکترود منفی بازوی راست و الکترود مثبت بازوی چپ لید I، اختلاف پتانسیل الکتریکی بین الکترو منفی بازو راست و الکترود مثبت پای چپ لید II و اختلاف پتانسیل بین الکترود مثبت پای چپ و الکترود منفی بازوی چپ لید III نام دارد. مجموع لید I و III برابر با لید II است.
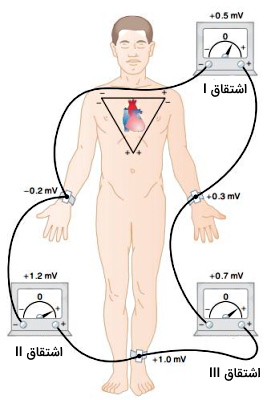
در لید aVR یک الکترود مثبت روی بازوی راست، یک الکترود منفی بازوی چپ و یک الکترود منفی روی پای چپ قرار میگیرد. در لید aVF یک الکترود منفی روی بازوی راست، یک الکترود منفی روی بازوی چپ و یک الکترود مثبت روی پای چپ قرار میگیرد. در لید aVL الکترودهای منفی روی پای چپ و بازوی راست و الکترود مثبت روی بازو چپ قرار میگیرد.
الکترودهای قفسه سینه
شش الکترود (V1-V6) در قفسه سینه قرار میگیرد. این الکترودها بین دندههای ۴ و ۵ سمت راست (V1) و چپ (V2) قفسه سینه، عمود بر استخوان ترقوه و بین دندههای ۵ و ۶ (V4)، بین الکترود ۲ و ۴ (V4)، همراستای الکترود V4 روی خط جلویی زیربغل و همراستای الکترود V4 روی خط میانی زیربغل قرار میگیرند. تمام این الکتروها مثبت هستند و اختلاف پتانسیل ایجاد شده در سطح مقطع عرضی بطنها را ثبت میکنند.
V1 و V2 اختلاف جریان ایجاد شده در سپتوم، V3 و V4 جریان الکتریکی ایجاد شده در دیواره جلویی بطنها (نزدیک دندهها) و V5 و V6 جریان الکتریکی ایجاد شده در بطن چپ را ثبت میکند.
منحنی الکتروکاردیوگرام
این الکترودها در لید II، جریان الکتریکی قلب سالم را در منحنی با سه موج اصلی P، QRS و T ثبت میکنند که در هر چرخه قلب تکرار میشود. موج P اولین قسمت منحنی است که پتانسیل ایجاد شده در دپلاریزه شدن میوکارد قلب را ثبت میکند. بین موج P و موج QRS بخش صافی به دلیل سرعت پایین انتقال پتانسیل الکتریکی در گره دهلیزی-بطنی ایجاد میشود. شاخه چپ رشتههای بین بطنی وظیفه انتقال جریان به میوکارد سپتوم بینبطنی را دارد. در این حالت جریان الکتریکی از الکترودهای مثبت به الکترود منفی حرکت کرده و موج نزولی Q ثبت میشود.
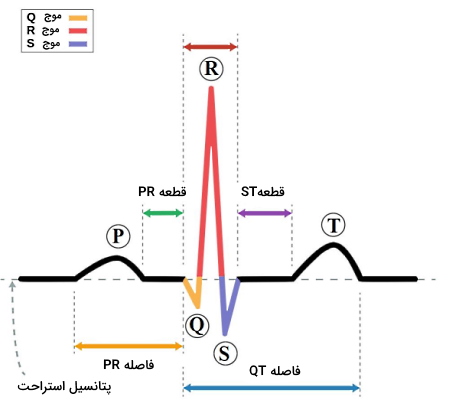
جهت جریان قلب در بطن چپ از الکترود منفی به مثبت و در بطن راست از الکترود مثبت به منفی است. اما ضخامت بیتشر میوکارد بطن چپ سبب ایجاد جریان پتانسیل بیشتر یده و میانگین جهت جریان از الکترود منفی به الکترود مثبت حرکت میکند. به همین دلیل دپلاریزه شدن میوکارد «نوک قلب» (Apex) بطنها به شکل موج صعودی R ثبت میشود. سپس جریان الکتریکی از نوک قلب به میوکارد «قاعده» (Base) و از الکترود مثبت به منفی حرکت میکند. در نتیجه دپلاریزه شدن میوکارد ابتدایی بطن در منحنی الکتروکاردیوگرام به شکل موج نزولی S دیده میشود. خط صاف S-T دپلاریزه شدن کامل بطنها را نشان میدهد و موج انتهایی T ریپلاریزه شدن بطن را به شکل موج صعودی ثبت میکند. در ریپلاریزاسیون، پتانسیل غشا از مقدار مثبت به مقدار منفی تغییر میکند و جهت جریان الکتریکی از الکترود منفی به الکترود مثبت است.
تفسیر الکتروکاردیوگرام
الکتروکاردیوگرام یکی از ابزارهای کاربردی برای بررسی فیزیولوژی قلب است و تفسیر آن به تشخیص بیماریهای بافت قلب کمک میکند. فیبروز میوکارد، تغییر بافت گره سینوسی، تغییر مسیر انتقال جریان الکتریکی در قلب و مسدود شدن (بلوک) مسیر انتقال جریان الکتریکی در در رشتههای بین بطنی و پورکنژ شکل یا اختلاف زمانی بین موجهای الکتروکاردیوگرام را تغییر میدهد.
بلوک های قلب
توقف انتقال جریان از گره سینوسی-دهلیزی به رشتههای دهلیزی، از گره SA به AV، از گره AV به رشتتههای بینبطنی و از رشتههای بینبطنی به رشتههای پورکنژ منجر به آریتمی قلب شده و در بخشهای مختلف الگکتروکاردیوگرام تغییر ایجاد میکند.
بلوک سینوسی دهلیزی
توقف جریان از گره سینوسی-دهلیزی به میوکارد دهلیزها منجر به حذف موج P از منحنی الکتروکاردیوگرام میشود. در این شرایط گره دهلیزی-بطنی جریان الکتریکی لازم برای انقباض بطنها را فراهم میکند. در نتیجه سرعت تشکیل کمپلکس QRS در الکتروکاردیوگرام کاهش مییابد، اما حذف نمیشود.
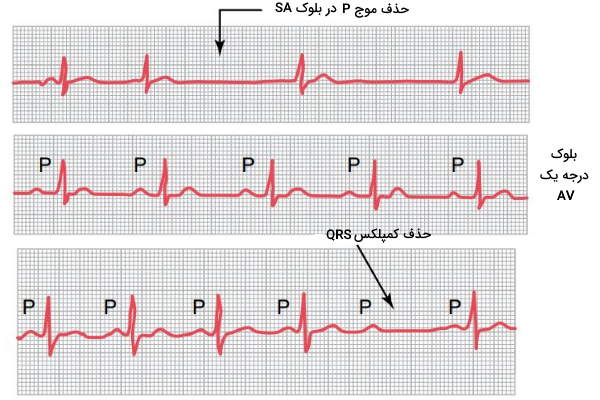
بلوک های دهلیزی بطنی
ایسکمی (کاهش جریان خون بافت)، فشار بافت فیبروزی بر گره دهلیزی-بطنی یا رسوب کلسیم در بافت، التهاب و تحریک بسیار شدید عصب واگ منجر به مسدود شدن مسیر انتقال جریان در گره دهلیزی-بطنی یا دستههای بینبطنی و تغییر شکل کمپلکس QRS در الکتروکاردیوگرام میشود. انسداد درجه یک، درجه دو و درجه سه این بخش از سیستم جریان هدایت قلب تغییرات متفاوتی در الکتروکاردیوگرام ایجاد میکند.
- بلوک درجه یک: در این حالت انتقال جریان کامل متوقف نمیشود. اما سرعت انتقال پیام از از دهلیز به گره دهلیزی-بطنی کاهش مییابد. در این حالت فاصه PR (زمان انتقال جریان از AV به رشتههای بینبطنی) یا P-Q از ۰٫۲ ثانیه بیشتر میشود. روماتوئید حاد قلبی یکی از دلایل افزایش این بخش از الکتروکاردیوگرام است.
- بلوک درجه دو: در این حالت انتقال جریان الکتریکی از دستههای بین بطنی به میوکارد قلب بسیار کند است و کمپلکس QRS و T از الکتروکاردیوگرام حذف میشود.
- بلوک درجه سه: در این مرحله انتقال جریان الکتریکی در گره دهلیزی-بطنی یا رشتههای بین بطنی کاملا متوقف شده و جریان الکتریکی گره سینوسی به بطن منتقل نمیشود. درنتیجه جریان مستقلی در رشتههای بطنی ایجاد خواهد شد. در الکتروکاردیوگرام این بلوک قلبی موج P مستقل از موج QRS و T ثبت میشود. به علاوه تعداد موجهای P ایجاد شده در هر دقیقه بیشتر از ۱۰۰ و تعدا موجهای QRS-T در هر دقیقه کمتر از ۴۰ است.
انتقال جریان الکتریکی ممکن از به دلیل ایسکمی، فشار بافت فیبروزی یا التهاب در دستههای پورکنژ داخل بطنی متوقف شود. در این شرایط انتقال جریان الکتریکی در هر ضربان قلب تغییر میکند. در نتیجه کمپلکس QRS در منحنی الکتروکاردیوگرام با نظم مشخص ایجاد نمیشود. به علاوه در الکتروکاردیوگرام به دلیل اینکه سرعت تحریک فیبرهای پورکنژ زیاد است و فرصت کافی برای ریپلاریزه شدن میوکارد وجود ندارد، تاکیکاردی ایجاد میشود.
ریتم غیرطبیعی سینوسی
مشکلات ایجاد شده در فیزیولوژی قلب بر اثر افزایش (تاکیکاردیا) و کاهش (برادیکاردیا) تولید جریان الکتریکی در گره سینوسی-دهلیزی و آریتمی این گره را میتوان با انجام الکتروکاردیوگرافی تشخیص داد.
- تاکیکاریا: تاکیکاردیا در افراد بالغ شرایطی است که ضربان قلب به بیش از ۱۰۰ ضربه در دقیقه میرسد. شکل امواج در الکرتوکاردیوگرام ثبت شده در این شرایط طبیعی است، اما به جای ۷۲ موج QRS در دقیقه، ۱۵۰ موج در هر دقیقه ثبت میشود. افزایش دمای بدن تا ۴۰٫۵ درجه سانتیگراد، تحریک گره سینوسی-دهلیزی بهوسیله عصب واگ و ترکیبات سمی از دلایل تاکیکاردیا هستند.
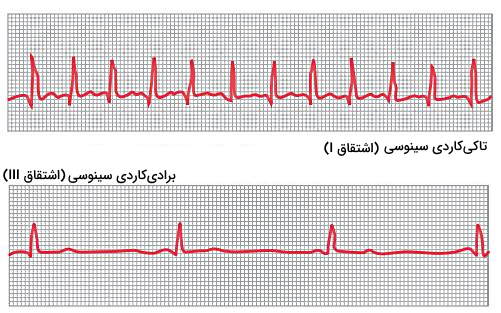
- برادیکاردیا: در برادیکاردیا تعداد ضربان قلب قرد بالغ به کمتر از ۶۰ ضربه در دقیقه کاهش مییابد. افزایش قدرت انقباضی میوکارد در افراد ورزشکار سبب افزایش حجم ضربهای در این افراد میشود. زمانیکه فرد در استراحت است، افزایش خون ورودی به آئورت سبب فعال شدن مکانیسمهای جبرانی و براکیکاردیا میشود. به علاوه تحریک گره سینوسی-دهلیزی بهوسیله شاخه پاراسمپاتیک عصب واگ با براکیکاردی همراه است. شکل موجها در الکتروکاردیوگرام براکیکاردی تغییر نمیکند، اما تعداد امواج QRS در هر دقیقه کاهش مییابد.
- آریتمی: آریتمی سینوسی به دلیل تمام واکنشهای سیستمی ایجاد میشود که تحریک سمپاتیک و پاراسمپاتیک قلب را تغییر میدهند. در این شرایط شکل امواج ثابت است و تعداد امواج QRS در دقیقه افزایش یا کاهش مییابد.
موج J
پتانسیل الکتریکی بین الکتروهای دستگاه الکتروکاردیوگرام به دلیل جریان الکتریکی پوست و انتقال یونها صفر نیست. به همین دلیل ابتدا باید نقطه مرجع پتانسیل را مشخص کرد. این نقطه صفر فرضی منحنی است. برای این کار پتانسیل نقطهای که موج QRS کاملا تمام میشود را ثبت میکنند. در این نقطه تمام سلولهای سالم و آسیبدیده ماهیچهای بطن دپلاریزه هستند و جریان الکتریکی اطراف قلب وجود ندارد. این نقطه به نام نقطه «J» و صفر فرضی الکتروکاردیوگرام ثبت میشود. خط افقی که از این نقطه عبور میکند، برای بررسی تغییر پتانسیل مراحل مختلف چرخه قلب بر اثر آسیب استفاده میشود.
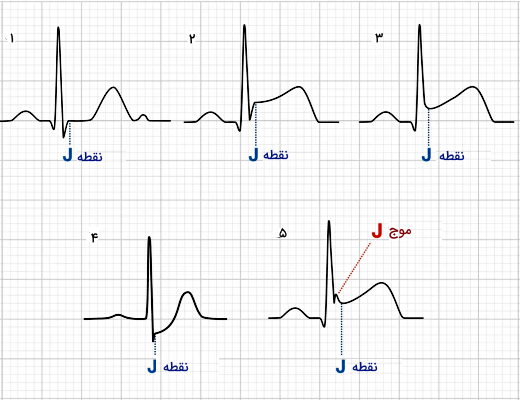
در شکل بالا نقطه J در منحنیهای الگتروکاردیوگرام مشخص شده است. منحنی ۱ نقطه J در الکتروکاردیوگرام قلب سالم را نشان میدهد.
موج J یا «آزبورن» (Osborn wave) در نقطه J ایجاد میشود و در الکتروکاردیوگرام قلب سالم وجود ندارد. کاهش شدید دمای بدن (Hypothermia)، سندروم بروگادا (Brugada Syndrome)، ریپلاریزه شدن پیش از موعد (Early Repolarization) و افزایش کلسیم خون (Hypercalcemia) اختلالهای فیزیولوژی قلب هستند که منجر به تشکیل موج J در الکتروکاردیوگرام و ایجاد سندروم موج J میشوند.
- کاهش شدید دمای بدن: کاهش دمای بدن به زیر ۳۰ درجه سانتیگراد منرج به ایجاد موج J در الکتروکاردیوگرام میشود.
- سندروم بروگادا: سندروم بروگا به دلیل جهش ژنتیکی در کانالهای یونی میوسیتهای قلب ایجاد میشود. در این شرایط نظم انقباض ماهیچههای بطن تغییر کرده و فرد دچار تاکیکاردی یا فیبریلاسیون میشود.
- ریپلاریزه شدن پیش از موعد: ریپلاریزاسیون پیش از موعد نشانه بیماری نیست و در مردان بیشتر از زنان ایجاد میشود.
اختلالات موج T
منحنیهای الکتروکاردیوگرام استاندارد معمولا از اشتقاق II ثبت میشودو در بخش قبلی توضیح دادیم موج T در این نمودار صعودی و مثبت است. اختلال در ریپلاریزه شدن بطن به شکل منفی شدن، کاهش یا افزایش دوره موج T ثبت میشود. بلوک شاخه چپ رشتههای بیبطنی سبب کاهش سرعت انتقال جریان الکتریکی به میوکارد بطن چپ میشود. در این شرایط موج T ایجاد شده جهت عکس موج QRS دارد.
اگر سلولهای ماهیچهای نوک بطن دیرتر از سلولهای ماهیچهای ابتدایی ریپلاریزه شود، موج T در الکتروکاردیوگرام هر سه اشتقاق اندام حرکتی (I، II و III) منفی ثبت میشود. در این شرایط برایند نمودار تغییر پتانسیل از از نوک بطن به سمت ابتدای بطن (الکترود مثبت به منفی) است. ایسکمی میوکارد یکی از شرایطی است که زمان ریپلاریزه شدن میوکارد نوک قلب را کاهش داده و به شکل موج T منفی ثبت میشود.
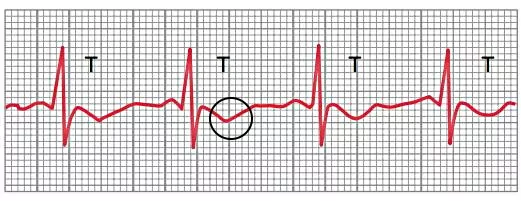
دو مرحلهای شدن موج T یکی دیگر از اختلالهایی است که به دلیل تغییرات فیزیولوژی قلب در الکتروکاردیوگرام ثبت میشود. برای مثال داروهای دیجیتالیز، ترکیباتی هستند که در بیماریهای رگهای کرونری برای افزایش قدرت انقباض ماهیچههای قلب تجویز میشود. مقدار بیش از حد دارو سبب افزایش زمان دپلاریزه شدن بخشی از سلولهای میوکارد شده و به شکل موج T منفی یا دو مرحلهای ثبت میشود.
فیبریلاسیون بطن قلب
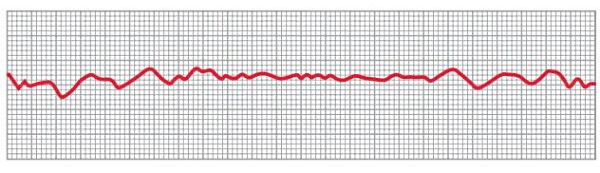
فیبریلاسیون بطن خطرناکترین نوع اختلال در نظم ضربان قلب است (آریتمی) است که به دلیل انتقال نامنظم جریان الکتریکی به سلولهای میوکارد ایجاد میشود. در این وضعیت بطنها در یک حرکت کلی و یکدست منقبض نمیشوند، انقباض بخشبخش میوکارد با لرزش قلب همراه است و برونده قلب بسیار (نزدیک صفر) کاهش مییابد. شوک الکتریکی و ایسکمی میوکارد، بافت هدایتی قلب یا هر دو از عوامل اصلی فیبریلاسیون بطن است.
امواج ثبت شده در الکتروکاردیوگرام فیبریلاسیون بطن بسیار نامنظم و آشفته هستند. در اوایل فیبریلاسیون انقباض بخش زیادی از میوکارد به شکل امواج نامنظم با فاصله زمانی کم و پس از چند ثانیه امواج با پتانسیل کمتر و نامنظم ثبت میشود. به همین دلیل غالب مشخصی برای فیبریلاسیون بطنی در الکتروکاردیوگرام وجود ندارد. پتانسیل الکتریکی در فیبریلاسیون بطن با ۰٫۵ میلیولت شروع میشود و پس از حدود ۱۰ دقیقه به ۰٫۱ یا کمتر میرسد.
فیبریلاسیون دهلیز قلب
در بخشهای قبلی این مقاله از مجله فرادرس توضیح دادیم که حفرههای بطنی و دهلیزی با بافت پیوندی کاملا از هم جدا شده و جریان فقط از گره دهلیزی-بطنی بین آنها منتقل میشود. به همین دلیل فیبریلاسیون این دو حفره نیز کاملا مستقل از هم است. بزرگ شدن دهلیزهای به دلیل بیماریهای دریچه قلب یا آنفارکتوس دهلیزی منجر به فیبریلاسیون این حفره میشود. در فیبریلاسیون دهلیزی بردارهای اختلاف پتانسیل بسیار ضعیف و در جهات مختلف ایجاد میشود که جمع آنها منجر به حذف موج P از الکتروکاردیوگرام یا ثبت یک موج با پتانسیل الکتریکی بسیار پایین و پرتکرار میشود. شکل کمپلکس QRS و T در الکتروکاردیوگرام تغییر نکرده اما فاصله زمانی این امواج تغییر میکند.
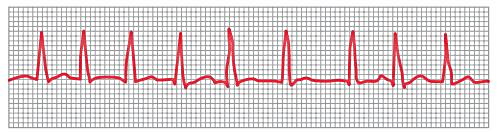
در فیبریلاسیون دهلیزی جریان الکتریکی سریع اما نامنظم به گره دهلیزی-بطنی منتقل میشود. فاصله انتقال هر پتانسیل عمل از این گره به دستههای بینبطنی ۰٫۳۵ر ثانیه است. انتقال نامنظم پتانسیل عمل به گره دهلیزی-بطنی صفر تا ۰٫۶ ثانیه به این فاصله زمانی اضافه میکند. در نتیجه موج QRS و T با فاصله زمانی نامنظم در الکتروکاردیوگرام ثبت میشود.
فیزیولوژی صدای قلب
بسته شدن دریچههای قلب به دلیل تغییر فشار، با ایجاد دو صدای اصلی در قلب همراه است که شدت و فاصله ایجاد شدن آنها اطلاعات مهمی در مورد تغییرات بافت و فیزیولوژی قلب به ما میدهد. اولین صدای قلب (S1) به دلیل بسته شدن دریچههای دهلیزی-بطنی در سیستول بطن و حدود ۰٫۱۴ ثانیه شنیده میشود. بسته شدن دریچه میترال به دلیل انقباض شدیدتر بطن چپ سهم بیشتری در این صدا دارد. در نتیجه دیر یا ضعیف شنیده شدن صدا ممکن است نشانهای از آسیب ساختار بافتی بطن چپ باشد. تغییر قدرت انقباضی بطن چپ، تغییر ساختار دریچه میترال و فاصله PR در منحنی الکتروکاردیوگرام، شدت صدای اول قلب را افزایش میدهد.
و صدای دوم (S2) به دلیل بسته شدن دوم به دلیل بسته شدن دریچه بسته شدن دریچههای سرخرگی در دیاستول بطن و حدود ۰٫۱۱ ثانیه شنیده میشود. فشار خون آئورت از فشار خون سرخرگ ششی بیشتر است. به همین دلیل دریچه آئورتی زودتر از دریچه ششی بسته شده و صدای بلندتری ایجاد میکند. این دو صدا را میتوان بهوسیله قرار دادن استتسکوپ پزشکی روی قفسه سینه شنید. فونوکاردیوگراف وسیلهای است که بهوسیله آن صداهای قلب به شکل نمودار ثبت میشود.
شدت صدای سوم و چهارم بسیار کمتر دو صدای اول است و به وسیله استتوسکوپ شنیده نشده اما بهوسیله فونوگراف ثبت میشود. صدای سوم در یکسوم میانی دیاستول و به دلیل حرکت خون از دهلیز به بطن و برخورد آن به دیواره بطنها ایجاد میشود. صدای چهارم به دلیل انقباض آئورتدر زمان تخلیه خون از دهلیز به بطن ایجاد میشود.
شنیدن صدای قلب
صدای اول و دوم قلب را میتوان بهوسیله گوشی پزشکی یا استتوسکوپ شنید. این صدا در بررسی وضعیت سلامت دریچهها و فیزیولوژی قلب به پزشک کمک میکند. صدای بسته شدن دریچه آئورتی در ناحیه آئورتی بین دنده ۱ و ۲ سمت چپ جناغ، صدای بسته شدن دریچه ششی بین دنده ۱ و ۲ سمت راست جناغ، صدای بسته شدن دریچه سهلختی بین دندههای ۴ و پنج سمت راست جناغ و صدای بسته شدن دریچه میترال همسطح دریچه سهلختی و از نوک قلب شنیده میشود.
فونوکاردیوگرام
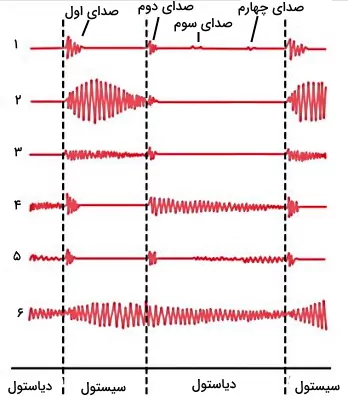
فونوکاردیوگرام نمودار شدت امواج صوتی صداهای قلب است. برای ثبت این نمودار میکروفون کوچکی صدای قلب را دریافت و به دستگاه فونوکاردیوگراف انتقال میدهد. به کمک این دستگاه میتوان تمام صداهای طبیعی قلب (اول، دوم، سوم و چهارم) و صداهای غیر طبیعی که در شرایط پاتولوژیک ایجاد میشود را ثبت کرد. شدت صدای سوم و چهارم بسیار کم است و صدای سوم در فونوگراف یکسوم افراد و صدای چهارم در فونوگراف یکچهارم افراد ثبت میشود. شکل زیر فونو کاردیوگرام شش فرد را نشان میدهد.
- نمودار ۱ مربوط به قلب سالم است.
- نمودار ۲ فونوکاردیوگرام فرد مبتلا به استنوئید یا تنگی دریچه آئورت را نشان میدهد. در این بیماری قطر دریچه آئورت به دلایل اختلالهای بدو تولد، التهاب باکتریایی یا تب روماتوئید کاهش مییابد. در نتیجه نیروی بیشتری برای تخلیه خون به آئورت ایجاد میشود. در این حالت دریچه میترال با محکتر بسته شده و صدای اول با شدت بیشتری ثبت میشود.
- نمودار ۳ فونوگراف قلب در نارسایی یا افتادگی دریچه میترال را نشان میدهد. در این بیماری دریچه میترال کامل بسته نشده و بخشی از خون در هر سیتسول به دهلیز چپ برمیگردد. این بیماری به دلیل آسیب بافت دریچه یا بافت بطن چپ ایجاد میشود. آسیب طناب وتری، التهاب ناشی از تب روماتوئید، عفونت اندوکاردیوم، بیماریهای رگهای کرونری، افزایش فشار خون و بیماریهای بدو تولد منجر به نارسایی دریچه میترال میشود. در فونوکاردیوگرام این بیماری شدت صدای اول کمتر اما زمان ثبت آن بیشتر است.
- نمودار ۴ فونوگراف نارسایی دریچه آئورت را نشان میدهد. در این بیماری دریچه آئورت کامل بسته نشده و در دیاستول بخشی از خون سرخرگی به بطن چپ برمیگردد. شدت و زمان ایجاد صدای اول در نارسایی دریچه آئورت طبیعی است اما صدای دوم با شدت بیشتر و طولانیتر ثبت میشود.
- نمودار ۵ فونوگراف استنوئید یا تنگی دریچه میترال را نشان میدهد. در این بیماری قطر دریچه میترال کاهش یافته و نیروی بیشتری برای انتقال خون از دهلیز به بطن نیاز است. التهاب ناشی از تب روماتوئید، رسوب کلسیم در بافت دریچه و بیماریهای بدو تولد دلایل اصلی این بیماری است. در تنگی دریچه میترال صدای اول و دوم تغییری نمیکند اما در فونوگراف یکسوم ابتدایی دیاستول صدای غیرطبیعی ثبت میشود.
- نمودار ۶ فونوگراف بیماری PDA را نشان میدهد. در این بیماری منافذی بین دیواره آئورت و سرخرگ ششی وجود دارد و بخشی از خون دو رگ مخلوط میشود. در این شرایط شدت صدای و زمان ثبت صدای اول و دوم قلب افزایش مییابد.
فیزیولوژی سیستم گردش خون
فیزیولوژی قلب در ارتباط مستقیم با دو سیستم گردش خون کوچک یا ششی و بزرگ یا سیستمی است. تغییر ساختار و بافت هر یک از این سیستمها عملکرد سیستم دیگر را تغییر میدهد. این دو سیستم با همکاری هم اکسیژن و مواد غذایی لازم برای انجام فعالیتهای متابولیک را فراهم میکنند. در گردش خون ششی انقباض بطن خون با فشار اکسیژن پایین را به سرخرگ ششی منتقل میکند. سرخرگ ششی خون را به ریهها منتقل کرده و پس از تبادل دیاکسید کربن در کیسههای هوایی ریه، خون با فشار جزئی اکسیژن بالا بهوسیله سیاهرگ ششی به دهلیز راست منتقل میشود.
گردش خون سیستمی از بطن چپ شروع میشود. انقباض بطن چپ خون با غلظت بالای اکسیژن را به آئورت منتقل میکند. آئورت به دو شاخه اصلی و پس از آنها بعه سرخرگهای کوچکتری تقسیم میشود که اکسیژن و مواد غذایی لازم برای تمام اندامهای بدن را به مویرگها منتقل میکند. مویرگها وظیفه اصلی تبادل مواد در بافت را بر عهده دارند. خون پس از مویرگ به سیاهرگها منتقل شده و برای تبادل اکسیژن به دهلیز راست منتقل میشود.
سرخرگها، سرخرگچهها، مویرگها، سیاهرگچهها و سیاهرگها لولههای ارتباطی قلب با اندامهای بدن و مسیر انتقال خون هستند. دیوراه همه رگها از لایههای بافت ماهیچه، پیوندی و پوششی تشکیل شده است که بر اساس عملکرد رگ ضخامت متفاوتی دارد.
- سرخرگ: دیواره این رگها بیشترین فشار را در سیستم گردش خون تحمل میکند. سطح داخلی سرخرگها از یک لایه سلول پوششی سنگفرشی تشکیل شده است و لایهای از بافت پیوندی با رشتههای الاستین فراوان (غشای پایه) اطراف آن قرار میگیرد. لایه میانی دیواره از سه لایه ماهیچههای صافی تشکیل میشود که انقباض آنها به حرکت جریان خون در اندامها و تغییر قطر دیواره در اثر تغییر فشار کمک میکند. لایه خارجی سرخرگ از بافت پیوندی با رشتههای الاستین و کلاژن متراکمتر از غشای پایه تشکیل شده است.
- سرخرگچه: سرخرگچهها از لایههای مشابه سرخرگ تشکیل می شود. اما تعداد لایههای بافت ماهیچهای و قطر این رگها کمتر از سرخرگ است.
- مویرگ: تعداد مویرگها در بافتهای مختلف بر اساس فیزیولوژی اندام متفاوت است. تعداد مویرگها در ماهیچههای اسکلتی، کبد و کلیه که متابولیسم بالایی دارند از سایر اندامها بیشتر است. سطح داخلی این رگها یک لایه سلول پوششی سنگفرشی تشکیل میشود.
- سیاهرگچه: دیواره این سیاهرگچهها شبیه سیاهرگها اما قطر آنها کمتر از سیاهرگها است.
- سیاهرگ: دیواره سیاهرگها از لایههای مشابه سرخرگ تشکیل شده است. اما ضخامت سلولهای ماهیچهای و بافت پیوندی در این رگها کمتر از سرخرگها است. فشار خون در این سیاهرگها کمتر از سرخرگ اما حجم آن بیشتر است. در سیاهرگهای متوسط و بزرگ دریچههایی شبیه دریچههای هلالی وجود دارد که به بازگشت خون از اندامهای فوقانی و تحتانی به قلب کمک میکند.
فیزیولوژی فشار خون
فشار خون و مقاومت دیواره رگها دو عامل فیزیکی مهم حرکت خون در بدن هستند که بهوسیله تغییرات پاتولوژیک بافت رگ، تغییر بافتی یا فیزیولوژی قلب، تحریک سیستم عصبی و هورمونها تغییر میکند. خون در تمام رگها در جهت شیب فشار و از فشار بیشتر به کمتر حرکت میکند. این فشار نیرویی است که از طرف خون به سانتیمتر مربع دیواره رگ وارد میشود. برای ادامه یافتن جریان این اختلاف فشار باید از نیرویی که دیواره به خون وارد میکند، بیشتر باشد.
دیواره سرخرگها از بافت انعطافپذیری تشکیل شده است که فشار خون وارد شده در هر سیستول را برای حفظ جریان خون حفظ میکند و در مویرگها به کمترین میزان میرسید. حجم ضربهای قلب و انعطافپذیری کلی بخش ابتدایی آئورت دو عامل تعیینکننده فشار ضربانی خون هستند. هر چه حجم ضربهای بیشتر باشد در هر ضربان خون بیشتری وارد آئورت شده و فشار بیشتری به دیوارهها وارد میکند. اما هر چه انعطافپذیری رگها بیشتر باشد، مقاومت کمتری نسبت به خون ورودی دارند و فشار ضربهای سرخرگکاهش مییابد.
تنظیم بافتی جریان خون
خون برای انجام فعالیت فیزیولوژیک خود در بافتها باید از قلب به بافت جریان داشته باشد. اما نیاز هر بافت در شرایط طبیعی و پاتولوژیک متفاوت است. مکانیسمهای کنترلی سریع و طولانیمدت روشهای اصلی تنظیم خون بافت هستند. مکانیسمهای سریع با تغییر قطر سرخرگچهها و اسفنکتر مویرگی در چند ثانیه جریان خون بافت را متناسب با نیاز سلولها افزایش یا کاهش میدهند. اما مکانیسمهای طولانیمدت در مدت چند روز، هفته یا ماه جریان خون بافت را با تغییر اندازه و تعداد رگها تغییر میدهند. این مکانیسمها در پاسخ به افزایش و کاهش اندازه اندام یا نکروز بخشی از بافت فعال میشوند.
تنظیم هورمونی فیزیولوژی خون
وظیفه اصلی سیستم گردش خون تامین مواد مورد نیاز و دور کردن مواد زائد از بافتها است.سیستم اندوکرین یکی از دستگاههایی است که با ترشح هورمونها و تغییر قطر رگها فیزیولوژی سیستم گردش خون را تنظیم میکند. قطر رگ با فشار خون رابطه عکس دارد. کاهش قطر رگ مقاوت محیطی و فشار خون را افزایش میدهد. اما افزایش قطر رگ مقاومت محیطی و فشار خون را کاهش میدهد. اتصال هورمونهای نوراپینفرین، اپینفرین، آنژیوتانسین II و وازوپرسین به گیرندههای سلولی سبب کاهش قطر رگ و اتصال هورمونهای برادیکینین و هیستامین به گیرنده سبب افزایش قطر رگ میشود.
- نوراپینفرین و اپینفرین: اپینفرین و نوراپینفرین دو ترکیب آمینی هستند که از پایانه آکسون عصبهای سیستم خودمختار و سلولهای اندوکرین غدد فوق کلیه ترشح میشوند. نوراپینفرین نقش بیشتری در کاهش قطر رگها دارد. این هورمون به گیرندههای آلفا ۱ در غشای سلولهای ماهیچه دیواره رگها متصل شده و مکانیسمهای انقباض را فعال میکند.
- آنژیوتانسین II: آنژیتاسین هورمونی پپتیدی است که اتصال آن به گیرنده ماهیچه صاف دیوراه سرخرگچهها آنزیمهای تروزین کیناز و انقباض ماهیچه را فعال میکند. در نتیجه قطر رگ کاهش یافته و فشار خون افزایش مییابد.
- وازوپرسین: وازو پرسین یا هورمون ضدادراری در بخش اندوکرین هیپوتالاموس سنتز شده و در هیپوفیز وارد خون میشود. این هورمون نقش کمی در تغییر قطر رگ داره و وظیفه اصلی آن افزایش بازجذب آب در توبولهای کلیه است. افزایش حجم خون بهوسیله بازجذب آب فشار خون را افزایش میدهد.
- برادیکینین: کینینها پپتیدهای کوچکی هستند که از تجزیه آنزیمی گلوبینهای آلفا ۲ در پلاسما ایجاد میشوند. کالیکرین یکی از این پروتئازها است که شکل غیرفعال آن در پلاسما و مایع میانبافتی وجود دارد. از فعالیت این آنزیم در التهاب برادیکینین تولید میشود. نیمهعمر برادیکینین بسیار کوتاه است و گیرندههای آن در غشای سلولهای اندوتلیال سرخرگچهها و مویرگها قرار دارد. اتصال هورمون گیرنده فاصله بین سلولهای اندوتلیال و قطر رگ را افزایش میدهد. افزایش قطر سرخرگچه به کاهش فشار و افزایش نفوذپذیری مویرگ به خروج پلاسما و سلولهای ایمنی از خون کمک میکند.
- هیستامین: هیستامین ترکیب آمینی است که در پاسخ به آسیب بافت و التهاب بهوسیله ماستسلهای مستقر در بافت و بازوفیلهای خون ترشح میشود. این ترکیب مثل برادیکینین نفوذپذیری سرخرگچهها و مویرگها را افزایش و فشار خون بافت را کاهش میدهد.
تنظیم عصبی فیزیولوژی خون
گیرندههای سیستم سمپاتیک و پاراسپاتیک علاوه بر کنترل فیزیولوژی قلب، فشار خون محیطی را تنظیم میکند. گیرنده انتقالدهنده عصبی سیستم سمپاتیک در غشای ماهیچهای سرخرگها، سرخرگچهها و سیاهرگهای تمام بافتها وجود دارد. اما اکثر مویرگها گیرنده سیستم سمپاتیک ندارند. تحریک سمپاتیک بر سرخرگها و سرخرگچهها مقاومت رگ را افزایش و جریان خون بافتی را کاهش میدهد. اما اتصال انتقالدهنده عصبی این اعصاب به گیرنده سیاهرگها با کاهش قطر رگ و افزایش فشار به حرکت خون خلاف نیروی گرانش برای بازگشت به قلب کمک میکند.
سوالات متدوال
در این بخش از مطلب مجله فرادرس به تعدادی از سوالات متداول پیرامون فیزیولوژی قلب پاسخ میدهیم.
انقباض ایزوولمیک قلب چیست؟
ایزوولمیک از دو وازه لاتین ایزو به معنی برابر و وولومیک به معنی حجم تشکیل شده است. انقباض ایزوولومیک بخشی از چرخه قلب است که ماهیچه منقبض میشود اما حجم خون در این اندام تغییر نمیکند. این مرحله در ۰٫۰۵ ثانیه ابتدای سیستول بطنها ایجاد میشود. در این شرایط فشار بطنی افزایش می یابد اما به دلیل بسته بودن دریچههای دهلیزی-بطنی و بطنی-سرخرگی بسته حجم خون قلب تغییر نمیکند.
بافت گرهی قلب از چه نوع بافتی است؟
سیستم هدایتی قلب از بافت ماهیچه قلب تمایزیافته تشکیل شده است که مشتقل از سیستم عصبی تحریک شده و پتانسیل الکتریکی لازم برای انقباض قلب و فعالیتهای فیزیولوژی قلب ایجاد میکنند.
در استراحت عمومی قلب چه اتفاقاتی می افتد؟
استراحت عمومی یا دیاستول کامل قلب بخشی چرخه فیزیولوژی این اندام است که هیچ یک از حفرهها منقبض نیستند. این بخش فاصله انتهایی موج T تا موج P بعدی در الکتروکادیوگرام استراحت عمومی قلب را نشان میدهد. در این مرحله دریچههای میترال و سهلختی باز هستند و خون بدون مصرف انرژی از دهلیزها وارد بطن میشود. دریچههای آئورتی و ششی بسته هستند و خونی از قلب خارج نمیشود. در استراحت عمومی قلب غشای میوکارد دهلیز و بطن ریپلاریزه است.