لکوسیت چیست؟ – وظیفه و اختلالات به زبان ساده

خون تنها بافت مایع بدن است که از پلاسما و سلولهای خونی تشکیل شده است. پلاسما ترکیبی از آب، پروتئینها محلول، یونهای معدنی و ترکیباتی که است که بین اندامهای مختلف مبادله میشود. گلبولهای سفید، پلاکتها و لکوسیتها سلولهای خونی هستند. این سلولها از تمایز سلولهای هماتوپویتیک در مغز قرمز استخوان تولید میشوند. گلبولهای قرمز سلولهایی هستند که هسته و اندامکهای انها با هموگلوبین جایگزین شده است. وظیفه این سلولها انتقال اکسيژن است. پلاکتها باقیماندههای سلولی هستند که اندامک ندارند و در فرایندهای انعقاد خون و ترمیم بافت آسیبدیده شرکت میکند. لکوسیتها یا گلبولهای سفید سلولهای سیستم ایمنی بدن هستند. در این مطلب توضیح میدهیم وظیفه لکوسیت چیست.
نوتروفیلها، بازوفیلها، ائوزینوفیلها، ماستسلها، مونوسیتها و لنفوسیتها انواع لکوسیتهای خون هستند. این سیتوپلاسم این سلولها برخلاف گلبولهای قرمز و پلاکتها هسته و تمام اندامکهای سلولی وجود دارد. این سلولها با فاگوسیتوز، القای آپوپتوز، ترشح آنتیبادی و لیز کردن سلول، پاتوژنها را از بین میبرند. افزایش یا کاهش این سلولها در خون منجر به اختلال در سیستم ایمنی بدن میشود. جهش ردههای مختلف سلولهای بنیادی مغز استخوان دلیلی اصلی اختلالهای لکوسیتی است. در این مطلب از مجله فرادرس انواع لکوسیت و مکانیسمهای دفاعی این سلولها را بررسی میکنیم و توضیح میدهیم اختلالات لکوسیت چیست.
لکوسیت چیست؟
لکوسیت ها یا گلبولهای سفید گروهی از سلولهای خونی هستند که برخلاف گلبولهای قرمز هسته و اندامک دارند. تعداد لوکوسیتهای خون و طول عمر بیشتر آنها کمتر از گلبولهای قرمز است. لکوسیتها با مکانیسمهای متفاوت از بدن در برابر باکتریها، ویروسها، آغازیان، انگلها و قارچها دفاع میکنند. به علاوه این سلولها باقیماندههای سلولی حاصل از آپوپتوز و نکروز و سلولهای توموری را از بین میبرند. قطر این سلول حدود ۱۲ تا ۱۴ میکرومتر است و یکی از ویژگیهای مهم آنها خروج از جریان خون و ورود به بافتهای آلوده برای از بین بردن این پاتوژنها است.
انواع لکوسیت چیست؟
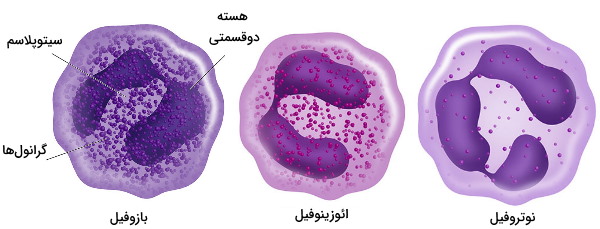
لکوسیتها را بر اساس شکل ظاهری به انواع گرانولوسیت و آگرانولوسیت تقسیمبندی کرد. نوتروفیل، ائوزینوفیل، بازوفیل و ماستسل، گرانولوسیتها هستند که در سیتوپلاسم آنها گرانول وجود دارد و پس از رنگآمیزی در زیر میکروسکوپ دیده میشود. این گرانولها آنزیمها و سایر مولکولهای شیمیایی از بینبرنده پاتوژنها هستند. مونوسیتها و لنفوسیتها، آگرانولوسیتها هستند که در سیتوپلاسم آنها گرانول وجود ندارد.
- نوتروفیلها: نوتروفیلها هسته ۳ تا ۵ قسمتی دارند که بهوسیله فیلامنتهای باریک نوکلئوپلاسم به هم متصل هستند. طول عمر نوتروفیلها بین ۷ تا ۱۰ روز قبل از ورود به بافت است و در بافت حداکثر چند روز زنده میمانند. این سلولها اولین لوکوسیتهایی هستند که به پاتوژنها حمله میکنند. این سلولها در از بین بردن عفونتهای قارچی و باکتریایی شرکت میکنند.
- بازوفیلها: بازوفیلها هسته دوقسمتی و S شکل دارند. فیلامنتهای نوکلئوپلاسم دو لوب هسته را به هم متصل میکند. باروفیلها علاوه بر مولکولهای ضدمیکروبی پاتوژنها آنزیمهای ضدانعقاد خون ترشح میکنند.
- ائوزینوفیلها: ائوزینوفیلها هسته دو قسمتی U شکل دارند که بهوسیله فیلامنتهای نوکلئوپلاسم به هم متصل شدهاند. عمر ائوزینوفیلها در خون حدود ۱۰ ساعت و در بافت حداکثر چند روز است. این لکوسیتها در از بین بردن کرمهای انگلی شرکت میکنند.
- ماستسلها: ماستسلها، لکوسیتهای مستقر در بافت پیوندی هستند و در خون وجود ندارند. هسته این سلولها یکقسمتی است و در سیتوپلاسم آنها گرانولهای فراوانی وجود دارد. این سلولها بر اساس گرانولهای سیتوپلاسم به دو دسته MC(T) و (TC)MC تقسیم میشوند. در گرانولهای MC(T) آنزیم تریپتاز و در گرانولهای (TC)MC آنزیمهای تریپتاز، کیماز و کربوکسی پپتیداز وجود دارد.
- مونوسیتها: مونوسیتها بزرگترین لکوسیتهای خون هستند. اندازه این سلولها تقریبا دو برابر گلبولهای قرمز است. هسته بزرگ و تکقسمتی این سلولها لوبیاییشکل است. این سلولها پس از مهاجرت از خون و ورد به بافت به ماکروفاژها و سلولهای دندریتی تمایز میيابند. ماکروفاژها تقریبا در تمام بافتهای بدن وجود دارند. اما سلولهای دندریتی بیشتر در بافتهایی (پوست، ریه، لوله گوارش و لایههای داخلی بینی) هستند که با محیط خارجی بدن در ارتباط است. طول عمر این سلولها در خون یک تا سه روز است.
- لنفوسیتها: لنفوسیتها به سه دسته لنفوسیتهای B، لنفوسیتهای T و سلولهای کشنده طبیعی تقسیم میشوند. این سلولها در از بین بردن باکتریها، ویروسها و سلولهای توموری نقش دارند. این سلولها در غدد لنفاوی و اندامهای لنفاوی ثانویه مستقر هستند. لنفوسیتهای B به انواع پلاسموسیت و سلولهای B خاطره و لنفوسیتهای T به انواع کمککننده (Th)، کشنده، خاطره و تنظیمی تقسیم میشوند.
تولید لکوسیت چیست؟
در بخشهای قبلی مطلب لکوسیت چیست با ویژگیهای انواع لکوسیت آشنا شدیم، در این بخش قصد داریم نحوه تولید لکوسیتها را توضیح دهیم. لکوسیتها از تقسیم و تمایز سلولهای بنیادی خونساز در مغز استخوان تولید میشود. از تقسیم سلولهای بنیادی اولیه، سلولهای رده میلوئید و لنفوئید به وجود میآید. از تمایز سلولهای میلوئیدی مونوبلاست، میلوبلاست، پریوارتیروبلاست و مگاکاریوسیت، و از تمایز رده سلولی لنفوئید، لنفوبلاست تولید میشود. مونوبلاست به مونوسیت، میلوبلاست به بازوفیل، نوتروفیل و ائوزینوفیل، پریوارتیروبلاست به گلبول قرمز، مگاکاریوسیت به پلاکت و لنفوبلاست به لنفوسیتهای T و B تمایز مییابد. گرانولوسیتها پس از بلوغ در مغز استخوان وارد جریان خون میشوند. محل بلوغ لنفوسیتهای B و T متفاوت است. لنفوسیتهای B در گرههای لنفاوی و لنفوسیتهای T در غده تیموس بالغ میشوند.
بلوغ لنفوسیت T
در مراحل بلوغ لنفوسیتهای T و B با انتخاب مثبت و منفی نسبت به آنتیژن سلولهای خودی بدن خنثی و نسبت به آنتیژنهای پاتوژنی حساس میشود. لنفوسیتهای T در پاسخ به کموکینهای ترشح شده (تایموزین، تایموتاکسین و تایموپوئتین) از سلولهای اپتیلیال تیموس به سمت این غده حرکت میکنند. به علاوه این کموکینها سنتز گیرندههای غشایی سلولهای T و گلیکوپروتئینهای CD4 و CD8 را تحریک میکند. به لنفوسیتها T در این مرحله تیموسیت گفته میشود.
در تیموس این سلولها به بخشهای عمقی قشر منتقل میشوند. در غشای سلولهای این بخش مولکولهای MHCI و MHCII وجود دارد. اگر گیرنده غشایی تیموسیتها با این مولکولها برهمکنش بدهد، سلول T زنده میماند و سلولهایی که گیرنده آنها رابطه مکملی صحیحی با هر یک از مولکولهای MHC ندارد با آپوپتوز از بین میرود. به این فرایند انتخاب مثبت گفته میشود.تیموسیتهایی که با مولکولهای MHCII برهمکنش مناسبی دارند در مراحل بعدی به لنفوسیتهای کمککننده و سلولهای T که با MHCI برهمکنش مناسبی دارند در مراحل بعدی به لنفوسیتهای کشنده تبدیل میشوند.
تیموسیتهایی که در انتخاب مثبت زنده میمانند به ناحیه بین قشر و مدولای تیموس منتقل میشوند. در این بخش تیموس برهمکنش آنتیژنهای خودی متصل به مولکولهای MHC با گیرنده لنفوسیت T بررسی میشود و لنفوسیتهایی که اتصال محکمی به آنتیژنهای خودی دارند با آپوپتوز از بین میروند. به این فرایند انتخاب منفی گفته میشود.

بلوغ لنفوسیت B
لنفوسیت B در گرههای لنفاوی به آنتیژن متصل میشود. اگر تمایل گیرنده گیرنده آنتیژن این سلولها به آنتیژن زیاد باشد، لنفوسیت B با آپوپتوز از بین میرود و اگر تمایل گیرنده به آنتیبادی زیاد باشد، لنفوسیت B زنده میماند.
گیرنده لکوسیت چیست؟
در غشای لکوسیتها گیرندههای شناسایی مولکولهای سطحی آنتیژنبه نام «گیرنده شناساییکننده الگو» (Pattern Recognition Receptors | PRR) وجود دارد که مولکولهای سطحی پاتوژنها (PAMPs) و مولکولهای ترشحی از سلولهای خودی نکروز شده (DAMPs) را شناسایی میکنند. مولکولهای سطحی پاتوژنها کربوهیدرات، پروتئینها، RNA تکرشته و دورشتهای، DNA و لیپیدهایی است که در بدن انسان وجود ندارد و عامل ایجاد بیماریزایی میکرواورگانیسم است. این گیرندهها بر اساس ساختار مولکولی به گیرندههای تول-لایک (Toll-like receptors | TLRs)، گیرندههای لکتین نوع C، «گیرندههای نود لایک» (NOD-like receptors | NLRs) و «گیرندههای شبیه القاکننده ژن رتینوئیکاسید» (RIG-I-like Receptors | RLRs) تقسیم میشوند.
- گیرندههای TLRs: گیرندههای TLR پروتئینهای غشایی و سیتوپلاسمی هستند که آنتیژنهای سطحی و درونسلولی ویروسها، باکتریها، قارچها و انگلها را شناسایی میکنند. TLR1 و TLR2 و TKR4 و TLR5 و TLR6 گیرندههای غشای پلاسمایی و TLR3 و TLR7و TLR8 و TLR9 گیرندههای غشای اندوزومهای سیتوپلاسمی هستند. ناحیه اتصالی به آنتیژن این گیرندهها غنی از آمینواسید لوسین است. ناحیه سیتوزولی این گیرندهها که به انتقال پیام درونسلولی کمک میکند، دومین گیرنده تول-اینترلوکین است. این گیرندهها لیپوپلیساکارید، پروفیلین، فلاژلین، لیپوپروتئین، پپتیدگلایکان، DNA و RNA را شناسایی میکنند. اتصال آنتیژن به این گیرندهها فاکتورهای رونویسی را فعال و ترشح مولکولهای ضدمیکروبی را تحریک میکند.
- گیرندههای لکتین نوع C: گیرندههای لکتین نوع C، پروتئینهای غشایی هستند که آنتیژنهای کربوهیدرات را شناسایی میکنند. این گیرندهها در شناسایی قارچها و ویروسها نقش دارند.
- گیرندههای NLRs: گیرندههای NLRs پروتئینهای سیتوپلاسمی هستند که DNA و RNA پاتوژنها را شناسایی میکنند. بعضی از گیرندههای NLR به هم متصل میشوند و کمپلکس اینفلامازوم (کمپلکس ایجاد التهاب | inflammasome) را تشکیل میدهند. اینفلامازوم آنزیم کاسپاز-۱ را فعال میکند و این آنزیم سیتوکینهای غیرفعال را به سیتوکینهای فعال تبدیل میکند.
- گیرندههای RLRs: گیرندههای RLRs سه آنزیم RNA هلیکاز هستند که RNA دورشتهای ویروسها را شناسایی میکنند. اتصال آنتیژن به این گیرندهها ترشح اینترفرونهای آلفا و بتا را تحریک میکند.
گیرنده لنفوسیت B
گیرنده آنتیژنی لنفوسیت B، آنتیبادیهای غشایی است که از دو زنجیره سنگین و دو زنجیره سبک تشکیل میشود. این زنجیرهها با پیوند دیسولفیدی به هم متصل هستند. دو جایگاه اتصال به آنتیژن در این گیرنده وجود دارد. در غشای پلاسمایی این سلولها، نزدیک زنجیره سنگین گیرنده، هترودیمری از آنتیبادیهای آلفا و بتا ($$Ig\alpha/Ig\beta$$) قرار دارد. این آنتیبادیها به آنتیژن متصل نمیشوند اما در بخش سیتوزولی آنها موتیف فعالکننده تیروزین وجود دارد که به انتقال پیام کمک میکند. زنجیره سنگین این گیرندهها از رونویسی ژنهای V و D و J و زنجیره سبک آنها از رونویسی ژنهای V و J سنتز میشود. نوترکیبی این ژنها به سنتز گیرندههای B متفاوت برای شناسایی اختصاصی آنتیژنها کمک میکند.
گیرنده لنفوسیت T
گیرنده لنفوسیت T، پروتئین عرض غشای پلاسمایی است که از دو زنجیره آلفا و بتا تشکیل شده است. که با پیوند دیسولفیدی به هم متصل هستند و به نواحی ثابت و متغیر تقسیم میشود. ناحیه متغیر به آنتیژنها متصل میشود و ناحیه متغیر بین لیپیدهای غشا قرار میگیرد. ناحیه متغیر این گیرندهها از رونویسی سه ژن V، D و J تشکیل شده است که از نوترکیبی آنها جایگاه اتصال به آنتیژن اختصاصی به وجود میآید. گیرنده لنفوسیت T برخلاف گیرنده لنفوسیت T یک جایگاه اتصال به آنتیژن دارد.
کنار این گیرندهها، در غشای پلاسمایی سلول T، پروتئین CD3 و دو زنجیره زتا وجود دارد. CD3 از سه زنجیره پلیپپتیدی گاما، دلتا و اپسیلون تشکیل شده است که به شکل هترودیمرهای گاما-اپسیلون و دلتا-اپسیلون در غشا قرار میگیرند. CD3 و زتا به آنتیژن متصل نمیشوند اما به انتقال پیام کمک میکنند. هر زنجیره پلیپتیدی در CD3 دو موتیف تیروزین و هر زنجیره زتا سه موتیف تیروزین دارد.
در کنار گیرندههای آنتیژنی سلولهای T علاوه بر CD3 و زنجیره زتا، گیرندههای کمکی CD4 و CD8 وجود دارد. این گیرندهها به آنتیژن متصل نمیشوند اما اتصال آنها به پروتئینهای MHCI (در غشای سلولهای آلوده به پاتوژن و توموری) و MHCII (در غشای سلولهای ارائهدهنده آنتیژن) پاسخ سلول به آنتیژن را افزایش میدهد. بر این اساس لنفوسیتهای T به انواع $$CD4^+$$ و $$CD8^+$$ تقسیم میشوند. سلولهای T کمککننده و تنظیمکننده $$CD4^+$$ و سلولهای T کشنده $$CD8^+$$ هستند.
وظیفه لکوسیت چیست؟
در بخشهای ابتدایی مطلب لکوسیت چیست توضیح دادیم که لکوسیتها سلولهای ایمنی بدن هستند. نوتروفیلها، بازوفیلها، ائوزینوفیلها و سلولهای کشنده طبیعی بهوسیله مکانیسمهای دفاع ذاتی و لنفوسیتها بهوسیله مکانیسمهای دفاع اختصاصی پاتوژنها را از بین میبرند. در دفاع ذاتی لکوسیتها به انواع پاتوژنها پاسخ میدهند اما در دفاع اختصاصی هر لکوسیت به یک نوع پاتوژن مشخص پاسخ میدهد. آزاد کردن گرانولها، فاگوسیتوز و دام خارج سلولی مکانیسمهای لکوسیتها در دفاع ذاتی، و تولید آنتیبادی، لیز کردن سلول و القای آپوپتوز مکانیسمهاس دفاع اختصاصی بدن است. در این بخش از مطلب مجله فرادرس هر یک از این مکانیسمها را توضیح میدهیم.
فاگوسیتوز
فاگوسیتوز مکانیسم هضم پاتوژنها بهوسیله سلولهای ایمنی است. نوتروفیلها، ماکروفاژها و سلولهای دندریتی لکوسیتهایی هستند که با این مکانیسم پاتوژنها و باقیمانده سلولهای آسیبدیده را از بین میبرند و به آنها فاگوسیت گفته میشود. این فرایند به چهار مرحله شناسایی پاتوژن، فعال شدن فاگوسیت، تشکیل وزیکول فاگوزوم و تشکیل فاگولیزوزوم تقسیم میشود.
- شناسایی پاتوژن: اولین مرحله فاگوسیتوز شناسایی پاتوژن با اتصال گیرندههای سلولی به مولکولهای سطحی پاتوژنها یا سلولهای آسیبدیده است.
- فعال شدن فاگوسیت و تشکیل فاگوزوم: پس از اتصال مولکول سطحی پاتوژن به گیرنده مسیرهای پیامرسانی متفاوتی در سلول فعال میشود که سبب به تغییر آرایش اکتینهای اسکلت سلولی و تشکیل فرورفتگی غشایی در سطح نزدیک پاتوژن میشود. در ادامه پای کاذب اطراف پاتوژن تشکیل میشود. افزایش طول پای کاذب تا زمانی ادامه دارد که دو طرف غشای یه هم برسد و فاگوزوم تشکیل شود.
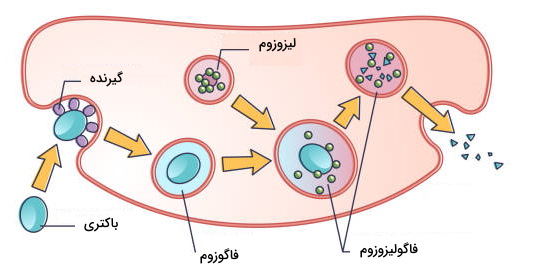
- تشکیل فاگولیزوزوم: فاگوزوم در سیتوپلاسم ابتدا با اندزومهای اولیه، اندوزومهای تاخیری و در نهایت با لیزوزوم ادغام میشود. همزمان با ادغام شدن فاگوزوم با اندوزومها، اندزومهای بازیافتی بخشی از ترکیبات را به غشا برمیگردانند. به همین دلیل اندازه فاگوزوم پس از ادغام با اندوزومها تغییری نمیکند. فاگوزوم اولیه با اندوزوم اولیه ادغام میشود. Rab5 آنزیم GTPase است که ادغام دو وزیکول را تنظیم میکند. پمپهای پروتون غشای فاگوزوم اولیه، pH این وزیکول را کاهش میدهد. در مرحله بعد فاگوزوم اولیه با اندوزوم تاخیری ادغام و فاگوزوم تاخیری تشکیل میشود. تعداد پمپهای پروتون فاگوزوم تاخیری بیشتر از فاگوزوم اولیه است. به همین دلیل pH فاگوزومهای تاخیری اسیدیتر است. در فاگوزوم تاخیری تجزیه پاتوژن یا سلول آسیبدیده بهوسیله آنزیمهای پروتئاز شروع میشود. در مرحله آخز فاگوزوم با لیزوزوم ادغام و فاگولیزوزوم تشکیل میشود. pH فاگولیزوزوم از فاگوزوم اولیه و تاخیری بیشتر است. در غشای این وزیکول کمپلکسهای اکسیداز NADPH وجود دارد. این آنزیمها رادیکال فعال اکسيژن (ROS) تولید میکنند. سوپراکسید ($$O_2^{-}$$) یکی از این رادیکالها است که بهوسیله آنزیم دسموتاز به پراکسید هیدروژن ($$H_2O_2$$) تبدیل میشود. از واکنش پراکسید هیدروژن با یون کلر، هیپوکلرواسید تشکیل میشود که یک ترکیب آنتیباکتریال قوی است. به علاوه آنزیمهای پروتئیاز، کاتپسین، لیزوزیم و لیپاز در فاگولیزوزوم ذره بلعیده شده را از بین میبرد.
دام خارج سلولی
تشکیل دام خارج سلولی یکی از مکانیسمهای دفاعی نوتروفیلها است. دام خارج سلولی از رشتههای DNA، پروتئازهای نوتروفیل و اکسيژن فعال تشکیل شده است. در این مکانیسم پاتوژن بین رشتههای DNA به دام میافتد و بهوسیله فاگوسیتها یا مولکولهای ضدمیکروبی ترشح شده از نوتروفیل از بین میرود. نوتروفیلها پس از آزاد کردن دام خارج سلولی از بین میروند.
ترشح آنتی بادی
آنتیبادیها درشتمولکولهای پروتئینی هستند که از دو زنجیره سبک و دو زنجیره سنگین تشکیل شدهاند. هر آنتیبادی از یک بخش ثابت و یک بخش متغیر تشکیل شده است. بخش متغیر به آنتیژن و بخش ثابت به گیرندهها یا لیپیدهای غشای سلولی متصل می شود. IgG و IgM و IgE و IgA و IgD کلاسهای آنتیبادی هستند که زنجیره سنگین آنها متفاوت است. آنتیبادیها بهوسیله لنفوسیتهای B ترشح میشوند و به از بین بردن پاتوژنها کمک میکنند. اتصال آنتیژن به گیرندههای لنفوسیت B سبب فعال شدن این سلول، رونویسی ژنها و ترشح آنتیبادی میشود.
لنفوسیتهای B فولیکولار که در فولیکولهای گرههای لنفاوی و طحال وجود دارد، برای فعال شدن به سلولهای T کمککننده وابسته هستند. در این سلولها مکانیسم تغییر کلاس آنتیبادی وجود دارد و تمایل آنتیژن به آنتیبادی بیشتر است. در تغییر کلاس جایگاه اتصال به آنتیژن ثابت است و زنجیره سنگین تغییر میکند. اما سلولهای B1 و لنفوسیتهای B ناحیه حاشیهای، مستقل از سلولهای T فعال میشوند. مکانیسم تغییر کلاس آنتیبادی در این سلولها وجود ندارد و آنتیبادیها تمایل کمتری به آنتیژن دارند.
- فعال شدن لنفوسیت B مستقل از Th: آنتیژنهای غیرپروتئینی از توالیهای تکراری لیپیدی یا پلیساکاریدی تشکیل شده است که گیرنده آنتیژنی لنفوسیت B بدون نیاز به Th آنها را شناسایی میکند. اتصال آنتیژن محلول یا آنتیژن غشای پاتوژن به گیرنده، اولین سیگنال فعال شدن سلولهای B است. اتصال گیرندههای تول-لایک به PAMPs یا برهمکنش با پروتئینهای مکمل سیستم ایمنی سیگنال دوم فعال شدن لنفوسیتها است. فعال شدن لنفوسیت با تقسیم این سلولها، تشکیل کلنی و تمایز سلولها به پلاسموسیتها همراه است. پلاسموسیتها آنتیبادی IgM ترشح میکنند.
- فعال شدن لنفوسیت B وابسته به Th: لنفوسیتهای B برای پاسخ به آنتیژنهای پروتئینی محلول و آنتیژنهای پروتئینی سطح باکتریها به سلولهای T کمککننده نیاز دارند. اتصال آنتیژن به گیرنده سلول B با اندوسیتوز آنتیژن-گیرنده همراه است. آنتیژن پی از پردازش در لیزوزوم به مولکولهای MHCII متصل و به غشای پلاسمایی منتقل میشود. گیرنده سلول T کمککننده آنتیژن متصل به MHCI را شناسایی میکند. فعال شدن سلول T با ترشح سیتوکینهایی همراه است که تقسیم و تمایز لنفوسیت B به پلاسموسیتها و سلولهای B خاطره را تحریک میکند. سلولهای B خاطره سرعت پاسخ سیستم ایمنی در مواجه بعدی با همان آنتیژن را افزایش میدهند. IgM اولین آنتیبادی است که از پلاسموسیتها ترشح میشود. اما سیتوکینهای سلولهای T تغییر کلاس آنتیبادی و ترشح IgG و IgA و IgE را تحریک میکند.
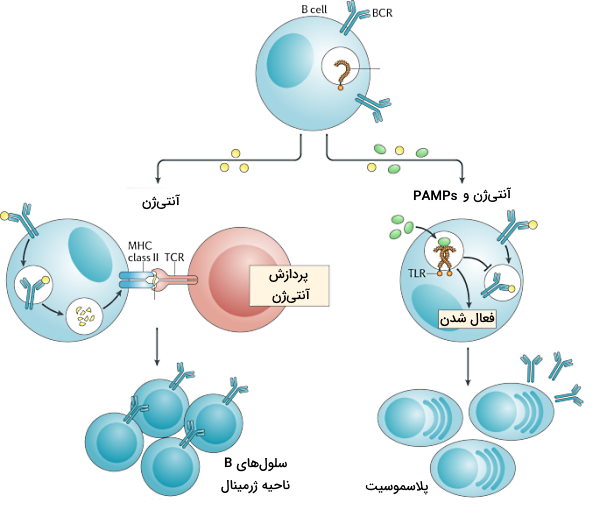
آنتیبادیها در خون به آنتیژنهای محلول یا آنتیزنهای سطح پاتوژن متصل میشوند و از آسیب رساندن یا ورود پاتوژن به سلولهای سالم جلوگیری میکنند. به علاوه اتصال آنتیبادی به پاتوژنها شناسایی آنها بهوسیله فاگوسیتها و پروتئینهای مکمل سیستم ایمنی را افزایش میدهد.
لیز کردن سلول و القای آپوپتوز
لیز کردن و القای آپوپتوز آخرین مکانیسم دفاعی است که در مطلب لکوسیت چیست توضیح میدهیم. لنفوسیتهای T کشنده از لیز کردن و القای آپوپتوز برای از بین بردن سلولهای آلوده به ویروس و تومورها استفاده میکنند. در سطح تمام سلولهای هستهدار انسان پروتئینهای MHCI وجود دارد. MHCI آنتیژن پاتوژنی پردازش شده در سلول را به غشای پلاسمایی منتقل میکند. سلولهای T کشنده این آنتیژنها را شناسایی میکند. گیرنده سلولهای T کشنده فعال به آنتیژن و کمک گیرنده CD8 به MHCI متصل میشود. اتصال آنتیژن به گیرنده ترشح پروتئینهای پرفورین و پروتئاز گرانزیم از سلولهای T را فعال میکند. پرفورینها در غشای سلول آلوده کانالهای پروتئینی ایجاد میکنند و گرانزیم از این کانالها وارد سیتوپلاسم میشود. ایجاد کانال تعادل اسمزی سلول را به هم میزند و منجر به لیز شدن سلول میشود. به علاوه گرانزیم مسیر آپوپتوز در سلول را فعال میکند.
اختلال های لکوسیت چیست؟
اگر تا این بخش از مطلب لکوسیت چیست با ما همراهی کرده باشید، متوجه شدید که انواع و مکانیسمهای دفاعی لکوسیت چیست. در این بخش انواع اختلالات لکوسیتی را بررسی میکنیم. اختلالهای لکوسیتی به دو دسته غیربدخیم و بدخیم تقسیم میشوند. این اختلالها شکل لکوسیتها یا تعداد آن در خون را تغییر میدهند.
به افزایش تعداد لکوسیتها، لکوسیتوز و به کاهش آن لکوپنیا گفته میشود. در لکوسیتوز تعداد گلبولهای سفید افراد بزرگسال بیشتر از $$11\times10^9$$ سلول در هر لیتر خون است. در این حالت ممکن است تعداد یک یا چند نوع لکوسیت افزایش یابد. در لکوپنیا تعداد گلبولهای سفید فرد بالغ کمتر از $$3\times10^9$$ سلول در هر لیتر خون است. از آنجا که تعداد ائوزینوفیلها، بازوفیلها و مونوسیتها معمولا در خون کم است، لکوپنیا بیشتر به دلیل کاهش لنفوسیتها یا نوتروفیلهای ایجاد میشود. در این بخش از مطلب لکوسیت چیست ابتدا اختلالت غیربدخیم و سپس اختلالانت بدخیم لکوسیتی را توضیح میدهیم.
اختلال های غیر بدخیم لوکوسیت چیست؟
اختلالهای غیر بدخیم را میتوان بر اساس لکوسیتها تقسیم بندی کرد.
اختلالت غیربدخیم نوتروفیل
نوتروفیلیا به وضعیتی گفته میشود که تعداد نوتروفیلها بیشتر از $$7\times10^9$$ سلول در هر لیتر خون است. این اختلال به دلیل عفونت، التهاب، مصرف دارو یا پاسخ به درمان ایجاد شود. نوتروپنیا به وضعیتی گفته میشود که تعداد نوتروفیلهای خون کمتر $$2\times10^9$$ سلول در هر لیتر خون است. بیماریهای سلولهای بنیادی مغز استخوان ازجمله میلومای چندگانه و کمخونی آپلاستیک و عفونتهای شدید دلیل ایجاد این اختلال است.
در بعضی از اختلالهای نوتروفیلی شکل سلولها تغییر میکند اما عملکرد آنها طبیعی است. در بعضی از اختلالها شکل (تعداد لوبهای هسته یا تعداد و شکل گرانولهای سیتوپلاسمی) و عملکرد تغییر میکند و در بعضی از اختلالها شکل سلول طبیعی است اما عملکرد آن تغییر میکند. این تغییرات به دلیل جهشهای ژنتیکی ایجاد میشود. بیماریهای «پلجر هوت» (Pelger–Huët Anomaly)، «آلدر ریلی» (Alder–Reilly Anomaly)، «سندروم شدیاک هیگاشی» (Chédiak–Higashi Syndrome) و «می هگلین» (May-Hegglin Anomaly) ازجمله اختلالهای غیربدخیم نوتروفیلها هستند که شکل سلول در آنها تغییر میکند.
در اختلالت «گرانولوماتوز مزمن» (Chronic Granulomatous Disease)، «اختلال چسبندگی لکوسیت» (Leukocyte Adhesion Disorders)، «سندروم جابز» (Job's Syndrome)، «تنبلی لوکوسیت» (Lazy Leukocyte) و «اختلال میسلانوس گرانولوسیت» (Miscellaneous Granulocyte Disorder)، شکل لکوسیتها طبیعی است اما عملکرد آنها تغییر میکند.
- گرانولوماتوز مزمن: این اختلال به دلیل جهش در ژنهای آنزیم NADPH اکسیداز ایجاد میشود. در نتیجه تولید رادیکالهای آزاد در نوتروفیل کاهش مییابد و نوتروفیل نمیتواند پاتوژن فاگوسیتوز شده را کامل از بین ببرد.
- اختلال چسبندگی لکوسیت: این اختلال به دلیل جهش در ژن پروتئینهای سلکتین یا اینتگرین غشای نوتروفیل ایجاد میشود. در نتیجه نوتروفیلها نمیتوانند از خون وارد بافت شوند.
- اختلال جابز: در این اختلال نروتروفیلها خیلی آهسته به کموکینها خیلی آهسته پاسخ میدهند و سرعت حرکت نوتروفیلها در جهت محل عفونت کاهش میيابد. در نتیجه حرکت جهتدار نوتروفیلها در این بیماری مختل میشود اما حرکت تصادفی نوتروفیلها تغییر نمیکند.
- تنبلی لکوسیت: در این بیماری حرکت تصادفی و جهتدار باکتریها مختل میشود. در این وضعیت نوتروفیلها به سمت محل عفونت حرکت نمیکنند. در این بیماری تولید نوتروفیل در مغز استخوان تغییر نمیکند اما به دلیل اینکه سلولها از مغز استخوان خارج نمیشود، تعداد نوتروفیلهای خون کم است. در این اختلال نوتروفیلها توانایی تشکیل پای کاذب ندارند.
- اختلال میسلانوس گرانولوسیت: در این اختلال میولوپروکسیدازهای در گرانولهای نوتروفیل و لیزوزومهای مونوسیت کاهش مییابد. این آنزیم پراکسیداز را با کلر ترکیب و اسید کلریدریک تولید میکند. این اسید یکی از ترکیبات ضدمیکروبی مهم در این لکوسیتها است.
اختلالت غیربدخیم ائوزینوفیل
ائوزینوفیلیا به وضعیتی گفته میشود که تعداد ائوزینوفیلها بیشتر از $$0.4\times10^9$$ سلول در هر لیتر خون است. تعداد ائوزینوفیلها در شرایط غیربدخیم به دلیل بیماریهای انگلی و آلرژی افزایش میيابد. ائوزینوپنیا به وضعیتی گفته میشود که تعداد ائوزینوفیلها کمتر از $$0.09\times10^9$$ در هر لیتر خون است. تعداد ائوزینوفیلها در اثر بیماریهای کاهشدهنده رشد سلولهای مغز استخوان، عفونت و التهاب کاهش مییابد. افزایش تعداد لوبهای هسته یکی از تغییرات مورفولوژی ائوزینوفیلها است.
اختلالات غیر بدخیم بازوفیل
بازوفیلیا به وضعیتی گفته میشود که تعداد بازوفیلها بیشتر از $$0.15\times10^9$$ سلول در هر لیتر خون است. تعداد این سلولها در اثر آلرژی و حساسیت شدید به دارو و غذا افزایش مییابد. بازوپنیا به وضعیتی گفته میشود که تعداد بازوفیلها کمتر از $$0.01\times10^9$$ سلول در هر لیتر خون است. تعداد این سلولها به دلیل عفونت حاد، استرس، پرکاری تیروئید و افزایش گلوکوکورتیوکوئیدها کاهش مییابد.
اختلالات غیر بدخیم مونوسیت
مونوسیتوز به وضعیتی گفته میؤود که تعداد مونوسیتها از $$1.0\times10^9$$ سلول در هر لیتر خون بیشتر است. تعداد این سلولها به دلیل التهاب حاد و مزمن، شیمیدرمانی و عفونت افزایش مییابد. مونوسیتوز معمولا یکی از علائم بهبود عفونتهای شدید است. مونوسیتوپنیا به وضعیتی گفته میشود که تعداد مونوسیتها کمتر از $$0.2\times10^9$$ سلول در خون است. این وضعیت به ندرت و بر اثر درمان با داروهای استروئیدی، همودیالیز، عفونت خونی و عفونتهای ویروسی ایجاد میشود. بیماریهای ذخیرهای لیزوزوم یکی دیگر از اختلالهای مونوسیت و ماکروفاژها است. در این اختلالها ژن آنزیمهای تجزیهکننده موکوپلیساکارید یا لیپیدها جهش پیدا میکند.
اختلالات غیر بدخیم لنفوسیت
لنفوسیتوز به وضعیتی گفته میشود که تعداد لنفوسیتهای خون کمتر از $$4.5\times10^9$$ سلول در هر لیتر خون است. تعداد این سلولها به دلیل عفونتهای باکتریایی و ویروسی افزایش مییابد. لنفوسیتوپنیا به وضعیتی گفته میشود که تعداد لنفوسیتها کمتر از $$1.0\times10^9$$ سلول در خون است. این اختلال به دلیل بیماریهای ارثی، عفونت، شیمیدرمانی و رادیوتراپی و سوتغذیه ایجاد میشود.
اختلال های بدخیم لکوسیت چیست؟
اختلالهای بدخیم آخرین موضوعی است که در مطلب لکوسیت چیست بررسی میکنیم. لوسمی یا «لوکمیا» (Leukemia)، لنفوم یا «لیمفوما» (Lymphoma) و «میلوما» (Myelima) انواع اختلالهای بدخیم لکوسیتها یا سرطانهای گلبول سفید هستند. لوکمیا و لیمفوما تومورهای لنفوسیتی هستند. لوکیما در مغز استخوان شروع میشود و تومورهای آن در خون و مغز استخوان وجود دارد. لیموفوما از گرههای لنفاوی و طحال شروع میشود و تورموهای آن در سیستم لنفاوی وجود دارد. این اختلالها با لکوپنیا، آنمی و ترومبوسیتوپنیا همراه است. لوسمی به انواع میلوئیدی و لنفوئیدی و لنفوم به انواع هوجکین و غیرهوجکین تقسیم میشود.
لوسمی میلوئیدی
لوسمی میلوئیدی به دلیل اختلال در تقسیم و تمایز سلولهای رده میلوئید در مغز استخوان ایجاد میشود. حاد و مزمن، «پلیسیتما ورا» (Polycythemia Vear) و ترومبوسیتمی اساسی، انواع لوسمی میلوئیدی هستند. در لوسمی میلوئیدی حاد و مزمن تعداد گرانولوسیتها، در پلیسیتما ورا تعداد گلبولهای قرمز و در ترومبوسیتمی اسای تعداد پلاکتها تغییر میکند.
در لوسمی میلوئیدی حاد سلولهای میوبلاست به جای تمایز به سلولهای پرومیوسیت و گرانولوسیتها با سرعت زیادی تقسیم میشوند و در مغز استخوان تودههای سلولی تشکیل میدهند. این اختلال به دلیل جهشهای ژنتیکی (برای مثال جهش جابهجایی کروموزومهای ۱۵ و ۱۷)، در اثر بیماریهای ژنتیکی دیگر (برای مثال بیماری سندروم داون) یا سندروم میودیپلاستیک ایجاد شود. افزایش تعداد میوبلاستها در مغز استخوان فضای رشد و موادغذایی لازم برای رشد مگاکاریوسیت و پریوارتیروبلاست را کاهش میدهد. به همین دلیل در این بیماری تعداد گلبولهای قرمز و پلاکتها کاهش مییابد. به علاوه میوبلاستها به گرانولوسیت تمایز نمییابد و تعداد این لکوسیتها در خون کاهش مییابد. در نتیجه کاهش گرانولوسیتها احتمال ابتلا به عفونت به ویژه در کلیه، مجاری ادراری، ریه و مثانه افزایش مییابد. کاهش گلبول قرمز با آنمی، احساس خستگی شدید و رنگ پریدگی همراه است و کاهش پلاکت احتمال خونریزی در بیمار افزایش مییابد. به علاوه حجم مغز استخوان به دلیل افزایش میوبلاستها افزایش مییابد و به اعصاب فشار وارد میکند. به همین دلیل لوسمی میلوئیدی حاد با درد استخوان همراه است. با افزایش تعداد میوبلاستها (بیش از ۱۰۰ هزار سلول) در خون احتمال لخته شدن آنها و مسدود شدن رگ افزایش میيابد. در نتیجه اکسیژنرسانی به بافتها مختل میشود که ممکن است منجر به تغییر بینایی، سردرد، تنگی نفس یا سکته مغزی شود.
در لوسمی میلوئیدی مزمن برخلاف نوع حاد، سلولها توانایی تمایز خود را از دست نمیدهند. در این اختلال سرعت تقسیم سلولهای بنیادی میلوئید و تعداد میوبلاست، پرومیوسیت، میوسیت، متامیوسیت و گرانولوسیتها افزایش مییابد. در این بیماری تعداد پلاکتها افزایش مییابد اما تعداد گلبولهای قرمز تغییر نمیکند. جهش جابهجایی بین کروموزومهای ۹ و ۲۲ یکی از مهمترین دلایل ایجاد لوسمی میلوئیدی مزمن است. این جابهجایی منجز به تشکیل ژن BCR-ABL میشود. پروتئین این ژن با تحریک گیرندههای تیروزین کیناز رشد تقسیم سلول را تحریک و آپوپتوز را مهار میکند. لوسمی میلوئیدی مزمن به سه مرحله میلوئیدی مزمن، سریع و بلاستیک تقسیم میشود.
- در مرحله مزمن بیشتر افراد علائمی ندارند. اما در بعضی از افراد تعداد گرانولوسیتهای به ویژه بازوفیل افزایش مییابد. گرانولوسیتها در طحال جمع میشوند و اندازه طحال افزایش میيابد. بزرگ شدن طحال به معده فشار میآورد و منجر به بیاشتهایی، احساس تهوع و احساس سیری کاذب میشود. به علاوه این سلولها تولید گلبولهای قرمز در طحال را تحریک میکنند. در این مرحله تعداد پلاکتها افزایش میيابد. تعداد میلوبلاستها در این مرحله کمتر از ۱۰٪ سلولهای مغز استخوان اسست.
- در مرحله سریع علاوه بر میلوئیدها، تعداد میوبلاستها افزایش مییابد. در این حالت فضای کافی برای رشد سلولهای دیگر نیست به همین دلیل تعداد پلاکتها و گلبولهای قرمز کاهش مییابد. کاهش گلبولهای قرمز منجر به ایجاد آنمی، خستگی شدید و تنگی نفس میشود و کاهش پلاکتها احتمال خونریزی را افزایش میدهد. تعداد گرانولوسیتها در این مرحله کمتر از فاز مزمن است. اما اختلاف آن زیاد نیست. در این مرحله طحال از مرحله مزمن بزرگتر است. تعداد میلوبلاستها در این مرحله بین ۱۰٪ تا ۱۹٪ سلولهای مغز استخوان است. در این مرحله افزایش تعداد سلولها با افزایش مغز حجم مغز استخوان، فشار به اعصاب و احساس درد در استخوان همراه است.
- در مرحله بلاستیک تعداد میلوبلاستها در این مرحله بیش از ۲۰٪ سلولهای مغز استخوان است. علائم این مرحله شبیه لوسمی میلوئیدی حاد است. تعداد گلبولهای قرمز و پلاکتها در این مرحله کمتر از مرحله سریع است. درد استخوان در این مرحله بیشتر میشود و فعالیت گرانولوسیتها کاهش میيابد. در نتیجه احتمال ایجاد عفونت افزایش میيابد.
لوسمی لنفوئیدی
لوسمی لنفوئیدی به دلیل اختلال در تقسیم و تمایز سلولهای رده لنفوئید در مغز استخوان ایجاد میشود. در این بیماری تعداد لنفوسیتهای T، لنفوسیتهای یا سلولهای کشنده طبیعی افزایش مییابد. لوسمی لنفوئیدی به انواع حاد و مزمن تقسیم میشود. در لوسمی لنفوئیدی حاد، سلولهای لنفوبلاست B و T به جای تمایز به لنفوسیتهای B و T با سرعت زیاد تقسیم میشوند و توانایی تمایز در آنها از بین میرود. جهش جابهجایی بین کروموزومها ۱۲ و ۲۱، جهش جابهجایی بین کروموزومهای ۹ و ۲۲ و عفونت ویروسی HTLV (ویروس لنفوتروپیک T انسان) به ایجاد لوسمی لنفوئیدی حاد میشود. علائم این بیماری شبیه لوسمی لنفوسیدی حاد است. افزایش تعداد لنفوبلاستها منجر به کاهش فضا و مواد غذایی برای رشد گلبولهای سفید و پلاکتها میشود و تعداد این گلبول قرمز و پلاکت کاهش مییابد. در نتیجه این بیماری با آنمی و افزایش احتمال خونریزی همراه است. کاهش لنفوسیتها احتمال ایجاد عفونت در بافتهای مختلف به ویژه ریه، دستگاه ادراری و پوست را افزایش میدهد. افزایش لنفوبلاستها با افزایش حجم مغز استخوان، افزایش فشار به اعصاب و درد استخوان همراه است.
تجمع لنفوبلاستها در اندانمهای مختلف منجر به اختلال در فعالیت بدن میشود. تجمع لنفوبلاستها در کبد منجر به افزایش اندازه این اندام میشود. بزرگ شدن کبد با فشار به اندامهای لوله گوارش، احساس تهوع، بیاشتهایی و احساس سیری کاذب همراه است. تجمع لنفوبلاستها در گرههای لنفاوی منجر به افزایش این بخش از سیستم لنفاوی میشود. بزرگ شدن این گرهها را میتوان در ناحیه گردن مشاهده کرد. تجمع لنفوبلاستها در پرده مننژ منجر به مننژیت میشود و یکی از علائم تمایز لوسمی لنفوئیدی حاد و لوسمی میلوئیدی حاد است. تجمع لنفوبلاستهای T در غده تیموس منجر به بزرگ شدن این غده و فشار به مسیرهای تنفسی، مری و بزرگسیاهرگ بالایی میشود.
در لوسمی لنفوئیدی مزمن سرعت تقسیم سلولهای بنیادی لنفوئیدی افزایش مییابد اما سلولها توانایی تمایز دارند و از تمایز آنها لنفوسیتهای B و T طبیعی تولید میشود. در این بیماری تعداد لنفوسیتهای B افزایش مییابد و تعداد لنفوسیتهای T تغییر نمیکند. برخلاف سایر لوسمیها دلیل ایجاد لوسمی لنفوئیدی حاد مشخص نیست و بیشتر در افراد بالای ۷۰ سال ایجاد میشود. بخشی از لنفوسیتهای B تشکیل شده در مغز استخوان کارایی کافی ندارند و آنتیبادی ترشح نمیکنند. بخش دیگری از لنفوسیتها اتوآنتیبادیهایی تولید میکنند که گلبولهای قرمز و پلاکتها را از بین میبرند. کاهش ترشح آنتیبادی مقاومت سیستم ایمنی بدن به میکروبها را کاهش و احتمال ایجاد عفونت را افزایش میدهد. افزایش لنفوسیتها در مغز استخوان منجر به کاهش تولید نوتروفیل، گلبول قرمز و پلاکت میشود. سیتوکین ترشح شده از لنفوسیت B منجر به افزایش دمای بدن و تب میشود. تجمع این سلولها در گرههای لنفاوی منجر به افزایش اندازه و ایجاد تومورهای گره لنفاوی میشود. تجمع این سلولها در کبد و طحال منجر به افزایش اندازه این اندامها میشود.
لنفوم هوجکین
در لنفوم هوجکین لنفوسیتهای B اولیه در گرههای لنفاوی تقسیم میشوند اما به سلولهای B بالغ تمایز نمییابند. در این شرایط سلولها B که تمایل کمی به آنتیژن دراند، آپوپتوز نمیشوند. مورفولوژی این سلولها تغییر میکند. در سیتوپلاسم بعضی از این سلولها دو هسته کنار هم با و تعداد زیادی گرانول وجود دارد. در رنگآمیزیها اطراف هسته این سلولها هاله کمرنگی وجود دارد. بعضی از این سلولها تکهسته هستند اما در سیتوپلاسم آنها تعداد زیادی گرانول وجود دارد. بعضی از این سلولها چند هسته چند قسمتی دارند و در سیتوپلاسم آنها گرانول وجود ندارد. در بعضی از سلولها سیتوپلاسم کاهشیافته و کروماتینها بسیار فشرده هستند. بعضی از سلولها تعداد زیادی هسته نامنظم و گرانولهای سیتوپلاسمی دارند.

در این سلولها فاکتور هستهای کاپا-بتا ($$NF-\kappa\beta$$) افزایش مییابد و ژنهای آپوپتوز را غیرفعال میکند. در این بیماری گرههای لنفاوی گردنی، بالای ترقوهای، زیربغل و قفسه سینه به دلیل تجمع لنفوسیتها بزرگ میشود اما درد ایجاد نمیکند. گرههای لنفاوی در این بیماری به ترتیب و به دنبال هم بزرگ میشود. این سلولهای سیتوکینهایی ترشح میکنند که منجر به تب دورهای، افزایش ترشح پروتئینهای واکنشی فاز حاد از کبد و کاهش تولید گلبولهای قرمز و افزایش تولید ائوزینوفیل در مغز استخوان میشود. لنفوم هوجکین به ندرت بر اندامها خارج سیستم لنفاوی اثر دارد. اما سلولهای هاجکین ممکن است از گرههای لنفاوی وارد خون شوند و فعالیت معده، کبد، دستگاه عصبی مرکزی، غدد اندوکرین و اگزوکرین، استخوان و دستگاه تنفسی را تغییر دهند.
لنفوم غیرهوجکین
لنفومهای غیرهوجکین آخرین اختلالی است که در مطلب لکوسیت چیست توضیح میدهیم. در لنفوم غیر هاجکین مراحل رشد و بلوغ لنفوسیتهای B و T تغییر میکند. ویروس لنفوتروپیک T انسان یکی از دلایل ایجاد لنفوم غیرهوجکین است. این ویروس در لنفوسیتهای T غدد لنفاوی جهش ایجاد میکند. یکی دیگر از عوامل ایجاد لنفومهای غیرهوجکین جهش لنفوسیتهای B در مراحل تکامل در گرههای لنفاوی است. لنفوم فولیکولار، لنفوم ناحیه مارجینال، لنفوم ناحیه قشری، لنفوم «بورکیت» (Burkitt Lymphoma) و لنفوم سلولهای B بزرگ پخش شده، بدخیمیهای غیرهوجکین لنفوسیتها است. در لنفوم فولیکولار و ناحیه مارجینال جهشهای سلولی منجر به کاهش آپوپتوز و در لنفوم ناحیه قشری، لنفوم بورکیت و لنفوم سلولهای B بزرگ پخش شده جهشهای سلولی منجر به افزایش تقسیم سلولی میشود. لنفومهایی که به دلیل تاخیر در آپوپتوز ایجاد میشود، پیشرفت کند و لنفومهایی که به دلیل افزایش تقسیم سلولی ایجاد میشوند، رشد سریعی دارند.
- لنفوم فولیکولار: در لنفوم فولیکار لنفوسیتهای B مرکزی (سنتروسیت) در گرههای لنفاوی جهش پیدا میکند. لنفوم فولیکولار از غد لنفاوی شروع میشود و ممکن است سلولهای مغز استخوان و طحال را درگیر کند. جهش جابهجایی بین کروموزومهای ۱۴ و ۱۸ دلیل اصلی این بیماری است. این جهش منجر به افزایش بیان ژن BCL2 میشود. این پروتئین آپوپتوز را مهار میکند.
- لنفوم ناحیه مارجینال: در لنفوم مارجینال بیان ژن BCL10 در لنفوسیتهای B مارجینال افزایش میيابد. پروتئين این ژن بیان $$NF-\kappa\beta$$ را افزایش میدهد. این پروتئین آپوپتوز را مهار میکند.
- لنفوم ناحیه قشری: در لنفوم ناحیه قشری جهش جابهجایی بین کروموزمهای ۱۱ و ۱۴ در لنفوسیتهای B قشری ایجاد میشود. این جهش بیان ژن سایکلین D را افزایش میدهد. این پروتئین یکی از فاکتورها تنظیمی ورود سلول از مرحله G2 به S چرخه سلولی است.
- لنفوم بورکیت: در لنفوم بورکیت جهش جابهجایی بین کروموزم ۸ و ۱۴ سنتروبلاستها ایجاد میشود. این جهش، بیان C-MYC را افزایش میدهد. این پروتسين تقسیم سلولی را تحریک میکند. ابتلا به HIV احتمال ایجاد این سرطان را افزایش میدهد.
- لنفوم سلولهای B بزرگ پخش شده: لنفوم سلولهای B بزرگ پخش شده به دلیل جهش ژن BCL6 روی کروموزوم ۶ لنفوسیتهای B، در مراحل مختلف بلوغ ایجاد میشود. این پروتئین تقسیم سلولی را افزایش میدهد. ابتلا به HIV احتملال ایجاد این سرطان را افزایش میدهد.

تجمع لنفوسیتها در گرههای لنفاوی گردن، بالای ترقوهای، زیربغلی، مدیاستن (در لنفوم هوجکین بیشتر است) و شکم (در لنفوم هوجکین ایجاد نمیؤود) منجر به افزایش اندازه این گرهها میشود. در لنفوم غیرهوجکین برخلاف لنفوم هوجکین گرهها به ترتیب بزرگ نمیشود. لنفوسیتهای B سیتوکینهایی ترشح میکنند که عملکرد هیپوتالاموس را تغییر میدهند و منجر به افزایش دمای بدن و عرق کردن شبانه میشوند. این علائم در بیماران مبتلا به لنفوم هوجکین متداولتر است. احتمال متاستاز لنفومهای غیرهوجکین از لنفوم هوجکین بیشتر است. این حالت با تومورهای سیستم عصبی مرکزی، استخوانها، غدد، دستگاه گوارش، کبد و طحال درگیر تومورهمراه است.
- سیستم عصبی مرکزی: تجمع این سلولها در مغز منجر به ایجاد لنفوم اولیه سیستم عصبی مرکزی میشود. ابتلا به HIV احتمال ایجاد این متاستاز را افزایش میدهد و در لنفوم سلولهای B بزرگ پخش شده بیشتر اتفاق میافتد. تجمع این سلولها در پرده مننژ منجر به مننژیت و تشنج میشود.
- استخوان: تجمع این سلولها فضا و موادغذایی لازم برای رشد سایر سلولهای خون را کاهش میدهد. کاهش گلبولهای قرمز منجر به آنمی، احساس خستگی و تنگی نفس میشود و کاهش لوکوسیتها احتمال ایجاد عفونت را افزایش میدهد.
- غدد: تجمع این سلولها در غدد بزاقی و لاکریمال منجر به کاهش بزاق و خشکی چشم میشود. تجمع این سلولها در غده تیروئید منجر به افزایش اندازه این غده میشود. درگیری غدد لنفاوی در بیماران مبتلا به لنفوم سلولهای مارجینال شایعتر است.
- دستگاه گوارش: تجمع این سلولها در معده منجر به ایجاد لنفوم مالت معده میشود. درگیری معده در بیماران مبتلا به لنفوم سلولهای مارجینال شایعتر است. تجمع این سلولها در دریچه ایلئوسیکال منجر به افزایش ضخامت این دریچه و انسداد روده میشود درگیری روده در بیماران مبتلا به لنفوم بورکیت شایعتر است.
- کبد و طحال: تجمع این سلولها در کبد و طحال منجر به افزایش اندازه این اندامها میشود. درگیری کبد و طحال در بیماران مبتلا به لنفوم فولیکولار شایعتر است.
سوالات متداول لکوسیت چیست
در این بخش از مطلب مجله فرادرس تعدادی از سوالات متداول پیرامون لکوسیت چیست را پاسخ میدهیم.
علت وجود لکوسیت در ادرار چیست؟
لکوسیت در ادرار افراد سال وجود دارد اما وجود تعداد زیاد لکوسیتها در خون نشانه عفونتهای ادراری، عفونتهای کلیوی و سنگ کلیه است.
لکوسیت استراز چیست؟
لکوسیت استراز یکی از آنزیمهای لکوسیتها است. از این آنزیم برای بررسی وجود گرانولیستها در خون استفاده میشود. در این آزمایش یک ترکیب اسید استر بهوسیله آنزیم به اسید و الکل فعال تبدیل میشود. الکل فعال با نمک دیازونیوم کمپلکس بنفش تشکیل میدهد. هر چه تعداد گرانولوسیتها رد ادرار بیشتر باشد، رنگ کمپلکس تیرهتر است.
آزمایش لکوسیت چیست؟
آزمایش لکوسیت تعداد گلبولهای سفید در ادرار و خون را مشخص میکند.