تولید پروتئین در زیست شناسی – نحوه و محل تولید به زبان ساده
سلول کوچکترین واحد سازنده تمام موجودات زنده است و از مولکولهای زیستی تشکیل میشود. کربوهیدراتها، لیپیدها، اسیدنوکلئوئیکها و پروتئینها مولکولهای زیستی سلول هستند. کربوهیدراتها در تامین انرژی و بخش کوچکی از ساختار سلول و لیپیدها در ذخیره انرژی، انتقال پیام نقش دارند. اسیدهای نوکلئوئیک ماده ژنتیکی سلول هستند و در انتقال صفات از نسلی به نسل دیگر نقش دارند. پروتئینها مولکولهای زیستی هستند که از زیرواحدهای آمینواسیدی تشکیل شدهاند و ساختار سلول، انتقال پیام بین سلولی، تمام واکنشهای بیوشیمیایی سلول و تنظیم ژنها نقش دارند. رشد و تقسیم سلولها وابسته به تولید پروتئین است.
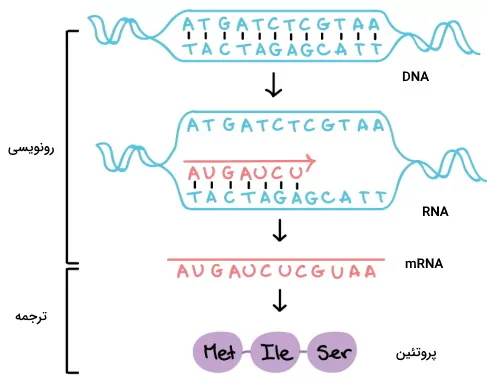
تولید پروتئین ها در سلول از رونویسی ژنها شروع میشود. در رونویسی آنزیمهای سلولی از روی DNA یک نسخه RNA تولید میکنند. در مرحله بعد نسخه RNA به آمینواسیدهای ساختار پروتئین ترجمه میشود. در ابتدای این مطلب از مجله فرادرس نحوه و محل تولید پروتئین در سلولها و در بخشهای انتهایی آن نحوه تولید پروتئین نوترکیب در آزمایشگاه را توضیح میدهیم.
نحوه تولید پروتئین
بسیاری از ساختارهای سلولی، مولکولهای انتقال پیام و ناقلهای غشایی سلولهای پروکاریوتی و یوکاریوتی پروتئینی است. به همین دلیل تولید پروتئین یکی از فرایندهای مهم برای رشد، تقسیم و عملکرد سلولها است. این فرایند از دو مرحله اصلی رونویسی و ترجمه تشکیل شده است. در رونویسی نسخه ریبونوکلئوتیدی mRNA از دئوکسی ریبونوکلئوتیدهای DNA رونویسی میشود و در ترجمه توالی ریبونوکلئوتیدهای mRNA به توالیهای آمینواسیدی پروتئین ترجمه میشود.
به غیر از این دو مرحله تغییرات پس از رونویسی و تغییرات پس از ترجمه نقش مهمی در ساختار و عملکرد پروتئین نهایی دارد. واکنشهایی که پس از ترجمه ساختار mRNA را تغییر میدهد به تولید پروتئین های متنوع و تغییراتی که ساختار رشته پلیپپتیدی اولیه را تغییر میدهد به تشکیل ساختار عملکردی پروتئین کمک میکند.
مراحل تولید پروتئین
در بخش ابتدایی این مطلب از مجله فرادرس توضیح دادیم که تولید پروتئین به دو مرحله رونویسی و ترجمه تقسیم میشود. این دو فرایند در سلولهای پروکاریوتی و یوکاریوتی تفاوتهایی با هم دارد. در این سلولها آنزیمهای RNA پلیمراز از رونویسی را ژن را انجام میدهند. اما ساختار پلیمرازها با هم متفاوت است. به علاوه در پروکاریوتها رونویسی و ترجمه همزمان انجام میشود اما در یوکاریوتها دو فرایند کاملا جدا از هم است. در ادامه ابتدا رونویسی ژنها و تغییرات پس از رونویسی را توضیح میدهیم و سپس ترجمه و تغییرات پس از ترجمه را مرور میکنیم.
رونویسی ژن ها
در فرایند ترجمه آنزیمهای پلیمراز یک رشته DNA را الگو قرار میدهند و رشته RNA مکمل آن را میسازند. به این ترتیب به جای بازهای A و G و C و T در DNA، به ترتیب بازهای U و C و G و A در mRNA ترجمه شده وجود دارد. به رشته DNA که الگو قرار میگیرد آنتیسنس یا غیرکدکننده و به رشتهای که الگو قرار نمیگیرد، سنس یا کدکننده گفته میشود. ژنها در سه مرحله شروع، طویلسازی و پایان رونویسی میشود.
شروع رونویسی
شروع نویسی مرحلهای است که RNA پلیمراز به ناحیهای از ژن به نام پروموتر متصل میشود. با اتصال RNA پلیمرا فاکتورهای رونویسی به پروموتر متصل و دو رشته DNA از هم باز میشوند. نوع RNA پلیمراز و جایگاه اتصال آن به DNA در یوکاریوتها و پروکاریوتها متفاوت است.
- شروع رونویسی در پروکاریوت: پروموتر باکتریها بخشی از توالی DNA است که شامل عناصر ۳۰- (TTGACG) و ۱۰- (TATAAT) میشود. این دو جایگاه قبل از این توالیها در فاصله ۳۰ تا ۲۰ نوکلئوتیدی قبل از جایگاه شروع رونویسی قرار دارند. آنزیم RNA پلیمراز مستقیم به این دو توالی متصل میشود. یک نوع RNA پلیمراز تمام ژنهای پروکاریوتی را رونویسی میکند. این آنزیم از دو زیرواحد $$\alpha$$، یک زیرواحد $$\beta$$، یک زیرواحد $$\beta^\prime$$ و یک زیرواحد $$\sigma$$ تشکیل شده است. زیرواحد $$\sigma$$ نقش مهمی در شناسایی پروموتر دارد و پس از اتصال پلیمراز به پروموتر از آنزیم جدا میشود. پلیمراز دو رشته DNA در جایگاه ۱۰- را از هم باز میکند. این جایگاه از بازهای A و T تشکیل شده است که پیوند هیدروژنی کمتری دارند.
- شروع رونویسی در یوکاریوت: در یوکاریوتها سه آنزیم متفاوت برای رونویسی ژنهای پروتئین، rRNA و tRNA وجود دارد. RNA پلیمراز II ژنهای پروتئين را رونویسی میکند. این پلیمراز برخلاف پروکاریوتها برای اتصال به DNA به کمک پروتئینهایی نیاز دارد که به آنها فاکتورهای رونویسی گفته میشود. در پروموتر بسیاری از ژنهای یوکاریوتی توالی نوکلئوتیدی به نام جعبه TATA وجود دارد که جایگاه اتصال فاکتورهای رونویسی به DNA است. این جایگاه ۳۰ نوکلئوتید قبل از جایگاه شروع رونویسی قرار دارد. دو رشته DNA در این توالی (TATAAA) از هم باز میشوند. فاکتورهای رونویسی با دو حرف انگلیسی TFII از کلمه انگلیسی Transcription Factor و حروف A-J نامگذاری میشوند. TFIID اولین فاکتور ورنویسی است که به پروموتر متصل میشود. پس از آن پنج فاکتور رونویسی مستقیم به DNA یا فاکتورهای رونویسی دیگر متصل میشود. TFIIH پیوند هیدروژنی بین بازها را هیدرولیز و دو رشته DNA را از هم جدا میکند.
طویلسازی رشته mRNA
شروع و طویلسازی در رونویسی برخلاف همانندسازی به پرایمر نیاز ندارد. در این مرحله RNA پلیمراز ریبونوکلئوتید ها را پشت سر هم اضافه میکند. جهت رشته الگوی RNA پلیمراز $$3^\prime$$ به $$5^\prime$$ است. رشته mRNA در جهت $$5^\prime$$ به $$3^\prime$$ رونویسی و ریبونوکلئوتیدهای جدید به OH انتهای $$3^\prime$$ اضافه میشود. تنها تفاوت mRNA رونویسی شده با رشته غیرالگو (کدکننده) جایگزینی باز T با باز U است. مرحله طویلسازی در یوکاریوت و پروکاریوت تفاوتهای کمی دارد.
- طویلسازی در پروکاریوت: طویلسازی RNA در سلولهای پروکاریوت پس از جدا شدن زیرواحد $$\sigma$$ شروع میشود. در این مرحله دو رشته DNA در جلوی پلیمراز از هم جدا و پس از رونویسی دوباره به هم متصل میشوند.
- طویلسازی در یوکاریوت: زمانی که سلول یوکاریوتی تقسیم نمیشوند. DNA آن بهوسیله واحدهای نوکلئوزومی فشرده میشود. هر نوکلئوزوم از حدود ۱۴۶ نوکلئوتید و پروتئینهای هیستون تشکیل شده است. برای طویلسازی RNA یوکاریوتی باید نوکلئوزوم باز و پروتئینهای هیستون از DNA جدا شوند تا فضای کافی برای حرکت آنزیم پلیمراز وجود داشته باشد. پروتئین دیمر FACT نوکلئوزومهای جلوی پلیمراز را باز میکند. این پروتئین دیمر هیستونهای H2A و H2B را از نوکلئوزوم جدا میکند و فضای کافی برای حرکت پلیمراز فراهم میشود. FACT پس از رونویسی قطعه DNA هیستونها را به نوکلئوزوم برمی گرداند.
پایان رونویسی
طویلسازی RNA تا رسیدن به سیگنال پایان در پروکاریوتها و تا چند هزار باز پس از ژن در یوکاریوتها ادامه دارد. پایان رونویسی در سلولهای یوکاریوتی و پروکاریوتی متفاوت است.
- پایان رونویس در پروکاریوت: رونویسی ژنوم پروکاریوتی با روش وابسته به پروتئین Rho و مستقل از پروتئین Rho پایان مییابد. در پایان ژن تونالی بازهای G وجود دارد. آنزیم RNA پلیمراز در این توالی متوقف میشود. در این شرایط پروتئین Rho که پشت سر پلیمراز حرکت میکند با این آنزیم برهمکنش میدهد. برهمکنش Rho-آنزیم منجر به تغییر کنفورماسیون آنزیم و جدا شدن آن از DNA میشود. در روش مستقل از Rho زمانی که پلیمراز به توالی غنی از GC در انتهای ژن را رونویسی میکند، mRNA خم و بین نوکلئوتیدهای G و C پیوند هیدروژنی ایجاد میشود. در نتیجه ساختار سنجاقسری پایداری در mRNA تشکیل میشود که از حرکت بیشتر RNA پلیمراز برای رونویسی توالی غنی از AT انتهایی جلوگیری میکند. پیوند ناپایدار UA بین mRNA و DNA، و توقف پلیمراز سبب جدا شدن آنزیم از DNA و پایان رونویسی میشود.
- پایان رونویسی در یوکاریوت: برخلاف پروکاریوتها سیگنال پایان مشخصی در یوکاریوتها وجود ندارد. رونویسی ژن پروتئینی یوکاریوتها ممکن است چند جفتباز پس از پایان ژن یا پس از چند هزار جفت باز پس از پایان ژن ادامه یابد. اما mRNA بهوسیله آنزیم اندونوکلئاز از یک نقطه بین توالی AAUAAA و توالی غنی از GC شکسته و از RNA پلیمراز جدا میشود. آنزیم $$5^\prime$$ اگزونوکلئاز باقیمانده RNA را هیدرولیز میکند و به آنزیم پلیمراز میرسد. هیدرولیز انتهای آویزان RNA سبب جدا شدن پلیمراز از DNA و پایان رونویسی میشود.
تغییرات پس از رونویسی
در پروکاریوتها همزمان با رونویسی ترجمه mRNA شروع میشود و نیاز به تغییرات پس از ترجمه نیست. اما در یوکاریوتها mRNA اولیه پس از تغییرات به سیتوپلاسم منتقل و ترجمه میشود. تغییرات پس از ترجمه سبب افزایش پایداری mRNA یوکاریوتی میشود. اضافه شدن $$5^\prime CAP$$، دم پلی A و پردازش سه تغییر پس از رونویسی است.
- اضافه شدن $$5^\prime CAP$$: در این مرحله کربن $$5^\prime$$ یک مولکول متیل گوانوزین به انتهای $$5^\prime$$ مولکول mRNA متصل میشود. این ترکیب از تجزیه انتهای RNA جلوگیری میکند. به علاوه اتصال فاکتورهای رونویسی به $$5^\prime CAP$$ به شروع ترجمه کمک میکند.
- اضافه شدن دم پلی A: پس از جدا شدن mRNA آنزیم پلی A ایزومراز حدود ۲۰۰ نوکلئوتید A به انتهای $$3^\prime $$ اضافه میکند. این توالی از تجزیه آنزیمی mRNA جلوگیری و به خروج mRNA بالغ از هسته کمک میکند.
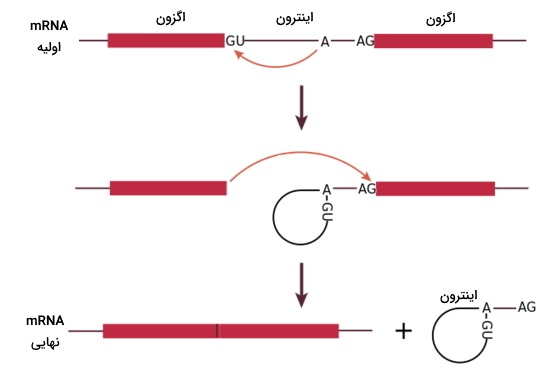
- پردازش mRNA: ژنهای یوکاریوتی از توالیهای اگزون و اینترون تشکیل شده است. اگزونها بخشهایی از ژن هستند که رونویسی و ترجمه میشود. اینترونها بخشهایی از ژن هستند که رونویسی میشوند اما ترجمه نمیشوند. اینترونها در پردازش از mRNA جدا میشود. پردازش در هسته و بهوسیله کمپلکس پروتئینی اسپلایسوزوم انجام میشود. هر اسپلایسوزوم از ۵ زیرواحد snRNPs (ذرات کوچک ریبونوکوتیدی هسته) و هر snRNPs از پروتئینها و RNA کوچک هسته (snRNAs) تشکیل شده است. اسپلایسوزوم توالی GU در انتهای $$5^\prime$$ و توالی AG در انتهای $$3^\prime $$ اینترونها را شناسایی میکند. این کمپلکس پروتئینی ابتدا پیوند فسفات نوکلئوتید G در انتهای $$5^\prime$$ اینترون را تجریه و نوکلئوتید G را به نوکلئوتید A در نزدیکی انتهای $$3^\prime $$ متصل میکند. اپلایسوزوم در ادامه انتهای $$3^\prime $$ اگزون اول را به انتهای $$5^\prime$$ اگزون دوم متصل میکند و انتهای $$3^\prime $$ اینترون آزاد میشود.
ترجمه mRNA
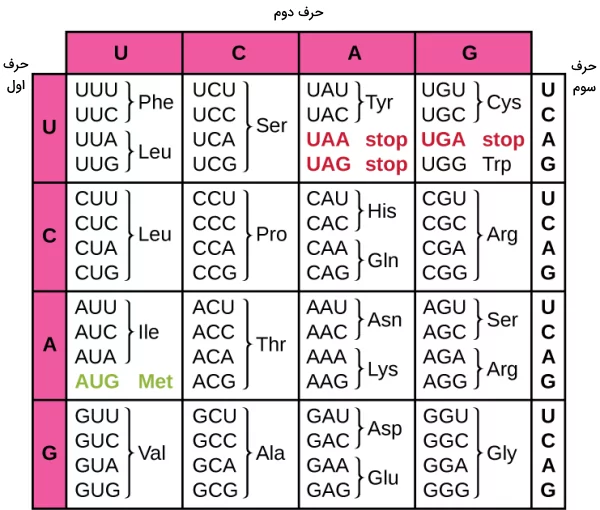
پروتئینها از ۲۰ نوع آمینواسید در توالیهای متفاوت تشکیل میشوند. هر آمینواسید با سه نوکلئوتید در mRNA تعریف میشود که کدون نام دارد. تمام آمینواسیدها به جز تریپتوفان و متیونین بیش از یک کدون دارند. در مجموع ۶۱ کدون آمینواسید و یک کدون پایان وجود دارد. کدون AUG علاوه بر آمینواسید میتیونین جایگاه شروع ترجمه را مشخص میکند. کدونهای سلولهای پروکاریوتی و یوکاریوتی یکسان هستند. جدول زیر کدونهای mRNA را نشان میدهد.
ریبوزوم و tRNA دو درشتمولکولی هستند که در فرایند ترجمه شرکت میکنند.
- ریبوزوم مجموعهای از پروتئینهای ساختاری، rRNA های ساختاری و rRNA های آنزیمی است. ریبوزومهای پروکاریوتی در سیتوپلاسم و ریبوزومهای یوکاریوتی در سیتوپلاسم، روی شبکه اندوپلاسمی، در میتوکندری و کلروپلاست قرار دارد. ریبوزومهای پروکاریوتی، میتوکندری و کلروپلاست ۷۰S اما ریبوزومهای سیتوپلاسمی و شبکه اندوپلاسمی ۸۰S است. ریبوزومها از یک زیرواحد کوچک و یک زیرواحد بزرگ تشکیل شده است. زیر واحد کوچک ریبوزوم پروکاریوت ۳۰S و زیرواحد بزرگ آن ۵۰S است. rRNA زیرواحد کوچک ۱۶S و rRNA زیرواحد بزرگ ۵S و ۲۳S است. زیرواحد کوچک ریبوزوم یوکاریوتها ۴۰S و زیرواحد بزرگ آن ۶۰S است. rRNA زیرواحد کوچک ۱۸S و rRNA زیرواحد بزرگ ۵S، ۵٫۸S و ۲۸S است. زیرواحد کوچک ریبوزوم به mRNA و زیرواحد بزرگ آن به tRNA متصل میشود.
- tRNAهای بالغ ماکرومولکولهای سهبعدی هستند. این ساختار سهبعدی به دلیل تاخوردگیهای مولکول و پیوندهای هیدروژنی درونمولکولی بین بازها تشکیل میشود. سه لوپ در این ساختار وجود دارد که یکی از آنها سه نوکلئوتید مکمل کدونهای mRNA را دارد. به این توالی آنتیکدون گفته میشود. در انتهای $$3^\prime $$ تمام tRNA ها توالی $$3^\prime ACC 5^\prime$$ وجود دارد که به آمینواسید اختصاصی متصل میشود.
فرایند ترجمه مثل رونویسی در سه مرحله شروع، طویلسازی زنجیره پلیپپتیدی و پایان انجام میشود.
- شروع ترجمه: در این مرحله ریبوزوم و mRNA با هم جفت میشود و اولین کدون ترجمه میشود.
- شروع ترجمه پروکاریوت: کمپلکس شروع ترجمه در پروکاریوتها از زیرواحد کوچک ریبوزوم، mRNA، سه فاکتور پروتئینی (IFs) و tRNA آغازگر (N-فرمیل متیونین tRNA) تشکیل شده است. rRNA زیرواحد کوچک ریبوزوم به توالی شاین دالگارنو (AGGAGG) در بالادست کدون شروع، متصل میشود. در ادامه IF2 مولکول tRNA آغازگر را به ریبوزوم منتقل میکند و tRNA به کدون آغاز متصل میشود. سپس زیرواحد بزرگ ریبوزوم به زیرواحد کوچک متصل میشود.
- شروع ترجمه یوکاریوت: کمپلکس شروع ترجمه یوکاریوتها شبیه پروکاریوتها است، با این تفاوت که متیونین متصل به tRNA آغازگر یوکاریوتها گروه فرمیل ندارد. در یوکاریوتها فاکتورهای پروتئینی به $$5^\prime CAP$$ متصل میشود و mRNA را با زیرواحد کوچک ریبوزوم جفت میکند. سپس کمپلکس فاکتورهای پروتئینی-ریبوزوم در جهت $$5^\prime$$ به $$3^\prime$$ روی mRNA حرکت و کدون AUG را پبدا میکند. جایگاه شروع ترجمه یوکاریوتها معمولا در توالی کوزاک ($$3^\prime$$ ACCAUGG $$5^\prime$$) قرار دارد. پس از اتصال tRNA آغازگر به کدون آغاز، زیرواحد بزرگ ریبوزوم به زیرواحد کوچک متصل میشود.
- طویلسازی زنجیره پلیپپتیدی: طویلسازی زنجیره پلیپپتیدی در پروکاریوتها و یوکاریوتها با مراحل مشابهی انجام میشود. زیرواحد بزرگ ریبوزوم از سه جایگاه A و P و E تشکیل شده است. جایگاه A محل قرار گرفتن tRNA متصل یه آمینواسید، جایگاه P محل قرار گرفتن tRNA متصل به زنجیره پلیپپتیدی و جایگاه E محل خروج tRNA از ریبوزوم است. پیوند پپتیدی بین گروه آمین آمینواسید جایگاه A و گروه کربوکسیل آمینواسید جایگاه P تشکیل میشود. پپتیدیل ترانسفراز (RNAهای ۲۳S و ۲۸S) تشکیل پیوند پپتیدی را کاتالیز میکنند. rRAN فاکتورهای پروتئینی طویلسازی با هیدرولیز یک مولکول GTP کنفورماسیون ریبوزوم را تغییر میدهند. در نتیجه تغییر کنفورماسیون ریبوزوم به اندازه یک کدون روی mRNA حرکت میکند و tRNA بین جایگاه A و P و E جابهجا میشود.
- پایان رونویسی: ترجمه زمانی تمام میشود که یکی از کدونهای پایان (UAA و UAG و UGA) در جایگاه A ریبوزوم قرار بگیرد. فاکتورهای آزادسازی این کدونها را شناسایی میکنند. اتصال این پروتئینها به کدون پایان سیگنال هیدرولیز پیوند بین اولین آمینواسید و tRNA جایگاه P بهوسیله پپتیدیل ترانسفراز است. پس از جدا شدن زنجیره پلیپپتیدی از tRNA ریبوزومها از هم جدا میشوند. mRNA پس از چند بار ترجمه بهوسیله آنزیمهای ریبونوکلئاز تجزیه میشود و نوکلئوتیدهای آن در سنتز RNA جدید شرکت میکند.
تغییرات پس از ترجمه
در تغییرات پس از ترجمه اضافه شدن گروههای عاملی به زنجیره جانبی آمینواسیدها یا هیدرولیز بخشی از زنجیره پلیپپتیدی، ویژگیهای ساختاری و عملکردی پروتئینها را تغییر میدهد. اضافه شدن گروههای عاملی تغییرات برگشتپذیر و هیدرولیز بخشی از آنزیم تغییرات برگشت ناپذیر هستند. این تغییرات عملکرد آنزیمها، طول عمر پروتئین، برهمکنش پروتئینها با هم، برهمکنش سلول با ماتریکس خارج سلولی، فعال شدن گیرندهها، حلالیت پروتئین و تاخوردگی پروتئین را تغییر میدهد.
در این فرایندها آنزیمهای کیناز، فسفاتاز، ترانسفراز و لیگاز گروههای شیمیایی جدید به پروتئین اضافه میکنند و آنزیمهای پروتئاز پیوند پپتیدی بین آمینواسیدها را هیدرولیز میکنند. این تغییرات بلافاصله پس از ترجمه زنجیره پلیپپتیدی برای تشکیل ساختار چهارم پایدار یا پس از تشکیل ساختار چهارم برای تغییر عملکرد پروتئین انجام میشود. فسفوریلاسیون، گلیکوزیلاسیون، اضافه شدن یوبیکوئیتین، نیتروزیلاسیون، متیلاسیون، استیلاسیون، لیپداسیون و پروتئولیز تغییراتی است که در این بخش از مطلب تولید پروتئین توضیح میدهیم.
- فسفوریلاسیون: فسفوریلاسیون برگشتپذیر گروه فسفات به سرین، تروئونین و تیروزین در تنظیم چرخه سلولی، رشد سلول، آپوپتوز، فعالیت آنزیم، فعالیت کانالهای غشایی و انتقال پیام بین سلولها نقش مهمی دارد. در این فرایند گروه فسفات بهوسیله آنزیمهای کیناز از ATP به پروتئین منتقل میشود. دفسفوریلاسیون فرایند جدا شدن فسفات از پروتئینها است که بهوسیله آنزیمهای فسفاتاز کاتالیز میشود.
- گلیکوزیلاسیون: در گلیکوزیلاسیون آنزیمهای گلیکوزیل ترانسفراز مونوساکاریدها، اولیگوساکاریدها یا پلیساکاریدها را به پروتئین متصل میکنند و پروتئین به گلیکوپروتئین تبدیل میشود. بسیاری از گیرندهها و آنتیژنهای غشای پلاسمایی گلیکوپروتئین هستند. کربوهیدراتها به نیتروژن زنجیره جانبی آسپارژین (اتصال N) یا اکسیژن زنجیره جانبی سرین و تروئونین (اتصال O) متصل میشود. گلیکوزیلاسیون در شبکه اندوپلاسمی، دستگاه گلژی، سیتوپلاسم یا غشای پلاسمایی سلولهای یوکاریوتی و پروکاریوتی انجام میشود.
- اضافه شدن یوبیکوئیتین: یوبیکوئیتین زنجیره پلیپپتیدی با ۷۶ آمینواسید و نشانه تجزیه پروتئین است. گلایسین انتهای C این پلیپپتید به لیزین پروتسین هدف متصل میشود و نشانهای برای آنزیمهای پروتئاز است. این فرایند بهوسیله یک کمپلکس آنزیمی کاتالیز میشود که از آنزیمهای فعالکننده یوبیکوئیتین، جفتکننده یوبیکوئيتین و متصلکننده یوبیکوئیتین تشکیل شده است.
- S-نیتروزیلاسیون: نیتریکاکسید یکی از پیامرسانهای شیمیایی سلول است که بهوسیله آنزیم نیتریکاکسید سنتتاز تولید میشود و به گروه سولفور سیستئین متصل میشود. S-نیتروزیلاسیون یک فرایند برگشتپذیر است و آنزیمهای گلوتاتیون و تیوردوکسین نیتریکاکسید را از پروتئین جدا میکنند.
- متیلاسیون: در فرایند متیلاسیون یک گروه متیل بهوسیله آنزیمهای متیل ترانسفراز از S-آدنوزیل متیونین (SAM) به گروه نیتروژن یا اکسیژن زنجیره جانبی آمینواسیدهای متصل میشود. متیلاسیون اکسيزن برگشتپذیر و متیلاسیون نیتروژن برگشتناپذیر است. متیلاسیون یکی از فرایندهای تنظیمی مهم در اپیئنتیک اسید و متیلاسیون هیستونها در تنظیم بیان ژن نقش دارد.
- استیلاسیون: استیلاسون واکنش اضافه شدن گروه استیل به پروتئین و داستیلاسیون واکنش جدا شدن گروه استیل از پروتئین است. آنزیمهای لیزین استیل ترانسفراز و هیستون استیل ترانسفراز واکنش استیلاسیون و داستیلازها واکنش داستیلاسیون را کاتالیز میکنند. آنزیمهای ترانسفراز گروه استیل را از استیل کوآنزیم A به نیتروژن آلفا (آمنی زنجیره اصلی)، نیتروژن اپسیلون (آمین زنجیره جانبی) یا اکسيژن منتقل میکنند. استیلاسیون هیستونها نقش مهمی در تغییرات اپیزنتیکی ژن و تنظیم بیان ژن دارد.
- لیپیداسیون: لیپداسیون واکنش اضافه شدن گروههای لیپیدی به پروتئینها است. این واکنشها لیپید را برای شرکت در غشای اندامکها (شبکه اندوپلاسمی، دستگاه گلژی و میتوکندری)، وزیکولها (اندوزوم و لیزوزوم) و غشای سلولی نشانهدار میکنند. این واکنشها خاصیت آبگریزی پروتئین و تمایل آن به قرار گرفتن در غشا را افزایش میدهند. لنگر گلیکوزیل فسفاتیدیل اینوزیل (GPI) انتهای C، مریستولاسیون انتهای آمین، S-مریستولاسیون و S-پرنیلاسیون انواع لیپیداسیونهای پروتئین است.
- لنگر GPI انتهای C: لنگر GPI انتهای C پروتئینها را به لیپیدهای غشایی متصل میکند. گلیکوزیل فسفاتیدیل اینوزیتول فسفات در شبکه اندوپلاسمی سنتز و به انتهای کربوکسیل پروتئینهای یوکاریوتی متصل میشود. GPI از اتصال فسفاتیدیل اینوزیتول (اینوزیتول، گلیسرول و دو اسید چرب)، یک گلوکزآمین، سه مانوز و یک فسفواتانول آمین تشکیل شده است. پروتئینهای دارای لنگر GPI معمولا در بخشهایی از غشای با کلسترول و اسفنگولیپید فراوان قرار میگیرند. این لیپیداسیون برگشتپذیر است و GPI بهوسیله آنزیم فسفولیپاز C از پروتئین جدا میشود.
- مریستولاسیون انتهای آمین: مریستیکاسید یک اسید چرب اشباع و ۱۴ کربنه است که به شکل برگشتناپذیر به پروتئینهای غشایی و سیتوپلاسمی یوکاریوتها اضافه میشود. آنزیم N-مریستول ترانسفراز، مریستول را از مریستول کوآنزیم A به گلایسین انتهای آمین پروتئین منتقل میکند.
- S-پالمیتوئیلاسیون: پالمیتوئیکاسید، یک اسید چرب ۱۶ کربنه و اشباع است که بهوسیله آنزیم پالمیتوئیل آسیل ترانسفراز از پامیتوئیل کوآنزیم A به سولفور سیستئین منتقل میشود. این واکنش به شکل برگشتپذیر انجام میشود و آنزیمهای تیواستراز پالمیتوئیل را از سیستئین جدا میکنند.
- S-پرنیلاسیون: فارنسیل (۱۵ کربنه) و جرانیلجرانیل (۲۰ کربنه) لیپیدهای ایزوپرنوئیدی هستند که بهوسیله آنزیمهای ترانسفراز به پروتئینها متصل میشوند. این لیپیدها به گروه S سیستئینی متصل میشوند که در توالی ۵ آمینواسدی انتهای کربوکسیل پروتئین قرار دارد. S-پرنیلاسیون در شبکه اندوپلاسمی انجام میشود.
- پروتئولیز: پروتئازها آنزیمهای تجزیهکننده پروتئینها هستند که بر اساس نوع جایگاه فعال به انواع سرین پروتئاز، سیستئین پروتئاز، آسپارتیکاسید پروتئاز و زینک متالوپروتئازها تقسیم میؤوند. فعالیت پروتئازها برای تنظیم غلظت پروتئین در سلول، تجزیه پروتئینهایی با کنفورماسیون اشتباه و تبدیل زیموژنها به آنزیم فعال نقش مهمی دارد.
تولید پروتئین نوترکیب
تولید پروتئین های نوترکیب یکی از فرایندهای زیستفناوری برای تولید یک پروتئین مشخص در مقیاس زیاد یا تولید پروتئین با ویژگیهای جدید است. این فرایند معمولا با اضافه کردن ژن پروتئین مورد نظر به ژنوم سلول میزبان و دستکاری بیان ژن در میزبان انجام میشود. انتخاب و کلونینگ ژن، بیان ژن در میزبان و تخلیص پروتئین نوترکیب مراحل تولید پروتئین نوترکیب است.
کلونینگ ژن
اولین مرحله تولید پروتئین نوترکیب انتخاب ژن پروتئین و تولید DNA نوترکیب است. DNA نوترکیب از ادغام دو یا چند قطعه DNA تشکیل شده است. ترانسپوزونها قطعات DNA هستند که در سلولهای یوکاریوت و پروکاریوت بین بخشهای مختلف ژنوم منتقل میشوند. به تولید DNA نوترکیب در محیط آزمایشگاه کلونینگ ژن گفته میشود. این فرایند برای سنتز مولکول DNAای استفاده میشود که به طور طبیعی در سلول وجود ندارد. جدا کردن ژن و اتصال آن به DNA جدید، انتقال ژن به میزبان و تکثیر ژن در میزبان مراحل انجام کلونینگ است.

جدا کردن ژن و اتصال به DNA جدید
برای جدا کردن ژن مورد نظر از کل DNA، از آنزیمهای محدودکننده استفاده میشود. آنزیمهای محدودکننده DNA را در توالیهای نوکلئوتیدی مشخص برش میدهند و انتهای تک رشتهای یا دورشتهای ایجاد میکنند. در ادامه ژن به وکتور منتقل میشود. وکتور مولکول حاملی است که ژن را به سلول میزبان منتقل میکند و با استفاده از سیستم همانندسازی میزبان تکثیر میشود. پلاسمیدها، باکتریوفاژها، کروموزوم مصنوعی باکتری (BAC)، کروموزوم مصنوعی مخمر (YAC) و کروموزوم مصنوعی پستانداران (MAC) انواع وکتورهای کلونینگ DNA هستند که اندازه آنها و تعداد نوکلئوتید ژنی که میپذیرند، متفاوت است. یک وکتور مناسب باید ویژگی های زیر را داشته باشد.
- جایگاه شروع همانندسازی و توانایی تکثیر مستقل در سلول میزبان را داشته باشد.
- یک جایگاه برش برای آنزیم محدودکننده داشته باشد، یک جایگاه شروع همانندسازی داشته باشد.
- «ژنهای نشانگر» (Gene Marker) داشته باشد تا در مراحل بعدی از DNA نوترکیب قابل تمایز باشد. این ژنها معمولا ژن مقاومت به یک نوع آنتیبیوتیک هستند.
- از سلول میزبان راحت استخراج شود.
- اگر وکتور در مراحل بعدی برای بیان ژن استفاده میشود باید پروموتر داشته باشد.
برای تشکیل DNA نوترکیب، وکتور با آنزیم محدودکنندهای ژن هدف برش داده شده، برش داده میشود. در ادامه ژن مورد نظر و وکتور با هم مخلوط میشوند و آنزیم DNA لیگاز انتهای آزاد دو قطعه DNA را به هم وصل میکند.
انتقال ژن به میزبان و تکثیر میزبان
در این مرحله DNA نوترکیب به میزبان که معمولا باکتری است منتقل میشود. ترانسفورماسیون، «میکرو اینجکشن» (Microinjection)، تفنگ ژنی و استفاده از فاژ روشهای انتقال DNA نوترکیب به میزبان است. در ترانسفورماسیون DNA نوترکیب به محیط کشت باکتری منتقل میشود. بعضی از باکتریها یدون نیاز به محرک خارجی DNA را جذی میکنند. اما برای انتقال DNA نوترکیب به بعضی از باکتریها از شوک دمایی، «الکتروپوریشن» (Electroporation)، «سونیکاسیون» (Sonication)، تغییر فشار هیدروستاتیک یا تیمار یون کلسیم استفاده میشود. این روشها یکپارچگی غشای پلاسمایی باکتری را به هم میزند و DNA نوترکیب وارد باکتری میشود. در میکرواینجکشن DNA نوترکیب بهوسیله سوزن شیشهای بسیار باریکی به هسته سلول میزبان غیرباکتریایی تزریق میشود. در روش تفنگ ژنی پوششی از DNA نوترکیب روی ذرات فلز سنگین قرار میگیرد و با نیروی زیاد به سمت سلول میزبان پرتاب میشود.
پس از انتقال DNA نوترکیب، برای جدا کردن سلولهای نوترکیب از سلولهای دیگر آنتیبیوتیک به محیط کشت اضافه میشود. سلولهایی که DNA نوترکیب را دریافت کردهاند، ژن مقاوم به آنتیبیوتیک دارند و از بین نمیروند. در ادامه سلولهای نوترکیب به محیط کشت جدید منتقل میشوند.
بیان ژن در میزبان
میزبان مناسب برای بیان ژن بر اساس مقدار پروتئین لازم، زمان و امکانات در دسترس و هدف بیان ژن انتخاب میشود. برای بیان ژن و تولید پروتئین نوترکیب میتوان از باکتری، سلولهای پستانداران، سلولهای حشرات یا سیستمهای فاقد سلول استفاده کرد.
- سلول پستانداران: شباهت کنفورماسیون، تغییرات پس از ترجمه و عملکرد پروتئینهایی که در سلولهای پستانداران بیان میشود به پروتئینهای انسان بیشتر است. برای بیان ژن میتوان از ردههای سلولی موقت و پایدار استفاده کرد. بیان ژن در سلولهای موقت بیشتر است و از سلولهای پایدار میتوان در چند آزمایش استفاده کرد. محیط کشت پیچیده، زمان بیان ژن طولانی، تولید محصول کم و هزینه زیاد از معایب این میزبانها است.
- سلول حشرات: برای انتقال DNA نوترکیب به سلولهای حشرات از ژنوم باکولوویروس استفاده میشود. این ویروسها از سیستم همانندسازی و بیان ژن حشرات استفاده میکنند و سلولهای انسانی را آلوده نمیکنند. سیستم بیان ژن و تغییرات پس از ترجمه حشرات شباهت زیادی به سیستم انسان دارد. به همین دلیل این سلولها میزبان مناسبی برای بیان ژنهای انسان هستند. محیط کشت این سلولها پیچیدهتر از باکتری است و به زمان بیشتری برای رشد و بیان ژن نیاز دارد.
- مخمر: یکی از مزایای میزانهای مخمری سرعت بالای تکثیر و بیان ژنها است. سیستم تغییرات پس از ترجمه این یوکاریوتها تقریبا شبیه پستاندراران است. اما گلیکوزیلاسیون پروتئین از روش متفاوت یانجام میشود. به همین دلیل برای تولید گلیکوپروتئینها نیمتوان از این میزبان استفاده کرد. پایداری پروتئین در این سیستم بیشتر از پروکاریوتها است.
- باکتری: سیستم ساده، آشنایی کامل با سیستم ژنتیکی، سطح بیان بالا و زمان کشت کوتاه، باکتریها را به یکی از متداولترین میزبانهای بیان ژن و تولید پروتسین نوترکیب تبدیل کرده است. اما سیستم تغییرات پس از ترجمه این میزبان با سلولهای انسانی بسیار متفاوت است و از آن نمیتوان برای تولید پروتئین های عملکردی استفاده کرد.
- سیستم فاقد سلول: در سیستمهای فاقد سلول تمام آنزیمهخا و مواد اولیهای که برای رونویسی، ترجمه و تغییرات پس از ترجمه نیاز است در لوله آزمایش با DNA نوترکیب مخلوط میشود. با این روش میتوان پروتئین نوترکیب را در چند ساعت تولید کرد. از این روش نمیتوان برای تولید پروتئین در مقیاس بالا استفاده کرد.
تخلیص پروتئین
تخلیص، فرایند جدا کردن پروتئین نوترکیب از دیگر اجزای سلول و محیط کشت است. این فرایند در سه مرحله استخراج پروتئین، رسوبگذاری و جداسازی پروتئین هدف انجام میشود.
- استخراج پروتئین: برای استخراج پروتئین از روشهای مکانیکی، شیمیایی، فیزیکی و آنزیمی لیز کردن سلول استفاده میشود. برای حفظ کنفورماسیون و ساختار طبیعی پروتئین از دترجنتهای ملایم ازجمله تریتون X-100 برای استخراج پروتئین استفاده میشود.
- رسوبگذاری: برای جدا کردن پروتئین از سایر اجزای سلول ، مخلوط ایجاد شده از لیز کردن سلول سانتریفوژ میشود. پس از سانتریفوژ تمام اجزای سلول به جز پروتئینها رسوب میکند.
- جداسازی پروتئین هدف: در این مرحله پروتئین هدف بر اساس ساختار شیمیایی و ویژگیهای فیزیکی با روش کروماتوگرافی یا روشهای مغناطیسی از سایر پروتئینهای سلول جدا میشود.
سوالات متدوال تولید پروتئین
در این بخش از مطلب مجله فرادرس به تعدادی از سوالات متداول پیرامون تولید پروتئین پاسخ میدهیم.
تولید پروتئین در کدام بخش سلول انجام میشود؟
در پروکاریوتها رونویسی DNA، ترجمه mRNA به پروتئین، تغییرات پس از رونویسی و تغییرات پس از ترجمه در سیتوپلاسم انجام میشود. اما در یوکاریوتها رونویسی و تغییرات پس از رونویسی در هسته و ترجمه در سیتوپلاسم و تغییرات پس از ترجمه در شبکه اندوپلاسمی و دستگاه گلژی انجام میشود.
مراحل تولید پروتئین در سلول چیست؟
رونویسی و ترجمه دو مرحله اصلی تولید پروتئین در پروکاریوتها و یوکاریوتها است. در رونویسی یک نسخه mRNA از DNA تولید میشود و در ترجمه کدونهای mRNA به توالی آمینواسیدهای پروتئین ترجمه میشوند.