رزونانس در شیمی — به زبان ساده

با استفاده از ساختار لوویس میتوان الکترونها و پیوندهای آنها در مولکول را نشان داد. گرچه برای برخی از مولکولها، تمامی پیوندهای محتمل در یک مولکول را نمیتوان با یک ساختار لوویسِ تنها نشان داد. این مولکولها، دارای چندین ساختار یا رزونانس هستند. رزونانس در شیمی برای توصیف الکترونهای آزاد در یک مولکول بکار میرود که سبب میشوند در مولکولی خاص، چندین ساختار مختلف در توضیح پیوندها داشته باشیم.
در تعریفی دیگر، رزونانس در شیمی راهی برای توضیح پیوندها در برخی از مولکولها یا یونها است. این کار با ترکیب چندین ساختار دخیل در مولکول موسوم به «ساختار رزونانس» (Resonance Structure) و تبدیل آن به یک «هیبرید رزونانس» (Hybride Resonance) انجام میگیرد.
مقدمه
در چارچوب «نظریه پیوندهای ظرفیت» (Valence Bond Theory)، رزونانس، نگاهی است که بیان میکند پیوندها در ذرات شیمیایی را میتوان با یک ساختار لوویس نشان داد. برای بسیاری از ذرات شیمیایی، یک ساختار لوویس تنها برای توصیف پیوندهای شیمیایی و مقادیر اندازهگیری شده خواص مولکولی همچون طول پیوند، زاویه پیوند و «ممان دوقطبی» (Dipole Moment) کفایت میکند. در برخی موارد، بیش از یک ساختار لوویس را میتوان برای یک مولکول رسم کرد و خواص مولکولی نیز تنها با یک ساختار، سازگار نیست.
برای توصیف این شرایط، چندین ساختار را به طور متوسط در نظر میگیرند و مولکول را به صورت هیبرید رزونانس توصیف میکنند که در آن، چندین ساختار لوویس برای توصیف ساختار حقیقی مولکول بکار رفته است.
به طور مثال، در یون نیتریت ، طول دو پیوند با یکدیگر برابرند. ساختار این یون را میتوان به صورت یک ساختار رزونانس و به صورت تصویر زیر نشان داد. این نوع از نمایش، دو پیوند با طول یکسان دارد که این طول، مقداری بین پیوند یگانه در مولکولی مانند با طول و پیوند دوگانه در با طول دارد. بر اساس این نوع از ساختارهای دخیل در مولکول، هر پیوند ، مقدار متوسطی از یک پیوند دوگانه و یک پیوند یگانه است و سبب ایجاد مرتبه پیوند برابر با 1/5 میشود. در نتیجه این نوع از متوسطگیری، ساختار لوییس حاصل در نیتریت با مقادیر اندازهگیری شده طول پیوند مطابقت پیدا میکند.

همانطور که پیشتر نیز توضیح داده شد، هیبرید روزنانس، مولکول حقیقی را به صورت متوسطی از ساختارهای دخیل، طول پیوند و بارهای جزئی نشان میدهد. لازم به ذکر است که هرکدام از ساختارها، تنها در نوع اختصاص الکترونها به اتمها متفاوت هستند و در چگالی و اسپین حقیقی الکترونها تفاوتی ندارند. با این وجود، ساختارهای دخیل، در مرتبه پیوند و بار قراردادی ممکن است تفاوت داشته باشند، اما تمامی این ساختارها در نوع اسپین و تعداد الکترون لایه ظرفیت برابر هستند.
انرژی رزونانس در شیمی
از آنجایی که الکترونهای آزاد، انرژی پتانسیل یک سیستم را کاهش میدهند، هر ذرهای که به صورت هیبرید رزونانس نمایش داده شود، پایدارتر از هر نوع ساختار دیگر است. اختلاف در انرژی پتانسیل بین ذرات حقیقی و مقدار محاسبه شده آن در ساختار دخیل با کمترین انرژی پتانسیل را انرژی رزونانس مینامند.
رزونانس در شیمی و ایزومری شدن
رزونانس را باید با ایزومری شدن، متفاوت دانست. ایزومرها، مولکولهایی با فرمول شیمیایی یکسان و آرایش اتمی مختلف هستند اما رزونانس در یک مولکول، تنها در نحوه اختصاص دادن الکترونها به اتم در ساختار لوویس تفاوت دارد.
به طور خاص، زمانی که مولکولی را با ساختار رزونانس هیبرید نشان میدهیم، به این معنی نیست که الکترونها در مولکول در حال رزونانس کردن یا نوسان در حالات مختلف هستند، بلکه بیانگر این است که ساختارهای دخیل، نوعی از ساختار واسط با هندسه و توزیع الکترونی دقیق را نشان میدهند.
این تصور اشتباه است که هیبرید رزونانس را به صورت ایزومرهایی در نظر بگیریم که به سرعت در حال تبدیل شدن به یکدیگر هستند. در حقیقت، عبارت رزونانس، به عنوان تمثیلی از فیزیک کلاسیک برای پدیده مکانیک کوانتومی است و در نتیجه، نمیتوان آنرا دقیقا با معنی لغوی آن برابر گرفت. لازم به ذکر است که به طور نمادین، از یک فلش دو طرفه به صورت برای بیان دو ساختار دخیل در یک ذره شیمیایی استفاده میکنیم.
به دلیل اشتباهاتی که ممکن از در اثر استفاده از واژه رزونانس پیش بیاید، نام ساختار رزونانس به «ساختار دخیل» (Contributing Structure) و رزونانس هیبرید به «ساختار هیبرید» (Hybrid Structure) تغییر پیدا کرد و به جای استفاده از فلش دو طرفه، از ویرگول استفاده میشود.
نمایش رزونانس در شیمی به صورت دیاگرام
در دیاگرامها، ساختارهای دخیل را به صورت فلش دو طرفه نشان میدهند. دقت کنید تا این فلش، با فلش دو طرفه در واکنشهای تعادلی شیمیایی اشتباه گرفته نشود. تمامی ساختارها را در یک کروشه بزرگ قرار میدهیم تا از این طریق، تصویر یک مولکول یا یون تنها را به طور کامل نشان دهیم.
به جای استفاده از ساختارهای دخیل در دیاگرامها، میتوان از یک ساختار هیبرید استفاده کرد. در یک ساختار هیبرید، پیوندهای پای در رزونانس را به صورت فلشهای خمیده یا خطچین نشان میدهند. چنین نمایشی بیان میکند که این نوع از پیوندها به صورت جزئی حضور دارند و نه به صورت پیوند کامل پای. در بنزن و سایر حلقههای آروماتیکی، الکترونهای آزاد پای را به صورت یک دایره نمایش میدهند:
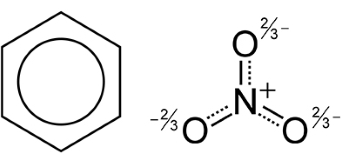
در مثال زیر، سه ساختار رزونانس در پروپان نشان داده شده که مهمترین آن، ساختار (I) خواهد بود چراکه قاعده اکتت به طور کامل در خصوص اتم اکسیژن و تمامی اتمهای کربن رعایت شده است. ساختار (II) مهمتر از (III) محسوب میشود زیرا بارهای الکتریکی در ساختار (II) مطابق با الکترونگاتیوی بیشتر اکسیژن نسبت به کربن توزیع شدهاند.
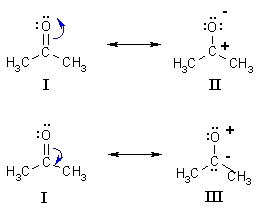
در مثالی دیگر، چهار ساختار رزونانس از نشان داده شده است. در میان این ساختارها، ساختار رزونانس (IV) از بقیه مهمتر است زیرا هیچ بار قراردادی به هیچ اتمی اختصاص ندارد. در مرحله بعد، ساختارهای (I) و (III) قرار دارند. قاعده اکتت در تمامی اتمها رعایت شده است اما دو اتم دارای بار قراردادی هستند. این نوع از ساختارها، از آن جهت اهمیت دارند زیرا میتوانند واکنشپذیری با «هستهدوستها» (Nucleophiles) و «الکتروندوستها» را توضیح دهد.
بررسی ساختارهای رزونانس در مولکولهای مختلف
در ادامه سعی داریم تا با بررسی چند مثال، ساختارهای رزونانس را در مولکولهای مختلف از جمله مولکولهای آروماتیک بررسی کنیم.
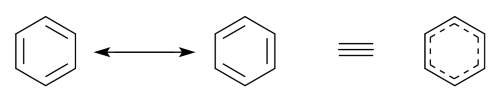
ساختار رزونانسی بنزن
در بنزن، از دو ساختار که توسط «آوگوست ککوله» (August Kekulé) پیشنهاد شد، برای نمایش ساختار کلی استفاده میشود. ساختار هیبرید در سمت راست، به کمک خطچین، با پیوندهای دوگانه در سمت چپ جایگزین شده است.
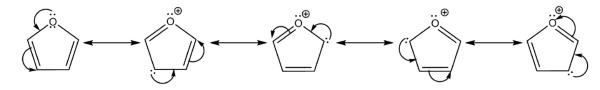
ساختار رزونانسی فوران
در مولکول «فوران» (Furan)، جفتالکترون اتم اکسیژن با اوربیتالهای پای در اتمهای کربن برهمکنش انجام میدهند و ساختارهای دخیل متفاوتی همچون تصویر زیر بوجود میآیند.
مولکولهای غنی از الکترون
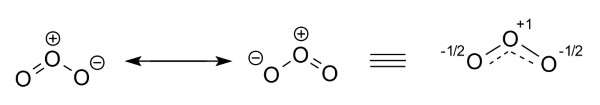
مولکول اوزون را با دو ساختار متفاوت نشان میدهند. در واقعیت، اتمهای اکسیژن در دو سر مولکول با یکدیگر همارز هستند و ساختار رزونانس را میتوان به صورت شکل سمت راست با بار روی هر دو اتم اکسیژن به همراه خطچین و مرتبه پیوند 1/5 نشان داد.
مولکولهایی با تعداد کم از الکترون
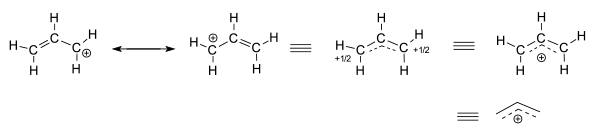
عبارت «فقدان الکترون» (Electron Deficiency) برای توصیف اتمها یا مولکولهایی به کار میرود که تعداد کمتری از الکترون مورد نیاز برای پایداری را در اختیار دارند. به طور مثال میتوان به کاتیون «آلیل» (Allyl) اشاره کرد. این کاتیون، دارای ساختارهای رزونانس متفاوتی به شکل زیر است:
رسم ساختار رزونانس
به هنگام رسم ساختار رزونانس در شیمی باید به یاد داشته باشید که تنها الکترونها را میتوانید جابجا کنید و اتمها باید در مکان ثابتی قرار بگیرند. در برخی موارد، ساختارهای رزونانس، شامل بارها مثبت و منفی بر روی برخی از اتمها هستند. از آنجایی که اتمها با بار الکتریکی، پایداری کمتری نسبت به اتمهای بدون بار دارند، این نوع از ساختارها، نسبت به ساختارهای بدون بار، کمتر مورد استفاده قرار میگیرند. در آموزشهای بعدی مجله فرادرس، به طور دقیقتری به رسم ساختار رزونانس خواهیم پرداخت.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش مدلسازی انواع ساختار مولکولی با HyperChem (هایپرکم)
- شکل مولکول — به زبان ساده
- تعادل شیمیایی — از صفر تا صد
^^












من در باره رزونانس معلومات به دست آوردم اما منبع شان را نمی دانم که در کدام کتاب ها زکر شده است
سلام میشه این عبارت رو توضیح بدید؟
(به علت پدیده رزونانس یا پیوستگی ابر الکترونی بنزن تمایلی به شرکت در واکنش های افزایشی ندارد)
سلام.. ممنون از مطالب خوبتون
ساختار رزونانسی N3 و No2رامیشه رسم کنید
باسلام؛
به کمک مطلب «رسم ساختار رزونانس — به زبان ساده» میتوانید با نحوه رسم ساختارهای مختلف رزونانس آشنا شوید.
با تشکر از همراهی شما با مجله فرادرس
سلام. ببخشید یک جا شنیده بودم مولکول های دارای رزونانس پایدار ترند. ولی اگر اوزون رزونانس باشد ولی کربن دی اکسید نباشد آیا اوزون پایدار تر است؟
با سلام؛
این دو مولکول با یکدیگر متفاوت هستند و البته نمیتوان گفت که دیاکسید کربن رزونانس یا غیررزونانس داریم. همانطور که در ابتدای مطلب هم ذکر شده است، از رزونانس زمانی که استفاده میکنیم که مولکولهایی داشته باشیم و نتوانیم آنها را تنها با یک ساختار لوویس مشخص کنیم. برای آشنایی بیشتر پیشنهاد میکنیم مطلب «رسم ساختار رزونانس — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سوال دیگری خدمتتون داشتم منظور از پایدار بودن ساختار های هیبرید که همون سطح انرژی پایین تره دقیقا چیه؟یعنی چگونه سطح انرژی پایین میاد میشه اینو دقیق و کامل توضیح بدید ممنون . ????
با سلام؛
زمانی که الکترونها خاصیت «پخشی» (Delocalization) داشته باشند یعنی به خوبی بین دو اتم پخش شوند، به طور طبیعی سطح انرژی پایینتری خواهیم داشت که به آن، پایداری رزونانسی میگویند.
با تشکر
سلام . سوالی داشتم خدمتتون:الان ساختار های رزونانسی که اتم غیر اکتد دارند یا باردار نسبت به ساختار های رزونانس دیگه احتمال حضورشون کمتره؟ مثلا ساختار so2 اغلب بدون بار و اکتد هست ولی میتونه بار دار هم باشه ولی شانس و زمانش کمتره و اگه اینگونه است برای اینگونه مولکول ها توی ساختار هیبرید دیگه توزیع بار و خط چین استفاده نمیکنیم چون یک فرم غالبه درسته ؟
با سلام؛
از همراهی شما با مچله فرادرس سپاسگزاریم. پیشنهاد میکنیم برای آشنایی بیشتر با ساختارهای رزونانس، مطلب «رسم ساختار رزونانس — به زبان ساده» را مطالعه کنید.