سینتیک شیمیایی – به زبان ساده
سینتیک شیمیایی از جمله موضوعات مهم در شیمی فیزیک به شمار میآید و به دانشآموزان و دانشجویان در فهم جنبههای مختلف یک واکنش شیمیایی کمک میکند. به طور خاص، واژه «سینتیک» (Kinetics) به نرخ تغییر یک کمیت اشاره دارد. به طور مثال، آهنگ تغییر جابجایی را به شکل سرعت بیان میکنند و به طور مشابه، شتاب، آهنگ تغییر سرعت است. به طور معمول، بر اساس این سرعت، واکنشهای شیمیایی را میتوان به واکنشهایی سریع مانند واکنش سدیم و آب، واکنشی با سرعت متوسط همچون واکنش منیزیم و آب و واکنشهای آهسته مانند واکنش استریفیکاسیون (استری شدن) تقسیم کرد. در این مطلب به شکلی ساده به سینتیک شیمیایی خواهیم پرداخت و روشهای اندازهگیری سرعت واکنش و عوامل موثر بر آنرا بیان میکنیم.

سینتیک شیمیایی چیست؟
سینتیک شیمیایی یا سینتیک واکنشهای شیمیایی به ما در درک سرعت واکنشهای شیمیایی و تاثیر عوامل مختلف بر این سرعت کمک میکند. علاوه بر این، سینتیک شیمیایی در تجزیه اطلاعات مرتبط با مکانیسم واکنشهای شیمیایی و تعریف مشخصههای واکنش شیمیایی تاثیر بسیار زیادی دارد.
سرعت فرآوردهها و واکنش دهندهها
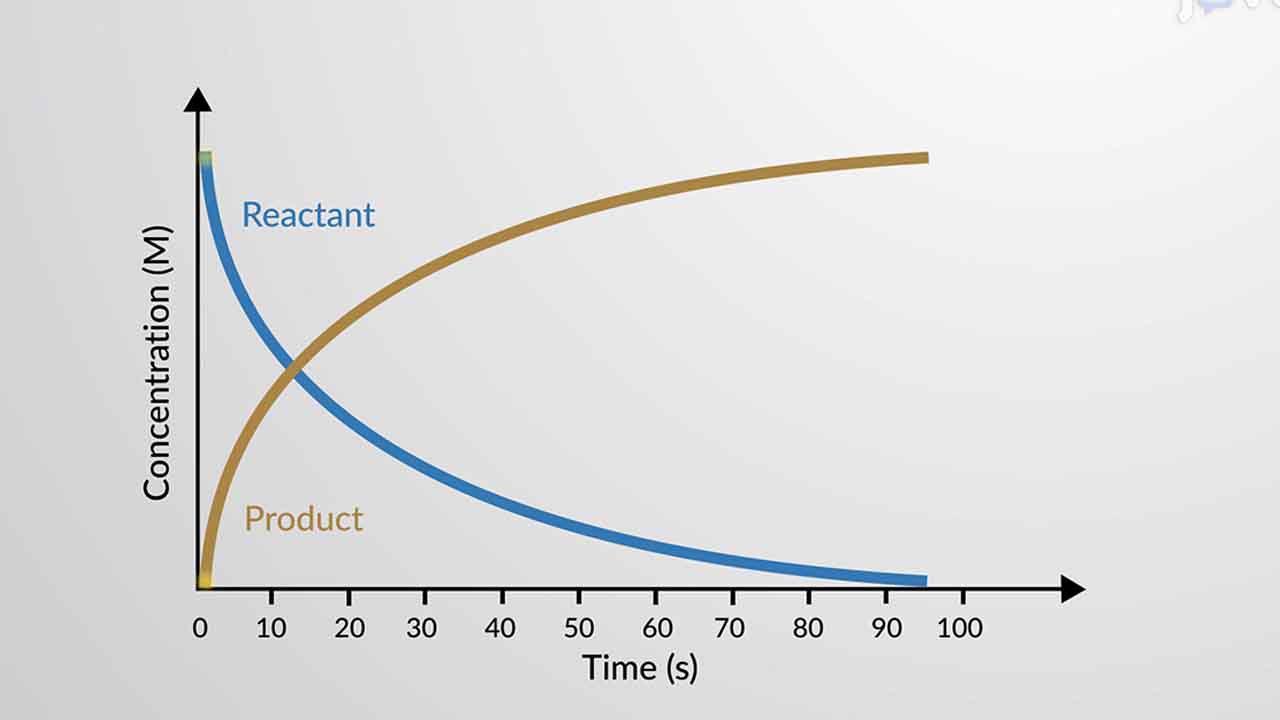
در بیشتر واکنشهای شیمیایی، با پیشرفت واکنش، مقدار واکنشدهندهها کاهش و میزان فرآوردهها افزایش پیدا میکنند. اگر بخواهیم درکی از سرعت واکنش داشته باشیم باید سرعت مصرف واکنشدهندهها و سرعت تولید فرآوردهها را در نظر بگیریم.
اگر نموداری رسم کنیم که غلظت فرآوردهها و واکنشدهندهها را بر حسب زمان نشان دهد، به راحتی میتوان از طریق شیب نمودارها حاصل، سرعت تشکیل فرآوردهها و مصرف واکنشدهندهها را محاسبه کرد.
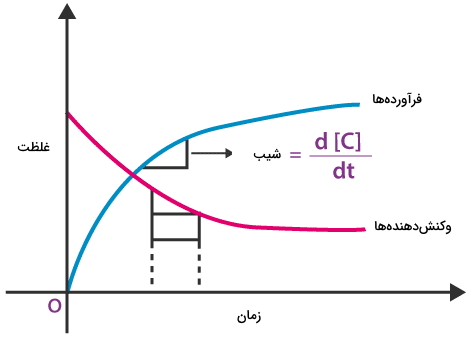
به کمک نمودار درمییابیم که شیب نمودارِ مربوط به واکنشدهندهها منفی و شیب نمودار فرآوردهها مثبت است. این شیبها به ترتیب بیانگر غلظت واکنشدهندهها و فرآوردهها هستند. برای اینکه با نحوه ارتباط سرعت واکنش کلی، سرعت مصرف واکنشدهندهها و سرعت تولید فرآوردهها آشنا شویم از مثالی ساده کمک میگیریم. واکنش هیدروژن و اکسیژن را در تشکیل مولکول آب در نظر بگیرید.
به کمک معادله موازنه شده بالا درمییابیم که به ازای هر یک مول گاز اکسیژن مصرفی، ۲ مول گاز هیدروژن به مصرف میرسد و ۲ مول آب تولید خواهد شد. اگر فرض کنیم که این واکنش در مدت زمان ۱۰ دقیقه به انجام برسد و مخلوط واکنش، شامل ۱ مول از گازهای هیدروژن و اکسیژن باشد. اگر بعد از ۱۰ دقیقه، نیم مول هیدروژن مصرف شده باشد، بر اساس استوکیومتری واکنش، 0/25 مول اکسیژن نیز مصرف خواهد شد و ۰/5 مول آب تولید میشود. حال میخواهیم سرعتهای مربوط به هیدروژن، اکسیژن و آب را محاسبه کنیم.
سرعت مصرف گاز هیدروژن:
سرعت مصرف گاز اکسیژن:
سرعت تشکیل مولکول آب:
به کمک محاسبات بالا میبینیم که سرعت مصرف گاز هیدروژن دو برابر سرعت مصرف گاز اکسیژن است. با توجه به محاسبات بالا میتوان از استوکیومتری واکنش برای مرتبط کردن سرعت مصرف و تولید مواد در واکنش شیمیایی استفاده کرد. واکنش زیر را در نظر بگیرید:
سرعت واکنش را در سینتیک شیمیایی میتوان به صورت زیر تعریف کرد.
در رابطه بالا، بیانگر تغییر در غلظتها است. در نتیجه، سرعت واکنش کلی را میتوان به صورت زیر تعریف کرد:
ضریب استوکیومتری جزء مورد نظر / سرعت تشکیل یا حذف هر جزء = سرعت کلی واکنش

سرعت متوسط و لحظهای
سرعت واکنش را در سینتیک شیمیایی میتوان بسته به مقدار زمان، به سرعتهای متوسط و لحظهای تقسیمبندی کرد. اگر زمان در نظر گرفته شده، زمانی محدود باشد، به آن سرعت متوسط گفته میشود که رابطه آن به صورت زیر خواهد بود.
در رابطه بالا:
- : تغییرات غلظت
- : تغییرات زمان
- : سرعت متوسط
در بسیاری از موارد، سرعت متوسط نمیتواند اطلاعات دقیقی در رابطه با تکمیل یک واکنش در اختیار ما قرار دهد. به طور مثال، هیدرولیز را برای استرها بمنظور تشکیل اسید و الکل را در نظر بگیرید.
فرض کنید که در زمان صفر، محلول ۱ مولار از استر داشتیم که در مدت زمان ۳۰ دقیقه به 0/5 مولار رسیده است. در نتیجه، منطقی است که فرض کنیم این واکنش در مدت زمان یک ساعت به طور کامل به انجام میرسد. اما در واقعیت، چنین واکنشی برای تکمیل شدن به ۳ ساعت زمان نیاز دارد.
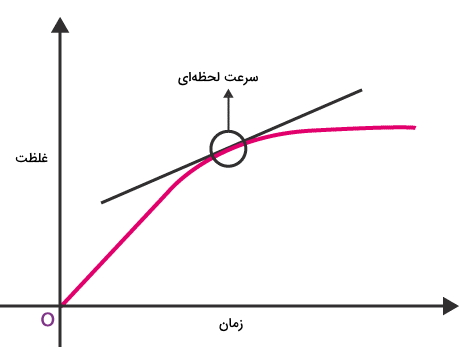
در نتیجه برای اینکه دیدگاه بهتری نسبت به زمان تکمیل یک واکنش داشته باشیم از مفهوم سرعت لحظهای در سینتیک شیمیایی کمک میگیریم. سرعت لحظهای را به صورت زیر تعریف میکنیم.
با توجه به معادله بالا میتوان دریافت که زمان را به صورت دیفرانسیلی یعنی به مقدار بسیار کم در نظر گرفتهایم به گونهای که این زمان به صفر میل میکند. اما به طور عملی، سرعت لحظهای را میتوان در هر لحظه از واکنش، به کمک رسم شیب خط نمودار غلظت-زمان در آن لحظه مورد نظر بدست آورد که در تصویر زیر به آن اشاره شده است.
واحد سرعت به صورت بیان میشود چراکه غلظت بر حسب مولاریته در نظر گرفته شده است. البته بسته به واحدهای مختلف زمان میتوان واحد سرعت را در سینتیک شیمیایی به شکلهای دیگری بیان کرد. پیشنهاد میکنیم برای درک بهتر این فرمول و مفهوم آن، مطلب جمع بندی فصل دوم شیمی یازدهم را مطالعه کنید.
عوامل موثر بر سرعت واکنش
به هنگام بررسی سینتیک شیمیایی باید به عوامل موثر در تغییر سرعت یک واکنش شیمیایی اشاره کرد. این عوامل در زیر آمدهاند که در ادامه متن به بررسی هریک از آنها خواهیم پرداخت.
غلظت واکنش دهندهها
بر اساس نظریه برخورد، مولکولهای واکنشدهنده برای تشکیل فرآورده باید با یکدیگر برخورد داشته باشند. اگر غلظت واکنشدهندهها افزایش پیدا کند، تعداد برخوردها نیز افزایش مییابند که همین امر، سرعت واکنش را افزایش میدهد.
دما
با افزایش دما، فرکانس برخورد یعنی تعداد برخوردها بین مولکولهای واکنشدهنده در هر ثانیه افزایش مییابد و در نتیجه این افزایش، سرعت واکنش نیز بیشتر میشود. البته بسته به گرماگیر یا گرماده بودن واکنش، افزایش دما میتواند موجب افزایش سرعت در مسیر رفت یا برگشت واکنش شود.
در سیستمی که امکان وقوع بیش از یک واکنش وجود داشته باشد، واکنشدهندهها میتوانند تحت دماهای مختلف، فرآوردههای مختلفی را تولید کنند. به طور مثال، در حضور سولفوریک اسید رقیق و در دمای ۱۰۰ درجه سانتیگراد، دیاتیل اتر از اتانول تولید میشود که واکنش آن را در زیر مشاهده میکنید.
اما در صورتیکه دمای واکنش برابر با ۱۸۰ درجه سانتیگراد باشد، در حضور سولفوریک اسید رقیق، اتیلن فرآورده اصلی خواهد بود.
فاز و سطح واکنش دهندهها
زمانی که واکنشدهندهها در فاز مایع قرار داشته باشند، ذرات آنها برخوردهای بیشتری نسبت به فاز جامد یا مخلوطهای ناهمگن دارند. در محیطی ناهمگن، برخورد بین ذارت در سطح تماس فازها رخ میدهد که در مقایسه با حالت همگن، تعداد برخوردها در واحد زمان بین ذرات واکنشدهنده به شدت کاهش مییابند و در نتیجه، سرعت نیز کاهش پیدا میکند.

اثر حلال
طبیعت حلال نیز به سرعت واکنش ذرات حلشونده ارتباط دارد که برای درک بهتر این موضوع، مثالی را در ادامه بررسی میکنیم. زمانی که سدیم استات با متیل یدید واکنش میدهد، فرآوردههای حاصل، متیل استات و سدیم یدید خواهند بود.
واکنش بالا را اگر در حلالی آلی مانند دیمتیل فرمامید (DMF) انجام دهیم، سرعت بیشتری نسبت به متانول خواهد داشت زیرا متانول میتواند با تشکیل پیوند هیدروژنی دهد اما چنین پیوندی در DMF امکانپذیر نیست.
کاتالیست
در بررسی سینتیک شیمیایی میتوان کاتالیزگر را نیز به عنوان عامل تغییر سرعت واکنش در نظر گرفت. کاتالیزورها با تغییر مکانیسم واکنش، سرعت واکنش را تغییر میدهند. توجه داشته باشید که برخوردها زمانی به انجام یک واکنش منتج میشوند که انرژی لازم برای انجام واکنش یعنی انرژی فعالسازی تامین شود. اضافه کردن یک کاتالیزور به واکنش سبب کاهش انرژی فعالسازی و در نتیجه، افزایش سرعت انجام واکنش میشود.
مثال
در واکنش زیر، سرعت مصرف گاز نیتروژن برابر با است. سرعت مصرف گاز هیدروژن، سرعت تشکیل آمونیاک و سرعت کلی واکنش را محاسبه کنید.
سرعتها را میتوان به کمک رابطه زیر به یکدیگر مرتبط کرد:
در صورت سوال داریم:
در نتیجه سرعت کلی واکنش نیز به صورت تعریف میشود. با بازآرایی رابطه سرعت کل، میتوان سرعت مصرف گاز هیدروژن را نیز به شکل زیر بدست آورد:
همچنین، سرعت تشکیل فرآورده نیز به صورت محاسبه خواهد شد:
فشار
افزایش فشار واکنشهای گازی سبب افزایش تعداد برخوردها بین ذرات واکنشدهنده و به دنبال آن، افزایش سرعت واکنش خواهد شد. دلیل این امر، نسبت مستقیم اکتیویته گاز با فشار بخار آن است و میتوان آنرا مشابه با افزایش غلظت یک محلول در نظر گرفت. علاوه بر این اثر، ضرایب سرعت نیز به دلیل فشار ممکن است تغییر کنند. اگر گازی بیاثر به مخلوط واکنش وارد شود، در دماهای بسیار بالا، ضرایب سرعت تغییر میکنند.
جذب نور
زمانی که یک مولکول واکنشدهنده، نوری با طول موج مناسب را جذب کند و به حالت برانگیخته برسد نیز انرژی فعالسازی واکنش تامین میشود که از نمونههای این نوع از واکنشهای فوتوشیمیایی میتوان به فوتوسنتز اشاره کرد.
معرفی فیلم آموزش شیمی عمومی
سینتیک شیمیایی از جمله مباحث اصلی در شیمی عمومی به شمار میرود و هم در دوره متوسطه و هم در دانشگاه به عنوان دروس پایهای به آن نگاه میشود. به همین منظور، «فرادرس» دوره آموزشی را در ۱۴ درس و بیش از ۸ ساعت تدوین کرده است که در ادامه به توضیح درسهای آن خواهیم پرداخت.
درس اول این آموزش به ساختار اتم اختصاص دارد و از جمله دروس مهم آن میتوان به ایزوتوپها، انرژی یونش، الکترونخواهی و الکترونگاتیوی اشاره کرد. در درس دوم پیوندهای شیمیایی از جمله پیوندهای یونی، کووالانسی و فلزی مورد بررسی قرار میگیرند و قاعده هشتتایی نیز در همین درس بررسی خواهد شد. ساختار هندسی مولکولها و مباحثی همچون ممان دوقطبی و هیبریداسیون در درس سوم بررسی میشوند. رفتار گازها و معادلات مربوط به گاز کامل و گازهای واقعی از مباحث مهم درس چهارم به شمار میآیند.
درس پنجم از این آموزش به فازهای مایع و جامد اختصاص دارد و محلولها در درس ششم بررسی میشوند. مباحث مربوط به ترمودینامیک از جمله قانون هس و قوانین ترمودینامیک در درس هفتم مرور خواهند شد. درس هشتم به طور ویژه به سینتیک شیمیایی میپردازد و انواع واکنشهای درجه ۱ و ۲ و قوانین دیفرانسیلی سرعت در این درس مطرح میشوند. انواع شناساگرهای اسید و باز و همچنین مباحث مربوط به اسید و باز از جمله اسیدهای قوی در درس نهم آموزش داده خواهند شد. درس دهم به تعادلهای آبی اشاره دارد و از مباحث مهم این درس باید به تیتراسیون و محلولهای بافر اشاره کرد.
از جمله مباحث مهم در شیمی، الکتروشیمی است که درس یازدهم این آموزش را شامل میشود انواع پیلهای گالوانی، سلولهای الکترولیتی و همچنین پتانسیل استاندارد الکترود در این درس مورد بررسی قرار میگیرند. روندهای تناوبی و آشنایی با هالوژنها و گازهای نجیب، سرفصلهای مهم در درس دوازدهم آموزش شیمی عمومی هستند و درس سیزدهم و چهاردهم نیز به شیمی فلزات از جمله فلزات قلیایی، واسطه و قلیایی خاکی اختصاص دارد. ساختارهای ایزومری همچون ایزومرهای فضایی و نامگذاری آنها نیز در درس چهاردم بررسی خواهند شد.

سوالات متداول مربوط به سینتیک شیمیایی
در ادامه متن به برخی سوالات متداول پیرامون سینتیک شیمیایی و سرعت واکنش میپردازیم.
تفاوت بین سینتیک شیمیایی یک واکنش با معادله موازنه شده در چیست؟
سینتیک شیمیایی یک واکنش اطلاعاتی در رابطه با مکانیسم و سرعت واکنش در اختیار ما قرار میدهد اما یک معادله موازنه شده، اطلاعات مربوط به استوکیومتری واکنش را ارائه میدهد. البته توجه داشته باشید که برای حل روابط مربوط به سرعت واکنش، به معادله موازنه شده نیاز داریم. البته در این خصوص میتوانید مطالب زیر را نیز مطالعه کنید.
چرا با افزایش دما، سرعت واکنش نیز افزایش مییابد؟
با افزایش دمای واکنش، انرژی جنبشی یونها و مولکولها به دلیل افزایش برخورد این ذرات افزایش مییابد و این افزایش برخورد نیز افزایش سرعت واکنش را به همراه دارد.
ارتباط سینتیک شیمیایی و تعادل شیمیایی در چیست؟
با وجود اینکه سینتیک شیمیایی به سرعت یک واکنش شیمیایی میپردازد اما علم ترمودینامیک، مقدار آنرا برای انجام واکنش تعیین میکند. در یک واکنش برگشتپذیر، زمانیکه سرعت واکنشهای رفت و برگشت برابر شوند، تعادل شیمیایی برقرار میشود.