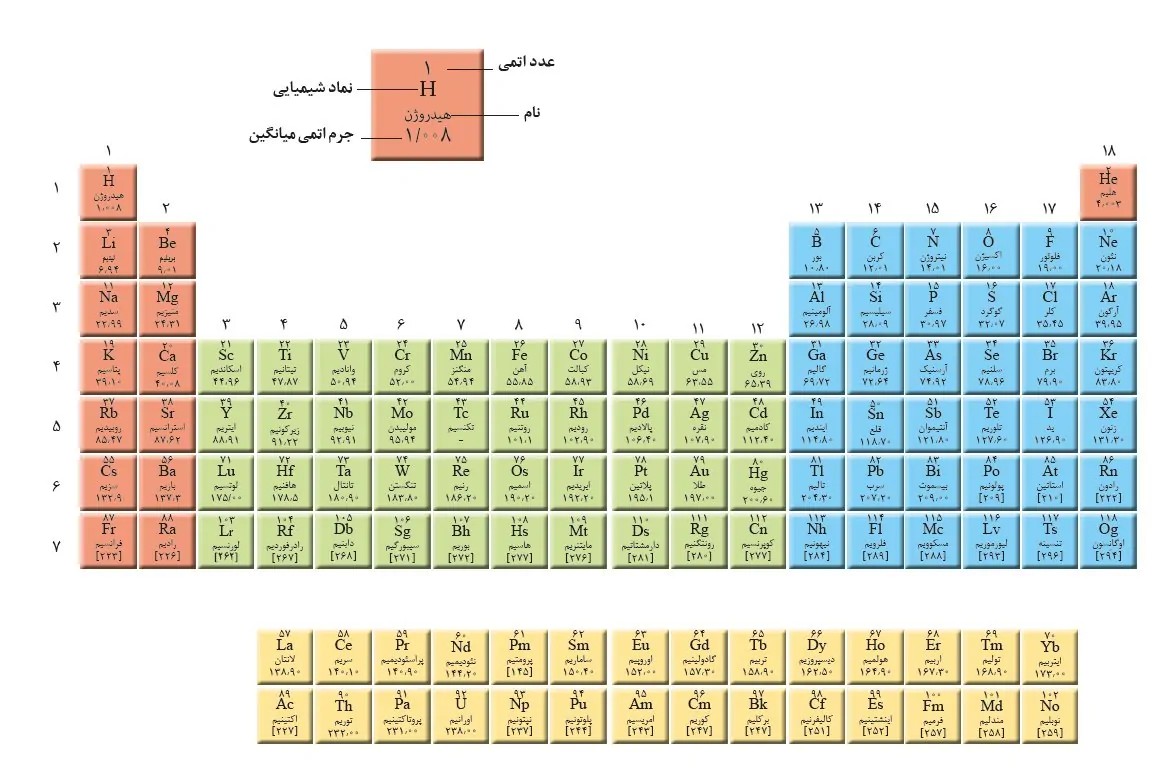
جدول تناوبی چیست؟ — به زبان ساده و کامل + PDF و عکس فارسی

جدول تناوبی عناصر در شیمی، جدولی است که در آن، عنصرها بر اساس افزایش عدد اتمی مرتب شدهاند. با چینش این عناصر به ترتیبی که گفته شد، عنصرها در هر ستون، دارای خواص یکسانی هستند. به این الگوی تکراری، «قانون تناوب» (Periodic Law) یا قانون دوره ای عنصرها میگویند. در اواسط قرن نوزدهم، تلاشهای اولیه برای کشف این پدیده، توسط دمیتری مندلیف انجام شد. کشف او نتایج ارزشمندی در توسعه علم شیمی داشت.
تا قرن بیستم، چینش عناصر بر اساس عدد اتمی کشف نشده بود. در اوایل قرن بیستم بود که توضیحاتی در خصوص قانون تناوب بر اساس ساختار الکترونی اتمها و مولکولها ارائه شد. این پیشرفتها سبب بهبود قانون تناوب شد که امروزه همچون قرن بیستم از آن استفاده میشود.
لازم به ذکر است که «فایل PDF جدول تناوبی عناصر» (تقلبنامه جدول تناوبی عناصر) را نیز میتوانید به طور جداگانه از لینک پایین دانلود و مطالعه کنید. این تقلبنامه شامل اطلاعات در خصوص روندهای تناوبی همچون الکترونگاتیوی، شعاع اتمی، جرم اتمی، انرژی یونش و الکترونخواهی است. علاوه بر این، اگر میخواهید با اصلیترین روشها در حفظ کردن جدول تناوبی آشنا شوید، میتوانید مطلب «روشهای کاربردی حفظ کردن جدول تناوبی — به زبان ساده» را در این لینک، مطالعه کنید. همچنین، جهت آشنایی با گروههای جدول تناوبی، مطلبی با عنوان «گروه های جدول تناوبی — از صفر تا صد» از مجله فرادرس تدوین شده است که در این لینک به آن دسترسی خواهید داشت. به هنگام مطالعه این مطلب، با اسم فارسی عناصر جدول تناوبی نیز آشنایی پیدا میکنید.
مقدمه
در اوایل قرن نوزدهم، «شیمی تحلیلی» (Analytical Chemistry) یا شیمی تجزیه، به پیشرفتهای بزرگی دست پیدا کرد. در حقیقت این علم، هنر تشخیص مواد شیمیایی از یکدیگر بود که به تبع آن سبب پیشرفت دانش در زمینههای خواص فیزیکی و شیمیایی عناصر و ترکیبات شد. این پیشرفت، لزوم در نظر گرفتن علم طبقهبندی را در شیمی بیشتر کرد. با طبقهبندی، نه تنها مقالات شیمی، که دانش آزمایشگاهی آن هم میتوانست به صورت یک دانش رو به رشد، از نسلی به نسل دیگر انتقال پیدا کند. در گذشته ارتباط بین ترکیبات شیمیایی بهتر از ارتباط بین عناصر درک میشد. این امر سبب شد تا طبقهبندی بر اساس عناصر، در پسزمینه ترکیبات شیمیایی قرار بگیرد. علاوه بر این، نزدیک به نیم قرن، هیچ اتقاق نظری هم بین دانشمندان برای طبقهبندی بر اساس عناصر وجود نداشت.
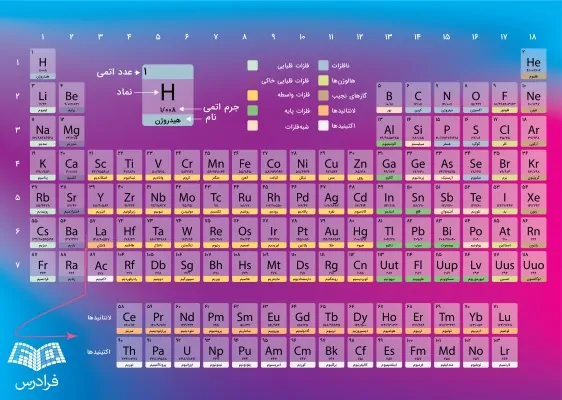
دانلود عکس جدول تناوبی فارسی
با کلیک بر روی تصویر زیر میتوانید عکس جدول تناوبی فارسی را با کیفیت بالا دانلود کنید.
دانلود PDF جدول تناوبی فارسی
فایل PDF جدول تناوبی فارسی به همراه تقلبنامه جدول تناوبی از لینکهای زیر قابل دانلود هستند. برای دانلود این فایلها، روی آنها کلیک کنید.
- دانلود PDF جدول تناوبی عناصر (تقلبنامه جدول تناوبی عناصر)
- دانلود فایل PDF جدول تناوبی فارسی به همراه اسم فارسی عناصر
- دانلود عکس سیاه و سفید جدول تناوبی فارسی برای پرینت سیاه و سفید
اولین طبقهبندیهای عناصر
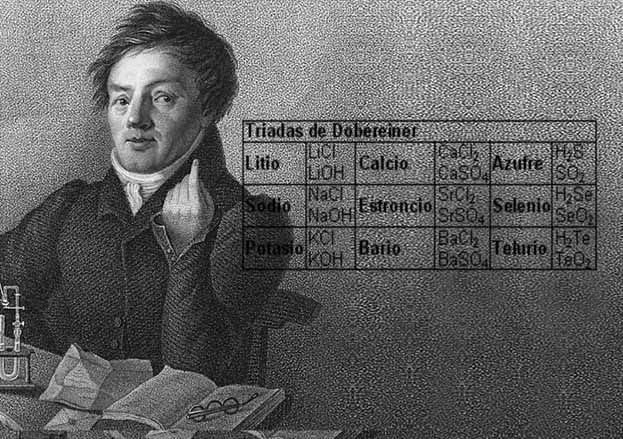
در سال 1817، دوبراینر (J.W. Döbereiner)، نشان داد که جرم اتمی استرانسیوم در بین کلسیم و باریم قرار دارد. او این ترکیبات را «سهگانه» (Triads) نامید و بعدها سهگانههای دیگری همچون کلر، بور، ید و لیتیم، سدیم و پتاسیم به آن اضافه شدند. بین سالهای 1827 تا 1858، دانشمندان نشان دادند که این شباهتها بیش از یک سهگانه است. فلوئور به هالوژنها اضافه شد و منیزیم به فلزات قلیایی خاکی. اکسیژن، گوگرد، سلنیوم و تلوریوم هم به یک خانواده از عنصرها اضافه شدند. نیتروژن، فسفر، آرسنیک، آنتیموان و بیسموت هم به یک خانواده دیگر از عنصرها اضافه شدند.
تلاشهای بیشتر نشان داد که جرم اتمی عناصر توسط یک تابع حسابی قابل تعریف است. در 1862 شانکورتوس (Chancourtois)، یک طبقهبندی برای عناصر، بر اساس مقادیر جرم اتمی ارائه شده توسط استانیسلاو کانیزارو (Stanislao Canizzaro)، پیشنهاد داد. شانکورتوس، جرمهای اتمی را روی یک استوانه با محیط 16 واحد، رسم کرد. عدد 16 بر اساس جرم اتمی اکسیژن انتخاب شد. بر اثر این کار، یک نمودار حلزونی تشکیل شد که عناصر مرتبط با یکدیگر را در بالا یا پایین هم، در استوانه قرار داد. اون با این نمودار پیشنهاد داد که «خواص عناصر، همان خواص اعداد است». این پیشبینی فوق العاده به کمک دانش جدید بوجود آمده بود.

طبقه بندی عناصر
در سال 1864، نولاندز (J.A.R. Newlands) طبقهبندی بر اساس افزایش عدد اتمی ارائه داد. به هر عنصر عددی نسبت داده شد و این عناصر به هفت گروه تقسیم شدند. این هفت گروه، خواصی مشابه هفت سرگروه خود یعنی هیدروژن، لیتیوم، برلیوم، بور، کربن، نیتروژن و اکسیژن داشتند. این رابطه به قانون اکتاو موسوم بود. اکتاو از تشابه اسمی فواصل هفتگانه در گامهای موسیقی گرفته شده بود.
در نهایت در سال 1869، مندلیف قانون تناوب را پیشنهاد داد. این قانون بر اساس رابطه بین خواص و جرم اتمی عناصر و با توجه به عدد پیوندهای یگانه که هر عنصر میتواند تشکیل دهد، ارائه شد. بر اساس این قانون، عناصری که طبق مقدار عدد جرمی خود مرتب شدهاند، خواصی تکرار شونده از خود نشان میدهند. لوتار میر (Lothar Meyer) هم جداگانه این مطلب را بعد از مقاله مندلیف به چاپ رساند.
اولین جدول تناوبی
جدول تناوبی مندلیف در سال 1869، 17 ستون داشت با دو تناوب کامل عناصر از پتاسیم تا بور و روبیدیوم تا ید. قبل از دو دوره تناوب، دو ردیف از هفت عنصر (لیتیوم تا فلوئور) و (سدیم تا کلر) و سه ردیف دوره تناوب ناقص وجود داشت. در سال 1871، مندلیف در مقالهای این جدول را بازنویسی کرد و جای 17 عنصر را در آن تغییر داد. او مانند لوتار میر، یک جدول با ۸ ستون ارائه داد که در هر ستون، دوره تناوبهای طولانی به تناوبهای 7 تایی تقسیم شدند. ستون هشتم، سه عنصر مرکزی داشت (عناصر آهن، کبالت و نیکل). مندلیف مس را به جای قرار دادن در گروه اول، به ستون هشتم اضافه کرد.
او یک دوره تناوب هفتتایی دیگر را به هر ستون اضافه کرد. اولین و آخرین تناوب هفتتایی، حروف a و b را در کنار نمادهای رومی در هر گروه گرفتند.

کشف گازهای نجیب و بهبود جدول تناوبی
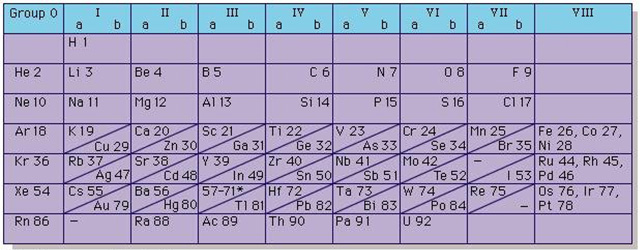
با کشف گازهای نجیب، مندلیف و دیگر دانشمندان یک گروه «صفر» (Zero) به جدول اضافه کردند تا بتوانند این نوع از گازها را هم در جدول قرار دهند. جدول ارائه شده تا سال 1930 مورد استفاده قرار گرفت. یک نمونه از جدول استفاده شده در تصویر زیر آمده است. این جدول با جدول ارائه شده مندلیف تفاوت بسیار اندکی دارد.
در سال 1895، تامسون (J. Thomsen)، یک جدول جدید ارائه داد. این جدول بر اساس ساختار الکترونی اتمها که توسط نیلز بور ارائه شده بود، تفسیر میشد. جدول شامل تناوبهایی از عناصر بود که طول آنها افزایش پیدا میکرد و دارای تناوبهای دو، هشت، هجده و ۳۲تایی بود. هر عنصر در هر دوره تناوب امکان داشت که با خطوطی به عناصر پایینی خود مرتبط شود. از نقاط ضعف این جدول، تعداد زیاد عناصر در ردیف 32تایی و دشواری دنبال کردن توالی عناصر مشابه هم بود. یک راه برای بهبود این جدول، قرار دادن دو گروه از عنصرها در خارج از جدول بود. این دو گروه به نامهای «لانتانیدها» (lanthanides) و «اکتینیدها» (actinides)، در پایین جدول تناوبی اضافه شدند. لانتانیدها و اکتینیدها در ادامه همین متن مورد بررسی قرار گرفتهاند.
شکلهای دیگری از جدول تناوبی
نوع دیگری از جدول تناوبی در سال 1905 توسط ورنر (A. Werner) ارائه شد. او هر دوره تناوب کوتاهتر را به دو بخش تقسیم کرد. هر کدام را در نقاط ابتدایی و انتهایی جدول، بالای عناصرِ با دوره تناوب بلندتر قرار داد. خطوطی که در مدل قبل، عناصر را به یکدیگر تقسیم میکردند، با ارائه این مدل در بین عناصر توزیع شد. در این مدل هم مانند قبل، با جداکردن لانتانیدها و اکتینیدها، جدول ساده میشود. تا اواسط قرن بیستم، این جدول بسیار مورد استفاده قرار میگرفت.

کشف عناصر جدید
ارزش بالای قانون تناوب زمانی مشخص شد که مندلیف در 1871 متوجه شد که خواص 17 عنصر با عناصر دیگر مرتبط است. او این کار را با انتقال 17 عنصر و مرتب کردن بر اساس جرم اتمی انجام داد. این تغییر نشان داد که خطای کمی در اندازهگیری جرم اتمی بسیاری از عناصر وجود دارد. همچنین مشخص شد که خطاهای زیادی در اندازهگیری جرم اتمی برخی عناصر وجود دارد. او علاوه بر این، عناصر کشف نشده و خواص آنها را پیشبینی کرد و نامهای اِکا-بور، اِکا-آلومینیوم و اِکا-سیلیکون را برای آنها انتخاب کرد. این عناصر امروزه به ترتیب با نامهای اسکاندیوم، گالیوم و ژرمانیوم شناخته میشوند.
با کشف هلیوم و آرگون، قانون تناوب به پیشبینی نئون، کریپتون، زنون و رادون هم راه پیدا کرد. علاوه بر این، بور اعتقاد داشت که عنصر کشف نشدهای مشابه با خواص زیرکونیوم (زرگون) وجود دارد. مشاهدات دانشمندان روی سنگ معدنهای زیرکونیوم در سال 1922، سبب کشف عنصر ناشناختهای با نام «هافنیوم» (Hafnium) شد.

اهمیت اعداد اتمی
با وجود اصلاحاتی که در اندازهگیری جرم اتمی عناصر انجام شد، برخی عناصر جدول مندلیف و میر، باید چینشی بر اساس مفهومی به غیر از جرم اتمی میداشتند. برای مثال در گروههای دوتایی آرگون-پتاسیم، کبالت-نیکل و تلوریوم-ید، عنصر اول، جرم اتمی بیشتری دارد اما قبل از عنصر دوم قرار داده شده است. راه حل این مشکل، بعد از فهم بهتر ساختار اتم ممکن شد.
رادرفورد و بار الکتریکی اتم
در سال 1910، ارنست رادرفورد آزمایشی روی خاصیت پخشی ذرات آلفا توسط هسته اتمهای سنگین انجام داد که به کشف بار الکتریکی هسته منجر شد. نسبت بار هسته به بار الکترون در حدود نصف جرم اتمی ذکر شد. در سال 1911 فندربروک (A.van den Broek)، پیشنهاد داد که این عدد اتمی به عنوان ترتیب عناصر در جدول استفاده شوند (همانند مدل نولاندز).
این پیشنهاد در سال 1913 زمانی که موزلی مشغول اندازهگیری طول موج «طیف خطی اشعه ایکس» (characteristic X-ray spectral lines) بسیاری از عناصر بود، اثبات شد. این اندازهگیری نشان داد که طول موج، به خوبی به اعداد اتمی متناظر با عناصر در جدول وابسته است. بنابراین دیگر هیچ شکی در نوع ترتیب عناصر در جدول تناوبی وجود نداشت.

معرفی ایزوتوپها
عدم وابستگی محل عناصر در جدول به عدد جرمی، با معرفی ایزوتوپها بیان شد. ایزوتوپها اتمهایی با عدد اتمی یکسان و عدد جرمی متفاوت هستند. خواص شیمیایی ایزوتوپهای یک عنصر تقریبا با هم برابر است. محل قرارگیری تمامی این ایزوتوپها در جدول، فارغ از عدد جرمی آنهاست.
بیان بهتر قانون تناوب
ساختار الکترونی اتم و تئوری کوانتوم که در سال 1913 توسط بور آغاز شده بود، در فهم دقیق تناوب نقش اساسی داشت. گامهای مثبتی توسط معادلات قدیمی تئوری کوانتوم توسط دانشمندان برداشته شد. اصل طرد پاولی در سال 1925 و توسعه مکانیک کوانتوم توسط هایزنبرگ و شرودینگر در همان سال از آن دسته است. توسعه تئوری والانس با تکیه بر مفهوم الکترون اشتراکی لوییس در سال 1916 هم نقش بسیاری را در توسعه قانون تناوب داشت.
جدول تناوبی عناصر چیست؟
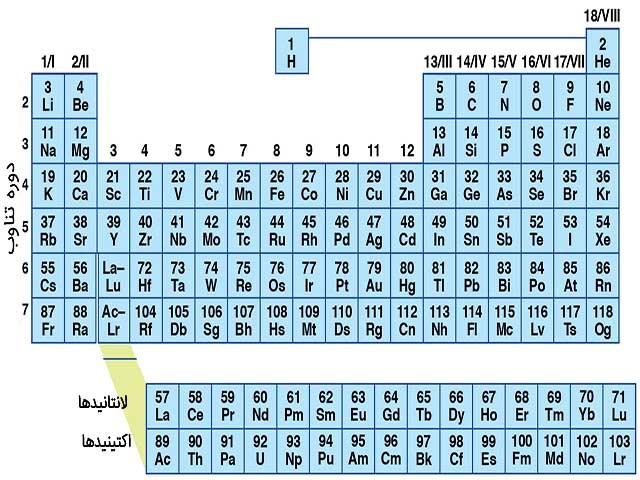
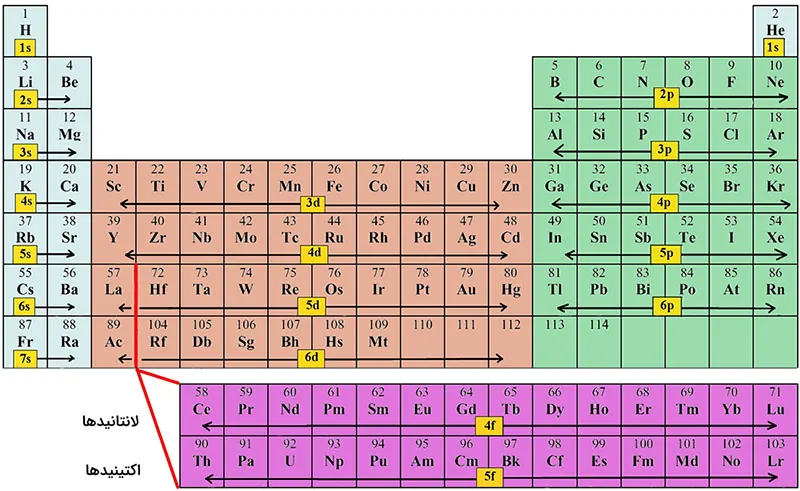
جدول تناوبی، تمامی عناصر کشف شده را شامل میشود. این جدول در هفت دوره تناوب افقی، با ترتیبِ عدد اتمی، چیده شده است و لانتانیدها و اکتیندها به صورت جداگانه در زیر تناوبها با طول متفاوت آورده شدهاند.
در تناوب اول، هیدروژن و هلیوم قرار دارند. سپس دو دوره تناوب با هشت عنصر در آن وجود دارند. این تناوبها به ترتیب شامل عناصری از لیتیوم تا نئون برای تناوب دوم و از سدیم تا آرگون برای تناوب سوم است. پس از این دو تناوب، دو دوره دیگر با 18 عنصر قرار دارند. تناوب چهارم از پتاسیم تا کریپتون و تناوب پنجم از روبیدیوم تا زنون است. اولین تناوب بلند با تعداد 32 عنصر از سزیم تا رادون با حذف لانتانیدها نمایش داده میشود. لانتانیدها به صورت جداگانه در پایین جدول نمایش داده میشوند. این کار سبب میشود تا 18 عنصر دیگر با خواص مشابه در کنار یکدیگر قرار بگیرند. دومین تناوب بلند شامل فرانسیم تا اوگانسون است. به طور مشابه از این گروه هم اکتینیدها حذف شده است.
طبقهبندی عناصر در گروهها
شش گاز نجیب شامل هلیوم، نئون، آرگون، کریپتون، زنون و رادون که در انتهای هر دوره تناوب قرار دارند، گروه 18 جدول تناوبی را تشکیل میدهند. بهتر است عنصرها را به صورت افقی و عمودی دستهبندی کنیم. به صورت افقی با نام تناوب و عمودی به صورت گروهی دستهبندی میکنیم. در این جدول به طور مثال هفت عنصر از لیتیوم تا فلوئور در یک تناوب قرار میگیرند. این تناوب شامل هفت گروه از 1 (la) تا 17 (Vlla) است. اما گروهها را به صورت عمودی در نظر میگیریم. در گروه اول، فلزات قلیایی از لیتیوم تا فرانسیم وجود دارند. در گروه دوم، فلزات قلیایی خاکی از برلیم تا رادیم وجود دارند. به همین ترتیب گروه 13 گروه بور، گروه 14 کربن، گروه 15 نیتروژن، گروه 16 اکسیژن و گروه 17 هالوژن نامگذاری میشوند.
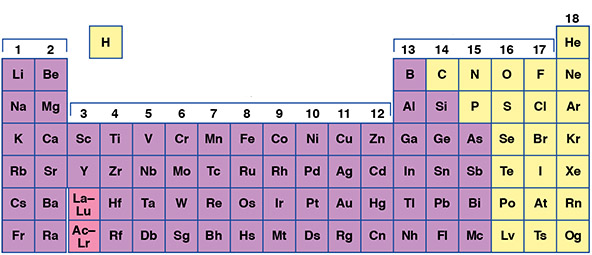
هیدروژن در گروه 1 قرار دارد اما خواص آن شبیه فلزات قلیایی یا هالوژنها نیست. دورههای تناوب طولانی با نام فلزات واسطه نامگذاری میشوند. به عنوان مثال از اسکاندیم تا روی را میتوان در نظر گرفت. طبق تعریف، فلزات واسطه، از گروه 3 تا گروه 12 را شامل میشوند.
خواص عناصر گروه ۱۶ جدول تناوبی چه هستند؟
گروه ۱۶ جدول تناوبی که به گروه اکسیژن یا کالکوژنها معروف است، با عناصر اکسیژن، گوگرد، سلنیوم، تلوریوم و پولونیوم شناخته میشود. این گروه، قبل از گروه هالوژنها قرار دارد و با نگاهی به جدول، درمییابیم که گروه ۱۶ جدول تناوبی شامل خواصی فلزی و شبهفلزی است.
بررسی مختصر روندهای تناوبی در جدول
در هر گروه از بالا به پایین، عدد اتمی عنصرها افزایش پیدا میکند. الکترونگاتیوی در هر گروه از بالا به پایین کاهش (به جز گروه 1۱) پیدا میکند. در هر تناوب از چپ به راست، شعاع اتم کاهش پیدا میکند. این کاهش شعاع سبب افزایش انرژی یونش و الکترونگاتیوی از چپ به راست در هر تناوب میشود.
دستههای جدول تناوبی چیست؟
جدول تناوبی را میتوان به بلوکها (دستهها) مختلف تقسیم کرد. هر بلوک را میتوان بر اساس اوربیتال فرعی الکترون لایه آخر نامگذاری کرد. دسته s شامل دو گروه اول به همراه هیدروژن و هلیوم است. گروههای 13 تا 18 (شامل شبه فلزات) را دسته p نامگذاری میکنیم. دسته d شامل گروههای 3 تا 12 (فلزات واسطه) است. گروه f نیز شامل لانتانیدها و اکتینیدها است.
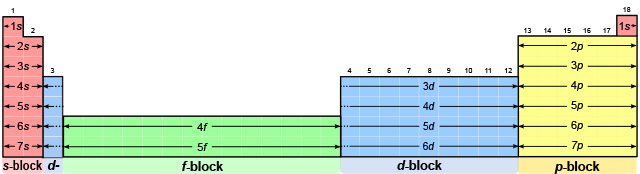
در پایان، خلاصه آنچه که در خصوص روندهای تناوبی عناصر در جدول توضیح داده شد، در شکل زیر آورده شده است. در ادامه متن نیز بررسی دقیقتری در خصوص روندهای تناوبی در جدول تناوبی خواهیم داشت.
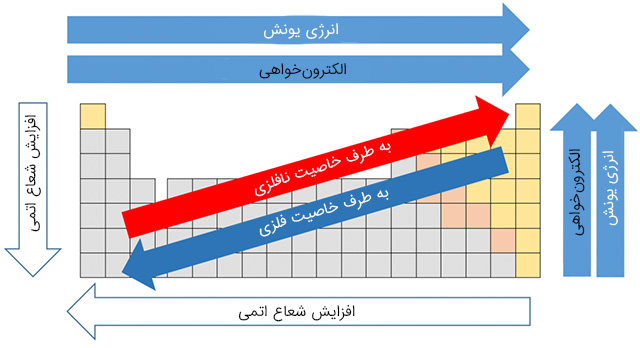
روندهای تناوبی در جدول تناوبی
روندهای تناوبی، الگوهای ویژهای در جدول تناوبی هستند که به کمک آنها میتوان جنبههای مختلفی از یک عنصر همچون اندازه و خواص الکترونی را مورد بررسی قرار داد. در آموزشهای قبلی «مجله فرادرس»، مطالبی در خصوص گروههای جدول تناوبی بیان شد. در ادامه این آموزش قصد داریم روندهای تناوبی موجود را در جدول تناوبی عناصر بررسی کنیم. اصلیترین روندهای تناوبی عبارتند از: الکترونگاتیوی، انرژی یونش، الکترونخواهی، شعاع اتمی، نقطه ذوب و خاصیت فلزی. در حقیقت، بررسی روندهای تناوبی ابزاری را در اختیار یک شیمیدان قرار میدهد تا از طریق آن، پیشبینی خواص عناصر، با سرعت بیشتری انجام شود. روندهای تناوبی به این دلیل وجود دارند که ساختارهای اتمی مشابهی در عناصر با گروهها و تناوبهای یکسان دیده میشود که حاصل طبیعت تناوبی عناصر است. در ادامه به بررسی این روندهای تناوبی میپردازیم.
روند الکترونگاتیوی
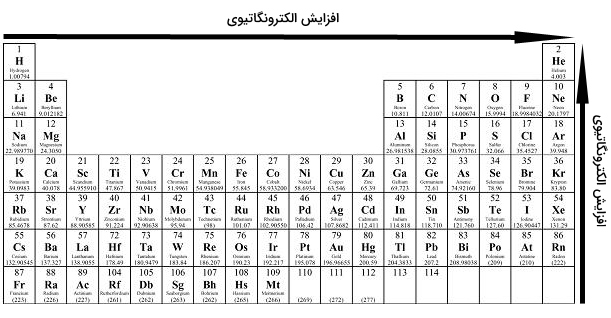
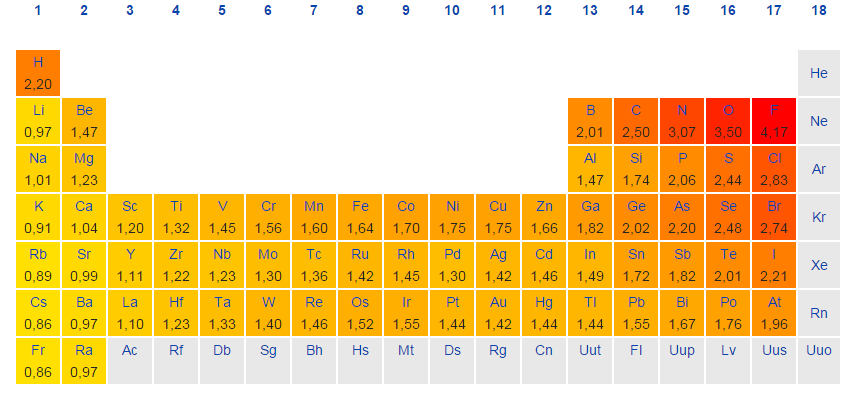
الکترونگاتیوی را میتوان به صورت یک خاصیت شیمیایی در توصیف توانایی اتم برای جذب الکترونها بیان کرد. به طور معمول، از روش «پاولینگ» (Pauling) برای بررسی مقدار الکترونگاتیوی عناصر استفاده میکنند. مقادیر الکترونگاتیوی که از این طریق به عناصر اختصاص مییابند، بدون بعد هستند. این امر، نشاندهنده طبیعت کیفی مقیاس الکترونگاتیوی است. در جدول زیر، الکترونگاتیوی عناصر را مشاهده میکنید.
الکترونگاتیوی، تمایل اتم برای جذب الکترون و تشکیل پیوند را نشان میدهد. این خاصیت، به دلیل آرایش الکترونی اتمها بوجود میآید. بیشتر اتمها برای رسیدن به پایداری، از قاعده اکتت پیروی میکنند. از آنجایی که لایه ظرفیت عنصرهای سمت چپ جدول تناوبی، کمتر از نصف پر شده، انرژی مورد نیاز برای دریافت الکترون، به طور مشخصی بیشتر از انرژی مورد نیاز برای از دست دادن الکترون است. در نتیجه، به طور کلی، عناصر سمت چپ جدول تناوبی به هنگام تشکیل پیوند، الکترون از دست میدهند. به طور عکس، عناصر سمت راست جدول تناوبی، تمایل بیشتری برای دریافت الکترون و تکمیل لایه ظرفیت خود دارند. روندهای تناوبی الکترونگاتیوی را به صورت زیر میتوان بیان کرد:
- از چپ به راست در جدول تناوبی، الکترونگاتیوی افزایش پیدا میکند. اگر لایه ظرفیت یک اتم، کمتر از نصف پر شده باشد، انرژی کمتری برای از دست دادن الکترون و رسیدن به پایداری نیاز دارد. به عکس، اگر لایه ظرفیت، بیش از نصف پر شده باشد، دریافت الکترون، سادهتر خواهد بود.
- در هر گروه، از بالا به پایین، الکترونگاتیوی کاهش پیدا میکند. این امر به دلیل افزایش عدد اتمی در هر گروه از بالا به پایین و در نتیجه، افزایش فاصله بین الکترونهای ظرفیت و هسته و همچنین، افزایش شعاع اتمی اتفاق میافتد.
موارد استثنا که از این روند تبعیت نمیکنند، گازهای نجیب، لانتانیدها و اکتینیدها هستند. لایه ظرفیت گازهای نجیب، به طور کامل پرشده است و به همین دلیل، تمایلی به جذب الکترون ندارند. لانتانیدها و اکتینیدها، خواص شیمیایی پیچیدهای دارند و به همین دلیل از روند خاصی پیروی نمیکنند. از اینرو، برای گازهای نجیب، لانتانیدها و اکتینیدها، عددی در خصوص الکترونگاتیوی ذکر نمیشود.
در خصوص فلزات واسطه باید گفت که این عناصر، انحرافهایی از روند اصلی در هر تناوب و گروه از خود نشان میدهند که این انحرافات نیز به دلیل خواص فلزی است که بر جذب الکترونها تاثیر میگذارد. با توجه به دو روند اصلی که در خصوص الکترونگاتیوی وجود دارد، میتوان نتیجه گرفت که عنصر فلوئور، بالاترین الکترونگاتیوی را در میان عناصر جدول دارد.
روند انرژی یونش
انرژی یونش، به انرژی مورد نیاز برای جداکردن یک الکترون از اتم خنثی در فاز گاز میگویند. از لحاظ مفهومی، انرژی یونش، مفهوم مقابل الکترونگاتیوی به شمار میآید. هر قدر این انرژی کمتر باشد، اتم راحتتر به کاتیون تبدیل میشود. به طور کلی، عناصر سمت راست جدول تناوبی، انرژی یونش بیشتری دارند چراکه لایه ظرفیت آنها تقریبا پر شده است. عناصر سمت چپ جدول تناوبی، انرژی یونش کمی دارند زیرا تمایل آنها برای از دست دادن الکترون و تبدیل شدن به کاتیون، بیشتر است. در نمودار زیر، انرژی یونش از هیدروژن تا آرگون را بر اساس عدد اتمی ملاحظه میکنید.
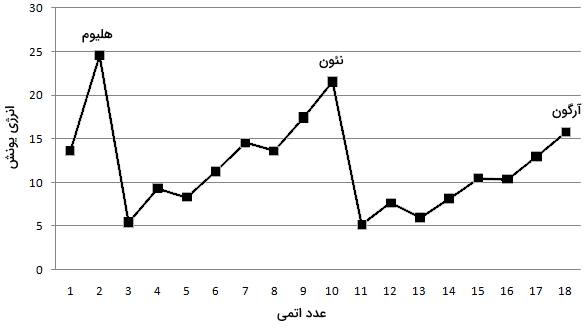
اثر پوششی الکترونها
عامل دیگری که بر انرژی یونش تاثیر میگذارد موسوم به «اثر پوششی الکترونها» (Electron Shielding) است. این اثر به توصیف توانایی الکترونهای لایههای داخلی برای پوشش تاثیر هسته مثبت در مقابل الکترونهای ظرفیت میپردازد. در هر تناوب از چپ به راست، تعداد الکترونها و به دنبال آن، اثر پوششی افزایش پیدا میکنند. در نتیجه افزایش این اثر، الکترونها سادهتر یونیزه میشوند. بنابراین، انرژی یونش در هر گروه از بالا به پایین کاهش مییابد. روندهای تناوبی در انرژی یونش به طور خلاصه در زیر آورده شدهاند.
- در هر تناوب از چپ به راست، انرژی یونش به طور کلی افزایش پیدا میکند.
- در هر گروه از بالا به پایین، انرژی یونش کاهش مییابد.
- گازهای نجیب، به دلیل لایه ظرفیت پر شده، انرژی یونش بسیار بالایی دارند. در این میان، هلیوم بیشترین انرژی یونش را در میان تمامی عناصر داراست.
انرژی یونش اول، دوم و ...
برخی از عناصر، چندین انرژی یونش دارند که با نامهای انرژی یونش اول، دوم و ... شناخته میشوند. انرژی یونش اول عبارتست از انرژی مورد نیاز برای حذف الکترون خارجیترین لایه و به همین ترتیب، انرژی دوم، شامل حذف الکترون از کاتیون گازی است. برای درک بهتر این تعریف، واکنشهای شیمیایی زیر در خصوص انرژی یونش اول و دوم آورده شدهاند:
انرژی یونش اول:
انرژی یونش دوم:
روندهای تناوبی در انرژیهای یونش دوم، سوم و ... نیز از همان روند انرژی یونش اول پیروی میکنند.
با افزایش شعاع اتمی، انرژی یونش کاهش پیدا میکند. این تاثیر، به طور عکس با عدد کوانتومی و به طور مستقیم با عدد اتمی مرتبط است.
- در هر تناوب از چپ به راست، افزایش پیدا میکند اما عدد کوانتومی ثابت است، در نتیجه، انرژی یونش افزایش پیدا میکند.
- در هر گروه از بالا به پایین، عدد کوانتومی با شدت بیشتری نسبت به عدد اتمی افزایش پیدا میکند و در نتیجه، انرژی یونش کاهش پیدا میکند.
روند الکترون خواهی
همانطور که از نام آن پیداست، الکترونخواهی به توانایی یک اتم برای پذیرش یک الکترون میگویند. برخلاف الکترونگاتیوی، الکترونخواهی، خاصیتی «کمی» (Quantitative) و بیانگر تغییر انرژی به هنگام اضافه کردن یک الکترون به اتم گازی خنثی است. هرقدر مقدار الکترونخواهی منفی باشد، تمایل یک اتم به جذب الکترون بیشتر خواهد بود.
به طور کلی، الکترونخواهی در هر گروه از بالا به پایین کاهش پیدا میکند زیرا اندازه هر اتم، از اتم بالاتر از خود، بزرگتر است که یعنی هر الکترونی که اضافه شود، نسبت به اتم کوچکتر، در فاصله دورتری از هسته اتم قرار دارد. این افزایش فاصله بین هسته مثبت و الکترون منفی، قدرت جاذبه را کاهش میدهد و سبب کاهش الکترونخواهی میشود. در هر تناوب از چپ به راست، اندازه اتمها کوچکتر میشود و بنابراین، نیروهای جاذبه افزایش پیدا میکنند. در نتیجه این امر، الکترونها به هسته نزدیکتر و سبب افزایش الکترونخواهی میشوند. روندهای تناوبی برای الکترونخواهی، به صورت خلاصه در زیر آورده شده است:
- در هر تناوب از چپ به راست، الکترونخواهی افزایش پیدا میکند.
- در هر گروه از بالا به پایین، الکترونخواهی کاهش پیدا میکند.
روند شعاع اتمی
شعاع اتمی، نیمی از فاصله بین هسته دو اتم ذکر میشود. البته این تعریف قدری پیچیده است چراکه همه اتمها به یک شکل با یکدیگر پیوند تشکیل نمیدهند و پیوندهای کووالانسی، یونی و فلزی گواه این ادعا هستند. گرچه این احتمال وجود دارد که بیشتر اتمها، پیوندهایی کووالانسی با یکدیگر تشکیل دهند. شعاع کووالانسی این مولکولها را به طور معمول به عنوان شعاع اتمی در نظر میگیرند. این فاصله را با واحد پیکومتر اندازهگیری میکنند.
در هر تناوب از چپ به راست، شعاع اتمی کاهش پیدا میکند زیرا در هر تناوب، تمامی الکترونها به یک لایه اضافه میشوند. به طور همزمان نیز به هسته، پروتون اضافه خواهد شد. در نتیجه این اتفاق، اثر جاذبه هسته افزایش پیدا میکند. این امر به این معنی است که هسته با شدت بیشتری الکترونها را به سمت خود جذب میکند و در نهایت، لایههای الکترونی به هسته نزدیکتر میشوند. با نزدیکی لایههای الکترونی به هسته، الکترونهای لایه ظرفیت نیز به هسته نزدیک خواهند شد و شعاع اتمی کاهش پیدا میکند.
در هر گروه از بالا به پایین، شعاع اتمی افزایش مییابد. با توجه به افزایش عدد کوانتومی، الکترونهای ظرفیت، سطوح بالاتری را اختیار میکنند. در نتیجه، با افزایش عدد n، فاصله الکترونها از هسته بیشتر خواهد شد. اثر پوششی مانع از جذب این الکترونها به هسته خواهد شد که این امر سبب میشود تا با قدرت کمتری الکترونها در کنار هسته قرار بگیرند و حاصل این کار، افزایش شعاع اتمی خواهد بود. خلاصه روندهای تناوبی در خصوص شعاع اتمی، در زیر آورده شده است:
- در هر تناوب از چپ به راست، شعاع اتمی کاهش پیدا میکند.
- در هر گروه از بالا به پایین، شعاع اتمی افزایش مییابد.
روند نقطه ذوب
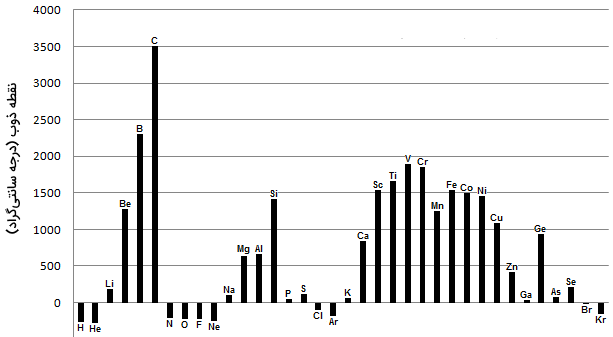
همانطور که میدانید، نقطه ذوب عبارتست از انرژی مورد نیاز برای شکست پیوندها و تغییر فاز یک جامد به مایع. به طور کلی، هرقدر پیوندهای بین اتمهای یک عنصر، قویتر باشند، انرژی بیشتری برای شکستن پیوندها مورد نیاز است. با توجه به اینکه دما به طور مستقیم با انرژی در ارتباط است، هرقدر انرژی تفکیک پیوند بالاتر باشد، دمای متناظر با آن نیز بیشتر خواهد بود. لازم به ذکر است که نقطه ذوب از یک روند مشخصی پیروی نمیکند اما نتایج مشخصی را میتوان به کمک تصویر زیر برای آن بیان کرد:
- فلزات به طور کلی نقطه ذوب بالایی دارند.
- بیشتر نافلزات، دارای نقطه ذوب پایینی هستند.
- نافلز کربن، بالاترین نقطه ذوب را در میان تمامی عناصر دارد. همچنین، شبه فلز بور را نیز باید در میان عناصر با نقطه ذوب بالا قرار داد.
روند خاصیت فلزی
خاصیت فلزی یک عنصر را میتوان با سختیِ از دست دادن یک الکترون در اتم مرتبط کرد. در هر تناوب از راست به چپ، خاصیت فلزی کاهش پیدا میکند زیرا جاذبه بین الکترونهای ظرفیت و هسته افزایش مییابند و به این ترتیب، اتم، دشوارتر الکترون از دست میدهد. در هر گروه از بالا به پایین هم به دلیل افزایش اندازه اتم، خاصیت فلزی افزایش پیدا میکند. زمانی که اندازه اتم افزایش پیدا کند، فاصله لایه خارجی از هسته، بیشتر میشود. در این شرایط، عدد کوانتومی افزایش مییابد و تمرکز چگالی متوسط الکترونی از روی هسته برداشته خواهد شد. در نتیجه، الکترونهای لایه ظرفیت، جاذبه کمتری را نسبت به هسته احساس میکنند و اتمها خیلی سادهتر الکترون از دست میدهند که همین امر موجب افزایش خاصیت فلزی خواهد شد. خلاصه روندهای تناوبی در زیر آورده شده است:
- در هر تناوب از چپ به راست، خاصیت فلزی کاهش پیدا میکند.
- در هر گروه از بالا به پایین، خاصیت فلزی افزایش مییابد.
- توانایی از دست دادن الکترون به خاصیت فلزی و توانایی دریافت الکترون به خاصیت نافلزی مرتبط است.
راه دیگری که میتوان این نوع از روندهای تناوبی را به خاطر سپرد این است که با حرکت قطری در جدول تناوبی از چپ به راست، یعنی با حرکت از آخرین فلز قلیایی به سمت هلیوم، خاصیت فلزی کاهش پیدا میکند.
جمعبندی روندهای تناوبی
در این آموزش، انواع روندهای تناوبی در جدول تناوبی را مورد بررسی قرار دادیم. در ادامه، روندهای تناوبی را به طور خلاصه بیان میکنیم:
الکترونگاتیوی
- از چپ به راست در جدول تناوبی، الکترونگاتیوی افزایش پیدا میکند.
- در هر گروه، از بالا به پایین، الکترونگاتیوی کاهش پیدا میکند.
انرژی یونش
- در هر تناوب از چپ به راست، انرژی یونش افزایش پیدا میکند.
- در هر گروه از بالا به پایین، انرژی یونش کاهش مییابد.
الکترونخواهی
- در هر تناوب از چپ به راست، الکترونخواهی افزایش پیدا میکند.
- در هر گروه از بالا به پایین، الکترونخواهی کاهش پیدا میکند.
شعاع اتمی
- در هر تناوب از چپ به راست، شعاع اتمی کاهش پیدا میکند
- در هر گروه از بالا به پایین، شعاع اتمی افزایش مییابد.
نقطه ذوب
به طور کلی بیشتر فلزات، نقطه ذوب بالایی دارند و نافلز کربن، بالاترین نقطه ذوب را در میان عناصر دارد.
خاصیت فلزی
- در هر تناوب از چپ به راست، خاصیت فلزی کاهش پیدا میکند.
- در هر گروه از بالا به پایین، خاصیت فلزی افزایش مییابد.
چطور جدول تناوبی را حفظ کنیم؟
اما با توجه به اینکه برای هر دانشآموز و دانشجوی شیمی، حفظ کردن جدول تناوبی از جمله دغدغههای همیشگی به شمار میآید، در ادامه این مطلب قصد داریم به ارائه روشهای مختلف برای حفظ کردن جدول تناوبی بپردازیم. این روشها از دشوار به ساده دستهبندی شدهاند اما به این معنی نیست که روش آخر، بهترین روش برای حفظ کردن جدول تناوبی به شمار میآید. بهتر است برای یادگیری ماندگار جدول تناوبی، به طور همزمان از روشهای مختلف کمک بگیرید.
روش آهسته تمرین و تکرار
همانطور که در کودکی، الفبا را به کمک تکرار و تمرین مداوم یاد گرفتید، برای یادگیری الفبای علم شیمی نیز باید به همین شکل کار کنید. البته چنین روشی در سنهای بالاتر قدری خستهکننده و ناکارآمد خواهد بود. به طور قطع برای حفظ کردن جدول تناوبی باید این روش را نیز بکار گرفت اما میتوان با ترکیب سایر روشهای سادهتر، به فرآیند یادگیری سرعت بخشید. در نهایت، اگر میخواهید با روش تکرار و تمرین، به حفظ کردن جدول تناوبی بپردازید، بهتر است چهار مرحله زیر را طی کنید:
- حفظ کردن ۵ عنصر در هر بازه زمانی: اگر در هر روز، تنها ۵ عنصر را حفظ کنید، با گذشت ۲۳ روز، بیش از ۹۰ درصد عناصر جدول تناوبی را حفظ کردهاید و تنها چند عنصر باقی ماندهاند. البته به یاد داشته باشید که در هر روز، حفظیات روزهای قبل را نیز مرور کنید.
- حفظ کردن با صدای بلند: حفظ کردن عناصر با صدای بلند، سبب ایجاد «یادگیری فعال» (Active Learning) میشود و شما را وادار میکند که توجه خود را به یادگیری خود معطوف کنید.
- ایجاد وقفه بین یادگیری: همواره به ذهن خود فرصت بدهید تا دوباره تمرکز خود را بدست آورد. این کار تنها با ایجاد وقفه بین یادگیری ممکن است. به طور مثال، برای مطالعه یک مطلب، اگر آنرا در ۳ بازه یک ساعتی مطالعه کنید، نتایج به مراتب بهتری را نسبت به مطالعه آن در یک بازه ۳ ساعتی بدست خواهید آورد.
- تنظیم هدف برای یادگیری زیاد: همواره از تکنیک «یادگیری زیاد» (Overlearning) استفاده کنید. یادگیری زیاد به معنی عدم توقف و ادامه فرآیند یادگیری به هنگام رسیدن به نقطه هدف است. به طور مثال، اگر به مرحلهای رسیدید که تعداد عناصر زیادی را حفظ کردید، یادگیری را متوقف نکنید و به آن ادامه دهید.
افزایش سرعت یادگیری به کمک فلش کارت
روش قبلی که برای حفظ کردن جدول معرفی شد، روشی آهسته بود که به کمک فلشکارتها میتوان کمی بر سرعت آن افزود. البته نمیتوان این روش را به صورت یک روش موثر شناخت بلکه استفاده فیزیکی آنها به افزایش سرعت روش قبل کمک میکند.
البته سعی کنید همواره خودتان نام عناصر را بر روی فلشکارتها بنویسید چراکه همین امر، سبب افزایش درگیری ذهنی میشود که خود در فرآیند یادگیری موثر است. فلشکارتهایی را که تهیه کردهاید همواره با خود به همراه داشته باشید تا در اوقات تلف شده در تاکسی و اتوبوس، آنها را مطالعه کنید.
بهتر است در هر فلشکارت، تعداد ۵ یا ۱۰ عنصر را بنویسید یا اینکه عناصر هر گروه از جدول تناوبی را در یک فلش کارت قرار دهید. بازههای یادگیری را افزایش دهید و در این بخش نیز از تکنیک یادگیری زیاد کمک بگیرید. به هنگام حفظ کردن عناصر، آنها را با صدای بلند تکرار کنید. البته این روش نیز، روشی زمانبر و خسته کننده به شمار میآید.

استفاده از حروف و جملات اختصاری
با توجه به اینکه جدول تناوبی عناصر شامل نمادهای هریک از عنصرها است، میتوان به کمک این نمادها جملاتی ساخت که در حفظ کردن جدول تناوبی موثر باشند. حفظ کردن عناصر را هم میتوانید به شکل گروهی و هم به شکل تناوبی انجام دهید. البته به طور معمول، از روش گروهی (بالا به پایین) برای حفظ کردن عناصر استفاده میکنند چراکه این روش، شامل سایر دستهبندیها همچون هالوژنها، فلزات قلیایی و قلیایی خاکی نیز می شود. سعی کنید جملات و حروف را خودتان درست کنید تا ماندگاری بیشتری در ذهن شما داشته باشند.
به مثال زیر توجه کنید:
HHeLiBeBCNOF
این حروف به صورت جمله «هیلیبِب کِرنف» (heeliebeb kernoff) تلفظ میشود. با اینکه معنای خاصی ندارد اما به کمک آن، ۹ عنصر ابتدایی جدول تناوبی را میتوان حفظ کرد.
همچنین، میتوان به کمک نماد عناصر، جملات معنیداری همچون جمله زیر نوشت:
«Here He Lies Beneath Bed Clothes, Nothing On, Feeling Nervous»
البته میتوان از جملات فارسی نیز استفاده کرد. به طور مثال، از جمله زیر جهت حفظ کردن فلزات قلیایی خاکی بهره میگیرند.
«بی مغازه، کار سرویس با رامین»
گروه فلزات قلیایی نیز عناصر زیر را شامل میشوند:
Be, Mg, Ca, Sr, Ba, Ra
البته نمیتوان برای حفظ کردن تمامی عناصر جدول تناوبی از این روش استفاده کرد بلکه برای ۲۰ عنصر ابتدایی جدول یا چند گروه اصلی، بکارگیری این روش به همراه سایر روشها بسیار مفید خواهد بود.
استفاده از تصاویر عناصر
رسم آرایش الکترونی برخی عناصر همچون مس، با تغییراتی همراه هستند. همچنین با دانستن عدد اتمی عناصر گازهای نجیب، میتوان به خصوصیات کلی عناصر قبل و بعد از آنها پی برد. به همین دلیل، به هنگام حفظ کردن جدول تناوبی، فراموش نکنید که بهتر است یادگیری آنها به کمک عناصر انجام شد. به طور مثال، یک فویل آلومینیومی کنار عنصر آلومینیوم یا تصویر لامپ نئونی، به یادگیری و حفظ جدول تناوبی کمک می کند.

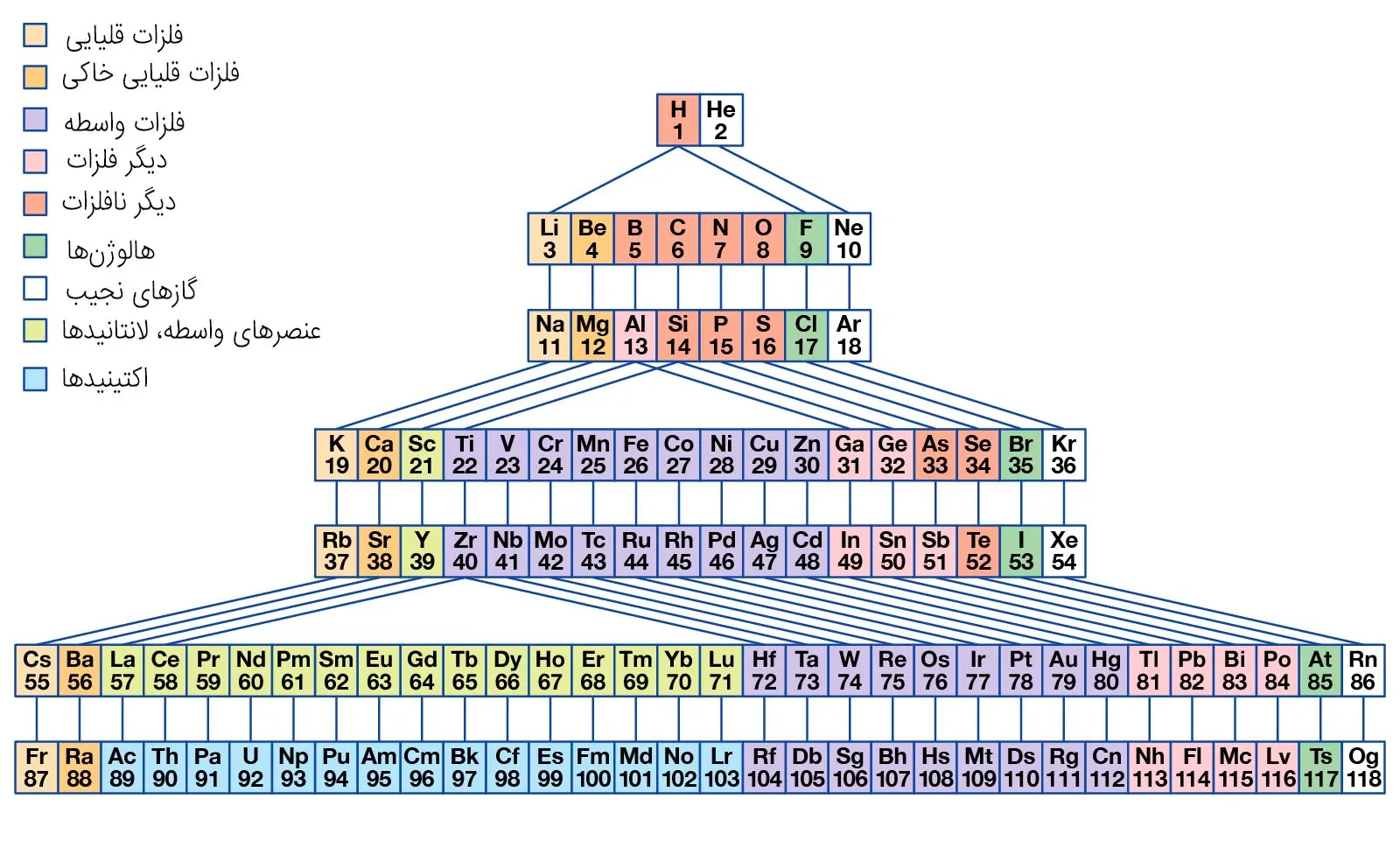
رنگ بندی عناصر در جدول تناوبی
آخرین روش برای حفظ کردن جدول تناوبی را میتوان در رنگبندی عناصر و گروهها خلاصه کرد. همانطور که در این مطلب یاد گرفتید، عناصر مختلف جدول تناوبی، در گروههای مختلفی همچون فلزات قلیایی، فلزات قلیایی خاکی، گازهای نجیب، هالوژنها، فلزات، نافلزات و ... طبقهبندی میشوند. برای اینکه ساختاری منظم در ذهن خود ایجاد کنید، این گروهها را در رنگهای مختلفی طبقهبندی کنید به گونهای که هر رنگ، به یک گروه اختصاص داشته باشد. این دستهبندی رنگی را میتوانید در تصویر زیر مشاهده کنید.

لانتانیدها و اکتینیدها در جدول تناوبی
در ادامه این آموزش قصد داریم تا توضیحات تکمیلی در خصوص لانتانیدها و اکتینیدها ارائه کنیم. اگر به جدول تناوبی در تصویر زیر نگاه کنیم، دو ردیف صورتیرنگ را در بیرون جدول پیدا خواهیم کرد که یکی، بین عناصر باریم و هافنیوم و دیگری در میان عناصر رادیم و رادرفوردیم قرار دارد. این دو کادر، شامل عناصری با زیرلایه پرنشده f هستند. در حقیقت، برای اینکه نظم و ترتیب در جدول تناوبی عناصر حفظ شود، عناصر این دو کادر را به پایین جدول منتقل کردهاند.
هرقدر تعداد الکترون در یک اتم افزایش مییابد، رفتارهای متفاوتی را شاهد خواهیم بود. میدانیم که برخی از سطوح انرژی (لایهها) در عناصر، بعد از پر شدن لایه خارجی، شروع به پر شدن میکنند. این پدیده، در دو گروه از عناصر به نامهای لانتانیدها و اکتینیدها قابل تشخیص است.
بلوک f در لانتانیدها و اکتینیدها
اولین زیرلایهای که در بلوک f پر میشود، زیرلایه است که بعد از زیرلایه پر میشود. هفت اوربیتال بلوک f میتوانند تا ۱۴ الکترون را در خود جای دهند و این بدان معنی است که این بلوک میتواند شامل ۱۴ عنصر باشد. به همراه دو عنصر لانتانیوم و اکتینیوم که در بلوک d قرار دارند، لانتانیدها و اکتیندها هرکدام شامل ۱۵ عنصر هستند.
تعداد عناصر در لانتانیدها و اکتینیدها
برخی از متون شیمی، به اشتباه دو عنصر ابتدایی در لانتانیدها و اکتینیدها را نیز جزو بلوک f محسوب میکنند که امری اشتباه است. همچنین، در برخی منابع، به اشتباه، تعداد عناصر در لانتانیدها و اکتینیدها را ۱۴ عنصر ذکر کردهاند بلکه باید به این نکته اشاره کرد که عناصر بلوکهای و هرکدام شامل ۱۴ عنصر هستند اما با احتساب دو عنصر لانتانیوم و اکتینیوم، تعداد عناصر در لانتانیدها و اکتیندها به ۱۵ میرسد. به همین دلیل برخی منابع تعداد آنها را ۱۵ و برخی دیگر ۱۴ عنصر ذکر میکنند.
اگر بخواهیم به طور دقیقتر این مساله را توضیح دهیم باید بگوییم که به طور مثال، واژه لانتانید به معنای «شبیه لانتانیوم» است و نمیتوان عنصر لانتانیوم را یک لانتانید دانست و در برخی منابع، این عنصر را در گروه ۳ جدول تناوبی قرار میدهند اما آیوپاک، این عنصر را نیز به دلیل استفاده رایج آن، در دسته لانتانیدها قرار داده است.
خواص عنصری در لانتانیدها و اکتینیدها
لانتانیدها به لحاظ شیمیایی با عناصر در گروههای اصلی جدول تناوبی و همچنین فلزات واسطه تفاوت دارند. این تفاوت به دلیل طبیعت زیرلایه f در آنها است. این اوربیتالها در داخل اتم قرار گرفتهاند و توسط الکترونها در اوربیتالهای و پوشیده شدهاند. به همین دلیل، خواص شیمیایی این عناصر به اندازه آنها وابسته است که این مقدار، با افزایش عدد اتمی، افزایش پیدا میکند.
اکتینیدها همانند سایر فلزات و نرم هستند. تمامی آنها رنگی نقرهای دارند که در برابر هوا، کِدر میشوند. علاوه بر این، اکتینیدها دارای چگالی و پلاستیسیته بالایی هستند. برخی از اکتینیدها همچون فلزات قلیایی با چاقو برش میخورند. عنصری مثل «توریم» (Thorium) را میتوان حرارت داد و همانند فولاد، آن را به ورقههایی تبدیل کرد. چگالی این عنصر در حدود نصف چگالی اورانیوم و پلوتونیوم و از هردو این عناصر سنگینتر است.
برخلاف لانتانیدها، بیشتر اکتینیدها، خواص مشابه بلوک d را دارند. این عناصر، با از دست دادن چندین الکترون، اعداد اکسایش متفاوتی بدست میدهند که نتیجه آن بوجود آمدن یونهای مختلف است. تمامی اکتینیدها رادیواکتیو و پارامغناطیس هستند و به غیر از اکتینیوم، بقیه دارای «فاز بلورین» (Crystalline Phase) هستند. علاوه بر این، تمامی اکتینیدها زمانی که در معرض هوا قرار بگیرند، به طور خود به خودی واکنش میدهند و ایجاد شعله میکنند.
نقطه ذوب اکتینیدها، وابستگی مشخصی به تعداد الکترونهای اوربیتالهای f ندارد. نقطه ذوب غیر معمول و پایین نپتونیم و پلوتونیوم - در حدود 640 درجه سانتیگراد - را به دلیل هیبرید شدن اوربیتالهای و و تشکیل پیوندهای جهتدار در این فلزات ذکر میکنند.
همچون لانتانیدها، تمامی اکتینیدها به شدت با هالوژنها و کالکوژنها واکنش میدهند. البته در این میان، اکتینیدها سادهتر وارد واکنش میشوند. اکتینیدها، خاصه آنهایی که تعداد کمی الکترون در اوربیتال دارند، مستعد هیبرید شدن هستند. این مورد را با شباهت انرژی الکترونها در زیرلایههای ، و توصیف میکنند.
اعداد اکسایش در لانتانیدها و اکتینیدها
لانتانیدها را با اعداد اکسایش میشناسند و در گذشته تصور میشد که تنها عناصر «ساماریم» (Samarium)، «یوروپیم» (Europium) و «ایتریبیم» (Ytterbium) به عدد اکسایش در محلولها میرسند اما امروزه دانشمندان به این نتیجه رسیدهاند که تمامی لانتانیدها، کمپلکسهایی به صورت تشکیل میدهند. در مقابل، اکتینیدها، اعداد اکسایش متفاوتی از تا حتی دارند.
کاربرد لانتانیدها در چیست؟
از لانتانیدها به طور گسترده در آلیاژها برای افزایش سختی و استحکام فلزات استفاده میشود. عنصر اصلی که برای این منظور از آن بهره میگیرند، «سریم» (Cerium) است که با مقادیری از سایر عناصر این گروه ترکیب میشود. همچنین از این فلزات به طور گسترده در صنایع نفتی برای پالایش نفت خام کمک میگیرند.

همچنین، از عنصر «اربیم» (Erbium) و سایر لانتانیدها در دستگاههای نوری همچون دوربینهای دید در شب، پرتوهای لیزر و مواد فسفرسانس بهره میگیرند.
انرژی یونش در لانتانیدها چه روندی را دنبال می کند؟
انرژی یونش در لانتانیدها را میتوان با آلومینیوم مقایسه کرد. در آلومینیوم، مجموع سه انرژی یونش اول برابر با است در حالیکه برای لانتانیدها این مقدار در بازه قرار میگیرد. دلیل این امر، واکنشپذیری بالای لانتانیدها ذکر میشود.
کاربرد اکتینیدها
از آنجایی که اکتینیدها همگی موادی رادیواکتیو هستند، در همین زمینه نیز به کار گرفته میشوند. از این عناصر به عنوان منبع انرژی در مسائل مختلفی همچون «ضربانسازها» (Pacemaker) در قلب و تولید انرژی الکتریکی در دستگاههای فضایی کمک میگیرند. از اورانیوم و پلوتونیوم نیز در نیروگاهها و بمبهای هستهای استفاده میکنند. همچنین، اکتینیدها در ساخت آشکارسازهای دود و «توریهای روشنایی» (Gas Mantles) کاربرد دارند.

جدول تناوبی در کتاب درسی
در کتابهای درسی، جدول تناوبی قدری با تصویر بالا متفاوت است چراکه عناصر لانتان و اکتینیم در خارج از جدول جای گرفتهاند. لازم به ذکر است که هر دو تصویر صحیح هستند اما سعی بر این است که شکل بهروز این جدول نیز بررسی شود. با این وجود، در تصویر زیر میتوانید تصویر جدول تناوبی در کتابهای درسی را نیز مشاهده و تفاوتهای این دو را بررسی کنید.
سوالات متداول پیرامون جدول تناوبی عناصر
در این مطلب به سوالات مختلفی پاسخ دادیم اما در ادامه، دو مورد از مهمترین سوالات متداول پیرامون این موضوع را بررسی میکنیم.
جدول تناوبی عناصر چیست؟
جدول تناوبی، تمامی عناصر کشف شده را شامل میشود. این جدول در هفت دوره تناوب افقی، با ترتیبِ عدد اتمی، چیده شده است و لانتانیدها و اکتیندها به صورت جداگانه در زیر تناوبها با طول متفاوت آورده شدهاند.
چطور جدول تناوبی را حفظ کنیم؟
با توجه به اینکه برای هر دانشآموز و دانشجوی شیمی، حفظ کردن جدول تناوبی از جمله دغدغههای همیشگی به شمار میآید، روشهای مختلفی برای حفظ کردن این جدول وجود دارد. این روشها از دشوار به ساده دستهبندی شدهاند که در این مطلب به طور کامل به آنها پرداخته شده است.
در صورتیکه نوشته بالا برای شما مفید بوده است، آموزشهای زیر از سایت و مجله فرادرس به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش مدل سازی انواع ساختار مولکولی با HyperChem (هایپرکم)
- اکسید چیست ؟ — بررسی رفتار شیمیایی اکسیدهای فلزی و نافلزی
- آب سخت چیست؟ — به زبان ساده
^^












راستش باگ ریزیه ولی تو جدول تناوبی اول سایت همونی که لگو فرادرس رو پایینش خورده عنصر بریلم رو برلیم نوشتن ☺☻♥
با سلام؛
از ارائه بازخورد شما بسیار سپاسگزاریم. شکل نوشتاری غالب، بریلیم است اما نوشتار به صورت «برلیم»، «بریلیوم» و «بریلیم» نیز کاربرد دارد.
با تشکر از همراهی شما با مجله فرادرس
بسیار خوب سپاس.
بسیار عالی است
باسلام
بنده این جدول رو میخواستم چون پایه دهم تجربی هستم ولی 2 یا 3 تا باگ همین الان تو جدولتون پیدا کردم. مثل بحص اکتینید لانتانید ها و شبه فلزات
لطفا درست کنید و دوستان هم پایه مراقب باشند چون همچنین مشکلاتی جدول(با وجود کیفیت بسیار بالا) دارد!
با سلام؛
توضیحات کاملی راجع به بحث اکتینیدها و لانتانیدها و مقایسه آن با کتاب درسی در همین مطلب آورده شده است. در برخی منابع، لانتان و اکتینیم در داخل جدول و برخی منابع قدیمیتر، این دو عنصر را پایین جدول جای دادهاند. متن نوشته شده صحیح است.
با تشکر از همراهی شما با مجله فرادرس
سلام خسته نباشيد!
خيلي ممنون !
عكس جدول تناوبي رو كه با كيفيت بالا گذاشتيد قابل انتشار هستش ؟
يعني ميشه انتشار داد؟
من ميخوام علامت فرادرس را از گوشه عكس پاك كنم اما در مشخصات حتما ذكر ميكنم منبع فرادرس هستش
با تشكر از شما☺
سلام، وقت شما بخیر؛
برای دریافت پاسخ این موضوع لطفاً به صفحه «شرایط استفاده از مجله فرادرس» رجوع کنید.
سلام ببخشید چرا بعضی از عناصر جدید تازه شناخته شده مورد تایید آیوپاک قرار نمیگیرند؟
سلام خسته نباشید
میشه بگید عناصر هایی که در گروه لانتانید ها واکتینید ها هستند در کدام گروه جدول طبقه بندی میشوند؟
سلام دوست عزیز عناصر مشترک چوب و فلز چی هست (عنصر هایی از چوب را میخوام که باعث تقویت فلز میشه
با سلام؛
در پاسخ به این سوال میتوان گفت چوب شامل رشتهها (فیبرهای) سلولزی هست و عمده اسکلت آن از ترکیبات کربنی تشکیل شده است. به عبارت دیگر، ساختار چوب از پلی ساکاریدهایی تشکیل شده که واحدهای سازنده آن سلولز هستند که عناصر کربن و اکسیژن و هیدروژن در هر مولکول سلولز به کار رفته است. برای آشنایی بیشتر با تفاوتهای فلز و نافلز، پیشنهاد میکنیم مطلب «فلز و نافلز چیست؟ — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
عالی بود ممنون
علت جدایی لانتانید ها و آکتینید ها از جدول مندلیف چیست؟
با سلام؛
همانطور که در داخل متن نیز به آن اشاره شده است، برای آنکه تمامی عناصر با خواص مشابه، در کنار یکدیگر قرار بگیرند، این دو گروه، خارج از جدول تناوبی چیده شدهاند.
با تشکر از همراهی شما با مجله فرادرس
سلام بسیار آموزیشی
سلام. یک سؤال استاد. استاد این رو نمیتونیم بگیم که در یک گروه ، خاص فیزیک عناصر مشابه است؛ ولی این را میتوان گفت که خواص شیمیایی عناصر مشابه همدیگر است، پس استاد چطور قانون تناوبی میگه که خاصیت هم شیمایی و فیزیکی عناصر در هر تناوب تکرار میشود ؟!؟! من این رو متوجه نمیشوم
با سلام؛
در طول متن به طور کامل در رابطه با قانون تناوب توضیح داده شده است اما برای درک بهتر آن پیشنهاد میکنیم بار دیگر بخش «بیان بهتر قانون تناوب» را مطالعه کنید. با این وجود، قانون تناوب ذکر نمیکند که خواص فیزیکی و شیمیایی در یک تناوب یکسان هستند.
با تشکر از همراهی شما با مجله فرادرس
سلام؛
بینهایت تشکر،
یه پیشنهاد: برای چاپ روی پرینتر سیاه/سفید قابل استفاده نیست، چنانچه مقدور یه نسخه با حالت GrayScale (256 رنگ بین سیاه تا سفید) نیز تدارک ببینید برای فقرای مثل من.
با سلام؛
از پیشنهاد شما بسیار سپاسگزاریم. نسخه GrayScale نیز در متن برای دانلود قرار داده شد.
با تشکر از همراهی شما با مجله فرادرس
سلام چرا باید هیدروژن و هلیوم را در بلوک sقرار بدهیم در صورتی که هیچکدام هیچ ربطی از لحاظ خواص شیمیایی و آرایش الکترونی به این دسته ندارند.
با سلام؛
با توجه به اینکه هیدروژن و هلیوم، هردو دارای یک اوربیتال s هستند میتوان آنها را در بلوک s جای داد.
از همراهی شما با مجله فرادرس سپاسگزاریم
سلام
براساس کربن۱۶ درست است نه اکسیژن ۱۶ اشتباه ببان کردید.
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. همانطور که در متن هم گفته شده است، استوانه مذکور بر اساس وزن اتمی اکسیژن یعنی 15.999u ساخته شده بود.
با تشکر
سلام خسته نباشید
من می خواستم با مفهوم کلی درهم تنیدگی کوانتمی اشنا شم
ایا در سایت فرادرس فیلمی موجود هست که این موضوع رو به زبان ساده شرح بده؟؟؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. برای آشنایی با این موضوع، میتوانید مطلب «درهم تنیدگی کوانتومی — به زبان ساده (+ دانلود فیلم آموزش گام به گام)» را مطالعه کنید.
با تشکر
سلام
لطفا بفرمایید که:
1- نوع پیوند بین فلز با شبه فلز از چه نوعی است؟ کوالانسی یا یونی؟ (یک جایی خوندم فلزها با شبه فلزها واکنش نشان نمی دهند. آیا این حرف، صحیحه؟)
2- نوع پیوند بین نافلز و شبه فلز از چه نوعی است؟ کوالانسی یا یونی؟
3- آیا همه فلزات واسطه در واکنش شیمیایی، الکترون از دست می دهند؟ (اگر پاسخ اینه که بعضی هاشون الکترون میگیرن، بعضی هاشون الکترون میدن؛ لطفا بگید کدوما الکترون میدن و کدوما الکترون میگیرن؟)
مرسی
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. در پاسخ به سوال اول و دوم، نوع پیوند را میتوان به کمک مثل پیوندی تشخیص داد که نحوه محاسبات آن در مطلب «پیوند فلزی — به زبان ساده» آورده شده است. در رابطه با سوال سوم هم میتوانید به مطلب «عناصر واسطه و خصوصیات آنها — از صفر تا صد (+ دانلود فیلم آموزش رایگان)» و بخش «عدد اکسایش» مراجعه کنید.
با تشکر
سلام واسه کنکور عنصر های جدول رو تا عدد اتمی 36 حفظ کنیم کافیه ؟
گروپ 4 نمیر اکسدیشن آن -4 و +4 است چرا کاربون که در گروپ چهارم است نمیر اکسیدشن آن 2 هم اس اگه جواب بدهیدممنون تان میشم
با سلام؛
از پیام شما سپاسگزاریم. برای کنکور بهتر است عنصرها را به صورت گروهی حفظ کنید و بعد از یادگیری گروههای جدول تناوبی، روندهای مختلف را نیز یاد بگیرید. تمامی این مطالب در مجله فرادرس وجود دارند و میتوانید از آنها کمک بگیرید که برخی از آنها در زیر آورده شدهاند:
«روشهای کاربردی حفظ کردن جدول تناوبی — به زبان ساده»
«گروه های جدول تناوبی (+ PDF و عکس فارسی)»
با تشکر
سلام ببخشی من در یک جایی دیدم که گفته بود همه ی اتم های دوره 6 و 7 متعلق به گروه 3 است آیا این درسته؟
با سلام؛
اینکه تمامی اتمهای تناوب ۶ و ۷ متعلق به گروه ۳ باشند صحیح نیست. در حقیقت، همانطور که در متن هم به آن اشاره شده است، دو گروه لانتانیدها و اکتینیدها متعلق به تناوب ۶ و ۷ هستند که بیرون از جدول قرار دارند تا با این نوع از چینش عناصر، هر کدام از اتمهای هر تناوب، در گروه مربوط به خود قرار بگیرند.
با تشکر
سلام لطفا میشه بگین چطور میشه فهمیدخواص فیزیکی دو عنصر شبیه هم هستند؟؟؟
از توجه شما سپاسگزاریم.
خواص فیزیکی از جمله خواص قابل اندازهگیری هستند که این خواص را از روشهای مختلفی همچون اسپکتروسکوپی (طیفسنجی) جرمی، پراش اشعه ایکس و … اندازهگیری میکنند. همچنین با توجه به نوع آرایش الکترونی و قرارگیری آنها در جدول تناوبی، تا حدی میتوان به خواص فیزیکی آنها پی برد اما هیچ راه ساده و بدون آزمایشی وجود ندارد تا بتوان بر اساس آن برای خواص فیزیکی یا شیمیایی دو عنصر نظر قطعی داد.
با تشکر
گروه چهاردهم همیشه به اشتراک میذاره ولی چرا قلع و سرب الکترون از دست میدن؟؟؟؟
سلام مگه هلیم جز گاز های نجییب نیست ??♀️پس چرا رنگشو اشتباهی زدید ?
با سلام؛
با کمی دقت میتوان دریافت که رنگ اصلی، نواری رنگی است که در پشت نام عناصر قرار گرفته است.
با تشکر از همراهی شما با مجله فرادرس
از توجه شما سپاسگزاریم.
در میان عناصر گروه چهارده، تنها کربن و سیلیکون الکترونهای خود را به صورت پیوندهای کووالانسی به اشتراک میگذارند. سرب و قلع هر دو فلز هستند و به دلیل فاصله الکترونهای لایه آخر با هسته الکترون از دست میدهند و ترکیبات کاتیونی با بار +4 تشکیل میدهند.
Thanks for all of you.
سلام ba دارای عدد اتمی 56 است با توجه به این که این اتم در لایه ی اخر خود 28 الکترون دارد چرا در ستون دوم و ردیف 6 نوشته شده است؟
لطفا پاسخ دهید
آرایش الکترونی باریم به صورت زیر خواهد بود:
1s22s22p63s23p63d104s24p64d105s25p66s2
این عنصر در لایه ظرفیت خود ۲ الکترون دارد که با از دست دادن (به اشتراک گذاشتن) آنها به آرایش پایدار گاز نجیب قبل از خود میرسد و با توجه به عدد اتمی، آرایش الکترونی و خواص فیزیکی و شیمیایی، در این گروه از جدول تناوبی قرار داده شده است.