هیدروکسید چیست؟ — به زبان ساده + فرمول و کاربرد

هیدروکسید همراه همیشگی شویندههای بهداشتی و مولکولی کوچک با کاربردهای فراوان است. هیدروکسید متدوالترین نامیست که در دنیای شیمی به آنیون $$OH^{-}$$ نسبت داده میشود. این یون منفی از دو عنصر هیدروژن و اکسیژن تشکیل شده است که در آن بهوسیله پیوند کووالانسی کنار هم نگه داشته میشوند. این پیوند شامل یک بار منفی و از سادهترین یونهای چنداتمی با بار $$-1$$ است. یون هیدروکسید جزو تشکیلدهنده بسیاری از نمکها است و بعضی از این نمکها در حلال آبی حل میشوند. بسیاری از ترکیبات سودمند و پرکاربرد در مصارف صنعتی و خانگی حاوی یون هیدروکسید هستند. در این مطلب، به طور مفصل با هم بررسی خواهیم کرد که هیدروکسید چیست و چه کاربردهایی دارد.
یون هیدروکسید چیست ؟
هیدروکسید یک یون چنداتمی است که از دو عنصر هیدروژن و اکسیژن و یک بار منفی تشکیل شده است. به طور کلی به ترکیبی که از آنیون هیدروکسید و یک کاتیونِ همراه تشکیل شده باشد، هیدروکسید گفته میشود. بازهای هیدروکسیدی گروهی از ترکیبات دارای این یون هستند.
بعضی از ترکیبات معروف این یون در زیر آورده شدهاند:
- آمونیوم هیدروکسید
- پتاسیم هیدروکسید
- سدیم هیدروکسید
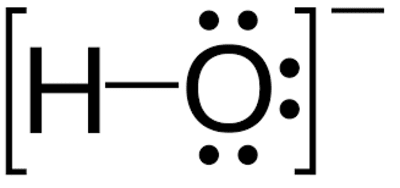
نحوه تشکیل آنیون هیدروکسید
واکنش آبپوشی فلزات قلیایی، رایجترین روش تشکیل هیدروکسید است. برای این واکنش کافی است سدیم فلزی را در مجاورت آب قرار دهیم. در زیر این واکنش آورده شده است.
$$2Na + 2H_2O → 2NaOH + H_2$$
روش دیگری نیز برای تولید هیدروکسید وجود دارد، در این روش با حل شدن نمک اسید ضعیف در آب، هیدروکسید تولید میشود.
آیا هیدروکسید باز است ؟
طبق تعریف، باز آرنیوس مادهای است که در فرآیند حل شدن در آب از خود یون هیدروکسید آزاد میکند. مثالی از باز آرنیوس آمونیاک است که با فرمول $$NH_3$$ نمایش داده میشود.
$$NH_3(g) + H_2O(l) → NH_4^+(aq) + OH^-(aq)$$
یون هیدروکسید در آب حل میشود و بازی بسیار قوی تولید میکند. یونهای هیدروکسید در بسیاری موارد به عنوان باز بهکار گرفته میشوند و در بسیاری واکنشهای خنثی شدن و واکنش اسید-باز دخالت دارند.
کاربرد هیدروکسید چیست ؟
برای ترکیبات شامل این یون کاربردهای زیادی را ذکر میکنند که ازجمله میتوان به فهرست زیر اشاره کرد.
- سود سوزآور یا همان سدیم هیدروکسید در صنایع گوناگون به عنوان باز قوی کاربرد دارد. از این صنایع میتوان به تولید صابون و شوینده، تولید کاغذ و پارچه و فرآیند تصفیه آب اشاره کرد.
- از این ماده برای تمیز کردن فاضلاب استفاده میشود.
- ترکیبات معدنی هیدروکسید فلز مانند لیمونیت به عنوان سنگ معدن آهن درجه پایین مورد استفاده قرار میگیرند.
- از پتاسیم هیدروکسید در کشاورزی استفاده میشود.
- رادیکالهای هیدروکسیل در ترکیبات آلی مانند شکر و چربی (لیپید) یافت میشوند.
- ترکیبات هیدروکسیدی برای پاکسازی هوا بهوسیله جذب گازهای اسیدی مانند کربن دیاکسید و دیاکسید گوگرد مفید هستند.
- تعدادی از هیدروکسیدها مانند آهک ($$Ca(OH)_2$$) برای تولید آمونیاک و کلسیم کربنات ($$CaCO_3$$) مورد استفاده قرار میگیرند.
جدول خواص یون هیدروکسید
در جدول زیر به برخی از خواص یون هیدروکسید اشاره شده است.
| نام | هیدروکسید |
| فرمول شیمیایی | -OH |
| باز مزدوج | آنیون اکسید |
| اسید مزدوج | آب |
| وزن مولکولی (گرم بر مول) | 17 |
| شماره ثبت سیایاس (Cas number) | 14280-30-9 |
بررسی چند نکته کاربردی و ساده
در این قسمت به سراغ چند سوال و نکته میرویم که باید بدانیم.
تفاوت بین OH و HO چیست؟
ممکن است در نگاه اول به نظر ما این دو فرمول یکسان باشند اما اینطور نیست. در واقع تفاوت این دو مولکول در بار آنهاست. به صورتی که HO دارای بار مثبت و در نتیجه کاتیون است. در حالی که OH دارای بار منفی و آنیون است.
نحوه شناسایی یون هیدروکسید
از آنجا که وجود آنیون هیدروکسید بهشدت باعث قلیایی شدن محیط میشود برای پی بردن به وجود یا عدم وجود آن میتوان از شناساگر اسید و باز مانند کاغذ تورنسل استفاده کرد.
خواهیم دید که رنگ قرمز کاغذ تورنسل در حضور هیدروکسید به آبی تبدیل میشود.

هیدروکسید به عنوان لیگاند
یون هیدروکسید لیگاند یا نوکلئوفیل (هستهدوست) است. هر اتم اکسیژن در $$OH^{-}$$ دارای یک جفت الکترون غیرمزدوج در بیرونیترین لایه الکترونی خود است. این الکترون غیرمزدوج به عنوان گیرنده در اختیار اتم هیدروژن قرار میگیرد و بین این دو، پیوندی تشکیل میشود.
آیا هیدروکسید الکل است ؟
خیر، یون هیدروکسید و دیگر ترکیبات هیدروکسیدی الکل نیستند. گروه عاملی هیدروکسیل (OH) با فرمول عمومی ROH ترکیبی آلی است که به نام الکل نیز شناخته میشود و نباید آن را با بازهای معدنی دارای یون هیدروکسید اشتباه گرفت.
فراوانی هیدروکسید در طبیعت
یون هیدروکسید و هیدروکسیدها بهفراوانی در طبیعت یافت میشوند. بسیاری از سنگهای معدنی مانند بوکسیت (هیدروکسید آلومینیوم) و لیمونیت (هیدروکسید آهن) شامل این یون هستند.
ترکیبات هیدروکسیدی
در ادامه به بررسی چند ترکیب دارای آنیون هیدروکسید میپردازیم و ویژگیهای هر یک را بررسی میکنیم.
سدیم هیدروکسید چیست ؟
سدیم هیدروکسید که با نام سود سوزآوز نیز شناخته میشود ترکیبی پرکاربرد در صنعت به طور مثال در تولید شویندههاست. در دمای اتاق سدیم هیدروکسید جامدی سفید رنگ و بدون بو است و واکنش بسیار شدیدی با اسیدهای قوی و آب دارد. در این واکنش گرمای زیادی نیز تولید میشود. حتی امکان دارد پرکهای آن با رطوبت موجود در هوا وارد واکنش شوند. فرمول مولکولی این ماده به صورت $$NaOH$$ است و جرم مولی برابر با ۴۰ گرم بر مول دارد.

روش نگهداری سدیم هیدروکسید
این ماده را باید در ظرفی دربسته و در جای خنک و بهدور از هرگونه آب، رطوبت و مایعات دیگر نگهداری کرد. از آنجا که این ماده خورنده است باید در کار با آن نهایت دقت و ایمنی را در نظر داشت. از هرگونه تماس با چشم باید خودداری کرد زیرا ممکن است باعث نابینایی دائمی فرد شود.
واکنش های سدیم هیدروکسید
در واکنش سدیم هیدروکسید با اسید شاهد یک واکنش خنثی شدن هستیم. برای مثال: در واکنش با هیدروکلریک اسید، سدیم کلرید و آب را به عنوان محصولها خواهیم داشت.
$$NaOH + HCl → NaCl + H_2O$$
برای تایید انجام این واکنش از شناساگر فنول فتالئین استفاده میشود که در اضافه شدن به محلول بازی رنگی زرشکی تولید میکند. با افزودن اسید به محلول سدیم هیدروکسید رنگ زرشکی بهتدریج از بین خواهد رفت.
واکنش سدیم هیدروکسید با فلزها
سدیم هیدروکسید هم با فلزها (روی، آلومینیوم و تیتانیوم) و هم با نافلزها (هالوژنها، گوگرد و فسفر) بهخوبی وارد واکنش میشود. در واکنش سدیم هیدروکسید با آلومینیوم، تترا هیدروکسی آلومینات سدیم ($$H_4AlNaO4$$) و گاز هیدروژن تولید میشود. از این واکنش برای تامین گاز هیدروژن بالونهای هوایی استفاده میشد.
$$2Al + 2NaOH + 6H_2O → 2Na[Al(OH)_4] + 3H_2 $$
واکنش سدیم هیدروکسید با نافلزها
در واکنش سود سوزآور با فسفر، سدیم هیپوفسفیت و فسفین تولید میشوند:
$$4P + 3NaOH + 3H_2O → PH_3 + 3NaH_2PO_2$$
در ادامه، واکنش سدیم هیدروکسید را با گوگرد بررسی خواهیم کرد:
$$3S + 6NaOH → Na_2SO_3 + 2Na_2S + 3H_2O $$
واکنش سدیم هیدروکسید با کلر بستگی به دما دارد. در زیر واکنش اول در حضور منبع گرما و واکنش دوم در دمای اتاق صورت گرفته است:
$$3Cl_2 + 6NaOH → NaClO_3 + 5NaCl + 3H_2O$$
$$Cl_2 + 2NaOH →NaClO + NaCl + H_2$$
پتاسیم هیدروکسید چیست ؟
پتاسیم هیدروکسید مادهای سفید و خورنده با فرمول مولکولی $$KOH$$ است. به طور سنتی این ماده از واکنش بین پتاسیم کربنات و کلسیم هیدروکسید به دست میآمد. در اثر این واکنش، کلسیم کربنات جامد ایجاد میشود و پتاسیم هیدروکسید در محلول آبی باقی میماند. سپس رسوب ایجاد شده را جدا میکنند و با تغلیظ محلول زیری، بلورهای تاسیم هیدروکسید پدیدار میشوند. این روش سنتز در شیمی امروزه تقریبا منسوخ شده است.
پتاسیم هیدروکسید چگونه تولید می شود ؟
با منسوخ شدن روش سنتی، تولید انبوه پتاسیم هیدروکسید به روش الکترولیز صورت میگیرد. در این روش محلولی شامل پتاسیم کلرید در معرض جریان ثابتی قرار داده میشود که در نتیجه آن گازهای کلر و هیدروژن آزاد میشوند و به پتاسیم اجازه واکنش با هیدروکسید را میدهند. گاز کلر از سمت کاتدی و گاز هیدروژن از سمت آندی متصاعد میشود. این واکنش الکترولیزی را به صورت زیر نشان میدهیم:
$$2KCl + 2H_2O → 2KOH + Cl_2 + H_2$$
کاربرد پتاسیم هیدروکسید چیست ؟
این ماده موارد مصرف صنعتی بسیاری دارد که برخی مشابه سدیم هیدروکسید هستند، مانند استفاده در تولید صابون و شوینده. برخی موارد مصرف دیگر این ماده را در ادامه بررسی خواهیم کرد:
- در تولید رنگدانههایی مانند {متیلن بلو} برای فعال کردن مولکولها استفاده دارد.
- برخی از باتریهای قلیایی از پتاسیم هیدروکسید به عنوان الکترولیت استفاده میکنند.
- از این ماده به عنوان پیشماده (Precursor) برای تولید ترکیبات پتاسیمی مانند کودها استفاده میشود.
نگهداری و کار با پتاسیم هیدروکسید
این ماده نیز مانند سدیم هیدروکسید خورنده است و باید در استفاده از آن موارد ایمنی را رعایت کرد. در صورت قورت دادن باعث ایجاد مسمومیت به خصوص در غلظت بالا میشود و خورندگی آن تخریب بافتهای بدن از جمله ریه را در پی دارد.

کلسیم هیدروکسید چیست ؟
کلسیم هیدروکسید با فرمول شیمیایی $$Ca(OH)_2$$ مادهای معدنی با ظاهر سفیدرنگ در حالت جامد و بیرنگ در فرم بلوری خود است. این ماده در نتیجه واکنشهای بسیاری تولید میشود از جمله از ترکیب کلسیم کلرید و سدیم هیدروکسید. مولکولهای کلسیم و هیدروکسید با پیوندی یونی بین دو آنیون $$OH^-$$ و یک کاتیون $$Ca^{2+}$$ این ماده را تشکیل میدهند.
ویژگی های فیزیکی و شیمیایی کلسیم هیدروکسید
برای شناخت بیشتر، بهتر است نگاهی به ویژگیهای این ماده بیندازیم:
- بلورهای این ماده ساختار شش وجهی دارند.
- در نزدیکی دمای نقطه ذوب با از دست دادن آب، تخریب میشود.
- حلالیت این ماده در آب زیاد نیست اما همان مقدار هم با افزایش دما روند نزولی خواهد داشت.
- به مقدار بسیار زیادی در اسید حل میشود.
- در واکنش با کربن دیاکسید، کلسیم کربنات $$(CaCO_3)$$ تشکیل میدهد.
موارد مصرف کلسیم هیدروکسید
با شناخت این ماده، این سوال مطرح میشود که چه کاربردی دارد. در زیر به برخی از این موارد اشاره کوتاهی میکنیم:
- این ماده در فرايند تولید کاغذ برای تبدیل چوب به خمیر چوب کاربرد دارد.
- در آمادهسازی ماده مهم آمونیاک نقش پررنگی را ایفا میکند.
- در محصولات گندزدا و شویندههای مو استفاده میشود.
- این ماده در تنظیم $$pH$$ محیط بهکار گرفته میشود.
- در صنعت چرم برای جدا کردن مو و پشم از پوست حیوان کاربرد دارد.
آمونیوم هیدروکسید چیست ؟
آمونیوم هیدروکسید مادهای قلیایی با فرمول شیمیایی $$NH_{4}OH$$ است. محلول آن شامل دو یون $$NH_{4}^{+}$$ و $$OH^-$$ است. به دلیل انحلال پذیری پایین این ماده در آب با وجود $$pH$$ بالا، باز ضعیفی است، زیرا مقدار زیادی از مولکولها دستنخورده باقی میمانند. این مولکول دارای ساختارسه ضلعی هرمی است.
آیا آمونیوم هیدروکسید سمی است ؟
به دلیل وجود آمونیوم با غلظت بالا این ماده سمی است و اگر بخارهای آن استنشاق شوند باعث سوزش مجرای تنفسی خواهد شد. همچنین در مدت طولانی میتواند باعث آسیب به دستگاه عصبی فرد شود. به همین دلیل کسانی که با این ماده سر و کار دارند باید حتما از دستکش، عینک ایمنی، ماسک و لباس مناسب استفاده کنند.
از آمونیوم هیدروکسید چه استفاده ای می شود ؟
این ماده ارزشمند و پرکاربرد موارد مصرف زیادی دارد. در این قسمت به تعدادی از آنها اشاره میکنیم.
- از این ماده در تمیزکنندههای سطوح آشپزخانه و دستشویی استفاده میشود زیرا در از بین بردن چربی و لکه بسیار کارآمد است.
- در صنعت داروسازی مورد استفاده قرار میگیرد.
- به عنوان گاز در سیستم خنک کننده یخچال کاربرد دارد که این به دلیل جذب دمای محیط اطراف، به خود است.
- در تجزیههای معدنی به عنوان باز کاربرد دارد.
- از این ماده در تولید کود کشاورزی آمونیوم نیترات بهره میگیرند. این کود با آزاد کردن نیتروژن موردنیاز برای رشد گیاه، موثر واقع میشود.

نکات تکمیلی
در ادامه این مطلب نکات بیشتری را در مورد هیدروکسید بیان میکنیم:
- از هیدروکسید با نامهای دیگری نیز یاد میشود. مانند: رادیکال هیدروکسی.
- هیدروکسید به عنوان کاتالیست کاربرد دارد.
- در بانک خون از این ماده به عنوان ضد میکروب استفاده میشود.
- از این ماده جهت قلیایی کردن ادرار برای جلوگیری از تشکیل سنگ کلیه استفاده میشود.
جمعبندی
در این مطلب خواص بازی یون هیدروکسید، کاربرد و ویژگیهای آن را مورد بررسی قرار دادیم. یون هیدروکسید یونی چنداتمی با بار منفی است و از اکسیژن و هیدروژن تشکیل شده است. فرمول شیمیایی هیدوکسید به صورت $$OH^{-}$$ نشان داده میشود. رادیکالهای هیدروکسید در بعضی ترکیبات آلی مانند شکر و چربی حضور دارند. برخی از کاربردهای آن در صنایعی مانند کاغذسازی، تولید صابون و شوینده و تولید پارچه است.











That’s great thanks a lot.