حلال قطبی چیست؟ – به زبان ساده + لیست

حلالها ترکیباتی هستند که نقش بسیار مهمی در علم شیمی دارند. این دسته از ترکیبات بستری بسیار مناسب و حیاتی برای انجام بسیاری از واکنشهای شیمیایی هستند. حلالها با توجه به ویژگیهای خود به انواع مختلفی تقسیمبندی میشوند که یکی از مهمترین آنها حلال قطبی است. اتمهای درگیر پیوند شیمیایی در حلال قطبی تفاوت الکترونگاتیوی بالایی با یکدیگر دارند و باعث قطبی شدن ساختار میشوند. به دلیل اهمیت و کاربرد فراوان این ترکیبات شیمیایی آشنایی با انواع و نحوه استفاده از آنها برای دانشجویان شیمی و فعالین در این حوزه ضروری و راهگشا است.
در این مطلب از مجله فرادرس ابتدا میخواهیم به نقش حلال در محلول بپردازیم و رابطه آن را با دیگر اجزا بسنجیم. سپس انواع حلال بهخصوص حلال های قطبی را بررسی میکنیم و مثالهایی از آن نیز ارائه خواهیم کرد. در ادامه به تفاوتهای این حلال با حلال ناقطبی اشاره میکنیم و در نهایت نیز تعدادی مثال و تمرین را حل خواهیم کرد.
حلال قطبی چیست ؟
«حلال قطبی» (Polar Solvent) حلالی است که گشتاور دوقطبی بزرگی دارد. در این دسته از حلالها، پیوندهایی وجود دارد که اتمهای سازنده آن با یکدیگر تفاوت «الکترونگاتیوی» (Electronegativy) بالایی دارند. برای داشتن درک بهتری بر این مفهوم بهتر است ابتدا با برخی از مفاهیم پایهای مانند چیستی حلال و حلشونده آشنا شویم. از همین رو مرور مختصری بر آنها خواهیم داشت.
حلال چیست؟
«حلال» (Solvent) را میتوان هر مادهای دانست که حلشونده را در خود حل میکند و به این طریق محلولی را به وجود میآورد. حلالها بهطور معمول به حالت فیزیکی مایع هستند، اما جامدها، گازها و «سیالهای فوقبحرانی» (Supercritical fluid) نیز میتوانند در نقش حلال باشند. آب حلالی از نوع قطبی است و پرکاربردترین حلال در صنایع و آزمایشگاه نیز به شمار میرود.
حلشونده چیست؟
«حلشونده» (Solute) مادهای است که در حلال حل میشود و محلول را به وجود میآورد. در یک محلول، جزئی که مقدار بیشتری را به خود اختصاص میدهد حلال و جزء دیگر که در مقدار کمتری حضور دارد، حلشونده نام دارد. حلشوندهها نیز مانند حلال میتوانند به حالتهای فیزیکی متفاوت حضور داشته باشند که در ادامه به آنها میپردازیم.
- حلشونده گازی: حلشوندهای که گاز است، میتواند در حلال جامد، مایع و گازی حل شود. مثالی از حلشونده گاز در حلال جامد، حل شدن هیدروژن در فلزی مانند پالادیوم است.
- حلشونده مایع: در صورتی که حالت فیزیکی حلشونده مایع باشد، توانایی حل شدن در حلال مایع و جامد را دارد. حلشوندهای مانند جیوه در حلال طلا، حل میشوند و آمالگامی را به وجود میآورد.
- حلشونده جامد: حلالهای مایع و جامد برای حل کردن حلشونده جامد مناسب هستند. مثال بسیار متدوالی از حلشونده جامد در حلال مایع، حل شدن شکر در آب است.
انحلالپذیری چیست؟
«انحلالپذیری» (Solubility) را میتوان بهصورت تمایل مادهای شیمیایی برای حل شدن در حلال و تولید محلول تعریف کرد. در یک محلول حلشونده میتواند بهصورت مایع، جامد یا گاز باشد. همچنین حلالهای با توجه به مولکولهای سازنده خود به انواع مختلفی طبقهبندی میشوند.
عوامل متعددی میتوانند روی انحلالپذیری یک ماده اثر بگذارند. برای مثال در مورد برخی از جامدات محلول در آب، انحلالپذیری با افزایش دما، افزایش پیدا خواهد کرد. دلیل این امر این است که افزایش دما باعث بالا رفتن انرژی جنبشی میشود که آن نیز به شکستن مولکولهای حلشونده کمک میکند. از دیگر عوامل تاثیرگذار بر انحلالپذیری میتوان به فشار و ماهیت واکنشدهندهها اشاره کرد.
در یک دمای خاص، «محلول اشباع» (Saturated Solution) به محلولی گفته میشود که بیشینه مقدار ممکن از حلشونده را در خود حل کرده باشد، بهصورتی که هرچه حلشونده بیشتری اضاف کنیم، بهصورت دست نخوده باقی میماند و حل نمیشود. «محلول غیراشباع» (Unsaturated Solution) نیز محلولی است که مقدار حلشونده آن کمتر از مقدار اشباع است و میتوان مقدار بیشتری از حلشونده را در آن حل کرد.
حلال ناقطبی چیست؟
«حلال ناقطبی » (Non Polar Solvent) دارای پیوندهایی شیمیایی است که اتمهای درگیر در آن الکترونگاتیوی نزدیک به یکدیگر دارند. برای مثال میتوان به پیوند بین عنصر کربن و هیدروژن اشاره کرد که سازنده هیدروکربنها هستند و به آنها ویژگی ناقطبی بودن میدهد. این دسته از ترکیبات به دلیل تشابه مقدار الکترونگاتیوی روی خود فاقد باز جزئی هستند و همین مورد نیز آنها را ناقطبی میسازد. در تصویر زیر ساختار سه مورد از حلالهای ناقطبی را مشاهده میکنید.
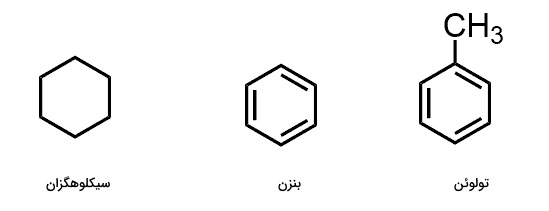
ثابت دیالکتریکی حلالهای ناقطبی کوچک و کمتر از ۵ است و به همین دلیل حلال خوبی برای گونههای باردار مانند آنیونها نیستند. موردی استثنا در این مورد دیاتیل اتر با فرمول شیمیایی $$Rt_2O$$ است که حلال «واکنش گرینیارد» (Gringnard Reaction) است. زوجالکترونهای ناپیوندی آن نقش باز لوییس را ایفا میکنند و به حل شدن کاتیون منیزیم کمک خواهند کرد. در فهرست زیر به برخی از حلالهای ناقطبی اشاره کردهایم.
- پنتان با ثابت دیالکتریک ۱٫۸
- هگزان با ثابت دیالکتریک ۱٫۹
- سیکلوهگزان با ثابت دیالکتریک ۲
- بنزن با ثابت دیالکتریک ۲٫۴
- تولوئن با ثابت دیالکتریک ۲٫۳
- کلروفرم با ثابت دیالکتریک ۴٫۸
- دیاتیل اتر با ثابت دیالکتریک ۴٫۸
تشخیص حلال قطبی از ناقطبی
برای اینکه بدانیم حلالی قطبی است یا خیر میتوانیم به مقدار «ثابت دیالکتریک» (Dielectric Constant) آن مراجعه کنیم. هر چه مقدار ثابت دیالکتریک حلالی بیشتر باشد، قطبیت آن نیز افزایش پیدا خواهد کرد. همچنین میتوان گشتاور دوقطبی حلال را نیز اندازهگیری کرد.
میدانیم که آلکانها، برای مثال پنتان، ناقطبی هستند و از آب نیز به عنوان معروفترین حلال قطبی یاد میشود. با این حال توجه داشته باشید که مواردی نیز وجود دارد که در مرز این دو مفهوم قرار دارند. برای مثال «دیاتیل اتر»، «دیکلرو متان» و «تتراهیدرو فوران» بهطور همزمان ویژگی قطبی و ناقطبی از خود به نمایش میگذارند. در عمل میتوان از این نکته برای تشخیص قطبیت حلالها استفاده کرد: در صورتی که حلالی با آب «امتزاجپذیر» (Miscible) باشد، آن را قطبی میدانیم.
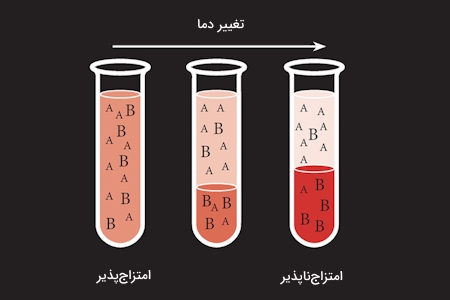
از این مورد میتوان به تتراهیدرو فوران، دیمتیل سولفوکسید، استونیرتیل، دیمتیل فرمامید و استون اشاره کرد. در صورتی که حلالی در عمل با آب، امتزاجپذیر نباشد، مانند دیکلرو متان و دیاتیل اتر، آن را ناقطبی میدانیم. در جدول زیر به تعدادی از مهمترین تفاوتهای این دو نوع حلال اشاره کردهایم که میتوان از آن برای تشخیص آنها استفاده کرد.
| حلال قطبی | حلال ناقطبی |
| دارای گشتاور دوقطبی بالایی هستند. | گشتاور دوقطبی آنها کم است. |
| ترکیبات قطبی را در خود حل میکنند. | ترکیبات ناقطبی را در خود حل میکنند. |
| مقدار ثابت دیالکتریک آنها زیاد است. | دارای مقدار ثابت دیالکتریک پایینی هستند. |
| شاهد جدایی بار در آنها هستیم. | در آنها جدایی بار رخ نمیدهد. |
| اتمهای سازنده آن اختلاف الکترونگاتیوی بالایی دارند. | اختلاف الکترونگاتیوی اتمهای سازنده آن کم است. |
| دارای پیوندهای قطبی هستند. | پیوندهای آنها ناقطبی است. |
انواع حلال قطبی
حلال های قطبی ترکیبات بسیار متنوعی را شامل میشوند. با توجه به ویژگی های این دسته از ترکیبات میتوان آنها را در یکی از دو گروه زیر گنجاند. این دستهبندی برای حلالهایی که ثابت دیالکتریک آنها بالای ۱۵ باشد، قابل ارائه است.
حلال قطبی پروتیک
«حلال قطبی پروتیک» (Protic Polar Solvent) حلالی است که در ساختار خود دارای پیوند اکسیژن و هیدروژن یا نیتروژن و هیدروژن باشد. این نکته از این نظر اهمیت دارد که حلال های قطبی پروتیک میتوانند در پیوند هیدروژنی شرکت کنند که باعث به وجود آمدن نیروی بینمولکولی قوی میشود. به علاوه این پیوندها میتوانند منبعی از یون هیدروژن باشند. این حلالها میتوانند به عنوان اسید و نوکلئوفیلهایی ضعیف نیز نقش ایفا کند. این دسته از حلالها از تنوع بالایی برخوردارند و در فهرست زیر به تعدادی از آنها اشاره کردهایم.
- آمونیاک با ثابت دیالکتریک ۲۵
- بوتانول با ثابت دیالکتریک ۱۲
- پروپانول با ثابت دیالکتریک ۲۰
- اتانول با ثابت دیالکتریک ۲۵
- متانول با ثابت دیالکتریک ۳۳
- استیک اسید با ثابت دیالکتریک ۶٫۲
- آب با ثابت دیالکتریک ۸۰
حلال قطبی آپروتیک
«حلال قطبی آپروتیک» (Aprotic Polar Solvent) حلالی است که در ساختار خود فاقد پیوند هیدروژن و نیتروژن یا هیدروژن و اکسیژن است و به همین دلیل نمیتوانند پیوند هیدروژنی تشکیل دهند. این نکته مهمترین تفاوتی است که بین حلال قطبی پروتیک و آپروتیک وجود دارد.
در عمل تفاوت این دو حلال در «واکنش جانشینی» (Substitution Reaction) مشخص خواهد شد زیرا در آن پیوند هیدروژنی حلال باعث کاهش واکنشپذیری نوکلئوفیل درگیر در واکنش شیمیایی میشود. در شیمی چهار حلال قطبی آپروتیک بسیار مهم وجود دارند که در بخش بعدی به آنها میپردازیم. در تصویر زیر سه نمونه ساختار از حلالهای قطبی آپروتیک را آوردهایم.
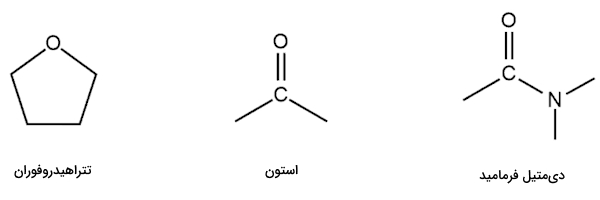
این حلالها همگی دارای ثابت دیالکتریک بالای ۲۰ هستند و گشتاور دوقطبی آنها نیز بالا است، با این حال همچنان به دلیل عدم وجود پیوند نیتروژن و هیدروژن یا اکسیژن و هیدروژن در پیوند هیدروژنی شرکت نمیکنند. قطبیت بالای آنها این اجازه را میدهد تا گونههای باردار مانند آنیونهای مختلف و نوکلئوفیلها را در خود حل کنند. عدم حضور پیوند هیدروژنی به این معناست که نوکلئوفیلها در آن آزاد هستند و واکنشپذیری بالایی دارند. در فهرست زیر به این چهار حلال اشاره کردهایم. همانطور که مشاهده میکنید مقدار ثابت دیالکتریک آنها بالاست.
- استون با ثابت دیالکتریک ۲۱
- دیمتیل فرمامید با ثابت دیالکتریک ۳۸
- استونیتریل با ثابت دیالکتریک ۳۷
- دیمتیل سولفوکسید با ثابت دیالکتریک ۴۷
حلال های قطبی آپروتیک مرزی
این دسته از حلالها، گشتاور دوقطبی پایینی دارند و ثابت دیالکتریک آنها نیز کم و در بازه زیر ۱۰ قرار دارد. مقدار ثابت دیالکتریک آنها از حلالهای ناقطبی بیشتر و از حلال های قطبی کمتر است. همچنین به دلیل عدم حضور پیوند اکسیژن و هیدروژن یا نیتروژن و هیدروژن به دسته حلالهای آپروتیک تعلق دارند. از این حلالها برای اهداف کلی استفاده میشود، یعنی برای مواردی که نمیخواهیم حلال در واکنش شرکتی داشته باشد و تنها محیط و بستری برای انجام آن به حساب میآید. در فهرست زیر تعدادی از حلال های قطبی آپروتیک را آوردهایم. توجه کنید که مقادیر ثابت دیالکتریک تمامی آنها زیر ۱۰ است.
- دیکلرو متان با ثابت دیالکتریک ۹٫۱
- تتراهیدرو فوران با ثابت دیالکتریک ۷٫۵
- اتیل استات با ثابت دیالکتریک ۶
مثال حلال قطبی
تا اینجا با حلال قطبی و ناقطبی آشنا شدیم و تفاوتهای آنها را بررسی کردیم. در هر مورد نیز به معرفی تعدادی از آنها بهصورت مختصر پرداختیم. در این بخش میخواهیم چند حلال مهم و کاربردی قطبی را با جزئیات مورد بررسی قرار دهیم.
آب
آب ماده شیمیایی بیرنگ و شفاف است و نقش بسیار مهمی در حفظ حیات در سیاره زمین دارد. فرمول شیمیایی این حلال بهصورت $$H_2O$$ است، یعنی از دو اتم هیدروژن و یک اتم اکسیژن تشکیل شده است که به کمک پیوند کووالانسی کنار یکدیگر قرار دارند. این حلال در دمای ۰ درجه سانتیگراد منجمد میشود و یخ جامد را به وجود میآورد. همچنین نقطه جوش آن در ۱۰۰ درجه سانتیگراد است که در آن تبدیل به بخار آب میشود. در تصویر زیر ساختار این حلال بسیار رایج را مشاهده میکنید.
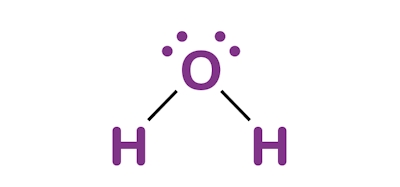
آب رایجترین حلالی است که در صنایع و آزمایشگاه به کار میرود زیرا توانایی حل کردن طیف وسیعی از ترکیبات شیمیایی آلی و معدنی را دارد. این ماده میتواند بسیاری از گازها مانند اکسیژن و کربن دیاکسید را نیز در خود حل کند. همچنین بسیاری از ترکیبات موجود در بدن جانداران مانند پروتئينها و دیانای $$(DNA)$$ در آب حل شدهاند. ترکیبات شیمیایی آبگریز مانند آلکانها و چربیها در آب حل نمیشوند. همچنین ترکیباتی مانند اکسیدها و سولفیدها نیز در آب نامحلول هستند.
اتانول
اتانول که از آن با عنوان «اتیل الکل» نیز یاد میشود، یکی از سادهترین ساختارهایی است که در خود گروه عاملی الکل دارد. فرمول شیمیایی این ماده بهصورت $$C_2H_5OH$$ و دارای هیدروژن، کربن و اکسیژن است. این ماده مایعی بیرنگ و فرار با بویی مخصوص به خود است. در تصویر زیر ساختار این حلال را مشاهده میکنید که در آن اتمهای کربن دارای هیبریداسیون $$sp^3$$ هستند.
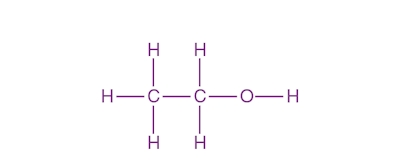
اتانول به دلیل داشتن گروه هیدروکسیلی مولکولی قطبی به شمار میرود و میتواند با مولکولهای دیگر پیوند هیدروژنی تشکیل دهد، به همین دلیل حلال بسیار خوبی برای مولکولهای قطبی خواهد بود.
متانول
متانول سادهترین عضو خانواده الکلها با فرمول شیمیایی $$CH_3OH$$ است که در آن یک گروه متیلی دارای گروه عاملی هیدروکسیل است. بوی این الکل ملایمتر و شیرینتر از بوی اتانول است. این ماده بیرنگ است و فراریت بالایی دارد. حلال متانول دارای جرم مولکولی برابر با ۳۱ گرم بر مول و نقطه جوشی برابر با ۶۴٫۶ درجه سانتیگراد است. در تصویر زیر میتوانید ساختار این حلال قطبی را مشاهده کنید.
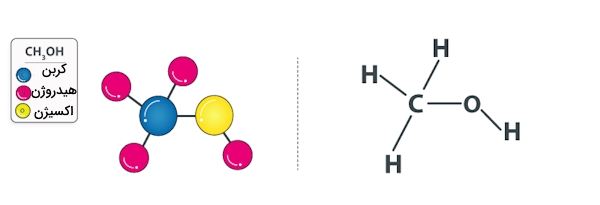
امروزه متانول از ترکیب گاز کربن مونوکسید و هیدروژن و در حضور یک کاتالیزور تولید میشود و کاربرد وسیعی به عنوان حلال آزمایشگاهی دارد.
دیمتیل فرمامید
دیمتیل فرمامید، مولکولی با فرمول $$C_3H_7NO$$ است که به اختصار با $$DMF$$ نمایش داده میشود. این مایع بیرنگ با آب و بیشتر مایعات آلی امتزاجپذیر است. در واکنشهای شیمیایی از این ماده بهوفور به عنوان حلال استفاده میشود. دیمتیل فرمامید حلالی قطبی و آپروتیک است، یعنی توانایی تشکیل پیوند هیدروژنی را ندارد. نقطه جوش این ماده بالاست و استفاده از آن انجام واکنشهای شیمیایی با مکانیسم $$S_N2$$ را تسهیل میکند. در تصویر زیر ساختار شیمیایی این ماده را مشاهده میکنید.
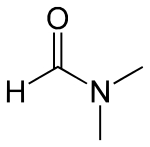
یکی از مهمترین واکنشهایی که برای انجام آن از دیمتیل فرمامید استفاده میشود، «کوپلینگ پپتید» (Peptide Coupling) است که در صنایع داروسازی، تولید چرم و تولید چسب و پوشش بسیار به کار میآید.
دیمتیل سولفوکسید
دیمتیل سولفوکسید یا به اختصار $$DMSO$$ مایعی بیرنگ و آلی است که به شدت قطبی است. این حلال دارای فرمول شیمیایی $$C_2H_6OS$$ است و در سال ۱۸۶۶ برای اولین بار کشف شد. ثابت دیالکتریک این حلال بسیار بالاست و به همین دلیل حلال مناسبی برای مولکولهای قطبی و ناقطبی به شمار میرود. جرم مولکولی دیمتیل سولفوکسید برابر با ۷۸٫۱۳ گرم بر مول و نقطه جوش آن نیز برابر با ۱۸۹ درجه سانتیگراد است. در تصویر زیر ساختار این حلال پرکاربرد را مشاهده میکنید.
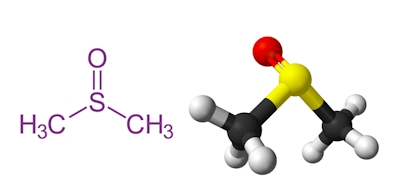
استونیتریل
استونیتریل مولکولی آلی و فرار با فرمول شیمیایی $$C_2H_3N$$ است. این ماده بویی شبیه به هیدروکربنهای آروماتیک دارد و بیرنگ است. این مایع در آب حل میشود و خود حلالی قطبی و آپروتیک است که ساختار آن را در تصویر زیر آوردهایم.
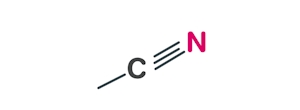
جرم مولکولی این حلال برابر با ۴۱٫۰۵۳ گرم بر مول است و در دمای ۸۱٫۳ درجه سانتیگراد به جوش میآید. از این حلال در فرآیند استخراج هیدروکربنها و برای جداسازی اسیدهای چرب از روغنهای گیاهی استفاده میشود. استونیتریل حلال خوبی برای سلولهای الکتروشیمیایی و در سنتز ترکیبات دارویی به شمار میرود.
در هنگام کار با این ماده باید موارد ایمنی را رعایت کرد و حتما دستکش به دست داشت زیرا جذب آن از طریق پوست باعث ایجاد مسمومیت میشود. این ماده همچنین بسیار اشتعالپذیر است و با سوختن از خود گازهای سمی تولید میکند. این حلال را باید به دور از عوامل اکسیدکننده نگهداری کرد زیرا میتواند باعث ایجاد انفجار شود.
استون
استون که «۲-پروپانون» و «دیمتیل کتون» نیز نامیده میشود، مولکولی آلی با فرمول شیمیایی $$(CH_3)_2CO$$ است. این مایع بیرنگ، فرار و اشتعالپذیر است. استون با آب امتزاجپذیر است و میتواند به عنوان حلالی آلی در صنعت به کار رود. ساختار این حلال دارای گروه عاملی کربونیل را میتوانید در تصویر زیر مشاهده کنید.
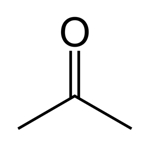
حدود ۳۰٪ استون مورد استفاده در جهان به عنوان حلال به کار میرود. این حلال قطبی و آپروتیک است و در واکنشهایی با مکانیسم $$S_N2$$ از آن بهره میبرند. همچنین به دلیل قیمت پایین و فراریت بالا به عنوان حلال شوینده ظروف آزمایشگاهی نیز از آن استفاده میشود.
حلال آلی چیست؟
«حلال آلی» (Organic Solvent) حلالی است که در ساختار خود بهطور عمده از اتمهای کربن تشکیل شده باشد و از آن برای حل کردن مواد متفاوت برای به دست آوردن محلول استفاده میشود. مورد کاربرد دیگر این دسته از حلالها در استخراج است که در آن یک ماده را از ماده دیگری جدا میکنند. «بنزن» (Benzene) یکی از متدوالترین حلالهای آلی است که از حلقهای با ۶ اتم کربن تشکیل میشود. در تصویر زیر ساختار آن را مشاهده میکنید.
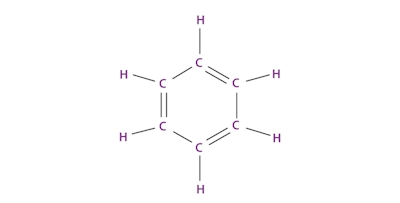
در این دسته از حلالها همیشه شاهد حضور پیوند کربن-کربن و تعدادی هیدروژن هستیم. در مواردی در آنها هترواتمهایی مانند نیتروژن، اکسیژن و هالوژن نیز مشاهده میشود. در یک تقسیمبندی میتوان آنها را به حلال آلی طبیعی و حلال آلی سنتزی طبقهبندی کرد. تفاوت این دو این است که حلالهای طبیعی در طبیعت وجود دارند اما حلالهای آلی سنتزی طی واکنشهای شیمیایی و از واکنشدهندههای متفاوتی به وجود میآيند.
انواع حلال آلی
متدوالترین طبقهبندی که برای حلالهای آلی وجود دارد را در این بخش مورد بررسی قرار میدهیم. این طبقهبندی بهطور عمده بر اساس ساختار و گروه عاملی موجود در آنها به وجود آمده است.
حلال آلی آلیفاتیک
«حلالهای آلی آلیفاتیک» (Aliphatic Organic Solvents) هیدروکربنهایی غیرحلقوی و معمولا در طبیعت بهصورت ناقطبی هستند. از این دسته از حلالها در تولید رنگ، استخراج، پلیمریزاسیون، صنایع چسب و دارویی استفاده میشود.
حلال آلی آروماتیک
«حلالهای آلی آروماتیک» (Aromatic Organic Solvents) نیز مانند حلالهای آلی آلیفاتیک ناقطبی هستند و کاربرد آنها نیز در موراد بسیاری مشابه یکدیگر است.

حلال آلی کربونیلی
«حلالهای آلی کربونیلی» (Carbonyl Organic Solvents) در ساختار خود دارای گروه عاملی استر هستند. برخلاف دو دسته دیگر حلالهای آلی، این حلالها از خود ویژگی حلال های قطبی را نشان میدهند و از آنها به عنوان پاککننده در صنایع الکتریسیته و مدارها استفاده میشود. از کاربردهای دیگر حلال آلی کربونیلی میتوان به از بین بردن لاک ناخن و کاربرد در ترکیبات طعمدهنده غذا اشاره کرد.
حلالهای دیگری نیز به دسته حلالهای آلی تعلق دارند که برای مثال میتوان به الکلها اشاره کرد. در بخش پیش رو میخواهیم به بررسی برخی از ویژگیهای این دسته از ترکیبات بپردازیم.
ویژگیهای حلال آلی
در فهرست زیر به ۳ مورد از مهمترین ویژگیهای این دسته از ترکیبات اشاره کردهایم.
- حلالهای آلی فرار هستند. همانطور که میدانید به حلالی فرار گفته میشود که توانایی تبخیر شدن را داشته باشد. دلیل معطر بودن حلالهای آلی نیز داشتن همین ویژگی است.
- حلالهای آلی نقطه جوش پایینی دارند که همین ویژگی باعث میشود توانایی تبخیر و ایجاد بو را داشته باشند.
- این دسته از حلالهای مایعاتی بیرنگ هستند و جرم مولکولی پایینی نیز دارند.
کاربرد حلال آلی
از این دسته از حلالها در زمینههای بسیار متنوعی استفاده میشود. برای مثال از حلال آلی تولوئن به عنوان پاککننده و رقیقکننده رنگ و پوشش بهره میبرند. در محصولاتی که برای پاک کردن لاک ناخن هستند، ترکیباتی مانند استون، اتیل استات و متیل استات وجود دارند. همچنین در بسیاری از سنتزهای شیمیایی از حلال آلی برای ایجاد بستری مناسب استفاده میشود. از دیگر کاربردهای حلالهای آلی میتوان به لکهبری و استفاده در صنایع عطر و ادکلن اشاره کرد.

ایمنی حلالها
حلالها نیز مانند دیگر مواد شیمیایی دارای ویژگیهای منحصر به خود هستند و میتوانند در مواردی خطرآفرین نیز باشند. بنابراین نیاز است که در هنگام کار با آنها موارد ایمنی را رعایت کنیم تا امکان ایجاد حادثه ناگوار و آسیب به کمترین مقدار ممکن برسد. در ادامه به چند مورد برای رعایت ایمنی خواهیم پرداخت.
اشتعالپذیری
همانطور که پیش از این گفتیم بسیاری از حلالها فرار هستند و به شدت «اشتعالپذیر» (Flammable) به شمار میروند. در این مورد تعدادی از حلالهای دارای عنصر کلر، مانند دیکلرو متان و کلروفرم استثناء به شمار میروند. در صورتی که حلالی فرار باشد، ترکیب بخارهای آن با هوا میتواند باعث ایجاد انفجار شود. بخار حلال از هوا سنگینتر است و نسبت به آن در لایه پایینتری قرار میگیرد و میتواند به همین صورت مسافتی طولانی را طی کند. بخارهای حلالها ممکن است در ظرفها و قوطیهای خالی نیز باقی بماند و ریسکی برای ایجاد آتش باشد. به همین دلیل بهتر است قوطیهای خالی را به صورت برعکس و با در باز نگهداری کنیم تا عاری از هرگونه بخارات شود.

دو حلال دیاتیل اتر و کربن دیسولفید دارای «دمای خودگیرانش» (Autoignition Temperature) بسیار پایینی هستند که باعث افزایش ریسک ایجاد آتش توسط آنها میشود. دمای خودگیرانش کربن دیسولفید کمتر از ۱۰۰ درجه سانتیگراد است و باید دور از منابع گرما نگهداری شود.
به علاوه برخی از حلالها مانند متانول میتوانند توسط شعلههای کوچک بسوزند. این شعلهها در برخی شرایط نوری قابل مشاهده نیستند، به همین دلیل ممکن است پس از گذشت زمانی قابل توجه متوجه ایجاد آتش شویم و شعله در این زمان به اطراف پخش شود.
تشکیل پروکسید منفجرشونده
ساختارهای اتری مانند دیاتیل اتر و تتراهیدروفوران میتوانند با قرارگیری در معرض اکسیژن و نور، پروکسیدهای آلی را تولید کنند که قابلیت انفجار بسیار بالایی دارند. احتمال تشکیل این پروکسیدها توسط تتراهیدروفوران بیشتر از دیاتیل اتر است. از دیگر حلالهایی که احتمال تشکیل پروکسید را دارند میتوان به دیایزو پروپیل اتر اشاره کرد.
هترواتم اکسیژن تشکیل رادیکال آزاد را پایدار میکند که طی جذب اتم هیدروژن توسط رادیکال آزاد دیگری خواهد بود. رادیکال آزاد با مرکزیت کربن میتواند با مولکول اکسیژن وارد واکنش شود و ترکیبات پروکسیدی را به وجود بیاورد. فرآیند تشکیل ترکیبات پروکسیدی با حضور کمترین مقدار نور سرعت پیدا میکند. با این حال توجه داشته باشید که در تاریکی نیز پیشروی آرامی دارد.
بعد از تشکیل مقدار کافی از ترکیبات پروکسیدی، آنها میتوانند تشکیل بلورهایی را در دهانه ظرف نگهدارنده حلال دهند. در این حالت در صورتی که انرژی کافی در دسترس این رسوب قرار بگیرد، انفجار رخ خواهد داد. این انرژی میتواند در پیچاندن در ظرف برای باز کردن آن نیز تامین شود. تشکیل پروکسید در صنایع مشکلآفرین نیست زیرا یک بهطور معمول یک بطری حلال به سرعت مصرف میشود.
این مشکل بیشتر در آزمایشگاههای تحقیقاتی بروز میکند که ممکن است یک بطری طی چندین سال مصرف شود و فرصت کافی برای تشکیل پروکسید وجود دارد. بنابراین در این مورد باید همیشه تنها مقدار کمی از حلال را تهیه کرد و در صورت باقی ماندن حلالهایی که مستعد تشکیل پروکسید هستند نیز، بهتر است مقدار اضافی آن را در زمانی کوتاه از محیط خارج کرد.

همچنین باید حلالهای اتری را در ظرفی نگهداری کرد که امکان ورود هوا به آن وجود نداشته باشد و تیره باشد تا نور نیز نتواند بر آن اثر بگذارد. در صورتی که حلالی اتر در دست داشته باشیم، میتوانیم به روشهایی به وجود ترکیبات پروکسیدی در آن پی ببریم و از ایجاد انفجار جلوگیری کنیم. در زیر به یکی از این روشها میپردازیم.
در یکی از این روشها میتوان از مخلوط آهن(II) سولفات و پتاسیم تیوسانات استفاده کرد. پروکسید میتواند آهن(II) را به آهن(III) اکسید کند که طی آن شاهد تشکیل رنگ قرمز تیره از کمپلکس آن با تیوسیانات هستیم. همچنین میتوان از روشهای برای از بین بردن این ترکیبات پروکسیدی استفاده کرد. شستشو با محلول آهن(II) سولفات و صاف کردن توسط آلومینا مثالهایی از این روشها هستند.
سلامت انسان
آشنایی با خطراتی که حلالهای مختلف برای انسان دارند از اهمیت بهسزایی برخوردار است و میتواند از بروز آسیبهای جبرانناپذیر جلوگیری کند. بسیاری از حلالها در صورتی که در مقادیر زیاد توسط انسان استشمام شوند، باعث از دست رفتن هوشیاری میشوند و به همین دلیل نیز در علم پزشکی حلالهایی مانند کلروفرم در گذشته به عنوان داروی هوشبری مورد استفاده قرار میگرفت. از جمله خطرات دیگر حلالها میتوان به متانول اشاره کرد. این حلال در صورتی که بلعیده شود، باعث از دست رفتن بینایی و حتی مرگ فرد میشود.
برخی از حلالها هستند که استفاده از آنها روبه کاهش و در برخی موارد ممنوع است. برای مثال حلالیهایی مانند کلروفرم و بنزن میتوانند عامل ایجاد سرطان در بدن فرد باشند. برخی حلالها میتوانند به اجزای بدن مانند کلیه، کبد و سیستم عصبی یا حتی مغز آسیب وارد کنند. به همین دلیل بسیار مهم است که در هنگام کار با این حلالها شرایط محیطی مناسب باشد، یعنی تهویه مناسب وجود داشته باشد تا از استشمام بخارهای آن جلوگیری شود.
آلودگی محیط زیستی
آلودگی خاک ایجاد شده بر اثر نشت حلال یکی از مهمترین روشهایی است که میتواند روی سلامت بدن انسان و دیگران جانداران تاثیر بگذارد. همانطور که میدانید حلالها به راحتی میتوانند جاری شوند و در مسیر خود آلودگی بر جا بگذارند. در این حرکت باعث آلودگی آبهای زیرزمینی نیز میشوند. بنابراین جمعآوری باقیمانده حلالها پس از فرآیندهای شیمیایی از اهمیت بالایی برخوردار است.
مثال و حل تمرین
حال که با انواع حلال های قطبی آشنا شدیم و مورد استفاده هر کدام را بررسی کردیم، در این بخش به بررسی چند مثال به همراه پاسخ تشریحی آن میپردازیم. سپس چند تمرین چندگزینهای را نیز مرور خواهیم کرد.
مثال
در این بخش به بررسی تعدادی مثال میپردازیم که پیرامون مفهوم حلال قطبی هستند. توجه به پاسخ تشریحی آنها در پاسخگویی به سوالهای مشابه کمککننده است.
مثال اول
تفاوت حلال قطبی پروتیک با حلال قطبی آپروتیک در چیست؟
پاسخ
هر دو این حلالها قطبی هستند، یعنی در ساختار خود پیوندهایی دارند که اتمهای درگیر در آن دارای اختلاف الکترونگاتیوی قابل ملاحظهای هستند با این حال در یک مورد با یکدیگر تفاوت دارند. حلال قطبی پروتیک در ساختار خود دارای پیوند اکسیژن با هیدروژن یا نیتروژن با هیدروژن است در حالی که حلال قطبی آپروتیک فاقد این نوع پیوند است. داشتن این پیوند باعث میشود حلال های قطبی پروتیک توانایی تشکیل پیوند هیدروژنی را داشته باشند.
مثال دوم
چرا استفاده از حلال های قطبی پروتیک در واکنشهای جانشینی توصیه نمیشود؟
پاسخ
همانطور که میدانید حلال های قطبی پروتیک نوعی از حلال هستند که در ساختار خود پیوند اکسیژن با هیدروژن یا نیتروژن با هیدروژن دارند. به همین دلیل نیز توانایی تشکیل پیوند هیدروژنی را دارند. تشکیل پیوند هیدروژنی میتواند از قدرت نوکلئوفیل بکاهد و روند انجام واکنش جانشینی را کند یا مختل کند.
مثال سوم
کدام ماده است که رایجترین حلال جهانی به شمار میرود؟
پاسخ
آب حلالی است که بسیاری از ترکیبات را در خود حل میکند. در واقع توانایی حل کردن این حلال، از تمامی حلالهای دیگر بیشتر است. به علاوه در دسترس بودن و فراوانی آب، آن را تبدیل به حلالی جهانی کرده است.
مثال چهارم
تفاوت محلول اشباع و محلول غیراشباع در چیست؟
پاسخ
در یک دمای مشخص، به محلولی اشباع گفته میشود که بیشینه مقدار ممکن از حلشونده را در خود حل کرده باشد، بهصورتی که با افزودن مقدار بیشتری از حلشونده، بهصورت دست نخوده باقی میماند و حل نمیشود. محلول غیراشباع نیز محلولی است که مقدار حلشونده آن کمتر از حد اشباع باشد و میتوان مقدار بیشتری از حلشونده را در حلال، حل کرد.
مثال پنجم
چرا استون حلال خوبی برای چربی به حساب میآید؟
پاسخ
استون در ساختار خود هم گروه متیل ناقطبی، هم گروه کربونیل قطبی را دارد و از همین رو توانایی حل کردن ترکیبات ناقطبی را نیز دارد. همانطور که میدانید چربی یا لیپید، به دسته ترکیبات ناقطبی تعلق دارد و در استون نیز حل میشود.
مثال ششم
آیا ترکیبات یونی در حلالهای ناقطبی حل میشوند؟
پاسخ
خیر، ترکیبات یونی دارای جدایی بار هستند و به همین دلیل در حلال های قطبی حل میشوند و در حلالهای ناقطبی انحلالپذیر نیستند.
مثال هفتم
در صورتی که مقدار الکترونگاتیوی اتمهای سازنده یک حلال در دست نباشد، از چه روشی به قطبی یا ناقطبی بودن آن پی میبریم؟
پاسخ
در صورتی که اطلاعاتی در مورد الکترونگاتیوی نداشته باشیم، میتوانیم مقدار گشتاور دوقطبی آن را در نظر بگیریم. این کمیت را میتوان در مطالعه تقارن یک مولکول پیدا کرد. با این حال استفاده از مقدار ثابت دیالکتریک، روش بهتری برای یافتن نوع حلال است. هرچه مقدار ثابت دیالکتریک حلالی بیشتر باشد، قطبیت آن نیز بیشتر خواهد بود.
مثال هشتم
آیا تمامی حلالهای آلی، ناقطبی هستند؟
پاسخ
خیر، تمامی حلالهای آلی، ناقطبی نیستند. برای مثال میتوان به حلال استون با فرمول شیمیایی $$C_3H_6O$$ اشاره کرد که آلی است اما قطبی به شمار میآید.
حل تمرین
تا اینجا دانستیم که حلال قطبی چیست و چه ویژگیهایی دارد. در این بخش میخواهیم تعدادی تمرین چندگزینهای را پیرامون مفهوم حلال قطبی مورد بررسی قرار دهیم.
تمرین اول
در یک محلول به جزئی که در مقدار کمتری حضور دارد، ... میگویند.
حلشونده
حلال
ترکیب محلول
حلال قطبی
تمرین دوم
۵ گرم سدیم در ۱۰۰ میلیگرم آمونیاک مایع حل شده است. حلشونده این محلول کدام یک از گزینههای زیر است؟
سدیم
آمونیاک مایع
آب
هیچ کدام
تمرین سوم
حلشوندههای ممکن در یک محلول آبی در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
جامد و مایع
فقط جامد
جامد، مایع و گاز
جامد و گاز
تمرین چهارم
اتانول و اتانوییک اسید هر دو با نسبتهای مختلفی با آب مخلوط میشوند. این ویژگی ... نامیده میشود.
غوطهور شدن
امتزاجپذیری
ترکیب شدن
انحلالپذیری
تمرین پنجم
در یک محلول به جزئی که در مقدار بیشتری حضور دارد، ... میگویند.
حلشونده
جزء اول
حلال قطبی
حلال
تمرین ششم
کدام یک از گزینههای زیر حلالی ناقطبی است؟
استیک اسید
آمونیاک
اتانول
بنزن
تمرین هفتم
مقدار اندکی ید، سدیم کلرید و پتاسیم برمید را در بشری میریزیم که در آن لایهای از آب و لایهای از بنزن وجود دارد. در این صورت ... در لایه آبی حل خواهد شد.
پتاسیم برمید و بد
فقط ید
فقط سدیم کلرید
سدیم کلرید و پتاسیم برمید
تمرین هشتم
آب و اتانول با یکدیگر ... هستند، بنابراین ... حضور آنها را با چشم تشخیص داد.
امتزاجناپذیر، میتوان
امتزاجپذیر، نمیتوان
امتزاجناپذیر، نمیتوان
امتزاجپذیر، میتوان
تمرین نهم
عبارت «شبیه شبیه را در خود حل میکند» به چه معناسیت؟
حلالهای گازی، حل شوندههای گازی را در خود حل میکنند.
حلالهای مایع، حل شوندههای مایع را در خود حل میکنند.
حلالهای قطبی، ترکیبات قطبی و حلالهای ناقطبی، ترکیبات ناقطبی را در خود حل میکنند.
حلالهای جامد، حل شوندههای جامد را در خود حل میکنند.
تمرین دهم
در جدول زیر اطلاعاتی مربوط به انحلالپذیری ۳ ترکیب ناشناس در آب و هگزان داده شده است. با توجه به آن کدام یک از گزینههای زیر صحیح است؟
| ماده | انحلالپذیری در هگزان | انحلالپذیری در آب |
| شماره ۱ | بله | خیر |
| شماره ۲ | خیر | بله |
| شماره ۳ | خیر | خیر |
ماده شماره ۱: سدیم کلرید، ماده شماره ۲: یدید، ماده شماره ۳: شن
ماده شماره ۱: یدید، ماده شماره ۲: سدیم کلرید، ماده شماره ۳: شن
ماده شماره ۱: شن، ماده شماره ۲: سدیم کلرید، ماده شماره ۳: یدید
ماده شماره ۱: سدیم کلرید، ماده شماره ۲: شن، ماده شماره ۳: یدید
تمرین یازدهم
بنزن بهطور معمول برای پاک کردن لکههای چربی از روی لباس به کار میرود، زیرا ...
بنزن حلالی ناقطبی و چربی ترکیبی قطبی است.
بنزن حلالی ناقطبی و چربی ترکیبی ناقطبی است.
بنزن حلالی قطبی و چربی ترکیبی قطبی است.
بنزن حلالی قطبی و چربی ترکیبی ناقطبی است.
تمرین دوازدهم
کدام یک از ترکیبات زیر به دسته حلالهای قطبی پروتیک تعلق دارد؟
متیل سولفوکسید
اتانول
استون
دیکلرو متان
تمرین سیزدهم
در یک محلول، جزئی که مقدار بیشتری را به خود اختصاص میدهد ... و جزء دیگر که در مقدار کمتری حضور دارد، ... نام دارد.
حلال، حلشونده
حلشونده، حلال
حلال، محلول
محلول، حلشونده
تمرین چهاردهم
تمامی گزینههای زیر حلال هایی پروتیک هستند، به جز ... که حلالی آپروتیک است.
آمونیاک
استون
اتانول
آب
تمرین پانزدهم
کدام یک از گزینههای زیر حلالی ناقطبی است؟
اتانول
کلروفرم
آب
استیک اسید
تمرین شانزدهم
در ساختار کدام یک از حلالهای زیر گروه عاملی استر وجود دارد؟
محلول نمکی
حلال طبیعی
حلال آلیفاتیک
حلال کربونیلی
تمرین هفدهم
حلالهای فرار، دستهای از حلالهای هستند که توانایی ... دارند.
جاری شدن
حفظ کشش سطحی
تحمل دمای بالا
تبخیر
تمرین هجدهم
انحلالپذیری یک ماده در حلال به کدام یک از گزینههای زیر بستگی دارد؟
دما
فشار
ماهیت حلشونده و حلال
تمامی گزینهها در انحلالپذیری اثرگذار هستند.
تمرین نوزدهم
کدام یک از گزینههای زیر ترکیبی است که در بنزن حل نمیشود؟
نفتالن
آنتراسن
$$C_6H_{12}O_6$$
تمامی گزینهها
تمرین بیستم
در کدام یک از گزینههای زیر مثالی از محلول گازی آورده شده است؟
اکسیژن حل شده در آب
کامفور در نیتروژن گازی
کربن دیاکسید حل شده در آب
هیدروژن در پالادیوم
سوالات متداول
حال که میدانیم حلال قطبی چیست و چگونه از حلال ناقطبی قابل تشخیص است، میخواهیم در این بخش به برخی از مهمترین و پرتکرارترین سوالهای موجود پیرامون آن پاسخ دهیم.
حلال قطبی آپروتیک چیست؟
حلال قطبی آپروتیک حلالی است که در ساختار خود فاقد پیوند هیدروژن با نیتروژن یا هیدروژن با اکسیژن است و به همین دلیل نمیتواند پیوند هیدروژنی تشکیل دهد.
انحلالپذیری چیست؟
انحلالپذیری یک ماده شیمیایی، تمایل آن برای حل شدن در حلال و تولید محلول است.
حلال آلی چیست؟
حلال آلی، حلالی است که ساختار آن بهطور عمده از اتمهای کربن تشکیل شده باشد. بنزن نمونهای از حلالهای آلی است.
حلال ناقطبی چیست؟
حلال ناقطبی دارای پیوندهایی شیمیایی است که اتمهای درگیر در آن الکترونگاتیوی نزدیک به یکدیگر دارند. این دسته از حلالها مقدار ثابت دیالکتریک پایینی نیز دارند.
حلال قطبی پروتیک چیست؟
حلال قطبی پروتیک حلالی است که در ساختار خود دارای پیوند اکسیژن با هیدروژن یا نیتروژن با هیدروژن باشد به همین دلیل حلال های قطبی پروتیک میتوانند در پیوند هیدروژنی شرکت کنند که باعث به وجود آمدن نیروی بینمولکولی قوی میشود.
تفاوت حلال قطبی با ناقطبی چیست؟
هر چه مقدار ثابت دیالکتریک حلالی بیشتر باشد، قطبیت آن نیز افزایش پیدا خواهد کرد، بنابراین مقدار ثابت دیالکتریک حلال های قطبی از حلالهای ناقطبی بیشتر است.
حلال های قطبی آپروتیک مرزی
حلال های قطبی آپروتیک مرزی، گشتاور دوقطبی پایینی دارند و ثابت دیالکتریک آنها نیز کم و در بازه زیر ۱۰ قرار دارد. مقدار ثابت دیالکتریک آنها از حلالهای ناقطبی بیشتر و از حلال های قطبی کمتر است.
جمعبندی
هدف از این مطلب مجله فرادرس آشنایی با ترکیبات بسیار مهم و کاربردی در شیمی به نام حلالها بود. حلال های قطبی به حلالهایی اطلاق میشود که دارای ثابت دیالکتریک بالایی هستند و اتمهای درگیر در پیوند در آن با یکدیگر تفاوت الکترونگاتیوی قابل ملاحظهای دارند.
این حلالها به دو گروه حلال پروتیک و حلال آپروتیک طبقهبندی میشوند. تفاوت این دو دسته در حضور پیوندهایی است که میتوانند باعث ایجاد پیوند هیدروژنی شوند. این پیوندها شامل پیوند بین هیدروژن و نیتروژن یا پیوند بین هیدروژن و اکسیژن میشوند.
در ادامه به تفاوت این حلالها با حلالهای ناقطبی پرداختیم و در هر مورد مثالهایی را از هر حلال ارائه دادیم. در نهایت نیز تعدادی مثال و تمرین را مرور کردیم و درک خود را از این مفهوم عمق بخشیدیم.
لیست حلال های قطبی و ناقطبی
در این مطلب به بررسی حلال های قطبی و ناقطبی پرداختیم و در هر مورد تعدادی مثال را نیز مورد بررسی قرار دادیم. در این بخش میخواهیم جدولی یکپارچه از این حلالها داشته باشیم که در صورت نیاز میتوانید برای استخراج اطلاعات در مورد انواع حلال به آن مراجعه کنید.
| نوع حلال | نام حلال | فرمول شیمیایی حلال |
| قطبی | آب | $$H_2O$$ |
| قطبی | استون | $$C_3H_6O$$ |
| قطبی | استونیتریل | $$C_2H_3N$$ |
| قطبی | دیمتیل فرمامید | $$C_3H_7NO$$ |
| قطبی | دیمتیل سولفوکسید | $$C_2H_6OS$$ |
| قطبی | ایزوپروپانول | $$C_3H_8O$$ |
| قطبی | متانول | $$CH_3OH$$ |
| ناقطبی | پنتان | $$C_5H_{12}$$ |
| ناقطبی | هگزان | $$C_6H_{14}$$ |
| ناقطبی | هپتان | $$C_7H_{16}$$ |
| ناقطبی | بنزن | $$C_6H_6$$ |
| ناقطبی | تولوئن | $$C_6H_5CH_3$$ |
| ناقطبی | زایلن | $$C_8H_{10}$$ |
| ناقطبی | دیاتیل اتر | $$(C_2H_5)_2O$$ |
| ناقطبی | تتراهیدرو فوران | $$C_4H_8O$$ |
| ناقطبی | پیرول | $$C_4H_5N$$ |
| ناقطبی | اتیل استات | $$C_4H_8O_2$$ |
| ناقطبی | ۱و۴-دیاکسان | $$C_4H_8O_2$$ |
| ناقطبی | پیریدین | $$C_5H_5N$$ |
| ناقطبی | کلروفرم | $$CHCl_3$$ |
| ناقطبی | کربن تتراکلرید | $$CCl_4$$ |
| ناقطبی | استیک اسید | $$CH_3COOH$$ |