اکسید چیست و چگونه درست می شود؟ – به زبان ساده

اکسید ها ترکیبات شیمیایی هستند که در آنها، یک یا چند اتم اکسیژن با اتم دیگری ترکیب شده است. به بیان دیگر، اکسیدها ترکیبات دوتایی (باینری) اکسیژن با عنصری دیگر هستند. از نمونههای این اکسیدها میتوان به دیاکسید کربن، دیاکسید گوگرد، کلسیم اکسید و حتی آب اشاره کرد. تمامی این ترکیبات، اکسید نام دارند چراکه در این ترکیبات، به غیر از اکسیژن، تنها یک اتم دیگر وجود دارد. در این آموزش یاد میگیریم که اکسید چیست و رفتار شیمیایی اکسیدهای فلزی و نافلزی را بررسی میکنیم.
انواع اکسید
بسته به خاصیت اسید و باز اکسیدها، رفتار شیمیایی آنها به سه دسته اسیدی، بازی و خنثی (آمفوتر) طبقهبندی میکنند. البته اکسیدهای فلزی و غیرفلزی نیز نوع دیگری از دستهبندی را تشکیل میدهند و زیرمجموعهای از دستهبندی زیر به شمار میآیند. در ادامه این دستهها را بررسی میکنیم.
- اکسیدی که با آب ترکیب شود و اسید تولید کند، موسوم به اکسید اسیدی است.
- اکسیدی که در آب، باز تولید کنید، اکسید بازی نام دارد.
- محلول آمفوتر نیز به مادهای میگیوند که هم به عنوان اسید و هم باز وارد واکنش میشود.
البته به این نکته توجه داشته باشید که یک اکسید میتواند اسیدی یا بازی نباشد اما همچنان در دسته اکسیدهای خنثی تقسیمبندی شود. خواص دیگری نیز وجود دارند که به کمک آنها میتوان انواع اکسید را شناسایی کرد. واژه «بیآب» (Anhydride) یا انیدرید به ترکیبی میگویند که برای تشکیل اسید یا باز، مولکول آب را جذب میکند.
اکسیدهای اسیدی
اکسیدهای اسیدی به اکسیدهای عناصر نافلزی (گروههای ۱۴ تا ۱۷ جدول تناوبی) میگویند. چنین اسید انیدریدهایی با آب، اسید تشکیل میدهند. برخی از این اسیدها به همراه واکنش در زیر آورده شدهاند.
سولفوروس اسید:
سولفوریک اسید:
کربنیک اسید:
اکسیدهای اسیدی با نام اسید انیدرید هم شناخته میشوند. به طور مثال، گوگرد دیاکسید را با نام سولفوروس انیدرید و گوگرد تریاکسید را با نام سولفوریک انیدرید نیز میشناسند. زمانی که این اکسیدها با باز ترکیب شوند، نمک تولید میکنند.
با توجه به اهمیت یادگیری علم شیمی در دروس دبیرستان، «فرادرس» اقدام به انتشار فیلم آموزش شیمی (۳) - پایه دوازدهم کرده که لینک آن در ادامه آمده است.
- برای دیدن فیلم آموزش شیمی (۳) - پایه دوازدهم + اینجا کلیک کنید.

اکسیدهای بازی
به طور کلی، عناصر مربوط به فلزات قلیایی و قلیایی خاکی (گروه اول و دوم)، اکسید بازی یا باز انیدرید تولید میکنند.
اکسیدهای بازی، اکسیدهایی فلزی هستند. این اکسیدها اگر در آب، انحلالپذیر باشند، در واکنش با آب، هیدروکسید تولید میکنند.
این اکسیدهای بازی را با نام باز انیدرید نیز میشناسند که در اثر واکنش با اسیدها، نمک تولید میکنند.
اکسیدهای آمفوتری
همانطور که گفته شد، اکسیدهای آمفوتری به اکسیدهایی میگویند که خواص هم اسیدی و هم بازی از خود نشان میدهند. به طور مثال، زمانی که با آب واکنش میدهد، هم هیدروکسید و هم یون هیدرونیوم تولید میکند.
اکسیدهای آمفوتری زمانی که با یک اسید واکنش میدهند، آب و نمک تولید میکنند و رفتاری بازی از خود نشان میدهند. همین اکسیدها اگر با بازها وارد واکنش شوند، آب و نمک تولید میکنند اما خاصیتی اسیدی از خود نشان میدهند.
به طور مثال، اکسید روی با فرمول ، رفتاری بازی در واکنش با خواهد داشت.
همچنین، این ماده در واکنش با سدیم هیدروکسید، رفتاری اسیدی دارد:
به طور مشابه، رفتاری بازی در واکنش با خواهد داشت.
همین اکسید در واکنش با سدیم هیدروکسید، رفتاری اسیدی دارد:
اکسیدهای خنثی
اکسیدهای خنثی هیچ خاصیت بازی یا اسیدی نشان نمیدهند. بنابراین، به هنگام واکنش با اسیدها یا بازها، نمک تولید نمیکنند. از جمله این اکسیدهای خنثی میتوان به ترکیبات زیر اشاره کرد:
- کربن مونواکسید (CO)
- نیتروس اکسید
- نیتریک اکسید (NO)

پراکسید و دی اکسید
دیدیم که فلزات گروه ۱ و ۲ در واکنش با اکسیژن، اکسید تولید میکنند. به طور مثال، فلزات گروه ۱ به سرعت با اکسیژن واکنش میدهند تا اکسیدهای مختلف یونی به شکل تولید کنند. در ادامه، با پراکسیدها و سوپراکسیدها و دیاکسیدها نیز آشنا خواهیم شد.
پراکسید
به طور معمول، سدیم و لیتیوم با اکسیژن اضافی واکنش میدهند تا پراکسید تولید کنند. در این شرایط، عدد اکسایش اکسیژن برابر با است.
سوپراکسید
به طور معمول، عناصر پتاسیم، روبیدیم و سزیم به همراه اکسیژن اضافی، در اثر واکنش، سوپراکسید به شکل تولید میکنند. در این حالت، عدد اکسایش اکسیژن برابر با است.
پراکسید، اکسید فلزی است که در اثر واکنشهای با اسیدهای رقیق، هیدروژن پراکسید تولید میکند. پراکسیدها اکسیژن بیشتری نسبت به اکسیدهای بازی متناظر با خود دارند که به طور مثال میتوان به پراکسیدهای سدیم، کلسیم و باریم اشاره کرد.
اکسید ترکیبی
«اکسیدهای ترکیبی» (Compound Oxides) اکسیدهای فلزی هستند که رفتار آنها به گونهای است که گویی از ۲ اکسید تشکیل شدهاند. یک اکسید با اکسایش پایینتر و گروه دیگر با اکسایش بالاتر. به طور مثال، میتوان به سرب قرمز و فروفریک اکسید اشاره کرد که به ترتیب در زیر آورده شدهاند.
در هنگام شستشو با اسید، اکسیدهای ترکیبی، مخلوطی از نمکها را تولید میکنند.
تهیه اکسید
اکسیدها با روشهای مختلفی به تولید میرسند که در زیر به برخی از آنها اشاره کردهایم.
حرارت مستقیم عنصر با اکسیژن
بسیاری از فلزات و نافلزات به هنگام حرارت دیدن در مقابل اکسیژن یا هوا، به سرعت میسوزند و اکسید تولید میکنند. در زیر، برخی از این واکنشها را مشاهده میکنید.
واکنش اکسیژن با ترکیبات در دمای بالا
در دماهای بالا، اکسیژن با بسیاری از ترکیبات واکنش میدهد و اکسید تولید میکند. در زیر به برخی از این واکنشها اشاره شده است.
- سولفیدها به طور معمول زمانی که در حضور اکسیژن، حرارت ببینند، اکسید میشوند.
- ترکیبات شامل کربن و هیدروژن نیز در حضور اکسیژن و حرارت، اکسید میشوند.
در اثر تجزیه حرارتی برخی ترکیبات مانند هیدروکسیدها، کربناتها و نیتراتها، اکسید به تولید میرسد.
اکسایش برخی فلزات با نیتریک اسید
از جمله راههای تهیه اکسیدها میتوان به واکنش اکسایش برخی فلزات با نیتریک اسید اشاره کرد که نمونهای از آن را در زیر مشاهده میکنید.
اکسایش برخی نافلزات با نیتریک اسید
مشابه روش قبل، در اثر واکنش اکسایش برخی نافلزات با نیتریک اسید نیز اکسید به تولید میرسد.
روندهای تناوبی در رفتار اسید و باز اکسیدها
خاصیت اسیدی اکسید عناصر در هر تناوب از چپ به راست به تدریج افزایش مییابد. به طور مثال، در تناوب سوم، رفتار اکسیدها مانند تصویر زیر تغییر میکند.
اگر با دقت بیشتری به یک تناوب در جدول تناوبی نگاه کنیم، فهم بهتری از خواص اسیدی و بازی اکسیدها پیدا میکنیم. بعلاوه از این طریق میتوانیم درک بهتری از خواص فیزیکی اکسیدها داشته باشیم. اکسیدهای فلزی در سمت چپ جدول تناوبی، محلولهای بازی تولید میکنند که به طور مثال میتوان به و اشاره کرد.
اکسیدهای غیرفلزی در سمت راست جدول، محلولهای اسیدی تولید میکنند که از نمونههای آن میتوان به و و اشاره کرد. در این میان، روند مشخصی را میتوان در رفتار اسید-باز مشاهده کرد. این روند به صورت زیر قابل توضیح است:
اکسیدهای بازی در سمت چپ جدول تناوبی و اکسیدهای بازی در سمت راست جدول تناوبی قرار دارند.
آلومینویم اکسید خواص اسیدی و بازی از خود نشان میدهد و آمفوتر است. در نتیجه میتوان آلومینویم اکسید را به صورت یک علامت در جدول در نظر گرفت که در آن نقطه، تغییر از اکسید بازی به اکسید اسیدی صورت میگیرد.
توجه داشته باشید که این روند تنها برای اکسیدهایی است که عدد اکسایش آنها، بالاترین عدد را داشته باشد. در تصویر زیر، این روند به خوبی نشان داده شده است. با دقت در اکسیدهای آمفوتر (آبیرنگ) نحوه تغییر از اکسید بازی به اسیدی را دنبال کنید.
معرفی فیلم آموزش شیمی (۳) - پایه دوازدهم
رفتار شیمیایی اکسیدهای فلزی و نافلزی به شکل مناسبی بررسی شد. البته این مورد از بحثهای پایه بویژه در دروس دبیرستان اهمیت بالایی پیدا میکنند. از اینرو در «فرادرس» مجموعه فیلمهای آموزشی پیرامون شیمی در دوره دبیرستان تدوین شده که یکی از این دروس، آموزش شیمی پایه دوازدهم است. این دوره ۷/۵ ساعته در چهار درس تدوین شده است که در ادامه، به توضیح این دروس خواهیم پرداخت.
در درس یکم این آموزش با انواع شویندههای صابونی و غیرصابونی آشنا میشویم. مباحث دیگری مانند شناخت اسیدها و بازها و مقایسه قدرت اسیدی نیز از جمله مباحث همین درس به شمار میآیند.
در درس دوم، سلولهای گالوانی و عدد اکسایش در واکنشهای الکتروشیمیایی بررسی خواهد شد و درس سوم نیز به انواع مواد از جمله کووالانسی، یونی، مولکولی و فلزی اختصاص دارد. درس چهارم نیز به بررسی تعادل شیمیایی و روش ساخت و بازیافت PET اختصاص دارد.
رفتار شیمیایی اکسیدهای فلزی و نافلزی
تا اینجا به خوبی با اکسیدها آشنا شدهایم و حتی رفتار شیمیایی اکسیدهای فلزی و نافلزی را نیز میشناسیم. علاوه بر این، روندهای تناوبی اکسیدها و رفتار شیمیایی آنها را نیز بررسی کردیم. با توجه به اهمیتی که اکسیدها در تناوب سوم جدول تناوبی دارند، در ادامه، واکنش برخی اکسیدها در این تناوب را بررسی میکنیم و رفتار شیمیایی اکسیدهای فلزی و نافلزی حاصل را مرور خواهیم کرد.
سدیم اکسید
سدیم اکسید از جمله اکسیدهایی است که رفتاری بازی از خود نشان میدهد. بازی بودن این اکسید به دلیل وجود یون اکسید است. این یون، باز بسیار قوی به شمار میآید که تمایل زیادی برای ترکیب با یون هیدروژن دارد.
واکنش با آب
سدیم اکسید در واکنشی گرماده با آب سرد واکنش میدهد تا محلول سدیم هیدروکسید به تولید برسد. محلول غلیظ سدیم هیدروکسید در آب دارای pH برابر با ۱۴ خواهد بود.
واکنش با اسیدها
سدیم هیدروکسید همچنین به عنوان باز قوی با اسیدها نیز وارد واکنش میشود. به طور مثال، به هنگام واکنش هیدروکلریک اسید رقیق، سدیم کلرید به تولید میرسد.
منیزیم اکسید
منیزیم اکسید نیز یک باز ساده به شمار میآید که حاوی یونهای اکسید است. با این وجود، قدرت بازی آن کمتر از سدیم اکسید ذکر میشود. در ماده جامد سدیم اکسید، جاذبه بین یونهای و وجود دارد. اما در منیزیم اکسید، جاذبه بین یونهای و وجود دارد. به دلیل بار بیشتری که روی فلز قرار دارد، انرژی بیشتری برای شکست این پیوند مورد نیاز است. حتی با در نظر گرفتن فاکتورهای دیگری مانند انرژی آزاد شده از برهمکنشهای یون-دوقطبی آب و کاتیون، اثر خالص واکنش منیزیم اکسید، کمتر از سدیم اکسید خواهد بود.
واکنش با آب
در نگاه اول، پودر منیزیم اکسید با آب واکنش نمیدهد. با این وجود، pH محلول حاصل برابر با ۹ است. این امر نشان میدهد که یونهای هیدروکسید تولید شدهاند. در حقیقت، منیزیم هیدروکسید در اثر واکنش به تولید رسیده است اما از آنحایی ذرات، تقریبا در آب انحلالناپذیر هستند، یونهای هیدروکسید کمی حل شدهاند. واکنش در زیر آورده شده است.
واکنش با اسیدها
واکنش این جامد همانند واکنش یک اکسید فلزی انجام میگیرد. به طور مثال، در واکنش با هیدروکلریک اسید رقیق و گرم، محلول منیزیم کلرید بدست میآید.
آلومینیوم اکسید
توصیف خواص آلومینیوم اکسید قدری گمراه کننده است چراکه به شکلهای مختلفی وجود دارد. یکی از این ترکیبات، واکنشپذیری بسیار کمی دارد که با نام شناخته میشود و در دماهای بالا به تولید میرسد. البته واکنشهایی که در ادامه آورده شدهاند، شامل انواع واکنشپذیر این مولکول هستند. همانطور که پیشتر هم گفته شد، رفتاری آمفوتری دارد. بنابراین، در واکنشها به صورت باز و اسید حضور خواهد داشت.
واکنش با آب
در آب نامحلول است و واکنش آن با آب مشابه دو ترکیب قبل نیست. در حقیقت، یونهای این ترکیب با قدرت بسیار زیادی در کنار یکدیگر و در شبکه نگهداشته شدهاند و واکنش آن با آب به سادگی صورت نمیگیرد.
واکنش با اسیدها
شامل یونهای اکسید است و بنابراین مانند دو ترکیب قبل، با اسیدها واکنش میدهد. این ماده با هیدروکلریک اسید رقیق و داغ واکنش میدهد و محلول آلومینیوم کلرید طبق واکنش زیر به تولید میرسد.
واکنش با باز
آلومینیوم اکسید خواصی اسیدی نیز نشان میدهد. این مورد را میتوان در واکنش با بازهایی مانند سدیم هیدروکسید مشاهده کرد. ترکیباتی که در آنها، آلومینویم، جزئی با یون منفی باشد، آلومینات نام دارد. در این واکنشها، آلومیناتهای مختلفی حضور دارند چراکه آلومینیوم توانایی تشکیل پیوند کووالانسی با اکسیژن دارد. این پیوند نیز به دلیل اختلاف کم الکترونگاتیوی بین آلومینیوم و اکسیژن صورت میگیرد. آلومینیوم اکسید با محلول داغ و غلیظ سدیم هیدروکسید واکنش میدهد تا محلولی بیرنگ از سدیم تتراهیدروکسوآلومینات بدست بیاید.
سیلیکون دی اکسید
سیلیکون از لحاظ الکترونگاتیوی و برای تشکیل پیوندهای یونی، بسیار به اکسیژن شبیه است. بنابراین، از آنجایی که سیلیکون دی اکسید شامل یونهای اکسید نیست، هیچ خاصیت بازی نخواهد داشت. در حقیقت، اسید بسیار ضعیفی است که با بازهای قوی واکنش میدهد.
واکنش با آب
این ترکیب با آب واکنش نمیدهد زیرا به لحاظ ترمودینامیکی، شکستن پیوندهای کووالانسی دشوار است.
واکنش با باز
سیلیکون دیاکسید با محلول داغ و غلیظ سدیم هیدروکسید واکنش میدهد. حاصل این واکنش، محلول بیرنگ سدیم سیلیکات خواهد بود.
اکسیدهای فسفر
در اینجا، اکسیدهای فسفر به صورت فسفر (III) اکسید و فسفر (V) اکسید در نظر گرفته میشوند.
فسفر (III) اکسید
در اثر واکنش با آب سرد، محلولی از اسید ضعیف فسفروس اسید تولید میکند.
در تصویر زیر، ساختار اسید را بر اثر پروتوندهی کامل مشاهده میکنید.
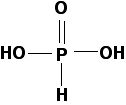
پروتونها تا زمانی که آب اضافه شود، در ساختار وجود خواهند داشت. حتی بعد از اضافه شدن آب نیز با توجه به اینکه اسید ضعیف داریم، مولکولهای کمی از اسید تفکیک میشوند. ثابت تفکیک در فسفروس اسید برابر با 2 است. این عدد نشان میدهد که خاصیت اسیدی آن بیش از برخی از اسیدهای آلی معمول مانند اتانوییک اسید است.
تقریبا به طور مستقیم با یک باز وارد واکنش نمیشود. در فسفروس اسید، دو اتم هیدروژن در گروه (OH)، اسیدی هستند اما اتم سوم، اسیدی نیست. بنابراین، دو واکنش محتمل با بازی همچون سدیم هیدروکسید وجود دارد. این واکنشها وابسته به مقدار بازِ اضافه شده هستند.
در واکنش اول، تنها یکی از پرتونها با یون هیدروکسید باز واکنش میدهد. در واکنش دوم، با استفاده از بیش از ۲ برابر سدیم هیدروکسید قبل، هر دو پروتون وارد واکنش میشوند.
اگر به جای این حالت، فسفر (III) اکسید به طور مستقیم با سدیم هیدروکسید واکنش دهد، احتمال تولید همان نمکها نیز وجود دارد:

فسفر (V) اکسید
به شدت با آب واکنش میدهد و محلولی شامل مخلوطی از اسیدها بدست میدهد که نوع آنها وابسته به شرایط واکنش است. البته تنها یک اسید مورد توجه قرار میگیرد و آن فسفریک اسید است.
سوالات رایج پیرامون اکسید
حال که میدانیم اکسید چیست و چگونه درست میشود، در ادامه مطلب قصد داریم به چند سؤال رایج در این رابطه پاسخ بدهیم.
آیا آب، اکسید است؟
بله. آب، اکسید هیدروژن است که با فرمول شیمیایی H2O نمایش داده میشود.
آیا زنگ آهن اکسید است؟
زنگ آهن برای توصیف اکسید قرمزرنگ آهن استفاده میشود. در حالت کلی، به فرآوردههای حاصل از واکنش آهن با آب و اکسیژن، زنگ آهن میگویند که نوعی اکسید است.













من برای شستشوی رادیاتور و مسیر خنک کننده اتومبیل سوال داشتم البته مقداری راهنمایی شدم ولی سوال اول ، معمولا توسط تعمیرکاران محلول اسیدی برای شستشوی مسیر خنک کننده در رادیاتوراستفاده میشود که با فلز مس و فلز آهن و آلومینیم تماس دارد و مقدار زیادی رسوب کلسیم و ناخالصی غیر فلزی محلول در اب و اکسید هایی که در محیط بسته رادیاتور وموتور تشکیل میشود اینها چه واکنشی خواهند داشت، که بسیار گیج کننده است
سوال دوم و بسیار مهمتر ، چگونه میتوان جلوی اکسیداسیون فلزی در محیط بسته و بسیار داغ موتور را گرفت یا کم کرد؟ در مجراهای فلزی آهن مس و آلومینیم آیا میتوان محلولی پیدا کرد جلوی اکسیداسیون را گرفته یا واکنش را کم کند ؟
در گذشته از راننده های سنگین شنیده بودم مایع آب صابون که واقعا اب صابون نیست بلکه مایع سفید رنگی که در تراشکاری و برش فلزات برای روان کردن تیغه اره وخنک کاری استفاده میشود واکنش اکسایش فلزی را متوقف میکند ، هیچ منبعی برای این گفته ندارم غیراز حرف راننده های قدیمی راننده های جدید کلا درباره نگهداری و تعمیرات بی نظر بوده فقط دنبال دستمزد هستن پیرمرد های بیسواد دههای ده بیست و سی شمسی کنجکاو تر و پژوهنده تر بودند
با سلام؛
استفاده از محلول برای شستوشوی رادیاتور خودرو شاید در ابتدا منطقی و اقتصادی به نظر برسد اما ممکن است بعدا نیاز به جوشکاری یا … وجود داشته باشد که زمان و هزینه بیشتری را بهوجود میآورد. از اینرو، تعویض رادیاتور و شلنگها، انتخاب بهتری است. در مورد سوال دوم هم بهتر است از همان ابتدا، از محلول آب و ضدیخ استفاده شود. استفاده از سایر محلولها ینز توصیه نمیشود.
با تشکر از همراهی شما با مجله فرادرس